一种热激相关基因peshsp70-2、peshsp70-3及其在调控植物耐热性中的应用
技术领域
1.本发明属于植物分子生物学技术领域,具体涉及一种热激相关基因peshsp70-2、peshsp70-3及其在调控植物耐热性中的应用。
背景技术:
2.西番莲(passiflora edulis),又名百香果、鸡蛋果,广泛种植于热带和亚热带地区,富含丰富的维生素,享有“果汁之王”的美誉,具有重要的经济价值。近年西番莲产业的迅速发展,已成为广西乡村振兴重点发展的产业之一。目前推广种植的主要西番莲品种花芽的正常发育容易受到南方高温天气的抑制,常导致西番莲在每年夏季的盛花期却无法正常开花、授粉受精不良导致落花、坐果率低等现象。夏季持续高温会导致西番莲花器发育不健全,高温干燥,雌蕊柱头粘度差,花粉管萎缩,雄蕊花粉发芽和花粉管伸长受影响,不利于授粉受精,甚至会出现枯花、落花现象。近年异常天气(高温、干旱)的频繁出现,使西番莲盛花期却花而无果的现象日益严重,导致果农严重亏损,严重阻碍了该新兴产业的健康发展。因此,研究西番莲对高温胁迫的响应机制,提高西番莲的耐热性是解决其高温季节坐果率低这一问题的关键。
3.近年来,大量研究表明植物热激蛋白70(heat shock protein 70,hsp70)是细胞应对高温和其它逆境胁迫时所产生的一类分子伴侣类型应激蛋白,hsp70基因的表达与植物获得的耐热性呈显著正相关性,植物通过诱导hsp70基因表达来应对高温带来的不利影响,主动适应不良的热环境。
4.据此,研究者将过量表达菊花hsp70和细胞质中的hsp70-1转化拟南芥,可以增强对高温胁迫的耐受性。可见,热激蛋白hsp70基因可以作为提高植物耐热性的潜在基因资源。
技术实现要素:
5.本发明旨在筛选鉴定出一种能够响应高温的热激相关基因peshsp70-2、peshsp70-3基因及其在调控植物耐热性中的应用。
6.本发明的技术方案为:
7.一种热激相关基因eshsp70-2、peshsp70-3,所述基因peshsp70-2的序列如seq id no.1所示,所述基因peshsp70-3的序列如seq id no.2所示。
8.本发明的热激相关基因peshsp70-2、peshsp70-3在调控植物耐热性中的应用。
9.具体的,所述应用为:将peshsp70-2、peshsp70-3基因序列转入植物细胞、组织、器官或种子,提高植物耐热能力。
10.优选地,所述植物是西番莲。
11.进一步地,所述植物植株在高温胁迫下能够使得所述基因peshsp70-2、peshsp70-3表达上调。
12.本发明热激相关基因peshsp70-2、peshsp70-3作为鉴定植物耐热能力的分子标记。
13.有益效果:本发明将peshsp70-2、peshsp70-3基因应用于植物耐热改良育种中,选育出具有耐热能力的品种,为降低高温胁迫对西番莲成花的不利影响与改善植株耐热性等方面研究提供科学依据。从分子水平上开展成花耐热相关基因挖掘以丰富西番莲耐热分子遗传改良基因资源,为培育耐热新品种提供基因资源和技术支撑。
附图说明
14.图1为实施例1中rna电泳图;
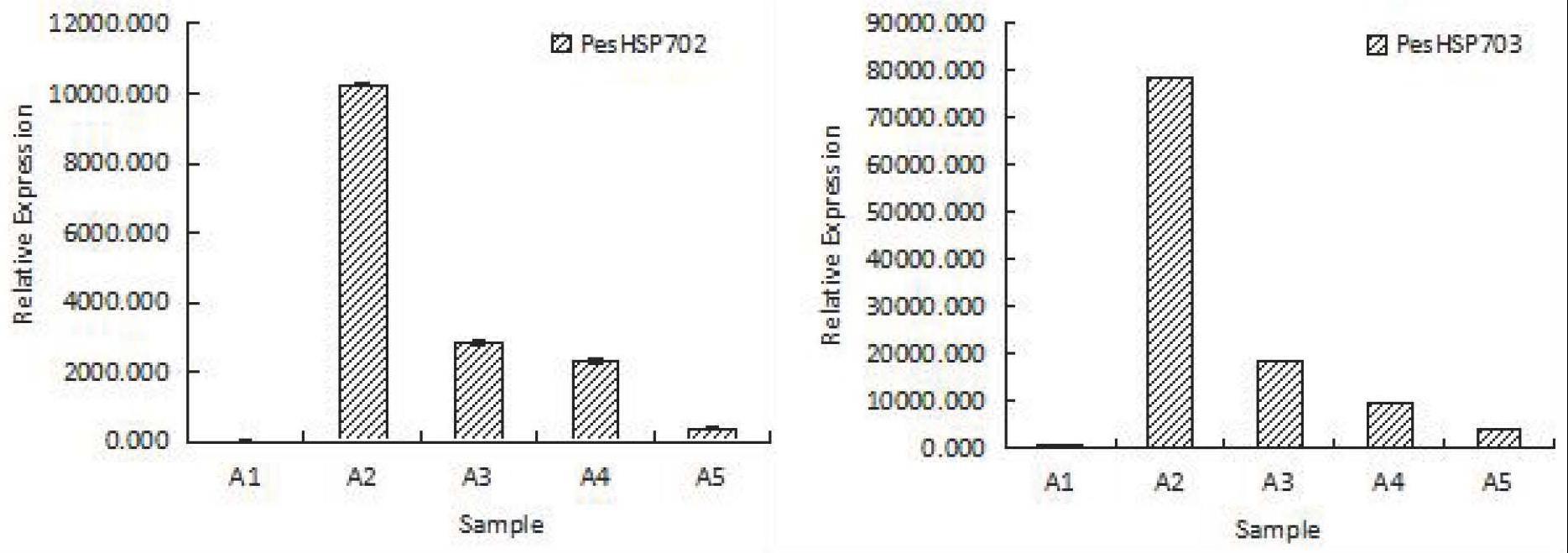
15.图2为实施例2中peshsp70-2与peshsp70-3基因在高温(42℃)下西番莲叶片中的表达图,其中,a1:0h;a2:3h;a3:6h;a4:9h;a5:恢复正常温度(26.5℃)15h;
16.图3为实施例3中pegep35s:gfp空载体的亚细胞定位检测结果;
17.图4为实施例3中pegep35s:hsp70-2-gfp质粒的亚细胞定位检测结果;
18.图5为实施例3中pegep35s:hsp70-3-gfp质粒的亚细胞定位检测结果;
19.图3-5中,从左到右依次为gfp荧光信号、细胞核定位标记物、明场以及明场与荧光通道叠加图片;图片标尺为50μm。
具体实施方式
20.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
21.以下实施例所使用的主要供试材料为:
22.试验材料采用西番莲品种
‘
台农1号’叶片。
23.主要仪器如表1所示。
24.表1主要实验仪器及生产厂家
[0025][0026]
实验试剂如表2所示。
[0027]
表2
[0028][0029]
引物信息如表3所示。
[0030]
表3
[0031][0032][0033]
实施例1:
[0034]
1、rna的提取及cdna的合成
[0035]
以西番莲品种
‘
台农1号’扦插苗为材料进行盆栽种植,将处于始花期的西番莲置于人工气候室进行高温(42℃)处理,于处理0、3、6和9h及其之后恢复正常温度(26.5℃)15h后,采集5株西番莲植株第二枝蔓倒数第1-3张完整叶进行混合,分别提取总rna,通过反转录得到cdna。具体为:
[0036]
(1)rna提取
[0037]
西番莲叶片总rna提取依照植物rna提取试剂盒使用说明书开展。(a)植物叶片经液氮研磨后,收集≤100mg植物样品至离心管,加入500μl rcl buffer,马上涡旋混匀。(b)55℃水浴1-3分钟,10,000
×
g室温离心5min。(c)将gdna filter过滤柱套入2ml收集管中,转移上清液至gdna filter过滤柱,室温14,000xg离心2min。(d)往滤液加入等体积的rcb buffer,涡旋混匀20s。(e)将rna mini结合柱套入2ml收集管中,转移一半混合液(<700μl)至rna mini结合柱上,12,000
×
g室温离心1min,弃掉滤液;(f)重复步骤
e,直至将所有混合液转移过柱;(g)将rna mini结合柱套入同一2ml收集管中,往rna mini结合柱加入400μl rwf wash buffer,10,000
×
g室温离心30s,弃掉滤液;(h)将rna mini结合柱套入同一2ml收集管中,往rna mini结合柱加入500μl rna wash buffer ii(提前使用无水乙醇稀释),10,000
×
g室温离心30s,弃掉滤液;(i)重复步骤;(j)将rna mini结合柱套入同一2ml收集管中,室温10,000xg离心2min,甩干rna mini结合柱基质;(k)将rna mini结合柱套在一个新的1.5ml离心管中,取50-100μl depc水,准确添加在rna mini结合柱膜中央,常温放置2min,10,000
×
g室温离心1min,洗脱rna。
[0038]
提取后使用超微量紫外分光光度计和琼脂糖凝胶电泳分别检测rna纯度和完整性。电泳条件:1.2%琼脂糖凝胶,电压80v,电泳30min。
[0039]
(2)逆转录
[0040]
试剂:hiscript ii q rt supermix for qpcr( gdna wiper)
[0041]
cdna第一链合成和gdna去除
[0042]
(a)将rna模板、5
×
hiscript ii qrt supermix ii和rnase-free water溶解并置于冰上备用。(b)根据以下表格配置反应体系。(c)用移液器轻轻吹打混匀。42℃15min。
[0043]
(d)在上一步反应管中加入4ul 5
×
hiscript ii qrt supermix ii,轻轻混匀。(e)50℃
[0044]
15min,85℃5s。反应结束后,短暂离心,置于冰上冷却备用。
[0045]
表4反转录体系
[0046]
reaction componentvolume(μl)rna template~2.3ug4 x gdna wiper mix4rnase-free waterupto16
[0047]
2、引物的设计和实时荧光定量pcr
[0048]
根据peshsp70-2与peshsp70-3基因的cds序列设计实时定量荧光pcr引物,引物信息如表3所示。荧光定量pcr反应体系和程序如表5和表6所示。
[0049]
表5 pcr反应体系
[0050]
reaction componentvolume(μl)universal sybr qpcr master mix10forward primer0.4reverse primer0.4template (cdna)1ddh2oup to 20
[0051]
表6反应程序:
[0052][0053]
3、结果
[0054]
rna检测
[0055]
(1)测定样品在260nm和280nm的吸收值确定rna的质量(仪器nd5000超微量紫外可见分光光度仪),不同样品od值测定。结果如表7所示。
[0056]
表7样本rna浓度
[0057][0058][0059]
(2)进行琼脂糖凝胶电泳,确定抽提rna的完整性和dna的污染情况,不同样品rna电泳图谱,结果如图1所示。
[0060]
4、结论
[0061]
图1结果表明,所提取得到的西番莲叶片总rna经1%琼脂糖凝胶电泳检测,两条主带28s与18s清晰完整,没有明显拖尾现象,表明总rna样品比较完整,没有明显的降解。紫外分光光度计法检测rna浓度表明,其od260/od280比值在2.0左右,表明其rna纯度与浓度符合合成cdna第一链的要求,以制备实时荧光定量pcr的模板。
[0062]
实施例2热胁迫下peshsp70-2和peshsp70-3基因在西番莲叶片中的表达
[0063]
以西番莲品种
‘
台农1号’扦插苗为材料进行盆栽种植,将处于始花期的西番莲置于人工气候室进行高温(42℃)处理,于处理0、3、6和9h及其之后恢复正常温度(26.5℃)15h后,采集5株西番莲植株第二枝蔓倒数第1-3张完整叶进行混合,分别提取总rna,通过反转录得到cdna进行实时定量荧光pcr,以0h的表达作为参考,以ef1(elongation factor 1)基因作为内参基因,结果如表8、表9和图2所示。42℃高温胁迫下,peshsp70-2与peshsp70-3均在处理3h后明显上调表达,比处理前均达到上万的表达量差异。
[0064]
表8 42℃高温胁迫下peshsp70-2基因的ct值
[0065][0066][0067]
表9 42℃高温胁迫下peshsp70-3基因的ct值
[0068][0069]
结论:表8与表9结果表明,西番莲植株在42℃高温胁迫下pehsp702、pehsp703相对表达量在胁迫3h后就明显上调表达达到最大值,分别是处理前的10246与78419倍,在处理6h与9h后稍有下调,复温后则下调至低水平,以推测这2个基因对西番莲响应高温胁迫起主要作用。
[0070]
实施例3peshsp70-2与peshsp70-3亚细胞定位
[0071]
1、亚细胞定位方法
[0072]
(1)烟草培养:播种烟草种子若干,12h光照培养,培养3-4周即可用于实验;
[0073]
(2)亚细胞定位载体的构建:分别以peshsp70-2、peshsp70-3基因的orf序列双酶切后与经同样限制性内切酶双酶切后的pegoep35s-gfp表达载体融合,构建pegoep35s-pehsp70-2-gfp与pegoep35s-pehsp70-3-gfp融合蛋白表达载体;
[0074]
(3)农杆菌培养:将构建好的表达载体电转化法转入农杆菌(gv3101),30℃培养2天;
[0075]
(4)悬浮农杆菌:用接种环将农杆菌从固体培养皿上刮下,接于相应抗性的1ml lb液体培养基中(2ml离心管),吹打均匀后摇床培养1h;
[0076]
(5)收集菌体:5000rpm/min,离心5min,去上清;
[0077]
(6)重悬:用10mm mgc12(含120um as)悬浮液重悬菌体,调od600至0.6左右,室温静置3-4h;
[0078]
(7)普通定位:目标蛋白菌液;
[0079]
共定位:目的蛋白菌液:maker蛋白菌液比例1:1;
[0080]
bifc:目的蛋白菌液a:目的蛋白菌液b比例1:1;
[0081]
(8)注射:挑选生长状况良好的烟草植株,用去枪头的1ml注射器从烟草叶片下表皮注射,并做好标注;
[0082]
(9)培养:将注射完成的烟草植株弱光培养2天,即可观察;
[0083]
(10)观察:取标记的农杆菌注射的烟草叶片,制作成玻片,激光共聚焦显微镜下观察,并拍照。
[0084]
2、结果
[0085]
分别转化pegep35s:hsp70-2-gfp与pegep35s:hsp70-3-gfp质粒以及pegep35s:gfp空载体到烟草,在激光共聚焦显微镜下观察,结果如图3-5所示。
[0086]
3、结论
[0087]
图3-5结果表明,peshsp70-2与peshsp70-3主要在细胞质中表达。
[0088]
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。