靶向gpc3和cd47的双特异性抗体
背景技术:
1.肝细胞癌(hcc)是全球第六常见的癌症,也是癌症相关死亡的第三大主导原因。对于新发或复发性晚期hcc患者来说,治疗选项有限。目前,只有两种多激酶抑制剂,索拉非尼(sorafenib)和仑伐替尼(lentivanib),被fda批准作为晚期hcc的一线系统性治疗药物。然而,它们的治疗益处和响应率往往不高。基于肿瘤抗原靶向抗体和免疫调节抗体的免疫疗法代表了可能改善hcc治疗结果的新兴方法。
2.磷脂酰肌醇聚糖-3(gpc3)是表征最充分的hcc相关抗原之一。它是磷脂酰肌醇聚糖家族的成员,其是通过糖基磷脂酰肌醇(gpi)锚锚定到细胞膜上的硫酸乙酰肝素蛋白聚糖。许多研究证实,gpc3在hcc中特异性上调,并在正常(甚至肝硬化)的肝组织中表达极低或不表达,使其成为用于抗体疗法的优秀肿瘤特异性靶点。然而,人源化抗gpc3抗体(例如gc33)作为单一疗法在ii期临床试验中并没有带来临床益处,这可能是由于未达最佳标准的给药和/或由于不利的免疫环境。
3.cd47是一种抑制性先天免疫检查点。它与其在髓系细胞(特别是巨噬细胞)上的受体信号调节蛋白α(sirpα)相互作用并发出“不要吃我”的信号,使得癌细胞可以避开免疫监督。因此,用靶向cd47的抗体阻断cd47与sirpα之间的相互作用,代表了增强癌细胞吞噬清除的一种有希望的策略。在包括hcc在内的许多实体肿瘤中均存在cd47的表达上调,抗cd47抗体可以抑制hcc肿瘤的生长。然而,目前正在临床开发的cd47靶向抗体被迅速清除并导致血液毒性,这主要是由于cd47在正常细胞、特别是在红细胞上表达。
技术实现要素:
4.第一方面,本发明涉及一种分离的抗cd47抗体或其片段,其具有结合cd47的能力并与sirpa竞争与cd47的结合。
5.在某些实施方式中,本发明的抗cd47抗体或其片段能够结合cd47。优选地,本发明的抗cd47抗体或其片段与人cd47(hcd47)结合。
6.在某些实施方式中,本发明的抗cd47抗体或其片段是人抗cd47抗体。
7.在某些实施方式中,本发明的抗cd47抗体或其片段是单克隆抗体。
8.在某些实施方式中,本发明的抗cd47抗体或其片段以高亲和性与cd47结合,并且解离常数(kd)小于约10nm,例如小于4nm。在某些实施方式中,本发明的抗cd47抗体或其片段甚至在0.06nm的低抗体浓度下,也能够与细胞表面上的hcd47结合,例如与raji和hek-293细胞表面上的hcd47结合。
9.在某些实施方式中,本发明的抗hcd47抗体或其片段能够阻断cd47/sirpα相互作用,并且能够使靶细胞被吞噬。
10.在某些实施方式中,本发明的抗hcd47抗体或其片段能够诱导有效的巨噬细胞介导的hl-60的吞噬。
11.在某些实施方式中,本发明的抗hcd47抗体或其片段能够减轻或甚至治愈人淋巴瘤或乳腺癌。例如,本发明的抗hcd47抗体或其片段能够在免疫缺陷小鼠中发挥对抗人淋巴
瘤的抗肿瘤作用。例如,本发明的抗hcd47抗体或其片段能够在免疫缺陷小鼠中发挥对抗人乳腺癌的抗肿瘤作用。
12.在某些实施方式中,显示了使用本发明的抗hcd47抗体或其片段,使得植入有raji的nsg小鼠中的大肿瘤缩小。
13.在非特异性结合实验中,本发明的抗hcd47抗体或其片段即使在500nm的高抗体浓度下,对不表达人cd47的cho、hepa1-6、b16f10、bhk-21、ct26细胞系也不显示出结合活性。
14.本发明的抗hcd47抗体或其片段显示出良好的热稳定性。
15.在某些实施方式中,本发明的抗hcd47抗体或其片段能够与可溶形式的hcd47结合。优选地,所述抗hcd47抗体能够与可溶形式的hcd47的胞外结构域结合。
16.在某些实施方式中,本发明的抗hcd47抗体或其片段能够与人cd47的胞外结构域的第1~118位残基结合。
17.在某些实施方式中,本发明的抗cd47抗体或其片段包括:含有重链互补决定区hcdr1、hcdr2和hcdr3的重链可变区,和含有轻链互补决定区lcdr1、lcdr2和lcdr3的轻链可变区,其中
18.hcdr1、hcdr2和hcdr3选自:(1)具有seq id no:1的氨基酸序列的hcdr1,具有seq id no:2的氨基酸序列的hcdr2,具有seq id no:3的氨基酸序列的hcdr3;(2)具有seq id no:4的氨基酸序列的hcdr1,具有seq id no:5的氨基酸序列的hcdr2,具有seq id no:6的氨基酸序列的hcdr3;(3)具有seq id no:7的氨基酸序列的hcdr1,具有seq id no:8的氨基酸序列的hcdr2,具有seq id no:9的氨基酸序列的hcdr3;(4)具有seq id no:10的氨基酸序列的hcdr1,具有seq id no:11的氨基酸序列的hcdr2,具有seq id no:12的氨基酸序列的hcdr3;(5)具有seq id no:13的氨基酸序列的hcdr1,具有seq id no:14的氨基酸序列的hcdr2,具有seq id no:15的氨基酸序列的hcdr3;和(6)(1)~(5)中所示的hcdr1、hcdr2、hcdr3,但其中至少一者包括1、2、3、4或5个氨基酸的添加、缺失、保守氨基酸替换或其组合;并且
19.lcdr1、lcdr2和lcdr3选自:(1)具有seq id no:16的氨基酸序列的lcdr1,具有seq id no:17的氨基酸序列的lcdr2,具有seq id no:18的氨基酸序列的lcdr3;(2)具有seq id no:19的氨基酸序列的lcdr1,具有seq id no:20的氨基酸序列的lcdr2,具有seq id no:21的氨基酸序列的lcdr3;(3)具有seq id no:22的氨基酸序列的lcdr1,具有seq id no:23的氨基酸序列的lcdr2,具有seq id no:24的氨基酸序列的lcdr3;(4)具有seq id no:25的氨基酸序列的lcdr1,具有seq id no:26的氨基酸序列的lcdr2,具有seq id no:27的氨基酸序列的lcdr3;(5)具有seq id no:28的氨基酸序列的lcdr1,具有seq id no:29的氨基酸序列的lcdr2,具有seq id no:30的氨基酸序列的lcdr3;和(6)(1)~(5)中所示的lcdr1、lcdr2、lcdr3,但其中至少一者包括1、2、3、4或5个氨基酸的添加、缺失、保守氨基酸替换或其组合。
20.在一个实施方式中,本发明的抗cd47抗体或其片段包括:含有重链互补决定区hcdr1、hcdr2和hcdr3的重链可变区,和含有轻链互补决定区lcdr1、lcdr2和lcdr3的轻链可变区,其中
21.hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3选自:(1)具有seq id no:1的氨基酸序列的hcdr1,具有seq id no:2的氨基酸序列的hcdr2,具有seq id no:3的氨基酸序列的
hcdr3,具有seq id no:16的氨基酸序列的lcdr1,具有seq id no:17的氨基酸序列的lcdr2,具有seq id no:18的氨基酸序列的lcdr3;(2)具有seq id no:4的氨基酸序列的hcdr1,具有seq id no:5的氨基酸序列的hcdr2,具有seq id no:6的氨基酸序列的hcdr3,具有seq id no:19的氨基酸序列的lcdr1,具有seq id no:20的氨基酸序列的lcdr2,具有seq id no:21的氨基酸序列的lcdr3;(3)具有seq id no:7的氨基酸序列的hcdr1,具有seq id no:8的氨基酸序列的hcdr2,具有seq id no:9的氨基酸序列的hcdr3,具有seq id no:22的氨基酸序列的lcdr1,具有seq id no:23的氨基酸序列的lcdr2,具有seq id no:24的氨基酸序列的lcdr3;(4)具有seq id no:10的氨基酸序列的hcdr1,具有seq id no:11的氨基酸序列的hcdr2,具有seq id no:12的氨基酸序列的hcdr3,具有seq id no:25的氨基酸序列的lcdr1,具有seq id no:26的氨基酸序列的lcdr2,具有seq id no:27的氨基酸序列的lcdr3;(5)具有seq id no:13的氨基酸序列的hcdr1,具有seq id no:14的氨基酸序列的hcdr2,具有seq id no:15的氨基酸序列的hcdr3,具有seq id no:28的氨基酸序列的lcdr1,具有seq id no:29的氨基酸序列的lcdr2,具有seq id no:30的氨基酸序列的lcdr3;和(6)(1)~(5)中所示的hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、lcdr3,但其中至少一者包括1、2、3、4或5个氨基酸的添加、缺失、保守氨基酸替换或其组合。
22.在某些实施方式中,本发明的抗cd47抗体或其片段包括重链可变区和轻链可变区,其中所述重链可变区具有选自seq id no:37~41中示出的氨基酸序列的氨基酸序列,以及与seq id no:37~41中示出的任一氨基酸序列具有至少95%序列同一性并保留表位结合活性的氨基酸序列,
23.其中所述轻链可变区具有选自seq id no:42~46中示出的氨基酸序列的氨基酸序列,以及与seq id no:42~46中示出的任一氨基酸序列具有至少95%序列同一性并保留表位结合活性的氨基酸序列。
24.在某些实施方式中,本发明的抗cd47抗体或其片段包括重链可变区和轻链可变区,其中所述重链可变区和轻链可变区具有选自下述的氨基酸序列:
25.(1)seq id no:37中所示的氨基酸序列和seq id no:42中所示的氨基酸序列;(2)seq id no:38中所示的氨基酸序列和seq id no:43中所示的氨基酸序列;(3)seq id no:39中所示的氨基酸序列和seq id no:44中所示的氨基酸序列;(4)seq id no:40中所示的氨基酸序列和seq id no:45中所示的氨基酸序列;(5)seq id no:41中所示的氨基酸序列和seq id no:46中所示的氨基酸序列;和(6)分别与(1)~(5)中的任一者具有至少95%序列同一性并保留表位结合活性的两个氨基酸序列。
26.在某些实施方式中,本发明的抗cd47抗体或其片段是igg、igm、iga、ige或igd同种型。在某些实施方式中,本发明的抗cd47抗体或其片段是igg1、igg2、igg3或igg4同种型。
27.优选地,本发明的单克隆抗体(mab)是人单克隆抗体(mab)。
28.在某些实施方式中,本发明的多核苷酸可以在同一多核苷酸分子上或在独立的多核苷酸分子上,编码整个重链可变区或整个轻链可变区或两者。或者,本发明的多核苷酸可以在同一多核苷酸分子上或在独立的多核苷酸分子上,编码部分重链可变区或部分轻链可变区或两者的部分。
29.另一方面,本发明提供了一种分离的细胞或载体,其包含一种或多种本发明的编码抗cd47抗体或其片段的多核苷酸。
30.另一方面,本发明提供了一种组合物,其包含本发明的抗cd47抗体或其片段和药学上可接受的载体。
31.另一方面,本发明提供了本发明的抗cd47抗体或其片段在制备用于在受试者中治疗其中cd47过表达或上调的障碍的药物中的用途。
32.所述受试者可以是需要诊断、预后或治疗的哺乳动物受试者。哺乳动物受试者包括人类、家畜、农场动物和动物园、体育或宠物动物,例如狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、奶牛等。
33.在某些实施方式中,所述障碍是癌症,包括但不限于实体肿瘤癌症(例如肺癌、前列腺癌、乳腺癌、膀胱癌、结肠癌、卵巢癌、胰腺癌、肾癌、肝癌、成胶质细胞瘤、髓母细胞瘤、平滑肌肉瘤、头颈部鳞状细胞癌、黑素瘤等)和液体癌症(例如血液学癌症、白血病、淋巴瘤)和脑癌。
34.在某些实施方式中,所述障碍是感染(例如慢性感染)和/或免疫学疾病或障碍(例如炎性疾病,包括但不限于多发性硬化症、关节炎等)。
35.另一方面,本发明提供了一种在受试者中治疗其中cd47过表达或上调的障碍的方法,所述方法包括向所述患者给药本发明的抗cd47抗体或其片段。
36.所述受试者可以是需要诊断、预后或治疗的哺乳动物受试者。哺乳动物受试者包括人类、家畜、农场动物和动物园、体育或宠物动物,例如狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、奶牛等。
37.另一方面,本发明提供了一种确定cd47存在的方法,所述方法包括将疑似含有cd47的细胞暴露到本发明的抗cd47抗体或其片段,并确定所述抗cd47抗体或其片段与所述细胞的结合。
38.所述方法可以是在受试者中诊断其中cd47过表达或上调的障碍的方法。
39.所述受试者可以是需要诊断、预后或治疗的哺乳动物受试者。哺乳动物受试者包括人类、家畜、农场动物和动物园、体育或宠物动物,例如狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、奶牛等。
40.第二方面,本发明涉及一种双特异性抗体或其片段,其具有与gpc3和cd47两者特异性结合的能力。优选地,所述双特异性抗体或其片段具有与hgpc3和hcd47两者特异性结合的能力。
41.在某些实施方式中,本发明的双特异性抗体是一种双特异性抗体,其包括:与人gpc3(hgpc3)结合的第一抗原结合部分,和与人cd47(hcd47)结合的第二抗原结合部分。在后文中,本发明的双特异性抗体也被称为gpc3/cd47 biab。
42.在某些实施方式中,所述与人gpc3结合的第一抗原结合部分包含:
43.(a)vh结构域,其包含(i)具有seq id no:31的氨基酸序列的hcdr1,(ii)具有seq id no:32的氨基酸序列的hcdr2,和(iii)具有seq id no:33的氨基酸序列的hcdr;和(b)vl结构域,其包含(i)具有seq id no:34的氨基酸序列的lcdr1,(ii)具有seq id no:35的氨基酸序列的lcdr2,和(iii)具有seq id no:36的氨基酸序列的lcdr3。
44.在某些实施方式中,所述与人gpc3结合的第一抗原结合部分包含:
45.(a)vh结构域,其包含seq id no:47的氨基酸序列;和(b)vl结构域,其包含seq id no:48的氨基酸序列。
46.在某些实施方式中,所述与人cd47结合的第二抗原结合部分包含:
47.(a)vh结构域,其包含(i)具有seq id no:1的氨基酸序列的hcdr1,(ii)具有seq id no:2的氨基酸序列的hcdr2,和(iii)具有seq id no:3的氨基酸序列的hcdr3;和(b)vl结构域,其包含(i)具有seq id no:16的氨基酸序列的lcdr1,(ii)具有seq id no:17的氨基酸序列的lcdr2,和(iii)具有seq id no:18的氨基酸序列的lcdr3。
48.在某些实施方式中,所述与人cd47结合的第一抗原结合部分包含:
49.(a)vh结构域,其包含seq id no:37的氨基酸序列;和(b)vl结构域,其包含seq id no:42的氨基酸序列。
50.在某些实施方式中,本发明的双特异性抗体还包含fc区。
51.在某些实施方式中,所述fc抗体结构域可以包括铰链部分、ch3部分和ch2部分。
52.在某些实施方式中,所述fc抗体结构域还可以包括促进异二聚化的结构域。在某些实施方式中,所述fc部分可以包括允许两条重链异二聚化的杵(knob)结构域和臼(hole)结构域。
53.在某些实施方式中,所述杵结构域和臼结构域分别位于ch3部分中。
54.优选地,所述杵结构域具有杵突变,并且所述臼结构域具有臼突变。优选地,所述杵突变是t366w和s354c,并且所述臼突变是y407v、l368a、t366s,并添加半胱氨酸突变以进一步促进异二聚化。
55.在某些实施方式中,本发明的双特异性抗体具有ch1部分和cl部分。
56.在某些实施方式中,ch1部分和cl部分被相互代替。
57.在某些实施方式中,本发明的双特异性抗体包含杵链(hc1链)和臼链(hc2链),其中所述杵链包含第一抗原结合部分、ch1部分、铰链部分、ch2部分和ch3区,并且所述臼链包含第二抗原结合部分、cl部分、铰链部分、ch2部分和ch3部分。优选地,本发明的双特异性抗体还包括:含有vl和cl的lc1部分,和含有vl和ch1的lc2部分。
58.在某些实施方式中,本发明的双特异性抗体包含具有seq id no:49的氨基酸序列的hc1、具有seq id no:50的氨基酸序列的lc1部分、具有seq id no:51的氨基酸序列的hc2和具有seq id no:52的氨基酸序列的lc2部分,并且hc1和hc2通过三个二硫键并以杵入臼方式互连,并且lc1和lc2通过二硫键分别附连到hc1和hc2。
59.具体来说,使用以前报道的kihs和crossmab技术对原始野生型hc和lc表达载体进行改良。简单来说,通过定点突变将几个突变引入到hc的ch3结构域中,以产生“杵链”(t366w、s354c)和“臼链”(y349c、t366s、l368a、y407v)。将臼链的ch1结构域和lc的cl结构域互换,以分别产生成对的互换重链(cl-臼链)和轻链(ch1-lc)。
60.在某些实施方式中,本发明的双特异性抗体对表达双抗原的细胞(gpc3
cd47
双阳性细胞)特异性具有极大的提高。
61.在某些实施方式中,与抗cd47 mab相比,本发明的双特异性抗体在人cd47/sirpα基因修饰的小鼠中显示出优越的安全性能和延长的血清半衰期。
62.在某些实施方式中,本发明的双特异性抗体显示出增强的fc介导的功能和针对表达双抗原的肿瘤(例如raji-gpc3h细胞)的选择性生长抑制。
63.在某些实施方式中,在异种移植hcc模型中,本发明的双特异性抗体的性能优于使用抗cd47或抗gpc3 mab的单一疗法,和使用抗cd47和抗gpc3 mab的联合疗法。
64.在本发明中,发现巨噬细胞和中性粒细胞在体内参与所述双特异性抗体的fc依赖性抗肿瘤活性。
65.第三方面,本发明涉及第二方面的双特异性抗体用于治疗hcc的用途。
66.本发明的双特异性抗体与gpc3和cd47结合,以特异性靶向hcc肿瘤细胞,显示出有吸引力的半衰期,并在药代动力学和潜在的不利作用测试中未表现出血液学毒性。
67.本发明的双特异性抗体的安全性能、长半衰期和优先抗肿瘤活性突出了它与使用抗cd47单克隆抗体的联合疗法相比的明显优势。
68.本发明说明了利用cd47阻断如何可以为cd47阳性hcc的治疗增添额外的促细胞吞噬的抗肿瘤响应。
69.在本发明中,发现在nod-scid小鼠中,中性粒细胞是所述双特异性抗体的抗肿瘤效应所需的。
70.本发明的双特异性抗体也可以利用t细胞的抗肿瘤活性,并且当与其他t细胞刺激性免疫检查点抑制剂或化疗药物一起作为联合药剂使用时,它的hcc治疗功效可能会进一步最大化。有必要在免疫活性(immune-competent)模型中,对gpc3/cd47 biab与t细胞免疫检查点抑制剂(例如抗pd-1或抗ctla-4mab)一起给药作进一步研究,以了解它们的相应贡献。
71.除了与单独的单克隆抗体相比表现出强得多的抗肿瘤活性之外,使用gpc3/cd47 biab治疗也比使用两种独立识别gpc3和cd47靶标的抗体进行联合疗提供了更优越的抗肿瘤益处。这一观察支持了,使用双特异性抗体结合两种抗原可能通过某种形式的协同作用而提供改进的临床价值。总之,本发明开发了一种双特异性抗体,并证实了它对hcc具有安全高效的抗肿瘤活性。最终,随着对gpc3/cd47 biab在治疗hcc中的特定机制的理解越来越多,我们可能会发现更多的一般性趋势,其可以支持开发双特异性抗体以增强先天免疫应答,从而采用创新的治疗策略以进一步改进癌症治疗结果。
72.一些研究使用了衔接t细胞的双特异性抗体(t-bsab)的策略,所述抗体在单个分子内组合了两种不同的抗原结合特异性;此类抗体用一个臂接合t细胞并用另一个臂接合肿瘤抗原。除了利用t细胞免疫应答对抗恶性细胞之外,还有越来越多的证据强调了先天免疫系统在癌症治疗中的影响。例如,研究报道了在gpc3阳性hcc患者中的巨噬细胞募集。癌细胞的吞噬是巨噬细胞介导的抗肿瘤活性的主要机制。因此,我们推测利用巨噬细胞可能是提高对这种类型的hcc的抗肿瘤功效的一种有前途的策略。
73.定义
74.磷脂酰肌醇聚糖-3(gpc3)是表征最充分的hcc相关抗原之一。它是磷脂酰肌醇聚糖家族的成员,是通过糖基磷脂酰肌醇(gpi)锚锚定到细胞膜上的硫酸乙酰肝素蛋白聚糖。许多研究证实,gpc3在hcc中特异性上调,并在正常(甚至肝硬化)的肝组织中表达极低或不表达,使其成为用于抗体疗法的优秀肿瘤特异性靶点。然而,已知的人源化抗gpc3抗体(例如gc33)作为单一疗法在ii期临床试验中并没有带来临床益处,这可能是由于未达最佳标准的给药和/或由于不利的免疫环境。
75.cd47是一种抑制性先天免疫检查点。它与其在髓系细胞(特别是巨噬细胞)上的受体信号调节蛋白α(sirpα)相互作用并发出“不要吃我”的信号,使得癌细胞可以避开免疫监督。因此,用靶向cd47的抗体阻断cd47与sirpα之间的相互作用,代表了增强癌细胞吞噬清
除的一种有希望的策略。在包括hcc在内的许多实体肿瘤中均存在cd47的表达上调,抗cd47抗体可以抑制hcc肿瘤的生长。然而,目前正在临床开发的cd47靶向抗体被迅速清除并导致血液毒性,这主要是由于cd47在正常细胞、特别是在红细胞上的表达。
76.本文所使用的没有具体数目的指称是指一个或超过一个(例如至少一个)指称物。
77.术语“或”在本文中用于意指术语“和/或”并可以与“和/或”互换使用,除非上下文明确指示不是如此。
[0078]“约”和“大约”通常是指考虑到测量的性质或精度,所测量的量的可接受的误差程度。示例性的误差程度是在给定值或值的范围的20%以内,通常在10%以内,更通常在5%以内。
[0079]
本文公开的产品和方法涵盖具有指定序列或与其相同或相似的序列,例如与指定序列具有至少约85%或95%序列同一性的序列的多肽和多核苷酸。在氨基酸序列的情形中,术语“85%或95%序列同一性”在本文中用于指,第一氨基酸含有足够或极少数量的氨基酸残基,所述氨基酸残基与第二氨基酸序列中对齐的氨基酸残基i)相同,或者ii)是保守替换,使得所述第一和第二氨基酸序列可以具有共同的结构域和/或共同的功能活性。例如,与参比序列(例如本文提供的序列)具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的含有共同结构域的氨基酸序列。
[0080]
在核苷酸序列的情形中,术语“85%或95%序列同一性”在本文中用于指,第一核酸序列含有足够或极少数量的核苷酸,所述核苷酸与第二核酸序列中对齐的核苷酸相同,使得所述第一和第二核苷酸序列编码具有共同功能活性的多肽,或编码共同结构性多肽结构域或共同功能性多肽活性。例如,与参比序列(例如本文提供的序列)具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。
[0081]
为了确定两个氨基酸序列或两个核酸序列之间的百分同一性,出于最佳比较的目的将序列对齐(例如可以将空位引入到第一和第二氨基酸或核酸序列中的一者或两者中用于最佳比对,并且出于比较目的可以忽略非同源序列)。在优选实施方式中,出于比较目的而对齐的参比序列的长度为所述参比序列长度的至少30%,例如至少40%、50%、60%,例如至少70%、80%、90%、100%。然后对相应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸进行比较。当第一序列中的位置与第二序列中的相应位置被同一氨基酸残基或核苷酸占据时,所述分子在该位置处是同一的。
[0082]
术语“多肽”、“肽”和“蛋白质”在本文中可互换使用,是指任何长度的氨基酸聚合物。
[0083]
术语“核酸”、“核酸序列”、“核苷酸序列”、“多核苷酸序列”和“多核苷酸”可互换使用。
[0084]
本文所使用的术语“抗体或抗体分子”是指包含至少一个免疫球蛋白可变结构域序列的蛋白质,例如免疫球蛋白链或其片段。术语“抗体分子”包括例如单克隆抗体(包括具有免疫球蛋白fc区的全长抗体)。在一个实施方式中,抗体分子包括全长抗体或全长免疫球蛋白链。在一个实施方式中,抗体分子包括全长抗体或全长免疫球蛋白链的抗原结合或功能性片段。当在本文中使用时,抗体分子与抗原“结合”,这种结合是本领域技术人员所理解
的。在一个实施方式中,抗体以约1
×
10-5
m或更低、1
×
10-6
m或更低或1
×
10-7
m或更低的解离常数(kd)与抗原结合。
[0085]
例如,抗体分子可以包含重(h)链可变结构域序列(在本文中缩写为vh)和轻(l)链可变结构域序列(在本文中缩写为vl)。在一个实施方式中,抗体分子包含重链和轻链,或由它们组成。在另一个实例中,抗体分子包含两个重(h)链可变结构域序列和两个轻(l)链可变结构域序列,从而形成两个抗原结合部位,例如fab、fab’、f(ab’)2、fc、fd、fd’、fv、单链抗体(例如scfv)、单可变结构域抗体、双体抗体(dab)(二价且双特异性)和嵌合(例如人源化)抗体,它们可以通过完整抗体的修饰来产生或者使用重组dna技术从头合成。这些功能性抗体片段保留了与它们相应的抗原或受体选择性结合的能力。抗体和抗体片段可以来自于任何抗体类别,包括但不限于igg、iga、igm、igd和ige,并且可以来自于任何抗体亚类(例如igg1、igg2、igg3和igg4)。抗体分子的制剂可以是单克隆或多克隆的。抗体分子也可以是人类、人源化、cdr移植或体外生成的抗体。抗体可以具有选自例如igg1、igg2、igg3或igg4的重链恒定区。抗体也可以具有选自例如κ或λ的轻链。在本文中,术语“免疫球蛋白”(ig)可以与术语“抗体”互换使用。
[0086]
本文所使用的术语“抗体片段”或“抗原结合片段”是抗体的部分,例如f(ab')2、f(ab)2、fab’、fab、fv、scfv等。抗体片段与完整抗体所识别的同一抗原结合。术语“抗体片段”包括适体、镜像体(spiegelmer)和双体抗体。术语“抗体片段”还包括任何合成或遗传工程改造的蛋白质,其通过与特定抗原结合以形成复合物而类似于抗体起作用。
[0087]
抗体分子的抗原结合片段的实例包括:(i)fab片段,其是由vl、vh、ck和ch部分组成的单价片段;(ii)f(ab’)2片段,其是包含在铰链区处通过二硫键相连的两个fab片段的二价片段;(iii)fd片段,其由vh和ch部分组成;(iv)fv片段,其由抗体单臂的vl和vh部分组成;(v)双体抗体(dab)片段,其由vh部分组成;(vi)骆驼或骆驼化可变部分;(vii)单链fv(scfv);(viii)单部分抗体。这些抗体片段可以使用任何适合的方法,包括本领域技术人员已知的常规技术来获得,并且所述片段可以以与完整抗体相同的方式进行实用性筛选。术语“抗体片段”还包括任何合成或遗传工程改造的蛋白质,其通过与特定抗原结合以形成复合物而类似于抗体起作用。
[0088]“单链可变片段”或“scfv”是指免疫球蛋白的重链可变区(vh)和轻链可变区(vl)的融合蛋白。在某些情况下,所述区域用10至约25个氨基酸的短接头肽相连。所述接头可以富含甘氨酸以获得柔性,并富含丝氨酸或苏氨酸以获得可溶性,并且可以将vh的n-端与vl的c-端相连或正好相反。尽管移除了恒定区并引入了接头,但这种蛋白质保留了原始免疫球蛋白的特异性。scfv分子在本领域中是已知的。
[0089]
轻链和重链被分成“恒定”区和“可变”区。轻链(vl)和重链(vh)两者的可变结构域决定抗原识别和特异性。而轻链恒定结构域(ck)和重链恒定结构域(ch1、ch2或ch3)提供了重要的生物学性质,例如分泌、经胎盘移动性、fc受体结合、补体结合等。n-端部分是可变区,c-端部分是恒定区;ch3和ck部分实际上分别包含重链和轻链的羧基端。
[0090]
可变区允许抗体选择性识别并特异性结合抗原上的表位。抗体的vl部分和vh部分,或互补决定区(cdr)的亚单位,组合在一起形成可变区,限定了三维抗原结合部位。这种四级抗体结构形成存在于y的每个臂的末端处的抗原结合部位。更具体来说,抗原结合部位由vh和vk链中每一者上的三个cdr(即hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3)定义。
[0091]
本文所使用的术语“互补决定区”和“cdr”是指抗体可变区内提供抗原特异性和结合亲和性的氨基酸序列。在某些实施方式中,在每个重链可变区中存在三个cdr(hcdr1、hcdr2和hcdr3),并且在每个轻链可变区中存在三个cdr(lcdr1、lcdr2和lcdr3)。
[0092]
给定cdr的精确氨基酸序列边界可以使用任何公知的方案来确定,包括由kabat等,(1991),《免疫学重要的蛋白质的序列》(sequences of proteins of immunological interest),第5版,public health service,national institutes of health,bethesda,md)所描述的方案(“kabat”编号方案)。
[0093]
每个vh和vl通常包括三个cdr和四个fr,它们从氨基端到羧基端以下述顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。
[0094]“受试者”或“个体”或“动物”或“患者”或“哺乳动物”意味着需要诊断、预后或治疗的任何受试者,特别是哺乳动物受试者。哺乳动物受试者包括人类、家畜、农场动物和动物园、体育或宠物动物,例如狗、猫、豚鼠、兔、大鼠、小鼠、马、牛、奶牛等。
[0095]
本文所使用的诸如“需要治疗的患者”或“需要治疗的受试者”的短语包括将从用于例如检测、诊断程序和/或治疗的本公开的抗体或组合物的给药获益的受试者,例如哺乳动物受试者。
[0096]
本文所使用的术语“表位”是指抗原(例如人gpc3(hgcp3)和人cd47(hcd47))的与抗体分子特异性相互作用的部分。此类基团(在本文中也被称为表位决定簇)通常包含诸如氨基酸侧链或糖侧链的元件或者是所述元件的一部分。表位决定簇可以通过本领域中已知或本文中公开的方法来确定,例如通过晶体学或通过氢-氘交换。抗体分子上的至少一个或一些与表位决定簇特异性相互作用的部分通常位于cdr中。通常,表位具有特定三维结构特征。通常,表位具有特定的电荷特征。一些表位是线性表位,而其他表位是构象表位。
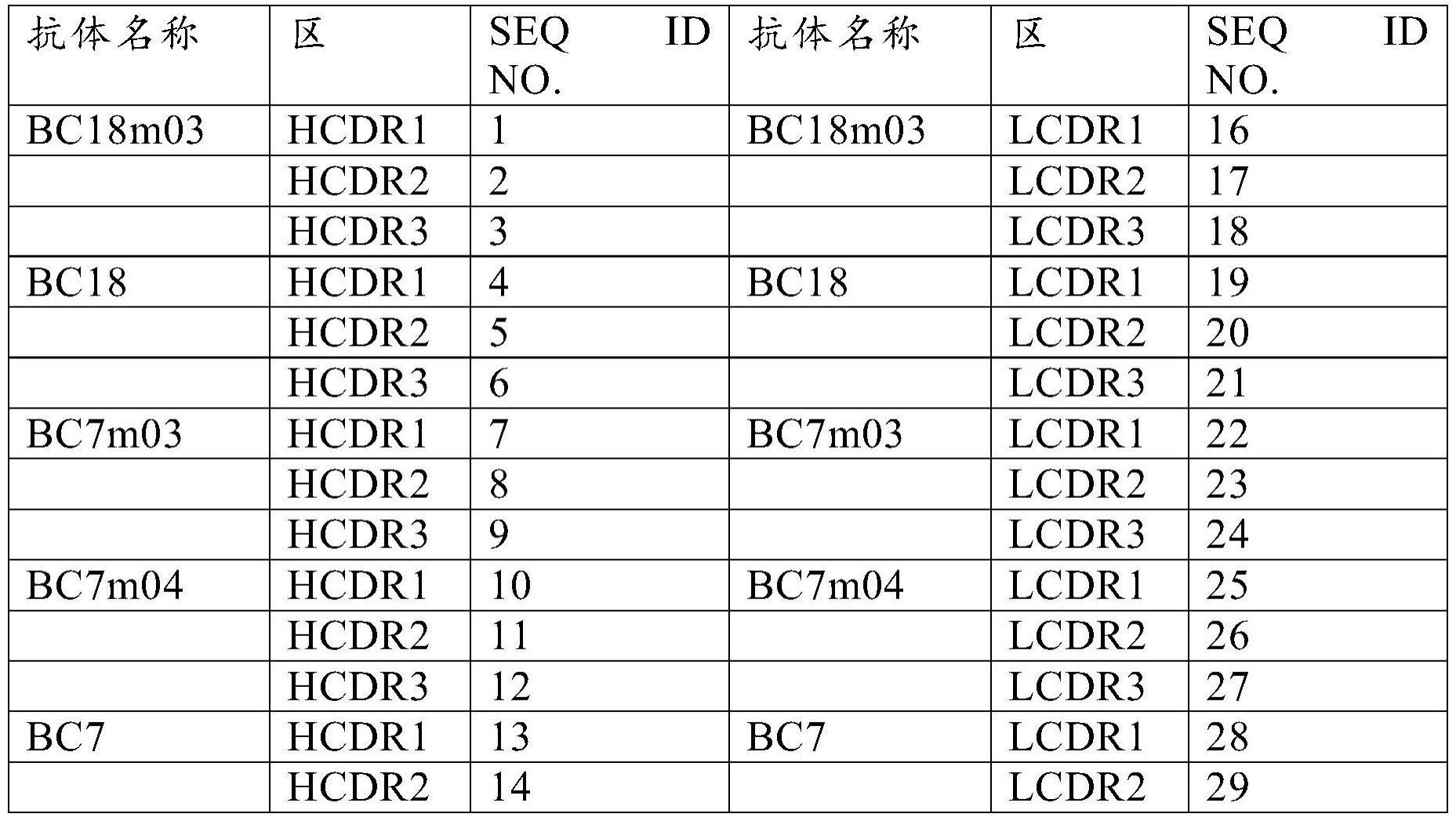
[0097]
本文所使用的术语“单克隆抗体”或“单克隆抗体组合物”是指单一分子组成的抗体分子的制备物。单克隆抗体组合物表现出对特定表位的单一结合特异性和亲和性。单克隆抗体可以通过杂交瘤技术或通过不使用杂交瘤技术的方法(例如文库选择和筛选或重组方法)来制备。
[0098]
所述抗体分子可以是多克隆或单克隆抗体。在其他实施方式中,抗体可以重组产生,例如通过酵母展示、噬菌体展示或通过组合方法来产生。
[0099]
在一个实施方式中,所述抗体是全人抗体(例如通过酵母展示产生的抗体、通过噬菌体展示产生的抗体或在小鼠中制造的抗体,它们已被遗传工程改造以产生来自于人免疫球蛋白序列的抗体),或者是非人类抗体,例如鼠类(小鼠或大鼠)、山羊、灵长类(例如猴)或骆驼抗体。产生啮齿动物抗体的方法在本领域中是已知的。
[0100]
人单克隆抗体可以使用带有人免疫球蛋白基因而不是小鼠体系的转基因小鼠来产生。将来自于用感兴趣抗原免疫的这些转基因小鼠的脾细胞,用于产生杂交瘤,该杂交瘤分泌对来自人类蛋白的表位具有特定亲和性的人mab。
[0101]
抗体可以是其中可变区或其一部分(例如cdr)在非人类生物体例如大鼠或小鼠中产生的抗体。嵌合、cdr移植和人源化抗体在本发明的范围之内。在非人类生物体(例如大鼠或小鼠)中产生的,然后(在例如可变构架区或恒定区中)进行修饰以降低在人类中的抗原性的抗体,也在本发明的范围之内。
[0102]
在本发明的范围内还包括其中已替换、缺失或添加特定氨基酸的人源化抗体。从
供体选择氨基酸的标准描述在us 5,585,089中,例如us 5,585,089的第12-16栏,其内容通过引用并入本文。用于抗体人源化的其他技术描述在padlan等人的ep 519596a1(公开于1992年12月23日)中。
[0103]
在其他实施方式中,所述抗体分子具有选自以下来源的重链恒定区:igg1、igg2、igg3、igg4、igm、iga1、iga2、igd和ige的重链恒定区,特别是选自例如igg1、igg2、igg3和igg4(例如人类)的重链恒定区。
[0104]
改变抗体恒定区的方法在本领域中是已知的。可以通过将抗体恒定部分中的至少一个氨基酸残基替换成不同的残基,来产生功能改变的抗体,例如对效应配体(例如细胞上的fcr或补体的ci组分)具有改变的亲和性(参见例如ep 388,151al、美国专利号5,624,821和美国专利号5,648,260,所有所述专利的内容通过引用并入本文)。也设想了使抗体结构稳定的氨基酸突变,例如人igg4中的s228p(eu编号)。
[0105]
应该理解,本发明的分子可以具有对它们的功能没有实质性影响的额外的保守或非必需氨基酸替换。
[0106]“保守氨基酸替换”是其中氨基酸残基被具有相似侧链的氨基酸残基代替的替换。具有相似侧链的氨基酸残基的家族在本领域中已被定义。这些家族包括具有碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。保守氨基酸替换:
[0107]
原始残基示例性替换优选替换alaval,leu,ilevalarglys,gln,asnlysasnglnglnaspgluglucysser,alaserglnasnasngluaspaspglypro,alaalahisasn,gln,lys,argargileleu,val,met,ala,phe,正亮氨酸leuleu正亮氨酸,ile,val,met,ala,pheilelysarg,1,4-二氨基丁酸,gln,asnargmetleu,phe,ileleupheleu,val,ile,ala,tyrleuproalaglyserthr,ala,cysthrthrsersertrptyr,phetyr
tyrtrp,phe,thr,serphevalile,met,leu,phe,ala,正亮氨酸leu
附图说明
[0108]
图1示出了通过表面等离子体共振(spr)分析得到的bc7和bc18抗体与hcd47的结合动力学。
[0109]
图2示出了通过spr分析得到的bc18、ab6.12、hu5f9抗体与hcd47的结合动力学。
[0110]
图3示出了通过elisa得到的抗hcd47抗体与cd47结合和与sirpα竞争能力的比较。
[0111]
图4示出了通过facs分析得到的抗hcd47抗体的比较。
[0112]
图5示出了bc18和bc7与细胞表面cd47结合。
[0113]
图6示出了bc18和bc7诱导hl-60进行有效的巨噬细胞介导的吞噬。
[0114]
图7示出了在免疫缺陷小鼠中建立的人淋巴瘤模型中,bc18发挥强的抗肿瘤作用。
[0115]
图8示出了在免疫缺陷小鼠中建立的人乳腺癌模型中,bc18发挥强的抗肿瘤作用。
[0116]
图9示出了通过spr分析得到的bc18、bc7和它们的突变体的结合动力学。
[0117]
图10示出了构建的gpc3/cd47 biab的示意性结构。
[0118]
图11示出了抗体的构建和纯化抗体的亲和性和纯度的表征。
[0119]
图12示出了gpc3/cd47 biab对表达双抗原的细胞具有极大提高的特异性。
[0120]
图13示出了gpc3/cd47 biab具有优异的安全特性。
[0121]
图14示出了在hcd47/hsirpα人源化小鼠中,在gpc3/cd47 biab治疗后没有观察到血液学毒性。
[0122]
图15示出了cd47敲除的基于jurkat的效应细胞(jurkat-cd16a-cd47
ko
)和hep3b细胞(hep3b-cd47
ko
)的产生。
[0123]
图16示出了gpc3/cd47 biab对表达双抗原的肿瘤发挥增强的fc介导的功能和选择性生长抑制。
[0124]
图17示出了在异种移植hcc模型中,gpc3/cd47 biab的性能优于单一疗法和抗cd47和抗gpc3 mab的联合疗法。
[0125]
图18示出了gpc3/cd47 biab提高hep3b异种移植小鼠的总存活率中值。
[0126]
图19示出了在体内,巨噬细胞和中性粒细胞参与gpc3/cd47 biab的fc依赖性抗肿瘤活性。
[0127]
图20示出了gpc3/cd47 biab fc变体(gpc3/cd47-dang)的产生。
[0128]
图21示出了对免疫细胞耗竭功效和肿瘤浸润巨噬细胞的分析。
具体实施方式
[0129]
所提供的特定实施方式和实施例的描述是作为说明而不是限制性的。本领域技术人员会容易地认识到可以改变或修改各种非关键参数,但产生基本上相似的结果。
[0130]
表1
[0131][0132][0133]
实施例
[0134]
实施例1.在改良的噬菌体展示抗体技术的基础上,产生针对人cd47的胞外结构域的人单克隆抗体
[0135]
抗原纯化
[0136]
从人pbmc的cdna获得编码人cd47的胞外结构域(cd47-ecd)第1~118位残基的基因片段,然后将它亚克隆到含有用于纯化的his6标签和用于生物素化的avi标签的表达载体中。通过用cd47表达质粒和生物素连接酶(bira)表达质粒以1:1的比例共转染293f细胞,来表达在c-端处带有生物素修饰的cd47-ecd-his6(cd47-bio),并使用ni-nta琼脂(qiagen)从细胞培养上清液纯化cd47-ecd-his6。
[0137]
噬菌体展示抗体文库
[0138]
从93位健康供体的外周血单核细胞(pbmc)构建人非免疫scfv(单链可变片段)抗体文库。所述文库的大小为总共1.1
×
10
10
个成员。
[0139]
噬菌体抗体文库的选择和筛选
[0140]
由所述文库,制备在表面上表达scfv的噬菌体粒子(噬菌体-ab),并将其用于选择
针对人cd47的胞外结构域的抗体。将cd47-bio捕获在偶联有链霉亲和素的磁性m-280(life technologies)上,然后与由所述文库制备的噬菌体粒子孵育。进行两轮选择。对于每一轮选择来说,为了获得高亲和性抗体,对捕获在磁珠上的cd47-bio的量进行优化,并应用大量清洗步骤。使用碱性三乙醇胺溶液洗脱结合的噬菌体-ab。随后,挑取总共95个单克隆,经挽救以产生噬菌体-ab,并通过酶联免疫吸附测定(elisa)筛选与cd47-bio特异性结合的单克隆。以与cd47-bio结合在450nm处的光密度值》0.2的克隆被评为阳性,而阴性克隆给出《0.1的值。在对阳性克隆的重链(vh)和轻链(vl)可变区的基因进行测序后,将它们相应的氨基酸序列进行比对,以消除重复的克隆并鉴定出具有不同序列的独特抗体用于进一步表征。最后鉴定到五种抗体,将它们命名为bc2、bc7、bc12、bc15、bc18。
[0141]
sirpα-d1纯化
[0142]
从人pbmc的cdna扩增编码人sirpα第一结构域(sirpα-d1)的第1~148位残基的基因片段。为了表达sirpα-d1-mfc融合蛋白,将sirpα-d1基因亚克隆到表达载体所含的小鼠igg2a fc片段的n-端。通过用表达载体瞬时转染293f或293t细胞来表达所述蛋白质,并通过蛋白a亲和层析进行纯化。使用磺基-nhs-ss-生物素(thermo)制备生物素化的sirpα-d1蛋白。
[0143]
用于elisa或中和测定的纯化的噬菌体-scfv的制备
[0144]
通过peg/nacl沉淀10~30ml细菌培养物上清液中的噬菌体-scfv,然后通过光谱仪定量。基于标准化到相同浓度的连续稀释的噬菌体-ab的剂量响应,来评估不同噬菌体-scfv的抗原结合或sirpα竞争测定的活性。
[0145]
scfv-hfc微抗体的制备
[0146]
将来自于噬菌体-scfv表达载体的scfv编码基因亚克隆到表达载体中,其中表达载体在scfv的c-端处含有人igg1 fc片段。为了产生scfv-hfc,用scfv-hfc表达质粒瞬时转染293f(life technologies)或293t细胞(atcc),在转染后5天,收获细胞培养上清液,并通过蛋白a亲和层析(蛋白a琼脂糖凝胶cl-4b,ge healthcare)纯化scfv-hfc。
[0147]
全长igg1抗体的制备
[0148]
将scfv的vh和vl编码序列独立地亚克隆到抗体重链(hc)表达载体和轻链(lc)表达载体中。为了制备igg1抗体,用两种表达质粒(hc lc质粒)以1:1的比例瞬时共转染293f或293t细胞。在转染后5天,收获细胞培养上清液,用于通过蛋白a亲和层析纯化igg1。
[0149]
elisa测定
[0150]
cd47结合elisa:将2μg/ml溶于磷酸盐缓冲盐水(pbs)中的中性亲和素(sigma)包被在u形底96孔板(nunc,maxisorp
tm
)中,每孔100μl,在4℃下过夜或37℃下1小时。然后,将2μg/ml溶于含2%脱脂奶的pbs中的bio-cd47以每孔100μl的量,通过在30℃下孵育1小时捕获在板上。对于基于噬菌体-scfv的elisa来说,以每孔100μl的量向每个孔添加溶于含2%脱脂奶的pbs中的连续稀释的噬菌体-scfv。通过添加hrp偶联的小鼠抗m13抗体(ge healthcare)并在30℃下孵育30min,检测特异性结合的噬菌体-scfv。在每个孵育步骤之间,将elisa板用每孔200μl的pbst溶液(含有0.05%吐温20的pbs)清洗6次。在hrp偶联的抗体孵育后,通过与tmb底物(sigma)在30℃下孵育5~10min来产生elisa信号,然后每孔用50μl的2m h2so4终止反应。通过微孔板读板器(bio-rad)读取在450nm处的吸光值。对于基于scfv-fc或igg1的elisa来说,方法与上面噬菌体-scfv描述的基本相同,区别在于结合的抗
体通过hrp偶联的小鼠抗人igg fc抗体(sigma)来检测。
[0151]
sirp竞争elisa:将2μg/ml cd47-ecd-his6以每孔100μl的量包被在u形底96孔板(nunc,maxisorptm)上,在4℃下过夜或在37℃下1小时。将0.8nm或0.5nm bio-sirpα-d1-mfc与不同浓度的测试抗体或sirpα-d1-mfc混合在含有2%脱脂奶的pbs中,然后以每孔100μl的量通过在30℃下孵育1小时捕获在板上。通过添加hrp偶联的链霉亲和素(sigma)并在30℃下孵育30min,来检测特异性结合的bio-sirpα-d1-mfc。清洗、显色和读取步骤与hcd47结合elisa相同。在数据分析中,将od450值转变成抑制%。
[0152]
表面等离子体共振(spr)分析
[0153]
表面等离子体共振测量在biacore t200仪器(bd)或biacore x200(bd)上进行。将抗cd47抗体捕获在固定化抗人igg fc cm5生物传感器芯片上,该芯片使用标准的伯胺偶联产生。所有测量均在ph7.4或ph6.8或ph6.0的hbs-ep缓冲液中,在25℃下进行,并使用氯化镁进行表面再生。将cd47的连续稀释液以30μl/min的流速进样到每个流动池上。所有数据均使用biacore t200评估软件,使用1:1朗缪尔(langmuir)结合模型来分析。
[0154]
spr在biacore x200上进行。将1μg/ml抗cd47 scfv-hfc,以10μl/min的流速在cm5芯片上捕获30s。将2倍连续稀释的cd47(以32nmol起始,总共5个浓度),以30μl/min的流速在结合有抗体的表面上进样1min,然后是1min的解离阶段。在每个循环后,表面用氯化镁再生。
[0155]
cho-47稳定细胞系的产生
[0156]
从人pbmc的总cdna克隆人cd47(2型,305个氨基酸)的cdna,并引入到含有neo抗性序列的表达质粒中。在用hcd47表达质粒转染后,通过用1mg/ml g418选择来获得已稳定转染有人cd47的cho细胞(cho-47),并在facsaria(bd)上通过流式细胞术分拣至等同的表面表达。
[0157]
流式细胞术测定
[0158]
对于cd47结合测试来说,将cho-47或表达hcd47的其他细胞系与连续稀释的抗cd47抗体在4℃下孵育1小时。然后,将细胞与fitc标记的抗人fcγ特异性抗体(sigma)在4℃下孵育0.5小时。对于sirpα竞争facs来说,将10nm bio-sirpα-d1-mfc与不同浓度的测试抗体混合,并与cho-47或其他cd47阳性细胞在4℃下孵育1小时。然后,将细胞与fitc标记的抗链霉亲和素特异性抗体(sigma)在4℃下孵育0.5小时。对于非特异性结合facs来说,将不表达hcd47的细胞(例如cho)与高浓度(例如500nm)的测试抗体孵育。与cd47结合测试相同,然后将细胞与fitc标记的抗人fcγ特异性抗体(sigma)孵育。在孵育后,将细胞用含有0.5%bsa的pbs溶液清洗3次。然后,将细胞重悬浮在400μl不含bsa的pbs中,在lsr ii(bd)上通过流式细胞术检测与细胞结合的抗体。
[0159]
通过上述elisa、spr分析,我们鉴定到两种很好的抗体bc18和bc7。在spr测定中,bc18显示出最好的动力学性能,其中kd值为1.43nm;其次是bc7,具有3.27nm的kd值(图1和表2)。因此,选择bc18和bc7用于进一步鉴定。
[0160]
bc18和bc7在体外的进一步表征
[0161]
bc18和bc7与其他已公开的治疗性cd47 mab的比较
[0162]
接下来,将bc18和bc7转变成全长人igg1形式。然后,通过spr测定(图2)、elisa(图3)和facs(图4),将cd47结合亲和性和sirpα竞争能力与b6h12、ab6.12、hu5f9进行比较。
b6h12是一种显示出广谱肿瘤治疗效果的已公开的cd47抗体。ab6.12和hu5f9是正在进行i期临床试验的两种抗cd47 mab(wo2011/143624a2;us2013/0224188a1)。bc18显示出与ab6.12、hu5f9相比不同的动力学性能,并具有可比的kd值。在elisa测定中,bc18和bc7两者均显示出比b6h12更强的cd47结合和sirpα竞争活性(图3a和图3c)。bc18在cd47结合和sirpα竞争活性两个方面均优于ab6.12并与hu5f9相近(图3b和图3d)。在细胞表面水平上,bc18显示出与ab6.12和hu5f9可比的cd47结合和sirpα竞争活性(图4)。
[0163]
在图2中,在biacore t200上进行spr。将1μg/ml的抗cd47的全长igg1抗体以10μl/min的流速在cm5芯片上捕获30s。将2倍连续稀释的cd47(以100nmol起始,总共7个浓度)以30μl/min的流速在结合有抗体的表面上进样120s,然后是240s的解离阶段。在每个循环后,表面用氯化镁再生。
[0164]
图3示出了通过elisa得到的抗hcd47抗体在cd47结合和sirpα竞争能力方面的比较。在图3中,a.全长igg1形式的抗体进行3倍连续稀释(以10nm起始,总共12个浓度)。b.全长igg1形式的抗体进行3倍连续稀释(以40nm起始,总共12个浓度)。c-d.sirpα竞争elisa。c.将0.8nm生物素化的sirpα-d1-mfc与测试的2倍连续稀释浓度(以40nmol起始,总共8个浓度)的全长igg1或sirpα-d1-mfc混合。d.将0.5nm生物素化的sirpα-d1-mfc与测试的3倍连续稀释浓度(以200nmol起始,总共12个浓度)的全长igg或sirpα-d1-mfc混合。
[0165]
图4示出了通过facs分析得到的抗hcd47抗体的比较。在图4中,a.cd47结合facs。将全长igg1形式的抗体进行3倍连续稀释(以40nmol起始,总共8个浓度)。b.sirpα竞争facs。将100nm生物素化的sirpα-d1-mfc与测试的3倍连续稀释浓度(以40nmol起始,总共8个浓度)的全长igg混合。sa-fitc表示fitc标记的链霉亲和素。
[0166]
bc18和bc7与肿瘤细胞上表达的cd47结合
[0167]
在这个实验中使用了两种表达人cd47的人细胞系,raji和hek-293。raji是人b成淋巴细胞系;hek-293t是人胚胎肾细胞系。bc18的结合使用fitc抗人fc抗体来检测,并通过bd lsr ii进行分析(图5)。即使在0.06nm的低抗体浓度下,bc18和bc7也可以与raji和hek-293细胞表面上的hcd47结合。bc18与细胞表面hcd47的结合亲和性略强于bc7。
[0168]
在图5中,示出了bc18和bc7可以与细胞表面cd47结合。将raji(a)或293t(b)细胞与5倍连续稀释(以200nmol起始,总共8个浓度)的全长igg1形式的抗体孵育。在与fitc偶联的抗hfc抗体孵育后,通过bd lsr ii对细胞进行分析。
[0169]
体外吞噬测定
[0170]
然后我们调查了用bc18和bc7阻断cd47/sirpα相互作用是否能够使靶细胞被吞噬。使用hl-60细胞系作为靶细胞,并将其用cfse标记。使用人外周血来源的巨噬细胞来测量吞噬活性,并使用荧光显微镜计数被摄入的细胞的数目。bc18和bc7两者均诱导hl-60细胞的有效吞噬,并且作用优于hsirpa-hfc和mb6h12(图6)。
[0171]
体外吞噬测定
[0172]
人巨噬细胞源自于外周血单核细胞(pbmc)。选择人b成淋巴细胞(raji)、hl-60或jurkat作为靶细胞。将靶细胞用5μm羧基荧光素琥珀酰亚胺酯(cfse)标记。将具有hfc的抗cd47抗体以10μg/ml的浓度添加到cfse raji细胞中。在孵育2h后,将调理过的靶细胞与保持在rpmi培养基1640中的巨噬细胞在37℃下共培养。通过共聚焦显微镜拍摄每个样品的3个不同点的照片,并对至少200个巨噬细胞进行计数,以计算100个巨噬细胞吞噬了多少个
fisher),按照用户指南测试抗体的热稳定性。简单来说,将12.5μl 0.5mg/ml的抗体或pbs与5μl蛋白质热漂移(protein thermal shift)缓冲液和2.5μl稀释的蛋白质热漂移染料(diluted protein thermal shift dye)混合,并添加到在冰上预冷的反应板中。然后,将板装载到7500快速实时pcr系统(fast real-time pcr system)上,运行解链曲线实验。通过蛋白质热漂移(protein thermal shift)软件分析tm值。
[0183]
表2.通过蛋白质热漂移染料试剂盒测试的bc7、bc18和它们的突变体的tmd值
[0184][0185]
实施例2双特异性抗体
[0186]
材料和方法
[0187]
细胞系
[0188]
遵照制造商的说明书(thermo fisher scientific)培养freestyle 293f细胞。raji细胞来自于中国科学院典型培养物保藏中心的细胞库。通过电穿孔和随后的g418选择和单细胞克隆分离来产生raji-gpc3h细胞系(表达人gpc3)。人hcc细胞系hep3b由鲁凤民博士(中国北京,北京大学医学部)慷慨提供。hep3b-luc23细胞系如以前所述构建。cd47基因敲除的细胞系hep3b-cd47
ko
和jurkat-cd16a-cd47
ko
使用crispr-cas9技术产生。raji、raji-gpc3h和jurkat-cd16a-cd47
ko
细胞用增补有10%胎牛血清(fbs)的rpmi 1640培养基培养。hep3b、hep3b-luc23和hep3b-cd47
ko
细胞用增补有10%fbs的dulbecco改良的eagle培养基(dmem)培养。
[0189]
双特异性抗体构建
[0190]
gc33的可变重链(vh)和轻链(vl)基因序列由genscript合成。抗人cd47抗体bc18选自我们的人非免疫scfv(单链可变结构域片段)噬菌体展示抗体文库。并且对它的vh和vl的基因进行测序。将gc33和bc18的vh和vl的编码序列分别亚克隆到人igg1重链(hc)表达载体和轻链(lc)表达载体中。
[0191]
为了构建双特异性抗体,我们使用以前报道的kih和crossmab技术修饰了原始野生型hc和lc表达载体(空白)。简单来说,通过定点突变将几个突变引入到hc的ch3结构域中,以产生“杵(knob)链”(t366w、s354c)和“臼(hole)链”(y349c、t366s、l368a、y407v)。将臼链的ch1结构域与lc的cl结构域交换,以分别产生配对的交换重链(cl-臼链)和轻链(ch1-lc)。然后,根据需要将gc33、bc18和对照抗体的vh和vl片段克隆到杵链、cl-臼链或ch1-lc表达载体中。
[0192]
表面等离子体共振(spr)分析
[0193]
所有spr分析均在biacore t200仪器(biacore,ge healthcare)上进行。为了测量每种单克隆抗体与它们自己的抗原的结合亲和性,首先使用固定到cm5传感器芯片的蛋白a/g(pierce,thermo fisher)捕获gc33或bc18(同种型人igg1);然后,将分析物(hgpc3
‑△
hs或hcd47蛋白,参见补充材料和方法)以连续稀释的浓度在每个流动池上进样。使用
biacoret200评估软件,计算结合速率(k
结合
(k
on
))、解离速率(k
解离
(k
off
))和亲和常数(kd)。如上所述进行gpc3/cd47biab或gpc3/cd47-dang变体与mfcγr结合的动力学分析(此时分析物是连续稀释的mfcγr)。
[0194]
为了证实gpc3/cd47 biab的同时结合,使用胺偶联试剂盒(biacore),将hgpc3
‑△
hs以~600个响应单元(ru)的表面密度共价附连到cm5传感器芯片。以20μg/ml进样gpc3/cd47 biab,解离阶段为80s,然后进样1mm hcd47-小鼠fc(mfc)融合蛋白,解离阶段为120s,然后用3m mgcl2再生。
[0195]
基于facs的结合和阻断测定
[0196]
为了比较每种抗体与表达单抗原或双抗原的细胞的结合能力,将raji或raji-gpc3h细胞(5
×
105个/孔,在96孔板中)与0.4μg/ml或2μg/ml测试抗体在facs缓冲液(0.5%bsa/pbs)中,在4℃下孵育30min。然后清洗结合有抗体的细胞,并与fitc偶联的山羊抗人igg二抗(sigma-aldrich)在4℃下孵育20min。将这些样品用facs arial ii仪器(bd biosciences)分析,并使用fcs express ver.4(de novo软件)处理数据。
[0197]
为了评估这些抗体的结合选择性,按照制造商的方案,将raji细胞用celltrack
tm
深红(thermo fisher scientific)进行标记,然后与未染色的raji-gpc3h细胞以1:1的比例混合。然后将混合的细胞(1
×
106个/孔)与0.2μg/ml的每种抗体在4℃下孵育30min,并如上所述进行分析。
[0198]
为了评估所有抗cd47抗体阻断cd47与sirpα之间的相互作用的能力,在不同抗cd47抗体(10μg/ml)的存在下,将raji或raji-gpc3h细胞与50nm生物素化的sirpα-mfc在4℃下孵育30min。然后在清洗后,添加链霉亲和素-fitc(sigma-aldrich),以测量sirpα与每种类型的细胞的结合。
[0199]
红细胞凝集测定
[0200]
将从健康供体采集的人类全血用pbs清洗并重悬浮。以每孔在pbs中3百万个rbc的数量铺板在聚丙烯96孔板(corning)中,并与连续稀释的抗体在室温下孵育1hr。
[0201]
hcd47/hsiprα人源化小鼠的产生
[0202]
所有动物实验均按照中国国家实验动物饲养和护理指南进行,并在北京国家生物科学研究所批准的iacuc方案下进行。人源化小鼠通过crispr/cas9介导的基因编辑技术产生。通过将小鼠sirpα基因的编码胞外结构域的外显子2替换成人sirpα外显子的对应物,来产生人源化sirpα小鼠。同样地,通过将小鼠cd47基因的编码胞外结构域的外显子2替换成人cd47外显子的对应物,来产生人源化cd47小鼠。通过将上述两种类型的人源化小鼠在一起交配,产生hcd47/hsirpα双基因人源化的小鼠。将纯合的人源化小鼠用于本研究。
[0203]
小鼠中的药代动力学和血液学毒性研究
[0204]
在hcd47/hsirpα人源化小鼠中进行单剂量药代动力学(pk)研究。将8至10周龄人源化小鼠(每组n=3)用10mg/kg的每种抗体i.p.注射。在不同时间点采集血样,并使用人igg elisa定量试剂盒(bethyl laboratories)测量每种人抗体的血清浓度。pk数据的评估使用winnonlin软件进行。将6至8周龄的人源化小鼠(每组n=4
–
6)用10mg/kg的每种抗体i.p.注射。在抗体给药后45min或2.5hr从眶窦采集血样,并在北京博瑞世安科技有限公司(beijing brightshines ltd)使用advia 2120i仪器测量红细胞计数。
[0205]
adcc报告物的生物测定
[0206]
adcc报告基因的生物测定按照以前的报告进行。将靶细胞(raji、raji-gpc3h或hep3b)以1.5
×
104的量接种在96孔固体白色聚苯乙烯微孔板(corning)的每个孔中。添加三倍连续稀释的抗gpc3 mab、抗cd47 mab或gpc3/cd47 biab以及jurkat-cd16a-cd47
ko
效应细胞;最终的效应细胞与靶细胞比例(e:t)为6:1。使用发光底物(promega bright-glo
tm
),在37℃、5%co2下孵育大约8hr后测量萤光素酶活性。
[0207]
adcp测定
[0208]
在adcp测定中,使用小鼠骨髓来源的巨噬细胞(bmdm)作为效应细胞。为了制备bmdm,从hcd47/hsirpα人源化小鼠的股骨和胫骨收集小鼠骨髓细胞,并用增补有15%l929(分泌gm-csf)细胞培养基的dmem培养基诱导3天。在与靶细胞孵育之前,将分化的bmdm用1:200稀释的抗小鼠f4/80抗体-alex fluor647(thermo fisher,克隆bm8)标记。
[0209]
对于竞争性adcp实验来说,将raji和raji-gpc3h细胞用作靶细胞;将它们用celltrace
tm
黄或cfse按照制造商的方案(thermo fisher scientific)进行染色。将荧光标记的靶细胞以1:1混合,并以4
×
105个细胞/孔的密度铺板。对于hcc细胞系的adcp实验来说,将hep3b或hep3b-cd47
ko
细胞用cfse染色,并以8
×
104个细胞/孔的密度铺板。将每种靶细胞与4μg/ml的每种抗体在rt孵育10min,然后添加到已分化且标记的bmdm(~2
×
105个细胞/孔)中,在37℃下孵育2hr。使用尼康a1r共聚焦显微镜,记录荧光标记的靶细胞被alex fluor647标记的bmdm的吞噬。洗掉未被吞噬的细胞,然后进行显微镜成像。统计分析(多重学生t-检验或单向anova)在graphpad prism中进行。
[0210]
体内hcc异种移植模型
[0211]
将5
×
106个hep3b-luc23细胞,皮下注射到6至8周龄的非肥胖型糖尿病严重联合免疫缺陷(nod-scid)小鼠的右胁腹中。基于等效平均肿瘤体积,将小鼠随机分组(每组n=5),并每周两次通过i.p.注射接受10mg/kg的每种抗体(或其变体),共3周。在i.p.注射15mg/kg d-萤光素(perkinelmer)后,使用ivis lumina iii体内成像系统(perkinelmer)测量带有肿瘤的小鼠的体内肿瘤的生物发光强度。用电子卡尺测量肿瘤尺寸,并使用公式(l
×
w2)/2计算肿瘤体积,其中l和w分别是最大和最小测量直径。所有小鼠如果它们的肿瘤尺寸超过2000mm3或在研究结束时,通过co2对它们实施安乐死。
[0212]
对于体内近红外荧光(nirf)成像来说,将gpc3/cd47 biab和同型对照抗体与cy7 nhs酯(ge healthcare)偶联。基于等效平均肿瘤体积,将带有hep3b肿瘤的小鼠随机分为两组(每组n=3),并用8mg/kg的每种荧光标记的抗体注射。在抗体给药后12、24、36和48h对小鼠进行成像,使用745和800nm的激发和发射波长。在抗体给药后48h解剖器官并成像。
[0213]
对于巨噬细胞的耗竭来说,在gpc3/cd47 biab治疗开始前3天,将nod-scid小鼠用200μl氯膦酸盐脂质体(formumax)i.p.注射,然后每周额外注射一次(100μl),直至研究结束。对于中性粒细胞的耗竭来说,将nod-scid小鼠每5天用200μg抗ly6g抗体(1a8克隆,bioxcell)i.p.注射。
[0214]
统计分析
[0215]
不同实验组之间的统计显著性通过学生t-检验、单向anova或双向anova和图基(tukey’s)检验来分析(*p《0.05,**p《0.01,***p《0.001,****p《0.0001)。所有统计分析和图表制作均使用graphpad prism进行。
[0216]
实施例2双特异性抗体
[0217]
双特异性抗体的产生和gpc3/cd47 biab对表达双抗原的细胞的特异性得到极大提高的证实
[0218]
在对各种抗gpc3或抗cd47 mab的结合亲和性、表位和抗肿瘤活性进行表征后,我们采用了两种抗体,即靶向人gpc3的考曲妥珠单抗(gc33)和靶向人cd47的mab(bc18)来产生gpc3/cd47 biab(图10和图11a)。通过我们的噬菌体展示幼稚抗体文库(scfv)筛选得到的bc18有效阻断了cd47与其受体sirpα之间的相互作用(图11b)。正如通过表面等离子体共振(spr)分析所测量的,gc33和bc18两者对它们自己的抗原均具有纳摩尔范围的亲和性(图11c)。为cd47或gpc3分别产生了另外两种bsab(ctrl/cd47 biab或gpc3/ctrl biab)作为对照(图11a)。所有biab均通过hek293f细胞的瞬时转染产生,然后通过蛋白a亲和层析进行纯化(图11d)。随后,基于spr的分析,证实了纯化并正确组装的gpc3/cd47 biab的双重特异性(图12a),并确认了两种对照biab的相应特异性(图11e)。
[0219]
cd47在正常组织细胞上的广泛表达可能导致对肿瘤细胞的抗体生物可利用性降低,从而损害抗cd47抗体的治疗功效(所谓的“抗原沉没”现象)。我们使用工程化改造的gpc3
cd47
双阳性细胞(raji-gpc3h,图11f)来研究gpc3/cd47 biab是否对所设计的表达双抗原的细胞具有选择性结合性质。我们发现,与表达单抗原的raji-wt细胞相比,gpc3/cd47 biab对双阳性raji-gpc3h细胞具有强得多的结合(图12b),这支持了我们的双重靶向策略提供改进的特异性。此外,我们设计了体外实验来模拟抗原沉没情景,其中双阳性和单阳性细胞两者均存在。具体来说,我们用深红色染料标记raji细胞,并将它们与raji-gpc3h细胞以1:1的比例混合,然后与每种抗体孵育。在facs分析期间,我们首先根据细胞类型对细胞进行门选,然后分析抗体结合。与raji细胞相比,gpc3/cd47 biab优先结合raji-gpc3h;对于上述对照抗cd47 mab或ctrl/cd47biab来说这种特异性并不太显著(图12c)。
[0220]
接下来我们测试了gpc3/cd47 biab的sirpα/cd47阻断活性:竞争性facs分析显示,与抗cd47 mab和ctrl/cd47 biab(其各自以相同程度阻断sirpα与表达cd47的raji-wt细胞和raji-gpc3h细胞的结合)相比,gpc3/cd47 biab对raji-gpc3h细胞的阻断活性强于对未修饰的raji细胞的阻断活性(图12d)。总而言之,这些结果表明gpc3/cd47 biab容易实现与表达双抗原的肿瘤细胞的优先结合和有效的sirpα/cd47阻断。
[0221]
与抗cd47mab相比,gpc3/cd47biab在人cd47/sirpα基因修饰的小鼠中具有优异的安全特性和延长的血清半衰期
[0222]
严重副作用是抗cd47抗体治疗的主要担忧之一。为了评估我们的gpc3/cd47 biab的血液学安全性,我们首先使用人红细胞(rbc)进行了体外凝集测定。正如预期,抗cd47 mab引起红细胞凝集,而gpc3/cd47 biab不引起红细胞凝集。与此相符的是,使用ctrl/cd47 biab不发生红细胞凝集,这表明仅通过一个抗体臂与cd47结合避免了诱导红细胞凝集(图13a)。
[0223]
为了评估gpc3/cd47 biab的体内安全特性,我们产生了人cd47/sirpα双基因修饰的小鼠(hcd47/hsirpα人源化小鼠),具体来说将鼠类cd47和sirpα基因的编码胞外结构域的外显子替换成人类的对应物(图14a~14b)。对于biab来说没有观察到血液学毒性的明显迹象,而抗cd47 mab在人源化小鼠中在1hr内就诱导了急性红细胞耗竭(图13b、图14c)。此外,抗cd47 mab引起体温的显著下降;而在用gpc3/cd47或ctrl/cd47 biab治疗后不发生这种下降(图13c)。
[0224]
cd47介导的快速药物清除也是临床应用的担忧。因此,我们使用上述人源化小鼠进行了单剂量pk研究。与ctrl/cd47 biab相似,gpc3/cd47 biab与亲代抗cd47 mab(t1/2~2.4天)相比显示出延长的血清半衰期(t
1/2
~13.4天)(图13d)。这些延长可能是由于抗体与表达cd47的正常体细胞的结合降低(抗原沉没)。总而言之,这些结果支持gpc3/cd47 biab在体内明显比抗cd47 mab更安全并具有有利的pk特性。
[0225]
gpc3/cd47 biab对表达双重抗原的肿瘤具有增强的fc介导的功能和选择性生长抑制
[0226]
由fc结构域介导的抗体依赖性细胞毒性(adcc)和抗体依赖性细胞吞噬(adcp)是在癌症治疗期间由抗体引发的两种功能。根据我们的发现,即gpc3/cd47 biab可以与表达双抗原的肿瘤细胞优先结合(图12c),我们研究了gpc3/cd47 biab诱导针对raji-gpc3h细胞的adcc和adcp的能力。对于adcc测定来说,我们使用了其中将工程化改造的jurkat t淋巴细胞用作效应细胞的报告系统(图15a)。我们还敲除了cd47表达,以克服由jurkat细胞中的cd47表达引起的背景毒性问题(jurkat-cd16a-cd47
ko
)(图15b~15c)。与抗cd47mab(其针对raji-gpc3h和raji细胞诱导同等强度的adcc)相比,gpc3/cd47biab以剂量依赖性方式诱导的对raji-gpc3h细胞的adcc强于对raji细胞的adcc(图16a)。
[0227]
然后,我们分析了与巨噬细胞在体外共孵育后,raji-gpc3h细胞的经biab诱导的adcp。在这个实验中,使用来自于人源化小鼠的表达人sirpα的骨髓来源的巨噬细胞(bmdm)作为效应细胞,同时将raji-gpc3h和raji细胞的混合物用作靶细胞。荧光显微术和吞噬定量的结果显示gpc3/cd47 biab诱导raji-gpc3h细胞的优先吞噬(图16b)。相比之下,抗cd47 mab没有表现出选择性:它诱导两种类型的细胞的吞噬。
[0228]
为了研究在体内治疗期间,gpc3/cd47 biab对表达双抗原的肿瘤的抗肿瘤功效,我们使用了双侧小鼠模型,其中将raji或raji-gpc3h细胞分别植入到nod-scid小鼠的右胁腹或左胁腹中(图16c)。令人鼓舞的是,与抗cd47 mab和ctrl/cd47 biab(其各自以相近水平抑制raji-gpc3h和raji肿瘤进展)两者均不同,gpc3/cd47 biab对raji-gpc3h的肿瘤抑制效果明显比对raji细胞更加显著(图16d)。抗gpc3 mab不抑制raji-gpc3h肿瘤的进展,这可能是由于它的效应功能弱。总而言之,这些体外和体内结果显示gpc3/cd47 biab对表达双抗原的肿瘤具有增强的fc介导的功能和选择性生长抑制。
[0229]
在异种移植hcc模型中,gpc3/cd47 biab的性能优于单一疗法和抗cd47和抗gpc3 mab的联合疗法
[0230]
为了测试gpc3/cd47 biab在体内对hcc进展的表现,我们在异种移植小鼠模型中使用了gpc3和cd47双阳性人hcc细胞系(hep3b)。在证实了hep3b细胞以中等水平表达gpc3和cd47两者(图15d)后,我们建立了稳定表达萤光素酶的hep3b-luc23细胞系,以便能够使用体内生物发光成像来测量肿瘤生长。nod-scid小鼠用这些hep3b-luc23细胞进行皮下注射,然后随机分成具有相近的平均肿瘤生物发光强度的四个组,然后每周两次接受抗体治疗,共三周。
[0231]
与抗gpc3 mab或抗cd47 mab相比,gpc3/cd47 biab提供显著增强的肿瘤抑制,但应该指出这些mab单一疗法各自也抑制了hep3b肿瘤生长。生物发光成像揭示出,在5只gpc3/cd47 biab组小鼠中的3只中肿瘤完全根除,而mab单一疗法组的小鼠没有检测到肿瘤根除(图17a~17c)。使用类似的给药方案,我们也比较了每种抗体对带肿瘤小鼠的总体存
活率的影响。尽管抗cd47 mab和抗gpc3 mab两者与pbs对照相比显著提高了总体存活率,但所有小鼠最终都因肿瘤发展而死亡。相比之下,gpc3/cd47 biab引发了强劲的抗肿瘤响应,在治疗结束后2个月引起50%小鼠(6只中的3只)的完全响应(cr)(图18a)。gpc3/cd47biab治疗将生存期中值延长到88天,与此相比生存期中值在抗cd47 mab组中为65天,在抗gpc3 mab组中为68.5天(图18b)。接下来,我们比较了gpc3/cd47biab与包含抗gpc3 mab和抗cd47 mab联合疗法的抗肿瘤性能。通过测量肿瘤体积和生物发光强度,对肿瘤生长随时间的变化进行了监测,结果显示gpc3/cd47 biab提供了比上述联合疗法优异的抗肿瘤效果(图17d~17f)。总之,这些结果为gpc3/cd47 biab针对gpc3和cd47双阳性hcc肿瘤的抗肿瘤活性提供了有力证实。
[0232]
巨噬细胞和中性粒细胞在体内参与gpc3/cd47 biab的fc依赖性抗肿瘤活性
[0233]
为了研究gpc3/cd47 biab用于治疗hcc的作用机制,我们首先检查了针对hep3b细胞的fc介导的效应功能。体外adcp实验显示,gpc3/cd47 biab诱导hep3b细胞的显著吞噬。我们还发现抗gpc3 mab不诱导hep3b细胞的吞噬,而从hep3b细胞的基因敲除掉cd47(hep3b-cd47
ko
)则恢复了抗gpc3 mab的吞噬活性(图19a~19b),这一发现证实了以前关于在肿瘤细胞上表达cd47赋予对抗体诱导的吞噬的抗性的报告。在体外adcc测定中,gpc3/cd47 biab以与抗cd47或抗gpc3 mab可比或更高的水平,诱导针对hep3b细胞的剂量依赖性的细胞毒性效应(图19c)。
[0234]
为了进一步在体内评估fc介导的效应功能,我们产生了gpc3/cd47 biab变体(gpc3/cd47-dang),其在fc区中有两个突变(d265a和n297g),已知这两个突变能消除fc区与所有类型fcγr的结合。在进行小鼠研究之前,我们成功地证实了gpc3/cd47-dang对mfcγr不表现出结合活性,但仍保留以与gpc3/cd47 biab相近的亲和性与hep3b细胞结合的能力(图20a~20b)。在使用上述hep3b-luc异种移植模型的实验中,我们发现gpc3/cd47-dang不提供抗肿瘤效应(图19d),表明fc介导的效应功能是biab的抗肿瘤活性所需的。使用全身近红外荧光(nirf)成像,我们还评估了gpc3/cd47 biab在带肿瘤小鼠中的分布。与同型对照抗体相比,gpc3/cd47 biab表现出肿瘤积累随时间的增加(图19e)。为了测量每种抗体在不同器官中的积累,对自于新鲜解剖的肿瘤和器官的荧光信号进行了定量。与同型对照抗体明显非特异性的分布不同,在gpc3/cd47 biab治疗的小鼠中器官与肿瘤荧光比率的显著降低支持了它在肿瘤部位处的特异性积累(图19f)。
[0235]
接下来,我们试图鉴定对gpc3/cd47 biab的抗肿瘤效应有贡献的免疫细胞类型。考虑到nod-scid小鼠的免疫受损的免疫背景,我们使用了免疫细胞耗竭方法来评估模型的三种主要先天性免疫细胞亚群的贡献:巨噬细胞、中性粒细胞和nk细胞。确认了对于所有三种免疫细胞亚群来说,耗竭效率均超过90%(图21a)。来自小鼠的巨噬细胞或中性粒细胞的耗竭导致gpc3/cd47 biab的抗肿瘤效应的显著降低,而nk细胞的耗竭不引起任何效应(图19g、图20b)。这个结果支持巨噬细胞和中性粒细胞两者均在功能上对biab的抗肿瘤效应有贡献。
[0236]
鉴于以前的研究显示gpc3在hcc中过表达可能召集m2极化的免疫抑制性巨噬细胞(据认为限制了抗体治疗功效的结果),我们进一步分析了在gpc3/cd47biab治疗后的浸润巨噬细胞。与载体对照相比,facs分析揭示出在用gpc3/cd47biab治疗的小鼠中浸润巨噬细胞的频率显著升高(图21c~21d)。这个结果得到了免疫荧光显微术分析结果的进一步支持
(图21e)。此外,gpc3/cd47 biab治疗似乎还引起m1样/m2样比率的提高,这一发现表明gpc3/cd47 biab可以使肿瘤内巨噬细胞稍微偏向促炎性状态(图21f)。综合来看,这些来自于nod-scid异种移植肿瘤模型的结果确认了gpc3/cd47 biab的抗肿瘤活性需要其fc介导的效应功能以及巨噬细胞和中性粒细胞的参与。
[0237]
图21:(a)巨噬细胞、中性粒细胞和nk细胞的体内耗竭。在gpc3/cd47biab治疗开始前3天,nod-scid小鼠经200μl氯膦酸盐脂质体(formumax)i.p.注射,然后每周一次进行额外的注射(100μl),直至研究结束。每5天使用200μg抗ly6g抗体(1a8克隆,bioxcell)进行中性粒细胞的耗竭。每周一次使用50μl抗asialo-gm1多克隆抗体(poly21460,biolegend)进行nk细胞的耗竭。通过流式细胞术证实了在脾脏和外周血中的耗竭效果。(b)在进行或不进行nk细胞耗竭(抗asgm1)的情况下,gpc3/cd47 biab治疗后的体内肿瘤生长。肿瘤体积在卡尺测量的基础上计算,并被显示为平均值
±
sem(****p《0.0001;双向anova,然后是tukey’s多重比较检验)。(c)用于从cd45
免疫细胞中鉴定肿瘤浸润性巨噬细胞的流式细胞术门选策略;首先在排除死细胞和双联体后对cd45
细胞进行门选。肿瘤内巨噬细胞被定义为cd11b
gr-1-f4/80
高
。(d)通过facs得到的cd45
免疫细胞中肿瘤浸润性巨噬细胞的百分率。(e)肿瘤浸润性f4/80 细胞计数的ihc分析(左),和使用或不使用gpc3/cd47biab治疗的情况下代表性f4/80染色肿瘤图像(右,
×
40放大)。(f)描绘了m1样/m2样巨噬细胞比率的条形图(左),和显示了在cd80和cd206染色的基础上m1样和m2样亚群的代表性facs图(右)。
[0238]
讨论
[0239]
尽管近年来在癌症疗法中取得了大量进展,但仍有很大一部分晚期hcc患者对一线治疗或免疫检查点抑制剂没有响应。因此,开发一种利用不同机制的治疗策略可能会使hcc患者受益匪浅。双特异性抗体代表了一类新兴的抗体疗法,其已被探索用于治疗各种肿瘤类型。在本研究中,我们产生了与gpc3和cd47结合的双特异性抗体,以特异性靶向hcc肿瘤细胞,并且我们评估了靶向人cd47的双特异性抗体在hcd47/hsirpα双重人源化小鼠中的药代动力学和潜在的不利反应。gpc3/cd47 biab具有吸引人的半衰期,并且不表现出血液学毒性。我们还利用双侧小鼠模型,经验性确定了gpc3/cd47 biab对肿瘤细胞的超过正常细胞的优先活性。总而言之,gpc3/cd47 biab的安全特性、长半衰期和优先抗肿瘤活性突出了其比利用抗cd47单克隆抗体的联合疗法的明显优势。
[0240]
回想一下,我们的体外adcp实验显示了在cd47敲除后抗gpc3 mab如何对hep3b发挥显著的吞噬作用。这个结果证实了以前的研究,所述研究报告了cd47在肿瘤细胞上的表达可以阻碍靶向肿瘤抗原的治疗性抗体的促吞噬潜力。因此,我们的工作说明了利用cd47阻断可以如何为cd47阳性hcc的治疗增加额外的促吞噬抗肿瘤响应。肿瘤相关巨噬细胞(tam)表现出,在抗肿瘤m1表型与促肿瘤m2表型之间连续的不同极化状态。以前的研究显示肿瘤中m2巨噬细胞水平的升高与hcc的不良预后相关。除了激活巨噬细胞吞噬之外,gpc3/cd47 biab还提高了m1/m2巨噬细胞的比率。这种情况对hcc患者可具有额外的好处应该是合理的。
[0241]
与充分研究的巨噬细胞抗肿瘤活性相比,中性粒细胞介导抗肿瘤效应的证据相对有限。尽管表达fc受体的中性粒细胞代表了最丰富的人类循环细胞的毒性效应细胞群体,但它们杀死抗体调理的癌细胞的确切机制仍然难以捉摸。有趣的是,我们的结果支持了,中性粒细胞是gpc3/cd47 biab在nod-scid小鼠中的抗肿瘤效应所需的。与我们的发现类似,
以前的研究显示中性粒细胞的选择性耗竭显著降低了抗cd52 mab和抗cd20 mab的保护活性。已显示cd47-sirpa相互作用的阻断增强了抗体介导的肿瘤细胞被中性粒细胞的灭杀。有趣的是,也存在中性粒细胞参与hcc进展的报道。因此,研究中性粒细胞在hcc患者中是否以及如何造成gpc3/cd47 biab的抗肿瘤效应,将是令人感兴趣的。
[0242]
当考虑gpc3/cd47 biab在hcc患者中的抗肿瘤活性时,不能忽略肝nk细胞。这些占肝总淋巴细胞的高达50%的细胞参与病毒感染的抑制以及肝肿瘤发生。值得注意的是,许多研究观察到随着hcc的发展,细胞毒性受损并且nk细胞的浸润减少。这种肿瘤中nk细胞的减少将明显限制adcc介导的抗体的抗肿瘤功效。以前的研究证实了adcc介导的治疗性抗体的抗肿瘤功效受到nk细胞上表达的fcγriiia中的多态性(158v/f)的影响。此外,值得注意的是,超过85%的人群已知携带低亲和性fcγriiia-158f同种异型。抗gpc3 mab(gc33)在晚期hcc患者中的ii期临床试验的失败可能归因于次优的adcc活性;选择具有高亲和性fcγriiia同种异型,或具有高表达水平的gpc3和/或fcγriiia的患者可能促进高adcc效应,最终会改善结果。考虑到这一点,并想到与亲代抗gpc3 mab相比,gpc3/cd47 biab对hep3b细胞(其表达中等水平的gpc3)的adcc活性极大增强。我们预计gpc3/cd47 biab引发nk细胞的adcc增强的能力可能促进其治疗更广范围的hcc患者(即具有非均质gpc3表达谱的患者)的总体功效。尽管我们研究的nk功能失调的nod-scid小鼠模型排除了对nk细胞参与gpc3/cd47 biab的抗肿瘤效应的明确确认,但未来在这种抗体(包括联合疗法)的临床前和临床试验中密切监测nk细胞活性,很可能会加深我们对adcc活性如何促进nk介导的肿瘤杀伤的理解。
[0243]
应该强调的是,其他宿主免疫细胞(例如t细胞)在抗肿瘤保护方面也有显著贡献。几项研究已证实了靶向gpc3的car-t细胞和t细胞接合性双特异性抗体在hcc异种移植模型中的治疗功效,但它们目前在临床实践中遇到了大量挑战,特别是对于实体肿瘤而言。值得注意的是,cd47阻断抗体可以利用抗原呈递细胞(巨噬细胞或树突状细胞)并促进肿瘤抗原向t细胞的交叉呈递,这导致持久的适应性抗肿瘤应答。因此,我们假设我们的gpc3/cd47 biab也可以利用t细胞抗肿瘤活性,并且当与其他t细胞刺激性免疫检查点抑制剂或化疗药剂一起作为联合药剂给药时,其hcc治疗功效可能会进一步最大化。将来有必要进行将gpc3/cd47 biab与t细胞免疫检查点抑制剂(例如抗pd-1或抗ctla-4mab)一起在具有免疫活性的模型中进行给药研究,以便了解它们各自的贡献。
[0244]
有趣的是注意到,除了表现出比单独的单克隆抗体强得多的抗肿瘤活性之外,使用gpc3/cd47 biab的治疗还提供了比含分别识别gpc3和cd47靶标的两种抗体的联合疗法更好的抗肿瘤益处。这一观察支持了使用双特异性抗体结合两种抗原可以通过某种形式的协同作用提供改进的临床价值。总之,我们在这里开发了一种双特异性抗体并证实了它对hcc具有安全有效的抗肿瘤活性。最终,随着我们对gpc3/cd47 biab在治疗hcc中的特定机制了解得更多,我们可以发现更多的一般性趋势,其可以支持开发双特异性抗体以增强先天性免疫应答,用于创新的治疗策略以进一步改善癌症治疗结果。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。