1.本发明涉及甲基化检测技术领域,具体地,涉及一种膀胱癌快速检测试剂盒。
背景技术:
2.目前,膀胱癌的主要诊断方法包括影膀胱镜检查、尿脱落细胞学检查和荧光原位杂交等。其中,膀胱镜检查结合活检组织病理为膀胱镜诊断的金标准,但该方法属于有创性检查且价格昂贵,患者依从性低。影像学检查对千微小病灶的诊断能力有限,尿脱落细胞学检查的灵敏度低,荧光原位杂交方法检测膀胱癌的敏感度高但特异性相对较低,尚未在临床上广泛应用。
3.近些年甲基化检测被广泛应用于膀胱癌的早期筛查,目前膀胱癌甲基化检测多为亚硫酸氢盐转化法。亚硫酸氢盐可将非甲基化的胞嘧啶转化为尿嘧啶,后者经pcr扩增转变成胸腺嘧啶而产生t:a配对,而甲基化的胞嘧啶则不显示结构变化,通过亚硫酸氢盐转化后dna包含的甲基化信息就转化为dna序列的差异。由此发展了多种膀胱癌甲基化检测方法,如亚硫酸氢盐测序法、焦磷酸测序、甲基化特异性pcr和实时甲基化特异性pcr等。但是,亚硫酸氢盐转化法存在下列缺点:
①
转化条件较为剧烈,可能会造成dna降解从而影响后续检测的灵敏度;
②
操作繁琐,转化后还需纯化,可能造成dna损失;
③
可能出现转化不完全的情况,从而影响后续检测的准确性;
④
未甲基化的胞嘧啶占人类基因组中总胞嘧啶的95%,未甲基化胞嘧啶完全转化为胸腺嘧啶将严重降低序列复杂性,从而降低了序列特异性并增加后续特异性检测的难度。因此,找到一种灵敏度高、特异性好、反应温和、操作便捷的甲基化分析方法,对膀胱癌的早期诊断、治疗和预后监测具有非常重要的现实意义。
4.甲基化敏感型限制性内切酶能够特异性识别酶切靶标并进行酶切,当酶切位点的胞嘧啶呈甲基化时无法进行酶切,因此能够将甲基化dna同非甲基化dna进行区分,将非甲基化的靶标序列进行充分碎片化,而保留完整状态的甲基化序列作为pcr和qpcr的模板。甲基化敏感型限制性内切酶检测方法,避免了使用亚硫酸氢盐转化,不会破坏核酸的完整程度,但是仍然面临着需要纯化回收酶切产物从而损失核酸的问题。除此之外,先酶切后pcr的过程也具有耗时长,易污染等缺陷,且酶切不完全也会导致检测产生假阳性。
5.膀胱肿瘤细胞容易从膀胱组织脱落,因此膀胱肿瘤患者的尿液样本包含大量脱落的病变细胞,这是尿液样本作为膀胱癌检测的物质基础。sox1-ot为sox1基因的重叠转录本,对于细胞胚胎发育、细胞增殖状态、细胞调控的稳态维持有重要影响。hist1h4f是组蛋白基因之一,对于形成和维持异染色质的结构、基因组印迹、dna修复、x染色质的失活和转录等调控方面具有关键作用。sox1-ot和hist1h4f基因特定位点的甲基化水平在膀胱癌组织中显著高于正常组织。目前市场上尚无使用甲基化敏感型限制性内切酶技术同步检测sox1-ot和hist1h4f基因甲基化的试剂盒。
技术实现要素:
6.本发明的目的是克服现有技术的上述不足,提供一种膀胱癌快速检测试剂盒。通
过调整酶切扩增缓冲液的组分,使酶切和pcr扩增处于同一体系中,以实现尿沉渣细胞dna甲基化程度的快速检测,且检测结果特异性和灵敏度更高。
7.本发明的第一个目的是提供一种检测膀胱癌的引物探针组合。
8.本发明的第二个目的是提供所述引物探针组合在制备检测膀胱癌的试剂盒中的应用。
9.本发明的第三个目的是提供一种检测膀胱癌的试剂盒。
10.为了实现上述目的,本发明是通过以下方案予以实现的:一组检测膀胱癌的引物探针组合,包括检测hist1h4f基因和sox1-ot基因的引物和探针,检测hist1h4f基因的引物的核苷酸序列如seq id no:1和seq id no:2所示,检测hist1h4f基因的探针的核苷酸序列如seq id no:7所示;检测sox1-ot基因的引物的核苷酸序列如seq id no:3和seq id no:4所示,检测sox1-ot基因的探针的核苷酸序列如seq id no:8所示;所述hist1h4f基因在ncbi上的gene id为319157,所述sox1-ot基因在ncbi上的gene id为100505996。
11.进一步地,所述引物探针组合中含包括检测b2m内参基因的引物和探针,检测b2m内参基因的引物的核苷酸序列如seq id no:5和seq id no:6所示,检测b2m内参基因的探针的核苷酸序列如seq id no:9所示;所述b2m内参基因在ncbi上的gene id为567。
12.进一步地,所述检测hist1h4f基因的探针的5’端的荧光基团为fam,3’端的荧光淬灭基团为bhq1;所述检测sox1-ot基因的探针的5’端的荧光基团为vic,3’端的荧光淬灭基团为mgb。
13.进一步地,所述检测b2m内参基因的探针的5’端的荧光基团为cy-5,3’端的荧光淬灭基团为bhq2。
14.所述引物探针组合在制备检测膀胱癌的试剂盒中的应用。
15.一种检测膀胱癌的试剂盒,所述试剂盒中含有所述的引物探针组合。
16.进一步地,所述引物和探针的浓度可以为10~100 μm。
17.进一步地,所述引物和探针的浓度为100 μm。
18.进一步地,检测hist1h4f基因的上下游引物的用量可以为0.08~0.15 μl。
19.进一步地,检测hist1h4f基因的上下游引物的用量都为0.11 μl。
20.进一步地,检测hist1h4f基因的探针的用量可以为0.04~0.08 μl。
21.进一步地,检测hist1h4f基因的探针的用量都为0.08 μl。
22.进一步地,检测sox1-ot基因的上下游引物的用量可以为0.08~0.15 μl。
23.进一步地,检测sox1-ot基因的上下游引物的用量都为0.12 μl。
24.进一步地,检测检测sox1-ot基因的探针的用量可以为0.03~0.06 μl。
25.进一步地,检测检测sox1-ot基因的探针的用量都为0.06 μl。
26.进一步地,检测b2m内参基因的上下游引物的用量可以为0.10~0.20 μl。
27.进一步地,检测b2m内参基因的上下游引物的用量都为0.12 μl。
28.进一步地,检测b2m内参基因探针的用量可以为0.05~0.10 μl。
29.进一步地,检测b2m内参基因探针的用量都为0.08 μl。
30.进一步地,所述试剂盒中还含有酶切扩增缓冲液,所述酶切扩增缓冲液含有tris-hcl、kcl、mgcl2、甘油、bsa、海藻糖、dntp和二硫苏糖醇中的一种或几种。
31.优选地,所述酶切扩增缓冲液由tris-hcl、kcl、mgcl2、甘油、bsa、海藻糖、dntp和二硫苏糖醇组成。
32.所述酶切扩增缓冲液可以由25~40 mmol/l tris-hcl、160~250 mmol/l kcl、10~25 mmol/l mgcl2、3~5%(w/v)甘油、4~8 μg/ml bsa、0.3~0.6%(w/v)海藻糖、0.8~1mmol/l dntp和0.30~0.50 mmol/l二硫苏糖醇的水溶液组成。
33.进一步地,所述酶切扩增缓冲液由40 mmol/l tris-hcl、200 mmol/l kcl、25 mmol/l mgcl2、5%(w/v)甘油、8 μg/ml bsa、0.6%(w/v)海藻糖、1 mmol/l dntp和0.45 mmol/l二硫苏糖醇的水溶液组成。
34.另外,所述试剂盒中还含有甲基化敏感限制性内切酶,所述甲基化敏感限制性内切酶含有rrui、hpaii和taii中的一种或几种。
35.优选地,所述甲基化敏感限制性内切酶由rrui、hpaii和taii组成。
36.进一步地,rrui、hpaii和taii的体积相同。
37.同时,所述试剂盒中还含有taq dna聚合酶和无核酸酶水。
38.进一步地,所述taq dna聚合酶的浓度可以为5~10 u/
µ
l。
39.进一步地,所述taq dna聚合酶的浓度为5 u/
µ
l。
40.在具体实施方式中,所述试剂盒中还含有阳性参考品、阴性参考品及空白对照品,所述阳性参考品为人膀胱癌细胞t24细胞dna,所述阴性参考品为经测序验证无目标基因甲基化的人基因组dna,所述空白对照品为无核酸酶水。
41.进一步地,阳性质控品和阴性质控品的浓度可以为5~100 ng/μl。
42.进一步地,阳性质控品和阴性质控品的浓度都为10 ng/μl。
43.进一步地,阳性质控品、阴性质控品和空白对照品的用量可以为1~5 μl。
44.进一步地,阳性质控品、阴性质控品和空白对照品的用量都为2 μl。
45.在使用所用试剂盒时,包括以下步骤:首先配置反应体系并进行pcr反应:1、准备尿沉渣细胞dna样本:提取尿沉渣细胞dna,进行紫外分光定量,满足od
260
/ od
280
的比值为1.4~2.1的作为样本dna模板。
46.可采用以下方法获得尿沉渣细胞dna和紫外分光定量:用尿杯采集至少10 ml待测尿液,将其迅速倒入尿液保存管中,立即颠倒混匀,得尿液样本。尿液保存管中含有广州凯普医药科技有限公司的样本保存液(粤穗械备20220604)。将尿液样本离心,取沉淀获得尿沉渣,将尿沉渣经充分重悬后进行核酸提取。用凯普生物公司生产的全自动核酸提取仪hbnp-4801a和磁珠法dr-4801-kz型核酸提取试剂抽提尿沉渣基因组dna,洗脱体积为60 μl,用微量分光定量仪nano100定量,获得od
260
/ od
280
的比值。
47.2、准备对照品:将人膀胱癌细胞t24细胞dna作为阳性质控品,将经测序验证无目标基因甲基化的人基因组dna作为阴性质控品,无核酸酶水替代dna模板作为空白对照,共计3组对照。
48.3、配置反应体系:
总反应体系为25 μl,其中所述酶切扩增缓冲液12.5 μl、所述检测hist1h4f基因的上下游引物各0.11 μl,所述检测hist1h4f基因的探针0.08 μl,所述检测sox1-ot基因的上下游引物各0.12 μl,所述检测sox1-ot基因的探针0.06 μl,所述检测b2m内参基因的上游引物0.12 μl,下游引物0.1 μl,所述检测b2m内参基因的探针0.08 μl,5 u/
µ
l的taq dna聚合酶0.5 μl,所述甲基化敏感限制性内切酶mix 1.5 μl,dna模板2 μl,无核酸酶水7.6 μl。所述引物和探针的浓度都为100 μm。
49.设置酶切实验组(添加甲基化敏感限制性内切酶mix)及无酶切对照组(用无核酸酶水替换甲基化敏感限制性内切酶mix),对比酶切前后膀胱癌阴性和阳性样本中各基因的扩增曲线变化。
50.此外,分别取阳性质控品和阴性质控品2 μl替换样本dna模板;空白对照反应采用2 μl无核酸酶水替换样本dna模板,作为对照品进行反应。
51.4、pcr反应在宏石slan 96s实时荧光pcr仪(也可选其他品牌的实时荧光pcr仪)上进行,每一循环实时采集fam、vic和cy5荧光信号。
52.pcr扩增反应程序为:酶切反应:37℃ 15 min,65℃ 15 min,1个循环;taq dna聚合酶活化与限制性内切酶失活:95℃ 5 min,1个循环;pcr循环:95℃ 15 s,60℃ 20 s,72℃ 20 s,45个循环。
53.上述反应完毕后,对反应结果进行分析:目标基因结果中fam或vic任一通道ct值≤40,且内参基因结果中cy5通道ct<35,则判读结果为阳性。
54.目标基因结果中fam和vic通道ct值>40或无扩增曲线,且内参基因结果中cy5通道ct<35,则判读结果为阴性。
55.内参基因结果中cy5通道ct>35,则目标基因核酸浓度低或有抑制物存在,需要复检。
56.若判读结果为阴性,患膀胱癌的风险较低,建议定期随访;若判读结果为阳性,患膀胱癌的风险较高,建议镜检或组织活检确认。
57.与现有技术相比,本发明具有以下有益效果:1、本发明通过深入挖掘公共数据库资源,筛选人膀胱癌早期基因组超甲基化区域,并与正常人群基因组对应区域进行比对,以正常人群中低甲基化且含有tcgcga,ccgg,acgt中至少三个酶切位点为可供切割的区域,设计多条荧光探针。确定了扩增效率高、特异性强和稳定性好的引物探针组合,最终得到可用于判别早期膀胱癌风险的hist1h4f和sox1-ot靶标引物及对应探针序列。内参基因b2m由于检测区域中未含有上述酶切序列,故不会发生酶切。
58.2、本发明甲基化敏感限制性内切酶为rrui、hpaii和taii混合而成的酶混合液,分别识别tcg/cga,c/cgg,acgt/序列。其中,斜线表示切割位点。rrui、hpaii的酶切温度为37℃,taii的酶切温度为65℃,分步切割实现对非甲基化核酸中含有的tcgcga,ccgg,acgt序列的酶切,可有效提高酶切效率,减少酶切不完全的发生,从而减少假阳性结果的发生,保证检测结果的准确性。
59.3、与基于亚硫酸氢盐转化的甲基化dna检测方法相比,本发明提供的方法极大地缩短了检测时间短,甲基化敏感型限制性内切酶可以在30min内完成阴性dna模板的切割;
且本发明通过体系优化,提供了一种酶切扩增缓冲液,酶切和荧光pcr可以在同一个pcr管中进行,不需要额外提纯,操作步骤进一步简化;dna损失少,检测灵敏度更高,仅需10 ml尿液参与核酸提取便可满足测试需要。
60.4、酶切扩增缓冲液加入了bsa和甘油。bsa中的赖氨酸含量高,可结合核酸提取过程中残留的酚类化合物,在分步酶切的过程中保护基化敏感型限制性内切酶和taq dna聚合酶活性,从而起到增强酶切和pcr扩增效率的作用。甘油作为一种低温保护剂,可以保护分步酶切过程中甲基化敏感型限制性内切酶活性,提高酶切效率。
附图说明
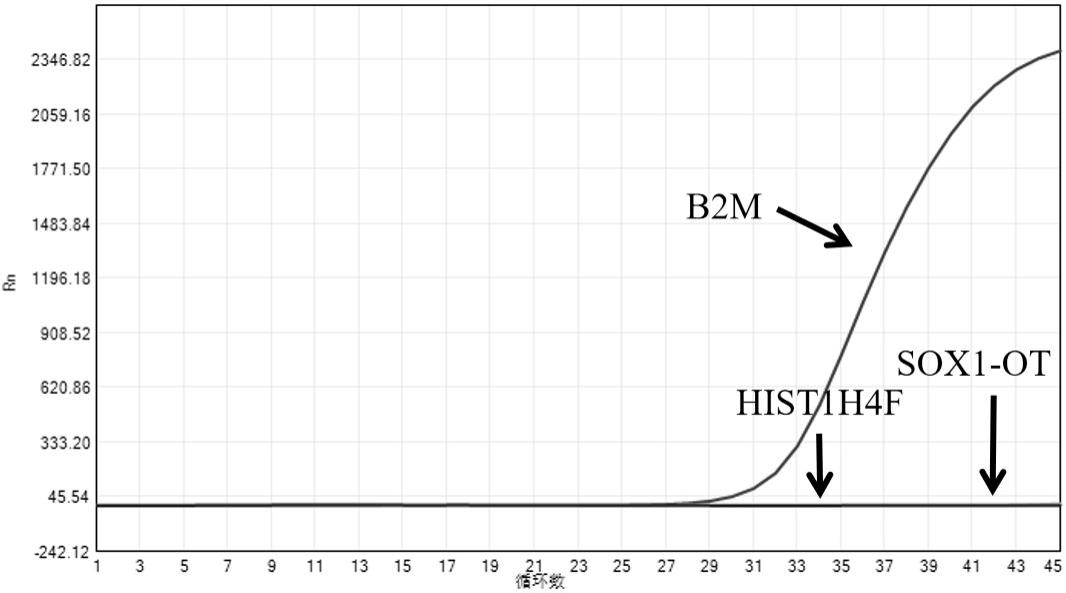
61.图1为膀胱癌阴性样本(不加甲基化敏感限制性内切酶mix)荧光定量pcr图。
62.图2为膀胱癌阴性样本(加甲基化敏感限制性内切酶mix)荧光定量pcr图。
63.图3为膀胱癌阳性样本(不加甲基化敏感限制性内切酶mix)荧光定量pcr图。
64.图4为膀胱癌阳性样本(加甲基化敏感限制性内切酶mix)荧光定量pcr图。
65.图5为膀胱癌阴性样本(无添加甘油及bsa)酶切扩增荧光定量pcr图。
66.图6为膀胱癌阴性样本(添加甘油及bsa)酶切扩增荧光定量pcr图。
具体实施方式
67.下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
68.实施例1 一种筛查早期膀胱癌的快速检测试剂盒本发明通过深入挖掘公共数据库资源,确定人膀胱癌早期基因组超甲基化区域,并与正常人群基因组对应区域进行比对,以正常人群中低甲基化且含有tcgcga,ccgg,acgt中至少三个酶切位点为可供甲基化敏感限制性内切酶切割的区域,设计荧光探针。
69.本发明所用的甲基化敏感限制性内切酶rrui、hpaii和taii(购买于thermo scientific
™
),分别识别tcg/cga,c/cgg,acgt/序列;其中,斜线表示切割位点。rrui、hpaii的酶切温度为37℃,taii的酶切温度为65℃,分步切割实现对非甲基化核酸中含有的tcgcga,ccgg,acgt序列的酶切,有效提高酶切效率,减少酶切不完全的发生,从而减少假阳性结果的发生,保证检测结果的准确性。
70.一、试剂盒的组成1、扩增靶标基因hist1h4f(ncbi上的gene id为319157)的特异性引物:上游引物hist1h4f-f;下游引物hist1h4f-r,用于扩增如seq id no:10所示的核苷酸序列。
71.2、扩增靶标基因sox1-ot(ncbi上的gene id为100505996)的特异性引物:上游引物sox1-ot-f;下游引物sox1-ot-r,用于扩增如seq id no:11所示的核苷酸序列。
72.3、内参基因b2m(ncbi上的gene id为567)的特异性引物:上游引物b2m-f,下游引物b2m-r,用于扩增如seq id no:12所示的核苷酸序列。
73.4、特异性检测靶标基因sox1-ot的荧光探针:sox1-ot-p,其5’端的荧光基团为vic,3’端的荧光淬灭基团为mgb。
74.5、特异性检测靶标基因hist1h4f的荧光探针:hist1h4f-p,其5’端的荧光基团为fam,3’端的荧光淬灭基团为bhq1。
75.6、检测内参基因b2m的探针:b2m-p,其5’端的荧光基团为cy-5,3’端的荧光淬灭基团为bhq2。
76.7、酶切扩增反应试剂:酶切扩增缓冲液、taq dna聚合酶、甲基化敏感限制性内切酶mix和无核酸酶水。其中,酶切扩增缓冲液由40 mmol/l tris-hcl、200 mmol/l kcl、25 mmol/l mgcl2、5%(w/v)甘油、8 μg/ml bsa、0.6%(w/v)海藻糖、1 mmol/l dntp和0.45 mmol/l二硫苏糖醇的水溶液组成。甲基化敏感限制性内切酶mix由rrui、hpaii和taii组成,三种酶体积相同。
77.8、膀胱癌的阳性参考品:人膀胱癌细胞t24细胞dna,浓度为10 ng/μl。
78.9、膀胱癌的阴性参考品:经测序验证无目标基因甲基化的人基因组dna,浓度为10 ng/μl。所述目标基因为hist1h4f和sox1-ot基因。
79.10、空白对照:无核酸酶水。
80.上述各引物和dna的核苷酸序列如表1所示:表1 试剂盒中各引物和dna的核苷酸序列
81.二、使用方法1、准备尿沉渣细胞dna样本:提取尿沉渣细胞dna,进行紫外分光定量,满足od
260
/ od
280
的比值为1.4~2.1的作为样本dna模板。
82.可采用以下方法获得尿沉渣细胞dna和紫外分光定量:用尿杯采集至少10 ml待测尿液,将其迅速倒入尿液保存管中,立即颠倒混匀,得尿液样本。尿液保存管中含有广州凯普医药科技有限公司的样本保存液(粤穗械备20220604)。将尿液样本离心,取沉淀获得尿沉渣,将尿沉渣经充分重悬后进行核酸提取。用凯普生物公司生产的全自动核酸提取仪hbnp-4801a和磁珠法dr-4801-kz型核酸提取试剂抽提尿沉渣基因组dna,洗脱体积为60 μl,用微量分光定量仪nano100定量,获得od
260
/ od
280
的比值。
83.2、准备对照品:将人膀胱癌细胞t24细胞dna作为阳性质控品,将经测序验证无目标基因甲基化的人基因组dna作为阴性质控品,无核酸酶水替代dna模板作为空白对照,共计3组对照。
84.3、配置反应体系:总反应体系为25 μl,反应体系组成如表2所示:表2 反应体系
85.设置酶切实验组(添加甲基化敏感限制性内切酶mix)及无酶切对照组(用无核酸酶水替换甲基化敏感限制性内切酶mix),对比酶切前后膀胱癌阴性和阳性样本中各基因的扩增曲线变化。
86.此外,分别取阳性质控品和阴性质控品2 μl,替换样本dna模板;空白对照反应采用2 μl无核酸酶水替换样本dna模板,作为对照品进行反应。
87.4、pcr反应在宏石slan 96s实时荧光pcr仪(也可选其他品牌的实时荧光pcr仪)上进行,每一循环实时采集fam、vic和cy5荧光信号,pcr扩增反应程序如表3所示:表3 pcr扩增反应程序
88.三、结果分析如表4所示,若判读结果为阴性,患膀胱癌的风险较低,建议定期随访;若判读结果为阳性,患膀胱癌的风险较高,建议镜检或组织活检确认。
89.表4 结果分析
90.如图1和图3所示,膀胱癌阴性样本和阳性样本未经过甲基化敏感限制性内切酶mix处理时,内参基因b2m、检测靶标hist1h4f和sox1-ot均能正常扩增。
91.如图2所示,膀胱癌阴性样本经过甲基化敏感限制性内切酶mix处理后,内参基因b2m仍正常扩增,且ct值与图1中b2m的ct值接近,说明b2m没有发生酶切。而检测靶标hist1h4f和sox1-ot无扩增,说明阴性样本中检测靶标hist1h4f和sox1-ot的检测序列已经被甲基化敏感限制性内切酶mix切割完全。
92.如图4所示,膀胱癌阳性样本经过甲基化敏感限制性内切酶mix处理后,内参基因b2m仍正常扩增,且ct值与图1中b2m的ct值接近,说明b2m没有发生酶切。而检测靶标hist1h4f和sox1-ot扩增曲线后延,说明阳性样本中检测靶标hist1h4f和sox1-ot的未甲基化序列发生切割,甲基化的序列被保留下来。
93.实施例2 临床样本检测一、实验方法使用实施例1的试剂盒和检测方法,检测72位经过膀胱镜或组织病理学确认的膀胱癌患者和非膀胱癌患者的尿液。
94.二、实验结果如表5~表8所示(其中noct表示无扩增),34例膀胱癌患者和38例非膀胱癌患者(包括其他癌症,膀胱炎等良性疾病,膀胱癌术后无复发者)的待测尿液中,hist1h4f指标在34例膀胱癌患者中,检测阳性为30例,灵敏度为88.2%;sox1-ot指标在34例膀胱癌患者中,检测阳性为31例,灵敏度为91.2%;而同时评估hist1h4f指标和sox1-ot指标,膀胱癌患者全部检出,灵敏度达到100%。在38例非膀胱癌患者样本中,有2例检测为阳性(1例为输尿管癌,1例为膀胱癌术后未复发),特异性为94.7%,对于17例正常体检样本,检测皆为阴性,特异性为100%。
95.表5 待测尿液检测结果(正常体检样本)
96.表6 待测尿液检测结果(肾结石、膀胱炎、前列腺增生、输尿管结石、尿路感染、肾积水伴输尿管扩张、输尿管癌、膀胱癌术后未复发、膀胱癌复发)
97.表7 待测尿液检测结果(低级别乳头状尿路上皮癌)
98.表8 待测尿液检测结果(浸润性高级别乳头状尿路上皮癌)
99.实施例3 单一甲基化敏感限制性内切酶与mix组合测试一、实验方法将实施例1试剂盒中的甲基化敏感限制性内切酶mix分别替换为单一的rrui、单一的hpaii、单一的taii、rrui和hpaii等体积混合、hpaii和taii等体积混合、rrui和taii等体积混合、无核酸酶水(对照)。以实施例1的阴性质控品为dna模板,按照实施例1的方法进行pcr反应。
100.二、实验结果如表9所示,经过不同的甲基化敏感限制性内切酶切割之后,内参基因b2m由于不含相应的酶切靶标,不会被切割,故其ct值基本保持不变。而单一甲基化敏感限制性内切酶(rrui、hpaii或taii)由于酶切位点不足(都少于三个)无法实现完全酶切,测试阴性样本出现假阳性。当rrui、hpaii和taii等体积混合后(即实施例1试剂盒中的甲基化敏感限制性内切酶mix),阴性样本的非特异扩增完全消失。
101.表9 不同甲基化敏感限制性内切酶的酶切效率(阴性质控品)
102.实施例4 不同酶切扩增缓冲液对检测效果的影响一、实验方法制备两组酶切扩增缓冲液,第一组为实施例1的酶切扩增缓冲液,第二组为不含甘油和bsa的酶切扩增缓冲液,其他组分与实施例1的酶切扩增缓冲液相同。dna模板为实施例1的阴性样本,浓度为10 ng/μl,按照实施例1的方法进行pcr反应。
103.二、实验结果如图5和图6可知,第一组酶切扩增缓冲液比第二组显著提高了pcr反应体系的酶切效率,减少假阳性。
104.实施例5 不同引物和探针对检测效果的影响一、实验方法确定人膀胱癌早期基因组超甲基化区域,并与正常人群基因组对应区域进行比对,在正常人群中对应区域中选择不同酶切靶点,设计引物和探针序列。
105.如表10和表11所示,根据不同酶切靶点,设计引物和探针序列,替换实施例1中的引物和探针序列,按照实施例1的方法进行pcr反应。对比实验组1~4用于检测hist1h4f基因,对比实验组5~8用于检测sox1-ot基因。检测靶标基因hist1h4f的荧光探针:hist1h4f-p2~p5,其5’端的荧光基团为fam,3’端的荧光淬灭基团为bhq1。检测靶标基因sox1-ot的荧光探针:sox1-ot-p2~p5,其5’端的荧光基团为vic,3’端的荧光淬灭基团为mgb。检测内参基因b2m的探针:sox1-ot-p2~p5,其5’端的荧光基团为cy-5,3’端的荧光淬灭基团为bhq2。
106.dna模板为实施例1的阴性质控品。
107.表10和表11中酶切序列以甲基化敏感限制性内切酶rrui、hpaii和taii表示,根据实施例1,rrui、hpaii和taii分别识别tcg/cga,c/cgg,acgt/序列;其中,斜线表示切割位点。酶切位点个数为对应引物探针的扩增序列中的酶切位点个数。
108.表10 设计不同引物和探针的对比实验组(对比实验组1~4)
109.表11 设计不同引物和探针的对比实验组(对比实验组5~8)
110.二、实验结果对比实验组1中hist1h4f的ct值为33.58,对比实验组2中hist1h4f的ct值为37.17,对比实验组3中hist1h4f的ct值为38.44,对比实验组4中hist1h4f的ct值为41.12,对比实验组5中sox1的ct值为35.74,对比实验组6中sox1的ct值为39.91,对比实验组7中sox1的ct值为38.65,对比实验组8中sox1的ct值为38.54。
111.使用表10和表11中的荧光探针组合,仍然无法保证完全酶切,扩增曲线有一定假阳性。
112.最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。