1.本发明涉及植物病毒病害检测诊断技术领域,更具体的说是涉及一种检测黄瓜绿斑驳花叶病毒和小西葫芦黄花叶病毒的引物组、试剂盒。
背景技术:
2.黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,cgmmv)属于烟草花叶病毒属(tobamovirus),为正义单链rna病毒,病毒粒子杆状,长约300nm,直径约18nm,基因组长度约6.4kb,共编码4个开放阅读框(open reading frame,orf)。靠近5
′
端的orf1和orf2分别编码与cgmmv复制相关的129kda和186kda复制酶;靠近3
′
端的orf3和orf4分别编码30kda的移动蛋白和17.5kda的外壳蛋白。cgmmv主要侵染葫芦科作物,感染cgmmv会使植株矮小生长发育缓慢,叶片出现斑驳花叶、褪绿等症状,结果延迟或不结果,果肉水渍状病变或空心,严重危害了葫芦科作物的生产。
3.小西葫芦黄花叶病毒(zucchini yellowmosaic virus,zymv)也是一种侵染葫芦科植物的常见病毒。它属于马铃薯y病毒科(potyviridae)马铃薯y病毒属(potyvirus),整个病毒粒子大小约为750nm
×
11nm,无包膜,由4.5%~7%的核苷酸和93%~95%的蛋白质组成,基因组大小为10kb,是单个orf,编码10个功能蛋白。zymv能够侵染包括葫芦科、苋科、藜科、豆科在内的11个属的植物。
4.多年田间调查发现,cgmmv经常出现在设施栽培作物中,zymv更多出现在露地栽培的作物中。但是由于两种病毒均能进行种子传播和机械传播,而葫芦科作物生产中嫁接、摘心、点花、打岔等农事操作频繁,cgmmv与zymv经常出现复合感染的情况。两种病害的症状也十分相似,均会引起斑驳花叶症状,仅仅通过观察无法区分。
5.植物病毒常用的检测方法有:生物学检测法、电子显微镜观察法、血清学检测法及分子生物学检测的方法等。上述方法各有利弊,常规pcr仍是目前使用最广泛的检测技术之一。但它需要大型且昂贵的热循环仪,这极大地限制了pcr在资源受限的环境中的分析应用。
6.在葫芦科作物生产中,培育健康无毒种苗是最为重要的病毒病防控措施,其技术保障便是建立高效的早期预警检测技术。由于不能完全满足培育健康种苗所需的检测时间更早(此时感染苗病毒滴度低要求灵敏度更高)、检测群体更大(检测结果更准确)的生产要求,因此需要在现有基础上开发兼具成本低、速度快、灵敏度高的检测技术。
7.随着技术的发展,近些年来也出现了根据不同的反应原理设计出不同的核酸等温扩增技术。其中重组酶聚合酶扩增(recombinase polymerase amplification,rpa),就是一种新型的核酸等温扩增技术。
8.但是,rpa也存在技术障碍,其主要缺点:由于引物(30~35nt)与探针(46~54nt)较长,不适合较短靶序列的检测;其检测特异性依赖于较好的引物和探针性质;针对不同病毒不同引物的rpa反应条件体系等较为苛刻;仅能进行dna扩增且结果依然需要电泳来显示
和判读等。其中,rpa方法发展中存在的一个关键性的挑战就是引物和探针的设计。
9.目前已有的rpa检测技术,均不能很好的适用于葫芦科作物感染cgmmv和zymv的检测。
10.因此,能否提供一种检测黄瓜绿斑驳花叶病毒和小西葫芦黄花叶病毒的引物组、试剂盒是本领域技术人员亟需解决的问题。
技术实现要素:
11.有鉴于此,本发明提供了一种检测黄瓜绿斑驳花叶病毒和小西葫芦黄花叶病毒的引物组、试剂盒。
12.本发明基于rpa技术,反应原理是:重组酶与引物结合形成的蛋白-dna复合物,能在双链dna中寻找同源序列。一旦引物定位了同源序列,就会发生链交换反应形成并启动dna合成,对模板上的目标区域进行指数式扩增。被替换的dna链与ssb结合,防止进一步替换。在这个体系中,由两个相对的引物起始一个合成事件。反应过程为1.在重组酶作用下,引物与靶序列结合;2.引物与靶序列结合后置换下的单链被单链结合蛋白结合;3.在聚合酶作用下进行延伸,同时置换下的单链被单链结合蛋白结合;4.同源双链分离,持续延伸;5.形成新的双链,并进行下一个循环。
13.为了实现上述目的,本发明采用如下技术方案:
14.一种检测黄瓜绿斑驳花叶病毒和小西葫芦黄花叶病毒的引物组,包括:c8f和c8r、z10f和z10r’,探针c8p、z10p’;核苷酸序列如下:
15.c8f:5
’‑
tccctgtctgcgttaccct-3’,如seq id no.1所示;
16.c8r:5
’‑
[biotin]agaagcgaaacgaagataggc-3’如seq id no.2所示;
[0017]
探针c8p:5
’‑
[fam]ctagattcccagatgcgggtttttacgcttt[thf]cctcaacggtcctgt[c3-spacer]-3’如seq id no.3所示;
[0018]
z10f:5
’‑
ttcaaatacaataaacccgtca-3’,如seq id no.4所示;
[0019]
z10r’:5
’‑
[tamra]aaatcatctagcccttcaaaat-3’,如seq id no.5所示;
[0020]
探针z10p’:5
’‑
[digoxin]cggttcattacagatcccgaggaaatcta ca[thf]actctttgaatatga[c3-spacer]-3’如seq id no.6所示。
[0021]
本发明还提供了基于上述引物组的试剂盒。
[0022]
优选的:还包括阳性标准品。
[0023]
优选的:阳性标准品的制备方法:
[0024]
利用引物扩增cgmmv全长,纯化回收扩增片段,与pce-zero vector进行同源重组,转化,提取质粒为pce-cgmmv;
[0025]
利用引物分2段扩增zymv全长,将两个片段纯化后同时与pce-zero vector进行同源重组,转化,提取质粒为pce-zymv。
[0026]
优选的:还包括反应试剂、双标试纸条。
[0027]
本发明还提供了上述引物组,或上述任一所述试剂盒在农业生产中的应用。
[0028]
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种检测黄瓜绿斑驳花叶病毒和小西葫芦黄花叶病毒的引物组、试剂盒,取得的技术效果:
[0029]
实现同时检测样本中是否感染cgmmv和zymv两种病毒。
[0030]
与其他等温扩增技术相比较,本发明具有操作更加简单方便、反应更加快速、准确、能更好的与检测平台结合等优点。同体系检测cgmmv rna模板的灵敏度为0.5ng,检测zymv的灵敏度为0.05ng。
[0031]
与现有常用的的elisa检测技术相比,本发明具有更高的特异性和灵敏性,可以在瓜苗感染早期,甚至在尚未显现症状的阶段,病毒繁殖量较低的状态下,即能开展检测,并且结果灵敏、准确。与传统rt-pcr检测相比,本发明操作步骤简单,不需要单独进行反转录步骤,与普通pcr相比,实验时间只有短短十几分钟,且不需要使用pcr仪这样的精密昂贵仪器。
[0032]
除了用于实验室常规检测cgmmv和zymv感染外,特别适用于无实验室条件下(如植保站、田间等)的现场检测,这给生产中该病毒的监控提供了十分便捷的检测途径。具有良好的应用前景,能够同时检测两种病毒,现有技术一般都是以某种特定条件检测某一种特定的病毒,而本发明在同一条件体系下可以同时检测出是否感染cgmmv和/或zymv病毒。
附图说明
[0033]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
[0034]
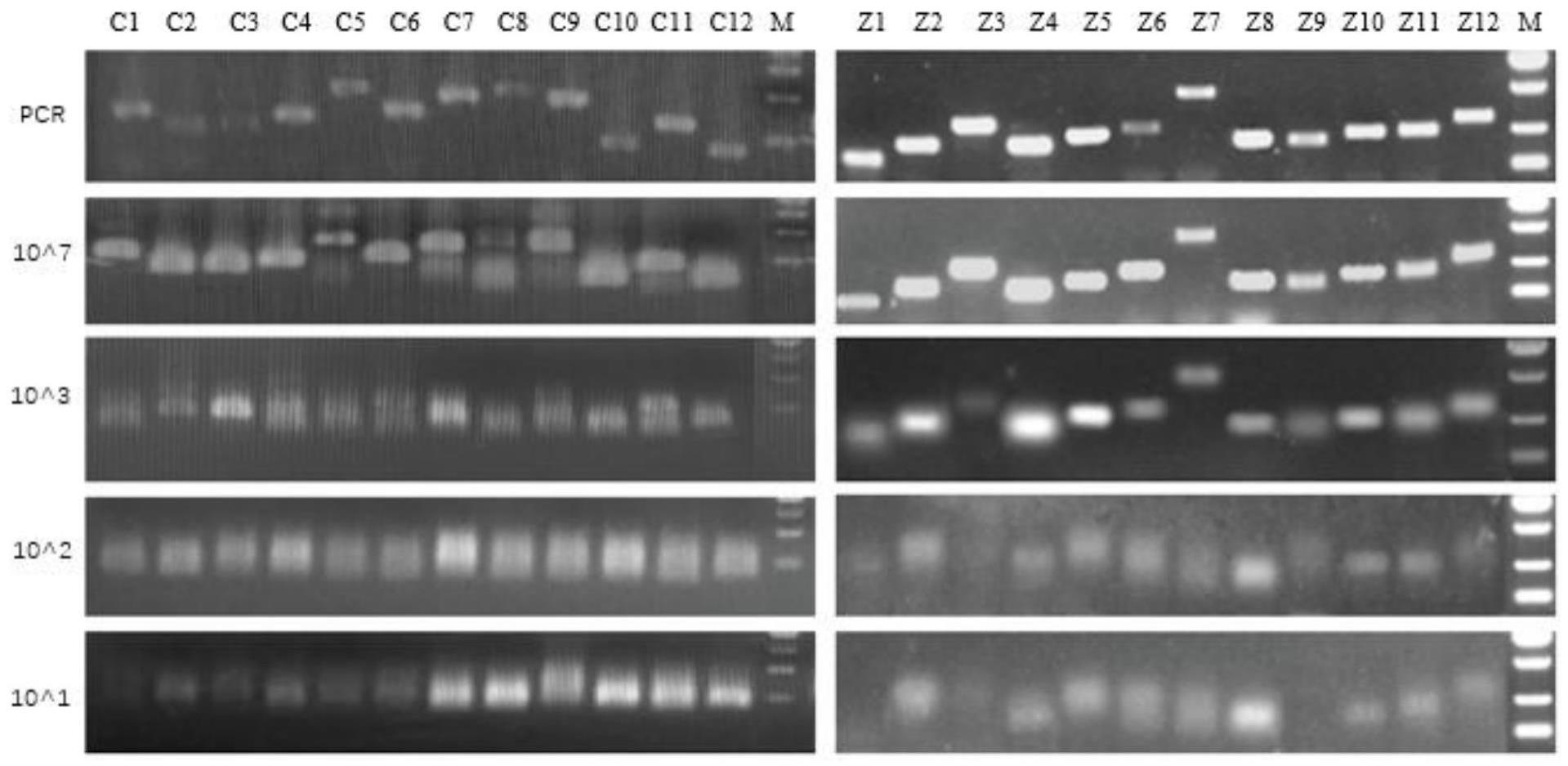
图1附图为本发明提供的各引物对不同浓度模板的扩增结果图,其中,c1~c12和z1~z12为设计的各引物扩增结果;m为marker,从上至下分别表示750bp、500bp、250bp、100bp。
[0035]
图2附图为本发明提供的单标试纸条检测结果显示与判定图,其中,如图结果分别判读为 :阳性;
±
:弱阳性;-:阴性。
[0036]
图3附图为本发明提供的双标试纸条检测结果显示与判定图,其中,由左至右依次为两种病毒阴性、两种病毒阳性、zymv阳性和cgmmv阳性。
[0037]
图4附图为本发明提供的引物及方法的特异性和准确性检测结果图,其中,泳道1~11分别为江苏省内田间采集的11份带有疑似病毒病症状的植株样本rt-pcr检测结果,下方试纸条对应的是实施例的检测结果;试验所使用样本1~3为2020年南京采集的黄瓜病叶,4~5为2019年苏州采集的南瓜病叶,6~7为2022年南京采集的甜瓜病叶,8~11为2022年南通采集的西瓜病叶。
[0038]
图5附图为本发明提供的与rt-pcr方法同时检测瓠瓜种子检测比较图,其中,a:本发明检测瓠瓜种子携带cgmmv的检测结果b:rt-pcr检测瓠瓜种子携带cgmmv的检测结果;s1~s8为样品编号;p为阳性对照;n为阴性对照;m为marker,从上至下分别表示1000bp、750bp、500bp、250bp、100bp,阳性样本目的条带大小为443bp。
具体实施方式
[0039]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他
实施例,都属于本发明保护的范围。
[0040]
本发明实施例公开了一种检测黄瓜绿斑驳花叶病毒和小西葫芦黄花叶病毒的引物组、试剂盒。
[0041]
实施例的试验流程及原理:
[0042]
操作流程为:1.对样本提取rna。2.分别取1μl rna、0.5μl引物四条、0.3μl探针两条加入rpa反应液中。反应液使用潍坊安普未来生物科技有限公司生产的rna恒温快速扩增试剂盒(胶体金试纸条型)中的冻干酶粉、14.7μl buffera和11.5μl ddh2o进行混合配制。最后加入0.8μl bufferb混合均匀并将反应液甩至管底。将其置于40℃条件下反应10分钟。3.结束后取10μl反应液加190μl ddho混匀,插入标记有地高辛和罗丹明抗体的双标试纸条(双标核酸检测试纸条,货号jy0209),观察质控线与检测线判读结果。
[0043]
结果判读方法:当质控线显色后,若检测线也显色,则为阳性结果,代表样品中含有相应的病毒;若检测线不显色,则为阴性,代表样品中未检出该病毒(不含该病毒或含量低于最低检出量)。若质控线不显色则提示试纸条或试剂失效。
[0044]
实施例1
[0045]
含有cgmmv和zymv全长的质粒的构建
[0046]
该质粒包含病毒全部基因序列信息,其构建目的为用于后续引物筛选、体系优化等实验,在检测应用过程中,该质粒用于阳性对照。使用多糖多酚植物rna提取试剂盒(上海浦迪生物科技有限公司)根据说明书步骤提取病毒感染的植物样品rna,取2μl提取后的rna使用hiscript ii q rt supermix(南京诺唯赞生物科技有限公司,货号r223)试剂盒根据说明书步骤反转录成cdna。根据ncbi登录的cgmmv全基因组序列(mn654020.1)和zymv全基因组序列(nc_003224.1)设计引物(表1)。
[0047]
利用引物cg-f和cg-r扩增cgmmv全长。
[0048]
扩增体系:2
×
phantapcr mix(南京诺唯赞生物科技有限公司)25μl,前后引物各1μl,模板cdna 2μl,ddh2o补足至50μl。
[0049]
反应程序为:94℃预变性2min,94℃变性20s,退火温度见表1,时间20s,72℃延伸6min 30s,30个循环后72℃再延伸10min。
[0050]
产物用1%的琼脂糖凝胶电泳进行分析。在紫外灯下切取凝胶上的目的条带,使用axygen胶回收试剂盒(爱思进生物技术有限公司)根据说明书步骤进行纯化回收。片段纯化后与pce-zero vector进行同源重组(南京诺唯赞生物科技有限公司,货号c115),重组产物转化大肠杆菌感受态细胞dh5α(南京诺唯赞生物科技有限公司,货号c502),经pcr(引物、体系和反应程序同上)和测序筛选出阳性克隆后,提取质粒命名为pce-cgmmv,存于-20℃备用。
[0051]
利用引物对zy-af、zy-ar和引物对zy-bf、zy-br分2段扩增zymv全长序列(体系与反应程序同上,退火温度见表1,延伸时间5min),将两个片段纯化后同时与pce-zero vector进行同源重组,两片段会根据同源重组臂重组连接出zymv全长序列,将产物转化大肠杆菌感受态细胞筛选出阳性克隆并提取质粒命名为pce-zymv。
[0052]
表1cgmmv和zymv扩增引物
[0053][0054]
注:小写字母为构建载体时的同源重组臂序列
[0055]
检测引物的筛选
[0056]
分别针对两种病毒序列全长利用软件primer5.0设计检测引物,各引物及其序列位置信息见表2和表3。将两种质粒分别按梯度稀释成104至101个拷贝作为模板。使用rna恒温快速扩增试剂盒(基础型)(潍坊安普未来生物科技有限公司,货号wlrb8207kit)进行扩增。在一管冻干酶粉中加入10μl buffera、2μl提取的rna、上下游引物各1μl和4μl ddh2o进行混合配制。最后加入2μl bufferb混合均匀并将反应液甩至管底。将其置于42℃条件下反应30分钟。反应结束后,加入20μl酚/氯仿,1:1抽提反应液,12000rpm离心5min,取5μl上清进行电泳检测。
[0057]
表2用于检测cgmmv的候选引物
[0058]
[0059][0060]
表3用于检测zymv的候选引物
[0061][0062]
分别利用含有病毒全长基因组序列的质粒pce-cgmmv和pce-zymv作为模板,将两种质粒分别按梯度稀释成104至101个拷贝。使用rpa基础试剂盒进行扩增。同时使用pcr扩增作为阳性对照。以水为模板作为阴性对照。
[0063]
根据图1电泳结果,初步筛选出扩增效率较高的引物为c3、c7、c8、c9、c10、c11、c12,z2、z4、z5、z6、z8、z10、z11进入下一步筛选环节。
[0064]
使用单标试纸条进一步筛选引物以及相应检测体系优化
[0065]
由于通过电泳检测扩增产物的步骤较为繁琐,且灵敏度有限,初筛后的各引物使用rna恒温快速扩增试剂盒(胶体金型)(潍坊安普未来生物科技有限公司,货号wlrn8209kit)结合单标试纸条(南京沃博生物科技有限公司,单标核酸检测试纸
条,货号jy0201)进行进一步筛选。
[0066]
将上述初筛后的引物下游序列5’端标记biotin,并在两引物之间的序列中设计探针。探针长约46nt,其5’端标记fam,距离5’端30nt左右的位置标记一个四氢呋喃thf,thf距离3’端约15nt并且3’末端标记c3-spacer。探针序列设计见表4。利用胶体金型rna恒温快速扩增试剂盒进行扩增,扩增产物稀释后用单标试纸条检测扩增结果。
[0067]
表4所用探针序列及其修饰
[0068][0069]
使用试剂盒推荐体系,条件设置为38℃反应10min。反应结束后取10μl产物加190μl ddh2o稀释,插入试纸条的结合垫端,待质控线c显色后,10min内根据t线的显色情况判定检测结果(图2)。各引物使用推荐体系的检测结果见表5。
[0070]
表5cgmmv和zymv各引物检测结果
[0071][0072]
代表阳性,-代表阴性,
±
代表弱阳性
[0073]
根据表5检测结果发现,许多引物在该体系和条件下扩增结果存在假阳性现象,无法判定该引物的灵敏性,也无法用于样品检测。因此需要对检测体系进行优化。
[0074]
去除灵敏度低于102的引物c10、c11和z11,其它引物进入体系优化及进一步筛选。
[0075]
使用胶体金型试剂盒结合单标试纸条优化检测体系并测定引物灵敏度。体系变量设置见表6。
[0076]
表6检测体系优化中的变量设置
[0077][0078]
表7体系b与c检测结果及比较
[0079][0080][0081]
表7结果表明,引物量的减少可能会略微降低灵敏度,但对结果影响不明显。由于添加量过少会影响加样量的精准度,为方便操作引物添加量仍然选则0.5μl。
[0082]
表8体系d、e和f的检测结果与比较
[0083][0084]
表8结果表明,bufferb减少反应灵敏度降低,同时也会使得假阳性减少。综合引物添加量和bufferb的影响,体系e结合引物c8和z10检测结果无假阳性,且灵敏度可达101个拷贝。被选为后续实验推荐体系和引物。
[0085]
实施例2
[0086]
以rna为模板验证检测引物和体系并进行优化
[0087]
提取感染cgmmv的样品rna,测定浓度为500ng/μl。对其进行逐级稀释,使其最终添加量为50ng、5g、0.5ng、0.05ng、0.01ng、0.005ng。使用c8引物组,按照体系e配制反应体系,置于不同反应条件进行反应,结果见下表9,在合适条件下能检出的最低rna量为0.05ng。
[0088]
表9不同检测条件下cgmmv的检测结果
[0089][0090]
提取感染zymv的样品rna,测定浓度为1000ng/μl。对其进行逐级稀释,使其最终添加量为10ng、1ng、0.1ng、0.01ng、0.001ng。使用z10引物组,按照体系e配制反应体系,置于不同反应条件进行反应,结果见下表,在合适条件下能检出的最低rna量为0.005ng。
[0091]
表10不同检测条件下zymv的检测结果
[0092][0093]
从上表中还可以看出提高反应温度和增加反应时长均能提高反应灵敏度,从操作简便、耗时更短的角度,选择40℃反应10min为最优反应条件。
[0094]
效果验证:
[0095]
更换zymv的引物和探针标记并重复验证检测体系
[0096]
为了实现两种病毒的同时检测,需将两种病毒的检测引物使用不同的基团标记以区分不同的病毒。因此重新合成z10的反向引物及其对应的探针分别命名为z10r’和z10p’,反向引物的5’端标记改为罗丹明,探针的5’端标记改为地高辛,其它标记相同,即:z10r’为5
’‑
[tamar]aaatcatctagcccttcaaaat-3’;z10p’为[digoxin]cggttcattacagatcccgaggaaatctaca[thf]actctttg aatatga[c3-spacer]。
[0097]
双标检测试纸条判读方法见图3。以质粒为模板使用体系e进行扩增,检测结果与原标记结果无明显差异。按照表10中的描述,以0.01ng和0.005ng rna为模板使用体系e在40℃反应10min,结果也与原标记引物无明显差异,表明更换引物标记后检测灵敏度没有明显变化。
[0098]
为进一步验证技术效果,以z8上下游引物和对应探针进行验证(z8灵敏度仅次于z10),同样更换了标记,灵敏度未变,说明更换标记不会改变灵敏度。
[0099]
实施例3
[0100]
两种病毒同体系检测
[0101]
在同一反应管中配制反应体系,分别加入引物对c8和z10、两种病毒rna模板、对应的探针,最后加入0.8μl bufferb,置于40度反应10min,对不同浓度模板检测结果见表11。
[0102]
表11不同浓度模板检测结果
[0103][0104]
两种及以上病毒同体系检测时,由于同一体系加入过多组分,可能会因为组分之间相互影响,从而使反应效率下降,造成检测灵敏度降低。将反应条件改为40度反应15分钟后,检测灵敏度无明显提高。
[0105]
综上,同体系检测cgmmv rna模板的灵敏度为0.5ng,检测zymv的灵敏度为0.05ng。
[0106]
检测引物及方法的特异性和准确性
[0107]
见图4,对田间采集的11份带有疑似病毒病症状的植株样本提取rna,使用筛选优化后的引物和体系进行检测,同时使用rt-pcr方法进行复检验证。
[0108]
检测结果显示,无论是单独感染还是复合感染tmv、wmv、ccyv、cabyv、prsv、cmv、sqmv、kgmmv这8种葫芦科作物病毒的植株样本均未检出阳性。其中zymv与wmv具有较高的亲缘关系,而kgmmv与cgmmv具有较高的亲缘关系。而感染这两种病毒的样本检测结果也为阴性。检测结果还显示无论是单独感染还是复合感染cgmmv和zymv的样本,均能检测出阳性条带,且检测结果与rt-pcr完全一致。以上结果表明该检测方法具有很高的特异性且准确性与rt-pcr一致。
[0109]
实施例4
[0110]
一种检测黄瓜绿斑驳花叶病毒和小西葫芦黄花叶病毒的试剂盒,包括引物c8f和c8r、z10f和z10r’、探针c8p、z10p’;
[0111]
c8f:5
’‑
tccctgtctgcgttaccct-3’,如seq id no.1;
[0112]
c8r:5
’‑
[biotin]agaagcgaaacgaagataggc-3’如seq id no.2;
[0113]
探针c8p:5
’‑
[fam]ctagattcccagatgcgggtttttacgcttt[thf]cctcaacggtcctgt[c3-spacer]-3’如seq id no.3;
[0114]
z10f:5
’‑
ttcaaatacaataaacccgtca-3’,如seq id no.4;
[0115]
z10r’:5
’‑
[tamra]aaatcatctagcccttcaaaat-3’,如seq id no.5;
[0116]
探针z10p’:5
’‑
[digoxin]cggttcattacagatcccgaggaaatcta ca[thf]actctttgaatatga[c3-spacer]-3’如seq id no.6。
[0117]
还包括:反应试剂(潍坊安普未来生物科技有限公司生产的rna恒温快速扩增试剂盒(胶体金试纸条型)中的冻干酶粉、14.7μl buffera和11.5μlddh2o进行混合配制,最后加入0.8μl buffer b混合均匀并将反应液甩至管底);
[0118]
双标试纸条(商品,单标核酸检测试纸条,购自南京沃博生物科技有限公司);
[0119]
阳性标准品(质粒pce-cgmmv和pce-zymv)。
[0120]
实施例5
[0121]
参见图5,调查检测发现江苏高邮大棚瓠瓜大面积感染cgmmv,由于该病毒经常通过种子传播,为明确本检测方法是否可以用于检测种子带毒情况,将该地区收获的种子随机取样8份(s1~s8),每份10颗种子破壳浸泡于无菌水中过夜,对浸泡液提取rna,同时使用该方法和rt-pcr方法进行检测,结果8份样品中有5份检出cgmmv阳性,与rt-pcr结果完全一致。这不仅表明该方法具有较高的准确性,同时也表明该方法可以应用于种子带毒检测。
[0122]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0123]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。