利用孤儿基序和cpg密度的组合来控制异源转基因的表达
技术领域
1.本发明涉及核酸序列,该核酸序列导致与其可操作地连接的异源转基因的受控表达。
背景技术:
2.将遗传物质(例如,异源核酸)递送至靶细胞以增加所希望的基因产物表达的基因疗法方法支持治疗目的。病毒已经进化到能够高效地将核酸递送到特定的细胞类型,同时避免受感染宿主的免疫监视(robbins等人,(1998)pharmacol.ther.[药物学与治疗学],80(1):35-47)。这些特性使病毒作为用于基因疗法的递送媒介物或载体具有吸引力。几种类型的病毒(包括逆转录病毒、腺病毒、腺相关病毒(aav)和单纯疱疹病毒)已在实验室中进行了修饰以用于基因疗法应用(lunstrom等人,(2018)diseases[疾病],6(2):42)。特别地,衍生自腺相关病毒(aav)的载体可以有效地递送遗传物质,因为(i)它们能够感染(转导)包括肌纤维和神经元在内的多种非分裂和分裂细胞类型;(ii)它们缺乏病毒结构基因,从而消除了天然宿主细胞对病毒感染的应答,例如干扰素介导的应答;(iii)野生型病毒从未与人类的任何病理相关;(iv)与能够整合到宿主细胞基因组中的野生型aav相比,复制缺陷型aav载体通常作为附加体持续存在,从而限制了插入诱变或癌基因激活的风险;并且(v)与其他载体系统相比,aav载体不触发显著的免疫应答,从而允许例如一种或多种治疗性异源核酸的长期表达(wold等人,(2013)curr.gene ther.[当前基因疗法],13(6):421-33;lee等人,(2017)genes dis.[基因与疾病],4(2):43
–
63)。
[0003]
aav为细小病毒科(parvoviridae)家族的成员。aav基因组包含线性单链dna分子,该线性单链dna分子典型地含有约4.7千碱基(kb)和编码非结构性rep(复制)及结构性cap(衣壳)蛋白的两个主要开放阅读框。两个顺式作用反向末端重复(itr)序列与aav编码区侧接,这些反向末端重复序列的长度典型地为约145个核苷酸,并具有间杂的回文序列,这些回文序列可折叠成发夹结构,其在dna复制的起始期间充当引物。除他们在dna复制中的作用以外,已证实itr序列有助于病毒整合、自宿主基因组的拯救及病毒核酸衣壳化成为成熟病毒粒子(muzyczka等人,(1992)curr.top.micro.immunol.[微生物学和免疫学当前主题],158:97-129)。
[0004]
虽然aav因其转导多种细胞类型并将异源核酸递送至多种靶组织类型的能力而令人满意,但是将异源核酸递送至不需要异源核酸表达的组织以及在需要的地方高表达转基因仍然是一个挑战。仔细校准所需组织中的基因表达可以提供治疗益处。含有cag启动子的aav载体已用于许多基因疗法的临床试验,例如用于cns疾病(hoequemiller等人,(2016)hum.gene ther.[人类基因疗法],27(7):478-96)。
[0005]
仍然需要开发在特定组织中获得异源核酸高表达的方法。因此,需要改善治疗性蛋白(例如抗体或功能性结合片段、酶等)和核酸(例如用于crispr的shrna、sirna、grna等)的组织特异性表达。
[0006]
更广泛地使用病毒载体进行基因递送的另一个障碍是载体的包装能力。例如,aav
载体基因组典型地限于单链(ssaav)的约4.7kb和自互补(scaav)载体的2.4kb,这限制了可以递送的遗传有效载荷的大小(wu等人,(2010)mol.ther.[分子疗法],18(1):80-86)。由于遗传有效载载包括调节元件(例如启动子、终止信号等),这进一步限制了可被包装的异源核酸的大小。因此,需要提供长度缩短的调节元件,以允许插入编码更大蛋白质的异源核酸序列,例如,插入用于基因疗法的aav衍生载体中。
技术实现要素:
[0007]
本发明人先前已经发现哺乳动物中迄今的孤儿调节基序当被蛋白质banp结合时充当强转录激活剂,也是cpg岛启动子的激活剂。当超过一个拷贝的基序存在于异源转基因前面时,这种强激活效协同增强。
[0008]
经过进一步研究,本发明人发现孤儿调节基序附近cpg位点的数量影响该基序的活性。可利用这种效应调节与所述基序可操作地连接的基因的表达。例如,一个表达载体可以包含多于一个异源转基因,每个都受其各自的banp基序的控制,但这些基序中的每个周围都有不同的cpg密度。这将导致每个转基因的不同的、受控的表达,尽管它们在相同的载体上并且由相同的转录因子结合的相同基序控制。
[0009]
本发明的另一个优点是,富含cpg的基序通常受细胞高度控制,并且如果构建体意外掺入宿主细胞的基因组,将导致转基因表达的关闭。
[0010]
因此,本发明提供了分离的核酸分子,其包含超过220bp,选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列,和在所述选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前的n个碱基对(bp)和/或之后的n个bp中的大于0.6的cpg观察值与估计值比率(o/e比率),其中该cpg o/e比率通过以下确定:对选自seq id no:1、seq id no:2和seq id no:3的组的至少一个或多个拷贝的序列周围的n个bp长序列中的cpg二核苷酸的数量进行计数,并通过将cpg二核苷酸的计数数量乘以n并将结果除以该n个bp中存在的c数量和g数量的乘积来计算该o/e比率(n*cpg/(c*g)),其中n在50和1000之间并且是紧接在所述选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前或紧跟其后的序列的长度,以bp计。为了清楚起见,声明技术人员熟知c代表胞嘧啶核苷酸,g代表鸟苷核苷酸并且cpg(或cg)代表5'—c—磷酸—g—3',即胞嘧啶和鸟嘌呤仅被一个磷酸基团隔开(磷酸将dna中的任意两个核苷连接在一起)。
[0011]
在一些实施例中,cpg存在于紧接选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前的50-1000bp中,并且异源转基因直接或不直接位于所述选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之后。
[0012]
在一些实施例中,cpg存在于紧接选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之后的50-1000bp中。
[0013]
在一些实施例中,cpg存在于紧接选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前的50-1000bp中且在该一个或多个拷贝的序列之后的50-1000bp中。
[0014]
在一些实施例中,n为约50。在一些实施例中,n为约100。在一些实施例中,n为约150。在一些实施例中,n为约200。在一些实施例中,n为约250。在一些实施例中,n为约500。在一些实施例中,n为约800。在一些实施例中,n为约1000。
[0015]
本发明的序列的核酸序列为:
[0016]
seq id no:1bmycgcgrbv
[0017]
seq id no:2ymycgcgrkv
[0018]
seq id no:3tctcgcgaga
[0019]
在一些实施例中,本发明的分离的核酸进一步包含编码蛋白质banp或其活性片段或变体的另一个序列,该序列可操作地连接至组成型启动子或诱导型启动子。
[0020]
在一些实施例中,本发明的分离的核酸的异源转基因是嵌合抗原受体。
[0021]
本发明还提供了载体,该载体包含本发明的分离的核酸。在一些实施例中,该载体是质粒、dna载体、rna载体、病毒载体、腺病毒载体、腺相关病毒载体、慢病毒载体、逆转录病毒载体、γ逆转录病毒载体或hsv载体。在一些实施例中,本发明的分离的核酸小于8kb。在一些实施例中,本发明的分离的核酸小于5kb。
[0022]
本发明还提供了试剂盒或组合物,该试剂盒或组合物包含本发明的分离的核酸和第二分离的核酸分子,该第二分离的核酸分子包含编码蛋白质banp或其活性片段或变体的序列,该序列可操作地连接至组成型启动子或诱导型启动子。在这样的试剂盒中,本发明的分离的核酸可以在同一载体内或在不同载体内。
[0023]
本发明还提供了本发明的分离的核酸、本发明的载体或本发明的试剂盒或本发明的组合物用于优选在细胞中瞬时体外、离体或体内表达异源转基因的用途。在一些实施例中,与在相同条件下与seq id no:1、seq id no:2或seq id no:3的单拷贝可操作地连接时的异源转基因的表达相比,该用途使异源转基因的表达增加大于二的倍数。在一些实施例中,异源转基因的表达通过报道基因活性、报道基因荧光、定量逆转录酶pcr或基因组学方法例如rna测序来测量。
[0024]
本发明进一步提供了体外、离体或体内在细胞中产生异源转基因的方法,该方法为将本发明的任何分离的核酸或权利要求书中本发明的载体引入细胞,培养该细胞(或细胞群),并纯化重组表达的异源转基因。在一些实施例中,细胞是干细胞。
[0025]
本发明还提供了分离的细胞,其包含本发明的分离的核酸。在该细胞或多个细胞中,包含选自seq id no:1、seq id no:2和/或seq id no:3的组的至少两个拷贝的序列的分离的核酸序列和异源转基因可以稳定地整合到所述细胞的基因组中。
附图说明
[0026]
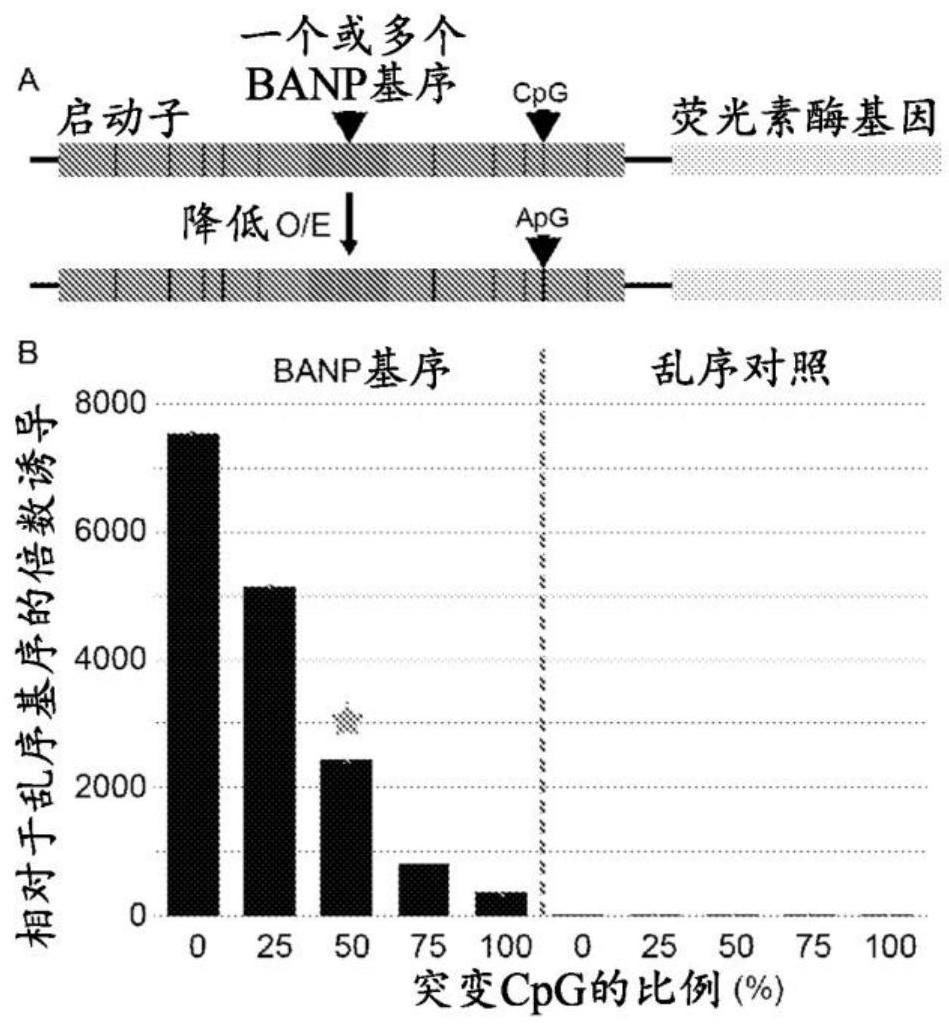
图1:可以通过调整人工banp启动子的cpg密度来调整荧光素酶报道基因的活性
[0027]
a)克隆在萤火虫荧光素酶报道基因上游的一个或多个banp基序指示周围人工启动子序列中的cpg二核苷酸及其突变为apg二核苷酸以降低o/e cpg密度。
[0028]
b)在瞬时转染到mesc中后,具有降低的o/e cpg密度的人工banp启动子相对于乱序基序对照对萤火虫荧光素酶活性的倍数诱导。在稳定的基因组整合后,可以将用灰色星号突出显示的启动子的活性与图2中同一启动子的活性进行比较。显示的是至少一个克隆的三个生物学重复的平均值,含标准偏差在内。数字0到100表示突变为apg的cpg的百分比。
[0029]
图2:在cpg密度降低50%的人工banp启动子的稳定基因组整合后,荧光素酶报道基因活性受到抑制
[0030]
a)具有三个包含不同cpg密度的完整或乱序基序的人工banp启动子稳定地整合到
mesc的β-珠蛋白基因座中。
[0031]
b)稳定整合的启动子的萤火虫荧光素酶报道基因活性。在瞬时转染后,可以将用灰色星号突出显示的启动子的活性与图1中同一启动子的活性进行比较。数字0到100表示突变为apg的cpg的百分比。绘制的是四个生物学重复的平均值。误差条表示标准偏差。
具体实施方式
[0032]
本发明人先前已经发现哺乳动物中迄今的孤儿调节基序当被蛋白质banp结合时充当强转录激活剂,也是cpg岛启动子的激活剂。当超过一个拷贝的基序存在于异源转基因前面时,这种强激活效协同增强。
[0033]
经过进一步研究,本发明人发现孤儿调节基序附近cpg位点的数量影响该基序的活性。可利用这种效应调节与所述基序可操作地连接的基因的表达。例如,一个表达载体可以包含多于一个异源转基因,每个都受其各自的banp基序的控制,但这些基序中的每个周围都有不同的cpg密度。这将导致每个转基因的不同的、受控的表达,尽管它们在相同的载体上并且由相同的转录因子结合的相同基序控制。
[0034]
本发明的另一个优点是,富含cpg的基序通常受细胞高度控制,并且如果构建体意外掺入宿主细胞的基因组,将导致转基因表达的关闭。
[0035]
因此,本发明提供了分离的核酸分子,其包含超过220bp,选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列,和在所述选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前的n个碱基对(bp)和/或之后的n个bp中的大于0.6的cpg观察值与估计值比率(o/e比率),其中该cpg o/e比率通过以下确定:对选自seq id no:1、seq id no:2和seq id no:3的组的至少一个或多个拷贝的序列周围的n个bp长序列中的cpg二核苷酸的数量进行计数,并通过将cpg二核苷酸的计数数量乘以n并将结果除以该n个bp中存在的c数量和g数量的乘积来计算该o/e比率(n*cpg/(c*g)),其中n在50和1000之间并且是紧接在所述选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前或紧跟其后的序列的长度,以bp计。为了清楚起见,声明技术人员熟知c代表胞嘧啶核苷酸,g代表鸟苷核苷酸并且cpg(或cg)代表5'—c—磷酸—g—3',即胞嘧啶和鸟嘌呤仅被一个磷酸基团隔开(磷酸将dna中的任意两个核苷连接在一起)。
[0036]
在一些实施例中,cpg存在于紧接选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前的50-1000bp中,并且异源转基因直接或不直接位于所述选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之后。
[0037]
在一些实施例中,cpg存在于紧接选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之后的50-1000bp中。
[0038]
在一些实施例中,cpg存在于紧接选自seq id no:1、seq id no:2和seq id no:3的组的一个或多个拷贝的序列之前的50-1000bp中且在该一个或多个拷贝的序列之后的50-1000bp中。
[0039]
在一些实施例中,n为约50。在一些实施例中,n为约100。在一些实施例中,n为约150。在一些实施例中,n为约200。在一些实施例中,n为约250。在一些实施例中,n为约500。在一些实施例中,n为约800。在一些实施例中,n为约1000。
[0040]
本发明的序列的核酸序列为:
[0041]
seq id no:1bmycgcgrbv
[0042]
seq id no:2ymycgcgrkv
[0043]
seq id no:3tctcgcgaga
[0044]
在一些实施例中,本发明的分离的核酸进一步包含编码蛋白质banp或其活性片段或变体的另一个序列,该序列可操作地连接至组成型启动子或诱导型启动子。
[0045]
在一些实施例中,本发明的分离的核酸的异源转基因是嵌合抗原受体。
[0046]
本发明还提供了载体,该载体包含本发明的分离的核酸。在一些实施例中,该载体是质粒、dna载体、rna载体、病毒载体、腺病毒载体、腺相关病毒载体、慢病毒载体、逆转录病毒载体、γ逆转录病毒载体或hsv载体。在一些实施例中,本发明的分离的核酸小于8kb。在一些实施例中,本发明的分离的核酸小于5kb。
[0047]
本发明还提供了试剂盒或组合物,该试剂盒或组合物包含本发明的分离的核酸和第二分离的核酸分子,该第二分离的核酸分子包含编码蛋白质banp或其活性片段或变体的序列,该序列可操作地连接至组成型启动子或诱导型启动子。在这样的试剂盒中,本发明的分离的核酸可以在同一载体内或在不同载体内。
[0048]
本发明还提供了本发明的分离的核酸、本发明的载体或本发明的试剂盒或本发明的组合物用于优选在细胞中瞬时体外、离体或体内表达异源转基因的用途。在一些实施例中,与在相同条件下与seq id no:1、seq id no:2或seq id no:3的单拷贝可操作地连接时的异源转基因的表达相比,该用途使异源转基因的表达增加大于二的倍数。在一些实施例中,异源转基因的表达通过报道基因活性、报道基因荧光、定量逆转录酶pcr或基因组学方法例如rna测序来测量。
[0049]
本发明进一步提供了体外、离体或体内在细胞中产生异源转基因的方法,该方法为将本发明的任何分离的核酸或权利要求书中本发明的载体引入细胞,培养该细胞(或细胞群),并纯化重组表达的异源转基因。在一些实施例中,细胞是干细胞。
[0050]
本发明还提供了分离的细胞,其包含本发明的分离的核酸。在该细胞或多个细胞中,包含选自seq id no:1、seq id no:2和/或seq id no:3的组的至少两个拷贝的序列的分离的核酸序列和异源转基因可以稳定地整合到所述细胞的基因组中。
[0051]
如本文所用,术语“启动子”是指任何顺式调控元件,包括增强子、沉默子、绝缘子和启动子。启动子是dna的通常位于需要转录的基因上游(朝向5'区域)的区域。启动子容许正确激活或抑制其控制的基因。在本发明的上下文中,启动子导致与它们可操作地连接的基因在表达胶质原纤维酸性蛋白的细胞中的特异性表达。外源基因的“特异性表达”,也称为“仅在某种类型的细胞中表达”意指至少超过75%,优选地超过85%、超过90%或超过95%的表达目的外源基因的细胞具有指定的类型,即在本案中为表达胶质原纤维酸性蛋白的细胞。
[0052]
典型地将表达盒引入载体中,该载体有助于表达盒进入宿主细胞并在宿主细胞中维持表达盒。此类载体是常用的并且是本领域技术人员熟知的。许多此类载体可例如从英杰公司(invitrogen)、斯特吉公司(stratagene)、宝日医公司(clontech)等商购获得,并且在许多指南中有描述,例如ausubel、guthrie、strathem或berger,全部同上。此类载体典型地包括启动子、多腺苷酸化信号等,连同多个克隆位点,以及其他元件,例如复制起点、选择性标记基因(例如leu2、ura3、trp 1、his3、gfp)、着丝粒序列等。为了清楚起见,对于技术人
员而言显而易见的是,本发明还包括具有与权利要求中定义的序列互补的序列的分离的核酸。
[0053]
适于本发明的病毒载体是本领域熟知的。例如,aav、prv或慢病毒适于将基因靶向并递送至细胞。
[0054]
如本文所用,术语“动物”在本文中用于包括所有动物。在本发明的一些实施例中,非人动物为脊椎动物。动物的实例为人、小鼠、大鼠、牛、猪、马、鸡、鸭、鹅、猫、狗等。术语“动物”还包括处于所有发育期(包括胚胎和胎儿期)的个体动物。“经遗传修饰的动物”是含有一种或多种下述细胞的任何动物,这些细胞带有通过在亚细胞水平上的有意遗传操作,例如通过靶向重组、显微注射或重组病毒感染而直接或间接改变或接收的遗传信息。术语“经遗传修饰的动物”无意涵盖经典杂交或体外受精,而是意在涵盖其中一种或多种细胞被重组dna分子改变或接收该重组dna分子的动物。该重组dna分子可以特异性地靶向限定的遗传基因座,可以随机整合到染色体内,或者可以是染色体外复制dna。术语“种系经遗传修饰的动物”是指其中将遗传改变或遗传信息引入种系细胞中,从而赋予将遗传信息传递给其后代的能力的经遗传修饰的动物。如果这样的后代实际上具有该改变或遗传信息中的一些或全部,则它们也是经遗传修饰的动物。
[0055]
该改变或遗传信息对于受者所属的动物物种可能是外来的,或者仅对于特定的个体受者是外来的,或者可以是受者已经具有的遗传信息。在最后一种情况下,该改变或引入的基因可以与天然基因不同地表达,或者根本不表达。
[0056]
用于改变靶基因的基因可以通过多种技术获得,这些技术包括但不限于从基因组来源分离、由分离的mrna模板制备cdna、直接合成或其组合。
[0057]
用于引入转基因的一类靶细胞是es细胞。es细胞可以从体外培养的植入前胚胎获得并与胚胎融合(evans等人(1981),nature[自然]292:154-156;bradley等人(1984),nature[自然]309:255-258;gossler等人(1986),proc.natl.acad.sci.usa[美国国家科学院院刊]83:9065-9069;robertson等人(1986),nature[自然]322:445-448;wood等人(1993),proc.natl.acad.sci.usa[美国国家科学院院刊]90:4582-4584)。可以通过标准技术例如使用电穿孔进行dna转染或通过逆转录病毒介导的转导,将转基因有效地引入es细胞中。之后可以通过聚集将得到的转化es细胞与桑椹胚组合或注射到来自非人动物的囊胚中。之后所引入的es细胞定殖于胚胎并产生所得嵌合动物的种系(jaenisch(1988),science[科学]240:1468-1474)。基因靶向的es细胞在产生基因靶向遗传修饰小鼠中的用途在1987年进行了描述(thomas等人(1987),cell[细胞]51:503-512)并且在其他地方进行了综述(frohman等人(1989),cell[细胞]56:145-147;capecchi(1989),trends in genet.[遗传学趋势]5:70-76;baribault等人(1989),mol.biol.med.[分子生物学与医学]6:481-492;wagner(1990),embo j.[欧洲分子生物学学会杂志]9:3025-3032;bradley等人(1992),bio/technology[生物技术]10:534-539)。
[0058]
有技术可用于通过使用靶向同源重组将特定变化插入染色体等位基因中,而使任何遗传区失活或改变成任何所需的突变。
[0059]
如本文所用,“靶向基因”是通过人为干预(包括但不限于本文所述的方法)引入非人动物种系中的dna序列。本发明的靶向基因包括被设计成特异性改变同源内源性等位基因的dna序列。
[0060]
在本发明中,“分离的”是指从其原始环境(例如,如果它是天然存在的,则为天然环境)中移出的材料,并因此“通过人工”从其天然状态改变。例如,分离的多核苷酸可以是载体或物质组合物的一部分,或者可以包含在细胞内,并且仍然是“分离的”,因为该载体、物质组合物或特定细胞不是多核苷酸的原始环境。术语“分离的”不是指基因组或cdna文库、全细胞总体或mrna制剂、基因组dna制剂(包括通过电泳分离并转移到印迹上的那些)、剪切的全细胞基因组dna制剂或其中本领域并未显示出本发明的多核苷酸/序列的区别性特征的其他组合物。分离的dna分子的进一步实例包括保持在异源宿主细胞中的重组dna分子或溶液中的纯化(部分或基本上)dna分子。分离的rna分子包括本发明的dna分子的体内或体外rna转录物。然而,出于本发明的目的,作为某文库(例如,基因组或cdna文库)的成员但尚未与该文库的其他成员分离(例如,呈含有克隆和该文库的其他成员的均一溶液的形式)的克隆中所含的核酸,或从细胞或细胞裂解液中移出的染色体(例如,“染色体分散”,如在核型中),或随机剪切的基因组dna的制剂,或经一种或多种限制酶切割的基因组dna的制剂不是“分离的”。如本文进一步讨论的,根据本发明的分离的核酸分子可以是以天然、重组或合成方式产生的。
[0061]“多核苷酸”可以由单链和双链dna、作为单链和双链区混合物的dna、单链和双链rna、以及作为单链和双链区混合物的rna、包含可为单链或更典型地为双链的或为单链和双链区混合物的dna和rna的杂交分子组成。另外,多核苷酸可由包含rna或dna或者rna和dna两者的三链区组成。多核苷酸还可以含有一个或多个经修饰的碱基或出于稳定性或其他原因而修饰的dna或rna主链。“经修饰的”碱基包括例如三苯甲基化碱基和稀有碱基,如肌苷。可以对dna和rna进行多种修饰;因此,“多核苷酸”包括以化学、酶促或代谢方式修饰的形式。
[0062]
表述“编码多肽的多核苷酸”涵盖仅包括该多肽的编码序列的多核苷酸以及包括另外的编码序列和/或非编码序列的多核苷酸。
[0063]“严格杂交条件”是指在42℃下在包含50%甲酰胺、5x ssc(750mm nacl、75mm柠檬酸三钠)、50mm磷酸钠(ph 7.6)、5x邓哈特氏溶液(denhardt's solution)、10%硫酸葡聚糖和20μg/ml变性的剪切鲑精dna的溶液中过夜孵育,然后在约50℃下在0.1x ssc中洗涤过滤器。杂交和信号检测严格性的改变主要通过控制甲酰胺浓度(较低的甲酰胺百分比导致严格性降低);盐条件或温度实现。例如,中等高严格性条件包括于37℃下在包含6x sspe(20x sspe=3m nacl;0.2mnah2po4;0.02m edta,ph 7.4)、0.5% sds、30%甲酰胺、100μg/ml阻断dna的鲑精的溶液中过夜孵育;之后用1xsspe,0.1% sds于50℃下洗涤。另外,为了达到甚至更低的严格性,严格杂交后进行的洗涤可以在更高的盐浓度(例如5x ssc)下进行。上述条件的变化可以通过包含和/或替换用于抑制杂交实验中的背景的替代性阻断试剂来实现。典型的阻断试剂包括邓哈特氏试剂(denhardt's reagent)、blotto、肝素、变性鲑精dna和可商购获得专利配制品。由于相容性问题,包含特定的阻断试剂可能需要修改上述杂交条件。
[0064]
当涉及多肽时,术语“片段”、“衍生物”和“类似物”意指保留与此类多肽基本上相同的生物学功能或活性的多肽。类似物包括前蛋白(pro-protein),它可以通过裂解前蛋白部分而激活以产生活性成熟多肽。
[0065]
术语“基因”意指参与产生多肽链的dna区段;它包括编码区之前和之后的区域“前
导区和尾区”以及各个编码区段(外显子)之间的间插序列(内含子)。
[0066]
多肽可以由通过肽键或修饰的肽键彼此连接的氨基酸组成,即肽等排体,并且可以含有除20种基因编码的氨基酸之外的氨基酸。多肽可以通过天然过程(如翻译后加工)或通过本领域熟知的化学修饰技术进行修饰。此类修饰在基础教科书和更详细的专著以及大量研究文献中有充分描述。修饰可以发生在多肽中的任何地方,包括肽主链、氨基酸侧链和氨基末端或羧基末端。应当认识到,相同类型的修饰可以在给定多肽中的几个位点以相同或不同的程度存在。而且,给定多肽可以含有许多类型的修饰。例如,多肽可以例如由于泛素化而分支,并且它们可以是环状的,有或没有分支。环状、分支和分支环状多肽可以由翻译后的天然过程产生,或者可以通过合成方法制备。修饰包括但不限于乙酰化、酰化、生物素化、adp-核糖基化、酰胺化、黄素的共价连接、血红素部分的共价连接、核苷酸或核苷酸衍生物的共价连接、脂质或脂质衍生物的共价连接、磷脂酰肌醇的共价连接、交联、环化、通过已知的保护/阻断基团衍生化、二硫键形成、去甲基化、共价交联的形成、半胱氨酸的形成、焦谷氨酸的形成、甲酰化、γ-羧化、糖基化、gpi锚形成、羟基化、碘化、与抗体分子或其他分子配体连接、甲基化、豆蔻酰化、氧化、聚乙二醇化、蛋白水解加工(例如,裂解)、磷酸化、异戊烯化、外消旋化、硒化、硫酸化、转运rna介导的向蛋白质添加氨基酸(如精氨酸化)和泛素化。(参见,例如,proteins-structure and molecular properties[蛋白质-结构和分子特性],第2版,t.e.creighton,w.h.freeman and company,new york[纽约w.h.弗里曼公司](1993);posttranslational covalent modification of proteins[蛋白质翻译后共价修饰],b.c.johnson编,academic press[学术出版社],纽约,第i-12页(1983);seifter等人,meth enzymol[酶学方法]182:626-646(1990);rattan等人,ann ny acad sci[纽约科学院年鉴]663:48-62(1992))。
[0067]“具有生物活性”的多肽片段是指表现出与原始多肽(包括成熟形式)的活性相似但不一定相同的活性的多肽,如在特定生物学测定法中所测量的,具有或不具有剂量依赖性。在确实存在剂量依赖性的情况下,它不需要与该多肽的剂量依赖性相同,而是与原始多肽相比与给定活性中的剂量依赖性基本上相似(即,相对于原始多肽,候选多肽将表现出更强的活性或低不超过约25倍且在一些实施例中,低不超过约十倍的活性,或低不超过约三倍的活性。)
[0068]
可以通过以下方式分离和鉴定物种同源物:由本文提供的序列制备合适的探针或引物,以及针对所需同源物对合适的核酸来源进行筛选。
[0069]“变体”是指与原始多核苷酸或多肽不同但保留其基本特性的多核苷酸或多肽。通常,变体与原始多核苷酸或多肽总体上非常相似,并且在许多区域中,与原始多核苷酸或多肽相同。
[0070]
实际上,可以使用已知的计算机程序以常规方式测定任何特定核酸分子或多肽是否与本发明的核苷酸序列具有至少80%、85%、90%、92%、95%、96%、97%、98%、99%或100%同一性。用于测定查询序列(本发明的序列)与目标序列之间的最佳总体匹配的优选方法,也称为全局序列比对,可以使用基于brutlag等人(comp.app.blosci.[计算机生物科学应用](1990)6:237-245)的算法的fastdb计算机程序来确定。在序列比对中,查询序列和目标序列都是dna序列。可以通过将u转换为t来比较rna序列。所述全局序列比对的结果是百分比同一性。用于dna序列的fastdb比对以计算百分比同一性的优选参数是:矩阵
(matrix)=酉(unitary),k-元组(k-tuple)=4,错配罚分(mismatch penalty)
‑‑
1,连接罚分(joining penalty)
‑‑
30,随机分组长度(randomization group length)=0,截止得分(cutoff score)=l,空位罚分(gap penalty)
‑‑
5,空位大小罚分(gap size penalty)0.05,窗口大小(window size)=500或目标核苷酸序列的长度(以较短者为准)。如果目标序列由于5'或3'缺失,而不是因为内部缺失而比查询序列短,则必须对结果进行人工校正。这是因为fastdb程序在计算百分比同一性时不考虑目标序列的5'和3'截短。对于相对于查询序列在5'或3'末端截短的目标序列,通过计算查询序列中在目标序列5'和3'而未匹配/对齐的碱基数占查询序列总碱基数的百分比来校正百分比同一性。通过fastdb序列比对的结果确定核苷酸是否匹配/对齐。然后从上述fastdb程序使用指定参数计算的百分比同一性中减去该百分比,以得出最终的百分比同一性得分。该校正后的得分是用于本发明目的的得分。为了人工调整百分比同一性得分,仅计算目标序列5'和3'碱基外(如通过fastdb比对展示的)未与查询序列匹配/对齐的碱基。例如,将90个碱基的目标序列与100个碱基的查询序列比对以确定百分比同一性。缺失发生在目标序列的5'末端,因此,fastdb比对未显示5'末端前10个碱基的匹配/对齐。这10个受损碱基占序列的10%(5'和3'末端未匹配的碱基数/查询序列中的碱基总数),所以从通过fastdb程序计算的百分比同一性得分中减去10%。如果剩余的90个碱基完全匹配,则最终的百分比同一性为90%。在另一个实例中,将90个碱基的目标序列与100个碱基的查询序列进行比较。这次缺失是内部缺失,所以在目标序列的5'或3'上没有与查询序列不匹配/对齐的碱基。在这种情况下,通过fastdb计算的百分比同一性不进行人工校正。再次,仅人工校正目标序列5'和3'处与查询序列不匹配/对齐的碱基。
[0071]
所谓具有与本发明的查询氨基酸序列具有至少(例如)95%“同一性”的氨基酸序列的多肽,旨在表示除了以下方面外,目标多肽的氨基酸序列与查询序列相同:目标多肽序列可以在查询氨基酸序列的每100个氨基酸中包括最多五个氨基酸改变。换言之,为了获得具有与查询氨基酸序列具有至少95%同一性的氨基酸序列的多肽,目标序列中最多5%的氨基酸残基可以插入、缺失或用另一种氨基酸取代。参考序列的这些改变可以发生在参考氨基酸序列的氨基或羧基末端位置或那些末端位置之间的任何位置,单独散布在参考序列中的残基之间或参考序列内的一个或多个连续组中。
[0072]
实际上,可以使用已知的计算机程序以常规方式测定任何特定多肽是否与例如序列中所示的氨基酸序列或与保藏dna克隆所编码的氨基酸序列具有至少80%、85%、90%、92%、95%、96%、97%、98%、99%或100%同一性。用于测定查询序列(本发明的序列)与目标序列之间的最佳总体匹配的优选方法,也称为全局序列比对,可以使用基于brutlag等人(comp.app.biosci.[计算机生物科学应用](1990)6:237-245)的算法的fastdb计算机程序来确定。在序列比对中,查询序列和目标序列均为核苷酸序列或均为氨基酸序列。所述全局序列比对的结果是百分比同一性。用于fastdb氨基酸比对的优选参数是:矩阵=pam 0,k-元组=2,错配罚分
‑‑
i,连接罚分=20,随机分组长度=0,截止得分=i,窗口大小=序列长度,空位罚分
‑‑
5,空位大小罚分
‑‑
0.05,窗口大小=500或目标氨基酸序列的长度(以较短者为准)。如果目标序列由于n-或c-端缺失,而不是因为内部缺失而比查询序列短,则必须对结果进行人工校正。这是因为fastdb程序在计算全局百分比同一性时不考虑目标序列的n-和c-端截短。对于相对于查询序列在n-和c-端截短的目标序列,通过计算查询序列中在
目标序列n-和c-端而未与相应目标残基匹配/对齐的残基数占查询序列总碱基数的百分比来校正百分比同一性。通过fastdb序列比对的结果确定残基是否匹配/对齐。然后从上述fastdb程序使用指定参数计算的百分比同一性中减去该百分比,以得出最终的百分比同一性得分。该最终百分比同一性得分是用于本发明目的的得分。为了人工调整百分比同一性得分,仅考虑目标序列n-和c-端未与查询序列匹配/对齐的碱基。也就是说,仅查询位于目标序列的最远n-和c-端残基外的残基位置。仅人工校正目标序列n-端和c-端外(如fastdb比对中所展示的)与查询序列不匹配/对齐的残基位置。出于本发明的目的,不需要进行其他人工校正。
[0073]
天然存在的蛋白质变体称为“等位基因变体”,并且是指占据生物体染色体上的给定基因座的基因的几种替代性形式之一。(genes[基因]11,lewin,b.编,john wiley&sons,new york[纽约约翰威利国际出版公司](1985))。这些等位基因变体可以在多核苷酸和/或多肽水平上变化。替代性地,非天然存在的变体可以通过诱变技术或通过直接合成而产生。
[0074]
如本文所用,包含“异源核酸序列”或“异源转基因”的分离的核酸是指包含在天然背景下发现通常不与分离的核酸的其余部分可操作地连接的部分(即,异源核酸部分)的分离的核酸。例如,异源核酸可以包含最初未在天然衍生出分离的核酸的其他组分(例如,启动子)的细胞、细菌细胞、病毒、或生物体中发现的核酸序列,或其中未发现分离的核酸的其他组分(例如,启动子)与细胞、细菌细胞、病毒、或生物体中的异源核酸天然地可操作地连接的核酸序列。在一些实施例中,异源核酸序列编码人蛋白。在一些实施例中,异源核酸序列编码rna序列,例如shrna。
[0075]“编码”特定rna的dna序列或dna多核苷酸序列是能够转录为rna的dna的序列。dna多核苷酸可以编码翻译成蛋白质的rna(mrna),或者dna多核苷酸可以编码不翻译成蛋白质的rna(例如,trna、rrna、或指导rna;也称为“非编码”rna或“ncrna”)。dna序列或dna多核苷酸序列也可以“编码”特定的多肽或蛋白序列,其中,例如,dna直接编码可翻译成多肽或蛋白序列的mrna。“蛋白质编码序列”或编码特定蛋白质或多肽的序列是当置于适当的调节序列的控制下时能够在体外或体内转录为mrna(在dna的情况下)和翻译(在mrna的情况下)成多肽的核酸序列。编码序列的边界可以由5’端(n-端)处的起始密码子和3’端(c-端)处的翻译终止无义密码子确定。编码序列可以包括但不限于来自原核或真核生物mrna的cdna、来自原核或真核生物dna的基因组dna序列、以及合成核酸。转录终止序列将通常位于编码序列的3’。
[0076]
在本文中可互换使用的术语“dna调节序列”、“控制元件”和“调节元件”是指提供和/或调节非编码序列(例如,短发夹rna)或编码序列(例如,pgrn)的转录和/或调节编码多肽的翻译的转录和翻译控制序列,如启动子、增强子、多腺苷酸化信号、终止子、蛋白降解信号等。
[0077]
术语“多腺苷酸化(polya)信号序列”和“多腺苷酸化序列”是指为转录终止和向rna转录物的3’末端添加腺苷均聚链提供信号的调节元件。多腺苷酸化信号可以包含终止信号(例如,aauaaa序列或其他非经典序列)和任选地侧接的辅助元件(例如,富含gu的元件)和/或与有效切割和多腺苷酸化相关的其他元件。多腺苷酸化序列可以包含一系列通过多腺苷酸化附接到mrna的3’末端的腺苷。特定的polya信号序列可以包括表1的poly(a)信号(seq id no:5)。在一些实施例中,dna调节序列或控制元件是组织特异性调节序列。
[0078]
术语“转录后调节元件”(“pre”)是指当转录为mrna时,在mrna转录水平调节基因表达的一个或多个调节元件。此类转录后调节元件的实例可以包括编码微小rna结合位点、rna结合蛋白结合位点等的序列。可与本文披露的病毒载体一起使用的转录后调节元件的实例包括土拨鼠肝炎转录后调节元件(wpre)、肝炎转录后调节元件(hpre)。
[0079]
术语“内含子”是指一个或多个核酸序列,例如在开放阅读框中的那些,该一个或多个核酸序列不编码从核酸表达的蛋白质的一个或多个氨基酸。内含子序列可以从dna转录为rna,但可以例如通过剪接在蛋白质表达之前被去除。在一些实施例中,将内含子序列添加到异源核酸序列以增加基因表达的总体效率和输出。可与本文披露的病毒载体一起使用的内含子的实例包括sv40内含子、β珠蛋白内含子、鸡β-肌动蛋白内含子等。
[0080]
如本文所用,“体外”进行的过程是指在正常生物环境之外进行的过程,例如在试管、烧瓶、培养皿、人工培养基中进行的研究。“体内”进行的过程是指在活生物体或细胞内进行的过程,例如,在细胞培养物或小鼠中进行的研究。“离体”进行的过程是指在外部环境(例如,具有对自然条件的最小改变)中在来自生物体的组织中或对来自生物体的组织进行的过程,例如,允许在比体内实验更受控的条件下操作生物体的细胞或组织。
[0081]
如本文所用,如应用于例如核酸、多肽、细胞、或生物体的术语“天然存在”或“未修饰”,是自然界中发现的核酸、多肽、细胞、或生物体。例如,存在于生物体(如病毒)中的多肽或多核苷酸序列是天然存在的,无论是存在于该生物体中还是从该生物体的一种或多种组分中分离的。
[0082]
在一些实施例中,“载体”是任何遗传元件(例如,dna、rna、或其混合物),该遗传元件含有能够在宿主细胞中表达的目的核酸,例如,在适用于递送至细胞、组织和/或生物体的较大核酸序列或结构中的目的核酸,如质粒、噬菌体、转座子、粘粒、染色体、病毒、病毒粒子等。例如,载体可以包含插入物(例如,编码待表达的基因或该基因的开放阅读框的异源核酸)以及一个或多个另外的元件,例如适用于递送或控制该插入物的表达的元件。例如当与适当的控制元件相关时,载体可以能够复制和/或表达,并且其可以能够在细胞之间转移遗传信息。在一些实施例中,载体可以是适用于在宿主细胞中表达的载体,例如aav载体。在一些实施例中,载体可以是适用于例如在细胞或生物反应器中表达和/或复制的质粒。在一些实施例中,特别地设计用于在靶细胞中表达异源核酸序列(例如,编码目的蛋白、shrna等的异源核酸)的载体可以称为表达载体,并且通常具有驱动该异源核酸序列表达的启动子序列。在其他实施例中,载体(例如,转录载体)可以能够被转录但不能被翻译:他们可以在靶细胞中复制但不能表达。转录载体可以用于扩增他们的插入物。
[0083]
术语“表达载体”是指包含多核苷酸的载体,该多核苷酸包含与待表达的核苷酸序列可操作地连接的表达控制序列。单独或与宿主细胞提供的或在体外表达系统中的其他用于表达的元件组合,表达载体可以包含足够的用于表达的顺式作用元件。表达载体包括例如掺入重组多核苷酸的粘粒、质粒(例如,裸露的或包含在脂质体中)和病毒(例如,慢病毒、逆转录病毒、腺病毒和腺相关病毒)。
[0084]
术语“质粒”是指包含完整“复制子”的非染色体(并且典型地为双链)dna序列,使得质粒在宿主细胞中复制。质粒可以是环状核酸。当将质粒放置在单细胞生物体内时,该质粒的dna导致该生物体的特征发生改变或转化。例如,携带四环素抗性(tcr)基因的质粒将先前对四环素敏感的细胞转化为对其具有抗性的细胞。
[0085]
如本文所用,术语“重组病毒”旨在意指包含基因或其他异源核酸的非野生型和/或人工产生的重组病毒(例如,细小病毒、腺病毒、慢病毒或腺相关病毒等)。重组病毒可以包含包装在病毒(例如:aav)衣壳内的重组病毒基因组(例如,包含编码目的基因的核酸)。重组病毒的特定类型可以是“重组腺相关病毒”或“raav”。包装在病毒衣壳中的重组病毒基因组可以是病毒载体。在一些实施例中,本文披露的重组病毒包含病毒载体。病毒载体的实例包括但不限于腺相关病毒(aav)载体、嵌合aav载体、腺病毒载体、逆转录病毒载体、慢病毒载体、dna病毒载体、单纯疱疹病毒载体、杆状病毒载体、或其任何突变体或衍生物。
[0086]
在另一实施例中,术语“转染”用以指细胞对外来dna的摄取,使得一旦已将外源dna引入细胞膜内侧,这些细胞就已被“转染”了。参见例如,graham等人,(1973)virology[病毒学],52:456;sambrook等人,(1989)molecular cloning,a laboratory manual[分子克隆:实验室手册],cold spring harbor laboratories[冷泉港实验室],纽约;davis等人,(1986)basic methods in molecular biology[分子生物学基本方法],elsevier[爱思唯尔];chu等人,(1981)gene[基因],13:197。此类技术可用于将一个或多个外源dna部分引入适合的宿主细胞中。在一些实施例中,术语“转导”用以指细胞对外来dna的摄取,其中该外来dna由病毒或病毒载体提供。因此,当已将外源dna引入细胞膜内侧时,细胞就已被“转导”。在一些实施例中,术语“转化”用以指细菌细胞对外来dna的摄取。
[0087]
如本文所用,术语“细胞系”是指能够在体外继续或延长生长和分裂的细胞群。在某些情况下,在储存或转移此类克隆群期间,核型可能发生自发或诱导的变化。因此,衍生自所指细胞系的细胞可能与祖先细胞或培养物不完全相同,并且所指细胞系包括此类变体。
[0088]
术语“可操作地连接”是指两个或更多个多核苷酸(例如,dna)区段之间的功能性关系。典型地,该术语是指转录调节序列与待转录序列的功能性关系。例如,如果启动子或增强子序列例如在适当的宿主细胞或其他表达系统中刺激或调节编码序列的转录,则启动子或增强子序列与编码序列可操作地连接。通常,与序列可操作地连接的启动子转录调节序列与该序列邻接或由短间隔子序列分开,即他们是顺式作用的。然而,一些转录调节序列例如增强子不需要在物理上邻接或位于极为接近这些转录调节序列增强其转录的编码序列的位置。
[0089]
如本文所用,术语“aav载体”是指衍生自或包含腺相关病毒血清型的一个或多个核酸序列的载体,包括但不限于aav-1、aav-2、aav-3、aav-4、aav-5、aav-6、aav-7、aav-8或aav-9病毒载体。aav载体可具有一个或多个aav野生型基因的整体或部分缺失,例如rep和/或cap基因,同时保留例如功能性侧接反向末端重复(“itr”)序列。在一些实施例中,aav载体可以包装在例如包含一个或多个aav衣壳蛋白的蛋白壳或衣壳中,该外壳或衣壳可提供用于将载体核酸递送至靶细胞的细胞核的媒介物。在一些实施例中,aav载体包含一个或多个aav itr序列(例如,aav2 itr序列)。在一些实施例中,aav载体包含一个或多个aav itr序列(例如,aav2 itr序列),但不含有任何另外的病毒核酸序列。这些载体构建体的实施例提供于例如wo/2019/094253(pct/us2018/058744)中,将其通过引用以其全文并入本文。
[0090]
在一些实施例中,“scaav”是自互补的腺相关病毒(scaav)。scaav被称为“自互补”,因为scaav的载体的至少一部分(例如,编码区的至少一部分)形成分子内双链dna。在一些实施例中,raav是scaav。在一些实施例中,病毒载体从天然存在的腺相关病毒(aav)工
程化以提供用于基因疗法的scaav。这些载体构建体的实施例以及其制备和纯化方法提供于例如wo/2019/094253(pct/us2018/058744)中,将其通过引用以其全文并入本文。
[0091]
如本文所用,“病毒”或“病毒粒子”指示包含病毒载体(例如,单独或与一种或多种另外的组分(如一种或多种病毒衣壳)组合)的病毒颗粒。例如,aav病毒可以包含例如与aav衣壳蛋白外壳相关的线性单链aav核酸基因组。
[0092]
在一些实施例中,术语如“病毒”、“病毒粒子”、“aav病毒”、“重组aav病毒粒子”、“raav病毒粒子”、“aav载体颗粒”、“完全衣壳”及“完全颗粒”等是指感染性、复制缺陷型病毒,例如包含aav蛋白壳的那些,该aav蛋白壳包裹例如在一侧或两侧上由aav itr侧接的病毒载体中的目的异源核苷酸序列。raav病毒粒子可以在适合的宿主细胞中产生,该适合的宿主细胞包含单独或与编码aav辅助功能和附带功能(如cap基因)的核酸组合(例如在相同或另外的质粒上)的指定aav载体的序列(例如一个或多个质粒)。在一些实施例中,使得宿主细胞能够编码aav多肽,这些多肽用于实现将aav载体(含有目的重组核苷酸序列)包装至感染性重组病毒粒子颗粒中以用于后续基因递送。
[0093]
术语“反向末端重复”或“itr”是指可以例如在腺相关病毒(aav)和/或重组腺相关病毒载体(raav)中形成t形回文结构的一段核苷酸序列。muzyczka等人,(2001)fields virology[费氏病毒学],第29章,lippincott williams&wilkins[利平科特、威廉姆斯和威尔金斯出版社]。在重组aav载体中,这些序列在基因组包装和第二链合成中发挥功能性作用。
[0094]
术语“宿主细胞”表示包含目的外源核酸的细胞,例如,一种或多种微生物、酵母细胞、昆虫细胞、或哺乳动物细胞。例如,宿主细胞可以包含aav辅助构建体、aav载体质粒、附带功能载体、和/或其他转移dna。该术语包括已转染的原始细胞的子代。由于自然的、偶然的或故意的突变,单个亲本细胞的子代在形态或基因组或总dna互补方面不一定与原始亲本完全相同。
[0095]
术语“aav辅助功能”是指可被表达以提供aav基因产物的aav衍生的编码序列,例如反式发挥功能以用于生产性aav复制的那些。例如,aav辅助功能可以包括两种主要的aav开放阅读框(orf):rep和cap。已证明rep表达产物具有许多功能,其中包括:aav的dna复制起点的识别、结合和切断;dna解旋酶活性;以及来自aav(或其他异源)启动子的转录的调节。cap表达产物提供必要的包装功能。在本文中,aav辅助功能可用于以反式补充aav载体中缺失的aav功能。
[0096]
术语“aav辅助构建体”一般是指包括提供或编码以下蛋白质或核酸的核苷酸序列的核酸分子,这些蛋白质或核酸提供从aav载体中缺失的aav功能,例如,用于将目的核苷酸序列递送至靶细胞或组织的载体。aav辅助构建体通常用于提供aav rep和/或cap基因的瞬时表达,以补充aav复制所缺失的aav功能。典型地,辅助构建体缺乏aav itr,并且既不能复制也不能包装自己。aav辅助构建体可以是质粒、噬菌体、转座子、粘粒、病毒、或病毒粒子的形式。已经披露了许多aav辅助构建体,如编码rep和cap表达产物的常用质粒paav/ad和plm29 45。参见例如,samulski等人,(1989)j.virol.[病毒学杂志],63:3822-3828;mccarty等人,(1991)j.virol.[病毒学杂志],65:2936-2945。已经披露了许多其他编码rep和/或cap表达产物的载体。参见例如,美国专利号5,139,941和6,376,237。这些载体构建体的实施例以及其制备和纯化方法提供于例如wo/2019/094253(pct/us2018/058744)中,将
其通过引用以其全文并入本文。
[0097]“标记”是指能够直接地或通过与信号产生系统的一个或多个另外成员相互作用而提供可检测信号的药剂。可直接检测并且可用于本发明的标记包括荧光标记。特定的荧光团包括荧光素、若丹明、bodipy、花青染料等。
[0098]“荧光标记”是指当被另一波长的光激发时能够发射某一波长的光的任何标记。
[0099]“荧光”是指任何可检测的荧光信号特征,包括强度、光谱、波长、胞内分布等。
[0100]“检测”荧光是指使用定性或定量方法评估细胞的荧光。在本发明的一些实施例中,将以定性方式检测荧光。换言之,是否存在荧光标记,表明重组融合蛋白是否表达。对于其他情况,可以使用定量手段测定荧光,例如,测量荧光强度、光谱或胞内分布,从而允许对不同条件下获得的值进行统计比较。该水平还可以使用定性方法来测定,例如视觉分析和人为对多个样品进行比较,例如,使用荧光显微镜或其他光学检测器(例如,图像分析系统等)检测样品。荧光的“改变”或“调制”是指在特定条件下与另一条件相比,荧光的强度、胞内分布、光谱、波长或其他方面的任何可检测的差异。例如,以定量方式检测“改变”或“调制”,并且差异是统计学上显著的差异。荧光的任何“改变”或“调制”可以使用标准仪器,如荧光显微镜、ccd或任何其他荧光检测器来检测,并且可以使用自动化系统(如集成系统)来检测,或者可以通过人类观察者来反映对改变的主观检测。
[0101]“绿色荧光蛋白”(gfp)是一种由238个氨基酸组成的蛋白质(26.9kda),该蛋白质最初从水母维多利亚多管发光水母(aequorea victoria)/水螅水母(aequorea aequorea)/肋骨水母(aequorea forskalea)分离,当暴露于蓝光时发出绿色荧光。来自维多利亚多管发光水母的gfp具有在395nm的波长下的主要激发峰和在475nm处的次要激发峰。其发射峰在509nm处,这处于可见光谱的绿色下部。来自海肾(renilla reniformis)的gfp具有在498nm处的单个主要激发峰。由于广泛使用的潜力和研究人员不断变化的需求,已经对许多不同的gfp突变体进行工程化。第一个主要的改进是1995年由roger tsien在nature[自然]上报道的单点突变(s65t)。这种突变显著改善了gfp的光谱特征,导致增强的荧光、光稳定性和主要激发峰迀移至488nm而发射峰保持在509nm。将37℃折叠效率(f64l)点突变添加至这个支架产生了增强的gfp(egfp)。egfp的消光系数(表示为ε),也称为其光学截面,为9.13
×
10-21m2/分子,也作为55,000l/(mol
·
cm)引述。2006年报道了超级折叠gfp,这是一系列允许gfp即使在与弱折叠肽融合时也快速折叠和成熟的突变。
[0102]“黄色荧光蛋白”(yfp)是衍生自维多利亚多管发光水母的绿色荧光蛋白的遗传突变体。其激发峰为514nm且发射峰为527nm。
[0103]
如本文所用,除非上下文另外明确指出,否则单数形式“一个/种(a/an)”和“该/所述”也包括复数指示物。
[0104]“病毒”是不能在宿主细胞外生长或繁殖的亚微观感染因子。每种病毒颗粒或病毒粒子由在称为衣壳的保护性蛋白外壳内的遗传物质dna或rna组成。衣壳形状从简单的螺旋和二十面体(多面体或近球形)形式到更复杂的具有尾部或包膜的结构变化。病毒感染细胞生命形式并且根据感染的宿主类型,分为动物、植物和细菌类型。
[0105]
如本文所用的术语“跨突触病毒”是指能够通过突触从一个神经元迁移到另一个相连神经元的病毒。此类跨突触病毒的实例是弹状病毒,例如狂犬病病毒和α疱疹病毒,例如假狂犬病病毒或单纯疱疹病毒。如本文所用的术语“跨突触病毒”还涵盖自身具有通过突
触从一个神经元迁移到另一个相连神经元的能力的病毒亚单位和包含此类亚单位并展示出通过突触从一个神经元迁移到另一个相连神经元的能力的生物载体(如经修饰的病毒)。
[0106]
跨突触迁移可以是顺行的或逆行的。在逆行迁移期间,病毒将从突触后神经元移动到突触前神经元。因此,在顺行迁移期间,病毒将从突触前神经元移动到突触后神经元。
[0107]
同源物是指具有共同祖先的蛋白质。类似物没有共同的祖先,但具有一些功能(而非结构)相似性,使得将它们包括在一个类别中(例如胰蛋白酶样丝氨酸蛋白酶和枯草杆菌蛋白酶明显不相关-它们在活性位点外的结构完全不同,但它们具有几何学上几乎相同的活性位点,并因此被认为是趋同进化为类似物的实例)。
[0108]
同源物有两个亚类-直系同源物和旁系同源物。直系同源物是不同物种中的相同基因(例如细胞色素
‘
c’)。相同生物体中的两个基因不可能是直系同源物。旁系同源物是基因复制的结果(例如血红蛋白β和δ)。如果两种基因/蛋白质是同源的并且在相同的生物体中,则它们是旁系同源物。
[0109]
如本文所用,术语“障碍”是指小病、疾病、病痛、临床病症或病理病症。
[0110]
如本文所用,术语“药学上可接受的载剂”是指不干扰活性成分的生物活性的有效性、是化学惰性的并且对所施用的患者无毒的载剂介质。
[0111]
如本文所用,术语“药学上可接受的衍生物”是指例如使用本发明的筛选方法鉴定的、对受试者相对无毒的药剂的任何同源物、类似物或片段。
[0112]
术语“治疗剂”是指有助于预防或治疗障碍或障碍的并发症的任何分子、化合物或治疗。
[0113]
可以制备配制在相容性药物载剂中的包含这样的药剂的组合物、包装并贴标签以用于治疗。
[0114]
如果复合物是水溶性的,则可以将其配制在合适的缓冲液中,例如磷酸盐缓冲盐水或其他生理上相容的溶液。
[0115]
替代性地,如果所得的复合物在水性溶剂中的溶解性差,则可以用非离子表面活性剂如tween或聚乙二醇配制。因此,组合物及其生理上可接受的溶剂化物可以被配制成通过以下方式施用:吸入或吹入(通过口或鼻)或口服、含服、肠胃外、直肠施用,或者在肿瘤的情况下,直接注射到实体瘤中。
[0116]
组合物可以被配制成通过注射,例如通过推注或连续输注而进行肠胃外施用。注射用配制品可以以单位剂型呈现,例如,在添加了防腐剂的安瓿中或多剂量容器中。
[0117]
该组合物可以采取例如处于油性媒介物或水性媒介物的悬浮液、溶液或乳液的形式,并且可以含有配制剂(例如助悬剂、稳定剂和/或分散剂)。替代性地,活性成分可以呈粉末形式,以在使用前用合适的媒介物(例如无菌无热原水)复原。
[0118]
组合物也可以配制成供局部应用,如霜剂或洗剂。
[0119]
除了前述配制品之外,组合物还可以被配制为贮库制剂。此类长效型配制品可以通过植入(例如,眼内、皮下或肌内)或通过眼内注射而施用。
[0120]
因此,例如,组合物可以与合适的聚合物或疏水性材料(例如,作为在可接受的油中的乳液)或离子交换树脂一起配制,或被配制成微溶性衍生物,例如被配制成微溶性盐。脂质体和乳液是用于亲水性药物的递送媒介物或载剂的熟知实例。
[0121]
如果需要,组合物可以呈现于包装或分配装置中,该包装或分配装置可以含有一
个或多个包含活性成分的单位剂型。该包装例如可以包含金属箔或塑料箔,例如泡罩包装。该包装或分配装置可以附有施用说明。
[0122]
本发明还提供了用于实施本发明的治疗方案的试剂盒。此类试剂盒在一个或多个容器中包含治疗或预防有效量的药学上可接受形式的组合物。
[0123]
试剂盒的小瓶中的组合物可以呈药学上可接受的溶液的形式,例如与无菌盐水、葡萄糖溶液或缓冲溶液或其他药学上可接受的无菌流体组合。替代性地,复合物可以冻干或脱水;在这种情况下,试剂盒任选地进一步在容器中包含优选地为无菌的药学上可接受的溶液(例如,盐水、葡萄糖溶液等),以将复合物复原以形成用于注射目的的溶液。
[0124]
在另一实施例中,试剂盒进一步包含优选地以无菌形式包装以用于注射复合物的针或注射器,和/或包装好的酒精垫。任选地包括供临床医生或患者施用组合物的说明书。
[0125]
蛋白质banp,也称为btg3相关核蛋白、支架/基质相关区域-1-结合蛋白、含ben结构域的蛋白1、蛋白质banp、bend1、smar1、btg3相关核蛋白、含ben结构域的1蛋白或smarbp1,是一种在人类中由banp基因编码的蛋白质(hgnc:13450entrez基因:54971ensembl:ensg00000172530 omim:611564uniprotkb:q8n9n5)。它是人类基因家族“包含ben结构域的蛋白(ben-domain containing)”的成员,其中包括其他八个基因:bend2、bend3、bend4、bend5、bend6、bend7、nacc1(bend8)、和nacc2(bend9)。
[0126]
除非另外定义,否则本文所用的所有技术和科学术语均具有与本发明所属领域的普通技术人员通常所理解的相同的含义。虽然与本文所述的那些方法和材料类似或等同的方法和材料可以用于本发明的实践或测试,但是以下描述合适的方法和材料。在冲突存在的情况下,则以包括定义在内的本说明书为准。此外,材料、方法和实例仅是说明性的而不旨在限制。
[0127]
实例
[0128]
瞬时转染后双荧光素酶报道基因测定
[0129]
将嵌入具有不同cpg二核苷酸密度(0%、25%、50%、75%、或100%突变cpg)的人工启动子序列中的三个banp基序和乱序对照克隆到萤火虫荧光素酶基因的上游。使用lipofectamine-2000(赛默飞世尔科技公司(thermo fisher scientific),l3000008)将萤火虫荧光素酶质粒与海肾荧光素酶对照报道基因质粒(10:1)共转染到24孔板中的小鼠胚胎干细胞(mesc)中。24小时后,执行荧光素酶测定系统(普洛麦格公司(promega)e1500)。细胞用pbs洗涤一次,并在室温下用被动裂解缓冲液(plb,100ul)轻轻搅拌裂解15min。将荧光素酶测定试剂ii(lar ii,100ul)分配到96孔光度计板中适当数量的孔中。照度计编程为执行2秒的预测量延迟,然后是每个报道基因测定的10秒测量周期。小心地将20μl细胞裂解液转移到含有lar ii的光度计板中,上下移液3次混合,然后测量萤火虫荧光素酶活性。从光度计上取下样品板,加入stop&glo试剂(100μl)并短暂涡旋混合。更换光度计中的样品,并测量海肾荧光素酶活性。萤火虫荧光素酶活性标准化为海肾荧光素酶活性,然后相对于含乱序对照基序的构建体来确定含banp基序的构建体的萤火虫荧光素酶活性的倍数增加。
[0130]
banp启动子的稳定基因组整合和荧光素酶报道基因测定
[0131]
将具有三个完整或乱序的banp基序的人工banp启动子-荧光素酶构建体稳定整合到mesc的β-珠蛋白基因座中。选择含有这些banp启动子中每一个的四个单独的克隆,并在执行荧光素酶测定系统(普洛麦格公司e1500)之前24小时铺板250,000个细胞。简而言之,
细胞在250μl1x plb中裂解,振荡孵育10min,然后转移到冰上管中。将细胞涡旋1秒,在室温下旋转沉降15秒,并将上清液转移到冰上的新管中。将细胞裂解液(20μl)一式两份等分到96孔板中,每孔加入100μl荧光素酶测定试剂,并将混合物上下移液三次。用光度计测量萤火虫荧光素酶信号,每孔1s,没有延迟。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。