1.本发明总体上涉及一种包含阿司匹林、扑热息痛和任选地扑热息痛辅助剂(例如,咖啡因)的药物组合物。更具体地,本发明涉及一种旨在提供活性组分的快速和/或增强释放的组合物。在一个方面,本发明进一步提供了一种显示出可接受的长期储存稳定性的组合物。
背景技术:
2.阿司匹林也称为乙酰水杨酸(asa),是一种众所周知的非甾体类抗炎药(nsaid)和解热活性成分。已知将阿司匹林与其他药物活性剂(例如,镇痛和解热剂扑热息痛(也称为n-乙酰基-对氨基苯酚、对乙酰氨基酚和apap)组合以提供镇痛/解热双组合产品。
3.市售的包含阿司匹林和扑热息痛(和有时包含咖啡因)的镇痛/解热组合产品的实例是由葛兰素史克消费者健康控股公司以商品名excedrin销售的产品。与仅包含单一nsaid的制剂相比,包含阿司匹林、扑热息痛和咖啡因的三组合的此类产品已被证明具有更好的功效和起效速度(goldstein j,,silberstein s.等人,headache 46(3),2006,p.444-453,doi:10.1111/j.1526-4610.2006.00376.x)。
4.wo2006/049978(novartis ag)公开了包含对乙酰氨基酚、咖啡因、阿司匹林以及用于增强吸收的碱性剂的组合物。根据wo2006/049978,将缓冲剂/碱性物质(例如碳酸盐、碳酸氢盐或其混合物)任选地连同药学上可接受的镁盐加入到含有镇痛/解热活性成分的制剂中,例如阿司匹林、对乙酰氨基酚和阿司匹林和/或对乙酰氨基酚与咖啡因的组合物中,提高了溶出度、加速了胃排空时间、并可能刺激胃肠道,以使镇痛/解热活性成分更迅速地吸收,并使镇痛/解热的起效时间缩短。此外,根据wo2006/049978,将碱性剂/抗酸剂,例如碳酸盐或碳酸氢盐、氧化物或氢氧化物加入到包含扑热息痛、阿司匹林和咖啡因的组合物中,加速扑热息痛和阿司匹林的血浆摄取,同时与不含碱性剂/抗酸剂的组合物生物等效。wo2006/049978还指出现有技术表明对于扑热息痛,较快的吸收速率带来镇痛作用的更快起效以及可能更大的峰值镇痛效果的临床益处。
5.如在wo2006/049978中所知晓的,必须防止碱性剂与酸性镇痛/解热活性成分反应以确保制剂的稳定性。为了隔开酸性镇痛/解热组分和碱性剂,其中所描述的单位剂型包括可以包装在双层袋中的粉末。可替代地,碱性剂可以包含在一个片剂或囊片中,而镇痛/解热组分可以包含在一个独立的片剂或囊片中。在一个实施方案中,阿司匹林和对乙酰氨基酚(扑热息痛)被配制在多层片剂或囊片的一层中,而碱性剂被配制在多层片剂或囊片的另一层中。保持组合物的酸性镇痛/解热组分不与碱性剂相互作用的另一种建议的方式是将酸性镇痛/解热组分放置在胶囊中并将胶囊插入至包含碱性剂的另一个胶囊中。可替代地,可将碱性剂放置在胶囊中并将胶囊插入至包含酸性镇痛/解热组分的另一个胶囊中。咖啡因可以存在于内部或外部胶囊中或分配在两个胶囊之间。替代一个胶囊在另一个胶囊内,剂型可以是一个片剂在一个胶囊内或一个片剂被压制在另一个片剂内。描述的关于保持组合物的酸性镇痛/解热组分不与碱性剂相互作用的另一种方式是包衣碱性剂、酸性镇痛/解
热组分或两者,从而在两者之间形成一道物理屏障,防止它们相互作用。
6.wo2006/049978提出的剂型是复杂的,因此可能导致较高的制造成本,并且给患者带来潜在的不便,从而导致依从性降低和对产品的总体不满意。
7.wo2007/118063涉及快速释放扑热息痛的产品并公开了包含扑热息痛、碳酸钙(caco3)和至少一种粘合剂和至少一种崩解剂作为颗粒形式中的颗粒内组分的药物组合物。该组合物满足关于对扑热息痛释放速率的特定溶出度测试的要求。配制该组合物以便在胃中快速崩解和溶出,从而促进扑热息痛快速吸收进入循环系统中。虽然wo2007/118063总体上考虑了包含阿司匹林的制剂,但没有具体公开如何配制包含阿司匹林、扑热息痛和碳酸钙的组合物。
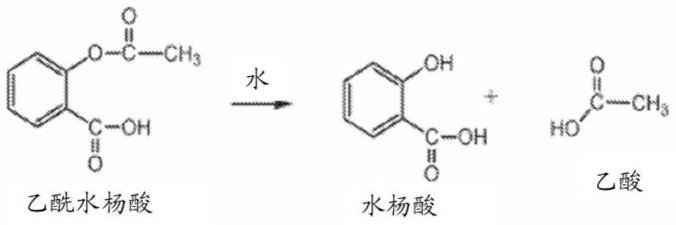
8.与阿司匹林的制剂相关的挑战之一是提供稳定的产品。阿司匹林容易水解降解,导致形成游离水杨酸和乙酸。阿司匹林水解分解为水杨酸和乙酸是由碱金属离子和碱土金属离子(例如,碳酸钙、碳酸钠和碳酸氢钠的阳离子)催化的:
[0009][0010]
水杨酸被认为是包含阿司匹林的药物产品中的杂质,并且在此类产品中它的存在超过一定水平是不被接受的。美国药典(usp)对于包含扑热息痛、阿司匹林和咖啡因的片剂的专论规定,作为接受标准,游离水杨酸的量不得超过片剂中阿司匹林的量的3%(参见,usp 40-nf 35,第二增补本)。此外,产生的第二种降解产物乙酸还具有明显且令人不悦的气味和味道,这对于药物产品(尤其是旨在口服摄入的药物产品)是不希望的。
[0011]
在本领域中持续需要含有扑热息痛和阿司匹林的组合物(任选地包含咖啡因)的口服剂型,其提供快速达到活性组分(扑热息痛和阿司匹林)的最大血药浓度,以及治疗效果快速起效的更大前景。在另一方面,仍然需要提供稳定的组合物。
技术实现要素:
[0012]
本发明的方面提供了一种合适地为吞咽片剂形式的药物组合物,其包含特定颗粒内和颗粒外组分。现已令人惊讶地发现,通过将扑热息痛与粘合剂和特定颗粒尺寸的碳酸钙一起配制为颗粒内组分,并将阿司匹林和亲水胶体配制成颗粒外组分,可以提供一种表现出期望特性(例如,改善的溶出性质)的组合物。根据本发明的组合物制造经济并且足够稳健,从而能够承受包装、运输和处理操作。根据本发明的组合物可以作为压制片剂或作为包封在硬壳(例如,明胶壳)中的自由流动的颗粒口服施用。当为片剂(例如,吞咽片剂)形式时,片剂可以是包衣的或未包衣的。
[0013]
有利地,与wo2006/049978中公开的组合物不同,根据本发明的组合物中不需要将碳酸钙(碱性剂)与阿司匹林(酸性镇痛/解热组分)物理隔离。
[0014]
本发明在一个方面提供了一种药物组合物,其包含颗粒内和颗粒外组分,其中所述颗粒内组分包含药学有效量的扑热息痛、以具有d50大于11μm的颗粒形式提供的碳酸钙
和至少一种粘合剂,并且其中所述颗粒外组分包含药学有效量的阿司匹林和至少一种亲水胶体。
[0015]
本发明在一个方面提供了一种片剂形式的药物组合物,其包含颗粒内和颗粒外组分,其中所述颗粒内组分包含药学有效量的扑热息痛、以具有d50大于11μm的颗粒形式提供的碳酸钙和至少一种粘合剂,并且其中所述颗粒外组分包含药学有效量的阿司匹林和至少一种亲水胶体。所述片剂可以任选地包含薄膜包衣。
[0016]
本发明的方面进一步涉及此类组合物用于治疗疼痛的用途。
附图说明
[0017]
图1:活性药物成分(api)赋形剂相容性研究
[0018]
图2:在长期研究条件(25℃,60%rh)下,碳酸钙的颗粒尺寸和阿司匹林的级别对水杨酸形成的影响
[0019]
图3:在加速研究条件(40℃,75%rh)下,碳酸钙的颗粒尺寸和阿司匹林的级别对水杨酸形成的影响
[0020]
图4:比较溶出度研究
具体实施方案
[0021]
出于本文的目的,提及“稳定的”组合物是指表现出药学上可接受的储存稳定性的组合物,其合适地与具有期望货架期(通常为至少一或两年)的商业产品所需的储存稳定性相当。本发明在一个方面提供了一种组合物,其中在40摄氏度(℃)和75%相对湿度(rh)下储存6个月后,组合物中游离水杨酸的量不超过阿司匹林的初始量的3%。
[0022]
如本文所用的溶出度是通过测量在规定溶出条件下在规定时间后在溶液中发现的组分的百分比来测定。
[0023]“规定溶出条件”是指使用以30转/分钟(rpm)旋转的usp桨装置,采用在37℃的900ml的0.05m hcl作为溶出介质的溶出测试方法。在作为规定时间的6分钟时测定溶解于溶出介质中的化合物的百分比量。
[0024]“溶出时间”是组分在溶出介质中溶出所需的时间。
[0025]
出于本文的目的,“快速释放”意指在规定溶出条件下,按重量计至少60%(例如按重量计至少70%或按重量计至少80%)的化合物从组合物中溶出。
[0026]
出于本文的目的,“增强释放”意指在规定溶出条件下,更高百分比量的化合物从根据本发明的组合物中溶出。出于本文的目的,“增强释放”意指与相同条件下的对照组合物相比,在规定溶出条件下于规定时间范围内,至少2倍(例如,至少3倍或至少4倍)量的化合物从组合物中溶出。在一个实施方案中,该化合物是阿司匹林。对照组合物包含相同量的阿司匹林,但不包含碳酸钙和亲水胶体。
[0027]
出于本文的目的,当以颗粒形式用于药物组合物中时,组分被称为“颗粒内”、“存在于颗粒内”或“颗粒内组分”。
[0028]
用于本发明的颗粒通过使颗粒内组分经过制粒方法来制备,例如如wo2007/118063中所描述的。
[0029]
众所周知的制粒方法包括湿法制粒和干法制粒。在一个实施方案中,颗粒内组分
通过湿法制粒来制粒。湿法制粒包括以下步骤:混合干燥的颗粒内组分,使由此获得的混合物与制粒粘合剂接触以产生粒状物,由该粒状物形成颗粒,干燥由此获得的湿颗粒以获得希望的残留水分含量的粒状物。显然,在该实施方案中采用湿法制粒作为制粒方法,一定残留含量的制粒粘合剂也作为颗粒内组分存在,并且因此存在于总组合物中。通常,制粒粘结剂是溶剂(例如,水、水性溶剂或有机溶剂)。在水性湿法制粒的情况下,该制粒粘合剂是水或水性溶剂。在一个实施方案中,颗粒内组分通过水性湿法制粒来制粒。令人惊讶地,已经发现尽管在本发明的一些实施方案中可能存在残留水,但阿司匹林(存在于颗粒外)的稳定性没有受到损害。可以通过本领域已知的任何干燥技术(例如,在间歇干燥烘箱、连续干燥烘箱或流化床干燥器中干燥)实现将颗粒和粒状物干燥至希望的残留水分含量。为了实现粒状物的均匀颗粒尺寸分布,可将粒状物通过合适筛目尺寸的筛子进行过筛,并可将残留物研磨并再次筛分。由此获得的颗粒可以随后进一步加工。
[0030]
根据本发明,颗粒内组分包含药学有效量的扑热息痛、以具有d50大于11μm的颗粒形式提供的碳酸钙和至少一种粘合剂。颗粒内组分可以进一步包含一种或多种另外的组分(例如一种或多种另外的活性药物成分(api)和药学上可接受的赋形剂,例如填充剂、膨胀剂、崩解剂、稀释剂、甜味剂、润滑剂、助流剂、流动助剂、压制助剂、着色剂、防腐剂、润湿剂、粘结剂或溶剂)。
[0031]
出于本文的目的,当存在于药物组合物中所述粒状物之外时,组分被称为“颗粒外”、“存在于颗粒外”或“颗粒外组分”。在形成本发明的药物组合物的过程中,将颗粒外组分与粒状物混合。
[0032]
根据本发明,颗粒外组分包含药学有效量的阿司匹林、至少一种亲水胶体和任选地咖啡因。颗粒外组分可以进一步包含一种或多种另外的组分(例如一种或多种另外的api和药学上可接受的赋形剂,例如填充剂、膨胀剂、粘合剂、崩解剂、稀释剂、甜味剂、润滑剂、助流剂、流动助剂、压制助剂、着色剂、防腐剂、润湿剂、粘合剂或溶剂)。
[0033]
扑热息痛
[0034]
根据本发明的药物组合物包含药学有效量的扑热息痛作为颗粒内组分。“药学有效量”应理解为能够在人类受试者中实现生物应答(即药理学作用)的api(例如扑热息痛)的量。实现此类作用所需的api的量对于不同的api是不同的,也因人类受试者个体而变化。即使在一个人类受试者中,实现药理学作用所需的量在不同的时间点也可变化(例如在进食状态和禁食状态之间)。取决于人类受试者,实现药理学作用所需的量可以更高(例如对于成人、体型较大的人、具有急性症状的人或当预计短期摄入时)或更低(例如对于儿童、老年人或当预计长期摄入时)。
[0035]
合适地,扑热息痛的药学有效量是100mg至1000mg/单位剂型(例如,每片)的量,例如50mg至500mg,例如250mg/单位剂型(例如,每片)的量。合适地,扑热息痛在根据本发明的组合物中以按组合物的重量计高达50%的量存在。在一个实施方案中,扑热息痛在药物组合物中以按组合物的重量计20%至50%的量存在。在一个实施方案中,扑热息痛在药物组合物中以按组合物的重量计25%至45%的量存在。在一个实施方案中,扑热息痛在药物组合物中以按组合物的重量计30%至40%的量存在。在一个实施方案中,扑热息痛在药物组合物中以按组合物的重量计31%至38%的量存在。
[0036]
扑热息痛辅助剂
[0037]
在一个方面,根据本发明的药物组合物进一步包含扑热息痛辅助剂。扑热息痛辅助剂可以作为颗粒内或颗粒外组分存在。在一个实施方案中,扑热息痛辅助剂是咖啡因。在一个实施方案中,咖啡因作为颗粒外组分存在。合适地,扑热息痛辅助剂(例如咖啡因)以15mg至250mg,例如30mg至150mg,例如65mg/单位剂型(例如,每片)的量存在。
[0038]
在一个实施方案中,扑热息痛辅助剂(例如咖啡因)以按组合物的重量计1%至20%,例如4%至15%的量存在。在一个实施方案中,扑热息痛辅助剂(例如咖啡因)以按组合物的重量计7%至11%的量存在。在一个实施方案中,颗粒外组分包含咖啡因、阿司匹林和预胶化淀粉的共混物。
[0039]
阿司匹林
[0040]
根据本发明的药物组合物包含作为颗粒外组分存在的药学上可接受级别的阿司匹林。市售级别的阿司匹林通常较粗,并且它们的颗粒尺寸合适地以筛目尺寸进行表征,意指阿司匹林通过具有特定筛目尺寸的筛子筛分,以使只有具有至少直径小于该筛目尺寸的颗粒通过该筛子。测定的“筛目”或“筛目尺寸”是在本领域中用来表征具有不均匀形状的较粗或颗粒状产品的颗粒尺寸的术语。所获得的值可以例如以“标准筛目”或“筛目号”表示。如本文所提及的,筛目号是指美国标准筛目号。例如,以“筛目号”或“筛目30”表征的产品仅包含通过美国标准筛目30(其被定义为具有600μm的孔径)的颗粒。
[0041]
对应于较小颗粒的精细级别的颗粒组分通常优选用于快速溶解的片剂,因为此类片剂通常显示更好的润湿性能,导致更快的崩解和更短的溶出时间。然而,本发明人发现,当配制包含阿司匹林、碳酸钙和扑热息痛的片剂组合物时,可能不希望使用精细级别的阿司匹林。本发明人发现,精细级别的阿司匹林导致阿司匹林降解的适度增加,而当使用较粗糙级别的阿司匹林(例如以20、30或40筛目号表征)时,则没有发现相同的情况。
[0042]
在一个实施方案中,本发明的组合物包含具有颗粒尺寸为20至40筛目,例如30至40筛目,例如40筛目的阿司匹林。筛目尺寸可与以下颗粒尺寸分布相关:
[0043]
因此,在一个实施方案中,用于本发明的阿司匹林以颗粒形式提供,其中至少70%的阿司匹林颗粒具有180μm至850μm范围内的颗粒尺寸分布。在另一个实施方案中,用于本发明的阿司匹林以颗粒形式提供,其中至少60%的阿司匹林颗粒具有420μm至850μm范围内的颗粒尺寸分布。在另一个实施方案中,用于本发明的阿司匹林以颗粒形式提供,其中至少85%的颗粒具有105μm至420μm的颗粒尺寸分布。
[0044]
合适地,本发明中使用的阿司匹林的药学有效量是25mg至2500mg,例如150mg至500mg,例如250mg的量/单位剂型(例如,每片)。在一个实施方案中,阿司匹林以按组合物重量计10%至60%的量存在于药物组合物中。在一个实施方案中,阿司匹林以按组合物重量计20%至50%的量存在于药物组合物中。在一个实施方案中,阿司匹林以按组合物重量计30%至40%的量存在于药物组合物中。在一个实施方案中,阿司匹林以按组合物重量计
32%至38%的量存在于药物组合物中。
[0045]
碳酸钙
[0046]
根据本发明的药物组合物包含特定颗粒尺寸分布的碳酸钙作为颗粒内组分。合适地本发明使用的碳酸钙是沉淀碳酸钙。
[0047]
最广泛使用的描述颗粒尺寸分布的方法之一是通过百分位数或“d”值描述。d10、d50和d90值是对应于10%、50%和90%的累积分布的颗粒尺寸值。取决于使用的方法,分布基于数量、质量或体积。
[0048]
如本文所用,术语“d10”是指以微米计的尺寸,以体积计10%的颗粒的尺寸低于该尺寸。
[0049]
如本文所用,“d50”,也称为中值或中值直径,是指以微米计的尺寸,以体积计50%的颗粒的尺寸高于或低于该尺寸。
[0050]
如本文所用,术语“d90”是指以微米计的尺寸,以体积计90%的颗粒的尺寸低于该尺寸。
[0051]
在本发明中,d10、d50和d90值被报告为通过激光衍射法,例如使用激光衍射颗粒尺寸分析仪(例如,malvern mastersizer 2000)测量的基于体积的颗粒直径。应理解,碳酸钙的颗粒尺寸值是指在与根据本发明的组合物的其他组分配制之前的颗粒尺寸。
[0052]
本文使用的碳酸钙具有大于11μm的d50。在一个实施方案中,碳酸钙具有11μm至30μm或12μm至25μm的d50。在一个实施方案中,碳酸钙具有14μm至20μm的d50。在进一步的实施方案中,碳酸钙具有15μm至18μm的d50。
[0053]
合适地,碳酸钙颗粒具有d50大于11μm和d90小于60μm,例如小于50μm或小于45μm的颗粒尺寸分布范围。在一个实施方案中,碳酸钙颗粒具有d50为11μm至30μm和d90小于60μm,例如小于50μm或小于45μm。在一个实施方案中,碳酸钙颗粒具有d50为12μm至25μm和d90小于60μm,例如小于50μm或小于45μm。在一个实施方案中,碳酸钙颗粒具有d50为14μm至20μm和d90小于60μm,例如小于50μm或小于45μm。在进一步的实施方案中,碳酸钙颗粒具有d50为15μm至18μm和d90小于60μm,例如小于50μm或小于45μm。
[0054]
在一个实施方案中,碳酸钙颗粒具有d50为11μm至30μm和d90小于60μm,例如小于50μm或小于45μm和d10小于10μm,例如小于5μm。在一个实施方案中,碳酸钙颗粒具有d50为12μm至25μm和d90小于60μm,例如小于50μm或小于45μm和d10小于10μm,例如小于5μm。在一个实施方案中,碳酸钙颗粒具有d50为14μm至20μm和d90小于60μm,例如小于50μm或小于45μm和小于10μm,例如小于5μm。在进一步的实施方案中,碳酸钙颗粒具有d50为15μm至18μm和d90小于60μm,例如小于50μm或小于45μm,和d10小于10μm,例如小于5μm。
[0055]
不受特定理论的束缚,据信在胃的酸性环境中,颗粒内碳酸钙与颗粒外亲水胶体反应,并且与由碳酸钙产生的二氧化碳组合,促进形成具有增加的表面积的精细颗粒悬浮液,导致溶出增强。
[0056]
在本文使用的特定溶出条件下,阿司匹林和扑热息痛以及咖啡因在根据本发明的组合物中的溶出特性相对于对照组合物得到改善。
[0057]
在一个实施方案中,根据本发明的组合物表现出阿司匹林、扑热息痛和咖啡因中至少一种的增强释放。在一个实施方案中,根据本发明的组合物表现出扑热息痛和咖啡因中至少一种的快速释放。
[0058]
合适地,碳酸钙以按组合物的重量计0.5%至10%,例如按组合物的重量计1%至8%的量存在。在一个实施方案中,碳酸钙以按组合物的重量计高达6%的量存在,例如按组合物的重量计2%至5%的范围内的量存在。令人惊讶地,仅掺入少量的适当颗粒尺寸的碳酸钙与不含碳酸钙的组合物相比可以改善扑热息痛和阿司匹林的溶出特性。
[0059]
然而,如本领域已知的,碳酸钙与阿司匹林共同配制会不利地影响阿司匹林的稳定性。本发明人惊讶地发现,通过使用具有d50大于11μm的碳酸钙作为颗粒内组分和通过使用阿司匹林作为颗粒外组分可以改善阿司匹林的稳定性。不同级别的阿司匹林(较粗相比于精细)的影响不超过在包含具有d50小于11μm的碳酸钙的组合物中观察到的阿司匹林降解的增加。
[0060]
粘合剂
[0061]
根据本发明的药物组合物包含至少一种粘合剂。在一个实施方案中,粘合剂仅在颗粒内存在。在一个实施方案中,粘合剂在颗粒内和颗粒外存在。
[0062]
合适的粘合剂包括本领域中使用的常规粘合剂,例如wo 2007/118063中所描述的。在一个实施方案中,粘合剂是淀粉、聚合物、纤维素衍生物或其两种或更多种的组合。合适地,粘合剂以按组合物的重量计0.5%至20%,例如1%至15%的量存在。
[0063]
合适的淀粉的实例包括玉米(或玉蜀黍)淀粉、改性玉米淀粉、小麦淀粉、改性小麦淀粉、马铃薯淀粉或预胶化淀粉,例如市售的starch 1500g或prejel;或其两种或更多种的组合。在一个实施方案中,粘合剂包含预胶化淀粉。
[0064]
预胶化淀粉是已经化学和/或机械处理过的淀粉。通常,预胶化淀粉包含5%的游离淀粉酶、15%的游离支链淀粉和80%的未改性淀粉。预胶化淀粉可以从玉米(或玉蜀黍)、马铃薯或大米淀粉获得。
[0065]
在一个实施方案中,粘合剂包含以按组合物的重量计1%至20%,例如5%至15%的量存在的预胶化淀粉。在一个实施方案中,粘合剂包含以按组合物的重量计1%至10%,例如3%至8%的量存在于颗粒内的预胶化淀粉,和以按组合物的重量计以1%至10%,例如4%至8%的量存在于颗粒外的预胶化淀粉。
[0066]
在一个实施方案中,粘合剂包含聚合物,其选自聚维酮(pvp)、聚乙烯醇(pva)、聚环氧乙烷、泊洛沙姆、聚甲基丙烯酸酯、卡波姆、聚乙二醇和聚卡波非钙或其两种或更多种的组合。在一个实施方案中,该聚合物包含聚维酮。在一个实施方案中,聚维酮存在于颗粒内。合适地,聚维酮包含约30,000的分子量。
[0067]
合适地,当存在时,聚合物以按组合物的重量计0.01%至5%,例如0.05%至0.5%的量存在。在一个实施方案中,聚合物包含以按组合物的重量计0.01%至5%的量存在于颗粒内的聚维酮。
[0068]
合适的纤维素衍生物的实例包括羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)、微晶纤维素(mcc)、羧甲基纤维素(mc)、羧甲基乙基纤维素钠及其两种或更多种的组合。在一个实施方案中,纤维素衍生物包括微晶纤维素,例如硅化微晶纤维素。在一个实施方案中,微晶纤维素存在于颗粒外。
[0069]
合适地,当存在时,纤维素衍生物以按组合物的重量计0.2%至8%,例如1%至15%的量存在。在一个实施方案中,纤维素衍生物包含以按组合物的重量计0.2%至8%的量存在于颗粒外的微晶纤维素。
[0070]
亲水胶体
[0071]
根据本发明的药物组合物包含亲水胶体,也称为水胶体。合适地,亲水胶体以颗粒外的形式存在于组合物中。合适的亲水胶体的实例包括海藻酸、角叉菜胶、结冷胶、果胶和琼脂。在一个实施方案中,亲水胶体是海藻酸。
[0072]
海藻酸,也称为褐藻酸(algin)或海藻酸盐(alginate),是通过碱抽提从某些褐色海藻(褐藻纲)中分离的亲水或阴离子多糖。它存在于藻类的细胞壁中,当与水结合时形成粘性凝胶。海藻酸是由l-葡糖醛酸和d-甘露糖醛酸残基通过1,4-糖苷键连接组成的直链聚合物。
[0073]
合适地,亲水胶体可以以按组合物的重量计0.1%至10%的量使用。在一个实施方案中,亲水胶体是以按组合物的重量计0.7%至5%的量存在的海藻酸。
[0074]
薄膜包衣
[0075]
当根据本发明的组合物是片剂形式时,它可以是包衣的或未包衣的。在一个实施方案中,根据本发明的组合物是薄膜包衣的片剂。合适地,薄膜包衣是透明的薄膜包衣,例如染料,尽管也可以使用不透明薄膜包衣,例如当将薄膜包衣与遮光剂或颜料(例如二氧化钛或色淀)组合使用时获得的不透明薄膜包衣。例如,一种市售的薄膜包衣是来自colorcon的opadry包衣系统。
[0076]
薄膜包衣通常用于增强适口性和产品外观并降低片剂的脆碎度和尘污。这对于扑热息痛片是期望的,因为扑热息痛的味道非常苦,因此可导致低的适口性和患者接受度。然而,本发明人已经发现包含阿司匹林的片剂的水性薄膜包衣可对阿司匹林的长期储存稳定性具有负面影响。不受任何特定理论的束缚,据信薄膜包衣中存在的残留水、以及在薄膜形成和干燥期间暴露于高温,会潜在地加速阿司匹林的水解降解。
[0077]
尽管存在该问题,根据本发明的储存稳定的薄膜包衣片剂可以通过使用具有总累积量不超过按组合物的重量计2%、例如按组合物的重量计0.3%至2%、例如按组合物的重量计0.3%至1.5%的薄膜包衣来实现。在一个实施方案中,组合物包含薄膜包衣片剂,其中薄膜包衣的量为按组合物的重量计0.3%至1.5%。
[0078]
在一个方面,控制包衣时间(即应用和干燥薄膜包衣所需的时间)并将其保持在最低值。例如,对于其中薄膜包衣的总组成为按组合物的重量计0.3%或2%的组合物,包衣时间分别不超过15分钟或1小时。
[0079]
崩解剂
[0080]
根据本发明的药物组合物可以进一步包含崩解剂。当存在时,崩解剂可存在于颗粒内、颗粒外或颗粒内和颗粒外两者。用于本发明的崩解剂合适地为常规崩解剂、超级崩解剂或两者的组合。超级崩解剂代表一类崩解剂,与常规崩解剂相比,其通常可以以较低的量用于药物组合物中。
[0081]
合适的常规崩解剂的实例包括淀粉、玉米淀粉、预胶化淀粉、微晶纤维素、纤维素和纤维素衍生物。
[0082]
常规崩解剂可以以按组合物的重量计以5%至30%的量存在,合适地以按组合物的重量计8%至20%的量存在。
[0083]
合适的超级崩解剂的实例包括羟基乙酸淀粉钠、羧甲基淀粉的钠盐、改性纤维素例如羧甲基纤维素的钠盐和交联聚乙烯吡咯烷酮(例如,交联聚维酮)。在一个实施方案中,
崩解剂包含超级崩解剂,其是交联聚乙烯吡咯烷酮。在一个实施方案中,超级崩解剂存在于颗粒内和颗粒外。
[0084]
超级崩解剂可以以按组合物的重量计0.05%至2%,例如0.1%至1%的量于颗粒内使用。超级崩解剂可以以按组合物的重量计0.05%至2.0%,例如0.5%至1.5%的量于颗粒外使用。在一个实施方案中,超级崩解剂是可以以按组合物的重量计0.05%至1%的量存在于颗粒内和以0.05%至1.5%的量存在于颗粒外的交联聚乙烯吡咯烷酮。
[0085]
本领域公认一些赋形剂是多功能的。因此,相同的赋形剂可以在组合物中发挥不止一种作用,例如给定的赋形剂可以作为粘合剂和作为崩解剂两者发挥功能。例如,包括预胶化淀粉的淀粉可以用作粘合剂和崩解剂。如果在组合物中掺入另外具有崩解剂功能的粘合剂,则不需要掺入另外的崩解剂。同样地,如果掺入另外具有粘合剂功能的崩解剂,则不需要掺入另外的粘合剂。因此,在一个实施方案中,崩解剂和粘合剂是同一种赋形剂。
[0086]
另外的组分
[0087]
其他药学上可接受的组分包括染料;着色剂;香料;压制助剂;防腐剂;润湿剂;膨胀剂;粘结剂;甜味剂;润滑剂(例如硬脂酸镁、硬脂酸钙、硬脂酸钠、硬脂酸或滑石);和流动助剂或助流剂如胶体二氧化硅(cab-o-sil,syloid
tm
)。合适地,当存在时,润滑剂或流动助剂各自以按组合物的重量计0.1%至5.0%的量使用。应认识到另外的药学上可接受组分可作为颗粒内组分以及颗粒外组分存在。
[0088]
合适地,将颗粒内组分混合并随后制粒以形成粒状物。随后,将粒状物与颗粒外组分混合。在一个实施方案中,粒状物包含以下(总组合物的%w/w):
[0089]
30%至40%扑热息痛
[0090]
2%至8%预胶化淀粉
[0091]
0.05%至0.2%聚维酮
[0092]
2%至6%碳酸钙
[0093]
0.1%至1%交联聚维酮
[0094]
适量水
[0095]
在一个实施方案中,颗粒外组分包含以下(总组合物的%w/w):
[0096]
30%至40%阿司匹林
[0097]
5%至10%预胶化淀粉
[0098]
0.1%至2%海藻酸
[0099]
5%至10%咖啡因
[0100]
合适地,阿司匹林、咖啡因和预胶化淀粉的混合物可以进一步与余下的颗粒外组分混合,随后与粒状物混合。可替代地,所有颗粒外组分同时与粒状物混合,随后压制以形成片剂(如果片剂是所需的剂型)。在一个实施方案中,本发明的组合物是片剂形式。在一个实施方案中,组合物是单层吞咽片剂形式。
[0101]
本发明的组合物可以通过本领域已知的压片方法制备。例如,片剂可以采用配备有约17.5
×
7.5mm的细长形工具的压片机,根据以下规格来制备:
[0102]
表1:片剂压制规格
[0103] 规格值重量(mg)730mg
±
18mg
硬度9-16kp脆碎度不超过1%w/w
[0104]
以下实施例是对本发明的说明,不应理解为限制性的。
[0105]
实施例1
[0106]
api赋形剂相容性研究
[0107]
活性药物成分(api)阿司匹林和赋形剂碳酸钙的相容性使用药物赋形剂相容性研究进行评估。
[0108]
颗粒尺寸分析
[0109]
使用三种市售级别的碳酸钙,并使用激光衍射法测定它们的颗粒尺寸分布。用于实验的不同级别的碳酸钙是scoralite ll250(可购自scora s.a.s,rue de i'usine,62132caffiers,france)、sturcal m(可购自alpha house,lawnswood business park,redvers close,leeds,ls16 6qy)和calessence 450pcc(可购自specialty minerals inc.,35highland avenue,bethlehem,pa 18017,usa)。这些不同的市售级别的碳酸钙的中值直径d50是使用malvern mastersizer 2000颗粒尺寸分析仪,采用hydro 2000s湿样品分散单元和以下参数测定的:
[0110][0111]
颗粒尺寸分析的结果显示在表2中。d50意指颗粒尺寸分布d50值,也称为颗粒尺寸分布的中值直径或中值,它是使用激光衍射法使用颗粒尺寸分析仪测定在累积体积分布中50%处的颗粒直径的值。d10是在累积体积分布中10%处的对应值,并且d90是在累积体积分布中90%处的对应值。
[0112]
表2:颗粒尺寸分析结果
[0113]
caco3的级别d10d50d90scoralite ll2502.910μm16.799μm39.709μmsturcal m2.691μm10.674μm20.019μm
calessence 450pcc1.002μm5.281μm12.114μm
[0114]
样品制备
[0115]
通过将阿司匹林和碳酸钙以按重量计1∶0.5混合并将规定量的混合物转移到玻璃小瓶中来制备样品。使用中值直径(d50)不同的精细级别(calessence 450pcc)和较粗级别(scoralite ll250)的碳酸钙。此设置用于测定碳酸钙的颗粒尺寸分布对阿司匹林降解为水杨酸的影响。所使用的阿司匹林是较粗级别的,颗粒尺寸以通过使用美国标准筛目号为30的筛子过筛来表征。制备具有如表3中提供的组成详情的制剂f1、f2和f3。对于每种制剂,制备两个样品,其中一个用盖子密封,而另一个小瓶保持敞口。制剂1是不含任何碳酸钙的对照样品。
[0116]
表3:药物赋形剂相容性研究的组成详情
[0117][0118]
方法
[0119]
使样品经受40℃温度和75%相对湿度(rh)的加速稳定性研究条件持续30天的研究期。在第0天和第30天,分析样品中水杨酸的含量。将水杨酸含量与样品中阿司匹林的初始量关联,并以%表示,其描述了在研究期间降解为水杨酸的阿司匹林的量。
[0120]
结果
[0121]
该研究的结果显示于下表4和图1中。
[0122]
表4:api赋形剂相容性研究的结果
[0123][0124]
与f1的对照样品相比,f2和f3的样品显示降解增加,说明碳酸钙对阿司匹林稳定性的有害影响。阿司匹林的水解通过在敞口小瓶条件下储存进一步增加,其中样品经受40℃温度和75%相对湿度(rh)。f3和f2的比较结果揭示了碳酸钙的平均颗粒尺寸的显著影响。在40℃和75% rh中于密封小瓶条件下,f3的样品中在30天的研究期间降解为水杨酸的
阿司匹林的量是f2的样品中的两倍。这种差异在敞口小瓶条件下被放大,其中f3样品中68%的阿司匹林降解为水杨酸,这比f2样品中表观降解的六倍还多。
[0125]
实施例2
[0126]
稳定性研究
[0127]
采用不同平均颗粒尺寸的碳酸钙和不同筛目号的阿司匹林生产六批样品片剂。这些片剂经受加速(40℃,75% rh)和长期(25℃,60% rh)稳定性测试条件,以评估在6个月的研究期间参数对阿司匹林降解为水杨酸的影响。
[0128]
研究片剂的制备
[0129]
研究片剂的批次由具有下表5(组成详情)和表6(碳酸钙的平均颗粒尺寸和阿司匹林的筛目号)中所提供的组成详情的制剂f4-f9生产:
[0130]
表5:研究片剂的组成详情
[0131][0132]
opadry ii 57u18539
*
0.300.300.300.300.30
‑‑
opadry ii 57u510001
*
‑‑‑‑‑‑‑‑‑‑
2.74纯化水q.s.q.s.q.s.q.s.q.s.q.s.
[0133]
*相对于片芯重量的包衣增重(%)
[0134]
q.s.=适量
[0135]
表6:制剂f4-f9中使用的碳酸钙和阿司匹林的级别:
[0136][0137]
f4-f9片剂的制备方法如下:
[0138]
部分a:将颗粒内组分,即扑热息痛、颗粒内预胶化淀粉、聚维酮-k25、碳酸钙和交联聚维酮通过筛子过筛并在快速混合制粒机中混合。向该混合物中加入纯化水适量(q.s.)以形成粒状物。将所得粒状物湿磨,随后在流化床干燥器中干燥。将该干燥的粒状物过筛,并研磨筛上截留的过大尺寸颗粒,得到均匀颗粒尺寸的干燥粒状物。将该粒状物与海藻酸和胶体二氧化硅混合并在共混机中使用硬脂酸润滑。然后将所得部分a共混物转移至合适的共混机中。
[0139]
部分b:将咖啡因、颗粒外预胶化淀粉和硅化微晶纤维素过筛并加载至部分a共混物上。将阿司匹林通过合适的筛子过筛并加载到同一共混机中。将成分在共混机中共混合
适的时间。加入另外的硬脂酸用于润滑,然后将所得混合物共混合适的时间以形成主共混物。
[0140]
压制:使用约17.5
×
7.5mm的囊片冲压机将主共混物压制为约730mg的片剂。
[0141]
水性薄膜包衣:将所得片剂(片芯)在合适的穿孔包衣锅中用指定的成膜系统和纯化水进行薄膜包衣,直至达到指定的0.3%w/w或2.74%w/w的片芯增重。
[0142]
包装:将包衣片剂包装在具有干燥剂的高密度聚乙烯(hdpe)瓶中并密封。
[0143]
使所得样品经受加速和长期稳定性研究条件持续1、3和6个月的研究期。加速研究的研究条件为40℃的温度和75% rh,长期稳定性研究的研究条件为25℃的温度和60% rh。在第0天、3个月后和6个月后分析水杨酸含量,并与样品中阿司匹林的初始含量关联且以百分比表示,描述了在研究期间降解为水杨酸的阿司匹林的量。研究结果如表7和图2和3所示。
[0144]
结果
[0145]
表7:稳定性研究结果
[0146][0147]
在图2中,包含具有16.8μm的d50的碳酸钙的制剂显示水杨酸的含量最低,因此阿司匹林在所有三个分析时间点上具有最有益的稳定性。在25℃/60% rh下储存后,所有制剂在6个月后的水杨酸含量均低于usp的阈值,即3%。
[0148]
在图3中,在加速稳定性研究条件下,包含具有10.67μm的d50或更小尺寸的碳酸钙的三种制剂显示不令人满意的大于3%的水杨酸含量。令人惊讶地发现,不同级别的阿司匹林的影响不超过在包含具有10.67μm的d50或更小尺寸的碳酸钙的制剂中观察到的阿司匹林的降解的增加。包含16.8μm的d50的碳酸钙的制剂f7和f8在6个月后显示小于3%的水杨酸形成。结果表明,对于包含碳酸钙和阿司匹林的组合物,当与特定颗粒尺寸的碳酸钙配制时,阿司匹林的稳定性令人惊讶地改善。
[0149]
制剂f8和f9具有相同的片芯组成,但应用于片芯的薄膜包衣的量不同。f8片芯包
衣至按片芯的重量计0.3%的增重,而f9具有包衣至按片芯的重量计2.7%的片芯。当经受6个月的加速稳定性条件时,f8显示水杨酸水平低于3%,而制剂f9水杨酸水平超过3%(图3)。令人感兴趣地发现,f7和f8在经受长期稳定性条件后显示可忽略不计的阿司匹林降解(图2)。不受特定理论的束缚,据信在长时间的水性包衣过程中,片芯中扩散和截留的水分是阿司匹林降解的原因。该水分的影响在加速研究条件下被放大。这一结果导致观察到片芯上的薄膜包衣的量和薄膜包衣过程也可能对阿司匹林的稳定性具有影响。
[0150]
实施例3
[0151]
溶出度研究
[0152]
进行溶出度研究以评估三种api在测试制剂中的溶出度并与市售产品的溶出度进行比较。
[0153]
样品制备
[0154]
使用制剂f9和如实施例2中所描述的制备方法生产测试片剂。作为对照片剂,使用以名称“excedrin extra strength”销售的市售产品,其包含相同量的扑热息痛、阿司匹林和咖啡因中的每一种,但不包含碳酸钙或任何碱性剂。
[0155]
使用以30rpm旋转的usp ii桨装置,采用在37℃的900ml的0.05m hcl作为溶出介质进行溶出度研究。在6分钟时测定溶解的api的百分比。该方法和条件被认为对所测试片剂的体内性能具有辨别性和预测性。在相同量的溶出介质中使用一片和两片片剂进行研究,以评估半剂量和单剂量情况下的溶出度。通过关联在6分钟时由测试片剂中释放的api的量与由对照片剂中释放的api的量,来计算测试片剂与对照片剂之间的释放差异。
[0156]
溶出度研究的结果提供于下表8和图4中。
[0157]
表8:溶出度研究的结果
[0158][0159]
结果显示,与包含相同api和剂量的当前市售产品相比,制剂f9具有优异的溶出特性。获得了所需的扑热息痛的快速释放。与不含碳酸钙的对照片剂的释放相比,从测试片剂中释放出3.5倍(一片)和4倍(两片)的扑热息痛。令人惊讶地发现,与对照制剂相比,测试制剂f9另外显示出阿司匹林的释放增加和咖啡因的快速释放。
[0160]
预期所有三种api在6分钟时显著较高的释放预示体内相对快速的药物释放。f7和f8与f9的不同之处在于对一些颗粒外组分的量进行了可忽略的调整,主要在于薄膜包衣的量,其在f7和f8中仅为按片芯的重量计0.3%,而在f9中为按片芯的重量计2.74%。因此,预期制剂f7和f8表现出与f9观察到的类似的快速溶出。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。