1.本发明涉及生物医药技术领域,特别涉及基于细菌生物被膜的肿瘤治疗工程菌及其构建方法和应用。
背景技术:
2.癌症已成为威胁人类生命健康最主要的疾病之一,传统的治疗方法,包括放疗、化疗、手术及靶向性药物等,存在靶向不完全、组织穿透性不足或细胞毒性等缺陷从而阻碍治疗效果,导致复发率和死亡率的增加。
3.研究表明,多种细菌具有较强的侵入和在实体肿瘤内定植的能力,同时还能产生毒素,从而抑制肿瘤的生长。沙门氏菌已被证明在肿瘤中会优先富集,它们在肿瘤组织内的定植浓度是正常组织的1000倍,同时它们还能产生各种毒素,破坏细胞信号,从而抑制肿瘤的生长。铜绿假单胞菌产生的s2对肿瘤细胞hepg2有明显的细胞毒性作用,而对正常细胞无影响。肿瘤靶向细菌除了具有直接的抗癌作用外,还可以修饰为药物载体,产生直接杀伤细胞的蛋白,通过信号通路诱导细胞凋亡,刺激免疫系统产生抗肿瘤作用。例如,沙门氏菌株(减毒,营养不良菌种)已被用作肿瘤内各种细胞因子表达的载体,导致肿瘤生长迟缓,在某些情况下,可以完全清除肿瘤。
4.虽然肿瘤细菌治疗已经有100多年的历史,但是治疗效果不稳定,其主要局限性是如何保证细菌将治疗药物有效地释放到肿瘤微环境中。现有的细菌疗法中一般利用肿瘤微环境、外部信号分子等激活目的基因的转录。hasty等人设计了一种临床的治疗菌株,基于群体感应反馈回路同步裂解,并通过与人类癌细胞在体外共培养展示了其作为药物输送载体的巨大潜力。除了环境传感器,细胞外诱导剂通常被用于精确触发基因表达。在小鼠模型中,静脉注射阿拉伯糖可以激活定植肿瘤中细菌的基因表达。目前没有技术能够实现人为操控肿瘤内细菌的表型,究其原因是在肿瘤细菌疗法中无法精确操控肿瘤内细菌基因线路中特定基因的表达。
5.现有的肿瘤细菌疗法中多数是将细菌作为一个独立的载体用于激活人体的免疫系统、释放细菌毒素以及抗癌药物等达到肿瘤治疗的目的。利用肿瘤内微环境的不同靶向释放药物的方法存在易脱靶、特异性差、组织穿透力弱、药物浓度不受控以及易受免疫系统干扰等缺陷。因此,需要多次注菌才能达到较好的治疗效果,这也增加了细菌治疗的毒性。
6.另外,相比于浮游细菌,形成生物被膜的细菌可以抵抗人体免疫系统的清除、加剧肿瘤内出血、抑制癌细胞的转移。例如:在sos反应过程中,癌细胞内细菌生物被膜的形成导致癌细胞转移中断;链球菌生物被膜中释放的多糖可以抑制癌细胞对内皮细胞的粘附,这是癌细胞转移的必要步骤。但是目前并没有方法可以操控肿瘤组织内细菌生物被膜的形成,也没有实验证实生物被膜的形成在肿瘤治疗中的重要作用。
技术实现要素:
7.本发明的主要目的是提供一种基于细菌生物被膜的肿瘤治疗工程菌,使得该工程
菌在肿瘤治疗中可以人为操控其在肿瘤内的表型,提高肿瘤细菌治疗的靶向性和特异性,并且实现长时间有效定植,避免重复给药,降低毒性。
8.为实现上述目的,本发明提出一种基于细菌生物被膜的肿瘤治疗工程菌,所述肿瘤治疗工程菌具有三种状态,依次包括:能够分裂生长,但无法粘附在细胞表面的状态;形成生物被膜的状态;以及裂解的状态。
9.优选地,所述肿瘤治疗工程菌具有响应外界环境刺激的响应蛋白,以诱导合成c-di-gmp信使分子,所述c-di-gmp信使分子操控所述肿瘤治疗工程菌形成生物被膜或裂解;
10.优选地,所述外界环境包括ph、温度、压力、渗透压、氧气、光、电磁波、化学信号分子中的任一种。
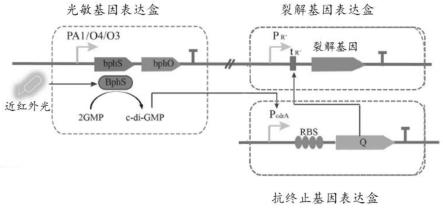
11.优选地,所述响应蛋白为光敏蛋白,所述外界环境为光,所述肿瘤治疗工程菌包括:
12.光敏基因表达盒,表达得到光敏蛋白,所述光敏蛋白在光调控下合成得到c-di-gmp信使分子;
13.抗终止基因表达盒,在所述c-di-gmp信使分子的调控下表达得到抗终止蛋白;
14.裂解基因表达盒,在所述抗终止蛋白的调控下表达得到裂解蛋白;
15.分解基因表达盒,表达得到所述c-di-gmp信使分子的分解蛋白,用于抑制细菌的非特异性黏附;其中,
16.当调控所述光敏蛋白的光强达到第一阈值时,所述肿瘤治疗工程菌裂解,当光强达到第二阈值并低于所述第一阈值时,所述肿瘤治疗工程菌形成生物被膜,当光强低于所述第二阈值时,所述肿瘤治疗工程菌分裂生长,无法粘附在细胞表面。
17.进一步地,还包括:
18.药物合成元件,用于合成药物,所述药物在所述肿瘤治疗工程菌裂解之后释放。
19.优选地,所述药物包括可直接杀死肿瘤细胞的物质、激活免疫系统的抗体、诱导肿瘤细胞凋亡的信号分子合成基因中的任一种;
20.更优选地,所述药物为hlye。
21.可选地,所述光敏基因表达盒、所述裂解基因表达盒和所述分解基因表达盒整合到所述肿瘤治疗工程菌的基因组中,所述抗终止基因表达盒和所述药物合成元件以外源质粒形式存在;
22.优选地,所述抗终止基因表达盒与所述药物合成元件构建在同一外源质粒中。
23.可选地,所述光敏基因包括bphs、bphg、bphs1中的任一种;
24.所述抗终止基因表达载体的启动子为受所述c-di-gmp调控启动子,包括cdra启动子、pela启动子、psla启动子、bera启动子、mrkj启动子、brlr启动子、vpsl启动子、enga启动子中的任一种;
25.优选地,所述分解基因包括磷酸二酯酶基因;
26.优选地,所述抗终止基因包括λ噬菌体的q基因;
27.优选地,所述裂解基因包括所述肿瘤治疗工程菌自带的裂解基因,或噬菌体的裂解基因;
28.更优选地,所述裂解基因包括λ噬菌体的lkd16基因或铜绿假单胞菌的alpbcde基因。
29.优选地,所述肿瘤治疗工程菌的出发菌包括:铜绿假单胞菌、沙门氏菌、李斯特菌、牛分枝杆菌、梭状芽胞杆菌、大肠杆菌中的任一种。
30.本发明还提出一种基于细菌生物被膜的肿瘤治疗工程菌的构建方法,包括质粒构建和质粒转化,所述质粒构建包括:
31.光敏基因表达载体的构建,表达得到光敏蛋白,所述光敏蛋白在近红外光的调控下合成得到信使分子;
32.抗终止基因表达载体的构建,所述抗终止基因表达载体的启动子受所述信使分子的调控表达得到抗终止蛋白;
33.裂解基因表达载体的构建,所述裂解基因表达载体的启动子受所述抗终止蛋白调控表达得到裂解蛋白;
34.分解基因表达载体的构建,表达得到所述信使分子的分解蛋白,用于抑制细菌的非特异性黏附;
35.所述质粒转化包括将所述光敏基因表达载体、抗终止基因表达载体、裂解基因表达载体和分解基因表达载体转化到出发菌中,得到所述肿瘤治疗工程菌。
36.优选地,所述质粒构建还包括:
37.药物合成元件的构建,用于合成药物,所述药物在所述肿瘤治疗工程菌裂解之后释放。
38.优选地,所述光敏基因表达载体、所述裂解基因表达载体和所述分解基因表达载体整合到所述肿瘤治疗工程菌的基因组中,所述抗终止基因表达载体和所述药物合成元件表达载体以外源质粒形式存在。
39.更优选地,所述抗终止基因表达载体与所述药物合成元件表达载体构建在同一外源质粒中。
40.可选地,所述光敏基因包括bphs、bphg、bphs1中的任一种;
41.所述抗终止基因表达载体的启动子为受所述c-di-gmp调控启动子,包括cdra启动子、pela启动子、psla启动子、bera启动子、mrkj启动子、brlr启动子、vpsl启动子、enga启动子中的任一种;
42.优选地,所述分解基因包括磷酸二酯酶基因;
43.优选地,所述抗终止基因包括λ噬菌体的q基因;
44.优选地,所述裂解基因包括所述肿瘤治疗工程菌自带的裂解基因,或噬菌体的裂解基因;
45.更优选地,所述裂解基因包括λ噬菌体的lkd16基因或铜绿假单胞菌的alpbcde基因。
46.本发明还提出一种基于细菌生物被膜的肿瘤治疗系统,包括上述任意一项所述的一种基于细菌生物被膜的肿瘤治疗工程菌和外界环境刺激装置,所述肿瘤治疗工程菌注射到肿瘤部位,所述外界环境刺激装置对所述肿瘤部位进行刺激,以使所述肿瘤治疗工程菌具有三种状态,依次包括:能够分裂生长,但无法粘附在细胞表面的状态;形成生物被膜的状态;以及裂解的状态。
47.优选地,所述外界环境刺激装置为激光发生装置,所述外界环境为光,所述响应蛋白为光敏蛋白;其中,
48.当调控所述光敏蛋白的光强达到第一阈值时,所述肿瘤治疗工程菌裂解,当光强达到第二阈值并低于所述第一阈值时,所述肿瘤治疗工程菌形成生物被膜,当光强低于所述第二阈值时,所述肿瘤治疗工程菌分裂生长,无法粘附在细胞表面。
49.本发明还提出一种药物组合物,包括上述任意一项所述的一种基于细菌生物被膜的肿瘤治疗工程菌。
50.本发明最后还提出如上述任意一项所述的一种基于细菌生物被膜的肿瘤治疗工程菌在制备治疗肿瘤药物中的用途。
51.本发明技术方案的基于细菌生物被膜的肿瘤治疗工程菌具有三种状态,能够分裂生长,但无法粘附在细胞表面的状态;形成生物被膜的状态;以及裂解的状态。从而该肿瘤治疗工程菌在用于治疗肿瘤时,可以操控肿瘤组织内细菌表型,实现肿瘤组织内细菌生物被膜形成及裂解的周期性变化,实现治疗菌株在肿瘤组织内的长时间有效定植,避免重复给药的同时达到药物释放浓度和位置的精确控制。
52.本发明技术方案的基于细菌生物被膜的肿瘤治疗工程菌通过基因工程手段构建光信号操控细菌生物被膜形成及裂解的基因回路,通过光敏蛋白在光的调控下合成信使分子,信使分子一方面调控细菌生物被膜的形成,另一方面调控抗终止蛋白的表达,抗终止蛋白调控裂解蛋白的表达,从而可以通过程序性的控制光信号的辐射强度精确操控肿瘤组织内细菌表型,实现肿瘤组织内细菌生物被膜形成及裂解的周期性变化,实现治疗菌株在肿瘤组织内的长时间有效定植,避免重复给药的同时达到药物释放浓度和位置的精确控制。
附图说明
53.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的附图。
54.图1为本发明方案的基于细菌生物被膜的肿瘤治疗工程菌的基因回路示意图;
55.图2为本发明的基于细菌生物被膜的肿瘤治疗工程菌的表型操控原理示意图;
56.图3为本发明的基于细菌生物被膜的肿瘤治疗工程菌治疗肿瘤的原理示意图;
57.图4为mini-ctx2质粒的图谱示意图;
58.图5为pa1/o4/o3-bphs-t0/t1-j23102-sfgfp-ctx2质粒的结构示意图;
59.图6为pucp20质粒的图谱示意图;
60.图7为pcdra-rbs-q-t0/t1-j23118-hlye-pucp20质粒的结构示意图;
61.图8为minitn7质粒的图谱示意图;
62.图9为j23109-pa2133-pr
’‑
tr
’‑
lkd-t0/t1-minitn7质粒的结构示意图;
63.图10为pex18gm质粒的图谱示意图;
64.图11a为减毒肿瘤治疗工程菌与细胞共培养的实验结果图;
65.图11b为减毒肿瘤治疗工程菌的细胞毒性定量分析结果图;
66.图12a为皮下注射减毒肿瘤治疗工程菌小鼠存活率的实验结果图;
67.图12b为皮下注射减毒肿瘤治疗工程菌小鼠体重变化率的实验结果图;
68.图13为微孔板高通量筛选工程菌光响应的光强范围的实验结果图;
69.图14a为显微镜下肿瘤治疗工程菌的光响应行为的实验结果图;
70.图14b为不同光强下肿瘤治疗工程菌的时间序列图片;
71.图14c为对应三种表型细菌的荧光染色结果图片;
72.图15a为本发明的肿瘤治疗工程菌程序性控制生物被膜的形成和裂解的光强和光照时间周期示意图;
73.图15b为本发明的肿瘤治疗工程菌在程序性操控光辐射强度下的时间序列图片;
74.图16a为微流控实验的装置设计图;
75.图16b为微流控实验不同光照强度条件下的细菌细胞共培养的实验结果图;
76.图17a为微流控实验中肿瘤治疗工程菌与a549活细胞共培养时,光辐射强度和时间的控制示意图以及实验结果图;
77.图17b微流控装置中,生物被膜裂解后的荧光生死染色的实验结果图;
78.图17c不同光照流程下,细胞存活率的定量统计结果图;
79.图18a为小鼠体内实验中光照流程及强度的示意图;
80.图18b为ivis活体成像的实验结果图;
81.图18c为肿瘤内细菌定植密度的定量分析结果图;
82.图19a为避光条件下,小鼠肿瘤内细菌的聚集状态实验结果图;
83.图19b为中等光照条件下,小鼠肿瘤内细菌的聚集状态实验结果图;
84.图19c为中等光照条件下处理7天后的肿瘤内细菌的裂解稳定性的实验结果图;
85.图20a为肿瘤组织切片的he染色结果图;
86.图20b为肿瘤相对体积变化率的实验结果图;
87.图21为不同光照流程下肿瘤体积变化率的定量分解结果图;
88.图22a为本肿瘤治疗工程菌的长时间治疗的光操控示意图;
89.图22b为长时间不同光照流程处理后的肿瘤图片;
90.图22c为长时间光治疗的小鼠肿瘤体积的变化趋势结果图;
91.图22d为长时间不同光照流程处理后的肿瘤质量统计图;
92.图22e为长时间不同光照流程处理时的小鼠体重变化结果图。
93.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
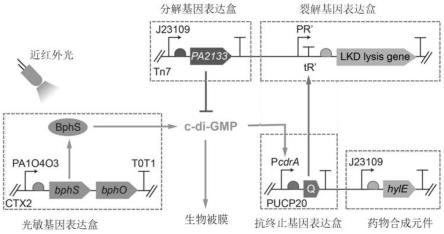
具体实施方式
94.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
95.本发明提出一种基于细菌生物被膜的肿瘤治疗工程菌,所述肿瘤治疗工程菌具有三种状态,依次包括:能够分裂生长,但无法粘附在细胞表面的状态;形成生物被膜的状态;以及裂解的状态。
96.该基于细菌生物被膜的肿瘤治疗工程菌在正常状态下可以进行分裂生长,进行扩增复制,在外界环境刺激下,该基于细菌生物被膜的肿瘤治疗工程菌形成生物被膜,从而可以粘附在肿瘤细胞表面,然后裂解释放药物,用于治疗肿瘤。
97.进一步地,该基于细菌生物被膜的肿瘤治疗工程菌具有响应外界环境刺激的响应蛋白,以诱导合成c-di-gmp信使分子,所述c-di-gmp信使分子操控所述肿瘤治疗工程菌形成生物被膜或裂解。
98.环鸟苷二磷酸c-di-gmp第二信使分子,在细菌由浮游状态和形成生物被膜的生活方式转换方面具有关键作用。c-di-gmp是由两个gtp分子通过含有ggdef结构域的二鸟苷酸环化酶(dgc)介导合成,并通过含有eal或hd-gyp结构域的磷酸二酯酶(pde)被分解为5
′‑
磷酸鸟苷酸-(3
′‑5′
)-鸟苷(pgpg)或鸟苷酸(gmp)。c-di-gmp与其效应器(c-di-gmp受体)结合,改变其效应器的结构并激活其功能,从而调节下游基因的表达。
99.被c-di-gmp激活的效应器,不但影响着细胞附属物,如鞭毛和iv型菌毛的合成,而且对铜绿假单胞菌的褐藻多糖、pel多糖和psl多糖等胞外多糖的合成具有调控作用,这些功能对于细菌生物被膜的形成必不可少。
100.优选地,所述外界环境包括ph、温度、压力、渗透压、氧气、光、电磁波中、化学信号分子的任一种。
101.在一优选实施例中,请参阅图1,所述响应蛋白为光敏蛋白,所述外界环境为光,所述肿瘤治疗工程菌包括:光敏基因表达盒,表达得到光敏蛋白,所述光敏蛋白在近红外光的调控下合成得到c-di-gmp信使分子;抗终止基因表达盒,在所述c-di-gmp信使分子的调控下表达得到抗终止蛋白;裂解基因表达盒,在所述抗终止蛋白的调控下表达得到裂解蛋白;分解基因表达盒,表达得到所述c-di-gmp信使分子的分解蛋白,用于抑制细菌的非特异性黏附;其中,当调控所述光敏蛋白的光强达到第一阈值时,所述肿瘤治疗工程菌裂解,当光强达到第二阈值并低于所述第一阈值时,所述肿瘤治疗工程菌形成生物被膜,当光强低于所述第二阈值时,所述肿瘤治疗工程菌分裂生长,无法粘附在细胞表面。图2为本发明的基于细菌生物被膜的肿瘤治疗工程菌的表型操控原理示意图。
102.术语“基因表达盒”是指包含启动子、目的基因、筛选基因和终止子的一段可以在细胞内进行表达的dna序列。可以理解的是,“基因表达盒”可以整合到细菌基因组中,从而提高基因表达盒的稳定性,也可以以外源质粒的形式存在,便于对基因表达盒的具体元件进行调整。
103.上述光敏基因表达盒、抗终止基因表达盒、裂解基因表达盒以及分解基因表达盒整合到细菌基因组,或者以外源质粒形式存在可以为任意组合。详细而言,例如可以为光敏基因表达盒整合到细菌基因组,抗终止基因表达盒、裂解基因表达盒和分解基因表达盒以质粒形式存在;也可以为光敏基因表达盒和分解基因表达盒整合到细菌基因组,抗终止基因表达盒和裂解基因表达盒以质粒形式存在;还可以为裂解基因表达盒和分解基因表达盒整合到细菌基因组,光敏基因表达盒和抗终止基因表达盒以质粒形式存在。上述基因表达盒的形式不限于所举例这些,其他实施例不再一一例举,可以理解的是,凡是通过基因工程构建的菌株包括上述光敏基因表达盒、抗终止基因表达盒、裂解基因表达盒以及分解基因表达盒都属于本发明技术方案保护的范围。
104.具体的,光敏基因表达盒的启动子为组成型启动子,可以持续表达光敏蛋白,光敏蛋白在光照射下可以合成信使分子,信使分子的浓度一方面促进细菌合成,使得所述肿瘤治疗工程菌形成生物被膜;另一方面促进抗终止蛋白的表达,所述抗终止蛋白的累积激活裂解蛋白的表达,促进细菌裂解。光强大小与合成的信使分子浓度成正相关,因此,光强大
小也与细菌合成的黏附因子和表达的抗终止蛋白的浓度成正相关。在一优选实施例中,所述光敏基因表达盒通过构建在自杀质粒中整合到细菌基因组中,提高光敏基因遗传稳定性。
105.具体的,抗终止基因表达盒的启动子为诱导型启动子,受信使分子的浓度调控表达得到抗终止蛋白,抗终止蛋白可以特异的阻止终止子的作用,使酶越过终止子继续转录。
106.具体的,裂解基因表达盒的启动子为启动子-终止子(pr
’‑
tr’)系统,其中,抗终止蛋白不表达或表达浓度低时,裂解基因表达盒的pr
’‑
tr’系统在终止子的作用下不转录,因而无法表达得到裂解蛋白,当抗终止蛋白的表达浓度足够多时,抗终止蛋白可以阻止pr
’‑
tr’系统的终止子的作用,使得裂解基因正常转录表达得到裂解蛋白,从而对细菌进行裂解。
107.由此可见,抗终止蛋白的浓度与裂解蛋白的浓度成正相关,因而,调控光敏蛋白的光强大小与裂解蛋白的表达浓度成正相关。因此可以理解,调控光敏蛋白的光强的第一阈值即为可以使得裂解蛋白的表达量使工程菌裂解的光强值。达到第一阈值可以为与第一阈值相同,也可以为超过第一阈值。还应当说明的是,对于不同出发菌构建的工程菌,由于其性质不同,即使其采用本发明技术方案进行改造,其第一阈值也有可能不同,因此,本发明技术方案对于具体的第一阈值不做具体限定。出发菌例如可以为铜绿假单胞菌、沙门氏菌、大肠杆菌中的任一种。
108.调控光敏蛋白的光强的第二阈值为可以使肿瘤治疗工程菌形成生物被膜的光强值,第二阈值低于第一阈值,达到第二阈值可以为与第二阈值相同,也可以为超过第二阈值。达到第二阈值并低于第一阈值的光强可以保证肿瘤治疗工程菌合成的黏附因子足以形成生物被膜,并且细菌不会裂解,可以实现治疗菌株在肿瘤组织内的长时间有效定植。调控光敏蛋白的光强低于第二阈值时,肿瘤治疗工程菌合成的黏附因子不足以使肿瘤治疗工程菌形成生物被膜,此时细菌为低黏附状态,可以正常生长扩增,但是无法在细胞表面粘附定植,并容易被人体免疫系统清除。
109.同样应当说明的是,对于不同出发菌构建的工程菌,由于其性质不同,即使其采用本发明技术方案进行改造,其第二阈值也有可能不同,因此,本发明技术方案对于具体的第二阈值也不做具体限定。
110.具体的,分解基因表达盒的启动子为组成型启动子,可以持续表达得到分解蛋白,用于分解信使分子,降低背景表达水平,确保光强低于第二阈值时,细菌处于低黏附状态;光强达到第二阈值并低于第一阈值时,就能诱导细菌生物被膜的形成,增加细菌的光敏感性,降低对正常细胞的损伤。
111.本发明技术方案的基于细菌生物被膜的肿瘤治疗工程菌通过基因工程手段构建光信号操控细菌生物被膜形成及裂解的基因回路,通过光敏蛋白在光的调控下合成信使分子,信使分子一方面调控细菌生物被膜的形成,另一方面调控抗终止蛋白的表达,抗终止蛋白调控裂解蛋白的表达,从而可以通过程序性的控制光信号的辐射强度精确操控肿瘤组织内细菌表型,实现肿瘤组织内细菌生物被膜形成及裂解的周期性变化,实现治疗菌株在肿瘤组织内的长时间有效定植,避免重复给药的同时达到药物释放浓度和位置的精确控制。
112.如图3所示为本发明的基于细菌生物被膜的肿瘤治疗工程菌治疗肿瘤的原理示意图,在此详细说明本发明的基于细菌生物被膜的肿瘤治疗工程菌在治疗肿瘤时候的具体操
作过程,例如可以将该肿瘤治疗工程菌注入到肿瘤部位,然后使用激光元件照射肿瘤部位,调控光敏蛋白的光强应为肿瘤治疗工程菌接收的光强,而非激光元件照射的光强。当调控光敏蛋白的光强低于第二阈值时,对应图3中的黑暗和低光强条件下,肿瘤治疗工程菌合成的c-di-gmp含量较低,肿瘤治疗工程菌为分散状态,在肿瘤组织无法在肿瘤表面定植;待肿瘤治疗工程菌扩增到合适的数量增大激光元件的照射强度,使得调控光敏蛋白的光强达到第二阈值并低于第一阈值,对应图3中的中光强条件下,使得肿瘤治疗工程菌合成的c-di-gmp增多,从而形成生物被膜,定植在肿瘤组织部位;然后再增大激光元件的照射强度,使得调控光敏蛋白的光强达到第一阈值,对应图3中的高光强条件下,使得肿瘤治疗工程菌合成的c-di-gmp浓度较高,从而诱导裂解蛋白表达,肿瘤治疗工程菌裂解释放药物,达到治疗效果。还要说明的是,上述治疗过程可以反复循环进行,也即肿瘤治疗工程菌可以在肿瘤组织不断进行生长、形成生物被膜、裂解释放药物,使得该工程菌只需注射一次,不需重复给药,即能达到治疗效果。
113.进一步地,还包括:
114.药物合成元件,用于合成药物,所述药物在所述肿瘤治疗工程菌裂解之后释放。
115.优选地,所述药物包括可直接杀死肿瘤细胞的物质、激活免疫系统的抗体、诱导肿瘤细胞凋亡的信号分子合成基因中的任一种;
116.更优选地,所述药物为hlye。
117.可选地,所述光敏基因表达盒、所述裂解基因表达盒和所述分解基因表达盒整合到所述肿瘤治疗工程菌的基因组中,所述抗终止基因表达盒和所述药物合成元件以外源质粒形式存在。
118.可选地,所述抗终止基因表达盒与所述药物合成元件构建在同一外源质粒中。从而,可以简化工程菌的构建过程。
119.可选地,所述光敏基因包括bphs、bphg、bphs1中的任一种;
120.所述抗终止基因表达载体的启动子为受c-di-gmp调控启动子,包括cdra启动子、pela启动子、psla启动子、bera启动子、mrkj启动子、brlr启动子、vpsl启动子、enga启动子中的任一种;
121.可选地,所述分解基因包括磷酸二酯酶基因;
122.可选地,所述抗终止基因包括λ噬菌体的q基因;
123.可选地,所述裂解基因包括所述肿瘤治疗工程菌自带的裂解基因,或噬菌体的裂解基因;
124.更优选地,所述裂解基因包括λ噬菌体的lkd16基因或铜绿假单胞菌的alpbcde基因。
125.本发明还提出一种基于细菌生物被膜的肿瘤治疗工程菌的构建方法,包括质粒构建和质粒转化,所述质粒构建包括:
126.光敏基因表达载体的构建,表达得到光敏蛋白,所述光敏蛋白在近红外光的调控下合成得到信使分子;
127.抗终止基因表达载体的构建,所述抗终止基因表达载体的启动子受所述信使分子的调控表达得到抗终止蛋白;
128.裂解基因表达载体的构建,所述裂解基因表达载体的启动子受所述抗终止蛋白调
控表达得到裂解蛋白;
129.分解基因表达载体的构建,表达得到所述信使分子的分解蛋白,用于抑制细菌的非特异性黏附;
130.所述质粒转化包括将所述光敏基因表达载体、抗终止基因表达载体、裂解基因表达载体和分解基因表达载体转化到出发菌中,得到所述肿瘤治疗工程菌。
131.进一步地,所述质粒构建还包括:
132.药物合成元件的构建,用于合成药物,所述药物在所述肿瘤治疗工程菌裂解之后释放。
133.在一实施例中,所述光敏基因表达载体、所述裂解基因表达载体和所述分解基因表达载体整合到所述肿瘤治疗工程菌的基因组中,所述抗终止基因表达载体和所述药物合成元件表达载体以外源质粒形式存在。
134.可选地,所述抗终止基因表达载体与所述药物合成元件表达载体构建在同一外源质粒中。
135.可选地,所述光敏基因包括bphs、bphg、bphs1中的任一种;
136.所述抗终止基因表达载体的启动子为受c-di-gmp调控启动子,包括cdra启动子、pela启动子、psla启动子、bera启动子、mrkj启动子、brlr启动子、vpsl启动子、enga启动子中的任一种;
137.可选地,所述分解基因包括磷酸二酯酶基因;
138.可选地,所述抗终止基因包括λ噬菌体的q基因;
139.优选地,所述裂解基因包括所述肿瘤治疗工程菌自带的裂解基因,或噬菌体的裂解基因;
140.更优选地,所述裂解基因包括λ噬菌体的lkd16基因或铜绿假单胞菌的alpbcde基因。
141.本发明还提出一种基于细菌生物被膜的肿瘤治疗系统,包括上述任意一项所述的一种基于细菌生物被膜的肿瘤治疗工程菌和外界环境刺激装置,所述肿瘤治疗工程菌注射到肿瘤部位,所述外界环境刺激装置对所述肿瘤部位进行刺激,以使所述肿瘤治疗工程菌具有三种状态,依次包括:能够分裂生长,但无法粘附在细胞表面的状态;形成生物被膜的状态;以及裂解的状态。
142.优选地,所述外界环境刺激装置为激光发生装置,所述外界环境为光,所述响应蛋白为光敏蛋白;其中,
143.当调控所述光敏蛋白的光强达到第一阈值时,所述肿瘤治疗工程菌裂解,当光强达到第二阈值并低于所述第一阈值时,所述肿瘤治疗工程菌形成生物被膜,当光强低于所述第二阈值时,所述肿瘤治疗工程菌分裂生长,无法粘附在细胞表面。
144.本发明还提出一种药物组合物,包括上述任意一项所述的一种基于细菌生物被膜的肿瘤治疗工程菌。
145.本发明最后还提出如上述任意一项所述的一种基于细菌生物被膜的肿瘤治疗工程菌在制备治疗肿瘤药物中的用途。
146.下面将结合具体实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明
具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
147.下述实施例中所使用的引物序列如表1所示。
148.表1为所用引物序列表
[0149][0150][0151]
实施例1基于细菌生物被膜的肿瘤治疗工程菌的构建
[0152]
1.1质粒构建
[0153]
1.1.1光敏基因bphs和绿色荧光基因sfgfp表达载体的构建
[0154]
本方案中以能够在肺部有效定植的铜绿假单胞菌pao1作为出发菌,以此为基础构建基于细菌生物被膜的肿瘤治疗工程菌。
[0155]
光敏基因bphs(seq id no.1)编码得到光敏蛋白bphs(seq id no.2),光敏蛋白bphs可以在近红外光调控下合成环鸟苷二磷酸c-di-gmp,bphs及其表达元件构建在重组质粒minictx2中(质粒图谱见图4所示),以将bphs基因及其相关表达元件整合到pao1基因组中,相关表达元件包括组成型启动子pa1/o4/o3(seq id no.3),光响应组件bpho(seq id no.4)。同时后续为了表征细菌定植实验中表面细菌的行为,需要对表面细菌的数目进行定量统计,将sfgfp绿色荧光蛋白基因连接到持续性启动子j23102启动子后面,然后整合到细菌基因组上,通过统计荧光强度的变化表征表面细菌数目的变化。构建重组质粒将bphs和sfgfp基因整合到pao1基因组的同一位点。
[0156]
具体的质粒构建流程如下:首先从上海生工生物有限公司合成pa1o4o3-bphs-bpho基因片段以及t1-j23102-b0034-sfgfp-t0(碱基序列为:seq id no.5)基因片段;随后
分别利用引物对pa1o4o3-f和bphs-r对pa1o4o3-bphs-bpho基因片段进行聚合酶链式pcr反应,以及引物对t1-sfgfp-f和t0-sfgfp-r对t1-j23102-b0034-sfgfp-t0基因片段进行聚合酶链式pcr反应,以获得带有25个碱基同源臂的能持续性表达光响应组件bpho和bphs的基因片段及表达绿色荧光蛋白sfgfp的基因片段;同时利用引物bphs-ctx-f和bphs-ctx-r对minictx2质粒进行聚合酶链式pcr反应得到线性化的载体质粒minictx2。最后利用吉布森连接法(gibson assembly)将3个基因片段连接,即构建得到pa1/o4/o3-bphs-t0/t1-j23102-sfgfp-ctx2质粒,质粒图谱见图5所示。构建好的质粒经测序鉴定后待用。
[0157]
1.1.2抗终止基因q和hlye基因表达载体的构建
[0158]
将抗终止基因q(seq id no.6)和hlye基因(seq id no.7)片段插入到可自主复制的外源质粒pucp20(质粒图谱见图6所示)上而不是细菌的基因组中,这样可以方便对抗终止基因q的表达进行优化调整。抗终止基因q来自λ噬菌体基因组,其表达载体使用的启动子为响应c-di-gmp的cdra启动子(seq id no.8),c-di-gmp的浓度越高,表达得到的抗终止蛋白q(seq id no.9)越多。
[0159]
首先人工合成以pao1为宿主进行碱基优化的pcdra-q基因片段,分别通过引物q-f和pcdra-r进行聚合酶链式pcr反应得到带有同源臂的pcdra-q片段,通过引物pucp-q-r和pucp-for进行聚合酶链式pcr反应得到线性化的pucp20载体片段;然后利用gibson assembly方法将pcdra-q碱基片段插入到pucp20中,从而构建载体pcdra-q-pucp20。q基因的表达量直接关系到细菌裂解时体内对应的c-di-gmp浓度(c-di-gmp由bphs基因合成,与光辐射强度正相关),因此q基因的表达需要不断优化。将抗终止基因q前的rbs进行批量置换筛选,即得到一系列pcdra-rbs-q-pucp20质粒。其中利用到的rbs序列及表达强度(以强表达核糖体结合位点boo34归一化)见表2所示。
[0160]
表2 rbs序列及表达强度
[0161][0162][0163]
采用组成型启动子j23118(seq id no.10),持续表达hlye(血溶素e)蛋白(seq id no.11),通过pcr方法获得j23118-hlye基因片段(引物为j23118-f和hlye-pucp-r),模板为人工合成;随后通过吉布森连接法在pcdra-rbs-q-t0/t1-pucp20质粒(线性化载体引物为
pucp20质粒电转入bphs-pa2133-lkd-sfgfp-pao1菌种内,即可得到本发明实施例的肿瘤治疗工程菌。
[0173]
实施例2肿瘤治疗工程菌的减毒改造
[0174]
2.1菌种构建
[0175]
2.1.1用于毒力因子敲除载体的构建
[0176]
细菌毒性一直是抑制肿瘤疗法应用的关键,本发明实施例的出发菌株选择的是可以在肺部定植,具有一定抗肿瘤能力的铜绿假单胞菌株pao1。将pao1菌株敲除三个基因以控制其毒性,分别为vfr(基因组编号为pa0652)、exos(基因组编号为pa3841)、exot(基因组编号为pa0044)。
[0177]
基因敲除采用无缝重组敲除的方法,以vfr基因敲除的载体构建为例,首先需要通过pcr技术从基因组上获得目的片段的上游及下游的1000个碱基的片段,记为vfr-up和vfr-dn;随后通过gibson assembly方法将他们插入到自杀型载体pex18gm的酶切位点ecori和hindiii之间(质粒图谱见图10所示),构建载体vfr-pex18gm。
[0178]
2.1.2减毒工程菌的构建
[0179]
在bphs-pa2133-lkd-sfgfp-pao1菌种基础依次敲除vfr、exos、exot三种基因。具体操作流程如下:首先将构建的敲除质粒vfr-pex18gm电转入目的菌种,在含有庆大霉素的平板上筛选出单克隆菌斑;随后在含有15%蔗糖的不含氯化钠的lb平板上划线。37℃培养16小时后,挑选单克隆菌斑pcr鉴定目的基因vfr是否成功敲除。测序验证后,以相同的方法进行第二个基因的敲除直至三个毒力基因全部敲除成功,该菌种记为exost。
[0180]
将pcdra-rbs-q-t0/t1-j23118-hlye-pucp20质粒电转入exost菌种内,即可得到减毒后的肿瘤治疗工程菌。
[0181]
2.2工程菌种毒性的测试
[0182]
2.2.1细胞水平的毒性测试
[0183]
哺乳动物细胞a549-mcherry和a549来自北京协和医学院细胞资源中心。细胞系在含有10%胎牛血清的mccoy’5a培养基中培养,置于37℃的组织培养箱中,5%co2保存。
[0184]
为了进行细胞毒性实验,a549细胞以每孔约104个细胞的密度接种于96孔板,实验前在37℃ 5%co2条件下培养24小时。细菌bphs-pa2133-lkd-sfgfp-pao1和exost在lb培养基中培养至对数期,用pbs离心重悬洗涤两次,然后用mccoy’s 5a细胞培养基稀释。将稀释后的菌液加入到细胞中,加入细菌数目的比例是细胞的50倍。共培养感染24小时后,从孔中取出培养基,置于离心管中,14000rpm离心2分钟。然后使用ldh细胞毒性检测试剂盒检测上清液中的乳酸脱氢酶(ldh)水平。使用裂解缓冲液处理的细胞作为最大ldh释放的阳性对照,使用未处理的细胞评估背景ldh释放。具体实验结果如图11a和11b显示,exost菌种对细胞a549的毒性相比于没有敲除毒力因子的bphs-pa2133-lkd-sfgfp-pao1细菌大大降低。
[0185]
2.2.2小鼠活体测试菌种毒性
[0186]
实验用的小鼠为免疫缺陷的6至8周的balb/c nude裸鼠。将处于对数生长期的细菌收集,用无菌pbs离心洗涤3次后注射到小鼠皮下。菌液浓度为5x107ml-1
,在小鼠的右前肢背部注射100ul体系的菌液。密切监测小鼠并每日体重和存活数量,计算小鼠的存活率及体重变化率,实验结果分别如图12a和图12b所示,敲除三种毒力因子的菌种在皮下注射模型中对小鼠的毒性可以忽略不计。所以后续细胞及小鼠肿瘤治疗效果的测试中,涉及的均为
减毒后的肿瘤治疗工程菌。
[0187]
实施例3程序性调节光照强度操控工程菌的表型转变
[0188]
3.1高通量筛选工程菌光响应的光强范围
[0189]
首先我们在96孔板中测试细菌的光响应行为,具体实验如下:将对数期生长的细菌离心,重悬至od600为0.5,加入100ul的菌液到黑色96孔板中;分别对不同位置的细菌施加不同的光照强度,室温放置24小时后,缓慢吸取上清液测od600检测细菌的生长情况,od600明显降低证明细菌裂解;随后对光处理后的96孔板进行结晶紫染色,定量表征生物被膜形成能力的强度。
[0190]
根据不同光强下细菌的生长以及生物被膜的定量染色结果,初步筛选具有合适光强区间的菌株。影响光响应范围的条件有很多,包括pa2133基因的表达量、q基因的表达量等。我们需要根据高通量筛选的结果,初步筛选到能利用光照强度操控3种表型的细菌,具体调节的因素有pa2133及q基因前的启动子和rbs强度。最终确定的基因路线中q基因前的rbs为rbs017其序列为:aacgcggtgcaa,具体的基因路线参考图1。得到的可用工程菌株记为h017,它可以在低于第二阈值的低光强下生长,达到第二阈值并低于第一阈值的中光强下形成生物被膜,达到第二阈值的高光强下裂解,具体微孔板实验结果如图13所示。
[0191]
3.2显微镜定量表征细菌的光响应动力学过程
[0192]
为了能精确定量光响应的区间,拟选用美国lumencor公司的spectrex多色led作为光源结合双zyla4.2 scmos相机搭建荧光显微镜,实现了双相机的同步多色荧光拍摄。并将其与动态显微投影设备集成,实现在单细菌尺度上的高通量精确照明。利用搭建的显微投影装置,拟用不同强度的近红外光(640nm)对构建好的菌株进行诱导。由于细菌基因组整合和持续性表达sfgfp的基因片段,因此可以统计表面绿色荧光强度代表表面细菌的聚集密度,以此确定细菌形成生物被膜及裂解时所需的合理光强区间。最后利用碘吡啶pi生死染色,再次确定表面细菌的表型,具体结果如图14a所示,显示低光强区间low-lpd(0-2μw/cm2)细菌无法在表面粘附定植,中等光强middle-lpd(2-20μw/cm2)细菌在表面形成生物被膜,而高光强high-lpd(20-720μw/cm2)细菌则裂解。
[0193]
初步实验结果如图14所示,图14a为定量表征表面细菌的光响应动力学过程以及操控细菌表型所需要的对应光强区间。图14b是代表性的时间序列显微镜图片。图14c是表面细菌的荧光染色图片。
[0194]
3.3程序性调节光照强度实现生物被膜的周期性形成及裂解
[0195]
首先在flow cell流动培养池内注射细菌,并以一定的流速3ml/hr推流新鲜的培养基。然后根据前期摸索出来的光照调控,进一步优化光辐射时间,实现生物被膜的裂解及再形成,光照强度和光照时间参见图15a所示,实验结果如图15b所示,证明工程菌在不同光照强度下可以实现周期性形成生物被膜及菌体裂解。
[0196]
实施例4光操控铜绿假单胞菌在肿瘤细胞表面上的定植及裂解
[0197]
4.1精确操控工程菌在特定细胞表面上的定植
[0198]
基于dmd芯片的显微投影设备,利用matlab控制光辐射强度以及辐射区域,实现对特定细胞的精准光照。设计微流控装置,以实现细菌与肺癌细胞a549的体外共培养,并系统的探索细菌的聚集密度与光强之间的关系,从而量化细菌在细胞表面上对光响应的行为,装置设计图如图16a所示。
[0199]
为了测试能否光控细菌在肿瘤组织表面形成生物被膜继而包裹住细胞,首先我们在流动培养池flowcel内注入新鲜消化的细胞悬浮液,2小时后待细胞粘附到玻璃基底表面后冲流除去上游没有粘附的细胞,然后将装置放置于co2培养箱中过夜培养,随后利用4%的多聚甲醛固定细胞,再用新鲜的细菌培养基fab冲洗通道,置换培养基。尝试精确操控光辐射强度以及光照时间,诱导肿瘤细胞表面生物被膜的形成,结合共聚焦显微镜,定量表征a549细胞表面上细菌的聚集密度。实验结果如图16b所示,在低光强(1.3μw/cm2)细菌无法在细胞表面定植,中等光强(7.7μw/cm2)时细菌可以在细胞表面形成紧密的生物被膜,而高光强时(30.1μw/cm2)细菌裂解。
[0200]
4.2程序性操控生物被膜的裂解释放药物杀死肿瘤细胞
[0201]
为了测试光操控细菌生物被膜的裂解,在肿瘤治疗释放药物中的优势,我们首先在活细胞水平上测试效果。所有细菌和癌细胞的共培养实验均在微流控装置中,添加含有10%胎牛血清和30庆大霉素的mccoy’5a培养基。将指数期a549细胞接种于微流控通道中,在不流动的情况下定植2h。然后,将设备置于37℃,5%co2培养箱中,以0.5ml/h的流速培养24h。次日将设备转移至显微镜下,将指数生长的假单胞菌(od600~0.8)注入微流控通道。在不同的光照条件下采了明亮场和荧光图像。a549细胞存活率可以通过细胞形态的变化来确定,pi染色结果可以验证。
[0202]
在微流控装置内培养a549细胞,然后注射优化后得到的菌种h017,2.8μw/cm2光强辐射特定区域4小时,实现细菌在指定细胞表面形成生物被膜;随后采用158.2μw/cm2光强辐射6小时,致使细菌裂解释放药物,并分别在第0、2、4、6、8小时观察荧光情况,结果如图17a所示,第0-4小时荧光逐渐增强,证明生物被膜的形成,第4-8小时荧光逐渐减弱并分散,证明细菌裂解。
[0203]
对a549细胞部位进行syto-9染色和pi染色,syto-9染色用于观察活细胞,pi染色用于观察死细胞,结果如图17b所示,证明在生物被膜形成的地方,死细胞数量大大多于活细胞数量,证明细菌裂解释放药物作用在a549细胞。
[0204]
如图17c所示,相比于直接裂解释放药物或其它不能裂解释放药物的情况,先形成生物被膜再裂解释放药物能显著增加细胞的死亡率。因此,光操控生物被膜的形成能控制药物释放的浓度,相比于单细菌具有更好的治疗效果。
[0205]
实施例5体内实验测试基于细菌生物被膜治疗恶性肿瘤的治疗效果
[0206]
5.1皮下实体瘤模型的构建
[0207]
在本项目中,构建小鼠皮下肿瘤的模型验证生物被膜在肿瘤治疗中的作用。首先将6~8周龄雌性balb/c nude裸鼠皮下接种a549细胞,将所有预处理过的肿瘤细胞在pbs中调整为每ml 108个细胞,并以每侧100μl的体积植入皮下。每2天用游标卡尺测量肿瘤,肿瘤体积(立方毫米)计算公式如下:0.5
×
(l
×
w2),其中l为长度,w为肿瘤宽度,单位为毫米。在实验前,肿瘤通常生长到合适的大小(约100mm3)。
[0208]
5.2光操控工程菌在肿瘤内形成生物被膜
[0209]
首先测试生物被膜能否帮助细菌在肿瘤组织内的定植。将gfp标记的工程菌h017(每只小鼠3
×
107cfu)瘤内注射到a549荷瘤balb/c小鼠体内。然后,将小鼠随机分为4组,每组6只。3个实验组采用不同光照条件下的近红外光照,其余对照组小鼠置于黑暗中,光照流程如图18a所示。光照结束,断颈法处死小鼠,并在要求的时间点采集肿瘤组织。随后,用4%
(wt/vol)多聚甲醛在4℃下过夜固定肿瘤组织,用ivis活体动物成像系统成像,以gfp的荧光强度定量组织内的细菌密度。结果如图18b和18c所示,中等光强下饲养的小鼠肿瘤组织内的细菌密度明显高于避光组。
[0210]
5.3工程菌在肿瘤的聚集状态的表征
[0211]
结合冷冻切片技术,确定细菌的聚集状态。肿瘤组织在4℃下30%蔗糖中脱水,并在oct中包埋,然后切片染色。冷冻组织进行免疫荧光和苏木精伊红染色(h&e)切片(8μm),荧光显微镜切片(15μm)。切片用dapi染色,然后使用带100
×
oil物镜和emccd相机(ix897 andor)的旋转盘共聚焦显微镜(revolutionandor)成像。获得z-扫描共聚焦图像(每步0.5μm),在近红外光照下重建肿瘤组织中细菌生物被膜(绿色)的三维结构。利用激光共聚焦显微镜重组三维图像,发现中等光强光照组内的细菌呈聚集状态,低光强光照组内的细菌呈分散状态,如图19a和19b所示,证实了细菌生物被膜的形成。结合活体成像数据,说明肿瘤组织内生物被膜的形成确实能有效帮助细菌在肿瘤组织内的定植。
[0212]
为了测试菌种的稳定性,我们收集中等光强处理7天后的肿瘤组织内,利用匀浆仪处理后,以一定的比例稀释后涂在含有庆大霉素的平板上;随后挑取96个单克隆菌斑,分散在水中。将其平均分成两份,分别在高光及避光条件下培养,酶标仪记录37℃培养12小时后的od600的数值,结果显示所有菌斑均能在高光下裂解(图19c)。
[0213]
5.4光操控生物被膜的裂解释放药物
[0214]
通过程序性的控制光辐射强度,周期操控组织内生物被膜的裂解,测试工程菌的抗肿瘤效果。首先测试增加光强能否诱导肿瘤组织内的生物被膜裂解,达到抑制肿瘤生长的目的。通过冷冻切片,he染色结果(图20a)显示,光照条件为中等光强2天-高光强1天的肿瘤组织相比于中等光强处理3天的肿瘤组织内细胞有明显的坏死区域。同时两个周期后,发现肿瘤体积大小的变化率有明显的差异,结果如图20b,显示光可以程序性操控生物被膜的形成及再裂解。
[0215]
5.5程序性调节光照强度实现生物被膜的周期性裂解治疗肿瘤
[0216]
皮下荷瘤a549-mcherry的balb/c小鼠,瘤内注射假单胞菌h017,并采用不同光强的周期性照射处理,每天监测小鼠肿瘤体积和体重。记录小鼠随时间的相对肿瘤体积,以跟踪物理肿瘤的生长。对比不同的光照流程下,小鼠肿瘤体积的变化,结果如图21,只有光照条件为中等光强2天-高光强1天(m2-h1)的循环光照处理组具有更好的治疗效果。
[0217]
确定好最优的光照条件后,延长光照周期数(图22a),可以有效抑制肿瘤的生长。结果如图22b至图22e显示,经历长达6个循环的光照,部分小鼠的肿瘤完全消失。本发明实施例的工程菌用于治疗肿瘤对比现有技术的需要反复注菌的肿瘤细菌疗法,大大降低了注菌数量,细菌周期性的形成生物被膜和裂解可以持续性产生药物,并且能在肿瘤内稳定定植,提高了治疗效果。
[0218]
以上所述仅为本发明的可选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。