抗pd-l1/cd47双特异抗体在治疗疾病中的应用
技术领域
1.本发明属于生物医药领域,尤其涉及抗pd-l1/cd47双特异抗体在治疗自身免疫性疾病、炎性疾病、感染性疾病或肿瘤中的应用。
背景技术:
2.癌症免疫疗法是近年来癌症治疗上的革命性突破,是生物科学领域的研究热潮,随着更多的抗体新药批准上市,已将癌症治疗的前景从传统疗法的补充要素转变为中心和标准的癌症治疗方案。在以免疫检查点(checkpoint)为靶点,激活t细胞功能,从而提高获得性免疫系统能力来攻克癌症这一道路上,围绕pd-l1/pd-1途径开发抗体疗法,已成为本领域的热点。当机体发生炎症或是受到感染时,程序性死亡配体1(programmed death-ligand 1,pd-l1)能够被诱导表达在造血、内皮或上皮细胞上,通过结合到表达于t细胞、b细胞和单核细胞的上的程序性死亡受体1(programmed death 1,pd-1)来抑制免疫应答。pd-1胞质区含有两个基于酪氨酸的信号转导结构域itim(免疫受体酪氨酸抑制基序)和itsm(免疫受体酪氨酸转换基序)。pd-l1在许多癌症中过表达,所述癌症包括多种多样的实体瘤以及血液瘤,诸如膀胱癌、乳腺癌、结肠癌、肺癌、黑色素瘤、卵巢癌、胃癌、甲状腺癌、原发性纵膈大b细胞淋巴瘤和典型霍奇金淋巴瘤。过表达在肿瘤细胞上的pd-l1,与t细胞上的pd-1结合,激活pd-1的itim结构域,导致t细胞功能障碍和衰竭,阻止细胞毒性t细胞有效地靶向肿瘤细胞,向免疫系统发出“don’tfindme”信号,使肿瘤细胞获得适应性免疫耐受,从而促进肿瘤侵袭,造成不良的预后。
3.固有免疫系统是抵御感染和恶性细胞转化的第一道非特异性防线。在固有免疫系统中,单核细胞、巨噬细胞以及树突状细胞通过吞噬作用(phagocytosis),起抗原提呈细胞(antigen presenting cells,apcs)的作用。而apcs通过吞噬作用吞没肿瘤细胞的能力是连接先天免疫和适应性免疫不可或缺的桥梁。靶向调节吞噬作用的检查点(phagocytosis checkpoints,如cd47-sirpα),提供了一条开发癌症免疫疗法的新途径。cd47(integrin associated protein,iap,cd47)在正常细胞表面广泛表达,通过与巨噬细胞表面的sirpα(signal regulatory proteinα,sirpα)结合,释放一种“don’teatme”的信号,从而保护健康细胞不被巨噬细胞“吃掉”。癌细胞利用这一机制,在其表面过量表达cd47,使巨噬细胞把它们当作“正常细胞”,从而逃脱固有免疫的监控,逃避巨噬细胞介导的吞噬攻击。已有研究证实,几乎所有的肿瘤细胞都高表达cd47,诸如甲状腺癌、卵巢癌、前列腺癌、子宫颈癌、膀胱癌、头颈癌、胃癌、急性髓细胞性白血病、b细胞和t细胞急性白血病、非霍奇金淋巴瘤等,且cd47过表达与临床预后差有关。
技术实现要素:
4.本发明公开了抗pd-l1/cd47双特异抗体或抗原结合片段用于治疗自身免疫性疾病、炎性疾病、感染性疾病或肿瘤的方法或用途。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段制剂用于治疗自身免疫性疾病、炎性疾病、感染性疾病或肿瘤。
5.在一些实施方案中,本发明提供了一种抗pd-l1/cd47双特异抗体或抗原结合片段,所述抗pd-l1/cd47双特异抗体或抗原结合片段包含特异性结合pd-l1的可变区a;其中,所述可变区a包含(a)-(f)中一种或多种氨基酸序列:
6.(a)vha cdr1,其包含如seq id no:1所示的氨基酸序列,或与seq id no:1所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
7.(b)vha cdr2,其包含如seq id no:2所示的氨基酸序列,或与seq id no:2所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
8.(c)vha cdr3,其包含如seq id no:3所示的氨基酸序列,或与seq id no:3所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
9.(d)vla cdr1,其包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
10.(e)vla cdr2,其包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
11.(f)vla cdr3,其包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
12.在一些实施方案中,所述可变区a包含重链可变区a(vha),所述重链可变区a包含vha cdr1、vha cdr2、vha cdr3;其中vha cdr1包含如seq id no:1所示的氨基酸序列;vha cdr2包含如seq id no:2所示的氨基酸序列;vha cdr3包含如seq id no:3所示的氨基酸序列。
13.在一些实施方案中,所述可变区a包含轻链可变区a(vla),所述轻链可变区a包含vla cdr1、vla cdr2和vla cdr3;其中vla cdr1包含如seq id no:4所示的氨基酸序列;vla cdr2包含如seq id no:5所示的氨基酸序列;vla cdr3包含如seq id no:6所示的氨基酸序列。
14.在一些实施方案中,所述可变区a包含vha和vla;所述vha包含vha cdr1、vha cdr2、vha cdr3;所述vla包含vla cdr1、vla cdr2和vla cdr3。其中,vha cdr1包含如seq id no:1所示的氨基酸序列;vha cdr2包含如seq id no:2所示的氨基酸序列;vha cdr3包含如seq id no:3所示的氨基酸序列;vla cdr1包含如seq id no:4所示的氨基酸序列;vla cdr2包含如seq id no:5所示的氨基酸序列;vla cdr3包含如seq id no:6所示的氨基酸序列。
15.在一些实施方案中,所述vha cdr1包含如seq id no:1所示的氨基酸序列,或与seq id no:1所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vha cdr2包含如seq id no:2所示的氨基酸序列,或与seq id no:2所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vha cdr3包含如seq id no:3所示的氨基酸序列,或与seq id no:3所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
16.在一些实施方案中,所述vla cdr1包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr2包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr3包含如seq id no:6所示的
氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
17.在一些实施方案中,所述vha cdr1包含如seq id no:1所示的氨基酸序列,或与seq id no:1所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vha cdr2包含如seq id no:2所示的氨基酸序列,或与seq id no:2所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vha cdr3包含如seq id no:3所示的氨基酸序列,或与seq id no:3所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr1包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr2包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr3包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
18.在一些实施方案中,所述vha包含如seq id no:10所示的氨基酸序列,或与seq id no:10所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:10所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
19.在一些实施方案中,所述vla包含如seq id no:12所示的氨基酸序列,或与seq id no:12所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:12所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
20.在一些实施方案中,所述可变区a包含vha和vla。所述vha包含如seq id no:10所示的氨基酸序列,或与seq id no:10所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:10所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vla包含如seq id no:12所示的氨基酸序列,或与seq id no:12所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:12所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
21.在一些实施方案中,本发明提供的一种抗pd-l1/cd47双特异抗体或抗原结合片段,所述抗pd-l1/cd47双特异抗体或抗原结合片段还包含轻链恒定区a(cla),以及重链恒定区a(cha)。
22.在一些实施方案中,所述cha包含如seq id no:13或19所示的氨基酸序列,或与seq id no:13或19所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:13或19所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
23.在一些实施方案中,所述cla包含如seq id no:14所示的氨基酸序列,或与seq id no:14所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:14所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
24.在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体包含一条重链a以及一条轻链a;所述重链a和轻链a配对形成pd-l1抗原结合位点。
25.在一些实施方案中,所述重链a包含如seq id no:16或21所示的氨基酸序列,或与seq id no:16或21所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:16或21所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
26.在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与
pd-l1的亲和力指数kd≤10nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与pd-l1的亲和力指数kd≤1nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与pd-l1的亲和力指数kd≤0.5nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与pd-l1的亲和力指数kd≤0.2nm。
27.另一方面,本发明提供了一种抗pd-l1/cd47双特异抗体或抗原结合片段,所述抗pd-l1/cd47双特异抗体或抗原结合片段包含特异性结合cd47的可变区b;其中,所述可变区b包含(g)-(l)中一种或多种氨基酸序列:
28.(g)vhb cdr1,其包含如seq id no:7所示的氨基酸序列,或与seq id no:7所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
29.(h)vhb cdr2,其包含如seq id no:8所示的氨基酸序列,或与seq id no:8所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
30.(i)vhb cdr3,其包含如seq id no:9所示的氨基酸序列,或与seq id no:9所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
31.(j)vlb cdr1,其包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
32.(k)vlb cdr2,其包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
33.(l)vlb cdr3,其包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
34.在一些实施方案中,所述可变区b包含重链可变区b(vhb),所述重链可变区b包含vhb cdr1、vhb cdr2、vhb cdr3;其中vhb cdr1包含如seq id no:7所示的氨基酸序列;vhb cdr2包含如seq id no:8所示的氨基酸序列;vhb cdr3包含如seq id no:9所示的氨基酸序列。
35.在一些实施方案中,所述可变区b包含轻链可变区b(vlb),所述轻链可变区b包含vlb cdr1、vlb cdr2和vlb cdr3;其中vlb cdr1包含如seq id no:4所示的氨基酸序列;vlb cdr2包含如seq id no:5所示的氨基酸序列;vlb cdr3包含如seq id no:6所示的氨基酸序列。
36.在一些实施方案中,所述可变区b包含vhb和vlb;所述vhb包含vhb cdr1、vhb cdr2、vhb cdr3;所述vlb包含vlb cdr1、vlb cdr2和vlb cdr3。其中,vhb cdr1包含如seq id no:7所示的氨基酸序列;vhb cdr2包含如seq id no:8所示的氨基酸序列;vhb cdr3包含如seq id no:9所示的氨基酸序列;vlb cdr1包含如seq id no:4所示的氨基酸序列;vlb cdr2包含如seq id no:5所示的氨基酸序列;vlb cdr3包含如seq id no:6所示的氨基酸序列。
37.在一些实施方案中,所述vhb cdr1包含如seq id no:7所示的氨基酸序列,或与seq id no:7所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vhb cdr2包含如seq id no:8所示的氨基酸序列,或与seq id no:8所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vhb cdr3包含如seq id no:9所示的氨基酸序列,或与seq id no:9所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
38.在一些实施方案中,所述vlb cdr1包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vlb cdr2包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vlb cdr3包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
39.在一些实施方案中,所述vhb cdr1包含如seq id no:7所示的氨基酸序列,或与seq id no:7所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vhb cdr2包含如seq id no:8所示的氨基酸序列,或与seq id no:8所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vhb cdr3包含如seq id no:9所示的氨基酸序列,或与seq id no:9所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vlb cdr1包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vlb cdr2包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vlb cdr3包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
40.在一些实施方案中,所述vhb包含如seq id no:11所示的氨基酸序列,或与seq id no:11所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:11所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
41.在一些实施方案中,所述vlb包含如seq id no:12所示的氨基酸序列,或与seq id no:12所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:12所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
42.在一些实施方案中,所述可变区b包含vhb和vlb。所述vhb包含如seq id no:11所示的氨基酸序列,或与seq id no:11所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:11所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vlb包含如seq id no:12所示的氨基酸序列,或与seq id no:12所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:12所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
43.在一些实施方案中,本发明提供的一种抗pd-l1/cd47双特异抗体或抗原结合片段,所述抗pd-l1/cd47双特异抗体或抗原结合片段还包含轻链恒定区b(clb),以及重链恒定区b(chb)。
44.在一些实施方案中,所述chb包含如seq id no:15或20所示的氨基酸序列,或与seq id no:15或20所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:15或20所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
45.在一些实施方案中,所述clb包含如seq id no:14所示的氨基酸序列,或与seq id no:14所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:14所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
46.在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体包含一条重链b以及一条轻链b;所述重链b和轻链b配对形成cd47抗原结合位点。
47.在一些实施方案中,所述重链b包含如seq id no:17或22所示的氨基酸序列,或与seq id no:17或22所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:17或22所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
48.在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与cd47的亲和力指数kd≤10nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与cd47的亲和力指数kd≤5nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与cd47的亲和力指数kd≤4nm。
49.在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段不引起红细胞凝集。
50.另一方面,本发明提供一种抗pd-l1/cd47双特异抗体或抗原结合片段,所述抗pd-l1/cd47双特异抗体或抗原结合片段包含特异性结合pd-l1的可变区a,以及特异性结合cd47的可变区b。
51.其中,所述可变区a包含(a)-(f)中一种或多种氨基酸序列:
52.(a)vha cdr1,其包含如seq id no:1所示的氨基酸序列,或与seq id no:1所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
53.(b)vha cdr2,其包含如seq id no:2所示的氨基酸序列,或与seq id no:2所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
54.(c)vha cdr3,其包含如seq id no:3所示的氨基酸序列,或与seq id no:3所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
55.(d)vla cdr1,其包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
56.(e)vla cdr2,其包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
57.(f)vla cdr3,其包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
58.所述可变区b包含(g)-(l)中一种或多种氨基酸序列:
59.(g)vhb cdr1,其包含如seq id no:7所示的氨基酸序列,或与seq id no:7所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
60.(h)vhb cdr2,其包含如seq id no:8所示的氨基酸序列,或与seq id no:8所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
61.(i)vhb cdr3,其包含如seq id no:9所示的氨基酸序列,或与seq id no:9所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
62.(j)vlb cdr1,其包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
63.(k)vlb cdr2,其包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;
64.(l)vlb cdr3,其包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
65.在一些实施方案中,所述可变区a包含重链可变区a(vha),所述重链可变区a包含
vha cdr1、vha cdr2、vha cdr3;其中vha cdr1包含如seq id no:1所示的氨基酸序列;vha cdr2包含如seq id no:2所示的氨基酸序列;vha cdr3包含如seq id no:3所示的氨基酸序列。所述可变区b包含重链可变区b(vhb),所述重链可变区b包含vhb cdr1、vhb cdr2、vhb cdr3;其中vhb cdr1包含如seq id no:7所示的氨基酸序列;vhb cdr2包含如seq id no:8所示的氨基酸序列;vhb cdr3包含如seq id no:9所示的氨基酸序列。
66.在一些实施方案中,所述可变区a包含轻链可变区a(vla),所述轻链可变区a包含vla cdr1、vla cdr2和vla cdr3;其中vla cdr1包含如seq id no:4所示的氨基酸序列;vla cdr2包含如seq id no:5所示的氨基酸序列;vla cdr3包含如seq id no:6所示的氨基酸序列。所述可变区b包含轻链可变区b(vlb),所述轻链可变区b包含vlb cdr1、vlb cdr2和vlb cdr3;其中vlb cdr1包含如seq id no:4所示的氨基酸序列;vlb cdr2包含如seq id no:5所示的氨基酸序列;vlb cdr3包含如seq id no:6所示的氨基酸序列。
67.在一些实施方案中,所述可变区a包含vha和vla;所述可变区b包含vhb和vlb。所述vha包含vha cdr1、vha cdr2、vha cdr3;所述vla包含vla cdr1、vla cdr2和vla cdr3。其中,vha cdr1包含如seq id no:1所示的氨基酸序列;vha cdr2包含如seq id no:2所示的氨基酸序列;vha cdr3包含如seq id no:3所示的氨基酸序列。所述vhb包含vhb cdr1、vhb cdr2、vhb cdr3;所述vlb包含vlb cdr1、vlb cdr2和vlb cdr3。其中,vhb cdr1包含如seq id no:7所示的氨基酸序列;vhb cdr2包含如seq id no:8所示的氨基酸序列;vhb cdr3包含如seq id no:9所示的氨基酸序列。vla cdr1或vlb cdr1包含如seq id no:4所示的氨基酸序列;vla cdr2或vlb cdr2包含如seq id no:5所示的氨基酸序列;vla cdr3或vlb cdr3包含如seq id no:6所示的氨基酸序列。
68.在一些实施方案中,所述vha cdr1包含如seq id no:1所示的氨基酸序列,或与seq id no:1所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vha cdr2包含如seq id no:2所示的氨基酸序列,或与seq id no:2所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vha cdr3包含如seq id no:3所示的氨基酸序列,或与seq id no:3所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vhb cdr1包含如seq id no:7所示的氨基酸序列,或与seq id no:7所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vhb cdr2包含如seq id no:8所示的氨基酸序列,或与seq id no:8所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vhb cdr3包含如seq id no:9所示的氨基酸序列,或与seq id no:9所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
69.在一些实施方案中,所述vla cdr1或vlb cdr1包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr2或vlb cdr2包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr3或vlb cdr3包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
70.在一些实施方案中,所述vha cdr1包含如seq id no:1所示的氨基酸序列,或与seq id no:1所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vha cdr2包含如seq id no:2所示的氨基酸序列,或与seq id no:2所示的氨基酸序列相比
具有一个或多个保守氨基酸取代的氨基酸序列。所述vha cdr3包含如seq id no:3所示的氨基酸序列,或与seq id no:3所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vhb cdr1包含如seq id no:7所示的氨基酸序列,或与seq id no:7所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vhb cdr2包含如seq id no:8所示的氨基酸序列,或与seq id no:8所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述vhb cdr3包含如seq id no:9所示的氨基酸序列,或与seq id no:9所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr1或vlb cdr1包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr2或vlb cdr2包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla cdr3或vlb cdr3包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
71.在一些实施方案中,所述vla cdr1与所述vlb cdr1包含相同的氨基酸序列。
72.在一些实施方案中,所述vla cdr2与所述vlb cdr2包含相同的氨基酸序列。
73.在一些实施方案中,所述vla cdr3与所述vlb cdr3包含相同的氨基酸序列。
74.在一些实施方案中,所述vla cdr1与所述vlb cdr1包含相同的氨基酸序列,所述vla cdr2与所述vlb cdr2包含相同的氨基酸序列,以及所述vla cdr3与所述vlb cdr3包含相同的氨基酸序列。
75.在一些实施方案中,所述可变区a包含重链可变区vha和轻链可变区vla;其中,所述vha包含如seq id no:10所示的氨基酸序列,或与seq id no:10所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:10所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;和/或所述vla包含如seq id no:12所示的氨基酸序列,或与seq id no:12所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:12所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
76.在一些实施方案中,所述可变区b包含重链可变区vhb和轻链可变区vlb;其中,所述vhb包含如seq id no:11所示的氨基酸序列,或与seq id no:11所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列;和/或所述vlb包含如seq id no:12所示的氨基酸序列,或与seq id no:12所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列。
77.在一些实施方案中,所述vha包含如seq id no:10所示的氨基酸序列,或与seq id no:10所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:10所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vhb包含如seq id no:11所示的氨基酸序列,或与seq id no:11所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:11所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
78.在一些实施方案中,所述vla或vlb包含如seq id no:12所示的氨基酸序列,或与seq id no:12所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:12所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
79.在一些实施方案中,所述可变区a包含vha和vla;所述可变区b包含vhb和vlb。所述
vha包含如seq id no:10所示的氨基酸序列,或与seq id no:10所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:10所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vhb包含如seq id no:11所示的氨基酸序列,或与seq id no:11所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:11所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vla或vlb包含如seq id no:12所示的氨基酸序列,或与seq id no:12所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:12所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
80.在一些实施方案中,所述vla与所述vlb包含相同的氨基酸序列。
81.在一些实施方案中,本发明提供的一种抗pd-l1/cd47双特异抗体或抗原结合片段,所述抗pd-l1/cd47双特异抗体或抗原结合片段还包含轻链恒定区a(cla),以及重链恒定区a(cha),轻链恒定区b(clb),以及重链恒定区b(chb)。
82.在一些实施方案中,所述vha与cha连接形成重链a,所述vhb与chb连接形成重链b。在一些实施方案中,所述vla与cla连接形成轻链a,所述vlb与clb连接形成轻链b。
83.在一些实施方案中,所述cha为igg1亚型。在一些实施方案中,所述chb为igg1亚型。
84.在一些实施方案中,所述cha和/或chb包含如下一种或多种氨基酸突变的igg1亚型:y349c、s354c、t366w、t366s、l368a以及y407v,其中氨基酸位置为eu编号。
85.在一些实施方案中,所述cha和/或chb包含如下氨基酸突变的igg1亚型:n297a,其中氨基酸位置为eu编号。
86.在一些实施方案中,所述cha和chb中的一个重链恒定区包含如下一种或多种氨基酸突变:n297a、y349c、t366s、l368a以及y407v。
87.在一些实施方案中,所述cha和chb中的另一个重链恒定区包含如下一种或多种氨基酸突变:n297a、s354c以及t366w。
88.在一些实施方案中,所述cha包含如seq id no:13或19所示的氨基酸序列,或与seq id no:13或19所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:13或19所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述chb包含如seq id no:15或20所示的氨基酸序列,或与seq id no:15或20所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:15或20所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
89.在一些实施方案中,所述cha包含如seq id no:13或19所示的氨基酸序列,或与seq id no:13或19所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:13或19所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
90.在一些实施方案中,所述chb包含如seq id no:15或20所示的氨基酸序列,或与seq id no:15或20所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:15或20所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
91.在一些实施方案中,所述cha包含如seq id no:13所示的氨基酸序列,所述chb包含如seq id no:15所示的氨基酸序列。在一些实施方案中,所述cha包含如seq id no:19所示的氨基酸序列,所述chb包含如seq id no:20所示的氨基酸序列。
92.在一些实施方案中,所述cla包含如seq id no:14所示的氨基酸序列,或与seq id no:14所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:14所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述clb包含如seq id no:14所示的氨基酸序列,或与seq id no:14所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:14所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
93.在一些实施方案中,所述重链a包含如seq id no:16或21所示的氨基酸序列,或与seq id no:16或21所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:16或21所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述重链b包含如seq id no:17或22所示的氨基酸序列,或与seq id no:17或22所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:17或22所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。在一些实施方案中,所述轻链a和轻链b包含相同的氨基酸序列。在一些实施方案中,所述轻链a和轻链b均包含如seq id no:18所示的氨基酸序列,或与seq id no:18所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:18所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
94.在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与pd-l1的亲和力指数kd≤10nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与pd-l1的亲和力指数kd≤1nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与pd-l1的亲和力指数kd≤0.5nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与pd-l1的亲和力指数kd≤0.2nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与cd47的亲和力指数kd≤10nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与cd47的亲和力指数kd≤5nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与cd47的亲和力指数kd≤4nm。在一些实施方案中,本发明提供的抗pd-l1/cd47双特异抗体或抗原结合片段与pd-l1结合的亲和力大于与cd47结合的亲和力。
95.另一方面,本发明提供了一种抗pd-l1/cd47双特异抗体或抗原结合片段,所述抗pd-l1/cd47双特异抗体或抗原结合片段包含特异性结合pd-l1的可变区a,特异性结合cd47的可变区b,轻链恒定区,以及重链恒定区;所述重链恒定区为igg1亚型,或包含如下一种或多种氨基酸突变的igg1亚型:y349c、s354c、t366w、t366s、l368a以及y407v,其中氨基酸位置为eu编号。
96.在一些实施方案中,所述重链恒定区还包含如下氨基酸突变的igg1亚型,其中氨基酸位置为eu编号:n297a。
97.在一些实施方案中,所述重链恒定区包含第一重链恒定区和第二重链恒定区,所述第一重链恒定区包含如下一种或多种氨基酸突变:
98.n297a、s354c以及t366w;和/或
99.所述第二重链恒定区包含如下一种或多种氨基酸突变:
100.n297a、y349c、t366s、l368a以及y407v。
101.在一些实施方案中,所述第一重链恒定区包含如seq id no:13或19所示的氨基酸
序列,或与seq id no:13或19所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:13或19所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;和/或所述第二重链恒定区包含如seq id no:15或20所示的氨基酸序列,或与seq id no:15或20所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:15或20所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
102.在一些实施方案中,所述可变区a中的vha与所述第一重链恒定区连接,所述可变区b中的vhb与所述第二重链恒定区连接;或,所述可变区a中的vha与所述第二重链恒定区连接,所述可变区b中的vhb与所述第一重链恒定区连接。
103.在一些实施方案中,所述轻链恒定区包含如seq id no:14所示的氨基酸序列,或与seq id no:14所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:14所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
104.在一些实施方案中,所述抗pd-l1/cd47双特异抗体或抗原结合片段包含本文所述的可变区a,和本文所述的可变区b。
105.另一方面,本发明提供了一种抗pd-l1/cd47双特异抗体或抗原结合片段,所述抗pd-l1/cd47双特异抗体或抗原结合片段包含一条重链a、一条重链b以及两条相同的轻链。
106.在一些实施方案中,所述轻链的可变区(vl)包含vl cdr1、vl cdr2和vl cdr3;其中vl cdr1,其包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;vl cdr2,其包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;vl cdr3,其包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
107.在一些实施方案中,所述vl cdr1包含如seq id no:4所示的氨基酸序列,或与seq id no:4所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vl cdr2包含如seq id no:5所示的氨基酸序列,或与seq id no:5所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。所述vl cdr3包含如seq id no:6所示的氨基酸序列,或与seq id no:6所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
108.在一些实施方案中,所述vl包含如seq id no:12所示的氨基酸序列,或与seq id no:12所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:12所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
109.在一些实施方案中,所述轻链包含如seq id no:18所示的氨基酸序列,或与seq id no:18所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:18所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
110.在一些实施方案中,所述重链a和一条所述轻链配对形成pd-l1抗原结合位点,所述重链b和另一条所述轻链配对形成cd47抗原结合位点。
111.在一些实施方案中,所述重链a包含如seq id no:16或21所示的氨基酸序列,或与
seq id no:16或21所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:16或21所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述重链b包含如seq id no:17或22所示的氨基酸序列,或与seq id no:17或22所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:17或22所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列;所述轻链包含如seq id no:18所示的氨基酸序列,或与seq id no:18所示的氨基酸序列有至少80%或至少90%同一性的氨基酸序列,或与seq id no:18所示的氨基酸序列相比具有一个或多个保守氨基酸取代的氨基酸序列。
112.在一些实施方案中,所述抗pd-l1/cd47双特异抗体或抗原结合片段与pd-l1的亲和力指数kd≤1nm。
113.在一些实施方案中,所述抗pd-l1/cd47双特异抗体或抗原结合片段与cd47的亲和力指数kd≤10nm。
114.在一些实施方案中,本发明的抗pd-l1/cd47双特异抗体或抗原结合片段具有以下一种或多种性质:
115.(a)在一些实施方案中,本发明的抗pd-l1/cd47双特异抗体能够同时与pd-l1和cd47结合,且维持了亲本抗体的亲和力常数,由此,能够阻断pd1/pd-l1信号传导通路和阻断sirpα/cd47信号传导通路;
116.(b)在一些实施方案中,本发明的抗pd-l1/cd47双特异抗体能够以超高的亲和力(例如,kd=0.174nm)与pd-l1结合,以高亲和力(例如,kd=3.78nm)与cd47结合;通过与肿瘤细胞上pd-l1的特异性结合促进了本发明的抗pd-l1/cd47双特异抗体对肿瘤细胞的选择性结合,避免了与许多正常组织中表达的cd47结合,减少副作用;通过当与cd47的亲和力远低于与pd-l1的亲和力,可显著扩大本发明的抗pd-l1/cd47双特异抗体的有效剂量范围;
117.(c)在一些实施方案中,本发明的抗pd-l1/cd47双特异抗体,设计了能够避免非相关重链和轻链配对的共同轻链;
118.(d)在一些实施方案中,本发明的抗pd-l1/cd47双特异抗体,设计了能够稳定四链抗体结构和有利于各条链之间的正确偶合或配对的氨基酸残基。在一些实施方案中,本发明的抗pd-l1/cd47双特异抗体各自的fc结构域中分别包含y349c和s354c或者分别包含s354c和y349c;本发明的抗pd-l1/cd47双特异抗体各自的fc结构域中分别包含凸起(“杆(knob)”)或空穴(“臼(hole)”),并且第一多肽链fc结构域中的所述凸起或空穴可分别置于第三多肽链fc结构域中的所述空穴或凸起中,由此所述第一多肽链和第三多肽链彼此形成“杆入臼(knob-in-hole)”的稳定缔合;其中,第一多肽链包含结构vha-cha,第一多肽链和轻链可特异性识别并结合pd-l1;第三多肽链包含结构vhb-chb,第三多肽链和轻链可特异性识别并结合cd47。
119.(e)在一些实施方案中,本发明的抗pd-l1/cd47双特异抗体,具有易于在体外的培养细胞中稳定表达,热稳定性好,抗体产率和纯度高,不需要复杂的生产工艺等优点;
120.(f)本发明的抗pd-l1/cd47双特异抗体或抗原结合片段结合表达人pd-l1的细胞,在一些实施方案中,例如,以小于或等于大约2nm、1nm、0.9nm、0.8nm、0.7nm、0.6nm、0.5nm、0.4nm、0.3nm、0.2nm或0.1nm的ec
50
结合表达人pd-l1的细胞。在一些实施方案中,所述结合用流式细胞术(例如facs)测定。在一些实施方案中,表达人pd-l1的细胞为表达人pd-l1的
remodeling the domain interface of a homodimer using aphage display library,j.mol.biol,270:p.26-35(1997);paul carter,bispecific human igg by design,journal of immunological methods,248,7-15(2001);专利us8216805b2)。该技术可在本发明抗pd-l1/cd47双特异抗体的不同链之间改造界面,以促进本发明抗pd-l1/cd47双特异抗体的各条链正确缔合。通常,该技术涉及在一条链的界面引入“凸起”(“杆(knobs)”),在欲与之配对的另一条链的界面引入相应的“空穴”(“臼(holes)”),使得凸起可置于空穴中。可通过将来自一条链的重链恒定结构域的ch3结构域的界面的氨基酸侧链替换为较大的侧链(如氨基酸置换t366w(eu编号))来构建凸起。通过将大氨基酸侧链替换为较小的侧链(例如氨基酸置换t366s、l368a和y407v(eu编号)),在欲配对的另一条链的重链恒定结构域的ch3结构域的界面构建与凸起相同或相似大小的补偿性空穴。在一些实施方案中,一条重链fc结构域中包含y349c,t366s,l368a和y407v,另一条重链fc结构域中包含s354c和t366w,形成“杆入臼(knob-in-hole)”的稳定缔合。
129.在一些实施方案中,本发明抗pd-l1/cd47双特异抗体的fc区包含对fc受体的结合亲和力的修饰。在一些实施方案中,所述fc受体是fcγ受体,特别地是人fcγ受体。在一个实施方案中,所述fc受体是活化性fc受体。在一些实施方案中,所述修饰减少本发明双特异抗体的效应子功能。在一些实施方案中,所述效应子功能是抗体依赖的细胞介导的细胞毒性(adcc)。在一些实施方案中,所述修饰在所述免疫球蛋白分子fc区内,特别地在其ch2区内。在一些实施方案中,所述免疫球蛋白分子包含在免疫球蛋白重链第297位置(eu编号)处的氨基酸置换。在一个具体实施方案中,所述氨基酸置换是n297a(参见,例如,j.lund等,oligosaccharide-protein interactions in igg can modulate recognition by fc gamma receptors,faseb.j.9,115-119(1995))。
130.在一些实施方案中,本发明的抗pd-l1/cd47双特异抗体的重链的信号肽序列,例如mefglswvflvailkgvqc(seq id no:23)。在一些实施方案中,本发明的抗pd-l1/cd47双特异抗体的轻链的信号肽序列,例如mdmrvlaqllgllllcfpgarc(seq id no:24)。
131.在一些实施方案中,所述抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a,所述抗体bsab-71-n297a的重链a包含如seq id no:16所示的氨基酸序列,所述抗体bsab-71-n297a的重链b包含如seq id no:17所示的氨基酸序列,所述抗体bsab-71-n297a的轻链a和轻链b具有相同的氨基酸序列(共同轻链),所述抗体bsab-71-n297a的轻链a和轻链b包含如seq id no:18所示的氨基酸序列。
132.在一些实施方案中,所述抗pd-l1/cd47双特异抗体为抗体bsab-71,所述抗体bsab-71的重链a包含如seq id no:21所示的氨基酸序列,所述抗体bsab-71的重链b包含如seq id no:22所示的氨基酸序列,所述抗体bsab-71的轻链a和轻链b具有相同的氨基酸序列(共同轻链),所述抗体bsab-71的轻链a和轻链b包含如seq id no:18所示的氨基酸序列。
133.抗pd-l1/cd47双特异抗体或抗原结合片段可以通过基因工程在宿主细胞中表达,并通过纯化获得;纯化可以采用常规方法进行,例如先离心细胞悬液并收集上清液,再次离心进一步去除杂质。proteina亲和柱和离子交换柱等方法可以用于纯化抗体蛋白。宿主细胞包括但不限于中国仓鼠卵巢细胞cho或从cho细胞修饰的cho-s、cho-dhfr-、cho/dg44或expicho;以及人胚肾细胞hek293或从hek293细胞修饰的hek293t、hek293f或hek293e。
134.抗体可通过公知的技术纯化,例如利用蛋白a或蛋白g进行亲和层析,其主要提供
了免疫血清中的igg级分。另外,可将免疫球蛋白所靶向的特异抗原或其表位固定于柱上,以通过免疫亲和色谱来纯化免疫特异性抗体。免疫球蛋白的纯化可参考d.wilkinson的文章(the scientist,由the scientist,inc.,philadelphia pa.出版,第14卷,第8期(2000年4月17日),第25-28页)。
135.在一些实施方案中,抗pd-l1/cd47双特异抗体由cho细胞系表达。
136.在一些实施方案中,所述方法或用途包括:向有需要的患者施用有效量的抗pd-l1/cd47双特异抗体或抗原结合片段。在一些实施方案中,所述抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a或bsab-71。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段施用的剂量的范围为从约0.1mg/kg到约100mg/kg,可以是例如每周两次(biw)或至每月一次。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段施用的剂量为每剂约0.1mg/kg至100mg/kg。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段是以每两天一次到每六周一次给药。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段是以每两天一次、每三天一次、每四天一次、每五天一次、每周两次、每周一次、每两周一次、每三周一次、每月一次或每六周一次给药。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段每次施用的剂量为约0.1mg/kg至100mg/kg。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段每次施用的剂量为约6mg至3000mg。
137.在一些实施方案中,患者患有与pd-l1和cd47相关的病症。在一些实施方案中,患者患有自身免疫性疾病、炎性疾病、感染性疾病(例如,慢性传染病或败血症)、肿瘤(包括良性肿瘤或癌症)。在一些实施方案中,自身免疫性疾病和炎性疾病,包括关节炎、类风湿性关节炎、多发性硬化、银屑病、银屑病关节炎、克罗恩病、炎性肠病、溃疡性结肠炎、狼疮、系统性红斑狼疮、幼年型类风湿性关节炎、幼年型特发性关节炎、格雷夫氏病、桥本氏甲状腺炎、艾迪生病、乳糜泻、皮肌炎、多发性硬化、重症肌无力、恶性贫血、舍格伦综合征、i型糖尿病、血管炎、葡萄膜炎以及强直性脊柱炎;自身炎性疾病,包括家族性地中海热、新生儿发病多系统炎性疾病、肿瘤坏死因子(tnf)受体相关周期性综合症、白介素1受体拮抗剂缺陷、白塞病;心血管疾病,包括冠心病、冠状动脉疾病、粥样硬化、心肌梗死、心力衰竭、以及左心室心力衰竭。在一些实施方案中,癌症包括但不限于实体瘤、血液癌症或转移性病灶。在一些实施方案中,血液癌症包括但不限于白血病、淋巴瘤或骨髓瘤。在一些实施方案中,白血病包括但不限于急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、慢性淋巴细胞白血病(cll)、慢性骨髓性白血病(cml)、骨髓性增生疾病/肿瘤(mpds)、脊髓发育不良综合征。在一些实施方案中,淋巴瘤包括但不限于弥漫大b细胞淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、伯基特淋巴瘤和滤泡型淋巴瘤(小细胞和大细胞)。在一些实施方案中,骨髓瘤包括但不限于多发性骨髓瘤(mm)、巨细胞骨髓瘤、重链骨髓瘤和轻链或本斯-琼斯骨髓瘤。在一些实施方案中,实体瘤包括但不限于乳腺癌、卵巢癌、肺癌、前列腺癌、黑素瘤、结直肠癌、头颈癌、膀胱癌、食管癌、肝癌、肾癌、胃癌、宫颈癌、胰腺癌、甲状腺癌、神经胶质瘤、唾液腺癌、平滑肌肉瘤、胸腺癌或上皮癌。在一些实施方案中,癌症为尚无有效治疗手段的经病理学确诊的局部晚期或转移性恶性实体肿瘤。
138.在一些实施方案中,本发明公开了一种用于治疗有需要患者的自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,其包括施用有效量的抗pd-l1/cd47双特异抗
体或抗原结合片段,其中抗pd-l1/cd47双特异抗体或抗原结合片段施用的剂量为约6mg至3000mg每个治疗周期。在一些实施方案中,一个治疗周期为一周、两周、三周、四周、五周、六周、七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值。在一些实施方案中,所述抗pd-l1/cd47双特异抗体为bsab-71-n297a或bsab-71。
139.在一些实施方案中,可以将抗pd-l1/cd47双特异抗体配制成药物组合物,并以适合于所选给药途径的多种形式向患者给药,给药途径例如口服给药、直肠给药、肠胃外给药、脑池内给药、阴道内给药、腹腔内给药、外敷(如通过粉末,软膏,滴剂或透皮贴剂)、口腔给药或通过口服或鼻腔喷雾给药。在一些实施方案中,可以将抗pd-l1/cd47双特异抗体静脉输注或皮下注射。
140.本发明使用的术语“肠胃外”是指包括静脉内、肌肉内、腹腔内、胸骨内、皮下和关节内注射和输注的施用方式。
141.施用方式可以是全身施用或局部施用。此外,可能需要通过任何合适的途径将本发明的抗体引入中枢神经系统,包括脑室内和鞘内注射;脑室内注射可以通过脑室内导管连接到如贮液囊(可以是ommaya贮液囊)来辅助注射。也可以通过肺部给药,例如通过使用吸入器或喷雾器,以及使用雾化的制剂。
142.在一些实施方案中,抗pd-l1/cd47双特异抗体可以局部施用于需要治疗的区域;可以通过但不限于以下方式:手术期间局部输注,例如与手术后伤口敷料联合的局部应用,通过注射,通过导管,借助栓剂或借助植入物来实现,所述植入物是多孔的、无孔的或凝胶状的材料,包括膜(例如硅橡胶膜)或纤维。优选地,当施用本发明的蛋白质(包括抗体)时,必须注意使用不吸收蛋白质的材料。
143.各种已知输送系统可用于施用抗pd-l1/cd47双特异抗体,例如包封于脂质体、微粒、微胶囊、能够表达所述化合物的重组细胞、受体介导的内吞作用(参见例如wu andwu,1987,j.biol.chem.262:4429-4432)、作为逆转录病毒或其它载体的一部分的核酸的构建等。抗pd-l1/cd47双特异抗体的给药量将取决于药物的性质、细胞表面触发药物的内在化、运输和释放的程度,以及所治疗的疾病和患者的状况(如年龄、性别、体重等)。
144.在一些实施方案中,每次施用的抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约0.1mg/kg至100mg/kg或含此剂量抗pd-l1/cd47双特异抗体的制剂。在一些实施方案中,每次施用的抗pd-l1/cd47双特异抗体的剂量为约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约0.9mg/kg、约1mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24mg/kg、约25mg/kg、约26mg/kg、约27mg/kg、约28mg/kg、约29mg/kg、约30mg/kg、约31mg/kg、约32mg/kg、约33mg/kg、约34mg/kg、约35mg/kg、约36mg/kg、约37mg/kg、约38mg/kg、约39mg/kg、约40mg/kg、约41mg/kg、约42mg/kg、约43mg/kg、约44mg/kg、约45mg/kg、约46mg/kg、约47mg/kg、约48mg/kg、约49mg/kg、约50mg/kg、约51mg/kg、约52mg/kg、约53mg/kg、约54mg/kg、约55mg/kg、约56mg/kg、约57mg/kg、约58mg/kg、约59mg/kg、约60mg/kg、约61mg/kg、约62mg/kg、约63mg/kg、约64mg/kg、约65mg/kg、约66mg/kg、约67mg/kg、约68mg/kg、约69mg/kg、约70mg/kg、约71mg/kg、约72mg/kg、约73mg/kg、约74mg/kg、约75mg/kg、约76mg/kg、约77mg/kg、约78mg/kg、约79mg/
kg、约80mg/kg、约81mg/kg、约82mg/kg、约83mg/kg、约84mg/kg、约85mg/kg、约86mg/kg、约87mg/kg、约88mg/kg、约89mg/kg、约90mg/kg、约91mg/kg、约92mg/kg、约93mg/kg、约94mg/kg、约95mg/kg、约96mg/kg、约97mg/kg、约98mg/kg、约99mg/kg、约100mg/kg,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体的制剂。在一些实施方案中,约一周、约两周、约三周、约四周、约五周、约六周、约七周给药1次。
145.在一些实施方案中,本发明公开了一种治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:每周向有需要的患者给予两次约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约0.9mg/kg、约1mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24mg/kg、约25mg/kg、约26mg/kg、约27mg/kg、约28mg/kg、约29mg/kg、约30mg/kg、约31mg/kg、约32mg/kg、约33mg/kg、约34mg/kg、约35mg/kg、约36mg/kg、约37mg/kg、约38mg/kg、约39mg/kg、约40mg/kg、约41mg/kg、约42mg/kg、约43mg/kg、约44mg/kg、约45mg/kg、约46mg/kg、约47mg/kg、约48mg/kg、约49mg/kg、约50mg/kg、约51mg/kg、约52mg/kg、约53mg/kg、约54mg/kg、约55mg/kg、约56mg/kg、约57mg/kg、约58mg/kg、约59mg/kg、约60mg/kg、约61mg/kg、约62mg/kg、约63mg/kg、约64mg/kg、约65mg/kg、约66mg/kg、约67mg/kg、约68mg/kg、约69mg/kg、约70mg/kg、约71mg/kg、约72mg/kg、约73mg/kg、约74mg/kg、约75mg/kg、约76mg/kg、约77mg/kg、约78mg/kg、约79mg/kg、约80mg/kg、约81mg/kg、约82mg/kg、约83mg/kg、约84mg/kg、约85mg/kg、约86mg/kg、约87mg/kg、约88mg/kg、约89mg/kg、约90mg/kg、约91mg/kg、约92mg/kg、约93mg/kg、约94mg/kg、约95mg/kg、约96mg/kg、约97mg/kg、约98mg/kg、约99mg/kg、约100mg/kg的抗体bsab-71-n297a或bsab-71,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗体bsab-71-n297a或bsab-71的制剂。
146.在一些实施方案中,本发明公开了一种治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:每周向有需要的患者给予一次约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约0.9mg/kg、约1mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24mg/kg、约25mg/kg、约26mg/kg、约27mg/kg、约28mg/kg、约29mg/kg、约30mg/kg、约31mg/kg、约32mg/kg、约33mg/kg、约34mg/kg、约35mg/kg、约36mg/kg、约37mg/kg、约38mg/kg、约39mg/kg、约40mg/kg、约41mg/kg、约42mg/kg、约43mg/kg、约44mg/kg、约45mg/kg、约46mg/kg、约47mg/kg、约48mg/kg、约49mg/kg、约50mg/kg、约51mg/kg、约52mg/kg、约53mg/kg、约54mg/kg、约55mg/kg、约56mg/kg、约57mg/kg、约58mg/kg、约59mg/kg、约60mg/kg、约61mg/kg、约62mg/kg、约63mg/kg、约64mg/kg、约65mg/kg、约66mg/kg、约67mg/kg、约68mg/kg、约69mg/kg、约70mg/kg、约71mg/kg、约72mg/kg、约73mg/kg、约74mg/kg、约75mg/kg、约76mg/kg、约77mg/kg、约78mg/kg、约79mg/kg、约80mg/kg、约81mg/kg、约82mg/kg、约83mg/kg、约84mg/kg、约85mg/kg、约86mg/kg、约87mg/kg、约88mg/kg、约89mg/kg、约90mg/kg、约91mg/kg、约92mg/kg、约93mg/kg、约94mg/
kg、约95mg/kg、约96mg/kg、约97mg/kg、约98mg/kg、约99mg/kg、约100mg/kg的抗体bsab-71-n297a或bsab-71,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗体bsab-71-n297a或bsab-71的制剂。
147.在一些实施方案中,本发明公开了一种治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:每两周向有需要的患者给予一次约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约0.9mg/kg、约1mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24mg/kg、约25mg/kg、约26mg/kg、约27mg/kg、约28mg/kg、约29mg/kg、约30mg/kg、约31mg/kg、约32mg/kg、约33mg/kg、约34mg/kg、约35mg/kg、约36mg/kg、约37mg/kg、约38mg/kg、约39mg/kg、约40mg/kg、约41mg/kg、约42mg/kg、约43mg/kg、约44mg/kg、约45mg/kg、约46mg/kg、约47mg/kg、约48mg/kg、约49mg/kg、约50mg/kg、约51mg/kg、约52mg/kg、约53mg/kg、约54mg/kg、约55mg/kg、约56mg/kg、约57mg/kg、约58mg/kg、约59mg/kg、约60mg/kg、约61mg/kg、约62mg/kg、约63mg/kg、约64mg/kg、约65mg/kg、约66mg/kg、约67mg/kg、约68mg/kg、约69mg/kg、约70mg/kg、约71mg/kg、约72mg/kg、约73mg/kg、约74mg/kg、约75mg/kg、约76mg/kg、约77mg/kg、约78mg/kg、约79mg/kg、约80mg/kg、约81mg/kg、约82mg/kg、约83mg/kg、约84mg/kg、约85mg/kg、约86mg/kg、约87mg/kg、约88mg/kg、约89mg/kg、约90mg/kg、约91mg/kg、约92mg/kg、约93mg/kg、约94mg/kg、约95mg/kg、约96mg/kg、约97mg/kg、约98mg/kg、约99mg/kg、约100mg/kg的抗体bsab-71-n297a或bsab-71,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗体bsab-71-n297a或bsab-71的制剂。
148.在一些实施方案中,本发明公开了一种治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:向有需要的患者给予约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约0.9mg/kg、约1mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24mg/kg、约25mg/kg、约26mg/kg、约27mg/kg、约28mg/kg、约29mg/kg、约30mg/kg、约31mg/kg、约32mg/kg、约33mg/kg、约34mg/kg、约35mg/kg、约36mg/kg、约37mg/kg、约38mg/kg、约39mg/kg、约40mg/kg、约41mg/kg、约42mg/kg、约43mg/kg、约44mg/kg、约45mg/kg、约46mg/kg、约47mg/kg、约48mg/kg、约49mg/kg、约50mg/kg、约51mg/kg、约52mg/kg、约53mg/kg、约54mg/kg、约55mg/kg、约56mg/kg、约57mg/kg、约58mg/kg、约59mg/kg、约60mg/kg、约61mg/kg、约62mg/kg、约63mg/kg、约64mg/kg、约65mg/kg、约66mg/kg、约67mg/kg、约68mg/kg、约69mg/kg、约70mg/kg、约71mg/kg、约72mg/kg、约73mg/kg、约74mg/kg、约75mg/kg、约76mg/kg、约77mg/kg、约78mg/kg、约79mg/kg、约80mg/kg、约81mg/kg、约82mg/kg、约83mg/kg、约84mg/kg、约85mg/kg、约86mg/kg、约87mg/kg、约88mg/kg、约89mg/kg、约90mg/kg、约91mg/kg、约92mg/kg、约93mg/kg、约94mg/kg、约95mg/kg、约96mg/kg、约97mg/kg、约98mg/kg、约99mg/kg、约100mg/kg的抗体bsab-71-n297a或bsab-71,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗体bsab-71-n297a或bsab-71的制剂,第一次给药四周后每两周给药一次。
149.在一些实施方案中,本发明公开了一种治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:每三周向有需要的患者给予一次约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约0.9mg/kg、约1mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24mg/kg、约25mg/kg、约26mg/kg、约27mg/kg、约28mg/kg、约29mg/kg、约30mg/kg、约31mg/kg、约32mg/kg、约33mg/kg、约34mg/kg、约35mg/kg、约36mg/kg、约37mg/kg、约38mg/kg、约39mg/kg、约40mg/kg、约41mg/kg、约42mg/kg、约43mg/kg、约44mg/kg、约45mg/kg、约46mg/kg、约47mg/kg、约48mg/kg、约49mg/kg、约50mg/kg、约51mg/kg、约52mg/kg、约53mg/kg、约54mg/kg、约55mg/kg、约56mg/kg、约57mg/kg、约58mg/kg、约59mg/kg、约60mg/kg、约61mg/kg、约62mg/kg、约63mg/kg、约64mg/kg、约65mg/kg、约66mg/kg、约67mg/kg、约68mg/kg、约69mg/kg、约70mg/kg、约71mg/kg、约72mg/kg、约73mg/kg、约74mg/kg、约75mg/kg、约76mg/kg、约77mg/kg、约78mg/kg、约79mg/kg、约80mg/kg、约81mg/kg、约82mg/kg、约83mg/kg、约84mg/kg、约85mg/kg、约86mg/kg、约87mg/kg、约88mg/kg、约89mg/kg、约90mg/kg、约91mg/kg、约92mg/kg、约93mg/kg、约94mg/kg、约95mg/kg、约96mg/kg、约97mg/kg、约98mg/kg、约99mg/kg、约100mg/kg的抗体bsab-71-n297a或bsab-71,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗体bsab-71-n297a或bsab-71的制剂。
150.在一些实施方案中,本发明公开了一种治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:每四周向有需要的患者给予一次约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.5mg/kg、约0.9mg/kg、约1mg/kg、约2mg/kg、约2.5mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约11mg/kg、约12mg/kg、约13mg/kg、约14mg/kg、约15mg/kg、约16mg/kg、约17mg/kg、约18mg/kg、约19mg/kg、约20mg/kg、约21mg/kg、约22mg/kg、约23mg/kg、约24mg/kg、约25mg/kg、约26mg/kg、约27mg/kg、约28mg/kg、约29mg/kg、约30mg/kg、约31mg/kg、约32mg/kg、约33mg/kg、约34mg/kg、约35mg/kg、约36mg/kg、约37mg/kg、约38mg/kg、约39mg/kg、约40mg/kg、约41mg/kg、约42mg/kg、约43mg/kg、约44mg/kg、约45mg/kg、约46mg/kg、约47mg/kg、约48mg/kg、约49mg/kg、约50mg/kg、约51mg/kg、约52mg/kg、约53mg/kg、约54mg/kg、约55mg/kg、约56mg/kg、约57mg/kg、约58mg/kg、约59mg/kg、约60mg/kg、约61mg/kg、约62mg/kg、约63mg/kg、约64mg/kg、约65mg/kg、约66mg/kg、约67mg/kg、约68mg/kg、约69mg/kg、约70mg/kg、约71mg/kg、约72mg/kg、约73mg/kg、约74mg/kg、约75mg/kg、约76mg/kg、约77mg/kg、约78mg/kg、约79mg/kg、约80mg/kg、约81mg/kg、约82mg/kg、约83mg/kg、约84mg/kg、约85mg/kg、约86mg/kg、约87mg/kg、约88mg/kg、约89mg/kg、约90mg/kg、约91mg/kg、约92mg/kg、约93mg/kg、约94mg/kg、约95mg/kg、约96mg/kg、约97mg/kg、约98mg/kg、约99mg/kg、约100mg/kg的抗体bsab-71-n297a或bsab-71,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗体bsab-71-n297a或bsab-71的制剂。
151.在一些实施方案中,所述方法包括至少一个、至少两个、至少三个、至少四个、至少五个、至少六个或至少七个治疗周期。在一些实施方案中,一个治疗周期为至少一周、至少两周、至少三周、至少四周、至少五周、至少六周、至少七周。在一些实施方案中,一个治疗周
期为一周至七周。在一些实施方案中,一个治疗周期为一周至六周。在一些实施方案中,一个治疗周期为一周至五周。在一些实施方案中,一个治疗周期为两周至六周。在一些实施方案中,一个治疗周期为两周至四周。在一些实施方案中,一个治疗周期为两周至三周。在一些实施方案中,约一周给药两次,或约一周、约两周、约三周、约四周、约五周、约六周、约七周给药一次。在一些实施方案中,第一次给药约四周后,约两周给药一次。在一些实施方案中,所述抗pd-l1/cd47双特异抗体是以每两天一次到每六周一次给药。在一些实施方案中,所述抗pd-l1/cd47双特异抗体是以每两天一次、每三天一次、每四天一次、每五天一次、每周两次、每周一次、每两周一次、每三周一次、每月一次或每六周一次给药。在一些实施方案中,所述抗pd-l1/cd47双特异抗体是以第一次给药四周后每两周给药一次。
152.在一些实施方案中,本发明公开了一种治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,其包括向有需要的患者施用有效量的抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂);其中,抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为单次给药约6mg至3000mg(或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂)。剂量时间表和给药方式取决于某些患者群中的抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)的获益风险评估和一般临床实践指南。
153.在一些实施方案中,患者每个治疗周期内抗pd-l1/cd47双特异抗体或抗原结合片段施用的剂量为约6mg至3000mg(或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约6mg、约7mg、约10mg、约14mg、约18mg、约21mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约435mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg、约2850mg、约2900mg、约2950mg、约3000mg,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体的制剂。在一些实施方案中,一个治疗周期为一周至七周给药一次。在一些实施方案中,一个治疗周期为两周至四周给药1次。
154.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约6mg至2800mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一
些实施方案中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约6mg、约7mg、约10mg、约18mg、约21mg、约30mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约434mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约567mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg,或这些数值中任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
155.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约6mg至18mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约6mg、约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
156.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约18mg至60mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、约31mg、约32mg、约33mg、约35mg、36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约45mg、约46mg、约47mg、约48mg、约50mg、约53mg、约55mg、约58mg、约60mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四
周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
157.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约60mg至180mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
158.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约180mg至600mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约320mg、约350mg、约400mg、约450mg、约480mg、约500mg、约520mg、约550mg、约580mg、约600mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
159.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约600mg至1200mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
160.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约1200mg至2400mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约1200mg、约1250mg、约1350mg、约1400mg、约1450mg、约1500mg、约1600mg、约1700mg、约1800mg、约
1900mg、约2000mg、约2100mg、约2200mg、约2300mg、约2400mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
161.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约7mg至21mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg,约21mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
162.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约21mg至70mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约21mg、约22mg、约23mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、约31mg、约32mg、约33mg、约35mg、36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约45mg、约46mg、约47mg、约48mg、约50mg、约53mg、约55mg、约58mg、约60mg、约61mg、约63mg、约65mg、约68mg、约70mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
163.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约70mg至210mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、约150mg、约155mg、约160mg、约165mg、约170mg、约175mg、约180mg、约185mg、约190mg、约195mg、约200mg、约205mg、约210mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
164.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结
合片段的剂量为约210mg至700mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约320mg、约350mg、约400mg、约450mg、约480mg、约500mg、约520mg、约550mg、约580mg、约600mg、约620mg、约650mg、约680mg、约700mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
165.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约700mg至1400mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约700mg、约720mg、约750mg、约780mg、约800mg、约820mg、约850mg、约880mg、约900mg、约920mg、约950mg、约980mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
166.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约1400mg至2800mg,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体或抗原结合片段的剂量为约1400mg、约1420mg、约1450mg、约1480mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
167.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约1mg至10mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约6mg给药1次;比如约7mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约6mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数
值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约7mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
168.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约15mg至25mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约18mg给药1次;比如约21mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约18mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约21mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
169.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约55mg至75mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约60mg给药1次;比如约70mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的有效量为约60mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的有效量为约70mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
170.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约150mg至230mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约180mg给药1次;比如约210mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的有效量为约180mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的有效量为约210mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
171.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约590mg至610mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约600mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约600mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一
个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
172.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约650mg至750mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约700mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约700mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
173.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约1150mg至1250mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约1200mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约1200mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
174.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约1350mg至1450mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约1400mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约1400mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
175.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约2370mg至2490mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约2400mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约2400mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
176.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约2750mg至2850mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约2800mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约2800mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
177.在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)的剂量为约2970mg至3050mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;比如约3000mg给药1次。在一些实施方案中,患者每个治疗周期内施用抗pd-l1/cd47双特异抗体的剂量为约3000mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂;其中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。
178.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)
施用的剂量为约6mg至3000mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约6mg、约7mg、约10mg、约14mg、约18mg、约21mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约435mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg、约2850mg、约2900mg、约2950mg、约3000mg,每两周一次。
179.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约6mg至2800mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约6mg、约7mg、约10mg、约14mg、约18mg、约21mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约435mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg,每两周一次。
180.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约6mg至18mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约6mg、约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg,每两周一次。
181.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约18mg至60mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、约31mg、约32mg、约33mg、约35mg、36mg、约37mg、约38mg、约39mg、约
40mg、约41mg、约42mg、约43mg、约45mg、约46mg、约47mg、约48mg、约50mg、约53mg、约55mg、约58mg、约60mg,每两周一次。
182.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约60mg至180mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg,每两周一次。
183.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约180mg至600mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约320mg、约350mg、约400mg、约450mg、约480mg、约500mg、约520mg、约550mg、约580mg、约600mg,每两周一次。
184.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约600mg至1200mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约434mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约567mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg,每两周一次。
185.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1200mg至2400mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg,每两周一次。
186.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约7mg至2800mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约7mg、约10mg、约14mg、约18mg、约21mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约435mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约
1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg,每两周一次。
187.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约7mg至21mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg,每两周一次。
188.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约21mg至70mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约21mg、约22mg、约23mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、约31mg、约32mg、约33mg、约35mg、36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约45mg、约46mg、约47mg、约48mg、约50mg、约53mg、约55mg、约58mg、约60mg、约63mg、约65mg、约68mg、约70mg,每两周一次。
189.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约70mg至210mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg,每两周一次。
190.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约210mg至700mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约434mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约567mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg,每两周一次。
191.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约700mg至1400mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg,每两周一次。
192.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1400mg至2800mg,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2430mg、约2450mg、约2480mg、约2500mg、约2530mg、约2550mg、约2580mg、约2600mg、约2630mg、约2650mg、约2680mg、约2700mg、约2730mg、约2750mg、约2780mg、约2800mg,每两周一次。
193.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1mg至10mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约6mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约7mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
194.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约15mg至25mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约18mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约21mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
195.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约55mg至75mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体的剂量为约60mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体的剂量为约70mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
196.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约150mg至230mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约180mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约210mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
197.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约590mg至610mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约600mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
198.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约690mg至710mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约700mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
199.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1150mg至1250mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体的剂量为约1200mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
200.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1350mg至1450mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体的剂量为约1400mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
201.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约2370mg至2490mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约2400mg,或含此剂量抗
pd-l1/cd47双特异抗体的制剂,每两周一次。
202.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约2770mg至2890mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约2800mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
203.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约2970mg至3050mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约3000mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,每两周一次。
204.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约6mg至3000mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约6mg、约7mg、约10mg、约14mg、约18mg、约21mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约435mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg、约2850mg、约2900mg、约2950mg、约3000mg,第一次给药四周后每两周给药一次。
205.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约6mg至2800mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约6mg、约7mg、约10mg、约14mg、约18mg、约21mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约435mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约
1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg,第一次给药四周后每两周给药一次。
206.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约6mg至18mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约6mg、约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg,第一次给药四周后每两周给药一次。
207.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约18mg至60mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、约31mg、约32mg、约33mg、约35mg、36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约45mg、约46mg、约47mg、约48mg、约50mg、约53mg、约55mg、约58mg、约60mg,第一次给药四周后每两周给药一次。
208.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约60mg至180mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg,第一次给药四周后每两周给药一次。
209.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约180mg至600mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约320mg、约350mg、约400mg、约450mg、约480mg、约500mg、约520mg、约550mg、约580mg、约600mg,第一次给药四周后每两周给药一次。
210.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约600mg至1200mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约434mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约567mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg,第一次给药四周后每两周给药一次。
211.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1200mg至2400mg,第一次给药四周后每两周给药一次。在一些实施方案中,
抗pd-l1/cd47双特异抗体施用的剂量为约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg,第一次给药四周后每两周给药一次。
212.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约7mg至2800mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约7mg、约10mg、约14mg、约18mg、约21mg、约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约435mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约560mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2450mg、约2500mg、约2550mg、约2600mg、约2650mg、约2700mg、约2750mg、约2800mg,第一次给药四周后每两周给药一次。
213.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约7mg至21mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg,第一次给药四周后每两周给药一次。
214.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约21mg至70mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约21mg、约22mg、约23mg、约25mg、约26mg、约27mg、约28mg、约29mg、约30mg、约31mg、约32mg、约33mg、约35mg、36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约45mg、约46mg、约47mg、约48mg、约50mg、约53mg、约55mg、约58mg、约60mg、约63mg、约65mg、约68mg、约70mg,第一次给药四周后每两周给药一次。
215.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约70mg至210mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg,第一次给药四周后每两周给药一次。
216.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约210mg至700mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约210mg、约220mg、约230mg、约240mg、约250mg、约
260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约434mg、约440mg、约450mg、约460mg、约470mg、约480mg、约490mg、约500mg、约510mg、约520mg、约530mg、约540mg、约550mg、约567mg、约570mg、约580mg、约590mg、约600mg、约610mg、约620mg、约630mg、约640mg、约650mg、约660mg、约670mg、约680mg、约690mg、约700mg,第一次给药四周后每两周给药一次。
217.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约700mg至1400mg,第一次给药四周后每两周给药一次。
218.在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、约1000mg、约1050mg、约1100mg、约1150mg、约1200mg、约1250mg、约1300mg、约1350mg、约1400mg,第一次给药四周后每两周给药一次。
219.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1400mg至2800mg,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约1400mg、约1450mg、约1500mg、约1550mg、约1600mg、约1650mg、约1700mg、约1750mg、约1800mg、约1850mg、约1900mg、约1950mg、约2000mg、约2050mg、约2100mg、约2150mg、约2200mg、约2250mg、约2300mg、约2350mg、约2400mg、约2430mg、约2450mg、约2480mg、约2500mg、约2530mg、约2550mg、约2580mg、约2600mg、约2630mg、约2650mg、约2680mg、约2700mg、约2730mg、约2750mg、约2780mg、约2800mg,第一次给药四周后每两周给药一次。
220.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1mg至10mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约6mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约7mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
221.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约15mg至25mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约18mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约21mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
222.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约55mg至75mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体的剂量为约60mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体的剂量为约70mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
223.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约150mg至230mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药
四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约180mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约210mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
224.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约590mg至610mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约600mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
225.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约690mg至710mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约700mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
226.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1150mg至1250mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体的剂量为约1200mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
227.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约1350mg至1450mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体的剂量为约1400mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
228.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约2370mg至2490mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约2400mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
229.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约2770mg至2890mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约2800mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
230.在一些实施方案中,抗pd-l1/cd47双特异抗体(如抗体bsab-71-n297a或bsab-71)施用的剂量为约2970mg至3050mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体施用的剂量为约3000mg,或含此剂量抗pd-l1/cd47双特异抗体的制剂,第一次给药四周后每两周给药一次。
231.在一些实施方案中,患者每个治疗周期内给药一次抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)。在一些实施方案中,每个治疗周期内多次给药抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂),例如2次、3次、4次或5次。在一些实施方案中,患者每个治疗周期只能给药1次或4次。
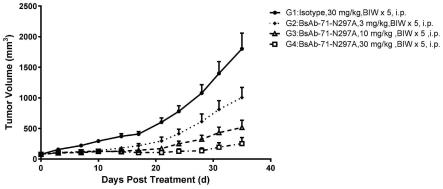
232.在一些实施方案中,患者接受一个治疗周期治疗。在一些实施方案中,患者接受多个(例如2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个或26个)治疗周期治疗。在一些实施方案
中,一个治疗周期为约一周、约两周、约三周、约四周、约五周、约六周、约七周,或这些数值中的任何两个值之间的范围(包括端点)或其中任何值(例如,约两周到四周)。在一些实施方案中,患者接受治疗直至病症得到缓解而不再需要治疗。
233.在一些实施方案中,本发明公开了一种用于治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:每两周向有需要的患者施用一次约6mg至18mg、约18mg至60mg、约60mg至180mg、约180mg至600mg、约600mg至1200mg、约1200mg至2400mg,比如约6mg、约10mg、约12mg、约18mg、约30mg、约50mg、约60mg、约80mg、约110mg、约130mg、约160mg、约180mg、约210mg、约230mg、约250mg、约300mg、约400mg、约500mg、约600mg、约700mg、约800mg、约900mg、约1000mg、约1100mg、约1200mg、约1300mg、约1500mg、约1600mg、约1700mg、约1800mg、约1900mg、约2000mg、约2100mg、约2200mg、约2300mg或约2400mg的抗pd-l1/cd47双特异抗体或抗原结合片段,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
234.在一些实施方案中,本发明公开了一种用于治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:每两周向有需要的患者施用一次约7mg至21mg、约21mg至70mg、约70mg至210mg、约210mg至700mg、约700mg至1400mg、约1400mg至2800mg,比如约7mg、约10mg、约12mg、约18mg、约21mg、约30mg、约50mg、约60mg、约70mg、约80mg、约110mg、约130mg、约160mg、约180mg、约210mg、约230mg、约250mg、约300mg、约400mg、约500mg、约600mg、约700mg、约800mg、约900mg、约1000mg、约1100mg、约1200mg、约1300mg、约1400mg、约1500mg、约1600mg、约1700mg、约1800mg、约1900mg、约2000mg、约2100mg、约2200mg、约2300mg、约2400mg、约2500mg、约2600mg、约2700mg或约2800mg的抗pd-l1/cd47双特异抗体或抗原结合片段,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
235.在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约6mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约7mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约18mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约21mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约60mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约70mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约180mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约210mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约600mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约700mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约1200mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约1400mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约2400mg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约2800mg。
236.在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约
0.1mg/kg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约0.3mg/kg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约1mg/kg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约3mg/kg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约10mg/kg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约20mg/kg。在一些实施方案中,每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约40mg/kg。
237.在一些实施方案中,本发明公开了一种用于治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:向有需要的患者施用约6mg至18mg、约18mg至60mg、约60mg至180mg、约180mg至600mg、约600mg至1200mg、约1200mg至2400mg,比如约6mg、约10mg、约12mg、约18mg、约30mg、约50mg、约60mg、约80mg、约110mg、约130mg、约160mg、约180mg、约210mg、约230mg、约250mg、约300mg、约400mg、约500mg、约600mg、约700mg、约800mg、约900mg、约1000mg、约1100mg、约1200mg、约1300mg、约1500mg、约1600mg、约1700mg、约1800mg、约1900mg、约2000mg、约2100mg、约2200mg、约2300mg或约2400mg的抗pd-l1/cd47双特异抗体或抗原结合片段,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
238.在一些实施方案中,本发明公开了一种用于治疗自身免疫病、急性或慢性炎性疾病、感染性疾病或肿瘤的方法,所述方法包括:向有需要的患者施用约7mg至21mg、约21mg至70mg、约70mg至210mg、约210mg至700mg、约700mg至1400mg、约1400mg至2800mg,比如约7mg、约10mg、约12mg、约18mg、约21mg、约30mg、约50mg、约60mg、约70mg、约80mg、约110mg、约130mg、约160mg、约180mg、约210mg、约230mg、约250mg、约300mg、约400mg、约500mg、约600mg、约700mg、约800mg、约900mg、约1000mg、约1100mg、约1200mg、约1300mg、约1400mg、约1500mg、约1600mg、约1700mg、约1800mg、约1900mg、约2000mg、约2100mg、约2200mg、约2300mg、约2400mg、约2500mg、约2600mg、约2700mg或约2800mg的抗pd-l1/cd47双特异抗体或抗原结合片段,或含此剂量抗pd-l1/cd47双特异抗体或抗原结合片段的制剂,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
239.在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约6mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约7mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约18mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约21mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约60mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约70mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约180mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约210mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约600mg。在一些实施方案中,第一
次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约700mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约1200mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约1400mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约2400mg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约2800mg。
240.在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约0.1mg/kg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约0.3mg/kg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约1mg/kg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约3mg/kg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约10mg/kg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约20mg/kg。在一些实施方案中,第一次给药四周后每两周给药一次抗pd-l1/cd47双特异抗体或抗原结合片段约40mg/kg。
241.在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。
242.在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
243.在一些实施方案中,单剂量给药后,患者的症状得到缓解。在一些实施方案中,单剂量给药后,患者后的症状未得到预期缓解,再对患者给药约6mg至3000mg抗pd-l1/cd47双特异抗体或抗原结合片段,直至患者的症状得到缓解。
244.在一些实施方案中,所述抗pd-l1/cd47双特异抗体或抗原结合片段是经由选自下述的至少一种方式施用:肠胃外、皮下、肌内、静脉内、关节内、支气管内、腹内、囊内、软骨内、腔内、体腔内、小脑内、脑室内、结肠内、颈内、胃内、肝内、心肌内、骨内、骨盆内、心包内、腹膜内、胸膜内、前列腺内、肺内、直肠内、肾内、视网膜内、脊柱内、滑膜内、胸内、子宫内、膀胱内、推注、阴道、直肠、口腔含化、舌下、鼻内,和经皮。
245.在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)是通过皮下(s.c.)注射、腹膜内(i.p.)注射、肠胃外注射、动脉内注射或静脉内(i.v.)注射等方式进行给药。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)是输液方式进行给药。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)是推注方式进行给药。
246.在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)是通过静脉内(i.v.)输液方式(即静脉输注)进行给药。在一些实施方案中,静脉内输液持续时间为约50分钟、约55分钟、约60分钟、约65分钟、约70分钟、约75分钟、约81分钟、约87分钟、约90分钟、约95分钟,或这些数值中任何两个值之间的范围(包括端点)或其中任何值。在一些实施方案中,静脉输液持续时间≥60分钟。
247.在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)与其他治疗方法联合用于治疗肿瘤(包括良性肿瘤或癌症),例如化疗、放疗、免疫治疗、激素治疗、靶向治疗、生物治疗和手术治疗等。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)与其他肿瘤或癌症治疗剂联合治疗肿瘤(包括良性肿瘤或癌症),如激素、治
疗肿瘤(包括良性肿瘤或癌症)的抗体等。
248.在一些实施方案中,本发明公开了抗pd-l1/cd47双特异抗体或抗原结合片段在治疗自身免疫性疾病、炎性疾病、感染性疾病或肿瘤(包括良性肿瘤或癌症)中的应用。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段的用量为0.1mg/kg至100mg/kg每两天一次到每六周一次给药。在一些实施方案中,每两天一次、每三天一次、每四天一次、每五天一次、每周两次、每周一次、每两周一次、每三周一次、每月一次或每六周一次给药。在一些实施方案中,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
249.在一些实施方案中,本发明公开了抗pd-l1/cd47双特异抗体或抗原结合片段在制备用于治疗自身免疫性疾病、炎性疾病、感染性疾病或肿瘤(包括良性肿瘤或癌症)的药物中的应用。在一些实施方案中,用于治疗自身免疫性疾病、炎性疾病、感染性疾病或肿瘤(包括良性肿瘤或癌症)的药物包括抗pd-l1/cd47双特异抗体或抗原结合片段。在一些实施方案中,抗pd-l1/cd47双特异抗体或抗原结合片段的用量为0.1mg/kg至100mg/kg每两天一次到每六周一次给药。在一些实施方案中,每两天一次、每三天一次、每四天一次、每五天一次、每周两次、每周一次、每两周一次、每三周一次、每月一次或每六周一次给药。在一些实施方案中,第一次给药四周后每两周给药一次。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
250.另一方面,本发明还公开了一种容器,包含抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)。在一些实施方案中,所述容器为注射器、输液袋或小瓶。在一些实施方案中,所述容器为安瓿瓶、预填充的一次性注射器、由玻璃或塑料制成的多剂量小瓶或输液袋。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
251.另一方面,本发明还公开了一种试剂盒,试剂盒包含抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)和用于指导有需要的患者施用抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)的说明书。在一些实施方案中,说明书为用于指导有需要的患者每两天一次到每六周一次施用0.1mg/kg至100mg/kg抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)的说明书。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
252.另一方面,本发明还公开了包含抗pd-l1/cd47双特异抗体或抗原结合片段的适合注射用的药物组合物,如推注型药物组合物或输液(滴注)型药物组合物。适于注射用途的药物组合物包括无菌水性溶液(在此是水溶性的)或分散体以及用于即时制备无菌注射液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水或磷酸盐缓冲盐水(pbs)、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)的溶剂或分散介质,及其适宜的混合物。在一些实施方案中,药物组合物还包括药学可接受的载体。在一些实施方案中,药学上可接受的载体可以包含抗细菌剂和/或抗真菌剂,如对羟基苯甲酸酯、氯代丁醇、苯酚、抗坏血酸、硫柳汞等来实现。在一些实施方案中,药学上可接受的载体可以包含等渗剂,如糖、多元醇(诸如甘露糖醇、山梨醇)、氯化钠。在一些实施方案中,药物组合物至少包含0.1%的抗pd-l1/cd47双特异抗体或抗原结合片段。抗体的含量可以变化,药物组合物至
少包含约2%至90%的抗pd-l1/cd47双特异抗体或抗原结合片段。这种治疗上有用的药物组合物中抗pd-l1/cd47双特异抗体或抗原结合片段的量可以为给药的有效量。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71-n297a。在一些实施方案中,抗pd-l1/cd47双特异抗体为抗体bsab-71。
253.另一方面,本发明还公开了上述药物组合物的制备方法:分别将本文所述的抗pd-l1/cd47双特异抗体或抗原结合片段与药学上可接受的适合注射用的载体(例如注射用水、生理盐水、pbs等)混合。上述抗pd-l1/cd47双特异抗体与药学上可接受的载体的混合方法是本领域通常已知的。
254.本发明抗pd-l1/cd47双特异抗体或抗原结合片段(或制剂)可用于自身免疫性疾病、炎性疾病、感染性疾病或肿瘤(包括良性肿瘤或癌症)的治疗。
附图说明
255.图1显示了抗体bsab-71、阳性对照抗体hu5f9-g4、阴性对照抗体igg-isotype对红细胞凝集的影响。
256.图2显示抗体bsab-71-n297a抑制肿瘤细胞的增殖;其中,横坐标表示给药治疗的天数,纵坐标表示肿瘤体积。
257.图3显示抗体bsab-71抑制肿瘤细胞的增殖;其中,横坐标表示给药治疗的天数,纵坐标表示肿瘤体积。
具体实施方式
258.除非另作说明,否则下列的每一个术语应当具有下文所述的含义。除非另有定义,本发明中使用的科学和技术术语的含义是本领域技术人员所通常理解的含义。除非本文中另外说明,否则恒定区中的氨基酸残基的编号根据如kabat等人,sequences of proteins of immunological interes,第5版,public health service,national institutes of health,bethesda,md,1991中所述的eu编号体系。
259.定义
260.应当注意的是,术语“一种”实体是指一种或多种该实体,例如“一种抗体”应当被理解为一种或多种抗体,因此,术语“一种”(或“一个”)、“一种或多种”和“至少一种”可以在本文中互换使用。
[0261]“约”或“大约”指相关技术领域技术人员容易知道的相应数值的常规误差范围。在一些实施方案中,本文中提到的“约”或“大约”指所描述的数值以及其
±
10%、
±
5%、
±
1%或
±
0.1%的范围。
[0262]
术语“多肽”旨在涵盖单数的“多肽”以及复数的“多肽”,并且是指由通过酰胺键(也称为肽键)线性连接的氨基酸单体构成的分子。术语“多肽”是指两个或更多个氨基酸的任何单条链或多条链,并且不涉及产物的特定长度。因此,“多肽”的定义中包括肽、二肽、三肽、寡肽、“蛋白质”、“氨基酸链”或用于指两个或多个氨基酸链的任何其他术语,并且术语“多肽”可以用来代替上述任何一个术语,或者与上述任何一个术语交替使用。术语“多肽”也意在指多肽表达后修饰的产物,包括但不限于糖基化、乙酰化、磷酸化、酰胺化、通过已知的保护/封闭基团衍生化、蛋白水解切割或非天然发生的氨基酸修饰。多肽可以源自天然生
物来源或通过重组技术产生,但其不必从指定的核酸序列翻译所得,它可能以包括化学合成的任何方式产生。
[0263]
如本文所用,二十种常规氨基酸及其缩写遵循常规用法。参见immunology-asynthesis(第2版,e.s.golub和d.r.gren编辑,sinauer associates,sunderland 7mass.(1991))。二十种常规氨基酸的立体异构体(例如,d-氨基酸)、非天然氨基酸(诸如α-、α-二取代氨基酸)、n-烷基氨基酸、乳酸及其它非常规氨基酸也可为适用于本公开多肽的组分。非常规氨基酸的示例包括:4-羟脯氨酸、γ-羧基谷氨酸盐、ε-n,n,n-三甲基赖氨酸、ε-n-乙酰赖氨酸、o-磷酸丝氨酸、n-乙酰丝氨酸、n-甲酰甲硫氨酸、3-甲基组氨酸、5-羟赖氨酰、σ-n-甲基精氨酸及其它类似的氨基酸和亚氨基酸(例如4-羟脯氨酸)。在本文所用的多肽表示方法中,左手方向为氨基末端方向,并且右手方向为羧基末端方向,与标准用法和惯例一致。常规(或天然)氨基酸包括丙氨酸(三字母代码:ala,一字母代码:a)、精氨酸(arg,r)、天冬酰胺(asn,n)、天冬氨酸(asp,d)、半胱氨酸(cys,c)、谷氨酰胺(gln,q)、谷氨酸(glu,e)、甘氨酸(gly,g)、组氨酸(his,h)、异亮氨酸(ile,i)、亮氨酸(leu,l)、赖氨酸(lys,k)、甲硫氨酸(met,m)、苯丙氨酸(phe,f)、脯氨酸(pro,p)、丝氨酸(ser,s)、苏氨酸(thr,t)、色氨酸(trp,w)、酪氨酸(tyr,y)和缬氨酸(val,v)。
[0264]
抗体或免疫球蛋白分子的氨基酸序列的微小变化都涵盖在本公开之内,条件是氨基酸序列的同一性保持至少75%、如至少80%、90%、95%并又如99%。在一些实施方案中,变化为保守氨基酸取代。保守氨基酸取代是在其侧链中相关的氨基酸家族内发生的取代。基因编码的氨基酸大致分以下类:(1)酸性氨基酸为天冬氨酸盐、谷氨酸盐;(2)碱性氨基酸为赖氨酸、精氨酸、组氨酸;(3)非极性氨基酸为丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸);以及(4)无电荷的极性氨基酸为甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸。其它家族的氨基酸包括(i)脂肪族-羟基家族的丝氨酸和苏氨酸;(ii)含酰胺家族的天冬酰胺和谷氨酰胺;(iii)脂肪族家族的丙氨酸、缬氨酸、亮氨酸和异亮氨酸;以及(iv)芳族家族的苯丙氨酸、色氨酸和酪氨酸。在一些实施方案中,保守氨基酸取代组为:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸、谷氨酸-天冬氨酸、以及天冬酰胺-谷氨酰胺。例如,可以合理地预测用异亮氨酸或缬氨酸单独的置换亮氨酸,用谷氨酸盐置换天冬氨酸盐,用丝氨酸置换苏氨酸,或用一个结构相关的氨基酸类似的置换一个氨基酸,且对所得分子的结合或特性不会有重要影响,特别是该置换不涉及结合位点内的氨基酸。氨基酸改变是否产生功能性肽可以容易地通过测定多肽衍生物的比活性来确定。所述测定在本文进行了详细描述。抗体或免疫球蛋白分子的片段或类似物可由本领域普通技术人员容易地制备。
[0265]
在一些实施方案中,氨基酸取代具有如下效果:(1)降低对蛋白水解作用的敏感性,(2)降低对氧化作用的敏感性,(3)改变用于形成蛋白复合物的结合亲和力,(4)改变结合亲和力,和(5)赋予或改进此类类似物的其它物理化学或功能特性。类似物可包括序列不同于天然存在的肽序列的各种突变蛋白。例如,可在天然存在的序列(优选在形成分子间接触的结构域之外的多肽部分中)中进行单个或多个氨基酸取代(优选保守氨基酸取代)。保守氨基酸取代不应当显著改变亲本序列的结构特性(例如,置换的氨基酸不应当趋于破坏亲本序列中存在的螺旋结构,或破坏表征亲本序列的其它类型二级结构)。人工识别的多肽的二级和三级结构的示例描述于proteins,structures and molecular principles
protocols in molecular biology中所述的软件程序。优选使用默认参数进行比对。其中一种比对程序是使用默认参数的blast,例如blastn和blastp,两者使用下列默认参数:geneticcode=standard;filter=none;strand=both;cutoff=60;expect=10;matrix=blosum62;descriptions=50sequences;sortby=highscore;databases=non-redundant;genbank embl ddbj pdb genbankcdstranslations swissprotein spupdate pir。生物学上等同的多聚核苷酸是具有上述指定百分比的同一性并编码具有相同或相似生物学活性的多肽的多聚核苷酸。
[0274]
多聚核苷酸是由四个核苷酸碱基的特定序列组成:腺嘌呤(a)、胞嘧啶(c)、鸟嘌呤(g)、胸腺嘧啶(t),或当多聚核苷酸是rna时胸腺嘧啶换为尿嘧啶(u)。“多聚核苷酸序列”可以以多聚核苷酸分子的字母表示。该字母表示可以被输入到具有中央处理单元的计算机中的数据库中,并用于生物信息学应用,例如用于功能基因组学和同源性搜索。
[0275]
术语“多聚核苷酸”和“寡核苷酸”可互换使用,是指任何长度的核苷酸的聚合形式,无论是脱氧核糖核苷酸还是核糖核苷酸或其类似物。多聚核苷酸可以具有任何三维结构并且可以执行已知或未知的任何功能。以下是不受限制的多聚核苷酸的实施例:基因或基因片段(例如探针、引物、est或sage标签)、外显子、内含子、信使rna(mrna)、转运rna、核糖体rna、核糖酶、cdna、dsrna、sirna、mirna、重组多聚核苷酸、分支的多聚核苷酸、质粒、载体、任何序列的分离的dna、任何序列的分离的rna、核酸探针和引物。多聚核苷酸可以包含修饰的核苷酸,例如甲基化的核苷酸和核苷酸类似物。如果存在该修饰,则对核苷酸的结构修饰可以在组装多聚核苷酸之前或之后进行。核苷酸的序列可以被非核苷酸组分中断。聚合后可以进一步修饰多聚核苷酸,例如通过与标记组分缀合。这个术语也指双链和单链分子。除另有说明或要求外,本公开的任何多聚核苷酸的实施例包括双链形式和已知或预测构成双链形式的两种可互补单链形式中的每一种。
[0276]“抗体”、“抗原结合片段”是指特异性识别和结合抗原的多肽或多肽复合物。抗体可以是完整的抗体及其任何抗原结合片段或其单链。因此术语“抗体”包括分子中含有具有与抗原结合的生物学活性的免疫球蛋白分子的至少一部分的任何蛋白质或肽。抗体和抗原结合片段包括但不局限重链或轻链或其配体结合部分的互补决定区(cdr)、重链可变区(vh)、轻链可变区(vl)、重链恒定区(ch)、轻链恒定区(cl)、框架区(fr)或其任何部分,或结合蛋白的至少一部分。cdr区包括轻链的cdr区(vlcdr1-3)和重链的cdr区(vh cdr1-3)。本发明所述抗体或抗原结合片段为双特异抗体,包含特异性结合抗原a、抗原b的抗体片段。在一些实施方案中,第一多肽链包含结构vha-cha,第二多肽链包含结构vla-cla,第三多肽链包含结构vhb-chb,第四多肽链包含结构vlb-clb。在一些实施方案中,第二多肽链与第四多肽链的氨基酸序列相同。
[0277]
术语“抗体片段”或“抗原结合片段”指抗体的一部分,本发明抗体片段的组成形式可类似于单特异性抗体片段中的f(ab')2、f(ab)2、fab'、fab、fv、scfv等。不管其结构如何,抗体片段与被完整抗体识别的同一抗原结合。术语“抗体片段”包括适体、镜像异构体和双价抗体。术语“抗原结合片段”还包括通过与特定抗原结合形成复合物起抗体作用的任何合成或基因工程蛋白质。
[0278]“单链可变片段”或“scfv”是指免疫球蛋白的重链(vh)和轻链(vl)的可变区的融合蛋白。在一些方面,这些区域与10个至约25个氨基酸的短接头肽连接。接头可以富含甘氨
酸以增加柔韧性,以及富含丝氨酸或苏氨酸以增加溶解性,并且可以连接vh的n端和vl的c端,反之亦然。尽管该蛋白质被除去了恒定区和引入了接头,但其保留了原始免疫球蛋白的特异性。scfv分子通常是本领域中已知的,例如在美国专利5,892,019中有相关描述。
[0279]
术语“抗体”包括可以在生物化学上区分的各种广泛种类的多肽。本领域技术人员将会理解,重链的类别包括gamma、mu、alpha、delta或epsilon(γ、μ、α、δ、ε),其中还有一些亚类(例如γ1-γ4)。该链的性质决定了抗体的“种类”分别为igg、igm、iga、igg或ige。免疫球蛋白亚类(同种型),例如igg1、igg2、igg3、igg4、igg5等已被充分表征并且赋予的功能特异性也已知。所有的免疫球蛋白种类都在本发明公开的保护范围内。在一些实施方案中,免疫球蛋白分子为igg种类。这四条链通过二硫键以“y”构型连接,其中轻链从“y”口开始并延续通过可变区包围重链。
[0280]
本发明公开的抗体、抗原结合片段或衍生物包括但不限于多克隆、单克隆、多特异性、全人源、人源化、灵长类化、嵌合抗体、单链抗体、表位结合片段(例如类fab、类fab'和类f(ab')2)、类单链fvs(scfv)。
[0281]
轻链可以分为kappa(κ)或lambda(λ)。每个重链可以与κ或λ轻链结合。一般来说,当由杂交瘤,b细胞或基因工程宿主细胞生产免疫球蛋白时,其轻链和重链通过共价键结合,两条重链的“尾巴”部分通过共价二硫键或非共价键结合。在重链中,氨基酸序列从y构型的叉状末端的n末端延伸至每条链底部的c末端。免疫球蛋白κ轻链可变区为v
κ
;免疫球蛋白λ轻链可变区为v
λ
。
[0282]
轻链和重链都分成结构和功能同源性的区域。术语“恒定的”和“可变的”根据功能被使用。轻链的可变区(vl)和重链的可变区(vh)决定了抗原识别和特异性。轻链的恒定区(cl)和重链的恒定区(ch)赋予重要的生物学性质,如分泌、经胎盘移动、fc受体结合、补体结合等。按照惯例,恒定区的编号随着它们变得更远离抗体的抗原结合位点或氨基末端而增加。n端部分是可变区,c端部分是恒定区;ch3和cl结构域实际上分别包含重链和轻链的羧基端。
[0283]
在天然存在的抗体中,假设抗体在含水环境中呈现其三维构型时,存在于每个抗原结合域中的六个“互补决定区”或“cdr”是形成抗原结合结构域的短的、非连续的与抗原特异性结合的氨基酸序列。抗原结合结构域中被称为“构架”区域的剩余其它氨基酸显示出较小的分子间可变性。构架区大部分采用β-折叠构象,cdr形成与之连接的环状结构,或在某些情况下形成β折叠结构的一部分。因此,框架区通过形成支架从而通过链间非共价相互作用使cdr定位在正确的方位上。具有特定位置的cdr的抗原结合域形成了与抗原上的表位互补的表面,该互补表面促进抗体和其抗原表位的非共价结合。对于给定的重链或轻链可变区,本领域普通技术人员都可以通过已知方法鉴定出包含cdr和框架区的氨基酸(参见kabat,e.,et al.,u.s.department of health and human services,sequences of proteins of immunological interest,(1983)和chothia and lesk,j.mol.biol.,196:901-917(1987))。
[0284]
同一抗体的可变区的cdr的边界,根据不同的指派系统,可能有所差异。因此,在涉及用本发明定义的具体cdr序列限定抗体时,所述抗体的范围还涵盖了这样的抗体:其可变区序列包含本发明的cdr序列,但是由于应用了不同的方案而导致其所声称的cdr边界与本发明所定义的具体cdr边界不同。根据kabat和chothia定义的cdr包括相互比较时的氨基酸
残基的重叠或子集。尽管如此,应用任一定义来指代抗体或其变体的cdr都在本发明范围内。包含特定cdr的确切残基编号将根据cdr的序列和大小而变化。本领域技术人员通常可以根据抗体的可变区氨基酸序列确定出cdr包含哪些特定的残基。
[0285]
在本领域中使用和/或接受的术语有两个或多个定义的情况下,除非明确地对立指出,否则本文使用的术语的定义包括所有这些含义。一个具体的例子是使用“互补决定区”(“cdr”)一词来描述在重链和轻链多肽的可变区内发现的非连续的抗原结合位点。这一特定区域在kabat et al.,u.s.dept.of health and human services,sequences of proteins of immunological interest(1983)和chothia等在j.mol.biol.196:901-917(1987)有相关描述,其通过引用全部并入本文。
[0286]
kabat等人还定义了适用于任何抗体的可变区序列的编号系统。本领域普通技术人员可以不依赖于序列本身以外的其他实验数据将该“kabat编号”系统应用到任何可变区序列。“kabat编号”是指由kabat et al.,u.s.dept.of health and human services在“sequence of proteinsof immunological interest”(1983)提出的编号系统。抗体还可以用eu或chothia编号系统。
[0287]
本发明公开的抗体可以来源于任何动物,包括鸟类和哺乳动物。较佳地,抗体是人源、鼠源、驴源、兔源、山羊源、骆驼源、美洲驼源、马源或鸡源抗体。在另一实施方案中,可变区可以是软骨鱼纲(condricthoid)来源(例如来自鲨鱼)。
[0288]“重链恒定区”包括ch1结构域、铰链(例如上、中和/或下铰链区)结构域、ch2结构域、ch3结构域,或变体或片段中的至少一种。抗体的重链恒定区可以来源于不同的免疫球蛋白分子。例如,多肽的重链恒定区可以包括源自igg1分子的ch1结构域和源自igg3分子的铰链区。在另一实施方案中,重链恒定区可以包括部分源自igg1分子和部分源自igg3分子的铰链区。在另一实施方案中,部分重链可以包括部分源自igg1分子和部分源自igg4分子的嵌合铰链区。
[0289]“轻链恒定区”包括来自抗体轻链的一部分氨基酸序列。较佳地,轻链恒定区包含恒定κ结构域或恒定λ结构域中的至少一个。“轻链-重链对”是指可通过轻链的cl结构域和重链的ch1结构域之间的二硫键形成二聚体的轻链和重链的集合。
[0290]“vh结构域”包括免疫球蛋白重链的氨基末端可变结构域。“ch1结构域”包括免疫球蛋白重链的第一个恒定区。ch2结构域不与其它结构域紧密配对,而是在完整的天然igg分子的两个ch2结构域之间插入两个n-连接的分支碳水化合物链。ch3结构域从ch2结构域开始延伸到igg分子的c-末端,大约包含108个残基。“铰链区”包括连接ch1结构域和ch2结构域的部分重链区域。所述铰链区包含约25个残基并且是有韧性的,从而使得两个n端抗原结合区能够独立移动。铰链区可以被细分为三个不同的结构域:上、中和下铰链结构域(rouxetal.,j.immunol 161:4083(1998))。
[0291]“二硫键”指两个硫原子之间形成的共价键。半胱氨酸的硫醇基团可以与第二个硫醇基团形成二硫键或桥接。在大多数天然存在的igg分子中,ch1和cl区通过二硫键连接。
[0292]“嵌合抗体”指其可变区从第一个物种中获得或衍生,而其恒定区(可以是完整的、部分的或修饰过的)来源于第二个物种的任何抗体。某些实施方案中,可变区来自非人源(例如小鼠或灵长类动物),而恒定区来自人源。
[0293]“特异性结合”通常是指抗体或抗原结合片段与特定抗原通过其抗原结合结构域
与表位互补性结合形成相对稳定的复合物。“特异性”可以用抗体或抗原结合片段与特定抗原或表位结合的相对亲和力表达。例如,如果抗体“a”比抗体“b”与同一抗原的相对亲和力大,可以认为抗体“a”比抗体“b”对该抗原具有更高的特异性。特异性结合可以用平衡解离常数(kd)来描述,较小的kd意味着较紧密的结合。确定两个分子是否特异性结合的方法是本领域内众所周知的,并包括例如平衡透析、表面等离子共振、生物膜层光学干涉测量法等。“特异性结合”抗原a的抗体包括与抗原a平衡解离常数kd小于或等于约100nm、小于或等于约10nm、小于或等于约5nm。
[0294]“ec
50”即半最大效应浓度(concentration for 50%of maximal effect,ec
50
)是指能引起50%最大效应的浓度。
[0295]“双特异”抗体指具有两个抗原结合位点的抗体,所述两个抗原结合位点可以是相同抗原的不同表位,也可以是不同抗原的不同表位。
[0296]
术语“表位”包括任意能够特异性结合免疫球蛋白或其片段或t细胞受体的蛋白决定区。表位决定区通常由分子的化学活性表面基团(如氨基酸或糖侧链)组成且通常有特定的三维结构性质以及特定的电荷性质。
[0297]
术语“共同轻链”指的是该轻链能够同时与不同的重链组装成具有相应功能的完全抗体;该轻链可以用于表达双特异抗体中,也可以用于表达含有两种抗体的混合物中。
[0298]
术语“效应子功能”指归因于免疫球蛋白fc区的那些生物学活性。免疫球蛋白效应子功能的例子包括:c1q结合和补体依赖的细胞毒性(cdc)、抗体依赖的细胞介导的细胞毒性(adcc)、抗体依赖的细胞吞噬作用(adcp)、细胞因子分泌、fc受体结合作用、免疫复合物介导的抗原呈递细胞摄取抗原、下调细胞表面受体(例如b细胞受体)和b细胞活化。
[0299]
如本公开中所用,除非另有说明,以下术语应理解为具有以下含义:术语“血红细胞”和“红细胞”是同义词并可互换使用。
[0300]
术语“凝集”表示细胞结块,而术语“血凝反应”表示特定的一类细胞(即血红细胞)结块。因此,血凝反应是凝集的一种类型。在本文所述的血细胞凝集实验中,红细胞在给定孔中形成可为“纽扣”、“晕圈”或介于两者之间的中间体的形式。术语“一字型”是指将96孔板倾斜45
°
后红细胞团流成一条线状。
[0301]“治疗”是指治疗性治疗和预防性或防治性措施,其目的是预防、减缓、改善和停止不良的生理改变或紊乱,例如疾病的进程,包括但不限于以下无论是可检测还是不可检测的结果,症状的缓解、疾病程度的减小、疾病状态的稳定(即不恶化)、疾病进展的延迟或减缓、疾病状态的改善或缓和,减轻或消失(无论是部分还是全部)、延长与不接受治疗时预期的生存期限等。需要治疗的患者包括已经患有病症或紊乱的患者,容易患有病症或紊乱的患者,或者需要预防该病症或紊乱的患者,可以或预期从施用本发明公开的抗体或组合物用于检测、诊断过程和/或治疗中受益的患者。
[0302]“自身免疫性疾病”是指身体免疫系统针对自身并且错误地攻击健康细胞的情况。
[0303]“炎性疾病”是指特征为炎症的疾病,该炎症是由以下组成的基础病理学过程:响应于由物理、化学或生物试剂引起的损失或异常刺激而发生于受累血管和相邻组织中的组织学上清楚的细胞学变化、细胞浸润以及介质释放的动态复杂过程,包括局部反应和所得形态学变化;有害材料的破坏或移除;以及引起修复和愈合的应答。“自身炎性疾病”是指当先天性免疫系统出于未知原因引起炎症时导致的疾病。
volume 4,article number:5885(2014);stefan schlatter et al.,on the optimal ratio of heavy to light chain genes for efficient recombinant antibody production by cho cells,biotechnol progress,21:122-133(2005);hadi bayat et al.,evaluation of different vector design strategies for the expression of recombinant monoclonal antibody in cho cells,preparative biochemistry&biotechnology,48(8):822-829(2018))。在一些实施方案中,表达抗体载体包括至少一个启动子元件,抗体编码序列,转录终止信号和polya尾。其他元件包括增强子,kozak序列及插入序列两侧rna剪接的供体和受体位点。可以通过sv40的前期和后期启动子,来自逆转录病毒的长末端重复序列如rsv、htlv1、hivi及巨细胞病毒的早期启动子来获得高效的转录,也可应用其它一些细胞的启动子如肌动蛋白启动子。合适的表达载体可包括pires1neo,pretro-off,pretro-on,plxsn,或者plncx,pcdna3.1( /-),pcdna/zeo( /-),pcdna3.1/hygro( /-),psvl,pmsg,prsvcat,psv2dhfr,pbc12mi,pcs2或pcho1.0等。常使用的哺乳动物细胞(宿主细胞)包括293细胞,cos1细胞,cos7细胞,cv1细胞,鼠l细胞和cho细胞等。
[0318]
为了表达本发明的抗pd-l1/cd47双特异抗体,可将编码全长轻链和重链的dna插入表达载体内,使得基因与转录和翻译控制序列可操作地连接。“可操作地连接”意指抗体基因连接到载体内,使得载体内的转录和翻译控制序列发挥其调节抗体基因转录和翻译的预期功能。
[0319]
抗体基因可以通过标准方法(例如,连接抗体基因片段和载体上的互补限制性位点,或者如果不存在限制性位点,则平端连接)插入表达载体内。在插入抗pd-l1/cd47双特异抗体相关的轻链或重链基因序列之前,表达载体可以已经携带抗体恒定区序列。例如,将抗pd-l1/cd47双特异抗体相关的vh和vl序列转换为全长抗体基因的一种方法是将它们分别插入已经编码重链恒定区和轻链恒定区的表达载体内,使得vh区段可操作地连接至载体内的ch区段,并且vl区段可操作地连接至载体内的cl区段。或者,重组表达载体可以编码促进宿主细胞分泌抗体链的信号肽。或者,可以将抗体链基因克隆到编码促进宿主细胞分泌抗体链的信号肽的载体中,使得信号肽与抗体链基因的氨基末端框内连接。信号肽可以是免疫球蛋白信号肽或异源信号肽(即,来自非免疫球蛋白蛋白的信号肽)。
[0320]
除抗体链基因之外,重组表达载体还可以携带控制抗体链基因在宿主细胞中表达的调节序列。调节序列包括控制抗体链基因的转录或翻译的启动子、增强子和其它表达控制元件(例如,多腺苷酸化信号)。此类调节序列在例如goeddel,gene expression technology:methods in enzymology 185,academic press,san diego,ca,1990中有描述。本领域技术人员了解表达载体的设计,包括调节序列的选择可以取决于待转化的宿主细胞的选择、所需蛋白质的表达水平等因素。用于哺乳动物宿主细胞表达的合适调节序列包括指导哺乳动物细胞中的高水平蛋白质表达的病毒元件,如衍生自巨细胞病毒(cmv)(如cmv启动子/增强子)、猿猴病毒40(sv40)(如sv40启动子/增强子)、腺病毒(如腺病毒主要晚期启动子(admlp))和多瘤的启动子和/或增强子。关于病毒调节元件及其序列的进一步描述,参见例如美国专利5,168,062,4,510,245和4,968,615。
[0321]
除抗体链基因和调节序列之外,重组表达载体可以携带另外的序列,例如调节载体在宿主细胞中复制的序列(例如,复制起点)和可选择标记物基因。可选择标记物基因促进载体已引入其内的宿主细胞的选择(参见例如,美国专利4,399,216、4,634,665和5,179,
017)。例如,通常可选择赋予已引入载体的宿主细胞针对药物(例如g418、潮霉素或氨甲蝶呤)的抗性的标记物基因。合适的可选择标记物基因包括二氢叶酸还原酶(dhfr)基因(用于在具有氨甲蝶呤选择/扩增的dhfr-宿主细胞中使用)、neo基因(用于g418选择)和gs基因。对于重链和轻链的表达,通过标准技术将编码重链和轻链的表达载体转染到宿主细胞内。
[0322]
本发明的抗pd-l1/cd47双特异抗体能够在真核宿主细胞中表达。在某些实施方案中,抗体的表达在真核细胞例如哺乳动物宿主细胞中进行。用于表达本发明的重组抗体的示例性哺乳动物宿主细胞包括中国仓鼠卵巢细胞(cho细胞)或从cho细胞修饰的cho-s、cho-dhfr-、cho/dg44或expicho、nso骨髓瘤细胞、cos细胞、sp2细胞、cv1细胞、鼠l细胞、人胚肾细胞hek293或从hek293细胞修饰的hek293t、hek293f或hek293e细胞。将编码抗体基因的重组表达载体引入哺乳动物宿主细胞内时后,将宿主细胞在培养基内培养允许抗体在宿主细胞中表达或抗体分泌到培养基的一段时间来产生抗体。可以使用标准蛋白质纯化方法从培养基中回收抗体。
[0323]
对于本发明的抗pd-l1/cd47双特异抗体的重组表达,可以用三种重组表达载体共转染宿主细胞,第一重组表达载体编码抗pd-l1重链,第二重组表达载体编码抗cd47重链,第三重组表达载体编码共同轻链。三个重组表达载体可以含有相同的可选择标记物,或者它们可以各自含有分开的可选择标记物。可替代地,可以使用编码抗pd-l1重链和共同轻链的重组表达载体以及编码抗cd47重链和共同轻链的重组表达载体共转染宿主细胞。两个载体可以含有相同的可选择标记物,或者它们可以各自含有分开的可选择标记物。
[0324]
本发明的抗pd-l1/cd47双特异抗体还可以通过化学合成(例如,通过solid phase peptidesynthesis,第2版,1984the pierce chemical co.,rockford,ill.中描述的方法)来生产。还可以使用无细胞平台(参见例如,chu等人,biochemiano.2,2001(roche molecularbiologicals)以及murray等人,2013,current opinion in chemical biology,17:420
–
426)生成变体抗体。
[0325]
通过重组表达产生的本发明的抗pd-l1/cd47双特异抗体,可以通过本领域已知的用于纯化免疫球蛋白分子的任何方法将它纯化,例如通过层析(例如,离子交换、亲和力和分级柱层析)、离心、差异溶解度、或纯化蛋白质的任何其它标准技术。进一步地,本发明的抗pd-l1/cd47双特异抗体可以与本领域已知的异源多肽序列融合,以促进纯化。
[0326]
实施例
[0327]
以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
[0328]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0329]
实施例1抗体的制备方法
[0330]
将编码抗pd-l1/cd47双特异抗体的重链和轻链的基因克隆至表达载体中,通过测序分析验证重组质粒的正确构建。将上述重组质粒转染cho细胞中进行表达,收集上清液、纯化获得抗pd-l1/cd47双特异抗体。测序后证实抗体序列正确,并用于下面各种实施例。
[0331]
抗体bsab-71-n297a的氨基酸序列见表1,抗体bsab-71的氨基酸序列见表2。
[0332]
表1抗体bsab-71-n297a的氨基酸序列
[0333]
[0334]
[0335][0336]
表2抗体bsab-71的氨基酸序列
[0337]
[0338][0339]
[0340]
实施例2红细胞凝集实验
[0341]
具体检测方法:采集新鲜人类血液,用生理盐水清洗三次后用生理盐水制备成2%人红细胞悬液,将2%人红细胞悬液与受试抗体(最高浓度为800nm,两倍系列稀释,总共获得11个稀释后浓度,溶媒为生理盐水)等体积混合,在37℃孵育4小时,随后评估抗体红细胞凝集情况,将96孔u型板倾斜45
°
,观察红细胞团的流向,如果呈“一字型”,说明红细胞没有发生凝集。红细胞凝集反应结果如图1所示。从图1可以看出,在高浓度下阳性对照抗体hu5f9-g4引起红细胞凝集,本发明示例的双特异抗体bsab-71不引起红细胞凝集,其促进红细胞凝集的活性明显低于阳性对照抗体hu5f9-g4。其中,阳性对照抗体hu5f9-g4(magrolimab)是在hek293f细胞中瞬时表达的人cd47抗体,其序列与美国专利us2015/0183874a1中的抗体“hu5f9”的序列相同;阴性对照抗体igg-isotype购自北京义翘神州科技股份有限公司(目录号:hg1k)。
[0342]
实施例3体内药效试验
[0343]
3.1评价抗体bsab-71-n297a在人源化小鼠c57bl/6-hsirpα皮下接种小鼠结肠癌细胞mc38-hcd47(tg)(江苏集萃药康生物科技有限公司)荷瘤模型中的抗肿瘤作用。
[0344]
1)肿瘤细胞接种:收集对数生长期的mc38-hcd47(tg)细胞,去除培养液并用pbs洗两次后接种人源化小鼠c57bl/6-hsirpα(雌性;6-9周龄;江苏集萃药康生物科技有限公司),接种量:1
×
106个/100μl/只,接种位置:小鼠右前肢皮下。
[0345]
2)分组给药:当平均肿瘤体积达到77.69mm3时随机分组,每组10只。分组当天定义为d0天,并于d0天、d3天、d7天、d10天、d14天、d17天、d21天、d24天、d28天、d31天采用腹腔给药(i.p.)。给药剂量和给药方式如表3所示。
[0346]
表3给药方案
[0347][0348]
注:i.p.:腹腔给药;biw
×
5:每周给药2次,共10次给药;溶媒:生理盐水。
[0349]
3)实验观察和数据采集:
[0350]
细胞接种后,每周常规监测肿瘤对动物正常行为的影响。具体内容有:实验动物的活动性,摄食和饮水情况,体重增加或降低情况,眼睛、被毛及其它异常情况。
[0351]
开始给药后,于d0天、d3天、d7天、d10天、d14天、d17天、d21天、d24天、d28天、d31天、d35天观测肿瘤大小并称量小鼠体重。肿瘤体积计算方式为:肿瘤体积(mm3)=0.5
×
(肿瘤长径
×
肿瘤短径2)。体内实验终点时间为给药后d35天。计算相对肿瘤抑制率(tgitv)。
[0352]
tgitv(相对肿瘤抑制率)计算公式:
[0353]
tgitv=(1-(mean rtv
治疗组
)/(mean rtv
溶媒对照组
))
×
100%;mean rtv
治疗组
:治疗组rtv平均值,mean rtv
溶媒对照组
:溶媒对照组rtv平均值;
[0354]
其中,rtvn=v
nt
/vn0;v
nt
:编号为n的小鼠在第t天的肿瘤体积,v
n0
:编号为n的小鼠在第0天的肿瘤体积,rtvn:编号为n的小鼠在第t天的肿瘤相对体积。
[0355]
4)统计分析:各组动物的肿瘤体积、小鼠体重、肿瘤重量等实验结果以平均值
±
标
准误差(mean
±
sem)表示。采用独立样本t检验比较不同治疗组与对照组相比有无显著性差异。数据使用spss进行分析。p《0.05为具有显著性差异。
[0356]
如图2和表4所示,抗体bsab-71-n297a(3mg/kg)、bsab-71-n297a(10mg/kg)、bsab-71-n297a(30mg/kg)均表现出显著的肿瘤抑制效果。在30mg/kg剂量下,试验终点(d35天)时相对肿瘤抑制率(tgitv)为86.22%。
[0357]
表4给药后d35天的肿瘤体积及肿瘤抑制率
[0358]
组别肿瘤体积(mm3)tgitvp值g1(对照)1803.59
±
255.87
‑‑‑‑
g21006.41
±
165.8943.64%0.018g3517.11
±
117.9475.96%0.001g4254.1
±
99.6686.22%《0.001
[0359]
3.2评价抗体bsab-71在人源化小鼠c57bl/6-hsirpα皮下接种小鼠结肠癌细胞mc38-hcd47(tg)(江苏集萃药康生物科技有限公司)荷瘤模型中的抗肿瘤作用。
[0360]
1)肿瘤细胞接种:收集对数生长期的mc38-hcd47(tg)细胞,去除培养液并用pbs洗两次后皮下接种人源化小鼠c57bl/6-hsirpα(雌性;5-8周龄;江苏集萃药康生物科技有限公司),接种量:1
×
106个/100μl/只,接种位置:小鼠右前肢皮下。
[0361]
2)分组给药:当平均肿瘤体积达到77.71mm3时随机分组,每组10只。分组当天定义为d0天,并于d0天、d3天、d7天、d10天、d14天、d17天、d21天、d24天、d28天、d31天采用腹腔给药(i.p.)。给药剂量和给药方式如表5所示。
[0362]
表5给药方案
[0363][0364]
注:i.p.:腹腔给药;biw
×
5:每周给药2次,共10次给药;溶媒:生理盐水。
[0365]
3)实验观察和数据采集:
[0366]
细胞接种后,每周常规监测肿瘤对动物正常行为的影响。具体内容有:实验动物的活动性,摄食和饮水情况,体重增加或降低情况,眼睛、被毛及其它异常情况。
[0367]
开始给药后,于d0天、d3天、d6天、d9天、d13天、d16天、d20天、d23天、d27天、d30天、d34天观测肿瘤大小并称量小鼠体重。肿瘤体积计算方式为:肿瘤体积(mm3)=0.5
×
(肿瘤长径
×
肿瘤短径2)。体内实验终点时间为给药后d34天。计算相对肿瘤抑制率(tgitv)。
[0368]
tgitv(相对肿瘤抑制率)计算公式:
[0369]
tgitv=(1-(mean rtv
治疗组
)/(mean rtv
溶媒对照组
))
×
100%;mean rtv
治疗组
:治疗组rtv平均值,mean rtv
溶媒对照组
:溶媒对照组rtv平均值;
[0370]
其中,rtvn=v
nt
/v
n0
;v
nt
:编号为n的小鼠在第t天的肿瘤体积,v
n0
:编号为n的小鼠在第0天的肿瘤体积,rtvn:编号为n的小鼠在第t天的肿瘤相对体积。
[0371]
4)统计分析:各组动物的肿瘤体积、小鼠体重、肿瘤重量等实验结果以平均值
±
标准误差(mean
±
sem)表示。采用独立样本t检验比较不同治疗组与对照组相比有无显著性差
异。数据使用spss进行分析。p《0.05为具有显著性差异。
[0372]
如图3和表6所示,抗体bsab-71(5mg/kg)、bsab-71(10mg/kg)、bsab-71(15mg/kg)均表现出显著的肿瘤抑制效果。在15mg/kg剂量下,试验终点(d34天)时相对肿瘤抑制率(tgitv)为84.50%。
[0373]
表6给药后d34天的肿瘤体积及肿瘤抑制率
[0374]
组别肿瘤体积(mm3)tgitvp值g1(对照)2149.90
±
301.01
‑‑‑‑
g2689.28
±
236.2566.97%0.0001g3622.66
±
192.0570.71%《0.0001g4341.84
±
259.0984.50%《0.0001
[0375]
实施例4药代动力学和毒理试验
[0376]
a)药代动力学
[0377]
本研究采用18只食蟹猴(雌雄各半),随机分为3组,每组雌性和雄性动物各3只。每组动物未禁食单次静脉输注(60min)分别给予2.5、20和80mg/kg抗体bsab-71-n297a,溶媒:0.9%氯化钠注射液,共给药1次。每组动物采集血清样本至给药后504h(day22)。通过血药浓度数据,运用phoenix7.0软件采用非房室模型计算其主要药代动力学参数。
[0378]
如表7所示,在2.5~80mg/kg剂量范围内,未禁食单次静脉输注给予雄性和雌性食蟹猴抗体bsab-71-n297a后,血清中抗体bsab-71-n297a的系统暴露量无明显性别差异,并且血清中抗体bsab-71-n297a系统暴露量与给药剂量呈正相关。
[0379]
表7单次静脉输注给予食蟹猴抗体bsab-71-n297a后血清中抗体bsab-71-n297a主要药代动力学参数(mean
±
sd)
[0380][0381]
b)毒性评价
[0382]
1)单次给药毒性试验
[0383]
考察食蟹猴单次静脉输注给予抗体bsab-71-n297a的毒性反应。试验共设计4组,每组雌性和雄性各1只。组别设置分别为赋形剂组(0mg/kg)、抗体bsab-71-n297a低剂量组(30mg/kg)、中剂量组(100mg/kg)和高剂量组(300mg/kg),溶媒:0.9%氯化钠注射液,经静脉输注1h给药,给药1次,观察期14天。
[0384]
食蟹猴单次静脉输注给予30、100、300mg/kg抗体bsab-71-n297a后,观察2周,在症状、体重、耗食量、体温、心电图,血压、血液学、凝血、生化、尿液、大体解剖等指标上均未见给予抗体bsab-71-n297a相关的毒性反应,最大耐受剂量大于300mg/kg。
[0385]
2)重复给药毒性试验
[0386]
考察食蟹猴静脉输注重复给予抗体bsab-71-n297a后的毒性反应和毒代动力学特征。试验共设计4组,每组雌性和雄性各5只。组别设置分别为赋形剂组(0mg/kg)、抗体bsab-71-n297a低剂量组(5mg/kg)、中剂量组(30mg/kg)和高剂量组(100mg/kg)。给药方式为静脉输注,给药时间1h;给药频率:1次/周(day 1、day 8、day 15、day 22、day 29),共给药5次;溶媒:0.9%氯化钠注射液。动物首次给药当天记为实验第1天(day 1)。
[0387]
如表8所示,食蟹猴单次及重复静脉给予5、30及100mg/kg的抗体bsab-71-n297a后,血清中抗体bsab-71-n297a暴露量随剂量的增加而增加,增加比值高于剂量增加比值,
无性别差异;重复给药四次后5、30mg/kg组重复给药后抗体bsab-71-n297a暴露量下降明显,100mg/kg组未见明显改变。
[0388]
在本试验条件下,食蟹猴每周1次,连续4周经静脉输注重复给予赋形剂(0mg/kg)5、30、100mg/kg抗体bsab-71-n297a,停药后恢复4周,供试品各剂量组均未见供试品相关的毒性反应,未观察到无毒性反应剂量水平(no observable adverse effect level,noael)为100mg/kg。
[0389]
表8单次及重复给予bsab-71-n297a四次后主要毒代动力学参数
[0390][0391]
免疫原性结果表明:重复给药后的day 14及day 28,抗体bsab-71-n297a低、中、高剂量组可检测到抗药物抗体,day 28呈现阳性的动物数明显高于day 14,day 28及day56三个剂量组抗药物抗体阳性率范围为75%(3/4)-100%(10/10),抗药物抗体阳性动物数顺序为抗体bsab-71-n297a低剂量》中剂量》高剂量;至恢复期结束时仍可检测到抗药物抗体。
[0392]
c)溶血试验
[0393]
采用新西兰兔血红细胞进行溶血试验。当抗体bsab-71-n297a注射液(50.5mg/ml)稀释10倍时不会引起新西兰兔体外红细胞的溶血或凝集。
[0394]
实施例5抗体bsab-71-n297a的临床研究
[0395]
本研究是一项评价抗体bsab-71-n297a注射液在晚期恶性肿瘤患者中的安全性、耐受性、药代动力学特征和初步临床有效性的多中心、开放的ia/ib期临床研究;探索最大耐受剂量(mtd)或最大给药剂量(mad)并为ii期或后续临床研究提供推荐剂量及合理的给药方案。
[0396]
研究分为2个阶段:
[0397]
第一阶段:剂量递增ia期研究。采用快速滴定和“3 3”的剂量递增规则来探索抗体bsab-71-n297a的安全性、耐受性和药代动力学特征。
[0398]
本剂量递增研究共设置7个剂量组,分别为0.1mg/kg组、0.3mg/kg组、1mg/kg组、3mg/kg组、10mg/kg组、20mg/kg组及40mg/kg组。其中0.1mg/kg组、0.3mg/kg组采用加速滴定方法进行剂量递增;1mg/kg组、3mg/kg组、10mg/kg组、20mg/kg组及40mg/kg组按标准“3 3”规则进行剂量递增研究。
[0399]
剂量递增规则如下:
[0400]
前2个剂量组(0.1mg/kg组、0.3mg/kg组)采用加速滴定的剂量递增方案即队列规模=1。首先纳入1例0.1mg/kg组受试者,若未观察到与研究药物相关的≥2级毒性反应,则可直接进入0.3mg/kg组进行剂量递增,以此规则(“1 1”)类推,加速递增至1mg/kg组。若在加速递增过程中,一旦某一组别观察到与研究药物相关的≥2级毒性反应,则停止加速滴定剂量递增,需在该剂量组再纳入2例受试者转为标准“3 3”剂量递增(即队列规模=3)模式直至达到mtd或mad。从1mg/kg组开始,调整为标准“3 3”规则的剂量递增模式。
[0401]
第二阶段:剂量扩展的ib期研究,进一步探索抗体bsab-71-n297a的安全性和临床有效性。
[0402]
静脉输注给药,输注时长可≥60分钟,研究用药为每2周给药一次(第二周期给药为距第一周期给药后28天)。如果患者出现输液相关反应并能够继续治疗,可基于既往经验和临床实际情况可以考虑使用如苯海拉明或对乙酰氨基酚等进行预防给药。研究药物治疗应持续至出现:疾病进展、或不可耐受的毒性而退出、或因无疗效获益而接受新的抗肿瘤治疗、或撤回知情同意以及其它原因主动退出、或最长1年,以先出现者为准。第一个给药周期为dlt评估期,即从首次给药至给药后28天。从第二次给药开始,以每2周为1个给药周期。
[0403]
耐受性评价指标涉及:剂量限制性毒性(dlt)事件及其发生率;安全性评价指标涉及:生命体征与体格检查、实验室检查(血常规、血生化、甲状腺功能、凝血常规、尿常规、大便常规、妊娠试验)、ecog评分、心电图、不良事件(包括免疫相关不良事件)等。
[0404]
免疫原性评价指标涉及:抗药抗体(ada)的样品阳性率和个体阳性率,ada阳性样品的滴度,ada阳性的样本将继续检测是否为中和抗体(nab)。
[0405]
所有剂量组的受试者在治疗期间(前6个治疗周期)的规定时间点需要收集血样,在给药前60分钟内监测血浆浓度(c
trough
)。每个时间点计划采2ml血样,检测血清药物的浓度水平,研究药代动力学(pk)特征。通过实际给药剂量、实际采样时间和非房室模型计算下述pk参数:单次给药:c
max
、t
max
、t
1/2
、cl、vd、ke、mrt、auc
(0-τ)
、auc
(0-∞)
;多次给药:c
max,ss
、c
avg,ss
、c
min,ss
、auc
(0-τ)ss
、auc
(0-∞)ss
、t
max,ss
、t
1/2,ss
、cl、vss、ke、mrt、蓄积指数(r
ac
)、波动指数df。
[0406]
临床有效性评价:根据recist 1.1(淋巴瘤根据lugano2014评价标准)定义的客观缓解率(orr)、缓解持续时间(dor)、疾病控制率(dcr)、无进展生存期(pfs)及总生存期(os)。
[0407]
客观缓解率(objective response rate,orr):为完全缓解(cr)和部分缓解(pr)的受试者的比例;缓解持续时间(duration of response,dor):为肿瘤第一次评估为客观缓解(objective response,or)至第一次评估为pd(progressive disease)或pd前任何原因死亡的时间,反映orr的持续时间;无进展生存期(progression-free survival:pfs):为从首次给药至出现肿瘤客观进展或全因死亡的时间(以先发生者为准)。“mtd”为某一剂量组在dlt评估期内观察到≤1/6的受试者中探索到的dlt的最高剂量水平。
[0408]
不良事件(ae)基于ctcae v5.0进行评估。剂量限制性毒性(dlt)定义为在dlt观察期发生并被认为至少可能与研究药物相关的ae,具体如下:
[0409]
■
5级毒性;
[0410]
■
血液学毒性:
[0411]
·
4级血液学毒性(注:3~4级淋巴细胞减少症不计入dlt);
[0412]
·
持续任何时间的4级血小板减少症;
[0413]
·
伴有出血倾向的或需要输注血小板的3级血小板减少症;
[0414]
·
持续任何时间的4级中性粒细胞减少症;
[0415]
·
3级的中性粒细胞减少伴感染持续时间≥7天或3级中性粒细胞减少伴发热;
[0416]
■
非血液学毒性:
[0417]
·
3、4级非血液学毒性(注:
①
3级恶心、呕吐、皮疹除外;
②
经过临床干预后可控制在3天以内的3级腹泻除外;
③
持续时间在7天以内疲劳/乏力除外);
[0418]
·
符合任一以下条件的、因临床实验室检查发现的3、4级非血液学毒性:
①
需要进行临床干预的;
②
导致住院治疗的;
③
持续时间≥7天的;
④
所有导致受试者在第1周期中停止治疗的;
⑤
任何导致第2周期给药延迟超过2周的治疗相关毒性;
[0419]
·
≥2级的脑部病变;
[0420]
·
需进行系统治疗的眼毒性(注:任何出现视力变化或眼部毒性达2级或更高的病人都将由眼科医生进行评估);
[0421]
在dlt判定中,一些明显且无可争议的由于疾病进展或dlt以外的原因而导致的ae则不应计入dlt。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。