1.本文公开了编码用于精确体内细胞靶向的高度紧凑的多输入基因逻辑门的连续dna序列,以及使用体内递送和此类连续dna序列的组合治疗疾病的方法。
背景技术:
2.基因治疗作为基因疾病和癌症的下一代治疗选项正在增加。然而,目前的基因治疗载体被为了产生治疗性引线(therapeutic lead)的低效力、高毒性和长开发时间线所困扰。这些缺点的一个原因是对基因治疗载体中治疗基因表达的控制不够严格,这导致(i)在非预期的细胞类型和组织中的或(ii)以不足的或过高的剂量的基因表达。换句话说,基因表达的精确控制,在基因产物剂量(即,每细胞的蛋白分子数目)和细胞类型限制的表达两方面在基因治疗中仍然是开放的挑战。
技术实现要素:
3.在生物分子计算和合成生物学中的研究已经长期寻求能够基于以下来实现新类型的治疗方法:(i)分子疾病指示器的多输入感测;(ii)以确定治疗响应强度的分子水平计算;以及(iii)以高度精确和协调的方式原位治疗的增强。本文描述了细胞分类器基因回路,其能够经由多个细胞输入的复杂逻辑集成来精确鉴定异质细胞类型。本文还描述了使用分类器基因回路治疗疾病的方法。癌症已被认为是一类这样的疾病,由于与健康细胞的肿瘤相似性、肿瘤异质性以及其在初级和次级基因座二者处的传播,所述疾病将从细胞分类器方法收益最多。本文所述的研究支持用于精确细胞靶向的多输入基因回路是用于下一代基因治疗的理想途径的概念。
4.因此,在一些方面,本公开涉及连续多核酸分子。在一些实施方式中,连续多核酸分子包含:a)第一盒,其编码第一rna,所述第一rna的表达可操作地连接至转活化剂响应元件,其中第一rna包含:(i)输出的核酸序列;和(ii)用于表1中列出的mirna的靶位点或其组合;和b)第二盒,其编码第二rna,其中第二rna包含转活化剂的核酸序列;其中第二盒的转活化剂,当表达为蛋白质时,结合和转活化第一盒的转活化剂响应元件。
5.在一些实施方式中,第一rna包含let-7c靶位点、let-7a靶位点、let-7b靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合。
6.在一些实施方式中,第一rna包含3’utr,并且其中3’utr包含let-7c靶位点、let-7a靶位点、let-7b靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合。
7.在一些实施方式中,第一rna包含5’utr,并且其中5’utr包含let-7c靶位点、let-7a靶位点、let-7b靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、
let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合。
8.在一些实施方式中,第二rna进一步包含用于表1中列出的microrna的靶位点或其组合。
9.在一些实施方式中,其中第二rna进一步包含let-7c靶位点、let-7a靶位点、let-7b靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合。
10.在一些实施方式中,第二rna包含3’utr,并且其中3’utr包含let-7c靶位点、let-7a靶位点、let-7b靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合。
11.在一些实施方式中,第二rna包含5’utr,并且其中5’utr包含let-7c靶位点、let-7a靶位点、let-7b靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合。
12.在一些实施方式中,第一盒的至少一个mirna靶位点和第二盒的至少一个mirna靶位点是由同一mirna调节的相同的核酸序列或不同的序列。
13.在一些实施方式中,第一rna和第二rna各自包含let-7c靶位点。
14.在一些实施方式中,转活化剂响应元件包含表3中列出的核酸序列或其组合。
15.在一些实施方式中,第二rna的表达可操作地连接至转录因子响应元件。在一些实施方式中,转录因子响应元件包含表4中列出的核酸序列或其组合。
16.在一些实施方式中,转活化剂独立地结合和转活化转活化剂响应元件。
17.在一些实施方式中,第一rna的表达可操作地连接至转录因子响应元件。在一些实施方式中,转录因子响应元件包含表4中列出的核酸序列或其组合。
18.在一些实施方式中,转活化剂仅在结合至转录因子响应元件的转录因子的存在下结合和转活化转活化剂响应元件。
19.在一些实施方式中,第一盒和/或第二盒包含启动子元件。在一些实施方式中,启动子元件包含表5中列出的核酸序列或其组合。在一些实施方式中,启动子元件包含哺乳动物启动子或启动子片段。
20.在一些实施方式中:第一盒从5’至3’包含:(i)包含转活化剂响应元件和转录因子响应元件的上游调节组分;(ii)编码输出的核酸序列;和(iii)包含let-7c靶位点的下游组分;和第二盒从5’至3’包含:(i)包含转录因子响应元件的上游调节组分;(ii)编码转活化剂的核酸序列;和(iii)包含let-7c靶位点的下游组分。
21.在一些实施方式中,第一盒的转录因子响应元件和第二盒的转录因子响应元件由相同的核酸序列组成。
22.在一些实施方式中,第一盒的转录因子响应元件和第二盒的转录因子响应元件由不同的核酸序列组成。
23.在一些实施方式中,第一盒和/或第二盒包含两个或多个转录因子响应元件。
24.在一些实施方式中,第一盒和/或第二盒包含两个不同的转录因子响应元件。
25.在一些实施方式中,第一盒的上游调节组分包含启动子元件。在一些实施方式中,启动子元件包含哺乳动物启动子或启动子片段。
26.在一些实施方式中,第二盒的上游调节组分包含启动子元件。在一些实施方式中,启动子元件包含哺乳动物启动子或启动子片段。
27.在一些实施方式中,第一盒和第二盒处于会聚取向。在一些实施方式中,第一盒和第二盒处于发散取向。在一些实施方式中,第一盒和第二盒处于头到尾取向。
28.在一些实施方式中,第一盒和/或第二盒侧翼为绝缘体。
29.在一些实施方式中,第二盒的转活化剂是tta、rtta、pit-rela、pit-vp16、et-vp16、et-rela、narlc-vp16或narlc-rela。
30.在一些实施方式中,第二盒的转活化剂包含表2中列出的核酸序列。
31.在一些实施方式中,输出是蛋白或rna分子。在一些实施方式中,输出是治疗剂。在一些实施方式中,输出是荧光蛋白、细胞毒素、催化前药活化的酶、免疫调节蛋白和/或rna、dna修饰因子、细胞表面受体、基因表达调节因子、激酶、表观基因修饰剂、和/或载体复制所需的因子和/或编码病原体的抗原多肽的序列。在一些实施方式中,输出是来自人单纯疱疹病毒1(hsv-tk)的胸苷激酶。在一些实施方式中,免疫调节蛋白和/或rna是细胞因子或集落刺激因子。在一些实施方式中,dna修饰因子是编码用来校正基因缺陷的蛋白、dna修饰酶和/或dna修饰系统的组分的基因。在一些实施方式中,dna修饰酶是位点特异性重组酶、归巢核酸内切酶或crispr/cas dna修饰系统的蛋白组分。在一些实施方式中,基因表达调节因子是能够调节基因表达的蛋白或能够调节基因表达的多组分系统的组分。
32.在一些实施方式中,连续多核酸分子,其包含表6中列出的核酸序列。
33.在一些实施方式中,连续多核酸分子包含编码rna的盒,所述rna的表达可操作地连接至转活化剂响应元件,其中rna包含:(i)输出的核酸序列;(ii)转活化剂的核酸序列;和(iii)用于表1中列出的mirna的靶位点或其组合;其中转活化剂,当表达为蛋白质时,结合和转活化转活化剂响应元件。
34.在一些实施方式中,第一rna包含let-7c靶位点、let-7a靶位点、let-7b靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合。
35.在一些实施方式中,rna进一步包含多顺反子表达元件的核酸序列,其隔开输出和转活化剂的核酸序列。
36.在一些实施方式中,rna包含3’utr,并且其中3’utr包含let-7c靶位点、let-7a靶位点、let-7b靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合。
37.在一些实施方式中,rna包含5’utr,并且其中5’utr包含let-7c靶位点、let-7a靶位点、let-7b靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合。
38.在一些实施方式中,rna包含let-7c靶位点。
39.在一些实施方式中,转活化剂响应元件包含表3中列出的核酸序列或其组合。
40.在一些实施方式中,转活化剂独立地结合和转活化转活化剂响应元件。
41.在一些实施方式中,rna的表达可操作地连接至转活化剂响应元件和转录因子响应元件。在一些实施方式中,转录因子响应元件包含表4中列出的核酸序列或其组合。
42.在一些实施方式中,转活化剂仅在结合至转录因子响应元件的转录因子的存在下结合和转活化转活化剂响应元件。
43.在一些实施方式中,盒包含启动子元件。在一些实施方式中,启动子元件包含表5中列出的核酸序列或其组合。在一些实施方式中,启动子元件包含哺乳动物启动子或启动子片段。
44.在一些实施方式中,连续多核酸分子从5’至3’包含:(i)包含转活化剂响应元件和转录因子响应元件的上游调节组分;(ii)编码输出和转活化剂的核酸序列;和(iii)包含let-7c靶位点的下游组分。
45.在一些实施方式中,(i)中的上游调节组分包含启动子元件。在一些实施方式中,启动子元件包含哺乳动物启动子或启动子片段。
46.在一些实施方式中,至少一个盒的转活化剂是tta、rtta、pit-rela、pit-vp16、et-vp16、et-rela、narlc-vp16或narlc-rela。
47.在一些实施方式中,输出是蛋白或rna分子。在一些实施方式中,输出是治疗性蛋白或rna分子。在一些实施方式中,输出是荧光蛋白、细胞毒素、催化前药活化的酶、免疫调节蛋白和/或rna、dna修饰因子、细胞表面受体、基因表达调节因子、激酶、表观基因修饰剂、和/或载体复制所需的因子和/或编码病原体的抗原多肽的序列。在一些实施方式中,输出是来自人单纯疱疹病毒1(hsv-tk)的胸苷激酶。在一些实施方式中,免疫调节蛋白和/或rna是细胞因子或集落刺激因子。在一些实施方式中,dna修饰因子是编码用来校正基因缺陷的蛋白、dna修饰酶和/或dna修饰系统的组分的基因。在一些实施方式中,dna修饰酶是位点特异性重组酶、归巢核酸内切酶或crispr/cas系统的蛋白组分。在一些实施方式中,基因表达调节因子是能够调节基因表达的蛋白或能够调节基因表达的多组分系统的组分。
48.在其他方面,本公开涉及载体,其包含本文所述的连续多核酸。
49.在其他方面,本公开涉及工程化病毒基因组,其包含本文所述的连续多核酸。在一些实施方式中,工程化病毒基因组源自腺相关病毒(aav)基因组、慢病毒基因组、腺病毒基因组、单纯疱疹病毒(hsv)基因组、牛痘病毒基因组、痘病毒基因组、新城疫疾病病毒(ndv)基因组、柯萨奇病毒基因组、rheo病毒(rheovirus)基因组、麻疹病毒基因组、水泡性口炎病毒(vsv)基因组、细小病毒基因组、塞内卡谷病毒基因组、马拉巴病毒基因组或常见感冒病毒基因组。
50.在其他方面,本公开涉及病毒体,其包含本文公开的工程化病毒基因组。在一些实施方式中,病毒体包含aav-dj、aav8、aav6或aav-b1衣壳。
51.在其他方面,本公开涉及在细胞群中刺激细胞特异性事件的方法。在一些实施方式中,在细胞群中刺激细胞特异性事件的方法包含将细胞群与本文所述的连续多核酸分子、本文所述的载体、本文所述的工程化病毒基因组或本文所述的病毒体接触,其中细胞群包含至少一个靶细胞类型和一个或多个非靶细胞类型,其中靶细胞类型和非靶细胞类型在
一个或多个内源性mirna的水平和/或活性上不同,使得一个或多个内源性mirna的水平和/或活性在两个或多个非靶细胞的每一个中相对于靶细胞的每一个至少两倍高;并且其中细胞特异性事件由细胞群的细胞中的输出的表达水平来调节。
52.在一些实施方式中,靶细胞的至少一个子集和非靶细胞的至少一个子集在内源性转录因子的水平或活性上不同,其中连续核酸分子进一步包含与内源性转录因子相对应的转录因子响应元件。
53.在一些实施方式中,靶细胞的至少一个子集和非靶细胞的至少一个子集在启动子片段的水平或活性上不同,其中连续核酸分子进一步包含该启动子片段。
54.在其他方面,本公开涉及诊断疾病或病况的方法。在一些实施方式中,一种诊断疾病或病况的方法,其包含向表现出与疾病或病况相关的一个或多个标志或症状的受试者施用本文所述的连续多核酸分子、本文所述的载体、本文所述的工程化病毒基因组或本文所述的病毒体,其中输出的水平指示疾病和或病况的存在或不存在。
55.在一些实施方式中,疾病是癌症。在一些实施方式中,癌症是肝细胞癌(hcc)、转移性结直肠癌、肝脏中转移性肿瘤、乳腺癌、肺癌、视网膜母细胞瘤和胶质母细胞瘤。
56.在其他方面,本公开涉及治疗疾病或病况的方法。在一些实施方式中,一种治疗疾病或病况的方法,其包含向具有疾病或病况的受试者施用本文所述的连续多核酸分子、本文所述的载体、本文所述的工程化病毒基因组或本文所述的病毒体。
57.在一些实施方式中,所述方法进一步包含施用前药,任选地其中前药是更昔洛韦,任选地其中连续多核酸分子包含表6中列出的核酸序列。
58.在一些实施方式中,疾病是癌症。在一些实施方式中,癌症是肝细胞癌(hcc)、转移性结直肠癌、肝脏中转移性肿瘤、乳腺癌、肺癌、视网膜母细胞瘤和胶质母细胞瘤。
59.在一些方面,本公开涉及在刺激细胞特异性事件的方法中使用的方法。在一些实施方式中,在细胞群中刺激细胞特异性事件的方法中使用组合物,所述方法包含将细胞群与本文所述的连续多核酸分子、本文所述的载体、本文所述的工程化病毒基因组或本文所述的病毒体接触,其中细胞群包含至少一个靶细胞类型和一个或多个非靶细胞类型,其中靶细胞类型和非靶细胞类型在一个或多个内源性mirna的水平和/或活性上不同,使得一个或多个内源性mirna的水平和/或活性在两个或多个非靶细胞的每一个中相对于靶细胞的每一个至少两倍高;并且其中细胞特异性事件由细胞群的细胞中的输出的表达水平来调节。
60.在一些实施方式中,靶细胞的至少一个子集和非靶细胞的至少一个子集在内源性转录因子的水平或活性上不同,其中连续核酸分子进一步包含与内源性转录因子相对应的转录因子响应元件。
61.在一些实施方式中,靶细胞的至少一个子集和非靶细胞的至少一个子集在启动子片段的水平或活性上不同,其中连续核酸分子进一步包含该启动子片段。
62.在其他方面,本公开涉及诊断疾病或病况的方法中使用的组合物。在一些实施方式中,一种诊断疾病或病况的方法中使用组合物,所述方法包含向表现出与疾病或病况相关的一个或多个标志或症状的受试者施用本文所述的连续多核酸分子、本文所述的载体、本文所述的工程化病毒基因组或本文所述的病毒体,其中输出的水平指示疾病和或病况的存在或不存在。
63.在一些实施方式中,疾病是癌症。在一些实施方式中,癌症是肝细胞癌(hcc)、转移性结直肠癌、肝脏中转移性肿瘤、乳腺癌、肺癌、视网膜母细胞瘤和胶质母细胞瘤。
64.在其他方面,本公开涉及在治疗疾病或病况的方法中使用的组合物。在一些实施方式中,在治疗疾病或病况的方法中使用组合物,所述方法包含向具有疾病或病况的受试者施用本文所述的连续多核酸分子、本文所述的载体、本文所述的工程化病毒基因组或本文所述的病毒体。
65.在一些实施方式中,所述方法进一步包含施用前药,任选地其中前药是更昔洛韦,任选地其中连续多核酸分子包含表6中列出的核酸序列。
66.在一些实施方式中,疾病是癌症。在一些实施方式中,癌症是肝细胞癌(hcc)、转移性结直肠癌、肝脏中转移性肿瘤、乳腺癌、肺癌、视网膜母细胞瘤和胶质母细胞瘤。
67.在其他方面,本公开涉及在细胞群中刺激细胞特异性事件的方法。在一些实施方式中,一种在细胞群中刺激细胞特异性事件的方法包含将细胞群与连续多核酸分子或包含所述连续多核酸分子的组合物接触,其中:a)细胞群包含至少一个靶细胞类型和两个或多个非靶细胞类型,其中靶细胞类型和非靶细胞类型在一个或多个内源性mirna的水平上不同,使得一个或多个内源性mirna的水平在非靶细胞的至少一个子集中,例如两个或多个非靶细胞的至少两个和任选地每一个中,相对于靶细胞的每一个至少两倍高;和b)连续多核酸分子包含:(i)第一盒,其编码rna,所述rna的表达可操作地连接至转活化剂响应元件,其中第一rna包含:输出的核酸序列;和与一个或多个内源性mirna相对应的一个或多个mirna靶位点;和(ii)第二盒,其编码第二rna,其中第二rna包含转活化剂的核酸序列;其中第二盒的转活化剂,当表达为蛋白质时,结合和转活化第一盒的转活化剂响应元件;并且其中细胞特异性事件由细胞群的细胞中的输出的表达水平来调节。在一些实施方式中,连续多核酸分子包含表6中列出的核酸序列。
68.在一些实施方式中,一种在细胞群中刺激细胞特异性事件的方法,其包含将细胞群与或包含所述连续多核酸分子的组合物接触,其中:a)细胞群包含至少一个靶细胞类型和两个或多个非靶细胞类型,其中靶细胞类型和非靶细胞类型在一个或多个内源性mirna的水平上不同,使得一个或多个内源性mirna的水平在非靶细胞的至少一个子集中,例如在两个或多个非靶细胞的至少两个和任选地每一个中,相对于靶细胞的每一个至少两倍高;和b)连续多核酸分子包含盒,所述盒编码mrna,所述rna的表达可操作地连接至转活化剂响应元件,其中rna包含:输出的核酸序列;转活化剂的核酸序列;和与一个或多个内源性mirna相对应的一个或多个mirna靶位点;并且其中转活化剂,当表达为蛋白质时,结合和转活化盒的转活化剂响应元件;并且其中细胞特异性事件由细胞群的细胞中的输出的表达水平来调节。
69.在一些实施方式中,包含连续多核酸分子的组合物包括包含连续多核酸的载体、包含连续多核酸的工程化病毒基因组或包含多核酸的病毒体。
70.在一些实施方式中,内源性mirna选自表1中列出的mirna或表1中列出的mirna的组合。在一些实施方式中,内源性mirna选自由let-7c、let-7a、let-7b、let-7d、let-7e、let-7f、let-7g、let-7i、mir-22、mir-26b、mir-122、mir-208a、mir-208b、mir-1、mir-217、mir-216a或其组合组成的组。
71.在一些实施方式中,靶细胞的至少一个子集和非靶细胞的至少一个子集在内源性
转录因子的水平或活性上不同,其中连续核酸分子进一步包含与内源性转录因子相对应的转录因子响应元件。
72.在一些实施方式中,靶细胞的至少一个子集和非靶细胞的至少一个子集在启动子片段的水平或活性上不同,其中连续核酸分子进一步包含该启动子片段。
73.在一些实施方式中,靶细胞是肿瘤细胞并且细胞特异性事件是肿瘤细胞死亡。在一些实施方式中,肿瘤细胞死亡通过活化受体配体、特异性抗原、刺激细胞因子或其任意组合的表达由免疫靶向来介导。
74.在一些实施方式中,靶细胞是衰老细胞并且细胞特异性事件是衰老细胞死亡。
75.在一些实施方式中,方法进一步包含将细胞群与由输出代谢成治疗性或有毒化合物的前药或无毒前体化合物接触。
76.在一些实施方式中,输出表达确保靶细胞群的存活,而非靶细胞由于缺乏输出表达和在不相关和非特异性细胞死亡诱导剂的存在下被消除。
77.在一些实施方式中,靶细胞包含感兴趣的特定表型使得输出表达限于该特定表型的细胞。
78.在一些实施方式中,靶细胞是精选的细胞类型,并且通过在精选的细胞类型中天然不存在或无活性的基因的表达,细胞特异性事件是新功能的编码。
79.在一些实施方式中,细胞群包含多细胞有机体。在一些实施方式中,多细胞有机体是动物。在一些实施方式中,动物是人。
80.在一些实施方式中,细胞群是离体接触的。在一些实施方式中,细胞群是体内接触的。
81.在其他方面,本公开涉及连续多核酸分子。在一些实施方式中,连续多核酸分子包含:a)第一盒,其编码第一rna,所述第一rna的表达可操作地连接至转活化剂响应元件,其中第一rna包含:(i)输出的核酸序列;和(ii)用于mirna的靶位点,其中所述mirna在哺乳动物的至少两个不同的健康组织中是高表达的和/或有活性的并且在一个或多个类型的靶细胞中以低水平表达;b)第二盒,其编码第二rna,其中第二rna包含核酸序列,其中第二盒的转活化剂,当表达为蛋白质时,结合以及转活化第一盒的转活化剂响应元件。
附图说明
82.以下附图构成本说明书的一部分,并且被包括以进一步展示本公开的某些方面,其可以通过参考这些附图中的一个或多个,结合本文呈现的具体实施方式的详细描述,被更好地理解。应当理解,附图中所示的数据决不限制本公开的范围。
83.图1a-1n.将多质粒回路结构翻译成病毒载体。图1a.基因设置示意图。制备发散的(顶部)和会聚的(底部)设置;使用辅助转活化剂pit的不同变体为每个制备两个变体(发散的:d-p2:pit=pit::rela;d-pv:pit=pit::vpi6;会聚的:c-p2:pit=pit::rela;c-pv:pit=pit::vpi6)。图1b.在hela细胞中使用瞬时转染和异位输入表达测试骨架dna性能。每个分组中的柱条从左到右:c-p2、d-p2、c-pv、d-pv。图1c.在huh-7和hela细胞中评估构建体对内源性输入的响应。每个分组中的柱条从左到右:c-p2、d-p2、c-pv、d-pv。图1d.使用mir-424靶序列说明并入mirna靶的构建体作为鲁棒关断开关的示意图。制备发散的(顶部)和会聚的(底部)设置;使用辅助转活化剂pit的不同变体为每个制备两个变体(发散的:d-p2:
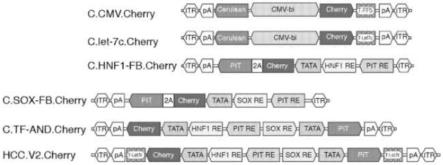
pit=pit::rela-t424;d-pv:pit=pit::vpi6-t424;会聚的:c-p2:pit=pit::rela-t424;c-pv:pit=pit::vpi6-t424)。图1e.经由tf输入的异位表达对hela细胞中的逻辑程序的and-门组分进行验证。每个分组中的柱条从左到右:c-p2-t424、d-p2-t424、c-pv-t424、d-pv-t424。图1f.在huh-7和hela细胞中评估回路对内源性转录输入的响应。柱条的顺序与图1e相同。图1g.使用异位输入递送在hela细胞中完整评估在发散的取向上编码的三-输入程序。鉴于在不存在所有输入的情况下表达的缺乏以及mir-424是负调节剂的事实,具有仅存在的mir-424的输入组合由于明显无用而未被评估。每个分组中的柱条从左到右:d-p2-t424、d-pv-t424。图1h.mirna开关在诱导tf输入的存在下的功能性。在有和没有mir-424模拟物的异位转染的huh-7细胞中测试回路输出(在x轴下指示)。柱条的顺序与图1g相同。图1i.在内源性表达的诱导tf输入的存在下,具有mir-126靶的回路相对于它们的抑制性的评估。柱条的顺序与图1g相同。图1j.以两个hcc细胞系和hela细胞作为阴性对照,评估mirna靶对细胞分类性能的作用。每个分组中的柱条从左到右:d-p2、d-pv、d-p2-t424、d-pv-t424、c-pv-t126、d-pv-t126。图1k.在hcc细胞系hepg2和huh-7中,有和没有并入、包装到dj-假型aav载体中的mirna传感器的回路组的评估。hela和hct-116细胞系用作计数器样本。每个分组中的柱条从左到右:cmv、d-p2、d-pv、d-p2-t424、d-pv-t424、c-pv-t126、d-pv-t126。图1l.区分健康的原代肝细胞与hcc细胞系的一组mirna的容量的体外评估。每个分组中的柱条从左到右:tff5、t424、t126、t122。图1m-1n.不同mirna靶设置以及它们对输出抑制幅度的影响的探究。图1m.不同构建体及它们的速记符号的示意图。图1n.hepg2细胞(无mir-122表达)和huh-7细胞(中间水平的mir-122表达)中生成的输出。每个分组中的柱条从左到右:hepg2、huh-7。缩写:itr:aav2的内部终端重复;pa:sv40多腺苷酸化信号(会聚取向),在发散取向上hgh与mcherry相邻并且sv40pa与pit基因相邻;cherry:编码mcherry荧光蛋白的序列;tata:最小tata盒(angelici等,2016);hnf1 re:结合hnf1a和hnf1b的响应元件;pit re:结合pit::rela和pit::vp16转活化剂的响应元件;sox re:结合sox9和sox10转录因子的dna序列,以及可能来自sox家族sox1-sox15、sox17、sox18、sox21、sox30和sry的其他转录因子;pit:普那霉素-诱导型转活化剂(fussenegger等,2000),其代表pit:rela或pit::vp16融合物二者其一。图表设计:输出mcherry的归一化表达显示在y轴上。
84.图2a-2f.hcc的原位小鼠模型中的特异性和功效的可行性评估。图2a.包装到dj-假型病毒载体中的所选回路的细胞分类能力的体外验证。图2b.与组成型对照载体相比,通过具有hsv-tk输出的回路的体外细胞去除。在此采用的回路的示意图显示在条形图的上方。对于每个细胞系或原代肝细胞,在组成型hsv-tk载体、回路以及单独的gcv的存在下,测量对更昔洛韦的剂量响应(x轴)。细胞活力mts读数显示在y轴上。图2c.如图中所示,针对先导实验的不同试验组(n=2)示出荷瘤小鼠中的肿瘤负荷的进展。图2d.在终止时通过发光定量肝脏中的肿瘤负荷,左边的图像是肝脏(灰度)和生物发光信号的叠加。图2e.终止后肝脏中的肿瘤负荷的定量分析。图2f.接种后不久肿瘤负荷与终止时的肿瘤负荷之间的相关性。来自治疗组的两个小鼠用两个红点表示。
85.图3a-3f.用于肿瘤靶向程序的选择的且广泛适用的mirna输入的鉴定。图3a.基于mirna候选物在健康肝脏中的高表达和在hcc样本中的低表达,它们的细胞概况分析和排列的示意图。图3b.预选择的mirna输入的功能验证的示意图。针对每个输入产生报告物病毒载体,并且将每个载体递送到感兴趣的每个样本(逐个)以评估输入的生物活性。图
3c.mirna组在两个hcc细胞系和原代健康肝细胞中的功能评估的结果。低报告物表达对应于高mirna活性。ff5是对照靶。图3d.ngs概况分析实验中鉴定的mirna表达计数(dastor等,2018)与所选mirna传感器的功能响应之间的相关性。趋势线拟合到抑制物hill函数。图3e.在全身递送后,在不同的小鼠器官中一组mirna报告物载体的定量表达。将同一器官(在图上方标示)中不同报告物的表达分组在一起。柱条阴影指示基于文献分析和概况分析数据报告物预期在哪个器官中作出响应。将这些值归一化到具有tff5靶的对照载体;接着,清楚的是该靶在体内响应隐藏的输入,并且许多报告物分子导致高于1的输出值。图3f.在各器官的报告物表达的代表性图像。报告物的名字标示在左边。cerulean图显示了组成型mcerulean内部对照的表达。cherry图显示了mcherry报告物的残留表达,并提供了指定的mirna靶。
86.图4a-4c.在体外回路特异性的验证。图4a.用于评估回路的作用机制的对照构建体的图。缩写与图1a、1d和1m中相同。图4b.将c.tf-and子回路响应映射到10个细胞系和原代肝细胞中的内源性输入。对于每个细胞系,分别在x和y轴上显示归一化到这些细胞中的组成型输出的sox9/10和hnf1a/b的反馈-放大传感器的对数变换输出。c.tf-and回路的输出显示在z轴上。图4c.映射10个细胞系和原代肝细胞中的hcc.v2回路响应。c.tf-and回路的对数变换输出和对数变换的c.let-7c报告物回路响应幅值绘制在轴x和y上,而每个细胞系中的完整回路的输出显示在轴z上。给定细胞类型的所有值归一化为该细胞类型中的组成型表达。
87.图5a-5d.回路靶向特异性的体内表征。图5a.在各种器官中使用b1-假型aav载体获得的所选子程序、对照载体、全程序和背景的输出。通过定量图像分析获得这些值。图5b.组织切片的图像表示不同的器官,显示了来自不同载体的mcherry的表达,如图所示。显示了相位图像和mcherry通道。使用两种不同的曝光来表示胰腺切片,以反映mcherry变化的大动态范围。图5c.在肿瘤和在负荷hepg2-肿瘤小鼠的器官中,来自hcc.v2回路的mcherry输出的表达。肿瘤用mcitrine稳定转导,并显示在黄色荧光通道中。图5d.使用图像处理获得的肿瘤和荷瘤小鼠的各种器官中的mcherry表达的定量分析。
88.图6a-6b.两个hcc细胞系和原代肝细胞中的回路和对照的体外功效。图6a.在不存在任何aav载体的情况下(正方形)、在组成型hsv-tk表达盒(三角形)或完整回路(圆圈)的存在下对gcv的剂量响应。使用mts测定法测量的细胞活力显示在y轴上。回路及它们的id的示意图显示在顶部。图6b.huh-7细胞系对组成型hsv-tk盒和两种不同的肿瘤靶向程序的不同载体剂量的敏感性。顶图,两个回路变体之间的比较;底图,组成型载体和第二回路变体之间的比较。
89.图7a-7f.原位小鼠模型中hcc靶向回路的功效。图7a.肿瘤建立和处理方案示意图。图7b.在各种试验组中的随时间的肿瘤负荷。经由体内全身生物发光测量的肿瘤负荷随时间的成像。对于每个动物,将负载归一化为在开始gcv注入方案之前的那天的负荷。图7c.蜘蛛图,其显示了主试验组中的个体动物的肿瘤负荷进展,归一化为在开始gcv注入方案之前的那天的肿瘤负荷。图7d.来自一些试验组的个体动物的全身发光的代表性图像。图7e.一些试验组在终止时通过整个器官生物发光测量的的个体肝脏和肝脏中的肿瘤负荷的图像。图7f.图7e中的肿瘤负荷的定量。
90.图8a-8c.aav-b1肿瘤转导的体内评估。图8a.在肝脏和hepg2-肿瘤中,将封装在
dj-假型aav载体中的对照载体、c.tf-and子程序以及全程序的输出与封装在b1-假型aav载体中的全回路的输出进行比较。肿瘤用mcitrine稳定转导,并显示在黄色荧光通道中。图8b.aav-dj和aav-b1递送时肿瘤中的hcc.v2驱动的输出水平(mcherry)的定量。通过定量图像分析获得这些值。图8c.在大肿瘤结节的核心部分中来自由b1-假型aav递送的hcc.v2回路的输出。
91.图9a-9b.结合多种肝脏保护性mirna的优化的回路的合理设计。图9a.结合强mir-let7c和弱mir-122抑制的候选回路(hcc.v3)的示意图。通过使用在hcc.v2中描述的靶构型获得强mir-let7c抑制。可以通过改变mirna靶的数量、设置或序列来调节由mir-122引起的抑制强度。示出了3种不同策略以减少与hcc.v1相比的mir-122抑制水平:(i)仅在回路的转活化剂分支上使用完美的mir-122靶(t-122*);(ii)使用具有不完美互补性的mir-122靶(t-122*)的转活化剂和输出的双重抑制;或(iii)依赖于完美靶以抑制转活化剂和不完美mirna靶以抑制输出的混合方法。选择使肝细胞系中的抑制最大化而使一组hcc细胞系(特别是huh-7)中的表达损失最小化的候选物。在两种可能的mirna靶相对定位变体中测试每个候选物。图9b.由mir-122(上和下分别为seq id no:305和306)调节的内源基因(p4ha1)的保守utr区衍生的不完美mir-122靶(t-122*)的实例。通过使用内源基因中存在的序列或通过在mirna种子序列侧翼的区域中引入随机突变获得具有不完美互补性的靶。两种方法都将用于产生具有不同剂量-响应分布的靶的选择。
具体实施方式
92.分子计算(benenson,2012)和合成生物学(weber和fussenegger,2012)的前景之一已经是“智能”治疗的合理设计(benenson等,2004),其以复杂的方式并且实时地感测和响应与疾病相关的线索,从而导致精确的和“基于需求”的治疗行动。为了在该前景上递送,解决了三个单独的挑战。首先,充分理解疾病机制,以便为治疗相关的感测-计算-响应级联设计蓝图。特别地,识别相关的输入,并且确定将优先地导致最有效和最小毒性响应的程序。第二,存在能够实现这些治疗级联的强大的合成生物学平台,或者为该目的被重新开发。第三,这些平台适于临床相关的治疗模式。在后者中,细胞和基因治疗已被确定为最适合于合成基因回路的临床翻译,考虑到这两种模态能够并且经常需要并入工程化基因载荷。
93.解决所有三种挑战使潜在医学指征的领域变窄,以在翻译设置中开发方法。一条线的工作集中在基于细胞的植入物上,其中基因修饰的细胞能够感测血液循环中的特定疾病相关的提示,并且在响应中分泌具有治疗性质的分子剂。在这条线的工作中,细胞植入物用作感测器官疾病状态并在响应中产生影响整个有机体的治疗(auslander等,2014;tastanova等,2018;ye等,2017)。研究的第二条线已经以car-t细胞治疗方法为基础并且扩增具有多输入组合感测性质的这些细胞,以便改善它们对表达表面抗原的组合的癌细胞的特异性,以及降低靶上、肿瘤外效应(cho等,2018;kloss等,2013;roybal等,2016;zah等,2016)。
94.基因治疗领域的合成生物学应用也显示了动物疾病模型的初始成功。将处理卵巢癌细胞和在这些细胞中表达免疫调节剂的一组慢病毒载体与工程化t细胞组合的混合方法,在小鼠卵巢转移模型中表现出对腹膜腔的功效。细胞靶向被实施为两个启动子之间的
mirna海绵使能的(mirna sponge-enabled)and门,两个启动子的组合显示为肿瘤特异性(nissim等,2017)。在另一项最近的工作中,溶瘤腺病毒被工程化为基于其生命周期的多输入逻辑控制进行复制,并在瘤内注入到皮下肿瘤时显示出功效(huang等,2019)。
95.用于基因和细胞治疗的合成基因回路的主要的附加值来自于对治疗响应进行“编程”的先进方法,即,以预定方式,潜在地以动态方式并组合各种反馈调节基序(angelici等,2016;xie等,2011)调节治疗行动的特异性、时机和剂量。然而,用调节其表达的基因回路提供已知的治疗性转基因可能不一定优于通常使用包装到病毒载体(其经由其衣壳另外具有一定程度的器官或细胞类型特异性)中的组成型-驱动或组织特异性启动子-驱动的治疗基因的更被认可的方法(al-zaidy等,2019;landegger等,2017;scholl等,2016)。可替代地,病毒载体可以直接注入到感兴趣的组织或器官中(juttner等,2019;nelson等,2016),从而减少需要特别解决的细胞类型的多样性。实际上,基于该方法被工程化的大多数批准的治疗,包括临床上批准的car-t细胞(june等,2018)和许多基因治疗(keeler和flotte,2019),显示出令人满意的功效和安全概况。因此,负担是在合成生物学领域上证明该优势。
96.癌症是具有巨大潜力从由合成生物学推动的治疗中受益的疾病。在患者组之间,并且甚至在同一患者中的各个肿瘤之间,甚至受限定义的癌症是异源性疾病(dagogo-jack和shaw,2018)。患者中的肿瘤通常在主和转移位点(loci)之间传播,使瘤内注入仅可针对病灶的子集。最后,抗肿瘤治疗是非常有毒的,这意味着它们在非肿瘤细胞中的激活将导致经常显著的不良反应。总之,与系统地递送药剂以解决肿瘤的传播群的需求相结合的,对精确地解决复杂的、异质的细胞群的要求表明使用合成生物学方法可以是有益的。
97.本文公开了连续多核酸分子,其编码与常用的基因治疗病毒和非病毒载体相容的分类器基因回路。本文还公开了在细胞群中对输出(即,感兴趣的基因)的表达实施复杂的多输入控制的方法。这些方法包括用于诊断和治疗疾病例如癌症(例如,肝细胞癌(hcc))的基因治疗。
98.i.连续多核酸分子的组合物
99.在一些方面,本公开涉及连续多核酸分子,其包含基因回路。如本文所用,术语“连续多核酸分子”是指单个连续核酸分子(即,单链多核酸分子)或两个互补的连续核酸分子(即,包含两个互补链的双链多核酸分子)。在一些实施方式中,连续多核酸是rna(例如,单链的或双链的)。在一些实施方式中,连续多核酸是dna(例如,单链的或双链的)。在一些实施方式中,连续多核酸是dna:rna杂合体。
100.本文所述的连续多核酸包含一个或多个表达盒编码的基因回路。如本文所用,术语“表达盒”和“盒”可互换使用并且是指多核酸,其包含:(i)编码rna的核酸序列(例如,其包含输出和/或转活化剂的核酸序列);和(ii)调节rna(例如,转活化剂响应元件、转录因子响应元件、最小启动子和/或启动子元件)的表达水平的核酸序列。
101.在一些实施方式中,连续多核酸分子包含由单个盒组成的基因回路。在其他实施方式中,连续多核酸分子包括包含两个或多个盒的基因回路。
102.在一些实施方式中,连续多核酸分子包含两个或多个盒并且至少两个盒处于发散取向。如本文所用,术语“发散取向”是指这样的配置,其中:(i)第一盒和第二盒的转录在连续多核酸分子的不同链上进行,并且(ii)第一盒的转录被引导远离第二盒并且第二盒的转录被引导远离第一盒。图1a(上部示意图)提供了各种发散配置的实例。
103.在一些实施方式中,连续多核酸分子包含两个或多个盒并且至少两个盒处于会聚取向。如本文所用,术语“会聚取向”是指这样的配置,其中:(i)第一盒和第二盒的转录在连续多核酸分子的不同链上进行并且(ii)第一盒的转录被引导朝向第二盒并且第二盒的转录被引导朝向第一盒。在一些实施方式中,两个会聚的盒共享多腺苷酸化序列。图1a(下部示意图)提供了各种会聚配置的实例。
104.在一些实施方式中,连续多核酸分子包含两个或多个盒并且至少两个盒处于头到尾取向。如本文所用,术语“头到尾”是指这样的配置,其中:(i)第一盒和第二盒的转录或翻译在连续多核酸分子的同一链上进行,并且(ii)第一盒的转录或翻译被引导朝向第二盒并且第二盒的转录或翻译被引导远离第一盒(5’...
→
...
→
...3’)。
105.在一些实施方式中,两个盒由一个或多个绝缘体隔开。绝缘体是核酸序列,其当由绝缘体结合蛋白结合时,屏蔽调节组分或响应组分免受其他附近调节元件的影响。例如,连续多核酸分子的盒的侧翼可屏蔽每个盒免受其他盒的调节元件的影响。绝缘体的实例是本领域技术人员已知的。
106.本文所述的基因回路利用一个或多个机制以调节输出分子(即,感兴趣的基因)的表达水平。因此,本文所述的每个连续多核酸包含编码rna的盒,所述rna包含输出的核酸序列。以下提供了示例性的输出分子。包含输出的核酸序列的rna可操作地连接至转活化剂响应元件(以及,任选地,一个或多个另外的调节rna,例如转录因子响应元件、最小启动子和/或启动子元件的表达的核酸序列)。
107.为了调节输出分子(即,感兴趣的基因)的表达水平,本文所述的每个连续多核酸进一步包含:(i)编码rna(例如,mrna)的盒,所述rna包含转活化剂的核酸序列;和(ii)编码rna的盒,所述rna包含mirna靶位点。以下提供了示例性的转活化剂和mirna靶位点。
108.编码rna(例如,mrna)(其包含转活化剂的核酸序列)的盒可操作地连接至调节rna(例如,转活化剂响应元件、转录因子响应元件、最小启动子和/或启动子和/或增强子元件)的表达的核酸序列。在一些实施方式中,编码包含转活化剂的核酸序列的rna的盒与编码包含输出的核酸序列的rna的盒是相同的(即,单rna包含转活化剂和输出二者的核酸序列)。
109.编码包含mirna靶位点的rna的盒可以与编码包含输出的核酸序列的rna的盒是相同的(即,包含输出的核酸序列的rna进一步包含mirna靶位点)。可选地或另外地,编码包含mirna靶位点的rna的盒可以与编码包含转活化剂的核酸序列的rna的盒是相同的(即,转活化剂的核酸序列进一步包含mirna靶位点)。
110.在一些实施方式中,由盒编码的rna的核酸序列进一步包含多腺苷酸化序列。在一些实施方式中,多腺苷酸化序列适合于哺乳动物细胞中的转录终止和多腺苷酸化。
111.(i)mirna靶位点
112.本文所述的每个连续多核酸包含编码rna的一个或多个盒(例如,rna包含编码输出的核酸序列和/或rna包含转活化剂的核酸序列),所述rna包含mirna靶位点。mirna是一类小的非编码rna,其长度通常为21-25个核苷酸,其下调它们以多种方式结合的rna的水平,包括翻译抑制、mrna切割和脱腺苷酸化。如本文所用,术语“mirna靶位点”是指与mirna互补和由mirna调节的序列。mirna靶位点可具有与结合和调节mirna靶位点的mirna至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%的互补性。
113.在一些实施方式中,由本文所述的盒编码的rna包含至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19或至少20个mirna靶位点。在一些实施方式中,由本文所述的盒编码的rna包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个mirna靶位点。在一些实施方式中,由本文所述的盒编码的rna包含1-2、1-3、1-4、1-5、1-6、1-7、1-8、1-9、1-10、2-3、2-4、2-5、2-6、2-7、2-8、2-9、2-10、3-4、3-5、3-6、3-7、3-8、3-9、3-10、4-5、4-6、4-7、4-8、4-9、4-10、5-6、5-7、5-8、5-9、5-10、6-7、6-8、6-9、6-10、7-8、7-9、7-10、8-9、8-10或9-10个mirna靶位点。
114.在一些实施方式中,由本文所述的盒编码的rna包含多个mirna靶位点并且每个mirna靶位点具有相同的序列或包含由同一mirna调节的不同的核酸序列。在其他实施方式中,由本文所述的盒编码的rna包含由不同的mirna调节的两个或多个mirna靶位点(即,不同的mirna靶位点);其包含例如,至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9或至少10个不同的mirna靶位点。在一些实施方式中,由本文所述的盒编码的rna包含1、2、3、4、5、6、7、8、9或10个不同的mirna靶位点。在一些实施方式中,由本文所述的盒编码的rna包含1-2、1-3、1-4、1-5、1-6、1-7、1-8、1-9、1-10、2-3、2-4、2-5、2-6、2-7、2-8、2-9、2-10、3-4、3-5、3-6、3-7、3-8、3-9、3-10、4-5、4-6、4-7、4-8、4-9、4-10、5-6、5-7、5-8、5-9、5-10、6-7、6-8、6-9、6-10、7-8、7-9、7-10、8-9、8-10或9-10个不同的mirna靶位点。
115.由本文所述的盒编码的rna的mirna靶位点可位于rna的序列内的任何位置。例如,在一些实施方式中,由本文所述的盒编码的rna包含3’utr,并且3’utr包含mirna靶位点。在一些实施方式中,由本文所述的盒编码的rna包含内含子,并且内含子包含mirna靶位点。在一些实施方式中,由本文所述的盒编码的rna包含5’utr,并且5’utr包含mirna靶位点。
116.示例性的mirna和mirna靶位点是表1中列出的。在一些实施方式中,由本文所述的盒编码的rna包含用于表1中列出的mirna的mirna靶位点。在一些实施方式中,由本文所述的盒编码的rna包含与表1中列出的mirna相对应的多个mirna靶位点(例如,包括let-7c靶位点和mir-122靶位点的组合)。
117.在一些实施方式中,由本文所述的盒编码的rna包含mirna靶位点,其具有与表1中列出的mirna靶位点的至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性。在一些实施方式中,由本文所述的盒编码的rna包含多个mirna靶位点,其具有与表1中列出的mirna靶位点的至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性。
118.在一些实施方式中,由本文所述的盒编码的rna包含let-7a靶位点、let-7b靶位点、let-7c靶位点、let-7d靶位点、let-7e靶位点、let-7f靶位点、let-7g靶位点、let-7i靶位点、mir-22靶位点、mir-26b靶位点、mir-122靶位点、mir-208a靶位点、mir-208b靶位点、mir-1靶位点、mir-217靶位点、mir-216a靶位点或其组合(例如,let7c靶位点和mir-122靶位点的组合)。
119.在一些实施方式中,由本文所述的盒编码的rna包含let-7c靶位点(即,与hsa-let-7c互补和由hsa-let-7c调节的核酸序列)。在一些实施方式中,let-7c靶位点由核酸序列aaccatacaacctactacctca(seq id no:42)组成。
120.在一些实施方式中,由本文所述的盒编码的rna包含mir-22靶位点(即,与mir-22
互补和由mir-22调节的核酸序列)。在一些实施方式中,mir-22靶位点由核酸序列acagttcttcaactggcagctt(seq id no:43)组成。
121.在一些实施方式中,由本文所述的盒编码的rna包含mir-26b靶位点(即,与mir-26b互补和由mir-26b调节的核酸序列)。在一些实施方式中,mir-26b靶位点由核酸序列acctatcctgaattacttgaa(seq id no:44)组成。
122.在一些实施方式中,由本文所述的盒编码的rna包含mir-126-5p靶位点(即,与mir-126-5p互补和由mir-126-5p调节的核酸序列)。在一些实施方式中,mir-126-5p靶位点由核酸序列cgtgttcacagcggaccttgat(seq id no:45)组成。
123.在一些实施方式中,由本文所述的盒编码的rna包含mir-424靶位点(即,与mir-424互补和由mir-424调节的核酸序列)。在一些实施方式中,mir-424靶位点由核酸序列gtccaaaacatgaattgctgct(seq id no:48)组成。
124.在一些实施方式中,由本文所述的盒编码的rna包含mir-122靶位点(即,与mir-122互补和由mir-122调节的核酸序列)。在一些实施方式中,mir-122靶位点由核酸序列caaacaccattgtcacactcca(seq id no:46)组成。
125.表1.示例性的mirna和示例性的mirna靶位点。
126.127.[0128][0129]
在一些实施方式中,本文所述的连续多核酸由单个盒组成,其中单个盒编码包含mirna靶位点的rna(除了包含输出的核酸序列和转活化剂的核酸序列)。
[0130]
在其他实施方式中,连续多核酸包含两个或多个盒,其至少一个编码包含mirna靶位点的rna。
[0131]
在一些实施方式中,连续多核酸分子的多个盒包含至少一个mirna靶位点。在一些实施方式中,连续多核酸的每个mirna靶位点是独特的(即,连续多核酸包括仅一个拷贝的mirna靶)。在一些实施方式中,连续多核酸分子包含至少两个盒,其各自包含是相同的核酸序列的至少一个mirna靶位点。在一些实施方式中,连续多核酸分子包含至少两个盒,其各自包含至少一个mirna靶位点,其中每个盒的至少一个mirna靶位点包含由同一mirna调节的不同的核酸序列。例如,第一盒可包含mirna靶位点x和第二盒可包含mirna靶位点y并且mirna z调节靶位点x和靶位点y。
[0132]
在一些实施方式中,本文所述的调节连续多核酸的mirna靶位点的mirna(即,至少一个mirna)在(例如,多细胞有机体的,诸如哺乳动物的)至少一个细胞类型中是高表达的和/或有活性的,其中输出表达必须是低的。如本文所述的,在所述组织细胞类型中,当相对于参考连续多核酸(即,缺少由mirna调节的mirna靶位点,但除此之外包含相同的核酸序列)的输出表达的水平,输出表达被降低至少50%时,mirna是高表达的和/或有活性的。在一些实施方式中,相对于参考连续多核酸,输出被降低至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少99.9%。
[0133]
在一些实施方式中,本文所述的调节连续多核酸的mirna靶位点的mirna(即,至少一个mirna)在(例如,多细胞有机体的,诸如哺乳动物的)至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少15、至少20、至少25、至少30、至少40、至少50、至少60、至少70、至少80、至少90、至少100、至少150、至少200、至少500、至少1000种细胞类型中是高表达的和/或有活性的,其中输出表达必须是低的。
[0134]
在一些实施方式中,本文所述的调节连续多核酸的mirna靶的mirna(即,至少一个mirna)在(例如,多细胞有机体的,例如哺乳动物的)至少一种靶细胞类型中具有低表达和/或是无活性的,其中输出表达必须是高的。如本文所述,在所述靶细胞类型中,当相对于参考连续多核酸(即,缺少由mirna调节的mirna靶位点,但除此之外包含相同的核酸序列)的输出表达的水平,输出表达被降低小于40%时,mirna具有低表达和/或是无活性的。在一些实施方式中,相对于参考连续多核酸,输出被降低小于35%、小于30%、小于25%、小于20%、小于15%、小于10%、小于5%、小于4%、小于3%、小于2%或小于1%。在一些实施方式中,在来自包含mirna靶的连续多核酸和参考连续多核酸分子的输出表达的水平之间没有统计学差异。
[0135]
在一些实施方式中,本文所述的调节连续多核酸的mirna靶位点的mirna(即,至少一个mirna)在(例如,多细胞有机体的,例如哺乳动物的)至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少15、至少20、至少25、至少30、至少40、至少50、至少60、至少70、至少80、至少90、至少100、至少150、至少200、至少500、至少1000种靶细胞类型中是以低水平表达的和/或无活性的,其中输出表达必须是高的。
[0136]
(ii)示例性的转活化剂
[0137]
本文所述的每个连续多核酸包含编码rna(例如,mrna)的盒,所述rna包含转活化剂的核酸序列。在一些实施方式中,连续多核酸包含单个转活化剂的核酸序列。在其他实施方式中,连续多核酸包含多个转活化剂(例如,2、3、4、5、6、7、8、9或10个转活化剂)的核酸序列。
[0138]
如本文所用,术语“转活化剂”或“转活化剂蛋白”是指在连续多核酸分子上编码的蛋白,其转活化输出(即,感兴趣的基因)的表达并结合至可操作地连接至编码输出(即,感兴趣的基因)的核酸的转活化剂响应元件。在一些实施方式中,转活化剂独立地(即,在不存在任何另外的因子的情况下)结合和转活化转活化剂响应元件。在其他实施方式中,转活化剂仅在结合至转录因子响应元件的转录因子的存在下结合和转活化转活化剂响应元件。
[0139]
在一些实施方式中,转活化剂蛋白包含dna-结合结构域。在一些实施方式中,dna结合结构域被工程化(即,非天然存在的)以结合不同于天然存在的序列的dna序列。dna结合结构域的实例是本领域技术人员已知的,并且包括但不限于,使用锌指技术或talen技术衍生的或源自来自细菌的两组分信号传导途径的突变响应调节剂的dna结合结构域。
[0140]
在一些实施方式中,dna结合结构域源自哺乳动物蛋白。在其他实施方式中,dna结合结构域源自非哺乳动物蛋白。例如,在一些实施方式中,dna结合结构域源自起源于细菌、酵母或植物的蛋白。在一些实施方式中,dna结合结构域需要另外的组分(例如,蛋白或rna)以靶向转活化剂响应元件。例如,在一些实施方式中,dna结合结构域是crispr/cas蛋白(例如,cas1、cas2、cas3、cas5、cas4、cas6、cas7、cas8a、cas8b、cas8c、cas9、cas10、cas10d、cse1、cse2、csy1、csy2、csy3、csm2、cmr5、csx10、csx11、csf1、cpf1、c2c1、c2c2、c2c3)的dna结合结构域,其需要引导rna的另外的组分以靶向转活化剂响应元件。
[0141]
在一些实施方式中,转活化剂蛋白源自天然存在的转录因子,其中天然存在的转录因子的dna结合结构域已被突变,导致相对于野生型转录因子的改变的dna结合特异性。在一些实施方式中,转活化剂是天然存在的转录因子。
[0142]
在一些实施方式中,转活化剂蛋白进一步包含转活化结构域(即,包含dna结合结
构域和转活化结构域的融合蛋白)。如本文所用,术语“转活化结构域”是指发挥功能以招募转录机器至最小启动子的蛋白结构域。在一些实施方式中,转活化结构域不独立地触发基因活化。在一些实施方式中,转活化结构域是天然存在的。在其他实施方式中,转活化结构域是工程化的。转活化结构域的实例是本领域技术人员已知的,并且包括但不限于rela转活化结构域、vp16、vp48和vp64。
[0143]
示例性的转活化剂在表2中列出。在一些实施方式中,至少一个盒的转活化剂是表2中列出的转活化剂或是其氨基酸序列与表2中列出的一个或多个转活化剂具有至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%同一性的转活化剂。在一些实施方式中,本文所述的连续多核酸分子编码表2中列出的转活化剂的组合或其氨基酸序列与表2中列出的一个或多个转活化剂具有至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%同一性的转活化剂的组合。
[0144]
在一些实施方式中,至少一个盒的转活化剂是tta、rtta、pit-rela、pit-vp16、et-vp16、et-rela、narlc-vp16或narlc-rela。参见例如,angelici b.等,cell rep.2016年8月30日;16(9):2525-2537。
[0145]
表2.示例性的转活化剂。dna序列仅仅是能够编码所描绘的蛋白序列的实例;由于简并密码子,非常大组的dna序列可编码相同的蛋白序列。诸如rela和vp16的转活化剂结构域仅是可能的转活化剂结构域(tad)的实例。
″
vp16 tad
″
代表源自单纯疱疹病毒的vp16基因的转活化剂结构域;当融合至dna结合结构域时,多个结构域及它们的组合和它们的突变体可用作转活化剂结构域。当源自全长蛋白时,转活化剂的dna结合结构域(dbd)仅仅是这样的结构域的实例;它们可进一步减少或提高以包括来自它们的全长蛋白祖先的更多氨基酸。基于它们在大肠杆菌中的蛋白质序列,示出了源自原核两组分信号传导系统的响应调节剂的dbd,然而,来自其它原核菌株和物种的这些基因的同源序列也可被使用。此外,不具有大肠杆菌中的同源序列的来自两组分信号传导途径的响应调节剂的dna结合结构域也可用于相同目的。m(下划线)代表在各种dbd的前面引入的起始密码子,以使它们能够翻译。
″
::
″
代表dbd和tad之间的融合点。
[0146]
[0147]
[0148]
[0149]
[0150]
[0151]
[0152]
[0153]
[0154]
[0155]
[0156][0157]
(iii)示例性输出分子
[0158]
本文所述的每个连续多核酸包含编码rna(例如,mrna)的盒,所述rna包含输出(即,感兴趣的基因)的核酸序列。在一些实施方式中,连续多核酸包含单个输出的核酸序列。在其他实施方式中,连续多核酸包含多个输出(例如,2、3、4、5、6、7、8、9或10个输出)的核酸序列。
[0159]
在一些实施方式中,输出是rna分子。在一些实施方式中,rna分子是编码蛋白的mrna。在一些实施方式中,输出是非编码rna分子。非编码rna分子的实例是本领域技术人员已知的,并且包括但不限于,包括转移rna(trna)、核糖体rna(rrna)、mirna、sirna、pirna、snorna、snrna、exrna、scarna和长ncrna。
[0160]
在一些实施方式中,输出是治疗性分子(即,与疾病的治疗有关),例如治疗性蛋白或rna分子。治疗性分子的实例包括但不限于,抗体(例如,单克隆的或多克隆的;嵌合的;人源化的;包括抗体片段和抗体衍生物(双特异性、三特异性、scfv和fab))、酶、激素、炎性分子、抗炎分子、免疫调节分子、抗癌分子、短发夹rna、短干扰rna和mirna。前述种类的治疗性分子的具体实例在本领域中是已知的,其中的任何一种可根据本公开使用。
[0161]
在一些实施方式中,输出编码抗原蛋白、蛋白结构域、或源自病原体并且当在体内产生时已知引发免疫响应的肽。
[0162]
在一些实施方式中,输出是可检测的蛋白,例如荧光蛋白。
[0163]
在一些实施方式中,输出是细胞毒素。如本文所用,术语“细胞毒素”是指对细胞有毒的物质。例如,在一些实施方式中,输出是细胞毒蛋白。细胞毒蛋白的实例是本领域技术人员已知的,并且包括但不限于,粒溶素、穿孔素/粒酶b和fas/fas配体。
[0164]
在一些实施方式中,输出是催化前药的活化的酶。催化前药活化的酶的实例是本领域技术人员已知的,并且包括但不限于羧酸酯酶、乙酰胆碱酯酶、丁酰胆碱酯酶、对氧磷酶(paraxonases)、基质金属蛋白酶、碱性磷酸酶、β-葡萄糖醛酸酶、伐昔洛韦酶(valacyclovirases)、前列腺特异性抗原、嘌呤核苷磷酸酶、羧肽酶、酰胺酶、β-内酰胺酶、β-半乳糖苷酶、和胞嘧啶脱氨酶。参见例如,yang y.等,enzyme-mediated hydrolytic activation of prodrugs.acta.pharmaceutica.sinica b.2011年10月;1(3):143-159。类似地,各种前药是本领域技术人员已知的,并且包括但不限于,阿昔洛韦、别嘌呤醇(allopurinaol)、叠氮胸苷、班布特罗、巴氨西林(becampicillin)、卡培他滨、卡托普利、卡马西平、卡立普多、环磷酰胺、乙烯雌酚二磷酸酯、地匹福林、依那普利、泛昔洛韦、氟达拉滨三磷酸、氟尿嘧啶、膦沙那韦(fosmaprenavir)、磷苯妥英(fosphentoin)、呋喃硫胺、加巴喷丁encarbil、更昔洛韦、吉西他滨、酰肼mao抑制剂、来氟米特、左旋多巴、甲胺、巯基嘌呤、丝裂霉素、吗多明、萘丁美酮、奥沙拉秦、奥美拉唑、帕利哌酮、非那西汀、匹氨西林、扑米酮、氯胍、赛洛西宾、雷米普利、s-甲基多巴、辛伐他汀、柳氮磺吡啶、苏灵大、替加氟、特非那定、伐昔洛韦、缬更昔洛韦和齐多夫定。
[0165]
在一些实施方式中,输出是hsv-tk、来自人α疱疹病毒1(hhv-1)的胸苷激酶、uniprotkb-q9qnf7(kith_hhv1)。
[0166]
在一些实施方式中,输出是免疫调节蛋白和/或rna。如本文所用,术语“免疫调节蛋白”(或免疫调节rna)是指通过诱导免疫系统组分的活化和/或提高活性来调节(刺激(即,免疫刺激蛋白或rna)或抑制(即,免疫抑制蛋白或rna))免疫系统的蛋白(或rna)。各种免疫调节蛋白是本领域技术人员已知的。参见例如,shahbazi s.和bolhassani a.immunostimulants:types and funtions.j.med.microbiol.infec.dis.2016;4(3-4):45-51。在一些实施方式中,免疫调节蛋白是细胞因子、趋化因子(例如,il-2、il-5、il-6、il-10、il-12、il-13、il-15、il-18、ccr3、cxcr3、cxcr4和ccr10)或集落刺激因子。
[0167]
在一些实施方式中,输出是dna修饰因子。如本文所用,术语“dna修饰因子”是指改变dna的结构和/或改变dna的序列(例如,通过诱导重组或引入突变)的因子。在一些实施方式中,dna修饰因子是编码用来校正基因缺陷的蛋白、dna修饰酶和/或dna修饰系统的组分的基因。在一些实施方式中,dna修饰酶是位点特异性重组酶、归巢核酸内切酶或crispr/cas dna修饰系统的蛋白组分。
[0168]
在一些实施方式中,输出是细胞表面受体。在一些实施方式中,输出是激酶。
[0169]
在一些实施方式中,输出是基因表达调节因子。如本文所用,术语“基因表达调节因子”是指当存在时,提高或降低至少一个基因的转录的任何因子。在一些实施方式中,基因表达调节因子是蛋白。在一些实施方式中,基因表达调节因子是rna。在一些实施方式中,基因表达调节因子是能够调节基因表达的多组分系统的组分。
[0170]
在一些实施方式中,输出是表观基因修饰剂。如本文所用,术语“表观基因修饰剂”是指提高、降低或改变表观基因修饰的因子(例如,蛋白或rna)。表观基因修饰的实例是本领域技术人员已知的,并且包括但不限于,dna甲基化和组蛋白修饰。
[0171]
在一些实施方式中,输出是载体复制所需的因子。载体复制所需的因子的实例是本领域技术人员已知的。
[0172]
(iv)调节组分
[0173]
编码rna(例如,包含输出和/或转活化剂的核酸序列)的盒可进一步包含调节组分。如本文所述,调节组分是控制rna的表达(即,刺激提高的或降低的rna的表达)的核酸序列。例如,在一些实施方式中,本文所述的盒可编码可操作地连接至转活化剂响应元件、转录因子响应元件、最小启动子和/或启动子元件的rna。调节组分“可操作地连接”至编码rna的核酸,当它关于核酸序列处于正确的功能位置和取向时,使得它调节(或驱动)序列的转录起始和/或表达。
[0174]
在一些实施方式中,调节组分包含转活化剂响应元件。“转活化剂响应元件”可包含由转活化剂蛋白结合和识别的最小dna序列。在一些实施方式中,转活化剂响应元件包含由转活化剂蛋白结合和识别的最小dna序列的多于一个拷贝(即,重复)。在一些实施方式中,转活化剂响应元件包含由转活化剂蛋白结合和识别的最小dna序列的至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9或至少10个重复。在一些实施方式中,重复是串联重复。在一些实施方式中,转活化剂响应元件包含最小dna序列的组合。在一些实施方式中,最小dna序列散置有间隔序列。在一些实施方式中,间隔序列长度是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或大于20个核苷酸。
[0175]
在一些实施方式中,转活化剂响应元件包含与最小dna序列的偏差或侧翼为另外的dna序列,同时仍能够结合转活化剂蛋白。在一些实施方式中,不同的转活化剂响应元件可彼此相邻放置,同时所有能够结合至同一转活化剂蛋白。
[0176]
示例性的转活化剂响应元件在表3中列出。在一些实施方式中,转活化剂响应元件由表3中列出的核酸序列或与表3中列出的核酸序列具有至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的核酸序列组成。
[0177]
表3.示例性的转活化剂响应元件。
″
::
″
代表在转活化剂结构域(tad)和dna结合结构域(dbd)之间的融合点。tad和dbd的序列的简化符号对应于表2。dna序列使用以下命名法:w=a或t;s=c或g;k=a或c;m=g或t;y=a或g;r=c或t;v=c、g或t;h=a、g或t;d=a、c或t;b=a、c或g;n=a、c、g或t。大写字母代表强保守;小写符号代表较弱的保守。
[0178]
[0179]
[0180]
[0181][0182]
在一些实施方式中,调节组分包含转录因子响应元件。术语“转录因子响应元件”是指由转录因子结合和识别的dna序列。如本文所用,术语“转录因子”是指不在调制基因转录的连续多核酸上编码的蛋白。在一些实施方式中,转录因子是转录活化剂(即,提高转录)。在其他实施方式中,转录因子是转录抑制剂(即,抑制转录)。在一些实施方式中,转录因子是细胞的内源性转录因子。
[0183]
在一些实施方式中,转录因子响应元件被工程化以直接结合以下转录因子的一个或多个,或被以下转录因子的一个或多个间接地影响:abl1、cebpa、ercc3、hist1h2be、mdm4、pax7、smarca4、tfpt、aff1、chd1、ercc6、hist1h2bg、med12、pax8、smarcb1、thrap3、aff3、chd2、erf、hlf、mef2b、pbx1、smarcd1、tlx1、aff4、chd4、erg、hmga1、mef2c、peg3、smarce1、tlx3、apc、chd5、espl1、hmga2、men1、per1、smurf2、tnfaip3、ar、chd7、esr1、hoxa11、mitf、phf3、sox2、sox4、tp53、arid1a、cic、ets1、hoxa13、mkl1、phf6、sox5、trim24、arid1b、ciita、etv1、hoxa7、mllt1、phox2b、sox9、trim33、arid3b、cnot3、etv4、hoxa9、mllt10、plag1、srcap、trip11、arid5b、creb1、etv5、hoxc11、mllt3、pml、ss18l1、trps1、arnt、creb3l1、etv6、hoxc13、mllt6、pms1、ssb、trrap、arnt2、crebbp、ewsr1、hoxd11、myb、pnn、ssx1、tsc22d1、asb15、crtc1、eya4、hoxd13、mybl1、mybl2、pou2af1、ssx2、tshz3、asxl1、csde1、ezh2、id3、myc、pou2f2、ssx4、vhl、atf1、ctcf、fev、irf2、mycn、pou5f1、
stat3、whsc1、atf7ip、ctnnb1、fli1、irf4、myod1、pparg、stat4、whsc1l1、atm、dach1、foxa1、irf6、ncoa1、prdm1、stat5b、wt1、atrx、dach2、foxe1、irf8、ncoa2、prdm16、stat6、wwp1、baz2b、daxx、foxl2、irx6、ncoa4、prdm9、sufu、wwtr1、bcl11a、ddb2、foxp1、jun、ncor1、prrx1、suz12、xbp1、bcl11b、ddit3、foxq1、khdrbs2、ncor2、psip1、taf1、xpc、bcl3、ddx5、fubp1、khsrp、neurog2、rara、taf15、zbtb16、bcl6、dek、fus、klf2、nfe2l2、rb1、tal1、zbtb20、bclaf1、dip2c、fxr1、klf4、nfe2l3、rbm15、tal2、zfp36l1、bcor、dnmt1、gata1、klf5、nfib、rbmx、tbx18、zfx、brca1、dnmt3a、gata2、klf6、nfkb2、rel、tbx22、zhx2、brca2、dot1l、gata3、ldb1、nfkbia、runx1、tbx3、zic3、brd7、eed、gli3、lmo1、nono、runx1t1、tcea1、zim2、brd8、egr2、gtf2i、lmo2、notch2、rxra、tceb1、znf208、brip1、elavl2、hdac9、lmx1a、notch3、sall3、tcerg1、znf226、brpf3、elf3、hey1、lyl1、npm1、satb2、tcf12、znf331、btg1、elf4、hist1h1b、lztr1、nr3c2、setbp1、tcf3、znf384、btg2、elk4、hist1h1c、maf、nr4a3、sfpq、tcf7l2、znf469、cbfa2t3、ell、hist1h1d、mafa、nsd1、sin3a、tfap2d、znf595、cbfb、ep300、hist1h1e、mafb、olig2、smad2、tfdp1、znf638、cdx2、epc1、hist1h2bc、maml1、pax3、smad4、tfe3、cdx4、ercc2、hist1h2bd、max、pax5、smarca1和tfeb。
[0184]“转录因子响应元件”可包含由转录因子结合和识别的最小dna序列。在一些实施方式中,转录因子响应元件包含由转录因子结合和识别的最小dna序列的多于一个拷贝(即,重复)。在一些实施方式中,转录因子响应元件包含由转录因子结合和识别的最小dna序列的至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9或至少10个重复。在一些实施方式中,重复是串联重复。在一些实施方式中,转录因子响应元件包含最小dna序列的组合。在一些实施方式中,最小dna序列散置有间隔序列。在一些实施方式中,间隔序列长度是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或大于20个核苷酸。在一些实施方式中,转活化剂响应元件包含与最小dna序列的偏差或侧翼有另外的dna序列,同时仍能够结合转活化剂蛋白。在一些实施方式中,不同的转活化剂响应元件可彼此相邻放置,同时所有能够结合至同一转活化剂蛋白。
[0185]
在一些实施方式中,转录因子响应元件是独特的(即,连续多核酸仅包括一个拷贝的转录因子响应元件)。在其他实施方式中,转录因子响应元件不是独特的。在一些实施方式中,结合至转录因子响应元件的转录因子活化它可操作地连接的rna的表达。在其他实施方式中,结合至转录因子响应元件的转录因子抑制它可操作地连接的rna的表达。
[0186]
在一些实施方式中,调节组分包含至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9或至少10个不同的转录因子响应元件,每个由不同的转录因子结合。在一些实施方式中,调节组分包含2、3、4、5、6、7、8、9或10个不同的转录因子响应元件,每个由不同的转录因子结合。
[0187]
示例性的转录因子响应元件在表4中列出。在一些实施方式中,转录因子响应元件由表4中列出的核酸序列或与表4中列出的核酸序列具有至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的核酸序列组成。
[0188]
表4.示例性的转录因子响应元件。
[0189]
[0190]
[0191][0192]
在一些实施方式中,调节组分包含启动子元件(或启动子片段)。示例性的启动子元件在表5中列出。在一些实施方式中,启动子元件由表5中列出的核酸序列或与表5中列出的核酸序列具有至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的核酸序列组成。
[0193]
表5.示例性的启动子元件。
[0194]
[0195]
[0196]
[0197]
[0198]
[0199]
[0200][0201]
在一些实施方式中,启动子元件包含转录因子响应元件和最小启动子。在一些实施方式中,启动子元件包含哺乳动物启动子或启动子片段。在一些实施方式中,哺乳动物启动子或启动子片段是独特的(即,连续多核酸仅包括一个拷贝的哺乳动物启动子或启动子片段)。在其他实施方式中,哺乳动物启动子或启动子片段不是独特的。
[0202]
在一些实施方式中,调节组分包含最小启动子。如本文所用,术语“最小启动子”是指必需但不足以启动输出的表达的核酸序列。在一些实施方式中,最小的启动子是天然存在的。在其他实施方式中,最小启动子是工程化的,例如通过改变和/或缩短天然存在的序列、组合天然存在的序列、或将天然存在的序列与非天然存在的序列组合;在每种情况下,工程化的最小启动子是非天然存在的序列。在一些实施方式中,最小启动子从病毒或非病毒来源工程化的。最小启动子的实例是本领域技术人员已知的。
[0203]
在一些实施方式中,调节组分包含转活化剂响应元件、转录因子响应元件和最小启动子。本领域技术人员将理解这些元件可以以各种配置被定向。例如,转活化剂响应元件可以是5’或3’至启动子元件和/或转录因子响应元件;转录因子响应元件可以是5’或3’至启动子元件和/或转活化剂响应元件;启动子元件可以是5’或3’至转录因子响应元件和/或转活化剂响应元件。
[0204]
在一些实施方式中,盒的调节组分从5’至3’包含:转活化剂响应元件、转录因子响应元件和最小启动子。在一些实施方式中,调节组分从5’至3’包含:转录因子响应元件、转活化剂响应元件和最小启动子。
[0205]
在一些实施方式中,盒的调节组分包含转活化剂响应元件和启动子元件。在一些实施方式中,盒的调节组分从5’至3’包含:转活化剂响应元件和启动子元件。在一些实施方
式中,盒的调节组分包含转活化剂响应元件、启动子元件和最小启动子。在一些实施方式中,盒的调节组分从5’至3’包含:转活化剂响应元件、启动子元件和最小启动子。在一些实施方式中,盒的调节组分从5’至3’包含:启动子元件和转活化剂响应元件。在一些实施方式中,盒的调节组分从5’至3’包含:启动子元件、转活化剂响应元件和最小启动子。在一些实施方式中,启动子元件是哺乳动物启动子。在一些实施方式中,启动子元件是启动子片段。
[0206]
(v)示例性的连续多核酸
[0207]
在一些实施方式中,连续多核酸分子包含具有单个盒的基因回路。例如,在一些实施方式中,连续多核酸分子包含编码rna的盒,所述rna的表达可操作地连接至转活化剂响应元件,其中rna包含:(i)输出的核酸序列;(ii)转活化剂的核酸序列;和(iii)mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合);其中转活化剂,当表达为蛋白质时,结合和转活化转活化剂响应元件。
[0208]
在一些实施方式中,mrna进一步包含多顺反子表达元件的核酸序列。如本文所用,术语“多顺反子响应元件”是指促进从单个mrna生成两个或多个蛋白的核酸序列。多顺反子响应元件可包含编码内部识别序列(ires)或2a肽的多核酸。参见例如,liu等,systematic comparison of 2a peptides for cloning multi-genes in a polycistronic vector.sci.rep.2017年5月19日;7(1):2193。在一些实施方式中,多顺反子表达元件隔开输出和转活化剂的核酸序列。
[0209]
在一些实施方式中,mrna包含3’utr,其中3’utr包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)。在一些实施方式中,mrna包含5’utr,其中5’utr包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)。
[0210]
在一些实施方式中,连续多核酸分子从5’至3’包含:(i)包含转活化剂响应元件和转录因子响应元件的上游调节组分;(ii)编码输出和转活化剂的核酸序列;和(iii)包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)的下游组分。
[0211]
在一些实施方式中,连续多核酸分子从5’至3’包含:(i)包含转录因子响应元件和转活化剂响应元件的上游调节组分;(ii)编码输出和转活化剂的核酸序列;和(iii)包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)的下游组分。
[0212]
在一些实施方式中,连续多核酸分子从5’至3’包含:(i)包含转活化剂响应元件和转录因子响应元件的上游调节组分;(ii)编码转活化剂和输出的核酸序列;和(iii)包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)的下游组分。
[0213]
在一些实施方式中,连续多核酸分子从5’至3’包含:(i)包含转录因子响应元件和转活化剂响应元件的上游调节组分;(ii)编码转活化剂和输出的核酸序列;和(iii)包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)的下游组分。
[0214]
在一些实施方式中,连续多核酸分子从5’至3’包含:(i)包含启动子元件和转活化剂响应元件的上游调节组分;(ii)编码转活化剂和输出的核酸序列;和(iii)包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)的下游组分。
[0215]
在一些实施方式中,连续多核酸分子从5’至3’包含:(i)包含转活化剂响应元件和启动子元件的上游调节组分;(ii)编码转活化剂和输出的核酸序列;和(iii)包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)的下游组分。
[0216]
在一些实施方式中,启动子元件包含哺乳动物启动子或启动子片段。
[0217]
在一些实施方式中,连续多核酸分子包含具有多个盒的基因回路。例如,在一些实施方式中,一种连续多核酸分子,其包含:a)第一盒,其编码第一rna,所述第一rna的表达可操作地连接至转活化剂响应元件,其中第一rna包含:(i)输出的核酸序列;和(ii)mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合);和b)第二盒,其编码第二rna,其中第二rna包含转活化剂的核酸序列;其中第二盒的转活化剂,当表达为蛋白质时,结合以及转活化第一盒的转活化剂响应元件。
[0218]
在一些实施方式中,第一rna包含3’utr,并且3’utr包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)。在一些实施方式中,第一rna包含5’utr,并且5’utr包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)。
[0219]
在一些实施方式中,第二rna包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)。在一些实施方式中,第二rna包含3’utr,并且3’utr包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)。在一些实施方式中,第二rna包含5’utr,并且5’utr包含mirna靶位点(例如,let-7c靶位点、mir-22靶位点、mir-26b靶位点或其组合)。在一些实施方式中,第一盒的至少一个mirna靶位点和第二盒的至少一个mirna靶位点是由同一mirna调节的同一核酸序列或不同的序列。
[0220]
在一些实施方式中,第一rna可操作地连接至转录因子响应元件。在一些实施方式中,第二rna可操作地连接至转录因子响应元件。在一些实施方式中,第一盒的转录因子响应元件和第二盒的转录因子响应元件由相同的核酸序列组成。在一些实施方式中,第一盒的转录因子响应元件和第二盒的转录因子响应元件由不同的核酸序列组成。在一些实施方式中,第一盒或第二盒二者其一或二者包含至少两种、至少三种...类型的转录因子响应元件。
[0221]
在一些实施方式中,第一盒从5’至3’包含:(i)包含转活化剂响应元件和转录因子响应元件的上游调节组分;(ii)编码输出的核酸序列;和(iii)包含let-7c靶位点的下游组分;并且第二盒从5’至3’包含:(i)包含转录因子响应元件的上游调节组分;(ii)编码转活化剂的核酸序列;和(iii)包含let-7c靶位点的下游组分。
[0222]
在一些实施方式中,第一盒从5’至3’包含:(i)包含转录因子响应元件和转活化剂响应元件的上游调节组分;(ii)编码输出的核酸序列;和(iii)包含let-7c靶位点的下游组分;并且第二盒从5’至3’包含:(i)包含转录因子响应元件的上游调节组分;(ii)编码转活化剂的核酸序列;和(iii)包含let-7c靶位点的下游组分。
[0223]
在一些实施方式中,第一盒从5’至3’包含:(i)包含转活化剂响应元件和转录因子响应元件的上游调节组分;(ii)编码输出的核酸序列;和(iii)包含let-7c靶位点的下游组分;并且第二盒从5’至3’包含:(i)包含启动子元件的上游调节组分;(ii)编码转活化剂的核酸序列;和(iii)包含let-7c靶位点的下游组分。
[0224]
在一些实施方式中,第一盒从5’至3’包含:(i)包含转录因子响应元件和转活化剂响应元件的上游调节组分;(ii)编码输出的核酸序列;和(iii)包含let-7c靶位点的下游组分;并且第二盒从5’至3’包含:(i)包含启动子元件的上游调节组分;(ii)编码转活化剂的核酸序列;和(iii)包含let-7c靶位点的下游组分。
[0225]
在一些实施方式中,第一盒的上游调节组分除了转录因子响应元件之外包含启动
子元件。在一些实施方式中,启动子元件取代转录因子响应元件。在一些实施方式中,启动子元件包含哺乳动物启动子或启动子片段。
[0226]
在一些实施方式中,第一盒和第二盒处于会聚取向。在一些实施方式中,第一盒和第二盒处于发散取向。在一些实施方式中,第一盒和第二盒处于头到尾取向。
[0227]
第一和/或第二盒可侧翼为一个或多个绝缘体(例如,1、2、3、4、5、6、7、8、9或10个绝缘体)。例如,在一些实施方式中,第一盒或第二盒侧翼为绝缘体。在一些实施方式中,第一盒和第二盒二者侧翼为绝缘体。在一些实施方式中,第一盒或第二盒在两侧侧翼为绝缘体。
[0228]
示例性的连续多核酸在表6中列出。在一些实施方式中,连续多核酸包含表6中列出的核酸序列或与表6中列出的核酸序列具有至少70%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性的核酸序列。
[0229]
表6.示例性的连续多核酸。
[0230]
[0231][0232]
[0233][0234]
[0235][0236]
[0237][0238]
[0239][0240]
[0241][0242]
[0243][0244]
[0245][0246]
[0247][0248]
[0249][0250]
[0251][0252]
[0253][0254]
[0255][0256]
[0257][0258]
[0259][0260]
[0261][0262]
[0263][0264]
[0265][0266]
[0267]
[0268]
[0269]
[0270]
[0271][0272]
[0273][0274]
[0275]
[0276]
[0277]
[0278]
[0279]
[0280]
[0281]
[0282]
[0283]
[0284]
[0285][0286]
[0287][0288][0289]
ii.其他组合物
[0290]
在其他方面,本公开涉及载体的组合物。在一些实施方式中,载体包含上文描述的连续多核酸分子。
[0291]
在其他方面,本公开涉及工程化病毒基因组的组合物。在一些实施方式中,病毒基因组包含上文描述的连续多核酸分子。在一些实施方式中,病毒基因组是腺相关病毒(aav)
基因组、慢病毒基因组、腺病毒基因组、单纯疱疹病毒(hsv)基因组、牛痘病毒基因组、痘病毒基因组、新城疫疾病病毒(ndv)基因组、柯萨奇病毒基因组、rheo病毒基因组、麻疹病毒基因组、水泡性口炎病毒(vsv)基因组、细小病毒基因组、塞内卡谷病毒基因组、马拉巴病毒基因组或常见的感冒病毒基因组。
[0292]
在其他方面,本公开涉及病毒体的组合物。如本文所用,术语“病毒体”是指在宿主细胞之外的感染形式的病毒(例如,包含dna/rna基因组和衣壳蛋白)。在一些实施方式中,病毒体包含上文描述的工程化病毒基因组。在一些实施方式中,病毒体包含aav-dj衣壳蛋白。在一些实施方式中,病毒体包含aav-b1衣壳蛋白、aav8衣壳蛋白或aav6衣壳蛋白。
[0293]
在其他方面,本公开涉及组合物,其包含上文描述的连续多核酸分子、上文描述的载体、上文描述的工程化病毒基因组或上文描述的病毒体。在一些实施方式中,组合物是治疗性组合物,其进一步包含药学上可接受的赋形剂或缓冲剂。示例性的药物赋形剂和缓冲剂是本领域技术人员已知的。
[0294]
iii.刺激细胞特异性事件的方法
[0295]
在其他方面,本公开涉及在细胞群中刺激细胞特异性事件的方法。在一些实施方式中,刺激细胞特异性事件的方法包含将细胞群与上文描述的连续多核酸分子、上文描述的载体、上文描述的工程化病毒基因组或上文描述的病毒体接触,其中细胞特异性事件经由细胞群的细胞中表达的输出的水平引发。
[0296]
在一些实施方式中,细胞群包含至少一个靶细胞和至少一个非靶细胞。靶细胞和非靶细胞类型在至少一个内源性转录因子的水平和/或至少一个内源性启动子或它的片段和/或至少一个内源性mirna的表达强度上不同。在一些实施方式中,输出的表达水平在靶细胞和非靶细胞之间的差异为至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少20、至少30、至少40、至少50、至少60、至少70、至少80、至少90、至少100、至少500、至少1,000或至少10,000倍。
[0297]
在一些实施方式中,方法包括将细胞群与连续多核酸分子或包含所述连续多核酸分子的组合物接触,其中:a)细胞群包含至少一个靶细胞类型和两个或多个非靶细胞类型,其中靶细胞类型和非靶细胞类型在一个或多个内源性mirna(例如,至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少20个内源性mirna)的水平上不同,使得一个或多个内源性mirna的水平在两个或多个非靶细胞的每一个中相对于靶细胞的每一个至少两倍高(例如,至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少15倍、至少20倍、至少50倍、至少100倍、至少1000倍高);和b)连续多核酸分子包含:(i)第一盒,其编码rna,所述rna的表达可操作地连接至转活化剂响应元件,其中第一rna包含:输出的核酸序列;和与一个或多个内源性mirna相对应的一个或多个mirna靶位点;和(ii)第二盒,其编码第二rna,其中第二rna包含转活化剂的核酸序列;其中第二盒的转活化剂,当表达为蛋白质时,结合和转活化第一盒的转活化剂响应元件。
[0298]
在一些实施方式中,方法包括将细胞群与连续多核酸分子或包含所述连续多核酸分子的组合物接触,其中:a)细胞群包含至少一个靶细胞类型和两个或多个非靶细胞类型,其中靶细胞类型和非靶细胞类型在一个或多个内源性mirna(例如,至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、
至少20个内源性mirna)的水平上不同,使得一个或多个内源性mirna的水平在两个或多个非靶细胞的每一个中相对于靶细胞的每一个至少两倍高(例如,至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少15倍、至少20倍、至少50倍、至少100倍、至少1000倍高);和b)连续多核酸分子包含编码mrna的盒,所述mrna的表达可操作地连接至转活化剂响应元件,其中rna包含:输出的核酸序列;转活化剂的核酸序列;和与一个或多个内源性mirna相对应的一个或多个mirna靶位点;并且其中转活化剂,当表达为蛋白质时,结合和转活化盒的转活化剂响应元件。
[0299]
在一些实施方式中,靶细胞类型和非靶细胞类型在一个或多个内源性转录因子(例如,至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少20个内源性转录因子)的水平上不同,其中连续核酸分子进一步包含与内源性转录因子相对应的一个或多个转录因子响应元件。
[0300]
在一些实施方式中,宿主细胞与上文描述的连续多核酸分子或上文描述的载体的接触经由非病毒递送方法发生。实例包括但不限于,转染(例如,deae葡聚糖介导的转染、capo4介导的转染、脂质介导的摄取、pei介导的摄取和激光转染)、转化(例如,氯化钙、电穿孔和热激)、基因转移和粒子轰击。
[0301]
在一些实施方式中,细胞群是离体接触的(即,细胞群分离自有机体,并且细胞群是在有机体外接触的)。在一些实施方式中,细胞群是体内接触的。
[0302]
如本文所用,术语“内源性
”‑
在细胞的背景中-是指在细胞中以其天然状态被发现的因子(例如,蛋白或rna)。在一些实施方式中,内源性转录因子可结合和活化至少一个盒的调节组分的启动子元件(例如,转录因子响应元件)。在一些实施方式中,内源性mirna可与至少一个盒的调节组分或响应组分的mirna靶位点互补。
[0303]
在一些实施方式中,“转活化剂”和相应的“转活化剂响应元件”将被选择使得转活化剂将特异性地结合至
″
转活化剂响应元件
″
,但是尽可能少地结合至细胞中天然存在的响应元件。在一些实施方式中,转活化剂蛋白的dna结合结构域将不能有效地结合细胞中存在的天然调节序列并且因此将不触发过量的不良反应。
[0304]
在一些实施方式中,靶细胞和非靶细胞是不同的细胞类型。
[0305]
在一些实施方式中,靶细胞是癌细胞并且非靶细胞是非癌细胞。在一些实施方式中,靶细胞可以是癌性肝细胞癌细胞或胆管癌细胞并且非靶细胞可以是实质和非实质肝脏细胞,包括肝细胞、吞噬库普弗细胞、星形细胞、窦内皮细胞。
[0306]
在一些实施方式中,靶细胞是肝细胞并且非靶细胞是非肝细胞(例如,肌细胞)。在其他实施方式中,靶细胞和非靶细胞是同一细胞类型(例如,二者是肝细胞),但是尽管如此,在至少一个内源性转录因子和/或至少一个内源性mirna的水平上不同。例如,靶细胞可以是衰老肌肉细胞和非靶细胞可以是非衰老肌肉细胞。
[0307]
在一些实施方式中,靶细胞是肿瘤细胞并且细胞特异性事件是细胞死亡。在一些实施方式中,靶细胞是衰老细胞并且细胞特异性事件是细胞死亡。在一些实施方式中,细胞死亡通过活化受体配体、特异性抗原、刺激细胞因子或其任意组合的表达由免疫靶向来介导。在一些实施方式中,方法进一步包括将细胞群与由输出代谢成治疗性或有毒化合物的前药或非毒前体化合物接触。
[0308]
在一些实施方式中,靶细胞相对于同一类型的野生型细胞(例如,健康的和/或非
患病的)差异表达因子并且细胞特异性事件是调制因子的表达水平。
[0309]
在一些实施方式中,输出表达确保靶细胞群的存活,而非靶细胞由于缺乏输出表达和在细胞死亡诱导剂的存在下被消除。在其他实施方式中,输出确保非靶细胞群的存活,而靶细胞由于输出表达和在细胞死亡诱导剂的存在下被消除。
[0310]
在一些实施方式中,靶细胞包含感兴趣的特定表型使得输出表达限于该特定表型的细胞。
[0311]
在一些实施方式中,靶细胞是精选的细胞类型,并且通过在精选的细胞类型中天然不存在或无活性的基因的表达,细胞特异性事件是新功能的编码。
[0312]
在一些实施方式中,细胞群包含多细胞有机体。在一些实施方式中,多细胞有机体是动物。在一些实施方式中,动物是人。
[0313]
iv.诊断和/或治疗疾病或病况的方法
[0314]
在一些方面,本公开涉及在表现出疾病或病况的一个或多个标志或症状的受试者中诊断疾病或病况(例如,癌症)的方法。如本文所用,术语“诊断”是指鉴定或确定疾病或病况的性质和/或原因的过程。在一些实施方式中,方法包括向表现出与疾病或病况相关的一个或多个标志或症状的受试者施用上文描述的连续多核酸分子、上文描述的载体、上文描述的工程化病毒基因组或上文描述的病毒体,其中输出的水平指示疾病或病况的存在或不存在。
[0315]
在一些方面,本公开涉及治疗疾病或病况(例如,癌症)的方法。如本文所用,术语“治疗”是指预防与疾病或病况相关的一个或多个症状的恶化的行为和/或减轻与疾病或病况相关的一个或多个症状的行为。在一些实施方式中,方法包含向具有疾病或病况的受试者施用上文描述的连续多核酸分子、上文描述的载体、上文描述的工程化病毒基因组或上文描述的病毒体。
[0316]
在一些实施方式中,涉及治疗疾病或病况,施用方法包括静脉内递送上文描述的载体。在一些实施方式中,施用方法包括多于一次行为的静脉内递送上文描述的载体。在一些实施方式中,施用方法包括以一次或多次给药瘤内递送上文描述的载体。在一些实施方式中,施用方法包括以一次或多次给药经动脉递送上文描述的载体。在一些实施方式中,施用方法包括肌内递送、鼻内递送、视网膜递送或口服递送。
[0317]
在一些实施方式中,治疗疾病的方法进一步包括前药以一次或多次给药施用。在一些实施方式中,前药的递送是静脉内的、经动脉或腹膜内的。在一些实施方式中,前药是更昔洛韦。
[0318]
在一些实施方式中,治疗疾病的方法进一步包括施用另一治疗例如小分子、生物制剂、单克隆抗体、另一基因治疗产物或基于细胞的治疗性产物。
[0319]
在一些实施方式中,疾病或病况是癌症。可通过本文所述的方法治疗的示例性的癌症包括但不限于,肝细胞癌(hcc)、转移性结直肠癌(mcrc)、任何其他转移至肝的癌症、肺癌、乳腺癌、视网膜母细胞瘤和胶质母细胞瘤。
[0320]
可通过本文所述的方法治疗的示例性的癌症包括但不限于,肝细胞癌(hcc)、转移性结直肠癌(mcrc)、肺癌、乳腺癌、视网膜母细胞瘤、胶质母细胞瘤。
[0321]
在一些实施方式中,癌症是肝细胞癌(hcc))。实际上,用于hcc的治疗性选择是有限的(llovet和lencioni,2020),产生了探索突破的新模态的迫切需要。本文所述的方法显
著地推进了当前hcc治疗方法。
[0322]
实施例
[0323]
实施例1.翻译为基因治疗载体的多路诊断回路。
[0324]
设计实验以评估来自多个分离的组分(即,每个质粒一个基因,并且特征在于瞬时转染细胞系)的逻辑门放在一起是否可以被再工程化以适合治疗相关的载体,并作为在动物疾病模型中的治疗性候选物研究。先前显示,通过在这些传感器的活性之间实施and逻辑的多质粒系统,整合用于转录因子(tf)sox9/10和hnf1a/b的传感器,当瞬时转染至huh-7细胞时引发强响应(angelici等,2016)。sox9是与重度hcc相关的预后标志物(richtig等,2017)。有趣的是,sox9响应元件可能被sox4(另外的其过表达与恶性hcc表型相关的tf)结合(liao等,2008;uhlen等,2017)。hnf1a和hnf1b是已知的肝脏管家因子(harries等,2009);尽管它们也在胃肠道的其它器官中表达。
[0325]
设计实验以测量先前描述的多质粒系统是否能够适应于连续dna盒并最终包装在病毒载体中。为此,显示在多质粒设置(angelici等,2016)中实施逻辑“sox9/10and hnf1a/b”的回路组分(其包含sox9/10-驱动的基于pit的活化剂(pit::rela或pit::vp16)(fussenegger等,2000)以及由pit和hnf1a/b协同驱动的荧光输出蛋白)),以发散或会聚取向二者其一被克隆在腺相关病毒(aav)转移载体中的itr之间(图1a)。将得到的质粒瞬时转染至hek293细胞中,并且将tf输入sox10和hnf1a从tre-驱动的质粒中局部表达,以生成至该门的所有四个逻辑输入组合。有趣的是,尽管趋势在所有四种情况下都被保持,但是当存在两个输入时,不同的变体在它们的绝对开水平上显著不同(图1b)。同一构建体也被转染至huh-7和hela细胞中,其中sox9/10和hnf1a/b的内源性表达有望在前者中诱导回路,并且不在后者中激活它。在这种情况下,差异不那么明显,但是发散取向生成稍微更高的输出。
[0326]
and门策略是活化期望细胞类型中的输出的方式,并且这种活化的增强通过并入有意的“关”开关(相当于not门,其在治疗的背景中将包括另外的安全层)来设计。为此,microrna靶被并入在输出基因的3
′‑
utr以及在pit衍生的组分的3
′‑
utr中。具体输入包括mir-424、mir-126和mir-122的选择,是基于先前执行的概况分析进行的(dastor等,2018)。mir-424靶被初始地引入,并且四个所得构建体(图1d)被再次测试它们在hek细胞中对异位tf组合的响应(图1e)和在huh-7和hela细胞中的内源性输入的存在下(图1f)。在性能上观察到标记的和一致的差异。与发散构建体相比,会聚构建体未能在hek细胞中响应异位输入并在huh-7细胞中以大大降低的强度进行响应。该事实强调了从在不同质粒上携带的回路以及整合在与基因治疗递送载体相容的连续主链上的回路的转变的复杂性。接下来,两个发散盒经历更广泛的逻辑表征,包括tf和mir-424模拟输入。两种构建体如预期的那样响应,实施逻辑“sox10 and hnf1a and not(mir-424)”(图1g)。为了证实高mir-424表达也以内源性tf输入覆盖输出活化,mir-424模拟物被转染至huh-7细胞中并且被发现关闭输出表达至几乎背景水平(图1h)。接着,用mir-126靶取代mir-424靶。仅在huh-7细胞中关于新的构建体对外源性mir-126的响应测试新的构建体组,并且结果类似于mir-424且与预期一致(图1i)。为了总结该设计阶段,评估没有mirna靶、具有mir-424或mir-126靶的发散构建体的容量,以将hcc细胞系huh-7和hepg2与hela细胞区分(图1j)。
[0327]
下一步是将盒引入至病毒载体中,并在临床前翻译之前评估它们的逻辑性能。已知aav递送的基因组在人细胞中形成多联体(duan等,2003),并且这与编码aav基因组但不
hsv-tk与gcv治疗方案(治疗组)、单独的相同的载体而无gcv、补充有gcv方案的假注入、以及假pbs注入且无gcv组合。在处理的动物中的肿瘤进展的实时成像(图2c),以及以生物发光对肝脏中的总肿瘤负荷的尸体解剖分析(图2d-2e)清楚地证明了,具有全回路程序的基因治疗载体与hsv-tk输出和gcv治疗方案组合具有强抗肿瘤活性,这在任何对照组中不存在。pbs对照组中的动物之一中的低肿瘤负荷由初始差的肿瘤植入引起(图2f),并且总体上所有三个对照组表现相同,导致最终的肿瘤负荷与初始负荷成比例,意味着肿瘤生长由相同的动力学支配。在先导试验的治疗组中的动物是明显的离群值(outlier),其提供治疗在降低肿瘤负荷方面是有效的另一证据。
[0333]
实施例3.具有更高特异性和更宽范围的肿瘤靶向程序的工程化。
[0334]
通过先导实验的结果鼓励,寻求改进肿瘤靶向程序且并行地执行对体外和体内作用的回路机制的更彻底的评估。假设sox9/10和hnf1a/b输入的组合是限制肝脏和肝脏肿瘤的表达的良好起点,然而,在体内mir-122活性上的先前数据表明它的活性被限制在肝脏(dastor等,2018),并且因此必须依赖于回路的仅tf组分用于所有其他器官,如果使用具有广泛器官特异性的载体衣壳,其可能成为问题。此外,虽然mir-122是从一些hcc亚型中分离健康肝细胞的良好分类标志物,但它不是通用的hcc特征。因此,探索集中在mirna输入上,其可能实现肝脏与肝脏肿瘤的更宽分类以及保护另外的器官。该探索的起源点为1)先前获得的mirna概况分析数据集(dastor等,2018)和2)用于不同器官中的高度表达的microrna的广泛文献分析。huh-7细胞和健康肝细胞在早期实验中被概况分析,并且首先尝试鉴定在肝细胞中高度表达但在huh-7细胞中下调的mirna(图3a)。基于ngs概况分析数据集中的计数比选择的mirna集包括mir-122(作为参考)、mir-424、mir-126-5p、mir-22、mir-26b和let-7c。双向mirna报告物(dastor等,2018)被构建并包装到aav-dj载体中,以确保体外对原代肝细胞的高递送效率(图3b)。在huh-7、hepg2和原代分离的鼠肝细胞中测量mirna候选物的生物活性。在测试的mirna中,let-7c显示出最高的差异活性;而且,它在huh-7和hepg2细胞二者中被下调(图3c)。有趣的是,比较ngs计数与生物活性的回顾性分析(图3d)仅显示非常表面的相关性,突出候选物输入的功能测试的重要性。
[0335]
针对潜在的器官保护mirna的文献搜索和概况分析数据集的调查导致了一组mirna:mir-424(肾脏和其它器官)、mir-208a和mir-208(心脏)、mir-216a、mir-217和mir-375(胰腺)。将基于体外筛选活动发现的用于肝脏保护的候选物let-7c添加到该表中。对于这些mirna中的每一种,双向报告物被工程化并被包装在b1-假型aav载体(choudhury等,2016)(由于其广泛的生物分布被选择)中。制备对照载体,其具有推测的中性mirna靶(“tff5”)。(然而,当数据显示时,该靶在至少一些器官中响应于mirna输入)。将载体全身注入到健康小鼠中,并在注入后3周在各种器官中评估报告物表达。在肝脏、胰腺、心脏和肾脏中发现强生物分布,并且将分析集中在这些器官上。let-7c是来自所述集的在体内显示作为健康的肝脏特异性输入的潜力的唯一mirna。在体内的胰腺中,mir-217和mir-375二者显示如从文献数据预期的活性;然而,let-7c具有最强的响应。在心脏中,mir-208a和mir-208b显示与先前数据一致的活性,但再次let-7c具有最强的响应。最后,如预期的,mir-424在肾脏中是有活性的,然而,也在该器官中,let-7c给出最强的效果(图3ef)。
[0336]
总之,体外和体内数据的组合表明,出于该研究的目的,let-7c可用作“通用的”输入,其同时发挥用于多个器官的保护性mirna输入的作用,在肿瘤研究中使用的两种hcc细
胞系中被强烈地下调。因此,该回路的下一迭代(称为hcc.v2)实施了程序“sox9/10 and hnf1a/b and not(let-7c)”。
[0337]
实施例4.体外和体内的作用机制。
[0338]
使用aav-dj衣壳作为用于体外细胞转导的有效载体,并且aav-b1作为在体内具有广泛生物分布的衣壳,进行了aav包装的回路的广泛的机制研究。在研究早期,通过将携带回路的质粒dna转染到不表达任何输入的背景细胞系中,并且然后通过所有可能的输入组合的系统性异位表达(将结果与预期进行比较)来分析和验证逻辑程序。在病毒载体的情况下,该策略现在更长效,因为当回路本身经由aav转导递送时,几乎不可能共同递送单独的异位输入。实际上,更有趣的问题是载体如何响应内源性表达的输入,因为在治疗的背景中的细胞分类必须依赖于内源性输入并充分地响应于内源性输入。因此,机制的证明包括细胞类型中的全回路的输出是否与这些细胞中的单独的回路输入的活性以及回路的逻辑程序一致的问题。
[0339]
因此,针对每个回路输入(分别为用于sox9/10和hnf1a/b反馈-放大传感器的aav-dj.c.sox-fb.mcherry和aav-dj.c.hnf1-fb.mcherry);let-7c传感器(aav-dj.c.let-7c.mcherry);仅实施and门的部分回路(aav-dj.c.tf-and.mcherry);全回路(aav-dj.hcc.v2.mcherry);和作为参考的组成型报告物(aav-dj.c.cmv.mcherry),创建单独的基因传感器并将其包装到aav-dj中(图4a)。在10个细胞系和原代肝细胞中测定这些构建体的输出。结果(图4b-4c)显示了多输入回路的响应与各个输入的表达一致,其证实了在基于质粒的和病毒载体包装的系统之间保留的作用机制。需要用于sox9/10和hnf1a/b的两个单独传感器的强响应以触发tf-and门的高响应;并且需要tf-and门的强响应以及let-7c传感器的缺乏响应来实现完整程序的高输出。
[0340]
对于体内表征,将分别包装组成型对照aav-b1.c.cmv.mcherry、仅tf的and门aav-b1.c.tf-and.mcherry、let-7c报告物aav-b1.c.let-7c.mcherry和全回路aav-b1.hcc.v2.mcherry,并表达mcherry为输出的b1-假型载体全身注入到小鼠尾静脉中,并且在注入后3周在各种器官中评估mcherry表达。通过图像处理在新鲜器官切片中对表达进行定量。结果(图5a-5b)突出了在不同器官中多个输入的复杂协同作用及它们的不同作用。在肝脏中,与组成型对照相比,and-门导致阳性细胞数目的减少,但导致在表现出阳性表达的细胞上升高的表达。与对照相比,let-7c报告物显示了降低的表达,但是残留表达明显高于背景。完整回路导致表达实际上不能与背景区分。在胰腺中,and门-控制的表达和let-7c控制的表达导致输出表达的大量减少,然而在每种情况下,表达高于背景。如在肝脏中,完整的靶向程序没有产生任何在背景以上的可检测的表达。在心脏中,and门或let-7c它们自身并且当在完整回路中组合时提供背景水平表达。在肾脏中情况类似于胰腺,无论是and门还是let-7c调节都不能将表达降低至背景,而完整的程序可以。总之,数据集强烈地支持这样的假设:需要多输入逻辑回路以在体内实现从健康器官高度有效的去靶向;如由逻辑程序“sox9/10 and hnf1a/b and not(let-7c)”提取的,多个输入的协同效应在四种情况的三种中是明显的。然后设计实验以确定同一程序是否能够在体内高效地靶向肿瘤,并将具有mcherry输出的b1-型aav-b1.hcc.v2.mcherry回路注入载瘤nsg小鼠中。数据(图5c)显示,实际上,在体内肿瘤被特异性地且高效地靶向,而其它器官不表达输出,与图5a-5b中的数据一致。
[0341]
实施例5.体外和体内的抗肿瘤功效。
[0342]
由于回路程序在体内显示出优异的肿瘤特异性表达和从主要器官去靶向,使用hsv-tk酶结合作为基准抗肿瘤执行器的前药更昔洛韦来进行其抗肿瘤活性的详细评估。该回路称为hcc.v2-hsv-tk。沿着类似于先导实验(图2)但具有较大的动物组和扩展数量的实验组的路线进行测试。在huh-7、hepg2和hela细胞系中以及在体外培养的原代肝细胞中,制造包括组成型对照和完整回路的dj-假型载体,并且评估它们对更昔洛韦的剂量响应。如预期的,huh-7和hepg2细胞被组成型载体和回路aav-dj.hcc.v2-hsv-tk等同地靶向,而hela阴性对照细胞和原代肝细胞二者对组成型载体敏感,但未被全供应的回路消除(图6a)。另外,由于使用在这些细胞中未下调的let-7c传感器,在huh-7细胞中,aav-dj.hcc.v2-hsv-tk比aav-dj.hcc.v1-hsv-tk更有效。然而,由于mir-122的不完全关闭,在huh-7细胞中,aav-dj.hcc.v1-hsv-tk仍是有活性的(图6b)。
[0343]
接下来,将含有回路的dj-假型aav载体全身递送至hepg2-lc荷瘤小鼠(图7a)。没有更昔洛韦的实验组包括假注入(生理盐水);编码tf-and程序的载体aav-dj.c.tf-and-hsv-tk;以及编码全回路aav-dj.hcc.v2-hsv-tk的载体。具有更昔洛韦的组在尾静脉递送载体或假冒物(sham),然后是更昔洛韦注入方案方面反映了上述组;即:包括假注入 gcv;and-门回路 gcv;和完整的回路 gcv。使用体内生物发光跟踪动物(每组n=4)的肿瘤负荷,并使用评分表标准跟踪它们的健康状况。数据(图7b-7f)表明,用含有提供有hsv-tk输出和补充有gcv方案的全hcc.v2-hsv-tk程序的载体处理的小鼠显示出稳健且可重现的遏制并且然后消退它们的肿瘤负荷,而没有gcv的对照组或仅注入gcv的组显示随着时间的推移指数肿瘤负荷增加。与aav-dj.hcc.v2-hsv-tk相比,编码具有hsv-tk输出的and门的载体aav-dj-c.tf-and-hsv-tk表现出相似的抗肿瘤效果,然而也引发了强烈的不良反应,并且因此该组中的动物不得不在计划完成之前被安乐死。另一方面,用完整的aav-dj.hcc.v2-hsv-tk回路处理的组显示出延长的肿瘤负荷减少,而没有明显的不良反应。这些结果明确地说明了体内靶向特异性(图5a-5d)与体内不良反应程度之间的紧密联系。因此,在未来,从荧光输出表达来测量的肿瘤外输出表达的存在将构成预筛选阶段,无需评估它们功能输出的毒性。
[0344]
实施例6.aav-b1和aav-dj假型回路驱动的hcc靶向的体内比较。
[0345]
鉴于针对b1型aav衣壳观察到的广泛的取向和强体内转导以及在hcc.v2程序的控制下放置基因表达完成的广泛的多器官去靶向,有理由认为得到的b1型aav-b1.hcc.v2回路可在不损害选择性的情况下产生高肿瘤转导。为了研究这种可能性,当使用b1衣壳代替先前功效研究中使用的dj衣壳递送aav-b1.hcc.v2-mcherry全回路输出时,比较回路输出(mcherry)。数据(图8a)显示,当以相同剂量施用时,b1型回路极大地胜过所有dj变体(aav-dj.hcc.v2.mcherry、仅tf的and门aav-dj.c.tf-and.mcherry或aav-dj.c.cmv.mcherry)的肿瘤表达水平,同时保持其对邻近肝脏组织的选择性。瘤内输出表达约40倍高(图8b),并且甚至在大肿瘤结节的核心部分中导致强荧光。与肿瘤渗入结合的强选择性表达提示回路靶向性,耦合到b1型衣壳作为hcc基因治疗的有前景的候选物。
[0346]
实施例7.mir-let-7c和mir-122的组合。
[0347]
体外功效数据显示,当hcc.v1即使以高剂量也完全保护肝细胞(图2b),同一程序相比于hcc.v2仅显示huh-7细胞杀伤效率的部分降低(图5b),并导致与高病毒剂量几乎相
当的性能。与huh-7细胞相比,该差异与肝细胞中观察到的更严格的基因抑制一致(图2a)。
[0348]
如本文所确立的,mir-122靶的数量和布置的变化可用于调制抑制强度,从而导致具有不同mir-122水平的细胞系中的不同表达水平(图1m)。假设通过靶数量、布置或经由使用不完美的互补靶mir-122抑制效率的降低可在肝去靶向部分减少的风险下,用于提高huh-7(甚至以较低的病毒剂量)中的回路效力。
[0349]
从这些数据,预期与来自具有较弱mir-122抑制的hcc.v2的mir-let7c靶(图9a)组合的hcc.v3回路同时胜过hcc.v3回路和hcc.v2回路。mir-122引起的抑制强度可通过改变t-122靶的数量和定位、通过引入不完美互补的靶或通过两种方法的组合来调节。不完美互补的靶可通过在mirna种子序列侧翼的序列中引入随机突变或通过使用源自由mirna调节的基因的保守3’utr的mir-122靶来获得(图9b)。可以选择最大化肝脏保护和针对hcc细胞(特别是huh-7)的功效的所需组合的候选物。
[0350]
预期hcc.v3将展现从主要器官的一般化mirna去靶向(let-7c),并受益于肝脏中的组合保护(let7c和mir-122),而没有显著降低其在hepg2和huh-7二者中的功效。作为对于大多数病毒载体具有最高生物分布的器官,实现最紧密的可能肝脏去靶向是特别期望的,并且可能导致治疗窗的进一步提高。
[0351]
实施例8.讨论。
[0352]
本公开显示了到逻辑基因回路方法的临床翻译的路径。需要三个根本的核心来支持这样的翻译,即:(1)组成疾病的分子的知识;(2)能够利用该知识的优势的平台的可用性;以及(3)该平台至临床相关治疗模态的可译性合在一起以递送在体外和体内功效和安全概况中具有前景的可行的治疗候选物。本文所述的广泛的机理表征突出了多输入细胞分类器的独特性质,与它的单独的组分相比,其被按照系统过程以合理的自下而上的方式构建。重要的是,本文中证明了,由报告物输出所测量的靶向特异性与体内的功效和不良反应二者紧密相关。
[0353]
诸如时机和剂量的治疗控制的特定表达和其它模态是不仅用于癌症而且用于其它指征的基因治疗的下一前沿。已经投入了大量努力来开发具有优先组织靶向的新型衣壳,以及用于特异性组织表达的启动子元件。值得注意的是,两个工作线都依赖于大文库的广泛筛选,并且它们不保证成功;而且,声称的特异性只能在大的相对样本组的存在下进行。对于人治疗,这些样本必须是人源的。由于人组织的大的多样性,叠加在衣壳和/或启动子筛选的大文库尺寸上,将使该努力过分复杂。本文所述的自下而上的方法使用合理的设计来从多个单独的输入创建组合特异性。通过概况分析使候选输入空间变窄,使得复杂程序的工程化能够在合理的、正向设计背景上解决异质细胞群(如在我们的huh-7和hepg2细胞实施例中)。该方法不排除使用靶向衣壳或特异性启动子:它们可以根据需要应用。然而,对于传播的疾病(例如癌症),广泛的趋向衣壳可能是优选的;然后将特异性表达的负担转移到在治疗的基因载荷中编码的分类的程序。在其它情况下,衣壳特异性和分类器程序可以协同使用以实现最佳期望的效果。
[0354]
在单个全身注入之后,在体内实现了肝脏中大的多病灶肿瘤的有效渗入(图5c-5d和图8a-8c),并且这提供了强的证据,即使单个注入也能向弥散的和血管化良好的肿瘤(例如hcc)递送载荷。然后,具有旁观者效应的输出能够有效地治疗这些肿瘤。
[0355]
实施例9.用于实施例1-8的材料和方法。
[0356]
细胞系:huh-7细胞购自日本健康科学基金会的健康科学研究资源库(health science research resources bank of the japan health sciences foundation)(cat-#jcrb0403),并且在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的低葡萄糖dmem,glutamax(life technologies,cat#21885-025)中,在37℃、5%co2下培养。hep g2细胞购自atcc(cat#hb-8065),并且在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的rpmi(gibco a10491-01)中,在37℃、5%co2下培养。hela细胞购自atcc(cat#ccl-2),并且在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的高葡萄糖dmem(life technologies,cat#41966)中,在37℃、5%co2下培养。hep3b细胞购自atcc(cat#hb-8064),并且在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的低葡萄糖dmem,glutamax(life technologies,cat#21885-025)中,在37℃、5%co2下培养。hct-116细胞购自deutsche sammlung von microorganismen和zellkulturen(dmz),dmz no acc-581,并且在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的dmem glutamax(life technologies,cat#31966-021)中,在37℃、5%co2下培养。sw-620细胞购自atcc(cat#ccl-227),并且在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的dmem glutamax(life technologies,cat#31966-021)中,在37℃、5%co2下培养。lovo细胞购自atcc(cat#ccl-229),并且在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的dmem glutamax(life technologies,cat#31966-021)中,在37℃、5%co2下培养。a549细胞购自atcc(cat#ccl-185),并且在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的dmem glutamax(life technologies,cat#31966-021)中,在37℃、5%co2下培养。sh4细胞购自atcc(cat#ccl-185),并且在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的dmem glutamax(life technologies,cat#31966-021)中,在37℃、5%co2下培养。igrov1细胞是nci-60组的一部分并通过nci(nih)获得。细胞在补充有10%fbs(sigma-aldrich,cat#f9665或life technologies,cat#10270106)和1%青霉素/链霉素溶液(sigma-aldrich,p4333)的rpmi(gibco a10491-01)中,在37℃、5%co2下培养。
[0357]
荧光素酶和mcitrine稳定细胞系(hepg2 lc)的创建:经由aavs基因座的talen编辑创建稳定表达mcitrine和萤光素酶的hepg2细胞系(hepg2 lc)。将4x105个hepg2细胞接种于6孔板中,并且24h后用总共2μg的dna和lipofectamine 2000转染。转染混合物由以下构成:在ef1a启动子(pik014)的控制下的500ng haavs1 1l talen(pik11)、500ng haavs1 1r talen(pik12)和1μg的荧光素酶2a citrine。将转化的细胞扩增并保持培养3周,以便稀释由瞬时转染引起的表达。3周后,使用bd facs aria iii对mcitrine
混合群(<1%)进行分选。将得到的20.000个细胞接种在24孔板中的补充有20%fbs的rpmi中持续第一周,以促
进初始回收。培养细胞并扩增2周,以选择具有稳定转基因表达的细胞,并避免倾向发生沉默的克隆。在96孔板中分选单个mcitrine
克隆,在补充有20%fbs的rpmi中培养和扩增。选择三种不同的高表达克隆,并将最好的用于连续试验。使用photonimagerrt(biospace laboratories)测量克隆的生物发光5分钟以确认萤光素酶表达。
[0358]
病毒载体质粒和病毒产生:如先前所述产生和纯化单链aav载体(paterna 2004,conway 1999)。简要地,用以1∶1∶1摩尔比的聚乙烯亚胺(pei)介导的aav载体质粒(提供待包装的aav载体基因组)、aav辅助质粒(提供感兴趣的aav血清型2rep蛋白和aav血清型的cap蛋白)和腺病毒(av)辅助质粒pbs-e2a-va-e4(glatzel 2000)共转染表达猿病毒大t抗原(293t)的人胚肾细胞(hek293t)。在转染后96至120h收集hek293t细胞并通过低速离心(在1500g/4℃,15min)从它们的上清中分离hek293t细胞。通过添加peg 8000溶液(最终:8%v/v)和nacl(最终:0.5m),将释放到上清中的aav载体在4℃条件下进行peg-沉淀过夜。通过低速离心(在3488g/4℃,60min)完成peg沉淀。丢弃清的上清液,并将造粒的aav载体重悬于aav重悬缓冲液(150mm nacl,50mm tris-hcl,ph 8.5)中。将hek293t细胞重悬于aav重悬缓冲液中,并通过bertin’s minilys homogenizer结合7ml软组织均质ck14管进行裂解(在5000rpm/rt下两个1min循环,在-20℃通过>4min冷却来中断)。将粗细胞裂解物用bitnuclease内切酶(75u/ml,在37℃,30至90min)处理并通过离心(在17000g/4℃,10min)清除。将peg-造粒的aav载体与清除的裂解物结合并经受不连续的密度碘克沙醇(optiprep,axis-shield)梯度(等密度)超速离心(在365929g/15℃,2h 15min)。随后,根据制造商的说明书,使用vivaspin 20超滤装置(100 000 mwco,pes膜,sartorius)和补充有1mm mgcl2和2.5mm kcl的1
×
磷酸盐缓冲盐水(pbs),通过三轮渗滤(超滤)从包含馏分的aav载体中去除碘克沙醇。在-80℃等分储存aav载体。使用qubit 3.0荧光计结合qubit dsdna hs assay kit(二者来自life technologies)对包封的病毒载体基因组(vg)进行定量。简言之,5μl未稀释的(或1∶10稀释的)aav载体一式两份制备。根据制造商的说明书,将一份样本热变性(在95℃,5min),并对未处理的和热变性的样本进行定量。通过从总的内-和外病毒(衣壳化的和非衣壳化的;热变性的样本)中减去外病毒(非衣壳化的;未处理的样本)来计算内病毒(衣壳化的)vg/ml。
[0359]
体内注入用细胞制剂:将hepg2 lc细胞培养并传代直到在t-75或t-150瓶中70-80%汇合。对于体内注入,我们使用具有低传代数(传代12或更少)的细胞以最小化报告物基因的沉默。通过去除生长培养基,用pbs(10ml用于t-75或20ml用于t-150)洗涤,并且在37℃用trypsin(gibco,25200056)(2ml用于t-75或6ml用于t-150瓶)解离细胞5min,使细胞脱离。将细胞悬液用8ml(t-75)或24ml(t-150)的pbs稀释,通过移液轻轻重悬,并且随后在50ml falcon管中使用100μm过滤器过滤,以得到单细胞悬液。使用另外的pbs洗涤过滤器,10ml(t-75)或20ml用于t-150,进一步将细胞稀释至20ml(t-75)或50ml(t-150)的总体积。将细胞悬液在4℃以498rpm离心9min。用20ml pbs洗涤细胞小球,并在4℃以498rpm离心6min再两次以去除任何痕量的胰蛋白酶(trypsin)。根据试验所需的细胞数量,用一个或多个瓶和管进行该程序。将每小球重悬于少量pbs(250-300ul用于每小球)中,并稀释小的等分试样(1∶50和1∶100),用于使用neubauer室和台盼蓝对活细胞进行手动计数。每细胞悬液取至少四个独立的计数,并使用平均值来确定待注入的细胞数。在显微镜下目视检查细胞悬液以验证不存在大团块。在结束时,用pbs将体积调节至约2
×
107细胞/ml。在手术的持续
时间内将细胞悬液保持在冰上,鉴于高细胞浓度,在每次注入前细胞需要重悬。为了最小化操作和提高活力,将细胞分成多个存储物(2-3管)。我们注意到细胞团块的存在和残留的胰蛋白酶或其它细胞解离试剂的存在对动物是有毒的并潜在地威胁动物的生命。
[0360]
异种移植小鼠肝脏小鼠模型:根据瑞士联邦法律和瑞士苏黎世联邦理工大学(technische hochschule(eth)zurich)的机构指南来执行所有动物过程,并且由州basel-stadt的动物伦理委员会批准。将8至10周龄的免疫缺陷nsg小鼠(德国苏尔茨费尔德查尔斯河的nod.cg-prkdcscid il2rgtm1wj1/szj)饲养在特定无病原体的设施中。为了产生源自人肿瘤细胞的小鼠肝脏肿瘤,用吸入式异氟烷麻醉nsg小鼠。使用无菌手术技术,进行1-1.5cm的左肋下切口并且暴露脾。使用27号针将105个hepg2细胞的50μl pbs注入到脾的下叶中。一旦去除针头,立即结扎脾的下极点。在结扎主脾脉管系统和移除脾之前,允许用于大多数细胞到达肝脏以定殖的10分钟引流。然后用缝线闭合腹部切口。小鼠中的肿瘤生长通过生物发光成像每星期2-3次监测(photonimager rt,biospace lab)。
[0361]
通过荧光显微术和流式细胞术的体内递送报告物aav和基因表达分析:为了使体内回路输出表达可视化,在肿瘤细胞移植后2周,将编码mcherry输出的2x10
12
vg(病毒基因组)的aav或pbs以单剂量通过尾静脉施用。3周后,将小鼠安乐死并立即用50-70ml的含10或25u/ml肝素(sigma-aldrich)的hbss灌注以去除自动荧光红细胞。收获器官和组织(肝脏、肺、脑、胰脏、骨骼肌、心脏和肾脏),并制备新鲜的组织切片并将其保持在冰上的pbs中。通过荧光显微术立即分析mcherry的表达。
[0362]
体内递送治疗性aav和前药治疗:在肿瘤细胞接种后两周,首先基于生物发光强度(高与低)反映的肿瘤负荷对荷瘤小鼠进行分层,并且然后将其随机分为各种处理组,以确保组之间的肿瘤负荷的可比性。将4x10
12
vg(病毒基因组)的aav-回路构建体或pbs经由相隔一周的两次分开的注入进行静脉内施用。在第一aav注入后第3天开始前药gcv(50mg/kg,invivogen)或盐水处理,每天一次腹膜内注入小鼠持续2周。每周用生物发光成像评估肿瘤生长2-3次。如果到了终点,则用评分表监测小鼠并安乐死。在前药处理14天后终止所有小鼠。收获肝脏用于肿瘤负荷的离体生物发光成像分析。在肿瘤细胞接种后两周,首先基于生物发光强度(高与低)反映的肿瘤负荷对荷瘤小鼠进行分层,并且然后将其随机分为各种处理组,以确保组之间的肿瘤负荷的可比性。将4x10
12
vg(病毒基因组)的aav-回路构建体或pbs经由相隔一周的两次分开的注入进行静脉内施用。在第一aav注入后第3天开始前药gcv(50mg/kg,invivogen)或盐水处理,每天一次腹膜内注入小鼠持续2周。每周用生物发光成像评估肿瘤生长2-3次。如果达到了终点,则用评分表监测小鼠并安乐死。在前药处理14天后终止所有小鼠。收获肝脏用于肿瘤负荷的离体生物发光成像分析。
[0363]
参考文献
[0364]
1.al-zaidy,s.,pickard,a.s.,kotha,k.,alfano,l.n.,lowes,l.,paul,g.,church,k.,lehman,k.,sproule,d.m.,dabbous,o.,et al.(2019).health outcomes in spinal muscular atrophy type 1 following avxs-101 gene replacement therapy.pediatric pulmonology 54,179-185.
[0365]
2.angelici,b.,mailand,e.,haefliger,b.,and benenson,y.(2016).synthetic biology platform for sensing and integrating endogenous transcriptional inputs in mammalian cells.cell reports 16,2525-2537.
systems for mammalian cells.nat biotechnol 18,1203-1208.
[0378]
15.grimm,d.,lee,j.s.,wang,l.,desai,t.,akache,b.,storm,t.a.,and kay,m.a.(2008).in vitro and in vivo gene therapy vector evolution via multispecies interbreeding and retargeting of adeno-associated viruses.j virol 82,5887-5911.
[0379]
16.harries,l.w.,brown,j.e.,and gloyn,a.l.(2009).species-specific differences in the expression of the hnf1a,hnf1b and hnf4a genes.plos one 4.
[0380]
17.huang,h.y.,liu,y.q.,liao,w.x.,cao,y.b.,liu,q.,guo,y.k.,lu,y.y.,and xie,z.(2019).oncolytic adenovirus programmed by synthetic gene circuit for cancer immunotherapy.nature communications 10.
[0381]
18.june,c.h.,o
′
connor,r.s.,kawalekar,o.u.,ghassemi,s.,and milone,m.c.(2018).car t cell immunotherapy for human cancer.science 359,1361-1365.
[0382]
19.juttner,j.,szabo,a.,gross-scherf,b.,morikawa,r.k.,rompani,s.b.,hantz,p.,szikra,t.,esposti,f.,cowan,c.s.,bharioke,a.,et al.(2019).targeting neuronal and glial cell types with synthetic promoter aavs in mice,non-human primates and humans.nature neuroscienee 22,1345- .
[0383]
20.keeler,a.m.,and flotte,t.r.(2019).recombinant adeno-associated virus gene thcrapy in light of luxturna(and zolgensma and glybera):where are we,and how did we get here?in annual review of virology,vol 6,2019,l.enquist,d.dimaio,and t.demody,eds.,pp.601-621.
[0384]
21.kloss,c.c.,condomines,m.,cartellieri,m.,bachmann,m.,and sadelain,m.(2013).combinatorial antigen recognition with balanced signaling promotes selective tumor eradication by engineered t cells.nat biotechnol 31,71- .
[0385]
22.kota,j.,chivukula,r.r.,o
′
donnell,k.a.,wentzel,e.a.,montgomery,c.l.,hwang,h.w.,chang,t.c.,vivekanandan,p.,torbenson,m.,clark,k.r.,et al.(2009).therapeutic microrna delivery suppresses tumorigenesis in a murine liver cancer model.cell 137,1005-1017.
[0386]
23.landegger,l.d.,pan,b.f.,askew,c.,wassmer,s.j.,gluck,s.d.,galvin,a.,taylor,r.,forge,a.,stankovic,k.m.,holt,j.r.,et al.(2017).a synthetic aav vector enables safe and efficient gene transfer to the mammalian inncr ear.nat biotechnol 35,280- .
[0387]
24.liao,y.l.,sun,y.m.,chau,g.y.,chau,y.p.,lai,t.c.,wang,j.l.,horng,j.t.,hsiao,m.,and tsou,a.p.(2008).identification of sox4 target genes using phylogenetic footprinting-based prediction from expression microarrays suggests that overexpression of sox4 potentiates metastasis in hepatocellular careinoma.oncogene 27,5578-5589.
[0388]
25.llovet,j.m.,and lencioni,r.(2020).mrecist for hcc:performance and hovel refinements.journal of hepatology 72,288-306.
[0389]
26.nelson,c.e.,hakim,c.h.,ousterout,d.g.,thakore,p.i.,moreb,e.a.,
rivera,r.m.c.,madhavan,s.,pan,x.f.,ran,f.a.,yan,w.x.,et al.(2016).in vivo genome editing improves musele function in a mouse model of duchenne muscular dystrophy.science 351,403-407.
[0390]
27.nissim,l.,wu,m.r.,pery,e.,binder-nissim,a.,suzuki,h.i.,stupp,d.,wehrspaun,c.,tabach,y.,sharp,p.a.,and lu,t.k.(2017).synthetic rna-based immunomodulatory gene circuits for cancerimmunotherapy.cell 171,1138- .
[0391]
28.richtig,g.,aigelsreiter,a.,schwarzenbacher,d.,ress,a.l.,adiprasito,j.b.,stiegelbauer,v.,hoefler,g.,schauer,s.,kiesslich,t.,kornprat,p.,et al.(2017).sox9 is a proliferation and stem cell factor in hepatocellular careinoma and possess widespread prognostic significance in different cancer types.plos one 12.
[0392]
29.roybal,k.t.,williams,j.z.,morsut,l.,rupp,l.j.,kolinko,i.,choe,j.h.,walker,w.j.,mcnally,k.a.,and lim,w.a.(2016).engineering t cells with customized therapeutic response programs using synthetic notch receptors.cell 167,419- .
[0393]
30.scholl,h.p.n.,strauss,r.w.,singh,m.s.,dalkara,d.,roska,b.,picaud,s.,and sahel,j.a.(2016).emerging therapies for inherited retinal degeneration.scienee translational medicine 8,10.
[0394]
31.tastanova,a.,folcher,m.,muller,m.,camenisch,g.,ponti,a.,horn,t.,tikhomirova,m.s.,and fussenegger,m.(2018).synthetic biology-based cellular biomedical tattoo for detection of hypercalcemia associated with.science trahslational medicine 10.
[0395]
32.uhlen,m.,zhang,c.,lee,s.,sjostedt,e.,fagerberg,l.,bidkhori,g.,benfeitas,r.,arif,m.,liu,z.t.,edfors,f.,et al.(2017).a pathology atlas of the human caneer transcriptome.science 357,660- .
[0396]
33.weber,w.,and fussenegger,m.(2012).emerging biomedical applications of synthetic biology.nature reviews genetics 13,21-35.
[0397]
34.xie,z.,wroblewska,l.,prochazka,l.,weiss,r.,and benenson,y.(2011).multi-input rnai-based logic circuit for identification of specific cancer cells.science 333,1307-1311.
[0398]
35.ye,h.f.,xie,m.q.,xue,s.,charpin-el hamri,g.,yin,j.l.,zulewski,h.,and fussenegger,m.(2017).self-adjusting synthetic gene circuit for correcting insulin resistance.nature biomedical engineering 1.
[0399]
36.zah,e.,lin,m.y.,silva-benedict,a.,jensen,m.c.,and chen,y.y.(2016).t cells expressing cd19/cd20 bispecific chimeric antigen receptors prevent antigen escape by malignant b cells.cancer immunology research 4,498-508.
[0400]
37.paterna,j.c.,feldon,j.,and bueler,h.(2004).transduction profiles of recombinant adeno-associated virus vectors derived from serotypes 2 and 5 in the nigrostriatal system of rats.j virol 78,6808-6817.
[0401]
38.conway,j.e.,rhys,c.m.,zolotukhin,i.,zolotukhin,s.,muzyczka,n.,hayward,g.s.,and byrne,b.j.(1999).high-titer recombinant adeno-associated virus production utilizing a recombinant herpes simplex virus type i vector expressing aav-2 rep and cap.gene ther 6,986-993.
[0402]
39.glatzel,m.,flechsig,e.,navarro,b.,klein,m.a.,paterna,j.c.,bueler,h.,and aguzzi,a.(2000).adenoviral and adeno-associated viral transfer of genes to the peripheral nervous system.proc natl acad sci u s a 97,442-447.
[0403]
其他实施方式
[0404]
本说明书中公开的所有特征可以以任意组合进行组合。本说明书中公开的每个特征可以用服务于相同、等同或类似目的的替代特征来取代。因此,除非另有明确说明,否则所公开的每个特征仅是等同或类似特征的通用系列的实例。
[0405]
从以上描述中,本领域技术人员可以容易地确定本公开的基本特征,并且在不脱离本公开的精神和范围的情况下,可以对本公开进行各种改变和改进以使其适应各种用途和条件。因此,其它实施方式也在权利要求内。
[0406]
等同物
[0407]
虽然本文中已经描述和示出了若干发明的实施方式,但是本领域普通技术人员将容易想到用于执行本文所述的功能和/或获得本文所述的结果和/或一个或多个优点的各种其他手段和/或结构,并且这些变型和/或改进中的每一个被认为在本文所述的发明实施方式的范围内。更一般地,本领域技术人员将容易地理解,本文所述的所有参数、尺寸、材料和配置目的是示例性的,并且实际的参数、尺寸、材料和/或配置将取决于发明教导所使用的具体的一个应用或多个应用。本领域技术人员将认识到,或能够使用不多于常规试验来确定本文所述的具体的发明实施方式的许多等同物。因此,应当理解的是,前述实施方式仅以实例的方式呈现,并且在所附权利要求及其等同物的范围内,发明实施方式可以以不同于具体描述和要求保护的方式实践。本公开的发明实施方式涉及本文所述的每个单独的特征、系统、制品、材料、试剂盒和/或方法。此外,如果这些特征、系统、制品、材料、试剂盒和/或方法不相互矛盾,则两个或多个这样的特征、系统、制品、材料、试剂盒和/或方法的任何组合都包括在本公开的发明范围内。
[0408]
本文定义和使用的所有定义应当被理解为相对于字典定义、以引用方式并入的文献中的定义和/或所定义的术语的普通含义起控制作用。
[0409]
本文所公开的所有参考文献、专利和专利申请通过引用关于引用每个参考文献、专利和专利申请的主题并入,其在一些情况下可涵盖整个文本。
[0410]
除非明确相反地指出,否则本文在说明书和权利要求书中所使用的不定冠词“一种(a/an)”和“一个(a/an)”应理解为意指“至少一种/个”。
[0411]
本文在说明书和权利要求书中使用的短语
″
和/或
″
应被理解为意指这样结合的元件的“二者其一或二者”,即在一些情况下结合地存在并且在其它情况下分离地存在的元件。以“和/或”所列出的多个元件应当以相同的方式解释,即,如此结合的元件的“一个或多个”。除了通过“和/或”具体确定的元件之外,其它元件可任选地存在,无论与具体鉴定的那些元件相关或不相关。因此,作为非限制性实例,当结合开放式语言例如“包含”使用时,提到“a和/或b”可在一个实施方式中,指仅a(任选地包含除b之外的元件);在另一实施方式
中,指仅b(任选地包含除a之外的元件);在又一实施方式中,指a和b二者(任选地包含其它元件);等。
[0412]
如本文在说明书和权利要求书中所使用的,“或”应被理解为具有与上文定义的“和/或”相同的含义。例如,当分开列表中的项目时,“或”或“和/或”将被解释为包括性的,即包括一些元件或元件列表以及任选地另外未列出的项目的至少一个,但也包括多于一个。仅被清楚地相反指示的术语例如
“……
的仅一个”或
“……
的确切一个”或当在权利要求中使用时的“由
……
组成”,将指包含一些元件或元件列表的确切一个元件。通常,本文中所使用的术语“或”,当其前面是排他性的术语例如“二者其一”、“一个”,“仅一个”或“确切一个”时,仅应被解释为指示排他的替代方案(即,“一个或另一个但不是二者”)。当在权利要求中使用时,“基本上由
……
组成”应当具有其在专利法领域中使用的普通含义。
[0413]
如本文在说明书和权利要求书中所使用的,涉及一个或多个元件的列表的短语
″
至少一个
″
应被理解为意指选自元件列表中的任何一个或多个元件的至少一个元件,但不一定包含元件列表中具体列出的每一个元件中的至少一个,并且不排除元件列表中的元件的任何组合。该定义还允许除了短语“至少一个”所指的元件列表内具体确定的元件之外,元件可以任选地存在,无论与具体确定的那些元件相关或不相关。因此,作为非限制性实例,“a和b的至少一个”(或等效地,“a或b的至少一个”,或等效地,“a和/或b的至少一个”)可以在一个实施方式中,指代至少一个、任选地包含不止一个a,不存在b(并且任选地包含除b之外的元件);在另一实施方式中,指代至少一个、任选地包含多于一个b,不存在a(并且任选地包含除a之外的元件);在又一个实施方式中,指代至少一个、任选地包含多于一个a,并且至少一个、任选地包含多于一个b(并且任选地包含其他元件);等。
[0414]
还应当理解的是,除非明确相反地指出,在本文要求保护的包括多于一个步骤或动作的任何方法中,所述方法的步骤或方法的动作的顺序不一定限于所叙述的方法的步骤或动作的顺序。
[0415]
在上文的权利要求书以及说明书中,所有过渡短语如“包含”,“包括、“携带”、“具有”、“含有”、“涉及”、“持有”、“由
……
构成”等将被理解为开放式的,即,意指包括但不限于。只有“由
……
组成”和“基本由
……
组成”的过渡短语应分别为封闭或半封闭过渡短语,如美国专利局《专利审查程序手册》第2111.03节中所述。应当理解的是,在该文档中描述的实施方式使用开放式过渡短语(例如,“包含”)描述的实施方式在替代实施方式中也被考虑为“由开放式过渡短语所描述的特征组成”和“基本上由开放式过渡短语所描述的特征组成”。例如,如果本公开描述了“包含a和b的组合物”,则本公开还考虑了替代实施方式“由a和b组成的组合物”和“基本上由a和b组成的组合物”。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。