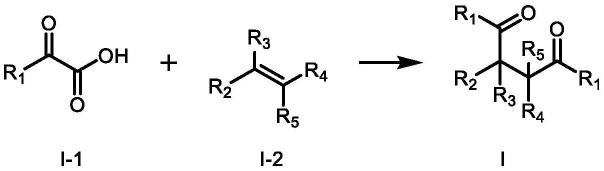
1.本发明涉及有机合成技术领域,更具体地,涉及一种光催化烯烃与α-酮酸直接1,2-双羰基化构筑1,4-二酮类化合物的方法。
背景技术:
2.1,4-双羰基化合物的分子中含有两个羰基,是构建药物分子和生物活性天然产物的重要骨架。直接合成1,4-双羰基化合物极具吸引力但又充满挑战。近年来,尽管发展的酰基自由基加成到α,β-不饱和酮衍生物的方法,可以向c=c双键引入一个酮羰基从而实现1,4-二酮类化合物的构筑(angew.chem.,int.ed.2011,50,1869-1872),但该方法只适用于预官能化的烯烃,例如丙烯酸酯(angew.chem.,int.ed.2015,54,14066-14069)。除此以外,fenton等人发展了以pdcl2为催化剂和fecl2为氧化剂,在高压co和o2气氛中实现了烯烃的1,2-双烷氧基羰基化的方法(j.org.chem.1972,37,2034-2035)。1,4-双羰基化合物也可以通过炔烃双羰基化来实现(j.am.chem.soc.2018,140,10282-10288等),然而该类反应仍然需要高温、高压剧毒的co和过渡金属参与。在没有co的情况下,段新华和其合作者开发了一种ag催化的α-酮酸脱羧交叉耦合反应,在k2s2o8氧化剂的帮助下实现了香豆素的1,2-双羰基化(tetrahedron 2015,71,630-636)。takaki和其合作者发展了一种n杂环卡宾催化的stetter式反应,用于α,β-不饱和酮的直接1,2-双羰基化(chem.commun.2014,50,12285-12288)。在过去的几十年里,零星的报道表明,通过一锅法实现烯烃直接的1,2-二羰基化构筑1,4-二酮类化合物是充满挑战的。已报道的方法需要外加氧化剂、高温、高压剧毒的co以及底物受限等苛刻的反应条件,因此需要新的方法,以便在温和的条件下实现烯烃的1,2-双羰基化构筑1,4-二酮。
3.光催化可以在温和的反应条件下实现高效的化学转化,已经引起了化学界广泛的关注。通过光催化单电子转移来实现多步骤串联的化学转化,需要高活性的光催化剂及其氧化还原中间体具备合适的氧化还原电位和足够的寿命来串联多步的反应过程。
4.然而,最近快速发展的有机光催化反应仍难以实现多组分烯烃的直接1,2-双羰基化。鉴于此,需要发展一种光催化直接实现烯烃1,2-双羰基化的方法。
技术实现要素:
5.为改善上述问题,本发明的目的在于提供一种光催化α-酮酸与烯烃直接的1,2-双羰基化反应合成1,4-二酮类化合物的方法。该方法在常温常压惰性气体(ar、n2等)或空气条件下,光催化剂、α-酮酸和烯烃的混合溶液在可见光的照射下发生1,2-双羰基化反应得到1,4-二酮类产物。
6.为达到上述目的,本发明提供一种制备1,4-二酮类化合物的制备方法,包括以下步骤:在光催化剂存在下,将α-酮酸和含有双键的化合物在光照下反应,得到1,4-二酮类化合物,其中,所述α-酮酸中与α-羰基相连的基团为芳香性的。
7.根据本发明的实施方案,本发明提供了一种制备式i化合物的制备方法,包括以下
步骤:在光催化剂存在下,化合物i-1和化合物i-2在光照下反应,得到式i所示的化合物;
[0008][0009]
其中,r1选自取代或未取代的芳基或杂芳基,所述取代的芳基或杂芳基例如为任选被一个、两个或更多个ra取代的芳基或杂芳基;
[0010]
每个ra相同或不同,彼此独立地选自h、卤素、硝基、-cn、叠氮基、重氮基、硼酸频哪醇酯基、烷基、环烃基、杂环基、芳基、杂芳基、酰基、羧基、酯基、醚基、硫醚基、酰胺基、磺酰基、亚磺酰基、磷氧基、硼烷基、硼酸酯基、-b(oh)2、氨基、-sh、烷氧基、卤代烷基、卤代烷氧基、烷基氨基、烷氧基羰基、烷基羰基氧基;
[0011]
r2、r3、r4、r5相同或不同,彼此独立地选自h、卤素、硝基、-cn、烷基、烯基、炔基、环烃基、杂环基、芳基、杂芳基、酰基、羧基、酯基、醚基、硫醚基、酰胺基、磺酰基、亚磺酰基、氨基、磷氧基、-sh,所述的烷基、烯基、炔基、环烃基、杂环基、芳基、杂芳基、酰基、酯基、醚基、硫醚基、酰胺基、磺酰基、亚磺酰基、磷氧基任选被一个、两个或更多个rb取代;且r2、r3、r4、r5中至少有一个不为h;或者r2和r5与所连接的碳一起形成任选被rb取代的环烯基,其中所述环烯基任选可以是苯并稠和的;
[0012]
每个rb相同或不同,彼此独立地选自h、卤素、硝基、-cn、叠氮基、重氮基、硼酸频哪醇酯基、烷基、环烃基、杂环基、芳基、杂芳基、酰基、羧基、酯基、醚基、硫醚基、酰胺基、磺酰基、亚磺酰基、磷氧基、硼烷基、硼酸酯基、-b(oh)2、氨基、-sh、烷氧基、卤代烷基、卤代烷氧基、烷基氨基、烷氧基羰基、烷基羰基氧基,所述rb中的烷基、烯基、炔基、环烃基、杂环基、芳基、杂芳基、酰基、酯基、醚基、硫醚基、酰胺基、磺酰基、亚磺酰基、磷氧基任选被一个、两个或更多个r
b1
取代。
[0013]
每个r
b1
相同或不同,彼此独立地选自h、卤素、硝基、-cn、叠氮基、重氮基、硼酸频哪醇酯基、烷基、环烃基、杂环基、芳基、杂芳基、酰基、羧基、酯基、醚基、硫醚基、酰胺基、磺酰基、亚磺酰基、磷氧基、硼烷基、硼酸酯基、-b(oh)2、氨基、-sh、烷氧基、卤代烷基、卤代烷氧基、烷基氨基、烷氧基羰基、烷基羰基氧基。
[0014]
在本发明的一个实施方案中,r2、r3、r4、r5相同或不同,彼此独立地选自h、卤素、硝基、-cn、烷基、烯基、炔基、环烃基、杂环基、芳基、杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)(rj)2、硼烷基、-b(ork)2、氨基;所述的烷基、烯基、炔基、环烃基、杂环基、芳基、杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)(rj)2、硼烷基、-b(ork)2、氨基任选被一个、两个或更多个rb取代;且r2、r3、r4、r5中至少有一个不为h;或者r2和r5与所连接的碳一起形成任选被rb取代的环烯基,其中所述环烯基任选可以是苯并稠和的。
[0015]
在本发明的一个实施方案中,每个ra相同或不同,彼此独立地选自h、卤素、硝基、-cn、叠氮基、重氮基、硼酸频哪醇酯基、烷基、环烃基、杂环基、芳基、杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)
(rj)2、硼烷基、-b(ork)2、氨基、-sh、烷氧基、卤代烷基、卤代烷氧基、烷基氨基、烷氧基羰基、烷基羰基氧基;
[0016]
在本发明的一个实施方案中,每个rb相同或不同,彼此独立地选自h、卤素、硝基、-cn、叠氮基、重氮基、硼酸频哪醇酯基、烷基、烯基、炔基、环烃基、杂环基、芳基、杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)(rj)2、硼烷基、-b(ork)2、氨基;所述的烷基、烯基、炔基、环烃基、杂环基、芳基、杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)(rj)2、硼烷基、-b(ork)2、氨基任选被一个、两个或更多个r
b1
取代;每个r
b1
相同或不同,彼此独立地选自h、卤素、羟基、烷基、烯基、炔基、烷氧基、卤代烷基、卤代烷氧基、烷基氨基、烷氧基羰基、烷基羰基氧基、环烃基、杂环基、芳基、杂芳基;
[0017]
rc、rd、re、rf、rg、ri、rj、rk相同或不同,彼此独立地选自h、卤素、硝基、-cn、叠氮基、重氮基、硼酸频哪醇酯基、烷基、烯基、炔基、环烃基、芳基、杂芳基、杂环基、苯并环烷基、芳基烷基、酰基、羧基、酯基、醚基、硫醚基、酰胺基、磺酰基、亚磺酰基、磷氧基、硼烷基、硼酸酯基、-b(oh)2、氨基、-sh、-oh;所述的烷基、烯基、炔基、环烃基、芳基、杂芳基、杂环基、苯并环烷基、芳基烷基、酰基、羧基、酯基、醚基、硫醚基、酰胺基、磺酰基、亚磺酰基、磷氧基、硼烷基、硼酸酯基、-b(oh)2、氨基、-sh、-oh任选被一个、两个或更多个rb取代。
[0018]
根据本发明的实施方案,r1选自无取代或任选被一个、两个或更多个ra取代的c
6-20
芳基、5-25元杂芳基;
[0019]
在本发明的一个实施方案中,r2、r3、r4、r5相同或不同,彼此独立地选自h、卤素、硝基、-cn、c
1-30
烷基、c
1-30
烯基、c
1-30
炔基、c
3-30
环烃基、5-25元杂环基、c
6-20
芳基、5-25元杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)(rj)2、硼烷基、-b(ork)2、氨基;所述的c
1-30
烷基、c
1-30
烯基、c
1-30
炔基、c
3-30
环烃基、5-25元杂环基、c
6-20
芳基、5-25元杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)(rj)2、硼烷基、-b(ork)2、氨基任选被一个、两个或更多个rb取代;且r2、r3、r4、r5中至少有一个不为h;或者r2和r5与所连接的碳一起形成任选被rb取代的c
3-30
环烯基,其中所述环烯基任选可以是苯并稠和的。
[0020]
在本发明的一个实施方案中,每个ra相同或不同,彼此独立地选自h、卤素、硝基、-cn、叠氮基、重氮基、硼酸频哪醇酯基、c
1-30
烷基、c
3-30
环烃基、5-25元杂环基、c
6-20
芳基、5-25元杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)(rj)2、硼烷基、-b(ork)2、氨基、c
1-30
烷氧基、卤代c
1-30
烷基、卤代c
1-30
烷氧基、c
1-30
烷基氨基、c
1-30
烷氧基羰基、c
1-30
烷基羰基氧基;
[0021]
在本发明的一个实施方案中,每个rb相同或不同,彼此独立地选自h、卤素、硝基、-cn、叠氮基、重氮基、硼酸频哪醇酯基、c
1-30
烷基、c
1-30
烯基、c
1-30
炔基、c
3-30
环烃基、5-25元杂环基、c
6-20
芳基、5-25元杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)(rj)2、硼烷基、-b(ork)2、氨基;所述的c
1-30
烷基、c
1-30
烯基、c
1-30
炔基、c
3-30
环烃基、5-25元杂环基、c
6-20
芳基、5-25元杂芳基、-c(o)orc、-oc(o)rd、-c(o)rd、-ore、-sre、-c(o)nhrf、-nhc(o)rf、-s(o)rg、-s(o)2rg、-p(o)(ori)2、-p(o)(rj)2、硼烷基、-b(ork)2、氨基任选被一个、两个或更多个r
b1
取代;每个r
b1
相同或不同,彼此独立地选自h、卤素、羟基、c
1-30
烷基、c
1-30
烯基、c
1-30
炔基、c
1-30
烷氧基、卤代c
1-30
烷基、卤代c1-30
烷氧基、c
1-30
烷基氨基、c
1-30
烷氧基羰基、c
1-30
烷基羰基氧基、c
3-30
环烃基、5-25元杂环基、c
6-20
芳基、5-25元杂芳基;
[0022]
rc、rd、re、rf、rg、ri、rj、rk相同或不同,彼此独立地选自h、卤素、硝基、-cn、-oh、叠氮基、重氮基、硼酸频哪醇酯基、c
1-30
烷基、c
1-30
烯基、c
1-30
炔基、c
3-30
环烃基、5-25元杂环基、c
6-20
芳基、5-25元杂芳基、苯并c
3-30
环烷基、c
6-20
芳基c
1-30
烷基;所述的c
1-30
烷基、c
1-30
烯基、c
1-30
炔基、c
3-30
环烃基、5-25元杂环基、c
6-20
芳基、5-25元杂芳基、苯并c
3-30
环烷基、c
6-20
芳基c
1-30
烷基例如为任选被一个、两个或更多个rb取代。
[0023]
根据本发明的实施方案,r1选自无取代或任选被一个、两个或更多个ra取代的c
6-14
芳基、5-14元杂芳基;
[0024]
根据本发明的实施方案,r2、r3、r4、r5相同或不同,彼此独立地选自h、卤素、硝基、、c
1-20
烷基、c
1-20
烯基、c
1-20
炔基、c
3-25
环烃基、5-20元杂环基、c
6-14
芳基、5-14元杂芳基、-c(o)orc、-oc(o)rd、-ore;所述c
1-20
烷基、c
1-20
烯基、c
1-20
炔基、c
3-25
环烃基、5-20元杂环基、c
6-14
芳基、5-14元杂芳基、-c(o)orc、-oc(o)rd、-ore任选被一个、两个或更多个rb取代;且r2、r3、r4、r5中至少有一个不为h;或者r2和r4与所连接的碳一起形成任选被rb取代的环烯基,其中所述环烯基任选可以是苯并稠和的。
[0025]
根据本发明的实施方案,每个ra相同或不同,彼此独立地选自h、卤素、c
1-20
烷基、c
1-20
烷氧基、3-20元环烷基;
[0026]
根据本发明的实施方案,每个rb相同或不同,彼此独立地选自h、卤素、cn、c
1-20
烷基、c
2-20
烯基、c
6-14
芳基、5-14元杂芳基、-c(o)orc、-oc(o)rd、-ore;所述c
1-20
烷基、c
2-20
烯基、c
6-14
芳基、5-14元杂芳基、-c(o)orc、-oc(o)rd、-ore任选被一个、两个或更多个r
b1
取代;每个r
b1
相同或不同,彼此独立地选自h、卤素、c
1-12
烷基、c
2-12
烯基、c
1-12
烷氧基、c
6-14
芳基;
[0027]
根据本发明的实施方案,rc、rd、re相同或不同,彼此独立地选自氢、c
1-20
烷基、c
2-20
烯基、3-20元环烷基、3-20元环烯基、c
6-14
芳基、5-25元杂芳基、5-25元杂环基、苯并3-20元环烷基、c
6-14
芳基-c
1-12
烷基;所述c
1-20
烷基、c
2-20
烯基、3-20元环烷基、3-20元环烯基、c
6-14
芳基、5-25元杂芳基、5-25元杂环基、苯并3-20元环烷基、c
6-14
芳基-c
1-12
烷基任选被一个、两个或更多个r
d1
取代;每个r
d1
相同或不同,彼此独立地选自c
1-16
烷基。
[0028]
根据本发明的实施方案,r1选自无取代或任选被一个、两个或更多个ra取代的c
6-10
芳基、5-10元杂芳基;
[0029]
r2、r3、r4、r5相同或不同,彼此独立地选自h、c
1-8
烷基、c
2-8
烯基、c
6-10
芳基、5-10元杂芳基、-c(o)orc、-oc(o)rd、-ore;所述c
1-8
烷基、c
2-8
烯基、c
6-10
芳基、5-10元杂芳基、-c(o)orc、-oc(o)rd、-ore任选被一个、两个或更多个rb取代;且r2、r3不同时为h;
[0030]
每个ra相同或不同,彼此独立地选自h、卤素、c
1-8
烷基、c
1-8
烷氧基、3-8元环烷基;
[0031]
每个rb相同或不同,彼此独立地选自h、卤素、cn、c
1-8
烷基、c
2-8
烯基、c
6-10
芳基、5-10元杂芳基、-c(o)orc、-oc(o)rd、-ore;所述c
1-8
烷基、c
2-8
烯基、c
6-10
芳基、5-10元杂芳基、-c(o)orc、-oc(o)rd、-ore任选被一个、两个或更多个r
b1
取代;每个r
b1
相同或不同,彼此独立地选自h、卤素、c
1-8
烷基、c
2-8
烯基、c
1-8
烷氧基、c
6-10
芳基;
[0032]
rc、rd、re相同或不同,彼此独立地选自氢、c
1-8
烷基、c
2-8
烯基、3-20元环烷基、3-20元环烯基、c
6-14
芳基、5-25元杂芳基、5-25元杂环基、苯并3-20元环烷基、c
6-10
芳基-c
1-8
烷基;所述c
1-8
烷基、c
2-8
烯基、3-20元环烷基、3-20元环烯基、c
6-14
芳基、5-25元杂芳基、5-25元杂
环基、苯并3-20元环烷基、c
6-10
芳基-c
1-8
烷基任选被一个、两个或更多个r
d1
取代;每个r
d1
相同或不同,彼此独立地选自c
1-16
烷基。
[0033]
在本发明的一个实施方案中,化合物i-2中,r2、r3、r4、r5中至少有一个基团为c
2-12
烯基、c
6-14
芳基、5-14元杂芳基、-c(o)orc。例如,所述c
2-12
烯基与所连接的烯基形成1,3-二烯基。
[0034]
在本发明的一个实施方案中,化合物i-2中,r4、r5为h,r2、r3如上述所定义。
[0035]
根据本发明的实施方案,r1选自无取代或任选被一个、两个或更多个ra取代的c
6-10
芳基;
[0036]
r2选自无取代或任选被一个、两个或更多个rb取代的c
2-8
烯基、c
6-10
芳基、5-10元杂芳基、-c(o)orc;
[0037]
r3选自h、无取代或任选被一个、两个或更多个rb取代的c
1-8
烷基、c
6-10
芳基;
[0038]
r4选自h、c
1-8
烷基;
[0039]
r5选自h、c
1-8
烷基;
[0040]
每个ra相同或不同,彼此独立地选自h、卤素、c
1-8
烷基、c
1-8
烷氧基;
[0041]
每个rb相同或不同,彼此独立地选自h、卤素、cn、c
1-8
烷基、c
6-10
芳基、-oc(o)rd、-ore;所述c
1-8
烷基、c
6-10
芳基、-oc(o)rd、-ore任选被一个、两个或更多个r
b1
取代;每个r
b1
相同或不同,彼此独立地选自h、卤素、c
1-8
烷基、c
6-10
芳基;
[0042]
rc、re相同或不同,彼此独立地选自氢、c
1-8
烷基、c
2-8
烯基、3-8元环烷基、c
6-10
芳基、c
6-10
芳基-c
1-8
烷基;
[0043]
rd选自氢、c
1-8
烷基、c
2-8
烯基、3-20元环烷基、3-20元环烯基、c
6-14
芳基、5-25元杂芳基、5-25元杂环基、苯并3-20元环烷基、c
6-10
芳基-c
1-8
烷基;所述c
1-8
烷基、c
2-8
烯基、3-20元环烷基、3-20元环烯基、c
6-14
芳基、5-25元杂芳基、5-25元杂环基、苯并3-20元环烷基、c
6-10
芳基-c
1-8
烷基任选被一个、两个或更多个r
d1
取代;每个r
d1
相同或不同,彼此独立地选自c
1-16
烷基。
[0044]
根据本发明的实施方案,所述制备方法可以在溶剂存在下进行,所述溶剂例如选自dme(1,2-二甲氧基乙烷)、1,4-二氧六环、丙酮、乙醚、etoh、meoh、thf、dmso、ch3cn、dmf、dma、甲苯、chcl3、dcm、dce、h2o中的至少一种。
[0045]
根据本发明的实施方案,所述的光催化剂为在激发态能够氧化α-酮酸且原位生成的烷基自由基能够被还原态的光催化剂还原并得到碳负离子,例如,光催化剂受光激发后其氧化电位为p
*
/p-》0.8v vs sce.;所述还原态的光催化剂的还原电位为p/p-《-0.8v vs sce.;
[0046]
根据本发明的实施方案,所述光催化剂选自有机光催化剂、金属光催化剂、量子点光催化剂。
[0047]
根据本发明的实施方案,量子点光催化剂受光激发后其价带电位大于0.8v vs sce.,导带电位小于-0.8v vs sce.;
[0048]
所述有机光催化剂可以为有机光氧化还原催化剂。所述有机光催化剂可以为选自被一个、两个或更多个腈基、卤素、咔唑基、二苯基氨基取代的芳基,且所述芳基至少被一个咔唑基或一个二苯基氨基取代;所述咔唑基、二苯基氨基可以被烷基、烷氧基、卤素取代;优选地,所述芳基至少被两个腈基和两个咔唑基取代,或者至少被两个腈基和两个二苯基氨
基取代;例如为二腈基苯衍生物,如咔唑取代的二腈基苯衍生物、二苯基氨基取代的二腈基苯衍生物。所述有机光催化剂还可以为荧光素及其衍生物、蒽及其衍生物、氧杂蒽酮及其衍生物、硫杂蒽酮及其衍生物。
[0049]
所述金属光催化剂可以为有机金属光催化剂,所述有机金属光催化剂为由金属中心和有机配体形成的配合物;所述有机金属光催化剂的金属中心可以为过渡金属元素,例如为钌或铱;所述有机金属光催化剂的配体可以为含氮杂芳基,例如为联吡啶基、联吡嗪基、联嘧啶基、菲罗啉基、苯基吡啶基,如2,2'-联吡啶基、2,2'-联吡嗪基、2,2'-联嘧啶基、1,10-菲罗啉基、2-苯基吡啶基。
[0050]
所述量子点光催化剂选自cdse量子点、cds量子点、cd/te量子点、cdse/cds核壳量子点、cdse/zns核壳量子点的一种或多种。
[0051]
根据本发明的实施方案,所述光催化剂包括但不限于4czipn、2czipn、4czpn、2czpn、4cztpn、2cztpn、3dpafipn、4dpafipn、dca、eosin y、fluorescein、rhodamine b、rhodamine 6g、xanthone、thioxanthone、(ir[df(cf3)ppy]2(dtbpy))pf6、ru(bpm)3cl2、ru(phen)3cl2、ru(bpz)3(pf)2、ru(bpy)cl2中的至少一种。
[0052][0053]
根据本发明的实施方案,所述制备方法可以在季铵盐存在下进行,所述季铵盐包括但不限于四丁基硝酸铵、四丁基乙酸铵、四丁基硫酸氢铵、四丁基氯化铵、四丁基溴化铵、四丁基四氟硼酸铵、四丁基六氟磷酸铵、四丁基碘化铵、四甲基氯化铵、十二烷基三甲基溴化铵、苄基三甲基氯化铵、西曲氯铵、十六烷基三甲基溴化铵、十六烷基三甲基氯化铵、n-苄基氯化辛可宁丁、n-苄基奎宁氯、n-苄基氯化喹啶嗡、n-苄基氯化辛可宁等的至少一种。所述季铵盐的阳离子可以稳定原位生成的碳负离子避免其被质子化,进而发生后续羰基化过程。
[0054]
根据本发明的实施方案,所述制备方法可以在碱作用下进行,所述碱为无机碱或有机碱,包括但不限于k2co3、na2co3、cs2co3、k3po4、k2hpo4、naoh、koh、dabco、吡啶类碱等中的至少一种。
[0055]
根据本发明的实施方案,所述反应可以在惰性气体下或空气中进行。
[0056]
根据本发明的实施方案,所述反应在可见光照射下进行。所述光照时间可以基于反应进程进行选择,例如光照时间为0.5-48h,或1-24h。优选地,所述光照时的光源选自led灯、太阳光、中压汞灯、高压汞灯或氙灯中的至少一种。
[0057]
根据本发明的实施方案,所述化合物i-2与化合物i-1的物质的量的比值是1:0.01~100,例如为1:0.02~50。
[0058]
根据本发明的实施方案,所述制备方法包括以下步骤:
[0059]
1)将光催化剂、化合物i-1、季铵盐和碱加入溶剂中,得溶液a;
[0060]
2)将化合物i-2加入溶液a中,得溶液b;
[0061]
3)用可见光照射溶液b,得到式i所示的化合物。
[0062]
根据本发明的实施方案,所述光催化剂在溶液b中的摩尔浓度在零到饱和摩尔浓度之间,且不包括零;所述光催化剂在溶液b中的摩尔浓度可以为1
×
10-3
m~5
×
10-5
m,例如为2
×
10-3
m~5
×
10-4
m,示例性为2
×
10-3
m、4
×
10-3
m、5
×
10-3
m;
[0063]
根据本发明的实施方案,所述化合物i-1在溶液b中的摩尔浓度在零到饱和摩尔浓度之间,且不包括零;所述化合物i-1在溶液b中的摩尔浓度可以为0.001m~10m,例如为0.02m~2m,示例性为0.05m、0.1m;
[0064]
根据本发明的实施方案,所述化合物i-2在溶液b中的摩尔浓度在零到饱和摩尔浓度之间,且不包括零;例如为0.001m~10m,例如为0.02m~2m,示例性为0.25m、0.125m;
[0065]
根据本发明的实施方案,所述季铵盐在溶液b中的摩尔浓度在零到饱和摩尔浓度之间,且包括零;例如为0.001m~2m,例如为0.005m~0.5m,示例性为0.01m、0.02m;
[0066]
根据本发明的实施方案,所述碱在溶液b中的摩尔浓度在零到饱和摩尔浓度之间,且包括零;例如为0.001m~2m,例如为0.01m~0.5m,示例性为0.01m、0.02m。
[0067]
优选地,所述光催化剂在溶液b中的摩尔浓度为5
×
10-3
m~5
×
10-5
m;优选地,所述化合物i-1在溶液b中的摩尔浓度为0.001m~10m;优选地,所述化合物i-2在溶液b中的摩尔浓度为0.001m~10m。
[0068]
优选地,当所述溶剂为dme时,化合物i-2与化合物i-1的物质的量的比值是1:0.01~100,例如为1:0.02~50。
[0069]
根据本发明的实施方案,所述化合物i-1具有式i-1a所示的结构式:
[0070][0071]
式i-1a中:
[0072]r11
、r
12
、r
13
独立的为h;或
[0073]r11
为-ch3,r
12
、r
13
独立的为h;或
[0074]r12
为-ch3,r
11
、r
13
独立的为h;或
[0075]r13
为-ch3,r
11
、r
12
独立的为h;或
[0076]r13
为-c(ch3)3,r
12
、r
13
独立的为h;或
[0077]r11
、r
13
独立的为-ch3,r
12
为h;或
[0078]r11
为f,r
12
、r
13
独立的为h;或
[0079]r13
为f,r
11
、r
12
独立的为h;或
[0080]r13
为cl,r
11
、r
12
独立的为h;或
[0081]r11
为-och3,r
12
、r
13
独立的为h;或
[0082]r13
为-och3,r
11
、r
12
独立的为h。
[0083]
或化合物i-1为含有萘环的化合物,结构式如下:
[0084][0085]
根据本发明的实施方案,所述化合物i-2具有式i-2a、i-2b或i-2c所示的结构式:
[0086][0087]
式i-2a中:
[0088]r21
、r
22
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0089]r21
为-ch3,r
22
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0090]r22
为-ch3,r
21
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0091]r23
为-ch3,r
21
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0092]r23
为-ch2cl,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0093]r23
为-cf3,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0094]r23
为-c(ch3)3,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0095]r22
、r
25
独立的为-ch3,r
21
、r
23
、r
24
、r
26
独立的为h;或
[0096]r23
为-ph(苯基),r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0097]r23
为-och3,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0098]r23
为-och2ch3,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0099]r23
为-oph(苯氧基),r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0100]r23
为-oc(o)ch3,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0101]r21
为f,r
22
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0102]r22
为f,r
21
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0103]r23
为f,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0104]r21
为cl,r
22
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0105]r22
为cl,r
21
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0106]r23
为cl,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0107]r21
为br,r
22
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0108]r22
为br,r
21
、r
23
、r
24
、r
25
、r
26
独立的为h;或
[0109]r23
为br,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0110]r23
为-c(o)och3,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0111]r23
为-cn,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0112]r26
为-ch3,r
21
、r
22
、r
23
、r
24
、r
25
独立的为h;或
[0113]r26
为ch2=ch-,r
21
、r
22
、r
23
、r
24
、r
25
独立的为h;或
[0114]r23
为-ch3,r
26
为ch2=ch-,r
21
、r
22
、r
24
、r
25
独立的为h;或
[0115]r23
为ch2=ch(ch2)2oc(o)-,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h;或
[0116]r23
为ch2=ch(ch2)3oc(o)-,r
21
、r
22
、r
24
、r
25
、r
26
独立的为h。
[0117]
或化合物i-2具有如下所示的结构:
[0118][0119]
式i-2b中:
[0120]r31
、r
32
、r
33
、r
34
独立的为h;或
[0121]r31
为-ch3,r
32
、r
33
、r
34
独立的为h;或
[0122]r32
为-ch3,r
31
、r
33
、r
34
独立的为h;或
[0123]r33
为ch3ch
2-,r
31
、r
32
、r
34
独立的为h;或
[0124]r33
为-cf3,r
31
、r
32
、r
34
独立的为h;或
[0125]r33
、r
34
独立的为f,r
31
、r
32
独立的为h;或
[0126]r33
为f,r
34
为-och3,r
31
、r
32
独立的为h;或
[0127]r33
为cl,r
31
、r
32
、r
34
独立的为h;或
[0128]r33
、r
34
独立的为cl,r
31
、r
32
独立的为h;或
[0129]r33
为-oph,r
31
、r
32
、r
34
独立的为h;
[0130]
式i-2c中:
[0131]r41
为-ch3,r
42
为h;或
[0132]r41
为ch3ch
2-,r
42
为h;或
[0133]r41
为ch3(ch2)2ch
2-,r
42
为h;或
[0134]r41
为ch3(ch2)4ch
2-,r
42
为h;或
[0135]r41
为(ch3)2ch-,r
42
为h;或
[0136]r41
为(ch3)3c-,r
42
为h;或
[0137]r41
为ch3ch2och2ch
2-,r
42
为h;或
[0138]r41
为环己基,r
42
为h;或
[0139]r41
为phch
2-,r
42
为h;或
[0140]r41
为ch3ch
2-,r
42
为-ch3;或
[0141]
根据本发明的实施方案,所述化合物i-2具有如下所示的结构:
[0142][0143]
本发明中含有双键的化合物进行1,2-双羰基化反应的过程是,在光照下光催化剂被光激发到达激发态,α-酮酸被激发态的光催化剂氧化得到酰基自由基和还原态的光催化剂。酰基自由基进攻双键一端得到的烷基自由基再被还原态的光催化剂还原,原位得到烷基碳负离子和基态的光催化剂。碳负离子随后亲核进攻另一个α-酮酸并脱除一分子的甲酸得到1,4-二酮类产物。在上述反应中,例如可以加入季铵盐,该季铵阳离子可以进一步稳定原位生成的碳负离子,避免其被质子化。
[0144]
有益效果
[0145]
1.本发明提供了一种光催化直接实现含双键的化合物进行1,2-双羰基化构筑,形成1,4-二酮类化合物的方法。该方法反应条件温和,在室温下用可见光或者太阳光照射即可实现,不需要高温高压和剧毒co等苛刻的反应条件,无外加氧化剂,所使用的催化剂为有机分子催化剂,并且底物适用性很广。整个反应过程简单,高效,反应条件温和,适合大规模生产。
[0146]
2.本发明中α-酮酸不仅作为酰基自由基的前体还作为酮羰基前体的亲电试剂,提供了一种通用的实现烯烃α位羰基化的方法。
附图说明
[0147]
图1为烯烃1,2-双羰基化反应研究现状以及本发明的示意图;
[0148]
图2为光催化化合物i-1与化合物i-2的反应方程式;
[0149]
图3为实施例1双羰基产物2-(4-氯苯)-1,4-二苯基丁烷-1,4-二酮的1h nmr图;
[0150]
图4为实施例1双羰基产物2-(4-氯苯)-1,4-二苯基丁烷-1,4-二酮的
13
c nmr图;
[0151]
图5为实施例17双羰基产物2-(4-氟代苯基)-1,4-二苯基丁烷-1,4-二酮的1hnmr图;
[0152]
图6为实施例17双羰基产物2-(4-氟代苯基)-1,4-二苯基丁烷-1,4-二酮的
13
cnmr图;
[0153]
图7为实施例17双羰基产物2-(4-氟代苯基)-1,4-二苯基丁烷-1,4-二酮的
19
fnmr图;
[0154]
图8为实施例22双羰基产物2-(4-溴代苯基)-1,4-二苯基丁烷-1,4-二酮的1hnmr图;
[0155]
图9为实施例22双羰基产物2-(4-溴代苯基)-1,4-二苯基丁烷-1,4-二酮的
13
cnmr图;
[0156]
图10为实施例25双羰基产物2-甲基-1,3,4-三苯基丁烷-1,4-二酮的1h nmr图;
[0157]
图11为实施例25双羰基产物2-甲基-1,3,4-三苯基丁烷-1,4-二酮的
13
c nmr图;
[0158]
图12为实施例32双羰基产物1,2,2,4-四苯基丁烷-1,4-二酮的1h nmr图;
[0159]
图13为实施例32双羰基产物1,2,2,4-四苯基丁烷-1,4-二酮的
13
c nmr图;
[0160]
图14为实施例42双羰基产物2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸甲酯的1hnmr图;
[0161]
图15为实施例42双羰基产物2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸甲酯的
13
cnmr图;
[0162]
图16为实施例61双羰基产物2-(4-氯苯基)-1,4-二对氟苯基丁烷-1,4-二酮的1h图;
[0163]
图17为实施例61双羰基产物2-(4-氯苯基)-1,4-二对氟苯基丁烷-1,4-二酮的
13
cnmr图;
[0164]
图18为实施例61双羰基产物2-(4-氯苯基)-1,4-二对氟苯基丁烷-1,4-二酮的
13
cnmr图;
[0165]
图19为实施例66双羰基产物胆甾烷醇衍生物的1h nmr图;
[0166]
图20为实施例66双羰基产物胆甾烷醇衍生物的
13
c nmr图;
[0167]
图21为实施例72双羰基产物海柯皂苷元衍生物的1h nmr图;
[0168]
图22为实施例72双羰基产物海柯皂苷元衍生物的
13
c nmr图。
[0169]
术语定义与说明
[0170]
除非另有说明,本技术说明书和权利要求书中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。这样的组合和结合后的基团定义及化合物结构,应当被理解为本技术说明书和/或权利要求书记载的范围内。
[0171]
除非另有说明,本说明书和权利要求书记载的数值范围相当于至少记载了其中每一个具体的整数数值。例如,数值范围“1-25”相当于记载了数值范围“1-10”中的每一个整数数值即1、2、3、4、5、6、7、8、9、10,以及数值范围“11-40”中的每一个整数数值即11、12、13、14、15、16、17、18、19、20、21、22、23、24、25。此外,当某些数值范围被定义为“数”时,应当理解为记载了该范围的两个端点、该范围内的每一个整数以及该范围内的每一个小数。例如,“0~10的数”应当理解为不仅记载了0、1、2、3、4、5、6、7、8、9和10的每一个整数,还至少记载
了其中每一个整数分别与0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9的和。
[0172]
应当理解,本文在描述一个、两个或更多个中,“更多个”应当是指大于2,例如大于等于3的整数,例如3、4、5、6、7、8、9或10。在一个或多个中,“多个”应指两个以上,即大于等于2,例如2、3、4、5、6、7、8、9或10。
[0173]
术语“卤素”表示氟、氯、溴和碘。
[0174]
术语“烷基”应理解为表示具有1~40个碳原子,例如1-20个碳原子的直链或支链饱和烃基。例如,“c
1-10
烷基”表示具有1、2、3、4、5、6、7、8、9或10个碳原子的直链和支链烷基,“c
1-6
烷基”表示具有1、2、3、4、5或6个碳原子的直链和支链烷基。所述烷基是例如甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、仲丁基、叔丁基、异戊基、2-甲基丁基、1-甲基丁基、1-乙基丙基、1,2-二甲基丙基、新戊基、1,1-二甲基丙基、4-甲基戊基、3-甲基戊基、2-甲基戊基、1-甲基戊基、2-乙基丁基、1-乙基丁基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基、2,3-二甲基丁基、1,3-二甲基丁基或1,2-二甲基丁基等或它们的异构体。
[0175]
术语“烯基”应理解为表示直连或支链的烃基,其包含一个或多个双键(例如1-5个双键)并且具有2~40个碳原子(例如2-20个碳原子),优选“c
2-10
烯基”。“c
2-10
烯基”应理解为优选表示直连或支链的一价烃基,其包含一个或多个双键并且具有2、3、4、5、6、7、8、9或10个碳原子,例如,具有2、3、4、5或6个碳原子(即,c
2-6
烯基),具有2或3个碳原子(即,c
2-3
烯基)。应理解,在所述烯基包含多于一个双键的情况下,所述双键可相互分离或者共轭。所述烯基是例如乙烯基、烯丙基、(e)-2-甲基乙烯基、(z)-2-甲基乙烯基、(e)-丁-2-烯基、(z)-丁-2-烯基、(e)-丁-1-烯基、(z)-丁-1-烯基、戊-4-烯基、(e)-戊-3-烯基、(z)-戊-3-烯基、(e)-戊-2-烯基、(z)-戊-2-烯基、(e)-戊-1-烯基、(z)-戊-1-烯基、己-5-烯基、(e)-己-4-烯基、(z)-己-4-烯基、(e)-己-3-烯基、(z)-己-3-烯基、(e)-己-2-烯基、(z)-己-2-烯基、(e)-己-1-烯基、(z)-己-1-烯基、异丙烯基、2-甲基丙-2-烯基、1-甲基丙-2-烯基、2-甲基丙-1-烯基、(e)-1-甲基丙-1-烯基、(z)-1-甲基丙-1-烯基、3-甲基丁-3-烯基、2-甲基丁-3-烯基、1-甲基丁-3-烯基、3-甲基丁-2-烯基、(e)-2-甲基丁-2-烯基、(z)-2-甲基丁-2-烯基、(e)-1-甲基丁-2-烯基、(z)-1-甲基丁-2-烯基、(e)-3-甲基丁-1-烯基、(z)-3-甲基丁-1-烯基、(e)-2-甲基丁-1-烯基、(z)-2-甲基丁-1-烯基、(e)-1-甲基丁-1-烯基、(z)-1-甲基丁-1-烯基、1,1-二甲基丙-2-烯基、1-乙基丙-1-烯基、1-丙基乙烯基、1-异丙基乙烯基。
[0176]
术语“炔基”应理解为表示直链或支链的烃基,其包含一个或多个三键并且具有2~40个碳原子,优选“c
2-10
炔基”、“c
2-6
炔基”。术语“c
2-6
炔基”应理解为表示直链或支链的烃基,其包含一个或多个三键并且具有2、3、4、5或6个碳原子。所述c
2-6
炔基是例如乙炔基、丙-1-炔基、丙-2-炔基、丁-1-炔基、丁-2-炔基、丁-3-炔基、戊-1-炔基、戊-2-炔基、戊-3-炔基、戊-4-炔基、己-1-炔基、己-2-炔基、己-3-炔基、己-4-炔基、己-5-炔基、1-甲基丙-2-炔基、2-甲基丁-3-炔基、1-甲基丁-3-炔基、1-甲基丁-2-炔基、3-甲基丁-1-炔基、1-乙基丙-2-炔基、3-甲基戊-4-炔基、2-甲基戊-4-炔基、1-甲基戊-4-炔基、2-甲基戊-3-炔基、1-甲基戊-3-炔基、4-甲基戊-2-炔基、1-甲基戊-2-炔基、4-甲基戊-1-炔基、3-甲基戊-1-炔基、2-乙基丁-3-炔基、1-乙基丁-3-炔基、1-乙基丁-2-炔基、1-丙基丙-2-炔基、1-异丙基丙-2-炔基、2,2-二甲基丁-3-炔基、1,1-二甲基丁-3-炔基、1,1-二甲基丁-2-炔基或3,3-二甲基丁-1-炔基。特别地,所述炔基是乙炔基、丙-1-炔基或丙-2-炔基。
[0177]
术语“环烷基”应理解为表示饱和的单环、二环(如稠环、桥环、螺环)烃环或多环烷
烃,其具有3~40个碳原子,优选3~20个碳原子,优选“c
3-10
环烷基”。术语“c
3-10
环烷基”应理解为表示饱和的一价单环、双环(如桥环、螺环)烃环或三环烷烃,其具有3、4、5、6、7、8、9或10个碳原子。所述c
3-10
环烷基可以是单环烃基,如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基或环癸基,或者是双环烃基如龙脑基、吲哚基、六氢吲哚基、四氢萘基、十氢萘基、二环[2.1.1]己基、二环[2.2.1]庚基、二环[2.2.1]庚烯基、6,6-二甲基二环[3.1.1]庚基、2,6,6-三甲基二环[3.1.1]庚基、二环[2.2.2]辛基、2,7-二氮杂螺[3,5]壬烷基、2,6-二氮杂螺[3,4]辛烷基,或者是三环烃基如金刚烷基。
[0178]
术语“环烃基”应理解为表示饱和或不饱和的一价单环、二环(如稠环、桥环、螺环)烃环、三环烃环、四环烃环、五环烃环、六环烃环或更多个环的烃环,例如具有3~40个碳原子,优选3~20个碳原子。所述环烃基包括环烷基、环烯基、环炔基。
[0179]
除非另有定义,术语“杂环基”是指饱和或不饱和的非芳族的环或环系,其包含一个或多个独立选自n、o和s的杂原子且总成环原子数为3-25(如原子数为3、4、5、6、7、8、9、10等),例如,其是4-、5-、6-或7-元的单环、7-、8-、9-、10-、11-或12-元的二环(如稠环、桥环、螺环)或者10-、11-、12-、13-、14-或15-元的三环环系,12-20元的四环环系、15-22元的五环环系、18-25元的六环环系以及更多环的环系,并且含有至少一个,例如1、2、3、4、5个或更多个选自o、s和n的杂原子,其中n和s还可以任选被氧化成各种氧化状态,以形成氮氧化物、-s(o)-或-s(o)
2-的状态。优选地,所述杂环基可以选自“3-20元杂环基”、或“3-10元杂环基”。术语“3-10元杂环基”意指饱和的或不饱和的非芳族的环或环系,并且含有至少一个选自o、s和n的杂原子。所述杂环基可以通过所述碳原子中的任一个或氮原子(如果存在的话)与分子的其余部分连接。所述杂环基可以包括稠合的或桥连的环以及螺环的环。特别地,所述杂环基可以包括但不限于:4元环,如氮杂环丁烷基、氧杂环丁烷基;5元环,如四氢呋喃基、二氧杂环戊烯基、吡咯烷基、咪唑烷基、吡唑烷基、吡咯啉基;或6元环,如四氢吡喃基、哌啶基、吗啉基、二噻烷基、硫代吗啉基、哌嗪基或三噻烷基;或7元环,如二氮杂环庚烷基。任选地,所述杂环基可以是苯并稠合的。所述杂环基可以是双环的,例如但不限于5,5元环,如六氢环戊并[c]吡咯-2(1h)-基环,或者5,6元双环,如六氢吡咯并[1,2-a]吡嗪-2(1h)-基环。杂环基可以是部分不饱和的,即它可以包含一个或多个双键,例如但不限于二氢呋喃基、二氢吡喃基、2,5-二氢-1h-吡咯基、4h-[1,3,4]噻二嗪基、1,2,3,5-四氢噁唑基或4h-[1,4]噻嗪基,或者,它可以是苯并稠合的,例如但不限于二氢异喹啉基。
[0180]
根据本发明,所述杂环基是无芳香性的。所述杂环基与其它基团相连构成本发明的化合物时,可以为杂环基上的碳原子与其它基团相连,也可以为杂环基环上杂环原子与其它基团相连。例如当杂环基选自哌嗪基时,可以为哌嗪基上的氮原子与其它基团相连。或当杂环基选自哌啶基时,可以为哌啶基环上的氮原子和其对位上的碳原子与其它基团相连。
[0181]
术语“芳基”应理解为优选表示具有6-20个碳原子(例如6、7、8、9、10、11、12、13或14个碳原子)的芳香性或部分芳香性的单环、双环、三环烃环、三环烃环、四环烃环、五环烃环、六环烃环或更多环的烃环。优选“c
6-14
芳基”,特别是具有6个碳原子的环(“c6芳基”),例如苯基;或联苯基,或者是具有9个碳原子的环(“c9芳基”),例如茚满基或茚基,或者是具有10个碳原子的环(“c
10
芳基”),例如四氢化萘基、二氢萘基或萘基,或者是具有13个碳原子的环(“c
13
芳基”),例如芴基,或者是具有14个碳原子的环(“c
14
芳基”),例如蒽基。当所述c
6-14
芳基被取代时,其可以为单取代或者多取代。并且,对其取代位点没有限制,例如可以为邻位、对位或间位取代。
[0182]
术语“杂芳基”应理解为包括这样的单环、二环(如稠环、桥环、螺环)、三环芳族环系、四环芳族环系、五环芳族环系、六环芳族环系或更多环的芳族环系:其具有5~25个环原子且包含一个或多个(例如1-5个)独立选自n、o和s的杂原子,例如“5-14元杂芳基”。术语“5-14元杂芳基”应理解为包括这样的一价单环、双环或三环芳族环系:其具有5、6、7、8、9、10、11、12、13或14个环原子,特别是5或6或9或10个碳原子,且其包含1-5个,优选1-3个独立选自n、o和s的杂原子。并且,另外在每一种情况下可为苯并稠合的。“杂芳基”还指其中杂芳族环与一个或多个芳基、脂环族或杂环基环稠合的基团,其中所述连接的根基或点在杂芳族环上。当所述杂芳基与其它基团相连构成本发明的化合物时,可以为杂芳基环上的碳原子与其它基团相连,也可以为杂芳基环上的杂原子与其它基团相连。当所述杂芳基被取代时,其可以为单取代或者多取代。并且,对其取代位点没有限制,例如可以为杂芳基环上与碳原子相连的氢被取代,或者杂芳基环上与杂原子相连的氢被取代。
[0183]
特别地,杂芳基选自噻吩基、呋喃基、吡咯基、恶唑基、噻唑基、咪唑基、吡唑基、异恶唑基、异噻唑基、恶二唑基、三唑基、噻二唑基、噻-4h-吡唑基等以及它们的苯并衍生物,例如苯并呋喃基、苯并噻吩基、苯并恶唑基、苯并异恶唑基、苯并咪唑基、苯并三唑基、吲唑基、吲哚基、异吲哚基等;或吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基等,以及它们的苯并衍生物,例如喹啉基、喹唑啉基、异喹啉基等;或吖辛因基、吲嗪基、嘌呤基等以及它们的苯并衍生物;或噌啉基、酞嗪基、喹唑啉基、喹喔啉基、萘啶基、蝶啶基、咔唑基、吖啶基、吩嗪基、吩噻嗪基、吩恶嗪基等。
[0184]
术语“螺环”是指两个环共用1个成环原子的环系。
[0185]
术语“稠环”是指两个环共用2个成环原子的环系。
[0186]
术语“桥环”是指两个环共用3个以上成环原子的环系。
[0187]
除非另有说明,杂环基、杂芳基或亚杂芳基包括其所有可能的异构形式,例如其位置异构体。因此,对于一些说明性的非限制性实例,可以包括在其1-、2-、3-、4-、5-、6-、7-、8-、9-、10-、11-、12-位等(如果存在)中的1、2个或更多个位置上取代或与其他基团键合的形式,包括吡啶-2-基、亚吡啶-2-基、吡啶-3-基、亚吡啶-3-基、吡啶-4-基和亚吡啶-4-基;噻吩基或亚噻吩基包括噻吩-2-基、亚噻吩-2-基、噻吩-3-基和亚噻吩-3-基;吡唑-1-基、吡唑-3-基、吡唑-4-基、吡唑-5-基。
[0188]
术语“氧代”是指取代基中的碳原子、氮原子或硫原子被氧化后形成的氧基取代(=o)。
[0189]
术语“烷氧基”应理解为-o-烷基,所述烷基如上所定义。
[0190]
术语“卤代烷基”应理解为烷基上的h被卤素部分或全部取代,所述烷基如上所定义。
[0191]
术语“卤代烷氧基”应理解为-o-卤代烷基,所述卤代烷基如上所定义。本发明所使用的立体化学定义和规则一般遵循s.p.parker,ed.,mcgraw-hill dictionary of chemical terms(1984)mcgraw-hill book company,new york;and eliel,e.and wilen,s.,“stereo chemistry of organic compounds”,john wiley&sons,inc.,new york,1994。
[0192]
术语“腈基”应理解为基团-cn,其也可称为氰基。
具体实施方式
[0193]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0194]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0195]
实施例1
[0196]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 4-氯苯乙烯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯)-1,4-二苯基丁烷-1,4-二酮,产率为78%。
[0197]
实施例2
[0198]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol苯乙烯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,2,4-三苯基丁烷-1,4-二酮,产率为73%。
[0199]
实施例3
[0200]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol邻甲基苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,4-二苯基-2-(邻甲苯基)丁烷-1,4-二酮,产率为53%。
[0201]
实施例4
[0202]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4aco和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol间甲基苯乙烯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,4-二苯基-2-(间甲苯基)丁烷-1,4-二酮,产率为65%。
[0203]
实施例5
[0204]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4aco和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对甲基苯乙烯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,4-二苯基-2-(对甲苯基)丁烷-1,4-二酮,产率为78%。
[0205]
实施例6
[0206]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对氯甲基苯乙烯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-(氯甲基)苯基)-1,4-二苯基丁烷-1,4-二酮,产率为54%。
[0207]
实施例7
[0208]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对三氟甲基苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,4-二苯基-2-(4-(三氟甲基)苯基)丁烷-1,4-二酮,产率为67%。
[0209]
实施例8
[0210]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对叔丁基苯乙烯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-(叔丁基)苯基)-1,4-二苯基丁烷-1,4-二酮,产率为71%。
[0211]
实施例9
[0212]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 2,5-二甲基苯乙烯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(2,4-二甲基苯基)-1,4-二苯基丁烷-1,4-二酮,产率为62%。
[0213]
实施例10
[0214]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对苯基苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-([1,1'-二苯基]-4-基)-1,4-二苯基丁烷-1,4-二酮,产率为55%。
[0215]
实施例11
[0216]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对甲氧基苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-甲氧基苯基)-1,4-二苯基丁烷-1,4-二酮,产率为64%。
[0217]
实施例12
[0218]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对乙氧基苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-乙氧基苯基)-1,4-二苯基丁烷-1,4-二酮,产率为82%。
[0219]
实施例13
[0220]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对苯氧基苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-苯氧基苯基)-1,4-二苯基丁烷-1,4-二酮,产率为62%。
[0221]
实施例14
[0222]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对乙酰氧基苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-乙酰氧基苯基)-1,4-二苯基丁烷-1,4-二酮,产率为54%。
[0223]
实施例15
[0224]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol邻氟苯乙烯。在440nm led下照射24小时。室温下,反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(2-氟代苯基)-1,4-二苯基丁烷-1,4-二酮,产率为53%。
[0225]
实施例16
[0226]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol间氟苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(3-氟代苯基)-1,4-二苯基丁烷-1,4-二酮,产率为62%。
[0227]
实施例17
[0228]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol对氟苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氟代苯基)-1,4-二苯基丁烷-1,4-二酮,产率为53%。
[0229]
实施例18
[0230]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol邻氯苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(2-氯代苯基)-1,4-二苯基丁烷-1,4-二酮,产率为54%。
[0231]
实施例19
[0232]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol间氯苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(3-氯代苯基)-1,4-二苯基丁烷-1,4-二酮,产率为60%。
[0233]
实施例20
[0234]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol邻溴苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(2-溴代苯基)-1,4-二苯基丁烷-1,4-二酮,产率为52%。
[0235]
实施例21
[0236]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol间溴苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(3-溴代苯基)-1,4-二苯基丁烷-1,4-二酮,产率为57%。
[0237]
实施例22
[0238]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对溴苯乙烯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-溴代苯基)-1,4-二苯基丁烷-1,4-二酮,产率为63%。
[0239]
实施例23
[0240]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 4-乙烯基苯甲酸甲酯。室温下,在440nm led下照射12小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为4-(1,4-二氧代-1,4-二苯基丁烷-2-基)苯甲酸甲酯,产率为61%。
[0241]
实施例24
[0242]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol对腈基苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-腈基苯基)-1,4-二苯基丁烷-1,4-二酮,产率为52%。
[0243]
实施例25
[0244]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmolβ-甲基苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-甲基-1,3,4-三苯基丁烷-1,4-二酮,产率为45%。
[0245]
实施例26
[0246]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 1,2-二氢萘。室温下,在440nm led下照射12小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为(1,2,3,4-四氢萘-1,2-二基)双(苯基甲酮),产率为52%。
[0247]
实施例27
[0248]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 2-乙烯基萘。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(萘-2-基)-1,4-二苯基丁烷-1,4-二酮,产率为58%。
[0249]
实施例28
[0250]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 2-乙烯基噻吩。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,4-二苯基-2-(噻吩-2-基)丁烷-1,4-二酮,产率为52%。
[0251]
实施例29
[0252]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol 2-乙烯基吡啶。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产
物为1,4-二苯基-2-(吡啶-2-基)丁烷-1,4-二酮,产率为56%。
[0253]
实施例30
[0254]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol对1-苯基丁二烯。室温下,在440nm led下照射24小时。室温下,反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为(反式)-1,4-二苯基-2-苯乙烯基丁烷-1,4-二酮,产率为16%。
[0255]
实施例31
[0256]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol 4-丁二烯基甲苯。室温下,在440nm led下照射24小时。室温下,反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为(反式)-2-(4-甲基苯乙烯基)-1,4-二苯基丁烷-1,4-二酮,产率为13%。
[0257]
实施例32
[0258]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol1,1-二苯基乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,2,2,4-四苯基丁烷-1,4-二酮,产率为58%。
[0259]
实施例33
[0260]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 1-甲基-2-(1-苯基乙烯基)苯。室温下,在440nm led下照射12小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,2,4-三苯基-2-(邻甲苯基)丁烷-1,4-二酮,产率为51%。
[0261]
实施例34
[0262]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 1-甲基-3-(1-苯基乙烯基)苯。室温下,在440nm led下照射12小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,2,4-三苯基-2-(间甲苯基)丁烷-1,4-二酮,产率为60%。
[0263]
实施例35
[0264]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 1-乙基-4-(1-苯基乙烯基)苯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,2,4-三苯基-2-(对乙苯基)丁烷-1,4-二酮,产率为54%。
[0265]
实施例36
[0266]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol1-(1-苯基乙烯基)-4-(三氟甲基)苯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,2,4-三苯基-2-(4-(三氟甲基)苯基)丁烷-1,4-二酮,产率为51%。
[0267]
实施例37
[0268]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 4,4'-(乙烯-1,1-二基)双氟苯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2,2-双(4-氟苯基)-1,4-二苯基丁烷-1,4-二酮,产率为56%。
[0269]
实施例38
[0270]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 1-氟-4-(1-(4-甲氧基苯基)乙烯基)苯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氟苯基)-2-(4-甲氧基苯基)-1,4-二苯基丁烷-1,4-二酮,产率为54%。
[0271]
实施例39
[0272]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 1-氯-4-(1-苯基乙烯基)苯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为1,2,4-三苯基-2-(对氯苯基)丁烷-1,4-二酮,产率为57%。
[0273]
实施例40
[0274]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol4,4'-(乙烯-1,1-二基)双氯苯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2,2-双(4-氯苯基)-1,4-二苯基丁烷-1,4-二酮,产率为64%。
[0275]
实施例41
[0276]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 1-苯氧基-4-(1-苯基乙烯基)苯。室温下,在440nm led下照射6小时。室温下,反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-苯氧基苯基)-1,2,4-三苯基丁烷-1,4-二酮,产率为52%。
[0277]
实施例42
[0278]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.04mmol k2co3、0.2m n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol甲基丙烯酸甲酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸甲酯,产率为50%。
[0279]
实施例43
[0280]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.04mmol k2co3、0.2m n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol甲基丙烯酸乙酯。室温下,在440nm led下照射24小时。室温下,反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸乙酯,产率为
48%。
[0281]
实施例44
[0282]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.04mmol k2co3、0.2m n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol甲基丙烯酸丁酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸丁酯,产率为50%。
[0283]
实施例45
[0284]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol甲基丙烯酸己酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸己酯,产率为44%。
[0285]
实施例46
[0286]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol甲基丙烯酸异丙酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸异丙酯,产率为41%。
[0287]
实施例47
[0288]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.04mmol k2co3、0.2m n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol甲基丙烯酸叔丁酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸叔丁酯,产率为42%。
[0289]
实施例48
[0290]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol甲基丙烯酸-2-乙氧基乙酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸-2-乙氧基乙酯,产率为41%。
[0291]
实施例49
[0292]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol甲基丙烯酸环己基酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸环己基酯,产率为40%。
[0293]
实施例50
[0294]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol甲基丙烯酸苄酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-苯甲酰基-2-甲基-4-氧代-4-苯基丁酸苄酯,产率为41%。
[0295]
实施例51
[0296]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.04mmol k2co3、0.2m n(n-bu)4no3和0.2mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol(反
式)-2-甲基丁-2-烯酸甲酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为(反式)-3,4-二甲基-1,6-二苯基己-3-烯-1,6-二酮,产率为43%。
[0297]
实施例52
[0298]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol苯甲酰甲酸(r1、r2、r3独立的为h)。将空气置换成n2气氛,然后加入0.2mmol 2,3-二甲基-1,3-丁二烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为(反式)-3,4-二甲基-1,6-二苯基己-3-烯-1,6-酮,产率为41%。
[0299]
实施例53
[0300]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmmol n(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol 4-乙烯基苯甲酸丁-3-烯-1-酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为丁-3-烯-1-基-4-(1,4-二氧代-1,4-二苯基丁烷-2-基)苯甲酸酯,产率为60%。
[0301]
实施例54
[0302]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmmol n(n-bu)4no3和0.5mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol4-乙烯基苯甲酸戊-4-烯-1-酯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为戊-4-烯-1-基-4-(1,4-二氧代-1,4-二苯基丁烷-2-基)苯甲酸酯,产率为43%。
[0303]
实施例55
[0304]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol邻甲基苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol 4-氯苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二邻甲苯基丁烷-1,4-二酮,产率为62%。
[0305]
实施例56
[0306]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.2mmol间甲基苯甲酰甲酸。将空气置换成n2气氛,然后加入0.5mmol 4-氯苯乙烯。50℃下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二间甲苯基丁烷-1,4-二酮,产率为71%。
[0307]
实施例57
[0308]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol对甲基苯甲酰甲酸。将空气置换成n2气氛,然后加入5mmol 4-氯苯乙烯。室温下,在440nm led下照射12小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二对甲苯基丁烷-1,4-二酮,产率为81%。
[0309]
实施例58
[0310]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol对叔丁基苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol 4-氯苯乙烯。
室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二对叔丁基苯基丁烷-1,4-二酮,产率为74%。
[0311]
实施例59
[0312]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol 2,4-二甲基苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol 4-氯苯乙烯。室温下,在440nm led下照射24小时。室温下,反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-双(2,4-二甲基苯基)丁烷-1,4-二酮,产率为57%。
[0313]
实施例60
[0314]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol邻氟苯甲酰甲酸。将空气置换成n2气氛,然后加入5mmol 4-氯苯乙烯。室温下,在440nm led下照射12小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二邻氟苯基丁烷-1,4-二酮,产率为81%。
[0315]
实施例61
[0316]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol对氟苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol 4-氯苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二对氟苯基丁烷-1,4-二酮,产率为80%。
[0317]
实施例62
[0318]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol对氯苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol 4-氯苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二对氯苯基丁烷-1,4-二酮,产率为74%。
[0319]
实施例63
[0320]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol邻甲氧基苯甲酰甲酸。将空气置换成n2气氛,然后加入5mmol 4-氯苯乙烯。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二邻甲氧基苯基丁烷-1,4-二酮,产率为53%。
[0321]
实施例64
[0322]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3和0.5mmol对甲氧基苯甲酰甲酸。将空气置换成n2气氛,然后加入0.2mmol 4-氯苯乙烯。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二对甲氧基苯基丁烷-1,4-二酮,产率为57%。
[0323]
实施例65
[0324]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mmol k2co3、0.04mmol n(n-bu)4no3和0.2mmol 2-萘甲酰甲酸。将空气置换成n2气氛,然后加入5mmol 4-氯苯乙烯。室温下,在440nm led下照射12小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯基)-1,4-二(萘-2-基)丁烷-1,4-二酮,产率为
35%。
[0325]
实施例66
[0326]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3、0.5mmol苯甲酰甲酸和0.2mmol胆甾烷醇衍生物66a,将空气置换成n2气氛。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为胆甾烷醇衍生物的1,2-双羰基化的产物66,产率为40%。
[0327][0328]
实施例67
[0329]
以4czipn为光催化剂,2ml dme和2ml dcm混合溶液中加入0.008mmol4czipn光催化剂、0.1m n(n-bu)4no3、0.5mmol苯甲酰甲酸和0.2mmol剑麻皂苷元衍生物67a,将空气置换成n2气氛。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为剑麻皂苷元衍生物的1,2-双羰基化的产物67,产率为62%。
[0330][0331]
实施例68
[0332]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3、0.5mmol苯甲酰甲酸和0.2mmol坎烷衍生物68a,将空气置换成n2气氛。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为坎烷衍生物的1,2-双羰基化的产物68,产率为50%。
[0333][0334]
实施例69
[0335]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.04mmol n
(n-bu)4no3、0.2mmol k2co3、0.2mmol苯甲酰甲酸和0.5mmol维生素e衍生物69a,将空气置换成n2气氛。室温下,在440nm led下照射6小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为维生素e衍生物的1,2-双羰基化的产物69,产率为47%。
[0336][0337]
实施例70
[0338]
以4czipn为光催化剂,2ml dme和2ml dcm混合溶液中加入0.008mmol4czipn光催化剂、0.1m n(n-bu)4no3、0.5mmol苯甲酰甲酸和0.2mmol表雄酮衍生物70a,将空气置换成n2气氛。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为表雄酮衍生物的1,2-双羰基化的产物70,产率为52%。
[0339][0340]
实施例71
[0341]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3、0.5mmol苯甲酰甲酸和0.2mmol雌酚酮衍生物71a,将空气置换成n2气氛。室温下,在440nm led下照射24小时。室温下,反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为雌酚酮衍生物的1,2-双羰基化的产物71,产率为46%。
[0342][0343]
实施例72
[0344]
以4czipn为光催化剂,2ml dme和2ml dcm混合溶液中加入0.008mmol4czipn光催化剂、0.1m n(n-bu)4no3、0.5mmol苯甲酰甲酸和0.2mmol海柯皂苷元衍生物72a,将空气置换成n2气氛。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为海柯皂苷元衍生物的1,2-双羰基化的产物72,产率为48%。
[0345][0346]
实施例73
[0347]
以4czipn为光催化剂,2ml dme中加入0.008mmol 4czipn光催化剂、0.2mn(n-bu)4no3、0.5mmol苯甲酰甲酸和0.2mmol胆固醇衍生物73a,将空气置换成n2气氛。室温下,在440nm led下照射24小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为胆固醇衍生物的1,2-双羰基化的产物73,产率为35%。
[0348][0349]
实施例74(克级放大实验)
[0350]
以4czipn为光催化剂,80ml dme中加入0.32mmol 4czipn光催化剂、0.2mn(n-bu)4no3和20mmol苯甲酰甲酸。将空气置换成n2气氛,然后加入8mmol 4-氯苯乙烯。室温下,在440nm led下照射24小时。50℃,440nm led下照射12小时。反应结束后,色谱柱分离。核磁氢谱、碳谱以及质谱鉴定产物为2-(4-氯苯)-1,4-二苯基丁烷-1,4-二酮,产率为54%(1.54g)。
[0351]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。