1.本发明属于生物医用材料领域,具体涉及一种雌激素缓释水凝胶及其制备方法和用途。
背景技术:
2.宫腔粘连(intrauterine adhesions,iuas)是指由于各种因素引起的子宫内膜基底层损伤,从而导致宫腔部分或全部闭塞,是妇产科常见病。iuas的症状因粘连的位置和范围而异,患者可出现月经过少(32.1%)、闭经(9.0%)或不孕症(55.1%)。iuas是困扰我国育龄期女性生殖心理健康的主要疾病之一。
3.iuas治疗的主要目的是恢复宫腔生理正常形态与结构,促进子宫内膜的再生,恢复子宫内膜的功能性,防止粘连的重新形成,最终改善生殖功能及妊娠结局。宫腔镜检查及宫腔镜下宫腔粘连松解术(transcervical resection of adhesion,tcra)是目前宫腔粘连的首选诊治方式,但目前中重度宫腔粘连tcra后再粘连率高达62.5%,术后成功妊娠率仅22.5%~33.3%。因此,如何预防宫腔镜术后的再次粘连成为临床工作中最棘手的问题。
4.临床上宫腔镜术后通常补充雌激素,用于促进子宫内膜生长,帮助创面修复。研究表明,雌激素可与在人子宫内膜腺上皮细胞和基质细胞中表达的雌激素受体相结合,刺激新生血管的生成和子宫内膜的生长。同时,为了减少再次粘连的机率,通常术后在宫腔内放置各类物理屏障,这样可以在创面最初愈合的阶段保持子宫壁之间解剖结构的表面分离,常见的屏障材料包括宫内节育器、宫腔球囊、透明质酸凝胶等。雌激素与屏障治疗相结合被证实可显著改善患者预后。
5.目前,雌激素的给药方式主要有三种,即口服给药、阴道给药、经皮给药。但不论以哪种方式,外源性雌激素均是在局部吸收后通过全身血液循环到达子宫内膜。这一给药过程选择性差,给药剂量高,当子宫内膜处达到有效浓度雌激素,能对治疗iuas发挥积极作用的同时,也将造成一定负面影响,如增加乳腺癌、乳腺增生、动静脉血栓风险、消化系统不适、肝功能损害等风险,且服药时间长,可能导致患者依从性差,出现错服、漏服等情况,致血药浓度不平稳等弊端。
6.如果能够将雌激素与屏障材料相结合,研究一种既可以作为屏障,又可以在子宫内缓释雌激素的体系,在物理屏障疗法的同时,在宫腔内部局部缓释雌激素进行药物治疗,使药物直接作用于子宫内膜,提高药物利用率,减少给药剂量,对于iuas治疗将十分有意义。
技术实现要素:
7.本发明的目的是提供一种雌激素缓释水凝胶及其制备方法和用途。本发明将雌激素疗法与物理屏障疗法结合起来,制备稳定的雌激素宫腔内缓释屏障材料,同时实现在宫腔内局部缓释雌激素,促进子宫内膜生长,以及屏障治疗,防止宫腔粘连的效果。
8.本发明提供了一种雌激素缓释水凝胶,它是由聚甲基丙烯酸羟乙酯水凝胶经过金
属阳离子交联后而得;所述聚甲基丙烯酸羟乙酯水凝胶中包含载雌激素的介孔二氧化硅微球。
9.进一步地,所述金属阳离子为cu
2
、ca
2
或fe
3
;
10.优选地,所述金属阳离子为fe
3
。
11.进一步地,所述聚甲基丙烯酸羟乙酯水凝胶由如下重量配比的原料制备而成:
12.甲基丙烯酸-2-羟乙酯1~10份、马来酸酐1~5份、载雌激素的介孔二氧化硅微球0.01~0.1份、光引发剂0.01~0.1份;
13.优选地,
14.所述聚甲基丙烯酸羟乙酯水凝胶由如下重量配比的原料制备而成:
15.甲基丙烯酸-2-羟乙酯7~8份、马来酸酐4~5份、载雌激素的介孔二氧化硅微球0.02份、光引发剂0.05份。
16.进一步地,所述聚甲基丙烯酸羟乙酯水凝胶的制备方法包括如下步骤:
17.将甲基丙烯酸-2-羟乙酯、马来酸酐和载雌激素的介孔二氧化硅微球加入溶剂中,真空脱氧后加入光引发剂,紫外光照射后制备得到水凝胶。
18.进一步地,
19.所述溶剂为水;
20.和/或,所述甲基丙烯酸-2-羟乙酯的浓度为1~5mol/l;
21.和/或,所述马来酸酐的浓度为1~5mol/l;
22.所述光引发剂为光引发剂1173;
23.和/或,所述紫外光照射时间为0.25~2小时;
24.优选地,
25.所述甲基丙烯酸-2-羟乙酯的浓度为2mol/l;
26.和/或,所述马来酸酐的浓度为1.4mol/l。
27.进一步地,所述载雌激素的介孔二氧化硅微球的制备方法包括如下步骤:
28.(1)模板剂、醇类溶剂、碱性催化剂分散于水中,滴加硅酸乙酯,反应得到二氧化硅微球;
29.(2)将步骤(1)制备得到的二氧化硅微球加入盐酸乙醇溶液中反应,去除模板剂,得到介孔二氧化硅微球;
30.(3)将介孔二氧化硅微球放入雌激素乙醇溶液中,反应,得到载雌激素的介孔二氧化硅微球;
31.优选地,步骤(1)中,所述醇类溶剂为甲醇、乙醇或正丙醇;
32.和/或,步骤(1)中,所述碱性催化剂为氢氧化钠或氨水;
33.更优选地,步骤(1)中,所述醇类溶剂为乙醇;
34.和/或,步骤(1)中,所述碱性催化剂为氢氧化钠。
35.进一步地,
36.步骤(1)中,模板剂、醇类溶剂和碱性催化剂的摩尔比为(1~5):(1000~2000):(1~5);
37.和/或,步骤(1)中,所述模板剂和水的摩尔体积比为(0.1~1)mmol:100ml;
38.和/或,步骤(1)中,所述模板剂和硅酸乙酯的摩尔体积比为(0.1~1)mmol:1ml;
39.和/或,步骤(1)中,所述滴加硅酸乙酯的速度为0.1~1ml/min;
40.和/或,步骤(1)中,所述反应温度为70~80℃;反应时间为24~48小时;
41.和/或,步骤(2)中,所述盐酸乙醇溶液中盐酸的浓度为0.3~0.5%;
42.和/或,步骤(2)中,所述二氧化硅微球和盐酸乙醇溶液的质量体积比为(0.1~1)g:100ml;
43.和/或,步骤(2)中,所述反应温度为80~90℃;反应时间为24~48小时;
44.和/或,步骤(3)中,所述介孔二氧化硅微球和雌激素乙醇溶液的质量体积比为(0.1~1.5)g:50ml;
45.和/或,步骤(3)中,所述雌激素乙醇溶液中雌激素浓度为50~100mg/ml;
46.和/或,步骤(3)中,所述反应时密封;所述反应温度为室温,反应时间为24~48小时。
47.进一步地,所述雌激素为雌二醇。
48.本发明还提供了前述的雌激素缓释水凝胶的制备方法,它包括如下步骤:
49.将聚甲基丙烯酸羟乙酯水凝胶浸泡于含金属阳离子的溶液,即得;
50.优选地,所述含金属阳离子的溶液为fecl3溶液;
51.和/或,所述浸泡时间为6~12小时;
52.更优选地,所述fecl3溶液的浓度为1~5mol/l。
53.本发明还提供了前述的雌激素缓释水凝胶在制备促进子宫内膜生长和/或防止子宫内膜粘连的医用材料中的用途。
54.本发明提供了一种雌激素缓释水凝胶。本发明制备的雌激素缓释水凝胶具有良好的抗溶胀性和机械稳定性,以及良好的生物相容性,同时还具备药物缓释能力,可实现雌激素至少30天的缓释效果。本发明雌激素缓释水凝胶既可以作为屏障材料,减少宫腔镜术后再次粘连;又可以通过缓释雌激素促进子宫内膜细胞增殖,促进子宫修复,在临床治疗子宫粘连上具有良好的应用前景。
55.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
56.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
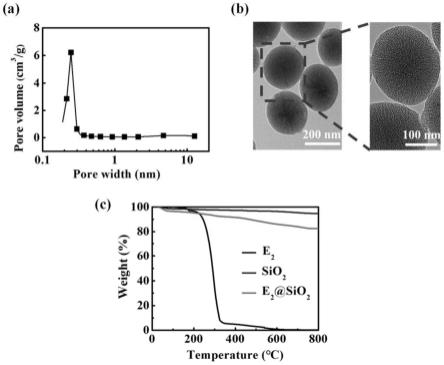
57.图1为e2@sio2的结构表征结果;其中,a为e2@sio2的孔径分布图;b为e2@sio2的tem图像;c为e2、sio2和e2@sio2的热重分析。
58.图2为phm、phmc、phm
h-si水凝胶的紫外可见吸收光谱。
59.图3为phm
h-si水凝胶流变性能表征;其中,a为phm
h-si水凝胶的流变主曲线,参考温度为10℃;b为水平位移因子的arrheniu曲线图,其中表观活化能ea由曲线图的斜率确定。
60.图4为phm
h-si水凝胶在模拟宫腔液中30d的含水率。
61.图5为phm
h-si水凝胶分别在模拟宫腔液中浸泡0、1、5和30d的实际照片。
62.图6为力学性能表征结果;其中,a为phm
h-si水凝胶在模拟宫腔液中浸泡30d内的应力-应变曲线;b为phm
h-si水凝胶在模拟宫腔液中浸泡30d内的弹性模量-断裂韧性柱状图。
63.图7为phm
h-si水凝胶的生物相容性结果;其中,a为huvec与各水凝胶浸提液共培养1、3和5d的荧光图像(活细胞和死细胞分别用绿色和红色标记);b为各水凝胶浸提液分别培养细胞1、3和5d后的活细胞光密度;c为采用cck-8法检测各水凝胶浸提液分别培养细胞1、3和5d后的细胞活性结果;control为细胞对照组。
64.图8为phm
h-si水凝胶中雌二醇的释放;其中,a为phm
h-si水凝胶和phm
h-e2水凝胶在模拟宫腔液中72h的雌二醇累积释放量;b为phm
h-si水凝胶在模拟宫腔液中30天累积释放的雌二醇含量;c为phm
h-si水凝胶在模拟宫腔液中30天中的单日释放量。
65.图9为phm
h-si水凝胶的体外治疗效果;其中,a为原代人子宫内膜细胞分别与phm
h-si水凝胶浸提液共培养1、3和5天的荧光图像(活细胞和死亡细胞分别用绿色和红色标记);b为对照组和phm
h-si组人子宫内膜培养5天中cck-8所测得相应光密度;c为phm
h-si组人子宫内膜细胞相较于对照组的细胞活性。
66.图10为phm
h-si水凝胶对大鼠宫腔粘连模型的治疗效果;其中,a为大鼠子宫切片的h&e和masson染色的代表图像;b为假手术组、iuas组、phm组和phm
h-si组的子宫内膜厚度;c为假手术组、iuas组、phm组和phm
h-si组的腺体数量;d为假手术组、iuas组、phm组和phm
h-si组的纤维化面积百分比;ns代表无明显差异,*p《0.05,**p《0.01,and***p《0.001)。
具体实施方式
67.本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
68.本实验选用生物效价最高的天然雌激素:雌二醇,作为缓释的目标药物,以介孔二氧化硅微球作为药物载体,以生物相容性优良的聚甲基丙烯酸羟乙酯(phema)水凝胶作为屏障主体材料,并通过fe
3
交联增加水凝胶的机械性能,从而使其在宫腔内保持稳定,并在治疗结束后方便术者完整将其取出。
69.实施例1、本发明雌二醇缓释水凝胶的制备
70.1、载雌二醇介孔二氧化硅微球(e2@sio2)的制备
71.载雌二醇介孔二氧化硅微球(e2@sio2)的制备方法包括如下步骤:
72.(1)2.7mmol十六烷基三甲基溴化铵(ctab),1.6mol乙醇,4mmol naoh分散均匀于500ml去离子水,在70℃下进行反应,反应开始时以0.1ml/min的速度将6ml硅酸乙酯(teos)匀速滴加至反应体系中,期间持续进行冷凝回流,滴加teos完毕后继续反应24小时,反应后经去离子水和乙醇分别清洗三次后过滤,并于60℃真空烘箱干燥12小时后得到二氧化硅微球。
73.(2)去除模板剂:将1g步骤(1)制备的二氧化硅微球加入100ml盐酸乙醇溶液(盐酸乙醇溶液中盐酸浓度为0.37wt%)中,于80℃反应24小时,反应后经去离子水和乙醇分别清洗三次后过滤,并于60℃真空烘箱干燥12小时后得到去除模板剂ctab后的介孔二氧化硅微球。
74.(3)载雌二醇:将0.5g步骤(2)制备的介孔二氧化硅微球分散于20ml雌二醇乙醇溶液(雌二醇乙醇溶液中雌二醇浓度为50mg/ml)中,室温密封搅拌24小时,搅拌后经去离子水
和乙醇分别清洗三次后过滤,并于60℃真空烘箱干燥12小时后获得载雌二醇介孔二氧化硅微球(e2@sio2)。
75.2、雌二醇缓释水凝胶(phm
h-si)的制备
76.雌二醇缓释水凝胶(phm
h-si)的制备方法包括如下步骤:
77.(1)配置含2mol/l甲基丙烯酸-2-羟乙酯单体(hema)、1.4mol/l马来酸酐(ma)的水溶液30ml,加入20mg e2@sio2抽真空脱氧后加入50mg光引发剂1173,于紫外光(250w)照射下进行反应1小时,交联形成水凝胶。
78.(2)将步骤(1)制得的水凝胶置于2mol/l fecl3溶液中进行浸泡6小时,浸泡后再于去离子水中浸泡24小时,获得phm
h-si水凝胶。
79.以下通过具体试验例证明本发明的有益效果。
80.试验例1、结构表征
81.1、实验方法
82.(1)e2@sio2的结构表征
83.bet测试:使用bet测量实施例1制备的e2@sio2样品的比表面积、孔隙体积、孔径以及绘制并计算氮气吸附-解吸等温线。样品在433k下进行真空脱附预处理24h,用软件分别计算样品的比表面积和孔径分布。
84.透射电子显微镜:将少量的e2@sio2加入适量无水乙醇中,超声分散,分散均匀后,取适量溶液,用滴管滴在铜网上。将含有e2@sio2乙醇溶液的铜网用洗耳球吹干。将干燥的铜网放入透射电子显微镜中以表征e2@sio2的内部结构,电子加速电压为120kv。
85.载药试验:采用热重分析仪测定雌二醇(e2,购买得到)和实施例1制备的介孔二氧化硅微球(sio2)以及e2@sio2的热稳定性。sio2在100-800℃不分解,e2在250℃左右开始分解,600℃时几乎完全分解。因此,可以通过测试sio2和e2@sio2的热稳定性来计算平均载药量。测试条件:n2,温度范围30-800℃,升温速率20℃/min,通风量50ml/min。
86.(2)phm
h-si水凝胶的结构表征
87.通过紫外可见吸收光谱仪测定实施例1制备的phm
h-si水凝胶的紫外-可见光谱,扫描范围为200~800cm-1
。用扫描电镜对phm
h-si水凝胶中的硅元素进行了表征。同时按照同样方法检测了phm水凝胶和phmc水凝胶的紫外-可见光谱。
88.采用流变仪对phm
h-si水凝胶、phm水凝胶和phmc水凝胶的流变性能进行了表征。样品制备成圆片状(直径40mm,厚度2mm)。对水凝胶进行频率扫描测试,温度范围为10~60℃,频率范围为1~100rad/s,应变为0.05%。基于时间-温度等效原理,将不同温度下的存储模量g'、损耗模量g"和损耗因子tanδ曲线平移叠加,以10℃为参考温度,得到流变宽频率范围的主曲线。
89.时间-温度叠加的水平位移因子a
t
符合arrhenius方程:
90.a
t
=e-ea/rt
91.两边取对数后,方程变换为:
92.ln a
t
=-ea/rt
93.其中,ea为表观活化能,r为气体常数,t为测试温度。
94.phm水凝胶的制备:将hema、ma溶于去离子水中形成均匀的溶液,其中hema的浓度为2mol/l,ma的浓度为1.4mol/l,除氧15min后,加入10mmol/l的光引发剂1173,置于250w的
uv下辐照2h,将得到的水凝胶置于去离子水中浸泡24小时进行溶胀平衡,获得phm水凝胶。
95.phmc水凝胶的制备:将hema、ma、n,n-二甲基丙烯酰胺(mba)溶于去离子水中形成均匀的溶液,其中hema的浓度为2mol/l,ma的浓度为1.4mol/l,mba浓度为6.7mmol/l,除氧15min后,加入10mmol/l的光引发剂1173,置于250w的uv下辐照2h,将得到的水凝胶置于去离子水中浸泡24小时进行溶胀平衡,获得phmc水凝胶。
96.2、实验结果
97.(1)e2@sio2的结构表征
98.e2@sio2的结构表征结果如图1所示:本发明制备的e2@sio2呈现介孔球形结构(图1b),经过bet试验测定介孔二氧化硅,其平均孔径为3.3nm,比表面积为1009.5m2/g(图1a),有利于载药。通过tga试验计算e2@sio2的载药率约为12.22%(图1c),从而证明了介孔二氧化硅载雌二醇成功。
99.(2)phm
h-si水凝胶的结构表征
100.为了进行比较,本试验例分别制备了ma和hmea聚合的phm水凝胶,以及在phm的基础上通过引入化学交联制备的phmc水凝胶。与phm和phmc水凝胶的紫外-可见光谱相比,phm
h-si水凝胶的紫外-可见光谱在450-600nm之间有一个额外的吸收峰(图2),表明phm
h-si水凝胶中存在fe
3 -羧基配位交联。
101.为了进一步区分水凝胶的动态作用,对于phm、phmc和phm
h-si水凝胶,在10℃至60℃范围内进行了扫频测试。然后将g'、g"、tanδ平移叠加得到符合时间-温度叠加原理的主曲线,如图3a所示。根据arrhenius方程,得到了水凝胶的表观活化能ea。phm、phmc和phm
h-si水凝胶的ea分别为57.7kj/mol、100.6kj/mol和159.6kj/mol(图3b)。表观活化能的差异是由于水凝胶的结合强度不同造成的。phm水凝胶的表观活化能低于phmc水凝胶,证明phmc水凝胶中的化学键比phm水凝胶中的氢键更强。引入离子配位作用后,phm
h-si水凝胶的表观活化能增加到159.6kj/mol,表明水凝胶网络变得更密、更强。有利于其长期在宫腔内保持稳定的形态。
102.试验例2、抗溶胀性测试
103.1、实验方法
104.采用质量分析方法,实施例1制备的载药样品phm
h-si水凝胶在100℃烘箱中烘烤5h,称量质量,记为w0。将水凝胶浸入模拟宫腔液中,隔一定时间测量水凝胶的重量,记为wd。含水率的计算公式:sr=(w
d-w0)/w0×
100%。
105.模拟宫腔液的配制:用去离子水分别溶解4.97g氯化钠、0.224g氯化钾、0.167g氯化钙、0.25g碳酸氢钠、0.50g葡萄糖、0.072g二水合磷酸二氢钠和1g人血白蛋白,置于1000ml容量瓶中,再用去离子水稀释至980ml,并用1.0mol/l的烯hcl溶液或1.0mol/l的烯naoh溶液将ph调至7.0
±
0.1,用去离子水定容。
106.2、实验结果
107.为探讨phm
h-si水凝胶用于iuas治疗的可行性,将phm
h-si水凝胶放入模拟宫腔液中30d,其抗溶胀性测试结果如图4和图5所示:虽然样品的含水率在第1天从28.63%迅速增加到39.21%,但含水率保持相对稳定的水平,并且从宏观上看,试样在不同时间溶胀后,其大小和形状没有明显变化。以上结果表明,本发明制备的phm
h-si水凝胶在模拟宫腔液中具有良好的抗溶胀性,有利于持续在宫腔中进行药物释放。可见坚韧而紧密的混合交联网络
使得phm
h-si水凝胶具有良好的抗溶胀性。
108.试验例3、力学稳定性测试
109.1、实验方法
110.将按照试验例2方法在模拟宫腔液中浸泡不同时间的phm
h-si水凝胶,用万能试验机测试其力学性能。将phm
h-si水凝胶切割成哑铃样(宽4mm,厚1mm,长20mm)进行室温拉伸试验,固定拉伸速率为100mm/min,每个待测样品重复试验5次,取其平均值。
111.2、实验结果
112.力学稳定性测试结果如图6所示:在模拟宫腔液中浸泡30d后,phm
h-si水凝胶的力学性能仍保持较高水平,拉伸强度为0.82mpa,断裂应变为134.18%,有利于在治疗结束后方便术者将其完整取出。可见坚韧而紧密的混合交联网络使得phm
h-si水凝胶具有良好的机械稳定性。
113.试验例4、生物相容性测试
114.1、实验方法
115.细胞死活染色实验及cck-8实验:phema水凝胶以及实施例1制备的phm
h-si水凝胶被切成边长为1cm的正方形,浸泡在4ml dmem培养基24h,0.22μm膜滤器过滤,然后添加400μl胎牛血清(fbs)和40μl青霉素-链霉素(ps)获得不同水凝胶的浸提液。
116.将人脐静脉内皮细胞(huvecs)以每孔5000个细胞密度在96孔板中孵育24h,并加入不同水凝胶的无菌浸提液。共培养1、3、5天后,分别加入1%的荧光ao/eb试剂。在徕卡倒置荧光显微镜下观察荧光图像(活细胞和死细胞分别用绿色和红色标记)。同时采用细胞计数试剂盒-8(cck-8)检测各组huvecs的生物活性。
117.phema水凝胶的制备:将甲基丙烯酸-2-羟乙酯单体(hema)溶于去离子水,hema的浓度为2mol/l,除氧15min后,加入10mmol/l的光引发剂2-羟基-2-甲基苯丙酮(1173),置于250w的紫外(uv)下辐照2h,将得到的水凝胶置于去离子水中浸泡24小时进行溶胀平衡,获得phema水凝胶。
118.2、实验结果
119.生物相容性测试结果如图7所示:phm
h-si水凝胶浸提液与人静脉内皮细胞(huvecs)共培养5d的细胞增殖率为96.65%,表现出良好的生物相容性。
120.试验例5、phm
h-si水凝胶的药物缓释能力测试
121.1、实验方法
122.将phm
h-e2水凝胶和实施例1制备的phm
h-si水凝胶切割成哑铃状样品(面积:3.5cm2),浸没于装有15ml模拟宫腔液(模拟宫腔液的配制方法同试验例2)的玻璃瓶中,置于37℃恒温水浴中保存30天。在预定的时间间隔内,从每个样品中采集0.5ml的溶液,然后在每个释放系统中加入等量新鲜模拟宫腔液,以保持总体积。用雌二醇elisa试剂盒测定释放液中雌二醇(e2)的浓度,用紫外分光光度法在450nm的吸收波长下,根据校准曲线测定e2的浓度。e2的累积量与每个样品的释放时间相对应。
123.phm
h-e2水凝胶的制备:将hema、ma、e2溶于去离子水中形成均匀的溶液,其中hema的浓度为2mol/l,ma的浓度为1.4mol/l,e2的浓度为2.5mmol/l,除氧15min后,加入10mmol/l的光引发剂1173,置于250w的紫外(uv)下辐照2h,将得到的水凝胶置于2mol/l fecl3溶液中进行浸泡6h,然后于去离子水中浸泡24小时进行平衡,获得phm
h-e2水凝胶。
124.2、实验结果
125.phm
h-si水凝胶的药物缓释能力测试结果如图8所示:phm
h-e2水凝胶(将e2直接加入水凝胶)浸泡72h后,其e2累积释放量高达22.98%,而phm
h-si水凝胶的e2累积释放率仅为2.13%。
126.本发明phm
h-si水凝胶每日药物释放浓度为3.07ng/ml,与文献报道(1、gao p,yang c,liang z,et al.n-propyl functionalized spherical mesoporous silica as a rapid and efficient adsorbent for steroid estrogen removal:adsorption behaviour and effects of water chemistry.[j]chemosphere,2019,214:361-370.;2、marshburn p b,head j r,macdonald p c,et al.culture characteristics of human endometrial glandular epithelium throughout the menstrual cycle:modulation of deoxyribonucleic acid synthesis by 17β-estradiol and medroxyprogesterone acetate.[j]american journal of obstetrics and gynecology,1992,167(6):1888-1898.)中的子宫内膜细胞高增殖率的雌二醇适用浓度相当。
[0127]
说明本发明phm
h-si水凝胶具有药物缓释能力,且每日药物缓释量可以促进子宫内膜细胞增殖,本发明制备的phm
h-si水凝胶可实现雌二醇至少30天的缓释效果。
[0128]
试验例6、phm
h-si水凝胶的体外研究
[0129]
1、实验方法
[0130]
将原代人子宫内膜细胞与实施例1制备的phm
h-si水凝胶的浸提液共同培养5天,并通过cck-8的方法判断细胞增殖情况。phm
h-si水凝胶的浸提液提取方法同试验例4。将原代人类子宫内膜细胞以每孔5000个细胞的密度在96孔板中培养24小时,其中phm
h-si组每孔加phm
h-si水凝胶浸提液10μl,空白对照control组每孔加入完全培养基10μl。分别共培养1、2、3、4和5天后,用cck-8染色1小时,用酶标仪在450nm处读取光密度(od)。细胞活力表示为用phm
h-si水凝胶浸提液处理的细胞与未处理的细胞所测定的马氏剂量之间的比率。同时,在共同培养1、3和5天后,还进行了细胞活/死染色。
[0131]
2、实验结果
[0132]
体外研究结果如图9所示:phm
h-si水凝胶浸提液与人子宫内膜细胞共培养5天后,相较于对照组细胞增殖率为117.37%。说明phm
h-si水凝胶可以促进人子宫内膜细胞增殖。
[0133]
试验例7、phm
h-si水凝胶的动物体内治疗研究
[0134]
1、实验方法
[0135]
本发明选择了20只发情周期规律的大鼠,并随机分为四组,包括假手术组sham(n=5)、iuas组(n=5)、phm组(n=5)和phm
h-si组(n=5)。其中sham组仅进行开关腹,iuas组进行机械损伤造模操作,phm组、phm
h-si组在造模完成后分别予phm水凝胶(制备方法同试验例1)、phm
h-si水凝胶(制备方法同实施例1)治疗。所有手术都在发情期进行,大鼠通过腹腔注射戊巴比妥(40mg/kg)进行麻醉。在无菌手术条件下对大鼠的腹壁进行消毒,切开腹壁,进入腹腔。在子宫两侧靠近子宫颈处做一个直径为2毫米的切口,使用自制的子宫刮匙对宫腔各壁中进行搔刮机械损伤造模。搔刮完成后,将条状phm
h-si水凝胶或phm水凝胶(20mm
×
0.5mm
×
0.5mm)置于大鼠宫腔。缝合子宫切口并逐层关腹。在术后10天处死大鼠,采集子宫进行he和masson染色。每张切片选10个不同位置测量子宫内膜厚度(e),每张切片选取5个不同视野计数腺体的数量(g),纤维化面积比使用image j软件进行计算。
[0136]
2、实验结果
[0137]
建造大鼠宫腔粘连模型,并在大鼠子宫内置入phm
h-si水凝胶进行治疗,通过对子宫内膜厚度、子宫内膜腺体数目、纤维化面积的比例等方面进行比较,说明了phm
h-si水凝胶对宫腔粘连有明显的治疗效果(图10)。
[0138]
本发明提供了一种雌激素缓释水凝胶。本发明制备的雌激素缓释水凝胶具有良好的抗溶胀性和机械稳定性,以及良好的生物相容性,同时还具备药物缓释能力,可实现雌激素至少30天的缓释效果。本发明雌激素缓释水凝胶既可以作为屏障材料,减少宫腔镜术后再次粘连;又可以通过缓释雌激素促进子宫内膜细胞增殖,促进子宫修复,在临床治疗子宫粘连上具有良好的应用前景。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。