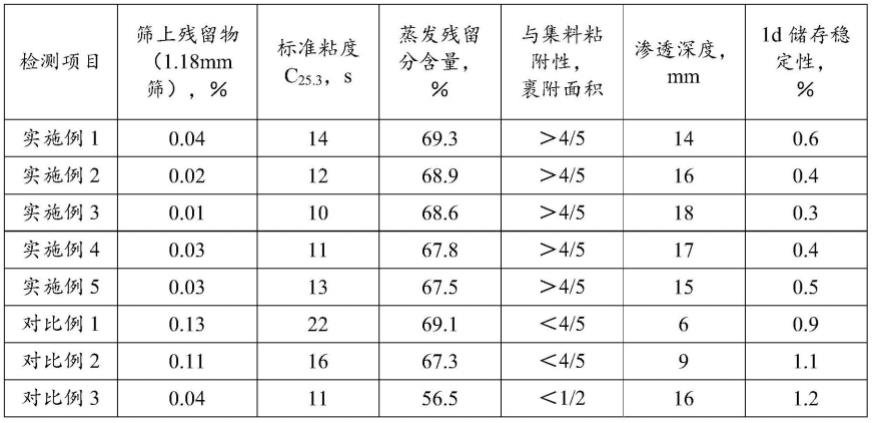
dna聚合酶单克隆抗体,然而其无法达到100%的封闭tth dna聚合酶的效果,另外,现有的热启动tth dna聚合酶存在稳定性差的问题。
8.鉴于此,特提出本发明。
技术实现要素:
9.本发明的目的在于提供一种分泌抗dna聚合酶单克隆抗体的杂交瘤细胞、单克隆抗体,该杂交瘤细胞分泌的单克隆抗体对多种dna聚合酶都具有良好的封闭活性,尤其是针对tth dna聚合酶能达到100%的封闭效果,由此制备的热启动酶稳定性好,在常温下放置15天以上仍保持良好的封闭效果和扩增效果,有助于降低扩增检测试剂或试剂盒在运输和保存时对于温度(低温)的要求,拓宽了热启动酶的应用场景。
10.本发明是这样实现的:第一方面,本发明提供了一种分泌抗dna聚合酶单克隆抗体的杂交瘤细胞,其保藏于广东省微生物菌种保藏中心,保藏地址为:广东省广州市越秀区先烈中路100号大院实验大楼5楼微生物研究所菌种保藏中心,保藏编号为:gdmcc:62992,保藏日期为:2022年11月22日,保藏细胞名称为:杂交瘤细胞tta135,鉴定结果为:存活,分类学名称为:杂交瘤细胞株。
11.该杂交瘤细胞分泌的抗体在低温下具有完全封闭dna聚合酶的活性,使dna聚合酶在低温条件下不发挥聚合酶活性。在高温下,单克隆抗体从dna聚合酶的结合位点脱离,释放dna聚合酶的活性。再进行pcr扩增反应,这样可以有效地避免引物二聚体的形成,降低非特异产物的扩增。因此,本发明提供的杂交瘤细胞分泌的单克隆抗体具有以下优势:一、具有降低非特异性反应的扩增的作用。二、该单克隆抗体能完全封闭dna聚合酶的活性,封闭后的热启动酶在高温下30s-10min的加热即可恢复dna聚合酶活性。三、相比于现有的热启动酶,该单克隆抗体修饰后的dna聚合酶具有更好的稳定性(尤其是热稳定性),显著延长了热启动酶的常温保存时间。四、单克隆抗体无dna分解酶活性残留、无核酸外切酶活性残留和无核酸内切酶活性残留。五、杂交瘤细胞分泌的单克隆抗体可以对多种dna聚合酶保持良好的低温封闭效果和高温释放聚合活性效果,具有普适性。
12.第二方面,本发明还提供了一种杂交瘤细胞的制备方法,其包括如下步骤:将dna聚合酶免疫能产生单克隆抗体的动物,检测动物血清效价和动物血清对dna聚合酶活性的封闭和/或启动活性,筛选获得能用于细胞融合的动物;将筛选出的动物的脾细胞与骨髓瘤细胞融合得到杂交瘤细胞;对杂交瘤细胞进行筛选和克隆化。
13.选择动物血清效价高的血清,通过初筛动物血清对dna聚合酶活性的封闭活性以及dna聚合酶启动活性的影响,剔除没有封闭dna聚合酶活性的动物,以提升后续筛得高封闭dna聚合酶活性甚至完全封闭dna聚合酶活性的杂交瘤细胞的几率。
14.在一种可选的实施方式中,把血清效价在1:10000以上且低血清用量时可完全封闭dna聚合酶活性的动物进行细胞融合。
15.筛选获得能用于细胞融合的动物,一种筛选方法为:选择a用量的动物血清有明显封闭dna聚合酶效果且高于a用量的动物血清条件下能完全封闭dna聚合酶活性的动物;选择a用量是指0.5-1μl的动物血清原液。
16.在一种可选的实施方式中,上述高于a用量指1<a《10μl的动物血清原液。例如1<a《4μl,或者2<a《4μl。
17.在其他实施方式中,当0.5μl的动物血清原液有明显封闭dna聚合酶效果,1μl用量的动物血清条件下能完全封闭dna聚合酶活性的动物,也在本发明的保护范围之内。
18.另一种筛选方法为:选择b用量即可完全封闭dna聚合酶活性的动物;b用量是指0.5-2μl的动物血清原液。
19.例如筛选0.5-1μl的动物血清原液即可完全封闭dna聚合酶活性的动物;或者筛选1-2μl的动物血清原液即可完全封闭dna聚合酶活性的动物。
20.在一种实施方式中,也可设置b=2a。例如a用量是指0.5-1μl的动物血清原液,b用量为1-2μl的动物血清原液。
21.上述筛选策略相较于单一的elisa检测方法,大幅提升了目标动物的精确性,从而增加了筛选到可完全封闭tth dna聚合酶活性的单克隆抗体的可能性。
22.上述细胞融合的方法包括不限于peg法、仙台病毒法、受体指引法、电融合法、磁场融合法。
23.杂交瘤细胞的筛选方法包括不限于:固相放射免疫测定法、固相酶免测测定法、免疫荧光技术、间接血凝试验、微量细胞毒试验或斑点试验。只要能筛出能分泌与dna聚合酶反应的单克隆抗体的杂交瘤细胞均可行。
24.杂交瘤细胞的克隆化包括不限于:有限稀释法、显微操作法、软琼脂平板法和细胞选分仪法。
25.例如采用有限稀释法进行杂交瘤细胞的克隆化,该方法不需任何特殊设备,出现克隆细胞的效率高。将细胞悬液通过系列稀释使得每个培养孔含特定数目的细胞。
26.在本发明应用较佳的实施方式中,上述杂交瘤细胞的克隆化包括:将阳性杂交瘤细胞进行三次单克隆化。经过三次单克隆化以保证每个孔均为单克隆。
27.在一种可选的实施方式中,在克隆化的过程中,每次单克隆化平铺1个96孔细胞培养板,且在第一次单克隆化过程中,设置5个细胞/孔;第二次单克隆化:设置3个细胞/孔;第三次单克隆化:设置1个细胞/孔。
28.每次克隆检测时根据细胞克隆大小和od
450nm
检测值进行综合评估,选择细胞克隆大小适中且阳性值高的单克隆细胞进行铺板,以避免阴性杂交瘤细胞、分泌抗体能力弱或分泌低亲和力抗体的非单克隆细胞之间长期竞争生长,保证分泌抗体能力强且分泌高亲和力抗体的单克隆细胞的有效生长和稳定性。
29.在一种可选的实施方式中,能产生单克隆抗体的动物为小鼠、大鼠或兔。
30.第三方面,本发明提供了一种单克隆抗体,单克隆抗体由上述的杂交瘤细胞所分泌,单克隆抗体能特异性结合dna聚合酶。
31.经鉴定,本发明提供的单克隆抗体具有以下特性:1)纯度高;2)dna聚合酶封闭后,残留活性低:3)封闭活性好,低用量即可满足实验需求,相比于现有技术1ug单克隆抗体/5u dna聚合酶的封闭用量,本发明提供的单克隆抗体具有用量少,封闭活性好的优势;4)抗体修饰后的dna聚合酶的启动活性好;5)无核酸酶残留的特点,无dna分解酶活性残留、无核酸外切酶活性残留和无核酸内切酶活性残留。
32.该单克隆抗体的亚型为igg1。
33.第四方面,本发明还提供了一种单克隆抗体的制备方法,其包括如下步骤:将上述的杂交瘤细胞或将上述的杂交瘤细胞的制备方法制得的杂交瘤细胞接种动物,采集腹水。
34.在本发明应用较佳的实施方式中,上述腹水采集后进行dna聚合酶的封闭和/或启动活性检测,筛选出能完全封闭dna聚合酶的活性的腹水。
35.通过预先对已接种的动物的腹水进行dna聚合酶的封闭和/或启动活性检测,以筛选出能完全封闭dna聚合酶的活性的腹水,然后再将能完全封闭dna聚合酶的活性的腹水进行抗体的小制。避免筛选得到的腹水封闭dna聚合酶的活性低。
36.在一种可选的实施方式中,采集腹水后还包括对腹水进行亚型鉴定和抗体纯化。
37.在一种可选的实施方式中,抗体纯化采用亲和层析、凝胶过滤层析、离子交换层析、羟基磷灰石层析、疏水相互作用层析和硫酸铵沉淀法中的至少一种方法进行抗体纯化。
38.亲和层析的层析柱的填料为protein a、protein g或protein l中的至少一种。
39.第五方面,本发明还提供了一种核酸分子,其编码上述的单克隆抗体。
40.第六方面,本发明还提供了一种重组载体,其包括上述的核酸分子。
41.第七方面,本发明还提供了一种热启动酶,其包括由抗体修饰的dna聚合酶,抗体为上述的单克隆抗体,单克隆抗体与dna聚合酶通过抗原抗体反应结合。
42.该热启动酶可以在30-60℃下加热1h后仍保持稳定的封闭效果,可以满足现有绝大部分实验条件下的实验需求,具有良好的应用前景。在37℃加速15d后,将含热启动酶的扩增体系进行pcr扩增,其扩增稳定性明显优于市场同类产品。
43.在一种可选的实施方式中,dna聚合酶为属于家族a的dna聚合酶。
44.在一种可选的实施方式中,dna聚合酶为选自由tth dna聚合酶或其突变体、taq dna聚合酶或其突变体和hawk z05聚合酶(如hawk z05 fast polymerase)或其突变体组成的组中的至少1种。
45.dna聚合酶包括不限于用于rt-pcr的逆转录酶(rt酶)、用于pcr的dna聚合酶等。
46.上述突变体包括不限于重组和n末端缺失的突变体。本发明提供的单克隆抗体尤其对于tth dna聚合酶和taq dna聚合酶具有良好的封闭聚合酶活性的效果。
47.在一种可选的实施方式中,单克隆抗体与dna聚合酶在30-60℃下通过抗原抗体反应结合,例如在37-50℃下通过抗原抗体反应结合。
48.第八方面,本发明还提供了一种热启动酶的制备方法,其包括如下步骤:将单克隆抗体与dna聚合酶共孵育。
49.在本发明应用较佳的实施方式中,单克隆抗体与dna聚合酶的混合比例为:每5u的dna聚合酶与0.1μg-0.5μg单克隆抗体的混合。
50.单克隆抗体与dna聚合酶的混合比例会影响单克隆抗体对于dna聚合酶的封闭效果。
51.在一种可选的实施方式中,单克隆抗体与dna聚合酶的混合比例为:每5u的dna聚合酶与0.3μg-0.5μg单克隆抗体的混合。在此混合比例下,dna聚合酶的活性基本被完全封闭,尤其是tth dna聚合酶的活性。
52.例如混合比例为0.3μg单克隆抗体/5u dna聚合酶,0.4μg单克隆抗体/5u dna聚合酶,0.5μg单克隆抗体/5u dna聚合酶。
53.上述混合比例释义如下:5u/μl的热启动酶中含0.3-0.5μg/μl的单克隆抗体混合,
也即单位体积的热启动酶中,5u dna聚合酶与0.3-0.5μg的单克隆抗体混合。
54.在一种可选的实施方式中,单克隆抗体与dna聚合酶的孵育是在25-37℃下进行。例如30-37℃下进行孵育。
55.在一种可选的实施方式中,孵育的时间为0.5-2h,例如孵育0.5h,1h,1.5h,2h。本发明提供的单克隆抗体在较短的孵育时间内达到对dna聚合酶较高的封闭效果。
56.第九方面,本发明还提供了一种热启动酶在聚合酶链式反应中的应用。包括不限于:pcr扩增、荧光定量pcr、数字pcr等。
57.第十方面,本发明还提供了一种杂交瘤细胞或单克隆抗体在制备热启动酶中的应用。
58.上述的单克隆抗体用于与dna聚合酶结合。
59.在一种可选的实施方式中,至少1种抗dna聚合酶的单克隆抗体与dna聚合酶结合。例如通过多种抗dna聚合酶的单克隆抗体与dna聚合酶结合以减少非特异性产物的产生,也均在本发明的保护范围之内。
60.第十一方面,本发明还提供了一种试剂或试剂盒,其包括上述的单克隆抗体或上述的热启动酶。
61.在一种可选的实施方式中,试剂盒为pcr扩增试剂盒。
62.在一种可选的实施方式中,上述试剂还包括稳定剂、缓冲剂等。例如包括聚乙烯醇、甘露醇等物质。
63.上述试剂或试剂盒包括不限于如下应用场景:用于检测侵染植物的病原体、侵染动物的病原体(如海关检疫)、目标基因的检测。
64.植物病原体检测例如来自植物细菌病害、植物真菌病害、植物土传病害和/或根结线虫病害,动物病原体检测例如检测人兽共患病、动物疫病或动物病虫害。
65.动物疫病来源于如下至少一种的病原体:动物布鲁氏菌、牛结核分枝杆菌、金黄色葡萄球菌、狂犬病毒、猪链球菌2型、炭疽芽胞杆菌、沙门氏菌、非洲猪瘟病毒、新冠病毒、流感病毒、hpv病毒、乙肝病毒、人免疫缺陷病毒、sars、mers、登革热病毒、禽流感、埃博拉和大肠杆菌。
66.本发明具有以下有益效果:(1)本发明提供的杂交瘤细胞及由此分泌的单克隆抗体,具有降低非特异性扩增的作用。
67.(2)杂交瘤细胞分泌的单克隆抗体能完全封闭dna聚合酶的活性,封闭后的热启动酶在高温下30s-10min的加热即可恢复dna聚合酶活性。
68.(3)相比于现有的热启动酶,该单克隆抗体修饰后的dna聚合酶具有更好的稳定性(尤其是热稳定性),显著延长了热启动酶的常温保存时间。
69.(4)杂交瘤细胞分泌的单克隆抗体无核酸酶活性残留,即无dna分解酶活性残留、无核酸外切酶活性残留和无核酸内切酶活性残留。
70.(5)杂交瘤细胞分泌的单克隆抗体可以对多种dna聚合酶保持良好的低温封闭效果和高温释放聚合活性效果,具有良好的普适性。
71.(6)获得的单克隆抗体的封闭活性好,低用量即可满足实验需求,相比于现有技术1ug单克隆抗体/5u dna聚合酶的封闭用量,本发明提供的单克隆抗体具有用量少,封闭活
性好的优势。
72.(7)本发明还提供了一种杂交瘤细胞以及单克隆抗体的制备方法,该制备方法优化了筛选策略,相较于单一的elisa检测血清效价的方法,新增了血清封闭酶活性的筛选,有助于大幅提升筛选获得的目标动物的精确性,从而增加了筛选到可完全封闭dna聚合酶活性的单克隆抗体的可能性。
附图说明
73.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
74.图1为腹水对tth dna聚合酶活性的封闭-启动检测结果;图2为纯化后的抗体的sds-page图;图3为抗体中dna酶残留活性检测电泳图;图4为抗体对tth dna聚合酶封闭活性检测结果图;图5为抗体对tth dna聚合酶封闭性能的热稳定性检测结果图;图6为热启动tth dna聚合酶在不同的启动时间下的启动检测结果图;图7为抗体修饰的tth dna聚合酶在qpcr体系中的功能应用检测结果图;图8为抗体对taq dna聚合酶封闭活性检测结果图;图9为抗体对taq dna聚合酶封闭性能的热稳定性检测结果图;图10为热启动taq dna聚合酶在不同的启动时间下的启动检测结果图;图11为抗体修饰的taq dna聚合酶的加速试验检测结果图。
具体实施方式
75.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
76.除非另外指明,否则实践本发明将采用细胞生物学、分子生物学(包含重组技术)、微生物学、生物化学和免疫学的常规技术,所述常规技术在本领域技术人员的能力范围内。文献中充分解释了这种技术,如《分子克隆:实验室手册(molecular cloning:a laboratory manual)》,第二版(sambrook等人,1989);《寡核苷酸合成(oligonucleotide synthesis)》(m.j.gait编,1984);《动物细胞培养(animal cell culture)》(r.i.freshney编,1987);《酶学方法(methods in enzymology)》(学术出版社有限公司(academic press,inc.);《实验免疫学手册(handbook of experimental immunology)》(d.m.weir和c.c.blackwell编);《哺乳动物细胞用基因转移载体(gene transfer vectors for mammalian cells)》(j.m.miller和m.p.calos编,1987);《当代分子生物学方法(current protocols in molecular biology)》(f.m.ausubel等人编,1987);《pcr:聚合酶链反应(pcr:the polymerase chain reaction)》(mullis等人编,1994);以及《当代免疫学方法
10:1的比例在不含血清的rpmi 1640培养基中混匀,1200rpm离心5min,弃上清;1200rpm离心1min,用移液器吸取残留rpmi 1640。用手指轻轻拍散细胞沉淀,将培养箱中孵育的50% peg 1ml和水浴锅中预热的盛有3/4容积的无菌水的烧杯取出,将离心管底部没入烧杯中的水;用剪过尖端的蓝枪头吸取1ml 50% peg,逐滴滴加到混合的骨髓瘤细胞和脾细胞中,边滴加边轻摇离心管,加完后轻轻吹吸混匀;加入终止液进行终止。终止反应结束后,1200rpm/min离心5min,弃上清。细胞沉淀用hat培养基重悬,混匀后加入培养皿中,铺板到96孔板中,100
µ
l/孔,共铺10个板;置于37℃,5% co2培养箱中培养。
90.(3)进行杂交瘤细胞筛选、克隆化。
91.由于融合早期的杂交瘤细胞很不稳定,易丧失抗体分泌能力,因此需尽早克隆化。显微镜下观察微孔板中细胞的生长状态,在融合后3天用hat培养基进行补液,融合后7天进行筛选,检测筛选的前一天用ht培养基进行全量换液。用免疫原最佳包被浓度(棋盘法摸索最佳包被浓度:0.25
µ
g/ml,包被体积50
µ
l)包被酶标板,采用间接elisa法检测细胞培养上清。筛选出od
450
nm值较高的阳性孔。
92.杂交瘤细胞克隆化:克隆化的前一天制备饲养细胞,克隆化采用有限稀释法。
93.第一次克隆化:ht培养基,5个细胞/孔,稀释、计数、铺板;第二次克隆化:20% fbs 1640培养基,3个细胞/孔,稀释、计数、铺板;第三次克隆化:20% fbs 1640培养基,1个细胞/孔。克隆化时,将96孔中的细胞吹起、稀释、计数、铺板。
94.每次克隆化后4天记录每个孔里细胞克隆的数量,着重标记单个克隆的进行筛选,克隆化后7天进行筛选,于前一天全量换液,用免疫原最佳包被浓度包被酶标板,采用间接elisa法检测细胞培养上清。
95.筛选出od
450
nm值较高的阳性单个克隆孔。将阳性单克隆再次克隆化,检测时所有克隆的孔均为阳性,该阳性单克隆孔稳定,进行扩培、冻存保种。最终,共获得180株阳性杂交瘤细胞。
96.(4)进行腹水小试制备-杂交瘤细胞的功能筛选。
97.将步骤(3)筛得的180株阳性杂交瘤细胞分批进行腹水小试制备,注射细胞前7-10天致敏小鼠,腹腔注射0.5ml液体石蜡;同天复苏细胞,补加饲养细胞(同步骤(2))调整细胞状态、用10cm细胞培养皿进行扩大培养;收集、离心细胞,用不含血清的1640 rpmi基础培养基进行重悬,细胞密度为1*107个/ml,每个杂交瘤细胞株注射3只小鼠,注射细胞悬液体积为:0.2ml,注射细胞量为:2*106个/只。5-7天后腹水增长,小鼠腹部紧绷时开始采集,采集到的腹水3000rpm离心10min,弃上层油脂和下层沉淀,取中间层,-20℃保存备用。腹水采集频率:每天,采集周期:7-10天,直至小鼠自然死亡。采集结束后,将同株细胞所制备的腹水整合到一起,进行鉴定。
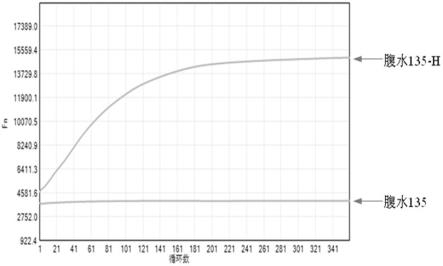
98.腹水鉴定:封闭-启动检测。用腹水修饰tth dna聚合酶,通过样品95℃启动5min后与未启动样品同时进行测试,对比来判断该腹水是否有封闭效果。如果样品启动后活性明显高于未启动时,则说明该腹水有封闭效果。每组样品的上样量均为10u。检测出腹水tt135可以完全封闭tth dna聚合酶活性,如图1。
99.腹水鉴定:亚型鉴定。通过商品化小鼠单克隆抗体亚型检测试剂盒鉴定腹水tt135中所含抗体的亚型,检测结果为igg1。
100.将杂交瘤细胞寄送保藏于广东省微生物菌种保藏中心,保藏地址为:广东省广州
市越秀区先烈中路100号大院实验大楼5楼微生物研究所菌种保藏中心,保藏编号为:gdmcc:62992,保藏日期为:2022年11月22日,保藏细胞名称为:杂交瘤细胞tta135。
101.实施例2本实施例进行抗体的纯化。
102.取实施例1中制备的腹水选择protein a亲和层析填料进行纯化:将腹水用偶联缓冲液(20 mm pbs磷酸钠缓冲液,ph 7.0)稀释,稀释比例为1:5,0.45
µ
m滤膜抽滤后;上样至提前平衡好的亲和纯化柱;洗涤液(20 mm pbs磷酸钠缓冲液,ph 7.0)洗除未结合的杂蛋白;洗脱液(50mm gly 70mm nacl缓冲液,ph 3.0)洗脱目的蛋白,加入中和液(1m tris-hcl缓冲液,ph9.0)调ph至中性,1*pbs透析后收集,所得抗体命名为tta135。tca-lowry法检测抗体浓度,sds-page检测抗体纯度,电泳结果如图2所示。
103.图2显示,纯化后的抗体纯度高,可以用于后续的检测实验。
104.实验例1抗体中dna酶残留活性检测。
105.通过将抗体与不同的dna共同孵育,体系配制如表1,然后进行电泳检测,观察其电泳谱带的变化,判断抗体是否有dna酶残留活性(分为dna分解酶,核酸外切酶,核酸内切酶活性)。
106.结果如图3,图3中泳道1为maker,泳道2、3、4为dna分解酶检测泳道,泳道5、6、7为核酸内切酶检测泳道,泳道8、9、10为核酸外切酶检测泳道,其中泳道2、3、5、6、8、9为抗体与dna混合孵育后的泳道,泳道4、7、10为阴性对照。结果显示,本发明制备的抗体无dna分解酶、核酸外切酶活性残留、核酸内切酶活性残留。
107.表1 反应体系配制表
酶残留检测项目检验体系与标准dna分解酶20μl反应体系中5μg抗体和0.2μgλdna37℃下反应16小时,琼脂糖凝胶电泳dna谱带不发生变化。核酸内切酶20μl反应体系中5μg抗体和0.2μgsupercoiledpuc18dna在37℃下反应16小时,琼脂糖凝胶电泳dna谱带不发生变化。核酸外切酶20μl反应体系中5μg抗体和0.2μghind
‑ⅲ
digestλdna在37℃下孵育16小时,琼脂糖凝胶电泳dna谱带不发生变化。
实验例2本实验例抗体对tth dna聚合酶活性的封闭-启动效果进行检测。
108.将tta135抗体与tth dna聚合酶以不同的比例混合,37℃孵育1h,使tta135抗体与tth dna聚合酶形成复合物,即热启动tth dna聚合酶。
109.抗体抗原混合比例如下:热启动的5u/μl tth dna聚合酶中的抗体浓度为0.1μg/μl,记为修饰度0.1的热启动tth dna聚合酶。
110.热启动的5u/μl tth dna聚合酶中的抗体浓度为0.2μg/μl,记为修饰度0.2的热启动tth dna聚合酶。
111.热启动的5u/μl tth dna聚合酶中的抗体浓度为0.3μg/μl,记为修饰度0.3的热启动tth dna聚合酶。
112.热启动的5u/μl tth dna聚合酶中的抗体浓度为0.4μg/μl,记为修饰度0.4的热启动tth dna聚合酶。
113.热启动的5u/μl tth dna聚合酶中的抗体浓度为0.5μg/μl,记为修饰度0.5的热启动tth dna聚合酶。
114.(1)封闭性能的检测:以分子信标作为模板和引物,以上所制备的热启动tth dna聚合酶为扩增聚合酶进行qpcr反应,阴性对照组以未修饰的tth dna聚合酶作为扩增聚合酶,空白对照组以h2o代替热启动tth dna聚合酶。qpcr反应体系配制表参照表2所示。
115.表2 qpcr反应体系配制表试剂加入量分子信标2.5μldntp(10mm)0.5μl10xbufferforqpcr2.0μl热启动(未修饰)tthdna聚合酶2.0μlh2o补至20μl反应程序为:40℃,5s,200个循环。
116.实验结果见图4,由图可知,阴性对照组能够正常扩增,说明反应体系与操作均正常;不同修饰度的热启动tth dna聚合酶具有不同的封闭效果,当修饰度为0.1-0.2时,tth dna聚合酶的活性大幅下降,说明修饰度为0.1-0.2时tth dna聚合酶的活性可以得到有效封闭;当修饰度大于0.3时其扩增线与阴性对照组相同,说明修饰度大于0.3时tth dna聚合酶的活性基本被完全封闭;空白对照组的荧光值即背景值。
117.(2)封闭性能的稳定性检测:选取修饰度0.3的热启动tth dna聚合酶,将此热启动tth dna聚合酶分别进行50℃/55℃/60℃ 1h的加热,加热后进行封闭性能检测(反应体系参照表2),阴性对照组以未修饰的tth dna聚合酶作为扩增聚合酶,空白对照组以h2o代替热启动tth dna聚合酶。
118.实验结果见图5,由图5可知,阴性对照组能够正常扩增,说明反应体系与操作均正常;经过不同温度加热过后的热启动tth dna聚合酶与未加热的扩增线基本相同,说明热启动酶的封闭效果在60℃以下是很稳定的;空白对照组的荧光值即背景值。
119.(3)热启动tth dna聚合酶的启动检测选取修饰度0.3的热启动tth dna聚合酶,将此热启动tth dna聚合酶在95℃条件下分别进行30s/1min/5min/10min的加热,加热后进行封闭性能检测(反应体系参照表2),阴性对照组以未修饰的tth dna聚合酶作为扩增聚合酶,空白对照组以h2o代替热启动tth dna聚合酶。
120.实验结果见图6,由图可知,阴性对照组能够正常扩增,说明反应体系与操作均正常;经过在95℃条件下分别进行30s/1min/5min/10min的加热,封闭的tth dna聚合酶的活性均得到恢复,且基本都能恢复到与阴性对照相当的活性,说明在95℃条件下进行30s以上的加热,热启动tth dna聚合酶的活性即可以恢复;空白对照组的荧光值即背景值。
121.实验例3抗体对tth dna聚合酶在qpcr体系中的功能应用检测。
122.以本发明制备的单克隆抗体tta135配制成qpcr扩增体系,检测该抗体对pcr效果的影响。基因组模板分组如表3,反应体系配制如表4,扩增程序:50℃,2min;95℃,5min;50cycles(95℃,10s;55℃,40s)。不同线条表示使用修饰度0.3的热启动tth dna聚合酶和不加修饰的tth dna聚合酶以不同用量的基因组为模板进行qpcr扩增的曲线图,且使用热
启动tth dna聚合酶和不加修饰的tth dna聚合酶都做了三个模板梯度。
123.结果如图7所示:在扩增体系中,经本发明制备的抗体tta135修饰的tth dna聚合酶的扩增效果明显优于未修饰的酶。
124.表3 基因组模板分组表
模板人基因组模板模板设置0.125ng/μl,2t;0.0125ng/μl,2t;0.00125ng/μl,4t。10μl/t程序50℃,2min;95℃,5min;50cycles(95℃,10s;55℃,40s)
表4 反应体系配制表试剂加入量dna四重引物探针0.5μldntp(16.67mm)0.3μlung(1u/μl)0.25μl12.5
×
bufferforqpcr2μl热启动(未修饰)tthdna聚合酶(5u/μl)0.25μlh2o补至15μl实验例4本实验例针对抗体对taq dna聚合酶活性的封闭-启动效果进行检测。
125.将tta135抗体与taq dna聚合酶以不同的比例混合,37℃孵育1h,使tta135抗体与taq dna聚合酶形成复合物,即热启动taq dna聚合酶。
126.抗体抗原混合比例如下:热启动的5u/μl taq dna聚合酶中的抗体浓度为0.1μg/μl,记为修饰度0.1的热启动taq dna聚合酶。
127.热启动的5u/μl taq dna聚合酶中的抗体浓度为0.2μg/μl,记为修饰度0.2的热启动taq dna聚合酶。
128.热启动的5u/μl taq dna聚合酶中的抗体浓度为0.3μg/μl,记为修饰度0.3的热启动taq dna聚合酶。
129.热启动的5u/μl taq dna聚合酶中的抗体浓度为0.4μg/μl,记为修饰度0.4的热启动taq dna聚合酶。
130.热启动的5u/μl taq dna聚合酶中的抗体浓度为0.5μg/μl,记为修饰度0.5的热启动taq dna聚合酶。
131.(1)封闭性能的检测:以分子信标作为模板和引物,以上所制备的热启动taq dna聚合酶为扩增聚合酶进行qpcr反应,阴性对照组以未修饰的taq dna聚合酶作为扩增聚合酶,空白对照组以h2o代替热启动taq dna聚合酶。qpcr反应体系配制表参照表5所示。
132.表5 qpcr反应体系配制表试剂加入量分子信标2.5μldntp(10mm)0.5μl10xbufferforqpcr2.0μl
热启动(未修饰)taqdna聚合酶2.0μlh2o补至20μl反应程序为:40℃,5s,200个循环。
133.实验结果见图8,由图可知,阴性对照组能够正常扩增,说明反应体系与操作均正常;不同修饰度的热启动taq dna聚合酶具有不同的封闭效果,当修饰度为0.1-0.2时,taq dna聚合酶的活性大幅下降,说明修饰度为0.1-0.2时taq dna聚合酶的活性可以得到有效封闭;当修饰度大于0.3时其扩增线与阴性对照组相同,说明修饰度大于0.3时taq dna聚合酶的活性基本被完全封闭;空白对照组的荧光值即背景值。
134.(2)封闭性能的稳定性检测:选取修饰度0.3的热启动taq dna聚合酶,将此热启动taq dna聚合酶分别进行50℃/55℃/60℃ 1h的加热,加热后进行封闭性能检测(反应体系参照表5),阴性对照组以未修饰的taq dna聚合酶作为扩增聚合酶,空白对照组以h2o代替热启动taq dna聚合酶。
135.实验结果见图9,由图可知,阴性对照组能够正常扩增,说明反应体系与操作均正常;经过不同温度加热过后的热启动taq dna聚合酶与未加热的扩增线基本相同,说明热启动酶的封闭效果在60℃以下是很稳定的;空白对照组的荧光值即背景值。
136.(3)热启动taq dna聚合酶的启动检测选取修饰度0.3的热启动taq dna聚合酶,将此热启动taq dna聚合酶在95℃条件下分别进行30s/1min/5min/10min的加热,加热后进行封闭性能检测(反应体系参照表5),阴性对照组以未修饰的taq dna聚合酶作为扩增聚合酶,空白对照组以h2o代替热启动taq dna聚合酶。
137.实验结果见图10,由图可知,阴性对照组能够正常扩增,说明反应体系与操作均正常;经过在95℃条件下分别进行30s/1min/5min/10min的加热,封闭的taq dna聚合酶的活性均得到恢复,且基本都能恢复到与阴性对照相当的活性,说明在95℃条件下进行30s以上的加热,热启动taq dna聚合酶的活性即可以恢复;空白对照组的荧光值即背景值。
138.实施例5抗体对taq dna聚合酶在pcr体系中的功能应用检测。
139.以本发明制备的单克隆抗体tta135配制成pcr扩增体系,检测该抗体修饰taq dna聚合酶对pcr扩增效果的影响,并对比市场同类产品。测试方法(单管稳定性测试):将pcr反应buffer、扩增酶和引物探针等组分,配制成单管试剂,混匀,37℃放置15天后,以-20℃保存的对应反应体系单管为对照,比较加速后的单管试剂的扩增性能。扩增体系配制表如表6。扩增程序:50℃,2min;95℃,5min;50cycles(95℃,10s;55℃,40s)。
140.结果如图11所示:在扩增体系中,市场同类产品toyobo hot start rtaq dna polymerase(tap-211)修饰的taq酶配制体系单管经37℃加速15d在vic通道扩增的rn值下降超50%,且ct值滞后,本发明制备的抗体tta135修饰的taq酶配制体系单管稳定性明显优于市场同类产品。
141.表6 扩增体系配置表体系2
×
robustartpremix-ung(probeqpcr)模板hbv-mln纯模板模板设置1e4iu/ml,2t;1e3iu/ml,2t;50iu/ml,4t。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。