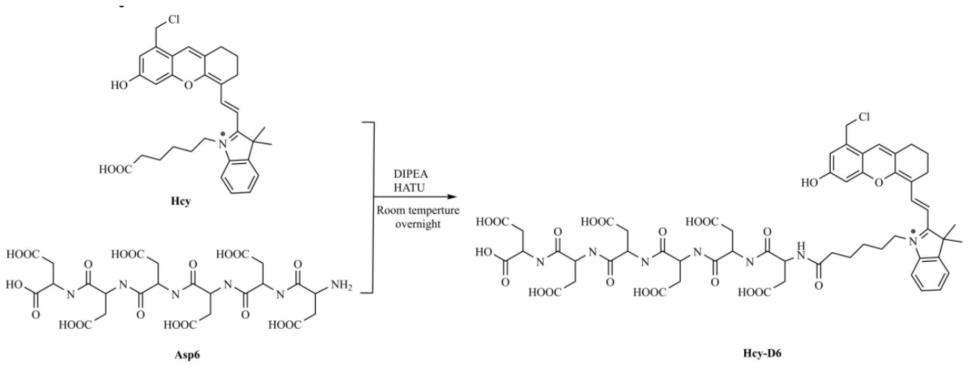
基因、表达载体、菌株及在提高头孢菌素c产量中的应用
技术领域
1.本发明涉及基因工程技术领域,更具体地说是涉及基因、表达载体、菌株及在提高头孢菌素c产量中的应用。
背景技术:
2.目前,人们通过几十年的研究已基本阐明青霉素、头霉素c和头孢菌素c等β-内酰胺类抗生素生物合成途径中关键基因及其编码产物参与的酶催化反应途径。尤其是近年来,上述β-内酰胺类抗生素生产菌株展黄青霉(penicillium chrysogenum)、棒状链霉菌(streptomyces clavuligerus)和产黄支顶孢霉(acremonium chrysogenum)全基因组序列测序的完成,以及其生产菌株转录组、蛋白质组和代谢组等系统生物学工作的完成,极大地促进了人们对上述β-内酰胺类抗生素生物合成及其调控的认知。青霉素、头霉素c和头孢菌素c均属于典型的非核糖体肽类化合物,参与其合成的前体均包括l-α-氨基己二酸(l-α-aminoadipic acid,l-α-aaa)、l-半胱氨酸和l-缬氨酸。这3个前体氨基酸在atp的存在下由acv合成酶(acvs)催化缩合形成δ-(l-氨基己二酰)-l-半胱氨酰-d-缬氨酸(lld-acv)三肽,接着在环化酶作用下acv三肽环化形成异青霉素n(ipn)。
3.青霉素、头霉素c和头孢菌素c等β-内酰胺类抗生素的合成与前体物质供应有关。通过提升细胞内l-α-aaa、l-半胱氨酸和l-缬氨酸的含量能够显著增加头霉素c、头孢菌素c等β-内酰胺类抗生素的产量。研究表明,产黄支顶孢霉细胞内l-α-aaa的浓度与头孢菌素c的产量直接相关,增加l-α-aaa前体的供应能够增加头孢菌素c的合成速率。
4.不同于细菌,真菌中的l-α-aaa是由α-酮戊二酸与乙酰辅酶a缩合,并经过高柠檬酸、同型乌头酸、高异柠檬酸、酮己二酸途径形成的,是形成l-赖氨酸的中间代谢产物。早在上世纪六十年代,科学家们便已证明α-酮戊二酸是形成l-α-氨基己二酸的前体物质。后续又进一步证明α-酮戊二酸还是cpc生物合成途径中另外一个重要的酶-去乙酰氧基头孢菌素c合成酶(扩环酶)催化五元噻唑环扩环生成六元噻嗪环时的重要辅因子。已有研究表明通过添加α-酮戊二酸能够有效提高头霉素c和头孢菌素c产量。
5.α-酮戊二酸(α-kg)是三羧酸循环(tca)和氨基酸代谢中重要的二元羧酸。在细胞胞内,异柠檬酸在异柠檬酸脱氢酶的作用下氧化脱羧,再由α-酮戊二酸脱氢酶的作用被氧化成为琥珀酰coa。α-酮戊二酸也可通过谷氨酸脱氢酶使l-谷氨酸脱氨生成,是谷氨酸、琥珀酸以及杂环类化合物的前体,在生物有机体的代谢中起着重要的作用。
6.自20世纪70年代,jurtshuk等人在从事维涅兰德固氮菌的研究中,发现了一种能氧化底物谷氨酸的酶,命名为l-谷氨酸氧化酶(l-glutamate oxidase,glod)。l-谷氨酸氧化酶是一种以黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,fad)为辅基的黄素蛋白酶类,能在不添加外源性辅助因子的条件下专一性地氧化l-谷氨酸生成过氧化氢、氨和α-酮戊二酸。l-谷氨酸氧化酶主要存在于链霉菌中,不仅对反应底物具有高特异性和高亲和力,而且反应条件温和、催化效率高,因此在食品、工业发酵及医药行业有广泛的应用。该酶自20世纪80年代发现以来,一直是国内外的研究热点,是潜在的工具酶之一。然而,l-谷
氨酸氧化酶作为一种较新的实用工具酶,目前尚未有关于该酶异源表达对β-内酰胺类抗生素等次级代谢产物产量研究的报道,另外其在头孢菌素c等生产菌株中的作用机制及应用研究也罕见报道。
7.适当地向产青霉素、头霉素c和头孢菌素c菌种发酵培养基中适当添加α-酮戊二酸能够明显提升上述β-内酰胺类抗生素的产量,然而在实际工业化生产中,向发酵培养基中额外添加α-酮戊二酸是十分不经济的。因此,需要开发一种能够使生产菌种在发酵过程中自主生产α-酮戊二酸作为前体物质的菌种改造策略。通过向头孢菌素c生产菌种中过表达异源的l-谷氨酸氧化酶,能够有效提高产黄支顶孢霉的头孢菌素c的产量。
8.因此,如何提供一种可以过表达异源的l-谷氨酸氧化酶的基因、载体和菌株是本领域技术人员亟需解决的问题。
技术实现要素:
9.有鉴于此,本发明提供了一种过表达异源的l-谷氨酸氧化酶的基因、载体和菌株,并以构建得到的菌株发酵产头孢菌素c,提高了头孢菌素c的产量。
10.为了实现上述目的,本发明采用如下技术方案:
11.一种过表达外源l-谷氨酸氢化酶的基因,基因命名为kclgox*,其特征在于,核苷酸序列如seq id no.3所示。
12.作为上述技术方案优选的技术方案,所述基因由野生型基因经过密码子优化得到,其中,野生型基因的核苷酸序列如seq id no.1所示;蛋白序列如seq id no.2所示。
13.作为上述技术方案优选的技术方案,所述密码子优化为丙氨酸密码子序列优化为ttc、半胱氨酸密码子序列优化为tgc、天冬氨酸密码子序列优化为gac、谷氨酸密码子序列优化为gag、苯丙氨酸密码子序列优化为ttc、甘氨酸密码子序列优化为ggc、组氨酸密码子序列优化为cac、异亮氨酸密码子序列优化为atc、赖氨酸密码子序列优化为aag、亮氨酸密码子序列优化为ctc、天冬酰胺密码子序列优化为aac、脯氨酸密码子序列优化为ccc、谷氨酰胺密码子序列优化为cag、精氨酸密码子序列优化为cgc、丝氨酸密码子序列优化为agc、苏氨酸密码子序列优化为acc、缬氨酸密码子序列优化为gtc、酪氨酸密码子序列优化为taa。
14.作为与上述技术方案相同的发明构思,本发明还请求保护一种过表达外源l-谷氨酸氢化酶基因的表达载体,所述表达载体为pbargpe1-pacgapdh-kclgox*。
15.作为上述技术方案优选的技术方案,由pacgapdh启动子和pbargpe1-hygro线性片段连接后形成pbargpe1-pacgapdh质粒,然后将kclgox*基因和pbargpe1-pacgapdh线性片段连接,获得pbargpe1-pacgapdh-kclgox*。
16.作为与上述技术方案相同的发明构思,本发明还请求保护所述的表达载体在构建高产头孢菌素c菌株中的应用。
17.作为与上述技术方案相同的发明构思,本发明还请求保护一种高产头孢菌素c的菌株,其特征在于,所述菌株由pbargpe1-pacgapdh-kclgox*转化至产黄枝顶孢霉菌中获得。
18.作为与上述技术方案相同的发明构思,本发明还请求保护所述的菌株在发酵高产头孢菌素c中的应用。
附图说明
19.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
20.图1附图为pbargpe1-hygro质粒经bamhi-bglii双酶切片段、pbargpe1-hygro环状质粒、pacgapdh启动子的电泳图;m:d15000 marker;line1:pbargpe1-hygro质粒经bamhi-bglii双酶切片段;line2:pbargpe1-hygro环状质粒;line3:pacgapdh启动子pcr扩增片段
21.图2附图为kclgox*基因;pbargpe1-pacgapdh bamhi单酶切后的线性质粒、单酶切前的pbargpe1-pacgapdh环状质粒、pbargpe1-hygro环状质粒电泳图;m:d15000 marker;line1:kclgox*基因;line2:pbargpe1-pacgapdh bamhi单酶切后的线性质粒;line3:单酶切前的pbargpe1-pacgapdh环状质粒;line4:pbargpe1-hygro环状质粒;
22.图3附图为pbargpe1-pacgapdh-kclgox*环状质粒、pbargpe1-pacgapdh环状质粒电泳图;其中,m:d15000 marker;l1~l20:pbargpe1-pacgapdh-kclgox*环状质粒;l21:pbargpe1-pacgapdh环状质粒;
23.图4附图为pbargpe1-pacgapdh-kclgox*质粒构建的完整程序图;
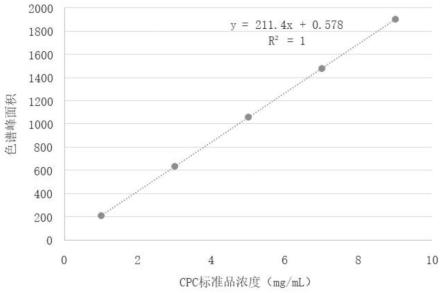
24.图5附图为hplc测定头孢菌素c(cpc)标准曲线图;
25.图6附图为cgmcc3.3795-pbargpe1-kclgox*、cgmcc3.3795-pbargpe1和野生型菌株cgmcc3.3795头孢菌素c(cpc)典型hplc色谱图比较图。
具体实施方式
26.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
27.实施例中用到的样品和来源:
28.菌株和质粒:大肠杆菌e.coli dh5α(购自日本takara);用于过表达谷氨酸氧化酶基因的菌株为产黄枝顶孢霉(acremonium chrysogenum)cgmcc 3.3795,收藏于中国普通微生物菌种保藏管理中心(china general microbiological culture collection center,cgmcc)。质粒pbargpe1-hygro为通用型丝状真菌整合型基因过表达质粒,购自淼灵质粒平台(货号:p0381)。质粒pbargpe1-pacgapdh和pbargpe1-pacgapdh-kclgox*的构建操作方法请参考文献(张丕燕等,产黄枝顶孢霉pcb ab-pcbc双向启动子区域的克隆与应用[j],微生物学报,2004,44(2):255-257;宋佳.黑曲霉ras基因功能的初步探究[d].哈尔滨工业大学,2018)。
[0029]
酶和试剂:限制性内切酶bamhi(酶切位点:5
’‑g↑
gatcc-3’)、限制性内切酶bgl ii(酶切位点:5
’‑a↑
gatct-3’)、primestar高保真酶、mighty mix连接酶、克隆用载体pet-30a( )、dl 2000dna marker、primescript rt reagent kit、sybrpremix ex taq等均购自takara公司,uniq-10柱式trizol总rna提取试剂盒、dnase i、rnase inhibitor等购自生工生物工程(上海)有限公司,lysing enzymes from trichoderma harzianum购自sigma,大
量质粒抽提试剂盒购自mn公司,d7010m型seamless cloning kit无缝克隆试剂盒购自上海碧云天生物技术有限公司,真菌基因组dna提取试剂盒购自北京索莱宝科技有限公司,cpc标准品(98%纯度)购自焦作健康元生物制品有限公司。
[0030]
lb培养基:胰蛋白胨10g/l,酵母提取物5g/l,nacl 10g/l,ph=7.4。
[0031]
pda培养基:马铃薯200g/l,葡萄糖20g/l,琼脂15g/l,121℃30min灭菌处理。
[0032]
cpc种子培养基:葡萄糖5g/l,蔗糖35g/l,玉米浆10ml/l,硫酸铵8g/l,dl-甲硫氨酸0.5g/l,碳酸钙5g/l,豆油5ml/l。
[0033]
cpc发酵培养基:淀粉30g/l,糊精60g/l,α-淀粉酶0.2g/l,玉米浆10ml/l,dl-甲硫氨酸6g/l,尿素2g/l,硫酸铵11g/l,硫酸镁(mgso4·
7h2o)3g/l,磷酸氢二钾9g/l,碳酸钙5g/l,豆油5ml/l。
[0034]
实施例1基因组dna的提取及测序
[0035]
采用北京索莱宝科技有限公司生产的d2300-50型真菌基因组dna提取试剂盒对产黄枝顶头孢霉ac-j-001(上述微生物及其基因组样品均由焦作健康元生物制品有限公司提供)基因组总dna进行提取。取培养至对数生长期产黄枝顶头孢霉ac-j-001的菌丝体约100mg,用玻璃研磨器加液氮适当研磨分散的菌丝体,加200μl基因组dna提取试剂盒中提供的溶液a,加入20μl试剂盒配备的rnasea,再加入100mg结晶无菌玻璃珠,在高速振荡器上振荡约30min,然后按照试剂盒提供的步骤提取上述微生物总基因组dna。
[0036]
提取后符合测序标准的基因组dna由广东美格基因科技有限公司进行测序和分析,留取约50ng基因组样品作为后续目标基因扩增的模板。基因组测序分析结果表明,产黄枝顶头孢霉ac-j-001的基因组约为28.95mbp。
[0037]
实施例2外源l-谷氨酸氧化酶基因的获得
[0038]
通过文献调研及ncbi数据库下载和分析,对齐远山北里孢菌(kitasatospora cheerisanensis)kctc 2395基因组注释文件及蛋白预测文件进行blast比对分析,确定其基因组上含有l-谷氨酸氧化酶基因,命名为kclgox。该基因野生型dna长度为1731bp(基因组位置:jnby01000141.1:48966-50696),本发明中序列为seq id no.1,其合成由576个氨基酸残基组成的l-谷氨酸氧化酶(蛋白序列号:kdn81488.1)蛋白序列seq id no.2。
[0039]
为了该基因序列更高效地在产黄支顶孢霉cgmcc 3.3795中表达,本发明发明人对其链霉菌中的野生型dna进行了密码子优化。本实施例中,丙氨酸密码子序列优化为ttc、半胱氨酸密码子序列优化为tgc、天冬氨酸密码子序列优化为gac、谷氨酸密码子序列优化为gag、苯丙氨酸密码子序列优化为ttc、甘氨酸密码子序列优化为ggc、组氨酸密码子序列优化为cac、异亮氨酸密码子序列优化为atc、赖氨酸密码子序列优化为aag、亮氨酸密码子序列优化为ctc、天冬酰胺密码子序列优化为aac、脯氨酸密码子序列优化为ccc、谷氨酰胺密码子序列优化为cag、精氨酸密码子序列优化为cgc、丝氨酸密码子序列优化为agc、苏氨酸密码子序列优化为acc、缬氨酸密码子序列优化为gtc、酪氨酸密码子序列优化为taa。优化后的基因序列命名为kclgox*,序列为seq id no.3。
[0040]
实施例3pbargpe1-hygro质粒启动子改造
[0041]
为了提高外源基因在产黄支顶孢霉基因组上的表达效率,本发明发明人特将pbargpe1-hygro质粒上的gpda启动子改造为与宿主菌同源性更高的pacgapdh启动子。发明人设计引物acgu(seq id no.4)/acgd(seq id no.5),以产黄支顶孢霉ac-j-001基因组为
模板扩增pacgapdh启动子片段。该启动子序列为seq id no.6,共2068bp。上述pcr反应体系为:2
×
max master mix,25μl;引物acgu,0.1μl;引物acgd,0.1μl;ac-j-001gdna,1μl;ddh2o,up to 50μl。pcr反应条件为:预变性98℃
×
3min,1次循环;变性98℃
×
10s,退火58℃
×
15s,延伸72℃
×
2min,34次循环;终延伸72℃
×
5min,1次循环。pcr扩增产物pacgapdh进行琼脂糖凝胶电泳(如图1),对扩增片段进行回收,备用。
[0042]
将纯化得到的pbargpe1-hygro质粒进行bam hi、bgl ii双酶切,制备线性化质粒载体,反应体系为:pbargpe1-hygro环状质粒,80μl;bam hi,8μl;bgl ii,8μl;10
×
buffer,20μl;ddh2o,up to 200μl。上述酶切体系放置37℃水浴中一夜后进行琼脂糖凝胶电泳,然后对电泳条带进行切胶回收。
[0043]
上述回收得到的pacgapdh启动子和pbargpe1-hygro线性片段用重组酶体系连接至bamhi和bglii酶切位点之间,形成新的环状质粒,命名为pbargpe1-pacgapdh(如图1所示)。重组酶连接体系包括:pacgapdh启动子序列,10~100ng;线性化质粒载体,50~100ng;2x seamless cloning mix,10μl;ddh2o,up to 200μl;每个插入片段与载体的摩尔比=3:1。上述重组酶连接体系在50℃水浴孵育15min后,42℃水浴中热激90s转化至大肠杆菌dh5α感受态细胞中,热激后迅速置于冰上冷却3~5min。向管中加入1ml的lb液体培养基(不含amp),混匀后37℃培养1h。将上述菌液摇匀后取100μl涂布于含有50μg/ml amp的抗性筛选平板上,正面向上放置30min,待菌液完全被培养基吸收后倒置培养皿,37℃培养16~24h。平板培养结束后,挑取单菌落转接5ml含50μg/ml amp抗性的lb液体培养基,37℃条件下200rpm过夜振荡培养后挑单扩培提质粒验证,连接好的环状质粒转化大肠杆菌dh5α后提取质粒并进行测序验证。
[0044]
实施例4l-谷氨酸氧化酶基因过表达质粒载体pbargpe1-pacgapdh-kclgox*的构建
[0045]
本实施例委托常州基宇生物科技有限公司对质粒dna进行全基因合成,将seq id no.3所示的经密码子优化后的l-谷氨酸氧化酶(l-gox)编码基因kclgox*插入大肠杆菌pet-30a( )载体中ndei/xhoi位点间得到的质粒,该质粒命名为pet30a-kclgox*,用于后续操作作为扩增l-谷氨酸氧化酶蛋白基因的dna模板。
[0046]
设计一对引物kcgou(seq id no.7)/kcgod(seq id no.8),以pet30a-kclgox*质粒为模板,pcr扩增l-谷氨酸氧化酶编码基因片段。上述pcr反应体系为:max master mix,25μl;引物kcgou,0.1μl;引物kcgod,0.1μl;pet30a-kclgox质粒dna,1μl;ddh2o,up to 50μl。pcr反应条件为:预变性98℃
×
3min,1次循环;变性98℃
×
10s,退火57℃
×
15s,延伸72℃
×
2min,34次循环;终延伸72℃
×
5min,1次循环。pcr反应结束后对反应产物进行回收(如图2所示)。
[0047]
上述回收得到的kclgox*基因和pbargpe1-pacgapdh线性片段(如图2所示)利用重组酶连至pbargpe1-pacgapdh载体bamhi位点,构建出产黄支顶孢霉外源l-谷氨酸氧化酶(lgox)编码基因kclgox*基因整合型过表达质粒,命名为pbargpe1-pacgapdh-kclgox*。重组酶连接体系包括:kclgox*基因片段,10~100ng;线性化pbargpe1-pacgapdh质粒载体,50~100ng;2x seamless cloning mix,10μl;ddh2o,up to 200μl;每个插入片段与载体的摩尔比=3:1。
[0048]
上述重组酶连接体系在50℃水浴孵育15min后,42℃水浴中热激90s转化至大肠杆
菌dh5α感受态细胞中,热激后迅速置于冰上冷却3~5min。向管中加入1ml的lb液体培养基(不含amp),混匀后37℃培养1h。将上述菌液摇匀后取100μl涂布于含有50μg/ml amp的抗性筛选平板上,正面向上放置30min,待菌液完全被培养基吸收后倒置培养皿,37℃培养16~24h。平板培养结束后,挑取单菌落转接5ml含50μg/ml amp抗性的lb液体培养基,37℃条件下200rpm过夜振荡培养后挑单扩培提质粒验证,连接好的环状质粒转化大肠杆菌dh5α后提取质粒并进行测序验证。验证后确定该质粒为pbargpe1-pacgapdh-kclgox*(如图3所示),质粒构建的完整程序如图4所示。
[0049]
实施例5过表达异源l-谷氨酸氧化酶基因lgox的产黄枝顶孢霉菌株构建产黄枝顶孢霉cgmcc 3.3795菌丝体的培养和原生质体制备:
[0050]
(1)从培养斜面上刮下适量产黄枝顶孢霉菌cgmcc 3.3795孢子,分别接种于100ml yps液体培养基(葡萄糖20g/l,酵母提取物5g/l,聚胨10g/l,mgso4·
7h2o 1g/l,k2hpo4·
3h2o 1.3g/l,ph=7.0)中,28℃、230rpm振荡培养4~5d;
[0051]
(2)培养结束后,以8000rpm转速离心15min收集菌丝体,离心弃上清后用无菌水洗涤一次;
[0052]
(3)0.22μm无菌滤膜过滤50ml的二硫苏糖醇(dtt,5mmol/l)溶液,30℃、150rpm振荡孵育40~60min;
[0053]
(4)孵育结束后以8000rpm转速离心5min,用p buffer(kcl 44.7g/l,mgcl2·
6h2o 2.03g/l,cacl22.78g/l)常温洗涤2次;
[0054]
(5)加入经0.22μm无菌滤膜过滤的60ml lysing酶解液(p buffer配制,10mg/ml),30℃、150rpm振荡孵育3~4h;
[0055]
(6)对酶解后的原生质体细胞悬液进行镜检,当视野中大部分菌丝体释放出原生质体后,加入4倍体积的p buffer,用灭菌的装填脱脂棉的针筒过滤除去残留的菌丝体;
[0056]
(7)3000rpm离心5min,p buffer洗涤2次,将原生质体悬浮于适量pbuffer中,使原生质体浓度》108cfu/ml;
[0057]
(8)将产黄枝顶孢霉菌cgmcc 3.3795的原生质体分装于1.5ml离心管中,每管100μl。
[0058]
实施例6pbargpe1-pacgapdh-kclgox*质粒转化产黄枝顶孢霉原生质体及鉴定
[0059]
采用peg-cacl2介导的原生质体转化法将构建的质粒pbargpe1-pacgapdh-kclgox*和空质粒载体pbargpe1-pacgapdh分别转化制备好的产黄枝顶头孢霉cgmcc 3.3795原生质体。实验步骤如下:
[0060]
(1)加入10μg的质粒dna,轻轻混匀,冰浴30min;
[0061]
(2)加入900μl 30%的peg4000/cacl2溶液,25℃孵育15min。
[0062]
(3)6000rpm
×
5min,尽量吸出peg4000溶液,用p buffer洗涤1次;
[0063]
(4)将上述实施例三中制备得到的原生质体分别重悬于100μl的p buffer中,加入于45℃保温的上层软琼脂培养基中,于旋涡振荡器上轻轻振荡混匀,然后倾倒在再生平板上,迅速转动平板使软琼脂均匀覆盖在下层培养基表面;于28℃培养36h,覆盖含有潮霉素的nacl软琼脂,使平板中潮霉素终浓度为5μg/ml,软琼脂凝固后,于28℃培养;
[0064]
(5)培养7d后分别挑取两种菌株博来霉素抗性转化子斜面培养,7d后提取基因组dna进行pcr验证。
[0065]
pcr验证正确后的突变菌株命名为cgmcc 3.3795-pacgapdh-kclgox*和阴性对照菌株cgmcc 3.3795-pacgapdh。
[0066]
实施例7产黄枝顶孢霉的发酵和发酵产物cpc的检测
[0067]
本实施例中的三角瓶的规格均为500ml,三角瓶底部带有弹簧圈,每个实验菌株有三个摇瓶重复。
[0068]
从培养10d的斜面上刮下适量产黄枝顶孢霉孢子,以野生型出发菌株cgmcc 3.3795为对照,含转化子的菌株为实验组。其中转化子1为转化有空质粒pbargpe1-pacgapdh的产黄枝顶孢霉菌菌株cgmcc 3.3795-pacgapdh,转化子2为转化有外源l-谷氨酸氧化酶基因过表达质粒pbargpe1-pacgapdh-kclgox*的产黄枝顶头孢霉菌菌株cgmcc3.3795-pbargpe1-kclgox*,分别接种于装有30ml种子培养基的500ml摇瓶中,于旋转式振荡摇床培养3d,转速为230rpmn,温度28℃。再以10%(v/v)的接种量转接至装量为30ml发酵培养基的250ml摇瓶中,25℃,230rpm,培养7d。
[0069]
cpc标准品制备及标准曲线测定:
①
精密称取纯度为98%的cpc标准品20mg,转移至100ml容量瓶中,加超纯水超声使溶解,并定容至刻度;
②
分别配制成2、4、6、8、10mg/ml的标准样品溶液;
③
分别对上述浓度标准品溶液进行hplc检测,每个浓度进样3次,对色谱峰面积均值绘制标准曲线。本实施例中标准品溶液需现配现用,cpc测定的标准曲线见图5所示。
[0070]
样品预处理方法:
①
使用中速定量滤纸过滤发酵液至50ml洁净的小烧杯中;
②
在2ml离心管中加入990μl去离子水;
③
吸取10μl过滤液加入上述离心管中;
④
旋涡混匀;
⑤
使用0.22μm过滤器过滤至样品瓶中,4℃放置待检测(24h内检测完毕)。
[0071]
高效液相色谱检测方法:使用的是美国agilent 1260型hplc检测器,c18反相色谱柱,柱温40℃,流动相为10mmol/l乙酸钠溶液:乙腈=99:1,进样量10μl,流速为1.0ml/min,压力上限280bar,分析时间10min,柱温箱30℃,检测波长为254nm,分析时间9min。根据峰面积和标准品的有效含量计算出样品中cpc含量。
[0072]
cpc样品浓度计算方法:
[0073][0074]
图6为野生型菌株cgmcc3.3795、阴性对照cgmcc3.3795-pbargpe1和突变菌株cgmcc3.3795-pbargpe1-kclgox*的发酵结束后cpc产量的hplc测定比较图;检测结果为,野生型出发对照菌株cgmcc3.3795的cpc产量为3196.3
±
77.8mg/l,转有空质粒pbargpe1-pacgapdh转化子的突变型对照菌株cgmcc3.3795-pbargpe1-pacgapdh的cpc产量为3008
±
214.3mg/ml,转化有外源l-谷氨酸氧化酶基因过表达质粒pbargpe1-pacgapdh-kclgox*转化子的突变型菌株cgmcc3.3795-pbargpe1-kclgox*的cpc产量为4182.7
±
238.9mg/ml。对数据进行统计分析后可知,野生型菌株cgmcc3.3795与转有空质粒pbargpe1-pacgapdh的阴性对照菌株cgmcc3.3795-pbargpe1-pacgapdh的cpc产量无显著性差异,而与转有l-谷氨酸氧化酶基因过表达质粒pbargpe1-pacgapdh-kclgox*的实验突变菌株cgmcc3.3795-pacgapdh-kclgox*有显著性差异(p=0.012);转有空质粒pbargpe1-pacgapdh的对照菌株cgmcc3.3795-pbargpe1-pacgapdh与转有l-谷氨酸氧化酶基因过表达质粒pbargpe1-pacgapdh-kclgox*的实验突变菌株cgmcc3.3795-pbargpe1-kclgox*之间同样有显著性差
异(p=0.024)。与野生型相比,过表达l-谷氨酸氧化酶kclgox*的产黄支顶孢霉cpc产量提高30.8%。
[0075]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0076]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。