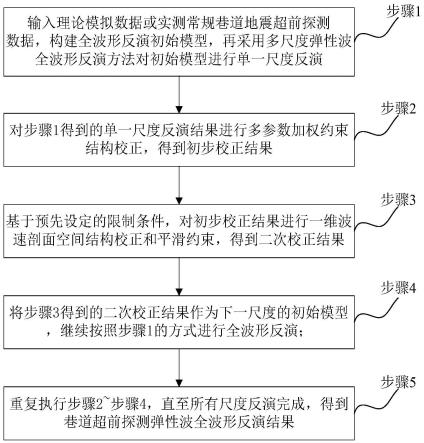
复合材料的免疫传感器。
7.本发明优选的,所述au颗粒的载量至少达到复合材料重量的0.3%。
8.本发明优选的,所述au颗粒的直径为0.234nm,tio2的直径为0.350nm。
9.本发明优选的,au颗粒复合到tio2纳米粒子的表面的方法是为:将tio2纳米粒子分散于溶液中,利用nabh4将haucl4还原并包覆在tio2纳米粒子表面。
10.本发明优选的,所述tio2纳米粒子的分散溶液为体积比为90:10的甲醇与乙醇混合液;所述haucl4或nabh4的溶解于体积比为90:10的甲醇与乙醇混合液中。
11.本发明优选的,所述haucl4或nabh4溶解后浓度为2.5-25mm;所述tio2纳米粒子米粒子的浓度为5.45-6.00mg/ml。
12.本发明优选的,所述抗体为异常凝血酶原单克隆抗体。
13.2、所述基于cys/au@tio2复合材料的免疫传感器在检测生物标志物中的应用,所述生物标志物为抗体特异识别物。
14.本发明优选的,所述生物标志物为异常凝血酶原。
15.3、含有所述免疫传感器的检测平台,还包括碳对电极和银参比电极,所述免疫传感器为工作电极。
16.本发明的有益效果在于:本发明公开了基于cys/au@tio2复合材料的免疫传感器,利用 cys/au@tio2复合物作为信号放大器,可以使用丝网电极,是一种超灵敏的免疫传感器。首先将tio2纳米粒子分散于溶液中,通过化学还原法,利用nabh4将haucl4还原并包覆在tio2纳米粒子表面,形成复合物。然后在通过半胱氨酸的自组装形成cys/au@tio2。最后通过共价键将异常凝血酶原单克隆抗体与复合物表面的氨基相结合。传感机理在于利用复合物吸附的异常凝血酶原单克隆抗体与其抗原的特异性结合引起的传感器的电流发生的变化进行检查。该cys/au@tio2复合物修饰的免疫传感器对异常凝血酶原抗原的检测极限为0.77pg/ml,检测范围为1pg/ml~10ng/ml。通过检测甲胎蛋白和抗缪勒试管激素表明该生物传感器具有良好的特异性。并通过使用同一批次的不同电极来验证该方法的稳定性。因此,该免疫传感器具有应用于异常凝血酶原的快速和早期检测的潜力,基于该原理也适用于检测其他蛋白。
附图说明
17.为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
18.图1为xrd和sem图(a:xrd图;b,c:au@tio2的sem形貌图);
19.图2为tem图(a,b:au@tio2的tem图:c,d,e,fau@tio2的元素分布图);
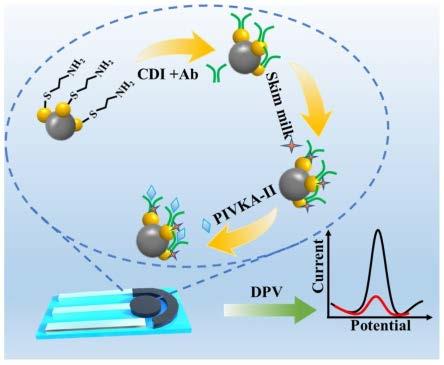
20.图3为传感器合成过程及检测原理图;
21.图4为电化学表征结果(a:循环伏安法;a:裸电极;b:修饰au@tio2;c:修饰 cys/au@tio2;d:ab固定;e:脱脂奶粉封闭;f:抗原-抗体反应;b:最佳反应时间优化);
22.图5为灵敏度检测结果(a:浓度与电流的关系;b:拟合曲线);
23.图6为特异性和稳定性结果(a:特异性;b:稳定性)。
具体实施方式
24.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
25.本发明实施例所用材料如下:
26.材料:磷酸盐缓冲液(pbs,ph:7.4),去离子水,脱脂奶粉封闭液(由脱脂奶粉和pbs 按一定比例配制,smpsf),pivka-ii单克隆鼠抗体(a-pivka-ii,);tio2纳米粒子(aladdin);丝网状电极(poten),haucl4.3h2o(aladdin),nabh4(艾科试剂),n,n
′‑
羰基二咪唑(macklin),半胱氨酸(macklin),铁氰化钾(aladdin)/亚铁氰化钾(macklin) (k4[fe(cn)6.3h2o)/(c6fek4n6)和氯化钾(kcl)(aladdin)。
[0027]
实施例1、au@tio2纳米粒子的制备
[0028]
au@tio2纳米粒子复合物通过化学还原haucl4制备,首先将tio2纳米粒子(300mg) 分散在甲醇/乙醇混合物(90/10,v/v,55ml)中,使用超声仪持续超声30min。然后添加给定体积的haucl4甲醇/乙醇溶液(2.5mm),以使载金量达到重量的0.3%。超声处理1h,然后加入10ml的nabh4甲醇/乙醇溶液(2.5mm)。然后继续超声处理10min。最后通过离心收集粉末,并在110℃的烘箱中干燥过夜。
[0029]
将合成的au@tio2纳米复合物,分别通过场域发射电镜(sem)(hitachi,su8220)、透射电子显微镜(tem)(电镜talos f200s,能谱super x)、x射线衍射仪(xrd)(日本理学,rigaku ultima iv)等仪器进行了形貌与结构的表征。用xrd分析了au@tio2的相组成如图1中a所示,xrd结果显示,制备的au@tio2材料au元素成功复合到tio2纳米粒子的表面,并且制备得到的材料非常的纯净,只含有au和tio2两种物质。利用扫描电镜 (sem)对au@tio2纳米粒子的形貌进行了研究,结果如图1中b所示,sem结果显示,制备好的au@tio2纳米复合物,au颗粒成功复合在tio2纳米粒子的表面。
[0030]
由于sem不能检测出au元素。所以我们进行了tem检测。结果如图2所示,由图2(a)、 (b),tem结果显示,au元素的直径为0.234nm,为(111)晶面,tio2的直径为0.350nm,为(101)晶面。图(d)、(e)、(f)显示了au@tio2的au、ti和o元素分布。其元素分布图符合图2(c)。进一步证实了au、ti和o元素的存在。
[0031]
实施例2、pivka-ii免疫传感器的构建
[0032]
电化学工作站由工作电极、碳对电极和银参比电极组成。其中工作电极可以选择丝网状电极(spe),将5μl au@tio2乙醇溶液滴加两次到丝网电极基片上(丝网电极基片可以选择陶瓷、铝片、玻璃等硬质材料,以及聚氯乙烯、聚碳酸酯等柔性材质),风干,得到 au@tio2/spe。然后将1mm的cys溶液滴加到au@tio2/spe上,让其自组装到复合材料上 (cys/au@tio2/spe)。在pivka-ii抗体(a-pivka-ii)固定之前,先用0.3m cdi在37℃水浴中将cys的氨基进行活化3h。接下来,将10μl的pivka-ii抗体滴加到活化后的电极上, 4℃,过夜。最后,用a-pivka-ii单克隆抗体修饰电极,得到a-pivka-ii/cys/au@tio2/spe 电极,用pbs洗涤,并且用脱脂奶粉封闭1h,以防止产生假阳性信号,具体原理图见图3。
[0033]
实施例3、电化学表征
[0034]
传感器得到构建成功与否可以通过电化学工作站(zahner pp211,德国)的循环伏安法(cv)来判断。在传感器的每一步修饰后,都进行了cv扫描。
[0035]
通过将不同修饰的传感器在5mm[fe(cn)6]
3-/
4- 0.1m kcl溶液中以50mv.s-1
的扫
描速率在-0.7至 1v的电压范围内扫描cv,结果如图4中a所示。裸spe电极(曲线a)显示出一对氧化还原峰。由于au@tio2的导电性较差,将au@tio2固定在spe(曲线b)上后,氧化还原峰电流明显降低。表明au@tio2能够有效地抑制电子转移,在au@tio2/spe表面连接cys后,峰值电流降低(曲线c)。并且,在cys/au@tio2/spe表面包覆抗体(ab)后,电流进一步降低(曲线d)。同样,在非特异性活性位点(曲线e)上覆盖smpsf将进一步增加 ab/cys/au@tio2/spe表面上的空间位阻,导致氧化还原峰电流降低。在抗体特异识别 pivka-ii后,免疫复合物(曲线f)在smpsf/ab/cys/au@tio2/spe表面形成,进一步抑制电子转移,从而进一步降低电流,这些表征揭示了电极的成功制备。
[0036]
实验条件的优化:由于生物传感器的分析性能与抗原与抗体反应密切相关,因此对反应时间进行了优化。如图4中b所示,随着反应时间从10延长到60分钟,信号响应持续增加,直到在40分钟达到最大值,继续增加反应时间,抗原抗体慢慢降解,表明pivka-ii抗原抗体之间的最佳反应时间为40分钟。
[0037]
实施例4、电化学分析
[0038]
在最佳反应条件下,从-0.3到 0.5v的电压,进行差分脉冲伏安法(dpv)扫描分析,免疫传感器(smpsf/ab/cys/au@tio2/spe)的当前信号记录为i0。在引入目标分析物后,来自免疫传感器(pivka-ii smpsf/ab/cys/au@tio2/spe)产生的dpv信号记录为i1。在测试反应器中的不同浓度的pivka-ii蛋白(1-10000pg/ml),dpv信号记录为δi(δi=i
0-i1)。所有实验数据均使用origin lab software v.6进行分析。
[0039]
当分析物与免疫传感器相互作用时,会在生物认知层界面区域形成免疫复合物,由于屏蔽作用,氧化还原探针的电子转移降低。在最佳条件下,用dpv研究了电化学免疫传感器在5mm[fe(cn)6]
3-/
4- 0.1m kcl中对不同浓度pivka-ii的电流响应。从图5中a可以清楚地看出,峰值电流随着pivka-ii浓度从1增加到10000pg.ml-1
而逐渐减小。如图5中b所示,当前信号差(δi)与实际pivka-ii浓度的对数值有很好的对应关系。相应的关系式为:δi (μa)=1.17log c
pivka-ii
(pg ml-1
) 4.815(r2=0.991),检测下限(lod)为0.77pg ml-1
(s/n= 3)。显然,电流信号的变化可以用来指示免疫反应,并且灵敏度可以被有效地放大。该方法具有线性范围宽、检测限低的特点。
[0040]
生物传感器特异性和稳定性被认为是真实生物标志物检测的重要方面性能。为了评估这种生物传感器检测pivka-ii的特异性,采用了不同蛋白质作为干扰分子,包括甲胎蛋白 (afp)、和抗缪勒试管激素(amh)。结果如图6中a所示。结果显示,当生物传感器在相同条件下进行评估时,只有pivka-ii和所含有干扰分子和靶分子pivka-ii的混合物引起信号反应的明显增强。相反,所含有干扰蛋白的当前反应可以忽略不计。结果表明,过量的干扰分子对该检测系统没有影响,表明该生物传感器具有良好的特异性。此外,还对生物传感器的稳定性进行了评价。为了研究稳定性,在相同的测定条件下,制备了同一批次生物传感中的五个生物传感器用于检测pivka-ii,所有这些传感器都执行相似的dpv值。如图6中b 所示,不同传感器测定相同浓度时,所产生的电流基本相同。表明该方法制备的生物传感器具有良好的稳定性。
[0041]
实施例5、血清样本测试
[0042]
为了验证传感器的适用性,进行了回收试验。在胎牛血清样品中加入不同浓度的 pivka-ii蛋白。然后利用自行研制的电化学生物传感器对样品进行检测。加入反应器的血
清加标pivka-ii蛋白的浓度测得的实际浓度,与理论浓度比较,以及回收率结果如表1所示。
[0043]
表1、不同pivka-ii蛋白浓度检测结果
[0044][0045]
结果显示,回收率为84.9%-102.79%。结果证实了电化学生物传感器在检测真实血清样品中pivka-ii方面具有一定的潜力。
[0046]
综上,本发明成功合成了au@tio2复合材料,并利用cys自组装的方式让半胱氨酸的巯基与复合材料的au粒子结合,以让氨基游离出来,为后续与抗体结合提供位点。通过这种方法,可以放大免疫反应,实现对pivka-ii的超灵敏检测。在优化的条件下,所制备的免疫传感器具有良好的检测pivka-ii的性能,线性范围宽,检出限低。此外,该免疫传感器还具有良好的稳定性和选择性。并且,可通过该免疫传感器所检测出来的δi的值大小,来初步判断样本中的pivka-ii的含量。总的来说,这种方法具有很大的应用潜力,为生物标志物分析和早期疾病诊断的应用构建了一个快速、灵敏的生物传感平台。我们未来的研究将集中在通过测试来自hcc患者的血清标本中的pivka-ii来进一步评估免疫传感器的性能。
[0047]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。