1.本发明属于酿酒技术领域,具体涉及一株高产乙酸乙酯的异常威克汉逊酵母及其培养方法。
背景技术:
2.芝麻香型白酒,特有一种类似焙炒芝麻的特殊香气与其它类香气组合,是中国“十一大香型”中最年轻的一个成员,由白酒专家和技术人员于建国后自主创新。其风格兼具清香型、浓香型、酱香型白酒的优点:闻香时与以乙酸乙酯为主体的清香型白酒相近,窖香突出,香气淡雅;入口时与酱香型白酒香气类似有焦香和煳香气味;入口后与浓香型白酒特点相近,香气饱满,后味悠长。芝麻香型白酒具有自身独特的风味特征,而这些组分来源于酿造过程中各种微生物的作用。
3.酒醅是一个富含微生物的体系,酵母菌就是芝麻香酿造的关键菌群之一,在推动白酒发酵进程的同时也代谢产生挥发性风味化合物,影响白酒的风味与品质。酵母菌主要为酿酒酵母和生香酵母两大类,其中酿酒酵母的主要作用是产乙醇,其菌体降解能为其它微生物提供营养物质;生香酵母又称产酯酵母,如汉逊酵母属、毕赤酵母属等,能产生大量酯酶将糖、醛、有机酸等物质转化为酯类、醇类、酮类、酚类、吡嗪类等芳香物质,对产酒率和酒质至关重要。酯类物质占芝麻香型白酒香味物质总量的40%~50%,对酒体的绵甜、醇厚等有重要贡献,其中总量最多的是乙酸乙酯。因此在芝麻香型白酒酿造体系中筛选高产乙酸乙酯的产香酵母菌菌株,探讨其培养方法和产香味物质,对提升芝麻香酿造效果具有潜在的现实意义。
技术实现要素:
4.本发明的目的之一是从酒醅中分离出高产乙酸乙酯的菌株;
5.本发明的目的之二是确定该菌株的最佳培养方法;
6.进而为提高芝麻香型白酒的产量和质量提供优质菌源。
7.本发明实现上述目的采取的技术方案如下。
8.本发明的高产乙酸乙酯的异常威克汉逊酵母,通过以下筛选方法制备:
9.步骤一、取芝麻香堆积酒醅溶于无菌水中,均质,得到酒醅水溶液;
10.步骤二、分别取等体积的酒醅水溶液进行10-5
倍、10-6
倍、10-7
倍、10-8
倍稀释,分别于分离培养基中涂布均匀,28℃培养2~5天,挑取不同形态的菌株分别于ypd液体培养基中培养72小时,通过感官闻香挑选具有香气的菌株,分别在分离培养基中多次纯化,至单菌株在培养皿上均为同一形态,显微镜下观察为同一类型细胞为止;
11.步骤三、利用酵母基因组dna快速抽提试剂盒分别提取上述单菌株的dna,依此dna为模板,its1/its4为引物进行pcr扩增,扩增产物经琼脂糖凝胶电泳检测后进行测序,测序结果在ncbi网站上进行blast比对,将结果为异常威克汗逊酵母菌的单菌株留下;
12.步骤四、挑取异常威克汗逊酵母的单菌株于ypd液体培养基中,30℃静置培养24小
时,将得到的单菌株活化液摇匀并取出10ml后,用无菌水稀释至od值的范围在0.4~0.5之间,并以3wt%的接种量接种到100ml的ypd液体培养基后,密封,30℃静置培养5天,得到发酵液;
13.步骤五、将发酵液混匀后,将混匀的发酵液与蒸馏水混匀,蒸馏至得到溜出液;
14.所述混匀的发酵液、蒸馏水和溜出液的体积比1:1:1;
15.步骤六、利用气相色谱仪分别对溜出液中的乙酸乙酯含量进行测定,将对乙酸乙酯代谢能力最强的菌株确定为高产乙酸乙酯的异常威克汉逊酵母。
16.作为优选,所述步骤一中,芝麻香堆积酒醅和无菌水的配比为25g:225ml。
17.作为优选,所述步骤一中,匀质时间为2分钟。
18.作为优选,所述步骤一中,分离培养基通过以下方法制备:将wl培养基在121℃湿热灭菌20min,降温到50~60℃时,加入终浓度为0.1g/l的氯霉素,摇匀后倒入无菌培养皿中,凝固后,静置3天。
19.作为优选,所述步骤二中,等体积为1ml。
20.作为优选,所述步骤二和步骤四中,ypd液体培养基含有酵母浸粉10wt%、蛋白胨20wt%和葡萄糖20wt%,余量的去离子水,且在121℃灭菌20分钟。
21.作为优选,所述步骤六中,利用气相色谱仪分别对溜出液中的乙醇、乙酸乙酯、乙酸、β-苯乙醇含量均进行测定。
22.作为优选,所述步骤六中,气相色谱仪的色谱柱条件为:cp-wax 57cb毛细管色谱柱(50m
×
0.25mm
×
0.2μm);起始温度30℃,恒温5min,以5℃/min程序升温至60℃,以6℃/min程序升温至120℃,恒温5min,以8℃/min程序升温至210℃,恒温5min;载气(高纯氮):流速1ml/min,分流比为40:1;氢气:流速为30ml/min;空气:流速为400ml/min;检测器温度:250℃;进样器温度:250℃;进样量:1μl。
23.本发明的高产乙酸乙酯的异常威克汉逊酵母的培养方法:在18~44℃,ph 3~8,乙醇在12wt%以内,nacl在20wt%以内的环境下培养。
24.上述技术方案中,优选在32℃,ph 7,乙醇在12wt%以内,nacl在20wt%以内的环境下培养。
25.与现有技术相比,本发明的有益效果为:
26.本发明的高产乙酸乙酯的异常威克汉逊酵母从芝麻香堆积酒醅中分离出11株异常威克汉逊酵母,对其发酵液进行气相分析筛选出一株产乙酸乙酯能力高的酵母菌y01;通过考察y01对温度、酸度、乙醇、葡萄糖、nacl的耐受性,发现其能在18~44℃、ph 3~8之间的环境下生长,最适生长温度为32℃,最适生长ph为7,能耐受12wt%的乙醇、20wt%的nacl。结合顶空固相微萃取气相色谱质谱联用技术(hs-spme-gc ms技术)检测y01的发酵液香气成分,发现该菌能产24种香味成分,其中乙醇、乙酸乙酯、异戊醇、苯乙醇的含量最高。这些成分对芝麻香型白酒产量和质量都有重要贡献,说明该菌株的产香特性有利于其在白酒酿造中进行应用,为芝麻香型白酒酿造提供优良的酵母菌种。
附图说明
27.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领
域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
28.图1为本发明实施例1的芝麻香堆积酒醅中酵母菌的形态图,其中,a为显微镜下的酵母菌形态,b为分离培养基上的酵母菌形态;
29.图2为本发明实施例1的11菌株的its扩增基因电泳图;
30.图3为本发明实施例1的y01菌株的生长曲线;
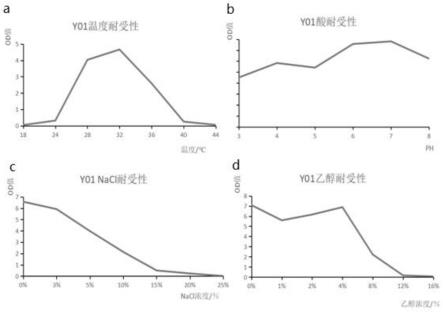
31.图4为本发明实施例1的y01菌株的耐受性实验结果图,其中,a为温度耐受性,b为酸耐受性,c为nacl耐受性,d为乙醇耐受性。
具体实施方式
32.为了进一步理解本发明,下面对本发明优选实施方案进行描述,但是应当理解,这些描述只是为进一步说明本发明的特征和优点,而不是对本发明权利要求的限制。
33.本发明的高产乙酸乙酯的异常威克汉逊酵母,通过以下筛选方法制备:
34.步骤一、取芝麻香堆积酒醅溶于无菌水中,均质,得到酒醅水溶液;
35.步骤二、分别取等体积的酒醅水溶液进行10-5
倍、10-6
倍、10-7
倍、10-8
倍稀释,分别于分离培养基中涂布均匀,28℃培养2~5天,挑取不同形态的菌株分别于ypd液体培养基中培养72小时,通过感官闻香挑选具有香气的菌株,分别在分离培养基中多次纯化,至单菌株在培养皿上均为同一形态,显微镜下观察为同一类型细胞为止;
36.步骤三、利用酵母基因组dna快速抽提试剂盒分别提取上述单菌株的dna,依此dna为模板,its1/its4为引物进行pcr扩增,扩增产物经琼脂糖凝胶电泳检测后进行测序,测序结果在ncbi网站上进行blast比对,将结果为异常威克汗逊酵母菌的单菌株留下;
37.步骤四、挑取异常威克汗逊酵母的单菌株(黄豆粒大小)于ypd液体培养基中,30℃静置培养24小时,将得到的单菌株活化液摇匀并取出10ml后,用无菌水稀释至od值的范围在0.4~0.5之间,并以3wt%的接种量接种到100ml的ypd液体培养基后,密封,30℃静置培养5天,得到发酵液;
38.步骤五、将发酵液混匀后,将混匀的发酵液与蒸馏水混匀,蒸馏至得到溜出液;
39.所述混匀的发酵液、蒸馏水和溜出液的体积比1:1:1;
40.步骤六、利用气相色谱仪分别对溜出液中的乙酸乙酯含量进行测定,将对乙酸乙酯代谢能力最强的菌株确定为高产乙酸乙酯的异常威克汉逊酵母。
41.上述技术方案,步骤一中,芝麻香堆积酒醅和无菌水的配比为25g:225ml。
42.上述技术方案,步骤一中,匀质时间为2分钟。
43.上述技术方案,步骤一中,分离培养基通过以下方法制备:将wl培养基在121℃湿热灭菌20min,降温到50~60℃时,加入终浓度为0.1g/l的氯霉素,摇匀后倒入无菌培养皿中,凝固后,静置3天。
44.上述技术方案,步骤二中,等体积为1ml。
45.上述技术方案,步骤二和步骤四中,ypd液体培养基含有酵母浸粉10wt%、蛋白胨20wt%和葡萄糖20wt%,余量的去离子水,且在121℃灭菌20分钟。
46.上述技术方案,步骤六中,利用气相色谱仪分别对溜出液中的对乙醇、乙酸乙酯、乙酸、β-苯乙醇含量均进行测定。
47.上述技术方案,步骤六中,气相色谱仪的色谱柱条件为:cp-wax 57cb毛细管色谱柱(50m
×
0.25mm
×
0.2μm);起始温度30℃,恒温5min,以5℃/min程序升温至60℃,以6℃/min程序升温至120℃,恒温5min,以8℃/min程序升温至210℃,恒温5min;载气(高纯氮):流速1ml/min,分流比为40:1;氢气:流速为30ml/min;空气:流速为400ml/min;检测器温度:250℃;进样器温度:250℃;进样量:1μl。
48.本发明的高产乙酸乙酯的异常威克汉逊酵母的培养方法:在18~44℃,ph 3~8,乙醇在12wt%以内,nacl在20wt%以内的环境下培养。
49.上述技术方案中,优选在32℃,ph 7,乙醇在12wt%以内,nacl在20wt%以内的环境下培养。
50.在本发明中所使用的术语,一般具有本领域普通技术人员通常理解的含义,除非另有说明。为了使本领域的技术人员更好地理解本发明的技术方案,下面将结合实施例对本发明作进一步的详细介绍。
51.在以下实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。下述实施例中所用的材料、试剂、装置、仪器、设备等,如无特殊说明,均可从商业途径获得。
52.以下结合实施例进一步说明本发明。
53.实施例1
54.1.1材料与方法
55.1.1.1材料与试剂
56.实验材料为生产中的堆积温度超过40℃的新鲜芝麻香堆积酒醅。wl培养基购自青岛海博生物有限公司,酵母基因组dna快速抽提试剂盒购自生工生物有限公司,taq酶及高保真hifi购自全式金生物有限公司,叔戊醇、乙酸戊酯、2-乙基丁酸购自百灵威科技有限公司。
57.1.1.2仪器与设备
58.高压蒸汽灭菌锅、生化培养箱:上海博讯实业有限公司;超净工作台:光明仪器有限公司;可见光分光光度计:上海菁华科技仪器有限公司;pcr仪、电泳仪:美国伯乐公司;dvb/car/pdma萃取头:supelco公司;7890b gc system气相色谱仪:美国agilent公司;气相色谱质谱联用仪(7890a-5975c):安捷伦科技有限公司。
59.1.1.3培养基的制备
60.(1)分离培养基:将wl培养基于三角瓶中,121℃湿热灭菌20min,待降温到50~60℃时,加入氯霉素(终浓度为0.1g/l),轻轻摇匀后倒入无菌培养皿中,待其凝固后做好标记,3天后使用。
61.(2)ypd液体培养基:酵母浸粉10wt%、蛋白胨20wt%、葡萄糖20wt%,余量的去离子水,121℃灭菌20分钟。
62.(3)耐受性培养基
63.酸度培养基:配制ypd液体培养基,用乙酸调节ph分别为3、4、5、6、7、8、9,分装到小三角瓶中,121℃灭菌20分钟后备用。
64.乙醇培养基:配制ypd液体培养基,分装到小三角瓶中,121℃灭菌20分钟后,依次加入相应体积的乙醇,使乙醇终浓度依次为0wt%、1wt%、2wt%、4wt%、8wt%、12wt%、16wt%,备用。
65.高盐培养基:配制ypd液体培养基,依次加入nacl,使其终浓度依次为0wt%、3wt%、5wt%、10wt%、15wt%、25wt%,分装到小三角瓶中,121℃灭菌20分钟后备用。
66.1.1.4实验方法
67.1.1.4.1酵母菌分离与纯化
68.取25g芝麻香堆积酒醅溶于225ml无菌水中,均质2分钟;在超净工作台中制备10倍递增稀释液,分别取1ml 10-5
、10-6
、10-7
、10-8
稀释液于分离培养基中涂布均匀后放入28℃培养箱中培养2~5天后,在培养皿中挑取不同形态的酵母菌分别于ypd液体培养基中培养72小时,通过感官闻香挑选具有香气的酵母菌作为实验对象,分别在分离培养基中多次纯化,至单菌株在培养皿上均为同一形态,显微镜下观察为同一类型细胞为止。在培养皿上分别挑取一块纯化的单菌株溶于30%的无菌甘油中,放到-80℃冰箱中冷冻保存。
69.1.1.4.2酵母菌形态学观察
70.固体培养菌落形态:将纯化的单菌株分别划线至ypd液体培养基中,28℃培养72小时后,进行单菌株形态学观察,观察菌落颜色、形状、边缘、质地、湿润程度等。
71.液体培养特性:将纯化的单菌株分别接种到ypd液体培养基,28℃,活化24h,观察菌体存在的位置,液面是否有菌膜,底层是否有沉淀等。
72.细胞形态观察:取无菌水1滴,滴于载玻片中央,用接种环挑取单菌株,涂布均匀后加盖玻片,于40倍物镜下观察细胞形态。
73.1.1.4.3酵母菌分子生物学鉴定
74.将单菌株分别接种到ypd液体培养基中,培养24小时后,利用酵母基因组dna快速抽提试剂盒进行dna提取。以基因组dna为模板,its1(5’—tccgtaggtgaacctgcgg—3’)和its4(5’—tcctccgcttattgatatgc—3’)为引物扩增酵母菌的18srna和5.8srna的内源转录间隔区(its1/its4)序列。扩增条件为:预变性95℃,10min;30个循环:94℃变性1min,55℃退火1min,72℃延伸1min:72℃再延伸10min。pcr扩增产物经1.5wt%的琼脂糖凝胶电泳检测后送至生工生物工程有限公司进行测序。测序结果在ncbi网站上进行blast比对。
75.1.1.4.4发酵液中醇、酯含量检测
76.1.1.4.4.1菌种培养
77.在超净工作台下,分别用接种针挑取一环酵母菌于ypd液体培养基中,30℃静置培养24小时。调整酵母菌活化液的浓度,做法是将酵母菌活化液摇匀并取出10ml后,利用分光光度计检测其od值,以未进行接种的ypd液体培养基进作对照。对酵母菌活化液进行合适的稀释处理,使其od值的范围在0.4~0.5之间,记录相应的稀释浓度。将需要进行稀释的酵母菌活化液在超净工作台内,用无菌水进行相应的稀释处理。将上述调整好的酵母菌活化液,以3wt%的接种量接种到100ml ypd液体培养基后,盖好筛子。放到30℃培养箱中静置培养5天。
78.1.1.4.4.2发酵液蒸馏
79.取50ml混匀的发酵液于蒸馏瓶中,加入50ml蒸馏水,安装好蒸馏瓶在蒸馏仪中蒸馏至溜出液为50ml。放到4℃冰箱中保藏。
80.1.1.4.4.3气相检测发酵液中醇、酯含量
81.利用气相色谱仪分别对馏出液中的乙醇含量以及其它挥发性物质含量进行测定。
82.分析条件:cp-wax 57cb毛细管色谱柱(50m
×
0.25mm
×
0.2μm);起始温度30℃,恒
温5min,以5℃/min程序升温至60℃,以6℃/min程序升温至120℃,恒温5min,以8℃/min程序升温至210℃,恒温5min;载气(高纯氮):流速1ml/min,分流比为40:1;氢气:流速为30ml/min;空气:流速为400ml/min;检测器温度:250℃;进样器温度:250℃;进样量:1μl。
83.1.1.4.5生物学分析
84.1.1.4.5.1生长曲线
85.挑取部分酵母菌菌落于ypd液体培养基中培养24小时活化后,以5%的接种量接种至150mlypd液体培养基中,在28℃下培养,以接种时间为起始时间,每隔4小时取样,以空白培养基为空白,利用可见分光光度计在600nm波长下测定菌液的吸光度(当吸光值较高时,菌液稀释适当倍数使吸光值保持在0.3~0.7之间)。以菌液od值为纵坐标,生长时间为横坐标,绘制菌株的生长曲线。
86.1.1.4.5.2酵母菌耐受性实验
87.温度耐受性实验:将酵母菌活化液,以5wt%的接种量接种至100ml ypd液体培养基中,分别在18℃、24℃、28℃、32℃、36℃、40℃、44℃培养箱中静止培养48小时后测菌液在600nm波长下od值。
88.酸度耐受性实验:将酵母菌活化液,以5wt%的接种量接种至ph为3、4、5、6、7、8、9的ypd培养中,30℃培养箱中静止培养48小时后测菌液od值。
89.乙醇耐受性实验:将酵母菌活化液,以5wt%的接种量接种至乙醇浓度分别为0wt%、1wt%、2wt%、4wt%、8wt%、12wt%、16wt%的ypd液体培养基中,28℃培养箱中静止培养48小时后测菌液od值。
90.葡萄糖耐受性实验:将酵母菌活化液,以5wt%的接种量接种至葡萄糖浓度分别为20wt%、25wt%、30wt%、40wt%、50wt%、60wt%的ypd液体培养基中,28℃培养箱中静止培养48小时后测菌液od值。
91.nacl耐受性实验:将酵母菌活化液,以5wt%的接种量接种至nacl浓度为0wt%、3wt%、5wt%、10wt%、15wt%、25wt%的ypd液体培养基中,28℃培养箱中静止培养48小时后测菌液od值。
92.1.1.4.6酵母菌香味物质含量分析
93.采用顶空固相微萃取技术(head-space solidphasemicroextraction,hs-spme)对酵母菌发酵液进行萃取,再利用气相色谱-质谱联用(gc-ms)仪进样分析酵母菌的挥发性代谢产物。
94.hs-spme:取5ml于玉米发酵液中培养了5天的酵母菌菌液、2g nacl,100微升内标(三内标,含量均为0.2%)及转子装入顶空进样瓶中。于在50℃的恒温磁力搅拌器上平衡10分钟后,将老化好的三相萃取头插入到样品瓶顶空部分,萃取40min。将萃取针放到gc-ms仪中热解吸5min,检测。
95.gc-ms分析:gc升温程序:40℃保持5min,以3.5℃/min升至90℃,再以15℃/min升至270℃,保留5min;进样口温度250℃,载气he,流速1ml/min;进样量1μl,不分流。
96.ms条件:电子轰击离子源(ei),离子源温度230c,电子能量70ev,扫描范围为35.00~350.00amu。
97.1.2结果与分析
98.1.2.1酵母菌的分离结果
99.芝麻香堆积酒醅经过分离纯化后初步筛选到11株酵母菌,它们的菌落形态和细胞形态一致(图1),均为椭圆形,生殖方式为出芽生殖;在分离培养基上菌落颜色为乳白色或浅绿色,圆形,边缘整齐,凸起,表面湿润,有光泽,粘稠,易挑起,菌体生长区域浅黄色,培养基绿色;液体培养时表面有大量菌膜,底部有沉淀,有气泡产生。
100.1.2.2酵母菌its分子生物学鉴定结果
101.利用its1/its4引物扩增这11株酵母菌的its序列,经琼脂糖凝胶电泳显示扩增出600bp左右的的条带(图2),符合设定要求,条件清晰明亮可直接用于测序。测序结果经ncbi网站进行blast比对后结果如表1所示,这11株酵母菌与wickerhamomyces anomalus(异常威克汉姆酵母)的相似度均达到99.51%以上,以上结果表明这些菌均为异常威克汉姆酵母。
102.表1酵母菌its序列ncbi数据库blast结果
103.[0104][0105]
1.2.3酵母菌发酵液中醇、酯含量
[0106]
利用气相色谱检测酵母菌在ypd液体培养基中代谢产生的醇、酯含量如表2所示,这些酵母菌均代谢产生了乙醇、乙酸乙酯、乙酸和β-苯乙醇,这些菌代谢产生醇、酯、酸的能力存在差异。y01菌株发酵液中乙醇含量为3820mg/l,比其它酵母菌发酵液中含量要高;乙酸乙酯的含量为1419mg/l,其含量最高;y02菌株发酵液中乙酸乙酯的含量较高,达到1206mg/l,但其乙醇的含量不占优势;y06菌株发酵液中β-苯乙醇含量最高,达到33.7mg/l,但其醇、酸、酯的含量都叫底;y07菌株发酵液中乙醇含量较高,达到3520mg/l,但其乙酸乙酯的含量较小。因此,y01菌株对代谢乙醇、乙酸乙酯的能力都较强,是本次实验筛选出的菌株,用来做后续的耐受性分析实验。
[0107]
表2酵母菌在ypd液体培养基中代谢产生的醇、酯含量结果
[0108]
[0109][0110]
1.2.4酵母菌生物学分析
[0111]
1.2.4.1酵母菌生长曲线
[0112]
y01酵母菌的生长曲线如图3所示,0~8h是酵母菌的延滞期,菌体生长缓慢,菌体浓度基本没有变化;当菌株适应环境后,在8h~20h时间内菌体利用培养基内的营养物质进行自我繁殖,菌体数呈指数生长,为菌株的对数生长期,此阶段微生物繁殖速度快,菌体增长效率高,该阶段菌体达到最高生长速率,能有效指导微生物接种时间控制接种量;24h以后,菌体开始进行代谢,菌体数基本保持一致,为菌株的生长平衡期。
[0113]
1.2.4.2酵母菌耐受性实验
[0114]
酵母菌对温度、酸度、乙醇、葡萄糖、nacl的耐受性实验如图4所示,y01酵母菌在18~44℃之间生长,当培养温度为32℃时,酵母菌的od值最高,是其最适生长温度。以乙酸和naoh调节溶液ph,其中ph=3时,乙酸的添加量达到15%,菌株培养48小时后的菌液od值如图4所示,其最适生长ph为7,在ph值3-8的范围内,该酵母菌都能保持较好的生长,代表了该酵母菌有广泛的ph生长范围,既对酸的耐受度大,又能在偏碱性的环境中较好的生存。这一生活特点既能适应酿造环境中局部酸度大又能适应酿酒生香的碱性环境。乙醇是酵母菌厌氧发酵的产物,酵母菌对乙醇的耐受性强,代表该菌产乙醇的潜力大,y01酵母菌能在0-12%乙醇浓度下生长,且随着乙醇浓度的升高,其存活率逐渐降低。y01酵母菌能在0-20%的nacl浓度下生长,且随着盐浓度的增加,其存活率逐渐降低。综上所述,y01菌株最适生长温度是32℃,最适ph为7,能耐在18~44℃、ph在3~8之间的环境下生长,能耐受12%的乙醇、20%的nacl。
[0115]
1.2.5酵母菌香味物质含量分析
[0116]
采用hs spme—gc ms分析y01菌株的香味物质,结果如表3所示,在发酵液中检测到24中香味物质成分,其中乙醇、异戊醇、苯乙醇、乙酸乙酯的含量较高。乙酸乙酯呈苹果或
香蕉样果香,是芝麻香型白酒中含量最多的酯类香味物质;异戊醇有苦杏仁的味道,是白酒中主要的高级醇之一,其少量存在能衬托酯香,赋予酒体特殊香味。
[0117]
表3 y01菌株的香味物质
[0118]
[0119][0120]
综上,本发明从芝麻香堆积酒醅中的分离到11株形态一致的酵母菌,经分子生物学鉴定,这11株酵母菌均为异常威克汉逊酵母(wickerhamomyces anomalus)。利用气相检测在这11株酵母菌中筛选到一株产乙酸乙酯能力最强的菌y01。通过考察y01对温度、酸度、乙醇、葡萄糖、nacl的耐受性,发现其最适生长温度为32℃,最适生长ph为7,能在18~44℃、ph 3~8之间的环境下生长,能耐受12wt%的乙醇、20wt%的nacl。结合顶空固相微萃取气相色谱质谱联用技术检测y01的发酵液香气成分,发现该菌能产24种香味成分,其中乙醇、乙酸乙酯、异戊醇、苯乙醇的含量最高。本研究结果可为芝麻香型白酒酿造提供优良的酵母菌种。
[0121]
显然,上述实施方式仅仅是为清楚地说明所作的举例,而并非对实施例的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有实施例予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
