1.本发明涉及微生物技术领域,尤其涉及一株罗伊氏乳杆菌及其应用。
背景技术:
2.随着科学研究的不断深入,叶酸对人体健康的重要程度不断增加,但它在天然样品中的含量很低,组成复杂而且稳定性差,因此叶酸很可能是所有维生素中给分析工作者带来最大挑战的物质。天然叶酸的主要来源是绿色植物的叶子、动物肝脏、蛋黄、大豆、小麦和以叶酸发酵产生的早餐谷物类及酵母。市售的叶酸以化学合成为主,但化学合成的叶酸和天然叶酸在人体内的代谢不尽相同,摄入过多的人工叶酸,会引起不良作用,比如减弱巨噬细胞的吞噬作用,甚至会促进部分癌细胞的生长。而微生物发酵产生的叶酸质量安全,不会给人体带来副作用,研究较多的菌种主要有酵母菌,乳酸菌,双歧杆菌。
3.其中,荷兰的amo wegkamp等利用代谢工程手段来提高乳酸乳球菌产叶酸的能力,印度的dhanya gandgadharan等在发酵乳和果汁中加入乳脂乳球菌来提高产品中叶酸的含量并进行了发酵条件的优化。此外,青霉菌如青霉属胃瘤球菌也具有生产叶酸的能力,为发酵法生物合成叶酸产业化开辟了重要途径。
4.微生物细胞和植物能利用自身的蝶呤、对氨基苯甲酸(paba)和谷氨酸在叶酸合成酶的作用下从头合成叶酸,生产的总叶酸量包括细胞内和细胞外的含量。其中,胞内的叶酸含量一般是胞外叶酸的2-6 倍,而人和其他高等哺乳动物缺乏完整的叶酸合成系统,只能通过食物摄取叶酸。由于目前叶酸的生产主要是以化学合成为主,安全性不高,通过微生物方法发酵所得的叶酸品质很高,对人体无副作用,但所得的叶酸含量比较低。因此,从自然界存在的菌株中筛选出高产叶酸的菌株成为了研究的热点。
技术实现要素:
5.本发明提供了一株罗伊氏乳杆菌,其为罗伊氏乳杆菌 (lactobacillus reuteri)hm-r28,其分离自新鲜母乳中。该菌株已于 2021年10月25日保藏于中国微生物菌种保藏管理委员会普通微生物中心。保藏单位地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所;邮政编码:100101,分类命名:罗伊氏乳杆菌lactobacillus reuteri,保藏编号为cgmccno.23658。
6.本发明提供的罗伊氏乳杆菌(lactobacillus reuteri)hm-r28,能够通过发酵过程稳定地获得大量的叶酸。
7.进一步,本发明还提供了一种微生物菌剂,其包含上述罗伊氏乳杆菌。
8.进一步,本发明还提供了一种产品,其含有上述罗伊氏乳杆菌或微生物菌剂;所述产品为选自药物、保健品、食品或食品添加剂、以及饲料或饲料添加剂中的任意一种。
9.进一步,本发明提供了上述罗伊氏乳杆菌或微生物菌剂在制备产品中的应用,所述产品为选自药物、保健品、食品或食品添加剂、以及饲料或饲料添加剂中的任意一种。
10.进一步,本发明提供了上述罗伊氏乳杆菌或微生物菌剂在制备含有叶酸的产品中
的应用。
11.进一步,本发明提供了一种产品,其以上述罗伊氏乳杆菌或微生物菌剂为原料制得;所述产品为选自药物、保健品、食品或食品添加剂、以及饲料或饲料添加剂中的任意一种。
12.更进一步,本发明提供了一种发酵乳的制备方法,包括:采用含有上述罗伊氏乳杆菌的发酵剂进行发酵。
13.作为一种优选的实施方案,包括:将上述罗伊氏乳杆菌接种于牛乳中,在37℃
±
5℃下发酵制得。
14.作为一种优选的实施方案,所述罗伊氏乳杆菌与所述牛乳的重量比为1:45~55。
15.进一步,本发明还提供了上述任一实施方案制备的发酵乳。
16.本发明在母乳源和婴儿粪便源菌株的基础上进行菌株筛选,相对于其他来源的菌株筛选而言,需要以新鲜的母乳和婴儿粪便为原材料进行筛选,随着时间的推移,越难从母乳和婴儿粪便中分离获得本发明的实验菌株。
17.本发明的有益效果在于:
18.提供了一株稳定高产叶酸的罗伊氏乳杆菌,解决了微生物生产的活性叶酸产量不高且不稳定的技术难题。而且本发明首次以母乳来源的益生菌进行分析,将其代谢途径中的指标进行检测,明确其合成机理,为进一步提高叶酸的产量奠定基础。
附图说明
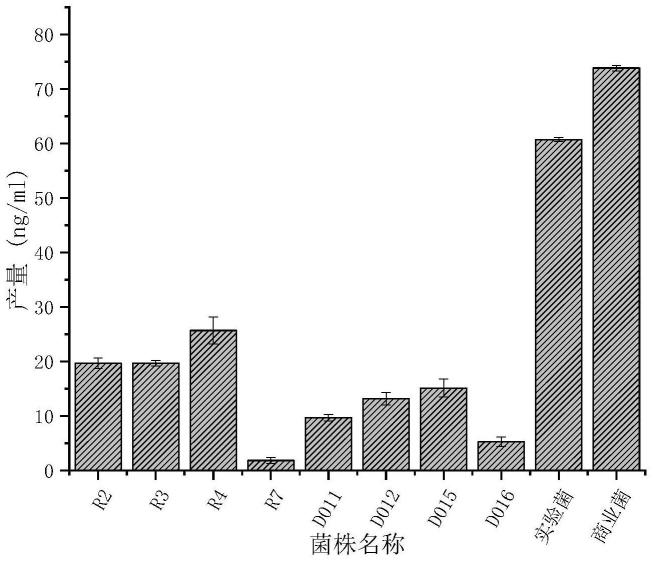
19.图1是母乳来源的不同菌株的叶酸产量对比图。
20.图2是罗伊氏乳杆菌(lactobacillus reuteri)hm-r28的生长曲线和培养基ph的变化图。
21.图3是罗伊氏乳杆菌(lactobacillus reuteri)hm-r28在添加谷氨酸后随时间变化产叶酸能力变化折线图。
22.图4为罗伊氏乳杆菌(lactobacillus reuteri)hm-r28添加谷氨酸后培养基中谷氨酸变化折线图。
23.图5为不同菌株发酵的发酵乳发酵前后的叶酸含量对比图。
具体实施方式
24.下面对本发明的罗伊氏乳杆菌(lactobacillus reuteri)hm-r28 的分离过程进行描述说明。
25.下述实施方案中未注明具体技术或条件者,均为常规方法或者按照本领域的文献所描述的技术或条件进行,或者按照产品说明书进行。所用试剂和仪器等未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
26.一、菌株的分离、鉴定及保存
27.新鲜母乳和婴儿粪便经过mrs液体培养基富集后,用pbs进行梯度稀释并涂布于mrs固体培养基,37℃培养48h,对其进行3次平板划线纯化分离培养后,传代2-3次,并进行革兰氏染色镜检观察其形态,使用冻存管将菌液和30%甘油按1:1体积比例混合,-80℃保存备用。
28.二、产叶酸菌株的初筛
29.在叶酸酪蛋白培养基(facm)中加入溴甲酚紫作指示剂,ph 6.8,取活化好的待测菌株液体培养物1-2滴接种,置于37℃培养1-3d。若培养基溶液变黄,则指示为阳性,表示该菌株能够合成叶酸。将菌株经形态学检查(细胞形态、菌落形态和革兰氏染色),将所有菌株保存在含30%甘油的-80℃的冰箱中,直到总叶酸分析和菌株鉴定。
30.本发明在培养基中添加溴甲酚紫,如果有叶酸产生,培养基颜色会由暗紫色变成浅黄色,通过这种方法来快速高效的筛选菌株。
31.三、产叶酸菌株的复筛
32.选择facm培养基中颜色变化的培养基,取4ml菌液于50ml 塑料离心管内(注意精确称量菌液和离心管重量,均需记录,精确至 0.0001g),调节ph值到1.7,避光静置2min,再调节ph值到4.7,避光放置2min后用水定容至10g,混匀后置于离心机内,4℃下10000 转/min离心20min,上清液过0.22μm滤膜后采用超高效液相色谱分析,整个过程尽量避光,离心管用铝膜包裹。
33.超高效液相色谱条件:流动相a:10mmol甲酸铵加0.1%甲酸水溶液;流动相b:乙腈;色谱柱:acquity uplc hss t3色谱柱(2.1 mm
×
50mm,1.8μm);柱温30℃,进样量5μl。质谱条件:离子源:电喷雾离子源;扫描方式:正离子(esi
)扫描;扫描方式:多反应监测(mrm);离子源温度:110℃;脱溶剂温度:350℃;脱溶剂气(n2)流量:700l/hr;锥孔反吹气流量:30l/hr;碰撞气(ar): 0.13ml/min。
34.四、菌株鉴定
35.将甘油保藏的菌株活化并转接3次。经革兰氏染色显微镜观察后,根据细菌基因组dna提取试剂盒的说明进行操作。并对其进行 16srrna pcr扩增,pcr产物用1%琼脂糖凝胶电泳进行检测,并送到北京诺赛基因组研制中心进行测序、分析,获取菌株分类。
36.经超高效液相色谱测试,不同菌株的产叶酸能力测试结果如图1 所示。进行对照的九株菌分别是植物乳杆菌r2、r3、r4、r7,双歧杆菌d011、d012、d015、d016和商业罗伊氏乳杆菌。结果表明,在实验室条件下,实验菌(即hm-r28)较其他母乳来源菌株叶酸产量相对较高,且稍低于商业罗伊氏乳杆菌。
37.进一步,本发明对筛选分离获得的罗伊氏乳杆菌(lactobacillusreuteri)hm-r28的代谢过程进行分析。
38.五、菌株生长曲线检测及ph和产叶酸能力检测
39.将在mrs固体培养基上培养的菌株取单菌落接种于10ml的 mrs液体培养基中。37℃震荡培养8-12小时。取200ul菌液加入10ml 的叶酸酪蛋白液体培养基中,37℃震荡培养。分别于0、2、4、6、8、 10、12、14、16、20、24、28、32、36、40及48h,取2ul菌液于紫外分光光度计上进行od600检测,并绘制生长曲线。每个时间点分别用ph计检测ph的变化。结果如图2所示。
40.由菌株在facm培养基中od600和培养基ph变化图可知,由于菌株的生长,使培养基ph在0-8h之间急剧下降后维持稳定。
41.同时,对罗伊氏乳杆菌(lactobacillus reuteri)hm-r28在添加谷氨酸后不同培养阶段的产叶酸能力进行测试。其中,向每10ml的 facm培养基添加0.4g谷氨酸,然后按照菌株复筛步骤对添加谷氨酸后每个时间点的样品进行处理,处理之后上机检测。结果如图3
所示。结果表明,由于前期菌株的生长,致使培养基中叶酸产量急剧下降,16h时叶酸产量最低,此时菌的浓度也与之相对应处于最大浓度, ph此时维持在小于4.8的状态。20h后叶酸基本维持在相对稳定的状态,后期由于叶酸含量不稳定,培养时间相对较长会使部分叶酸发生分解。因此,在生产叶酸的过程中,应保持培养基ph《4.8,培养时间维持在20小时左右。
42.六、谷氨酸含量变化分析
43.谷氨酸作为叶酸合成三大前体(paba、gtp、谷氨酸)物质之一,对其变化过程进行检测,从而得出谷氨酸在叶酸合成过程中哪个时间点消耗最大,也就是叶酸合成量最多的时间点。
44.谷氨酸作为叶酸合成过程中直接参与叶酸合成的物质,在叶酸合成途径中十分重要,因此有必要对谷氨酸产量进行阶段性的检测。
45.谷氨酸检测方法:试剂准备:10%磺基水杨酸:称取10g磺基水杨酸于100ml容量瓶中,加水定容至100ml,用锡箔纸包好后置于 4℃下贮藏;accqflour试剂:吸取1mlaccq〃tagultra试剂稀释剂 (2b)清洗枪头,向accq〃tagultra试剂粉(2a)中加入 1mlaccq〃tagultra试剂稀释剂(2b),涡旋振荡器振荡10s,于55℃恒温干燥箱中衍生10min,冷却至室温,置于干燥罐内贮藏。氨基酸标准品(浓度为2.5μmol/ml)。标准工作液:分别吸取氨基酸标准品(3.5)8.0μl、16.0μl、32.0μl、40.0μl、80.0μl,160μl用水定容至1.0ml,配制分别相当于0.02μmol/ml、0.04μmol/ml、0.08 μmol/ml、0.1μmol/ml、0.2μmol/ml、0.4μmol/ml浓度标准溶液。样品制备:吸取300μl样品,于1.5ml离心管中,待提取。加入20 μl10%磺基水杨酸,涡旋混匀,4℃、10000r/min条件下离心15min,上清液通过0.22μm滤膜过滤,收集滤液于离心管中。向微量进样瓶中加入70μl硼酸盐缓冲液,10μl样品滤液,20μlaccqflour试剂,混匀,于55℃恒温干燥箱中衍生10min,冷却至室温,待色谱仪测定。向微量进样瓶中加入70μl硼酸盐缓冲液,10μl标准工作液, 20ulaccqflour试剂,混匀,于55℃恒温干燥箱中衍生10min,冷却至室温,待色谱仪测定。色谱柱条件:色谱柱:氨基酸分析柱(2.1mm
ꢀ×
100mm,1.7μm)。柱温:49℃。流动相:a相:accq〃tagultra 洗脱液a浓缩液,b相:accq〃tagultra洗脱液b 水=1 9(体积比), c相:水,d相:accq〃tagultra洗脱液b。流速:0.7ml/min。波长:260nm。进样量:1μl。结果如图4所示。从图4中可知,谷氨酸浓度虽然在整个培养过程中有高有低,但是其变化趋势是一致的,从0.16umol/ml下降到0.02umol/ml以下,始终保持下降趋势,这也证明了培养基中叶酸是一直合成的,谷氨酸一直被消耗。
46.进一步,本发明将不同的发酵菌株与牛乳混合后发酵,制备出不同叶酸含量的发酵乳。其中r11、r18、r19是来源于新鲜母乳中分离的植物乳杆菌,f020、f003是来源于婴儿粪便中分离获得的格氏乳杆菌,b1-10、b1-27是来源于新鲜母乳中分离获得的罗伊氏乳杆菌,d020是来源于乳制品中分离获得的双歧杆菌,b2-14是来源于新鲜母乳中分离得到的鼠李糖乳杆菌。
47.具体步骤如下:
48.将牛乳在95℃下杀菌10min后,冷却至42℃接种发酵菌株,然后在37℃下发酵18~24h,发酵完成之后检测叶酸浓度。其中,菌株经过传代三次后使菌浓度达到108cfu/g,接种前要进行不同浓度的测定,从而使不同菌在该体系中保证最大活力生长。其中,实验菌(即hm-r28)的接种量为每10ml牛乳0.2ml菌液。
49.对发酵乳发酵前后的叶酸含量进行测试,结果如图5所示。由于牛乳中叶酸结合蛋
白的存在,使其能和叶酸聚谷氨酸相连,进而能使罗伊氏乳杆菌(lactobacillus reuteri)hm-r28发酵的酸奶中的叶酸含量得到大幅度提升。
50.最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。