1.本发明属于食用菌遗传和基因工程技术领域,具体涉及葡聚糖基转移酶gfgel4其编码基因和应用。
背景技术:
2.食药用真菌多糖是当前国内外研究十分活跃的领域之一,其广泛参与细胞中各种生命代谢活动,具有抗肿瘤、抗病毒、抗氧化、免疫调节等多种生物学活性,其中,葡聚糖是由d
‑
葡萄糖之间通过β
‑
1,3和/或β
‑
1,6糖苷键链接聚合而成的多糖,具有多种生物活性,而分支度适中的多糖往往具有较高的生物活性,例如分支度在0.31-0.36的灰树花葡聚糖具有较强的免疫活性。
3.然而,食药用真菌多糖的合成过程极为复杂,参与合成的底物和酶系众多,且可参考的技术方法严重不足,因而对其了解和认识十分有限。研究发现,葡萄糖作为灵芝发酵的碳源时,除供菌体自身生长需求外,还会被多种核苷酸糖合成酶(如udp
‑
葡萄糖焦磷酸化酶、udp
‑
葡萄糖
‑4‑
差向异构酶、gdp
‑
甘露糖焦磷酸化酶和dtdp
‑
葡萄糖焦磷酸化酶等)转化为相应的udp
‑
葡萄糖、udp
‑
半乳糖、gdp
‑
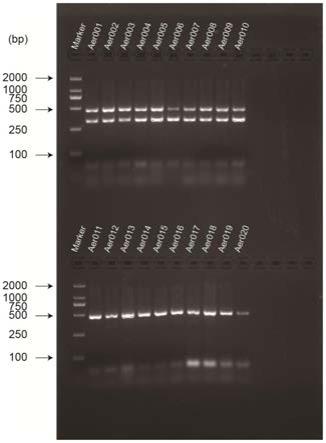
甘露糖和dtdp
‑
鼠李糖等核苷酸糖,并推测糖基转移酶可能与多糖支链的形成有着密切的关系,因此,要实现食药用真菌葡聚糖高效而稳定的合成,还需明确葡聚糖合成相关酶系的功能,并采取具有针对性的代谢调控手段以有效强化其合成。
4.灰树花(grifola frondosa)是富含多糖和蛋白质等营养成分的食用菌。已有的研究结果显示,灰树花子实体中纯化出的葡聚糖(d
‑
fraction)具有显著的抗肿瘤和免疫调节等活性。已有研究证实,灰树花菌丝体多糖或胞外多糖中的单糖组成和含量与核苷酸糖合成酶的活性直接相关,灰树花胞外葡聚糖的分支度与糖基转移酶也有着密切关系。但多数食用真菌葡聚糖含有不同比例的分支结构,那么这些分支结构如何形成,哪些酶涉及葡聚糖分支化重构,目前还未得到系统研究。
技术实现要素:
5.本发明目的是提供对灰树花胞外葡聚糖一级结构进行简单修饰和有效改变灰树花多糖合成量的技术手段。具体的,本发明的目的在于提供灰树花多糖合成相关酶,即β
‑
1,3葡聚糖基转移酶,同时提供灰树花β
‑
1,3葡聚糖基转移酶编码基因序列、基因沉默和基因过表达质粒、基因工程菌及生产方法。
6.为实现灰树花菌丝体多糖高效而稳定的合成和进一步提升灰树花发酵产品品质的目标,本发明首次从灰树花菌丝体基因组中克隆得到多糖合成关键酶-β
‑
1,3
‑
葡聚糖基转移酶的编码基因,并通过基因沉默证明该基因在灰树花菌丝体生长和多糖合成过程中的关键角色;
7.最后通过基因工程技术,在灰树花中过表达β
‑
1,3
‑
葡聚糖基转移酶,显著提高了重组菌株的多糖合成产量以及提高了胞外多糖的分支度。本发明将有助于从分子水平理解
食药用真菌多糖的合成机制,开展食药用真菌多糖合成的代谢工程研究和高效发酵生产品质稳定的多糖提供重要的技术支持和参考。
8.本发明通过rna干扰(rna interference,rnai)技术进行灰树花β
‑
1,3
‑
葡聚糖基转移酶基因沉默,以及通过同源重组技术进行灰树花β
‑
1,3
‑
葡聚糖基转移酶基因过表达,为分子水平理解食药用真菌多糖的合成机制和高效生产免疫增强剂多糖提供行之有效的解决策略和方法,所构建的重组菌株能以葡萄糖、淀粉水解物和木质纤维素等底物合成多糖。
9.本发明提供灰树花β
‑
1,3
‑
葡聚糖基转移酶(1,3
‑
beta
‑
glucanosyltransferase
‑
gfgel4),编码所述gfgel4基因序列全长1945bp,如seq id no.1所示;所述酶包括1个完整的开放阅读框,共编码554个氨基酸,如seq id no.2所示。
10.本发明还提供所述灰树花β
‑
1,3
‑
葡聚糖基转移酶在改变多糖合成量中的用途,所述改变包括上调或下调灰树花多糖合成量;进一步的,所述上调多糖合成量是通过表达编码灰树花β
‑
1,3
‑
葡聚糖基转移酶基因实现;所述下调多糖合成量是通过基因沉默编码灰树花β
‑
1,3
‑
葡聚糖基转移酶基因实现;进一步的,所述上调灰树花多糖合成量是通过表达灰树花β
‑
1,3
‑
葡聚糖基转移酶基因的全序列(seq id no.1)实现,所述下调灰树花多糖合成量是通过基因沉默灰树花β
‑
1,3
‑
葡聚糖基转移酶基因的保守序列(seq id no.3)实现。
11.本发明还提供所述灰树花β
‑
1,3
‑
葡聚糖基转移酶在改变胞外葡聚糖分支度中的用途,所述改变包括增大或减小灰树花胞外葡聚糖的分支度;进一步的,所述增大或者减小胞外葡聚糖分支度是通过表达或者基因沉默编码灰树花β
‑
1,3
‑
葡聚糖基转移酶基因实现。
12.本发明还提供两种重组载体,即过表达载体,所述载体包含所述灰树花β
‑
1,3
‑
葡聚糖基转移酶基因gdna序列(seq id no.1),用于增加灰树花胞外葡聚糖的分支度以及上调灰树花多糖合成量。所述重组载体是通过扩增β
‑
1,3
‑
葡聚糖基转移酶基因gdna序列(seq id no.1),经同源重组连接酶分别与质粒pan7
‑
gpd和pan7
‑
35s连接获得;根据本发明的实施例之一,所述的基因过表达载体为pan7
‑
gpd
‑
gfgel4和pan7
‑
35s
‑
gfgel4。
13.所述重组载体还包括灰树花gpd启动子(seq id no.4)和构巢曲霉35s启动子(seq id no.5),即基因沉默载体。质粒pan7
‑
1(购于湖南丰晖生物科技有限公司)经hindⅲ单酶切,将酶切产物与上述获得的35s启动子(seq id no.5)目的片段通过同源重组连接酶连接得到pan7
‑
35s质粒;pan7
‑
35s质粒经sbfⅰ和bamhⅰ双酶切,将酶切产物与上述获得的gpd启动子(seq id no.4)用同源重组连接酶连接得到pan7
‑
35s
‑
gpd质粒。pan7
‑
35s
‑
gpd质粒经sbfⅰ单酶切,将酶切产物与上述获得的灰树花β
‑
1,3
‑
葡聚糖基转移酶基因保守序列(seq id no.3)通过同源重组连接酶连接获得双向启动子沉默β
‑
1,3
‑
葡聚糖基转移酶基因保守区域的载体pan7
‑
gfgel4
‑
dual。
14.本发明还提供重组工程菌,所述重组工程菌包括所述的基因沉默载体或过表达载体。所述工程菌是通过制备不完全酶解的灰树花原生质体,并采用peg介导转化法将所述的重组载体转化该原生质体得到。
15.其中,所述制备不完全酶解的灰树花原生质体是通过将培养的灰树花菌丝体经0.3
‑
0.6m甘露醇溶液洗涤后,加入0.5
‑
4.0%溶壁酶(购自广东微生物研究所)在25
‑
45℃条件下酶解1
‑
5h,离心收集酶解后的不溶物,经过滤获得。
16.所述的peg介导转化法将基因沉默载体或过表达载体转入原生质体,是将基因沉
默载体pan7
‑
gfgel4
‑
dual或基因过表达载体pan7
‑
gpd
‑
gfgel4和pan7
‑
35s
‑
gfgel4与peg/cacl2溶液中混匀后添加到灰树花原生质体中,冰浴后再次加入peg/cacl2溶液,用stc buffer定容离心后重悬涂布于选择性再生cym培养基(潮霉素100μg/ml)抗性平板上,28℃条件培养筛选获得。
17.本发明还提供所述的重组工程菌在改变葡聚糖分支度中的用途;所述改变包括增加或减少灰树花胞外葡聚糖的分支度。
18.本发明还提供高产灰树花多糖的生产方法,采用所述灰树花重组工程菌,以葡萄糖、淀粉水解物或木质纤维素等底物生产,所述方法包括如下步骤:
19.(1)配制发酵培养基和种子培养基,其碳源为葡萄糖、或淀粉水解物或木质纤维素中的或两种,浓度为5.0~100.0g/l;
20.(2)培养所述的工程菌,在培养基中活化工程菌种子液,并在相应规模的发酵罐中逐级放大制备种子培养液;
21.(3)将工程菌种子液以5.0%
‑
15.0%的接种量接种到含有发酵培养基的摇瓶或发酵罐。
22.所述发酵罐培养条件:20℃
‑
30℃,通气量0.5
‑
2.0vvm,搅拌转速50
‑
500rpm,培养3
‑
10d;所述摇瓶条件为:20
‑
30℃,转速80
‑
200rpm,培养3
‑
10d。
23.使用该方法发酵重组灰树花可得多糖总产量为2.0
‑
50.0g/l以上。
24.(1)本发明通过采用过表达技术或基因沉默技术调控灰树花多糖的合成。经基因沉默的灰树花重组菌,菌体生长速度相对较慢,且多糖合成量和合成速度与原始菌株相比也有不同程度的下降,胞外葡聚糖的分支度相应减小,说明β
‑
1,3
‑
葡聚糖基转移酶在多糖合成过程中具有不可替代的作用。经基因过表达的灰树花重组菌,其多糖合成量和合成速度与原始菌株相比显著提高,胞外葡聚糖的分支度也相对增大。基因过表达灰树花重组菌在25l发酵罐发酵多糖的产量能够提高30%以上,胞外葡聚糖的溶解性更好,生物活性更高;还具有生长快、培养基廉价、遗传稳定、产量高等诸多优势,具有明显的工业化生产的潜力。本发明为利用基因工程技术改造出食药用真菌的多糖合成途径提供技术基础和方法指导。
附图说明
25.图1为灰树花β
‑
1,3
‑
葡聚糖基转移酶(gfgel4)基因的克隆结果;图中,a:gfgel4基因的gdna全长;b:gfgel4基因的cdna全长;m1:dna 5000maker,1为gfgel4
‑
gdna扩增产物;m2:dna 2000maker,2为gfgel4
‑
cdna扩增产物。。
26.图2为灰树花β
‑
1,3
‑
葡聚糖基转移酶基因的沉默载体pan7
‑
gfgel4
‑
dual构建示意图。
27.图3为灰树花β
‑
1,3
‑
葡聚糖基转移酶基因的过表达载体pan7
‑
35s
‑
gfgel4构建示意图。
28.图4为灰树花β
‑
1,3
‑
葡聚糖基转移酶基因的过表达载体pan7
‑
gpd
‑
gfgel4构建示意图。
29.图5为灰树花β
‑
1,3
‑
葡聚糖基转移酶peg介导转化及再生沉默重组菌在含有100μg/ml潮霉素培养基生长结果,其中wt表示原生质体在不含有潮霉素培养基上生长。
30.图6为灰树花β
‑
1,3
‑
葡聚糖基转移酶peg介导转化及再生过表达重组菌在含有100μg/ml潮霉素培养基生长结果。
31.图7为灰树花β
‑
1,3
‑
葡聚糖基转移酶基因沉默和基因过表达的灰树花重组菌在pda平板上生长15d的对比图。
32.图8、9为灰树花β
‑
1,3
‑
葡聚糖基转移酶基因沉默和基因过表达的灰树花重组菌在25
‑
l发酵罐条件下发酵合成多糖的结果。图中,wt:对照菌株;gfgel4
‑
i:沉默重组菌;gfgel4
‑
35s、gfgel4
‑
gpd:过表达重组菌。
33.图10为灰树花β
‑
1,3
‑
葡聚糖基转移酶基因沉默和基因过表达的灰树花重组菌的胞外多糖的单糖组成,图中,wt:对照菌株;gfgel4
‑
i:沉默重组菌;gfgel4
‑
35s、gfgel4
‑
gpd:过表达重组菌。
34.附表说明
35.表1为灰树花β
‑
1,3
‑
葡聚糖基转移酶基因沉默和基因过表达的灰树花重组菌胞外多糖的甲基化结果。
36.表1
37.具体实施方式
38.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
39.请参阅图1
‑
10,本发明提供技术方案:灰树花葡聚糖基转移酶gfgel4及其编码基因和应用,以下结合实例与附图对本发明的具体实施作进一步的说明,以下实施例中使用的质粒、pcr试剂等采用商业产品,具体操作按照说明书进行。但本发明的实施方式不限于此,其他未注明的实验操作和工艺参数按照常规技术进行。
40.本发明实施例中所述的葡聚糖测定方法如下:收集灰树花发酵醪,经10000g离心收集上清液,浓缩后使用95%乙醇按体积比1:3沉淀;10000g离心收集醇沉物,经50℃真空干燥至恒重,即为所产葡聚糖重量并记录。
41.本发明实施例中所述的葡聚糖中单糖组成测定方法如下:称取40mg葡聚糖样品,加入3ml 2mol/l的tfa溶液,110℃条件下水解3h,冷却至室温后,转移至旋转蒸发瓶,40℃旋干,然后加入3ml甲醇,40℃旋干(重复4次以完全除去tfa),加入3ml水溶解,过0.22μl滤膜备用。葡萄糖、甘露糖、半乳糖、木糖、阿拉伯糖、n
‑
乙酰氨基葡萄糖的标准品各5mg定容于
5ml容量瓶中,过0.22μl滤膜备用。色谱条件如下:carbopac pa20(3mm
×
150mm)阴离子交换色谱柱,carbopac pa20(3mm
×
50mm)保护柱,以氢氧化钠溶液(7mmol/l)洗脱,脉冲安培检测器检测。
42.本发明实施例中所述的葡聚糖中甲基化分析方法如下:称取10mg干燥的灰树花胞外粗多糖于1.5mldmso中,超声水浴20min;使样品充分溶解后加入过量的新鲜研磨的naoh粉末,继续超声水浴20min;冰浴冷却至样液凝固后在氮气保护下滴加过量的ch3i,在18℃
‑
20℃的水浴中超声30min;加入1ml含4mmol/l na2s2o3的水,终止甲基化反应。甲基化反应后,产物经水解、还原、乙酰化,得到部分甲基化的糖醇乙酰酯衍生物,然后进行gc
‑
ms分析,通过对gc峰的质谱图进行解析。
43.实施例1:灰树花β
‑
1,3
‑
葡聚糖基转移酶编码基因的克隆
44.离心收集灰树花gf02(购自美国模式培养物集存库,american type culture collection,60301
tm
)培养菌丝体,迅速加入液氮研磨成细粉,通过植物或者真菌基因组提取试剂盒提取基因组。
45.根据已公开的灰树花β
‑
1,3
‑
葡聚糖基转移酶基因(genbank id:a0h81_00473)设计引物,分别为:
46.gfgel4
‑
f(seq id no.7):5'ccacctccgcacacgcatc 3',
47.gfgel4
‑
r(seq id no.8):5'cgtgtccaccactctaccctc 3'。
48.以已经公布的灰树花的基因组(genbank assembly accession:gca_001683735.1)为模板采用上述引物扩增基因全长,pcr反应程序:94℃预变性3min;94℃变性20s,退火30s,退火温度52℃(温度由上、下游引物决定),72℃延伸2min 30s(时间由目的基因长度决定),反应35个循环;采用1%琼脂糖凝胶电泳分离pcr扩增产物,再用琼脂糖凝胶dna回收试剂盒回收目的基因片段(如图1所示)测序,然后将测序获得gfgel4基因序列,在ncbi中进行blast比对,确认其为编码灰树花β
‑
1,3
‑
葡聚糖基转移酶的基因序列。
49.将培养的灰树花gf02菌丝体收集并迅速在液氮中研成粉末状提取总rna。根据race技术,使用takara 3
’‑
full race core set v2.0试剂盒(takara code:d314)并设计特异性引物3race1(seq id no.9):5'
‑
ttctgggtatccatcctcgc
‑
3',3race2(seq id no.10):5'
‑
gatacccagaagtaggtca
‑
3',以灰树花总rna反转录的cdna为模板,pcr扩增获得gfgel4基因3’cdna特异片段,根据已经得到的灰树花基因特异片段,使用takara 5
’‑
full race kit(takara code:d315)试剂盒并设计特异性引物5race1(seq id no.11):5'
‑
cccatcagttctcttttgcg
‑
3',5race2(seq id no.12):5'
‑
aagaagaagaggctcgggca
‑
3',经去磷酸化反应,去帽子反应、5'race adaptor的连接以及反转录反应之后的cdna为模板,pcr扩增获得gfgel4基因5’cdna特异片段,经拼接得到gfgel4基因完整的cdna序列见seq id no.6。
50.实施例2:构建灰树花β
‑
1,3
‑
葡聚糖基转移酶基因序列的基因沉默载体pan7
‑
gfgel4
‑
dual与基因过表达载体pan7
‑
gpd
‑
gfgel4、pan7
‑
35s
‑
gfgel4
51.根据实施例1中克隆得到的灰树花β
‑
1,3
‑
葡聚糖基转移酶的基因序列(gfgel4),根据同源区域设计上下游含有同源臂的pcr引物,分别为:
52.gfgel4
‑
i
‑
tf(seq id no.13):5'
‑
ttgtacccaccagtacctgcaggaaaaatggcctcgccttcagct
‑
3',
53.gfgel4
‑
i
‑
tr(seq id no.14):5'
‑
gcagctttaagcttgcatgcctgcaggttttttaccgctgaagtcgcac
‑
3',
54.gfgel4
‑
tf35s(seq id no.15):5'
‑
cactccacatctccactcgacctgcaggccacctccgcacacgcatc
‑
3',
55.gfgel4
‑
tr35s(seq id no.16):5'
–
ggcagctttaagcttgcatgcctgcaggcgtgtccaccactctaccctc
‑
3',
56.gfgel4
‑
tfgbd(seq id no.17):5'
–
accagtacctgcaggcatgcaagctt cgtgtccaccactctaccctc
‑
3',
57.gfgel4
‑
trgbd(seq id no.18):5'
–
tgtaaaacgacggccagtgccaagcttccacctccgcacacgcatc
‑
3'。
58.以实施例1中得到的灰树花cdna为模板pcr扩增获得目的基因的片段gfgel4
‑
i(seq id no.3)与以灰树花gdna为模板pcr扩增获得目的基因的片段gfugt
‑
o(seq id no.1)。
59.根据灰树花gpd基因序列(genbank:a0h81_05461),设计gpd启动子引物为:
60.gpd
‑
f(seq id no.19):5'
‑
gagtagatgccgaccgcgggatcc aatcgtaattaggtggct
‑
3';
61.gpd
‑
r(seq id no.20):5'
‑
cagctttaagcttgcatgcctgcagg tactggtgggtacaaatga
‑
3'。
62.以实施例1中得到的灰树花总dna为模板pcr扩增目的基因(seq id no.4)。
63.根据质粒pan7
‑
1(购于湖南丰晖生物科技有限公司)中构巢曲霉35s启动子序列,设计35s启动子引物为:
64.35s
‑
f(seq id no.21):5'
‑
cgacctgcaggcatgcaagctt aaagctgcctaccagggact
‑
3';
65.35s
‑
r(seq id no.22):5'
‑
aaaacgacggccagtgccaagctt gatttcggcacggctacgg
‑
3'。
66.以质粒pan7
‑
1为模板pcr扩增目的基因(seq id no.5)。
67.将质粒pan7
‑
1(购于湖南丰晖生物科技有限公司)进行sbfⅰ与bamhⅰ双酶切,将酶切产物与上述获得的gpd启动子目的片段通过同源重组连接酶连接得到pan7
‑
gpd质粒;将质粒pan7
‑
1进行hindⅲ单酶切,将酶切产物与上述获得的35s启动子目的片段通过同源重组连接酶连接得到pan7
‑
35s质粒;pan7
‑
35s质粒经sbfⅰ和bamhⅰ双酶切,酶切产物与上述获得的gpd目的片段同源重组连接酶连接得到pan7
‑
35s
‑
gpd质粒。
68.pan7
‑
35s
‑
gpd质粒经sbfⅰ单酶切,酶切产物与上述获得的gfgel4
‑
i片段通过同源重组连接酶连接获得双向启动子沉默β
‑
1,3
‑
葡聚糖基转移酶基因保守区域的载体pan7
‑
gfgel4
‑
dual。(载体构建示意图如图2所示)。
69.pan7
‑
35s质粒经sbfⅰ单酶切,酶切产物与上述获得的gfugt
‑
o片段通过同源重组连接酶连接获得β
‑
1,3
‑
葡聚糖基转移酶基因的过表达载体pan7
‑
35s
‑
gfgel4。(载体构建示意图如图3所示)。
70.pan7
‑
gpd质粒经hindⅲ单酶切,酶切产物与上述获得的gfugt
‑
o片段通过同源重组连接酶连接获得β
‑
1,3
‑
葡聚糖基转移酶基因的过表达载体pan7
‑
gpd
‑
gfgel4。(载体构建
示意图如图4所示)。
71.实施例3:不完全酶解制备灰树花原生质体
72.收集灰树花pda液体培养所得菌丝体,组织粉碎机无菌条件下处理1min,以10%接种量接种于100ml pdb培养基,28℃静置培养4d后,5000g离心15min收集不溶物;用0.6m甘露醇溶液洗涤2次,加入1ml 2%丝状真菌破壁酶液,30℃酶解4h。将酶解液以5000g离心15min收集不溶物,无菌过滤得到酶解的原生质体;将制备的原生质体加入50ml再生cym培养基(葡萄糖20g蛋白胨2g酵母膏2g七水硫酸镁0.5g磷酸氢二钾1.0g磷酸二氢钾0.46g琼脂20g,潮霉素100μg/ml)中混匀,倒入平板,28℃培养再生。
73.实施例4:灰树花β
‑
1,3
‑
葡聚糖基转移酶基因沉默与过表达重组菌gfgel4
‑
i、gfgel4
‑
35s和gfgel4
‑
gpd的构建
74.取10μg质粒pan7
‑
gfgel4
‑
dual和50μl peg/cacl2溶液(25%peg4000和50mm cacl2)添加到100μl的灰树花原生质体溶液中,冰上孵育30分钟;再次加入0.5ml的peg/cacl2溶液,室温静置20min;用stc buffer定容至1ml,颠倒混匀,室温下放置5min;4000r/min离心10min,弃上清;用stc buffer重悬涂布于含有100μg/ml潮霉素b的选择性再生cym培养基上,28℃条件培养筛选获得灰树花β
‑
1,3
‑
葡聚糖基转移酶基因沉默重组菌gfgel4
‑
i,如图5所示。以同样的方法筛选获得了灰树花β
‑
1,3
‑
葡聚糖基转移酶基因的过表达重组菌gfgel4
‑
35s和gfgel4
‑
gpd,如图6所示。
75.由图5、6可知,灰树花出发菌株制备的原生质体在100μg/ml潮霉素抗性平板中再生被抑制;携带潮霉素抗性基因的空载体及沉默转化子转入原生质体后在28℃培养10d后均可再生;将灰树花出发菌株wt、对照菌株control、gfgel4
‑
i沉默菌株和gfgel4
‑
gpd、gfgel4
‑
35s过表达菌株用统一规格的打孔器接种至pda平板上培养15d,菌株生长情况如图7所示,由此可以看出,沉默转化子与过表达转化子的生长情况有较大差距,相较于对照菌株的生长状况,沉默转化子生长相对缓慢,而过表达菌株则相对较快;其中不同质粒构建的过表达转化子也体现出不同的生长状况,gfgel4
‑
gpd过表达转化子的生长速度要快于gfgel4
‑
35s过表达转化子。表明对β
‑
1,3
‑
葡聚糖基转移酶基因沉默导致了灰树花菌丝体的生长变缓,对其过表达则加快了灰树花菌丝体生长的生长。
76.实施例5:以葡萄糖为碳源灰树花重组菌gfgel4
‑
i、gfgel4
‑
35s和gfgel4
‑
gpd 25
‑
l发酵生产葡聚糖
77.(1)斜面培养基(g/l):土豆200,葡萄糖20,蛋白胨5,kh2po41.5,mgso4·
7h2o 0.75,ph自然。该培养基用于菌种保藏及活化。
78.一级种子培养基为(g/l):葡萄糖20,蛋白胨5,kh2po41.5,mgso4·
7h2o0.75,ph自然。
79.二级种子培养基为(g/l):葡萄糖30,蛋白胨6,kh2po43,mgso4·
7h2o 1.5,ph自然。
80.(2)发酵培养基为(g/l):葡萄糖60,蛋白胨6,kh2po46,mgso4·
7h2o1,大豆油50ml,ph自然。
81.(3)切取5mm
×
5mm的新鲜重组菌菌丝块置于斜面培养基上,于28℃的恒温培养箱中培养5d。
82.分别制备一级和二级种子培养基。接入10块5mm
×
5mm重组菌菌块,装液量为75/250ml,28℃、150rpm摇床培养3d,制得一级种子液。将一级种子液接种于二级种子培养基
中,接种量10%(v/v),装液量150/500ml,摇床(28℃,150rpm)培养3d,获得二级种子液。
83.(4)将培养好的二级种子液以10%的接种量,接种至25l发酵罐中,装液量60%,控制温度28℃,培养7d,控制搅拌转速和通气量分别为90rpm和0.8vvm。每24h取发酵醪,10000g离心10min后,得到灰树花菌丝体沉淀,蒸馏水反复洗涤菌体,冷冻干燥后称量计算菌丝体干重;上清液经浓缩乙醇沉淀,干燥后称量计算葡聚糖量,并检测葡聚糖样品中单糖组成。经发酵6d后,灰树花原始菌株wt菌体量为16.77g/l(如图8所示),胞外葡聚糖产量为5.65g/l(如图9所示);而灰树花β
‑
1,3
‑
葡聚糖基转移酶基因沉默重组菌gfgel4
‑
i的菌体量仅为12.7g/l,葡聚糖产量为3.38g/l,其葡萄糖组成相较于wt菌株的83.5%减少至78%;而β
‑
1,3
‑
葡聚糖基转移酶基因过表达菌株gfgel4
‑
35s和gfgel4
‑
gpd的菌体量均提高了5%以上,其中gfgel4
‑
gpd的菌体量最高提高了32%,达到22.1g/l,葡聚糖产量达为8.23g/l,其葡萄糖组成达88.07%以上(如图10所示)。这也表明,对β
‑
1,3
‑
葡聚糖基转移酶基因进行过表达或者对其保守区域进行基因沉默,对灰树花菌丝体生长和葡聚糖合成均有不同程度的影响。
84.实施例6:灰树花重组菌gfgel4
‑
i和gfgel4
‑
gpd所产胞外葡聚糖的分支度结构变化
85.灰树花胞外葡聚糖经甲基化处理后的产物,经水解、还原、乙酰化后由gc
‑
ms检测分析,确定了糖苷键的类型及比例关系。其中2,3,4,6
‑
四
‑
o
‑
甲基
‑
葡萄糖醇,表明了glcp
‑1→
的存在;2,4,6
‑
三
‑
o
‑
甲基
‑
葡萄糖醇,对应
→3‑
glcp
‑1→
键型;2,4
‑
二
‑
o
‑
甲基
‑
葡萄糖醇,对应
→
3,6
‑
glcp
‑1→
键型;其中灰树花原始菌株的胞外葡聚糖的三种衍生化产物比例为glcp
‑1→
:
→3‑
glcp
‑1→
:
→
3,6
‑
glcp
‑1→
=14.17%:61.8%:13.15%(如表1所示);而灰树花β
‑
1,3
‑
葡聚糖基转移酶基因沉默重组菌gfgel4
‑
i的三种衍生化产物比例为glcp
‑1→
:
→3‑
glcp
‑1→
:
→
3,6
‑
glcp
‑1→
=12.19%:62.87%:11.23%;对β
‑
1,3
‑
葡聚糖基转移酶基因进行过表达得到灰树花β
‑
1,3
‑
葡聚糖基转移酶基因过表达重组菌gfgel4
‑
gpd的三种衍生化产物比例为glcp
‑1→
:
→3‑
glcp
‑1→
:
→
3,6
‑
glcp
‑1→
=17.15%:58.1%:15.42%。β
‑
1,3
‑
葡聚糖基转移酶沉默菌株中β
‑
1,3
‑
连接的葡萄糖残基比例增加,而β
‑
1,3
‑
葡聚糖基转移酶过表达菌株中β
‑
1,3
‑
连接的葡萄糖残基比例则相应减少,末端葡萄糖和在分支点
→
3,6
‑
glcp
‑1→
的残基比例略有增加,表明被基因沉默的菌株其分支度明显有所下降,而过表达菌株的分支度则高于出发菌株,表明灰树花β
‑
1,3
‑
葡聚糖基转移酶能够对葡聚糖分支结构的形成有明显的调控作用。
86.seq id no.1:灰树花β
‑
1,3
‑
葡聚糖基转移酶gfgel4基因序列
87.atgtacaaccttccgcggttagcgaccgtgattgctggcgtcgccgccttcgcaagtggtgtccatgccatccagaatgttacaagaacgggcaggtacctctatactgctgatggaaacaggttcttcatcaagggtattgcataccaagaacaaggtgtgctggtcattcgtctcgtatgccaccttataacgagcggtttcaggcgccatctccacggacccaaacaatccattcttggagccctcaaatttcaccgaccccctcattgacggagcagcgtgttcgcgcgatcttcctttcctccagcagctcggggtcaacgccatccgtgtctacagtgtgaattcttcgcttaaccacgatgcctgcatgagcaccttcagcaatgcgggcatctataccatgtgcgaaattgtctccgtaatgtgttccacagaattctaacaaaactgcgattttcgcagtattgaccttgcactccccgtgaatgggtcgatcgaccgtgcttccccggcttggacgaccaatctcttggacctttacctcaatacgatcaacgtcttcaacaagtacgacaatgttttggcgtacaatgtaggtaacgaggttgtcatcgaccccactggcactggcgctgcagccttcatcaaggctgccgctcgcgacgtcaaa
tcatacctgtatggctcatgattaattacgttccttggcacgcgctgacgccgtctcggcactagcaaatccatttcatcgtctgcacttgttggctatgctgccattgatggagactccacctgggtggaccctctcgccaattacctcgactgtgatccctcgggctccaattccggagatacctccattgacctcttcggcctcaataactagtacgttgactgcgcattgttctattctcgtgcttacccacattcttttcccagcgagtggtgcgggaatgccaccgcaagcgtctatgccaccaagaacggtgacttcgcaggctacaacgttgcggcgtacttcagcgagttcggttgcattacctcccccccacgcctctggaccgaggtccaggcgctgttcagcagccccatgaccgacatctggtcgggtggcctcgccttcagctatttccctgcgaccagcagccagggccagttcggcattgtcaacatttcctctgacggatccacggtgacgacgggcgatgacttcagccgtctcaagacgcagtacagcgaggtctcgccgccgaacagccctaccctgagcagcgcaggtccgaatacgttctcggcgtgcccccaggagaactcgacattcctcgcgtcctcgacgcttcccccaacgcccaacgacgcggcatgtagctgcctggagagccagctgagctgccagttcacgcccaagaccacgaacaccagtggtatcgtcggcacgctcctcgataccgcgtgctcgttgcttggcggcactggcggctcctgcgccgccatctccgccaacgggaccaccggaacgtacgggagcgttgcgttctgcgaccctggtgcgcatctcggcttcttgttcttgccttctattcagtgctgacctcccgatattgcagacgtgaagctctcgttcgtgatgagcgagtattatgaggctacgggccgcctggcgacgtcgtgcgacttcagcggtaacgcgacggtcaacagcggggcgccctcgtccggcgcgaccgctgctgtcacgtcgtgtctggcgaacccttctgcgacgttcacccccagtgccccgactgtcaccccaggcggctcatcaacaggaacgtccagcgctggatcgtctgggtccagcaataacaagaacggcgctgtcgggctgctgggcaacccgcaggcgttggtggggctggcgtcgcgtgcatcttcagcgtcttgggcggtgtgttga
88.seq id no.2:灰树花β
‑
1,3
‑
葡聚糖基转移酶gfgel4基因编码氨基酸序列
89.mynlprlatviagvaafasgvhaiqnvtrtgrylytadgnrffikgiayqeqgaistdpnnpflepsnftdplidgaacsrdlpflqqlgvnairvysvnsslnhdacmstfsnagiytiidlalpvngsidraspawttnlldlylntinvfnkydnvlaynvgnevvidptgtgaaafikaaardvksylksisssalvgyaaidgdstwvdplanyldcdpsgsnsgdtsidlfglnnyewcgnatasvyatkngdfagynvaayfsefgcitspprlwtevqalfsspmtdiwsgglafsyfpatssqgqfgivnissdgstvttgddfsrlktqysevsppnsptlssagpntfsacpqenstflasstlpptpndaacsclesqlscqftpkttntsgivgtlldtacsllggtggscaaisangttgtygsvafcdpdvklsfvmseyyeatgrlatscdfsgnatvnsgapssgataavtsclanpsatftpsaptvtpggsstgtssagssgssnnkngavgllgnpqalvglasrassaswavc*
90.seq.id.no.3:灰树花β
‑
1,3
‑
葡聚糖基转移酶基因保守序列
91.tggcctcgccttcagctatttccctgcgaccagcagccagggccagttcggcattgtcaacatttcctctgacggatccacggtgacgacgggcgatgacttcagccgtctcaagacgcagtacagcgaggtctcgccgccgaacagccctaccctgagcagcgcaggtccgaatacgttctcggcgtgcccccaggagaactcgacattcctcgcgtcctcgacgcttcccccaacgcccaacgacgcggcatgtagctgcctggagagccagctgagctgccagttcacgcccaagaccacgaacaccagtggtatcgtcggcacgctcctcgataccgcgtgctcgttgcttggcggcaccggcggctcctgcgccgccatctccgccaacgggaccaccggaacgtacgggagcgttgcgttctgcgaccctgacgtgaagctctcgttcgtgatgagcgagtattatgaggctacgggccgcctggcgacgtcgtgcgacttcagcggt
92.seq.id.no.4:灰树花gpd启动子
93.tcgggatccccgtcgcattacacacattgttcgaacatgtacagagagtttgacagacaaaacagtaacacttgtttcgagagagacgctcgtagctaaacccgatgtccgaagaggaccctccccacgcgagtccgcaagatgaatgcgacagttggttgccacgagcacagagagcggcaaataccctcgagtcatcgtacggagcttgtcaatccagcaaatgtacacgagcatggcaggatccaatcgtaattaggtggctgagatctgaccaccgagaatgtgcgccctag
gggatgagtaaacgcacgtttgcgcgtgaatcagcgatgatgctgtacggtggtgcttagagatacgaaaagttgcaagtgaacgtaaatggaggaaagggactggttgggaatattcatgacaagctggctagaacaagtcggaaatctagtctgaggcaaagccaccagcggagagccgttcgcggccttgcggtgacagtcgggcaacggccggaagctgcccggtgtaatcatccatcttagataacgatcaccaccccaccctataagacccctctccatctctgctcttctccccatccttcgtctccaaaaccattatcctcagcaatgccagtgagtcctgcagacaatctgcatcgtcttcgagcatccgtctcacccgtggttttcacaggtcaaggtcggaatcaacgggtgcgtcggctgtgggtgtgtgaacgttcagactgattaataccgtttctcgtgtcgccctactccagcttcggtaagaacttgcatatttgctggcttcgccgtgctcacggcagtgtgtaggtcgcattggccgtattgtgctccgtaatgctctcctcaaccccgaaatcgaggtcgtcgctgtgaacgagtgcgtattagttgatccccacccaatctccactgacgtcatttgtacccaccagta
94.seq.id.no.5:构巢曲霉35s启动子
95.gatttcggcacggctacggaagacggagaagccaccttcagtggactcgagtaccatttaattctatttgtgtttgatcgagacctaatacagcccctacaacgaccatcaaagtcgtatagctaccagtgaggaagtggactcaaatcgacttcagcaacatctcctggataaactttaagcctaaactatacagaataagataggtggagagcttataccgagctcccaaatctgtccagatcatggttgaccggtgcctggatcttcctatagaatcatccttattcgttgacctagctgattctggagtgacccagagggtcatgacttgagcctaaaatccgccgcctccaccatttgtagaaaaatgtgacgaactcgtgagctctgtacagtgaccggtgactctttctggcatgcggagagacggacggacgcagagagaagggctgagtaataagccactggccagacagctctggcggctctgaggtgcagtggatgattattaatccgggaccggccgcccctccgccccgaagtggaaaggctggtgtgcccctcgttgaccaagaatctattgcatcatcggagaatatggagcttcatcgaatcaccggcagtaagcgaaggagaatgtgaagccaggggtgtatagccgtcggcgaaatagcatgccattaacctaggtacagaagtccaattgcttccgatctggtaaaagattcacgagatagtaccttctccgaagtaggtagagcgagtacccggcgcgtaagctccctaattggcccatccggcatctgtagggcgtccaaatatcgtgcctctcctgctttgcccggtgtatgaaaccggaaaggccgctcaggagctggccagcggcgcagaccgggaacacaagctggcagtcgacccatccggtgctctgcactcgacctgctgaggtccctcagtccctggtaggcagcttt
96.seqidno.6:灰树花β
‑
1,3
‑
葡聚糖基转移酶基因cdna序列
97.atgtacaaccttccgcggttagcgaccgtgattgctggcgtcgccgccttcgcaagtggtgtccatgccatccagaatgttacaagaacgggcaggtacctctatactgctgatggaaacaggttcttcatcaagggtattgcataccaagaacaaggcgccatctccacggacccaaacaatccattcttggagccctcaaatttcaccgaccccctcattgacggagcagcgtgttcgcgcgatcttcctttcctccagcagctcggggtcaacgccatccgtgtctacagtgtgaattcttcgcttaaccacgatgcctgcatgagcaccttcagcaatgcgggcatctataccattattgaccttgcactccccgtgaatgggtcgatcgaccgtgcttccccggcttggacgaccaatctcttggacctttacctcaatacgatcaacgtcttcaacaagtacgacaatgttttggcgtacaatgtaggtaacgaggttgtcatcgaccccactggcactggcgctgcagccttcatcaaggctgccgctcgcgacgtcaaatcatacctcaaatccatttcatcgtctgcacttgttggctatgctgccattgatggagactccacctgggtggaccctctcgccaattacctcgactgtgatccctcgggctccaattccggagatacctccattgacctcttcggcctcaataactacgagtggtgcgggaatgccaccgcaagcgtctatgccaccaagaacggtgacttcgcaggctacaacgttgcggcgtacttcagcgagttcggttgcattacctcccccccacgcctctggaccgaggtccaggcgctgttcagcagccccatgaccgacatctggtcgggtggcctcgccttcagctatttccctgcgaccagcagccagggccagttcggcattgtcaacatttcctctgacggatccacggtgacgacgggcgatgacttcagccgtctcaagacgcagtacagcgaggtctcgccgccgaacagccctaccctgagcagcgcaggtccgaatacgttctcggcgtgcccccaggagaactcgacattcctcgcgtcctcgacgcttcccccaa
cgcccaacgacgcggcatgtagctgcctggagagccagctgagctgccagttcacgcccaagaccacgaacaccagtggtatcgtcggcacgctcctcgataccgcgtgctcgttgcttggcggcaccggcggctcctgcgccgccatctccgccaacgggaccaccggaacgtacgggagcgttgcgttctgcgaccctgacgtgaagctctcgttcgtgatgagcgagtattatgaggctacgggccgcctggcgacgtcgtgcgacttcagcggtaacgcgacggtcaacagcggggcgccctcgtccggcgcgaccgctgctgtcacgtcgtgtctggcgaacccttctgcgacgttcacccccagtgccccgactgtcaccccaggcggctcatcaacaggaacgtccagcgctggatcgtctgggtccagcaataacaagaacggcgctgtcgggctgctgggcaacccgcaggcgttggtggggctggcgtcgcgtgcatcttcagcgtcttgggcggtgtgttga。
98.尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。