c-3全氟烷基化4-喹啉酮类化合物的制备方法
技术领域
1.本发明涉及有机合成领域,尤其涉及一种c-3全氟烷基化4-喹啉酮类化合物的制备方法。
背景技术:
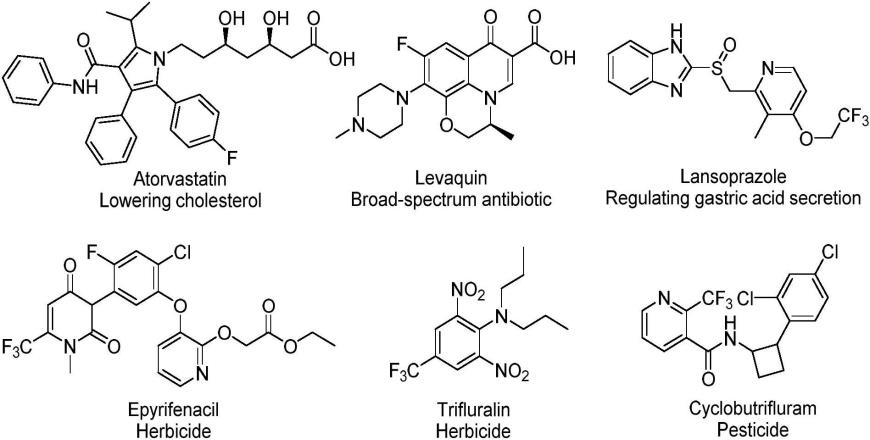
2.氟和含氟官能团作为有机化合物中重要的官能团,将氟原子结合到有机分子上可能会对母体化合物的立体化学、代谢稳定性和亲脂性产生深刻影响,因此,该类官能团广泛应用于药物、农药和材料中。据统计,目前fda-批准的药物中,有20-25%新药和约50%的农药含有氟原子,含氟原子的临床药物和农药实例如下:
[0003][0004]
4-喹啉酮类骨架广泛存在于天然产物和药物中,是组成天然产物的重要的骨架;目前,有文献报道4-喹啉酮类化合物在抗肿瘤、抗菌以及抗凝血等方面均有作用,如:2012年,shanahan等人使用各种卤化试剂获得了卤代2-庚基-4(1h)-喹啉酮类药物,通过对该类化合物进行研究发现,能够抑制铜绿假单胞菌群体效应。目前公开的制备c-3全氟烷基化4-喹啉酮类化合物的方法一般是通过将可见光照射(自由基反应)或电化学的方法易于全氟烷基,其反应流程见方案1a和1b。
[0005][0006]
上述方法虽然能够得到c-3三氟甲基取代的4-喹啉酮类药物,但是反应条件比较
苛刻,且对底物仍存在一些限制,例如,光照反应下,n-保护的4-喹啉酮类无法进行氟烷基化。因此,得到一种反应条件温和,对底物适应性广的c-3全氟烷基化4-喹啉酮类化合物的制备方法具有重要意义。
技术实现要素:
[0007]
有鉴于此,本发明所要解决的技术问题在于提供了一种c-3全氟烷基化4-喹啉酮类化合物的制备方法,本发明提供的方法不仅反应条件温和,而且对底物的适用性广。
[0008]
与现有技术相比,本发明提供了一种c-3全氟烷基化4-喹啉酮类化合物的制备方法,通过将式(i)结构的化合物与rfso2na混合反应,得到式(ii)结构的化合物,即为c-3全氟烷基化4-喹啉酮类化合物;其中,通过选择rfso2na作为全氟烷基氟源,并且选择特定的氧化剂(nh4)2s2o8或过氧叔丁醇,使得本发明提供的方法反应条件温和,且对不同基团取代的式(i)结构化合物的适用性较广,实验结果表明,本发明提供的方法反应收率相对较高,且可适用于大量的不同取代基的式(i)结构化合物上引入全氟烷基,具有很好的应用前景和研究价值。
附图说明
[0009]
图1为本发明实施例1得到的产物2a的氢谱图;
[0010]
图2为本发明实施例1得到的产物2a的碳谱图;
[0011]
图3为本发明实施例1得到的产物2a的氟谱图;
[0012]
图4为本发明实施例3得到的产物2ab的氢谱图;
[0013]
图5为本发明实施例3得到的产物2ab的碳谱图;
[0014]
图6为本发明实施例3得到的产物2ab的氟谱图。
具体实施方式
[0015]
本发明提供了一种c-3全氟烷基化4-喹啉酮类化合物的制备方法,包括:
[0016]
将式(i)结构的化合物与rfso2na混合反应,得到式(ii)结构的化合物,即为c-3全氟烷基化4-喹啉酮类化合物;
[0017][0018]
其中,所述r1为氢、c1~c15的含取代基的烷基或c1~c15的不含取代基的烷基;
[0019]
所述r2为氢、c1~c15的不含取代基的烷基、c1~c15的含取代基的烷基、c2~c10的不含取代基的乙烯基、c2~c10的含取代基的乙烯基、c6~c30的含取代基的芳香基、c6~c30的不含取代基的芳香基、c4~c10的杂芳基或c2~c5的酯基;
[0020]
所述r3为氢、卤素、c1~c10的未取代的烷基、c1~c10的未取代的烷氧基或者r3与其所在的碳和所在碳相邻的碳共同形成苯并杂环;
[0021]
所述rf为cf3、c6f
13
或c8f
17
;
[0022]
所述混合反应的氧化剂为(nh4)2s2o8或过氧叔丁醇。
[0023]
按照本发明,所述反应的溶剂为dmso、dmf和环丁砜中得一种或几种,更优选为dmso;所述氧化剂优选为(nh4)2s2o8;所述式(i)结构化合物与氧化剂的摩尔比优选为为1∶(1.8~2.6),更优选为1∶(2~2.2);所述式(i)结构的化合物与rfso2na的摩尔比优选为1∶(1.5~3),更优选为1∶(2~2.5);所述反应的温度优选为30~80℃,更优选为40~70℃,最优选为50~60℃;所述反应的氛围优选为惰性气体氛围,更优选为氮气氛围;所述反应的时间优选为4~16小时,更优选为6~12小时。
[0024]
按照本发明,本发明所述的式(i)化合物中:
[0025]
所述r1优选为氢、c1~c4的含取代基的烷基或c1~c4的不含取代基的烷基,更优选为氢、甲基、乙基、正丙基、异丙基、正丁基、苯基甲基。
[0026]
所述r2优选为氢、c1~c8的不含取代基的烷基、c1~c5的含取代基的烷基、c2~c5的不含取代基的乙烯基、c2~c10的含取代基的乙烯基、c6~c15的含取代基的芳香基、c6~c15的不含取代基的芳香基、c4~c8的杂芳基或c2~c4的酯基;其中,所述含取代基的烷基中的取代基优选为羟基或卤素,更优选为羟基、氟、氯、溴或碘;所述含取代基的乙烯基中的取代基优选为卤素或苯基,更优选为氟、氯、溴、碘或苯基;所述含取代基的芳香基的取代基优选为c1~c4的烷氧基、c1~c4的烷基、卤素、三氟甲氧基、三氟甲基或者取代基与芳香基所在的碳形成芳香基并杂环,更优选为甲基、乙基、正丙基、异丙基、正丁基、甲氧基、乙氧基、丙氧基、丁氧基、氟、氯、溴、碘、三氟甲氧基、三氟甲基;所述芳香基上的取代基优选为1个、2个或3个;所述杂芳基中的杂原子为氧、氮或硫;更具体的,所述r2为氢、苯基、甲基苯基、二甲基苯基、溴苯基、氯苯基、二氯苯基、三氟甲氧基苯基、呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、噁唑基、噻唑基、吡啶基、哌啶基、哌嗪基、哒嗪基、嘧啶基、吡嗪基、噻唑基、三氮唑基、四氮唑基、甲基、乙基、正丙基、异丙基、正丁基、正戊基、正己基、正庚基、正辛基、羟基甲基、2-羟基乙基、1-羟基乙基、羟基冰机、苯基甲基、三氟甲基苯基、甲酯甲酸基或乙酯甲酸基。
[0027]
所述r3优选为氢、卤素、c1~c6的未取代的烷基、c1~c6的未取代的烷氧基或者r3与其所在的碳和所在碳相邻的碳共同形成苯并杂环;其中,所述苯并杂环为苯并五元杂环或苯并六元杂环,其中,杂环上的杂原子为氧或氮,更具体的,所述r3为甲基、乙基、正丙基、异丙基、正丁基、甲氧基、乙氧基、丙氧基、丁氧基、氟、氯、溴、碘或与苯形成苯并五元杂环,其中,杂环上含有两个氧原子。
[0028]
更具体的,所述式(i)化合物为:
[0029][0030]
本发明提供了一种c-3全氟烷基化4-喹啉酮类化合物的制备方法,通过将式(i)结构的化合物与rfso2na混合反应,得到式(ii)结构的化合物,即为c-3全氟烷基化4-喹啉酮类化合物;其中,通过选择rfso2na作为全氟烷基氟源,并且选择特定的氧化剂(nh4)2s2o8或过氧叔丁醇,使得本发明提供的方法反应条件温和,且对不同基团取代的式(i)结构化合物的适用性较广,事实证明,本发明提供的方法反应收率相对较高,且可适用于大量的不同取代基的式(i)结构化合物上引入全氟烷基,具有很好的应用前景和研究价值。
[0031]
下面将结合本发明实施例的技术方案进行清楚、完整地描述,显然,所描述的实施
例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0032]
本发明所需化学品和溶剂都是市售的,无需进一步纯化即可使用。使用uv光(254nm)在硅胶板(gf254)上进行分析薄层色谱(tlc)。对于快速色谱,使用200-300目硅胶(中国青岛)。在400mhz下记录1h nmr谱。相对于dmso-d6(δ=2.50ppm)、cdcl3(δ=7.26ppm)、acteone-d6和cf3cood(δ=11.5ppm),化学位移以ppm为单位。数据报告如下:化学位移、多重性(s=单重态、d=双重态、t=三重态、q=四重态、m=多重态)、积分和耦合常数j(hz)。13c nmr光谱在100mhz下记录,质子完全去耦。相对于dmso-d6(δ=39.6ppm)、cdcl3(δ=77.2ppm)、200acteone-d6(δ=29.8ppm)或cf3cood(δ=164.2ppm),化学位移的报告单位为ppm。
19
f nmr在376mhz下记录。在bruker apex iv ftms光谱仪上记录高分辨率质谱(hrms)。
[0033]
实施例1
[0034]
在10毫升圆底烧瓶中,将4(1h)-喹啉酮(0.2mmol,1.0eq)、cf3so2na(0.4mmol,2.0eq)和(nh4)2s2o8(0.4mmol,2.0eq)溶解在4.0毫升dmso中。然后,将混合物在n2氛围下60℃搅拌4小时。通过tlc监测反应进程,反应完毕后,将反应液冷却至室温,用饱和nahco3(40m1)淬灭,并用etoac(3
×
30m1)萃取,合并萃取的有机层,并用饱和nacl(50m1)洗涤,并用无水na2so4干燥。将干燥好的有机层旋蒸得到粗产物,将还粗产物通过硅胶柱层析纯化,洗脱机为pe∶ea(1∶1),得到纯产物2a,为白色固体。
[0035]
对得到的2a进行核磁检测,其氢谱、碳谱和氟谱见图1~图3,图1为本发明实施例1得到的产物2a的氢谱图;图2为本发明实施例1得到的产物2a的碳谱图;图3为本发明实施例1得到的产物2a的氟谱图。其相关谱图数据结果如下:1h nmr(400mhz,dmso-d6)δ12.17(s,1h),8.16(d,j=8.0hz,1h),7.75(t,j=7.6hz,1h),7.67(d,j=8.0hz,1h),7.57(m,5h),7.45(t,j=8.0hz,1h);
13
c{1h}nmr(100mhz,dmso-d6)δ174.0,152.3,139.1,134.4,133.2,130.0,128.4,128.2,125.2,125.0,124.9,124.5(q,j=271.2hz),118.9,107.6(q,j=26.6hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-53.58.
[0036]
按照上述的实验方法,改变反应的部分条件,对反应的条件进行优化,改变方法见表1,表1为反应条件的优化结果。
[0037][0038]
表1反应条件的优化a[0039][0040]a反应条件:在60℃下,2-苯基-4(1h)-喹啉酮1a(0.2mmol)、naso2cf3(0.4mmol)、氧化剂(0.4mmol)、溶剂(4.0ml)。b分离产率。c5.0eq的氧化剂。d1.2eq或3.0eq的(nh4)2s2o8。e温度为90℃或40℃。f用zn(so2cf3)2代替naso2cf3。g反应在n2下进行。
[0041]
从表1可以看出,在dmso(表1,条目1)中获得的三氟甲基化产物2a产率为34%,而在其它溶剂中(条目12~14)2a的产率显著降低或未检测到所需产物。随后,对氧化剂进行了筛选,发现(nh4)2s2o8是最适合该反应的氧化剂,产物2a产率可达70%(表1,条目2)。虽然氧化剂tbhp(叔丁基氢过氧化物,浓度为70%)也可实现此转化,但与(nh4)2s2o8相比分离产率较低(表1,条目3)。而且我们也使用了其他氧化剂,如过氧化苯甲酸叔丁酯(tbpb)、氧酮、苯碘双(三氟乙酸)(pifa)、苯碘二乙酸(pida)和h2o2(浓度为30%),均不能使反应发生。为了中和反应过程中产生的酸性产物,筛选了cs2co3、k2co3、csf和三乙胺(tea)作为添加剂(表1,条目4-7)。所筛选的无机碱对该转化几乎没有影响,而tea抑制该反应,仅检测到痕量的2a。此外,增加或减少(nh4)2s2o8的量导致了产物2a的减少(表1,条目8)。提高或降低反应温度,也未获得更好的结果(表1,条目9)。当选择zn(so2cf3)2作为三氟甲基化试剂时,反应效率较低(表1,条目10)。最后,反应在氮气环境下进行,2a的分离产率提高到75%(表1,条目11)。因此我们认为,将2-苯基-4(1h)-喹啉酮(1a,1.0eq)与naso2cf3(2.0eq.)和(nh4)2s2o8(2.2eq)在dmso中反应温度为60℃并在n2条件下反应4小时,是在4-喹啉酮支架的c-3位置区域特异性引入cf3基团的最佳反应条件。
[0042]
实施例2
[0043]
2-苯基-4(1h)-喹啉酮类衍生物(1.0eq)、naso2cf3(2.0eq.)和(nh4)2s2o8(2.2eq)
溶解在dmso中于氮气氛围下,在60℃条件下反应4小时,按照实施例1的方法进行后处理,得到2b~2aa,其具体反应原料及反应结果如表2所示。
[0044]
表2.用于三氟甲基化反应的4-喹啉酮类的底物范围
[0045]
[0046][0047]
反应条件:1(0.2mmol)、naso2cf3(0.4mmol)和(nh4)2s2o8(0.4mmol)在dmso(4.0ml)中于60℃下在n2条件下搅拌4小时。b分离产率。
[0048]
从表2可以看出,我们将该方法扩展应用到4-喹啉酮类衍生物中,获得了多种有良好产率的3-三氟甲基化4-喹啉酮类化合物。首先,研究了取代基对4-喹啉酮类化合物2-苯
基环的影响。含电子供体基团的2-苯环(-ch3,-och3或亚甲二氧基)或卤素原子(无论邻位、间位或对位)均能够被良好的修饰,且能顺利转化为所需产物2b-2j,产率为34-79%。同时,该方案对在2-苯基进行取代的吸电子基团也有效(-cf3或-ocf3),产物2k和2l产率分别为54%和40%。值得一提的是,含有邻位取代的2-苯基部分的底物产率稍低(2e、2g和21),这可能是由于邻位基团的空间效应阻碍了底物的反应活性。随后,我们研究了4-喹啉酮类的芳烃部分不同取代基的作用。在大多数情况下,产物2m-2q有着良好的产率。此外,4-喹啉酮基芳香环上取代基的电子性质对这种转变有轻微的影响。值得注意的是,在4-喹啉酮骨架的c-2位置上的杂芳环(呋喃、噻吩和嘧啶),也能够很好的被取代基修饰,得到产物2r-2t,产率为46-62%。类似地,(e)-2-苯乙烯基-4(1h)-喹啉酮类也可以与该反应条件相适应,得到相应的产物2u产率为57%。令人兴奋的是,富电子取代基(呋喃、噻吩和苯乙烯基)与4-喹啉酮类主核之间没有发生明显的竞争性三氟甲基化反应。此外,将-4(1h)-喹啉酮和2,8-二甲基-4(1h)-喹啉酮直接加入反应体系,也获得了所需产物2v和2w,产率分别为23%和51%。重要的是,该方法也可用于生物活性性质产物2-庚基-4(1h)-喹啉酮(hhq,铜绿假单胞菌的关键信号分子)的后期功能化,得到的产物2x产率为48%。以上三种情况(2v-2x)表明,在我们的反应条件下,4-喹啉酮的c-2位上的烷基或氢原子是相容的,但4(1h)-喹啉酮的反应明显较差。此外,我们为了探索这种三氟甲基化方法的普遍适用性合成了n-保护的4-喹啉酮类化合物。研究发现n-甲基或n-苄基-4-喹啉酮类药物耐受性良好,相应的产品2y-2aa产率为48-56%。我们推断,具有不同取代基的4-喹啉酮类与该三氟甲基化反应相适应。
[0049]
对实施例2得到的化合物2b~2aa进行鉴定,其谱图数据如下:2b:white solid,45mg,73%yield.1h nmr(400mhz,dmso-d6)δ12.10(s,1h),8.15(d,j=8.0hz,1h),7.74(t,j=7.6hz,1h),7.67(d,j=7.6hz,1h),7.43-7.45(m,3h),7.36(d,j=8.0hz,2h),2.41(s,3h);
13
c{1h}nmr(100mhz,dmso-d6)δ174.0,152.4,139.7,139.1,133.0,131.6,128.8,128.1,125.1,125.0,124.8,124.7(q,j=271.1hz),118.8,107.6(q,j=26.4hz),21.0;
19
f{1h}nmr(376mhz,dmso-d6)δ-53.51;hrms(esi)m/z calcd for c
17h13
f3no[m h]
304.0941,found 304.0937.
[0050]
2c:white solid,50mg,79%yield.1h nmr(400mhz,dmso-d6)δ12.10(s,1h),8.15(d,j=8.0hz,1h),7.75(dt,j1=8.0hz,j2=1.2hz,1h),7.73(t,j=8.0hz,1h),7.66(d,j=8.0hz,1h),7.44(t,j=7.6hz,1h),7.21(s,1h),7.15(s,2h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.9,152.5,139.1,137.5,134.4,133.1,131.2,127.2,125.7,125.4,125.1,125.0,124.8,123.6,121.8,118.8,107.5(q,j=17.7hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-53.64;hrms(esi)m/z calcd for c
18h15
f3no[m h]
318.1105,found 318.1095.
[0051]
2d:white so1id,39mg,61%yield.1h nmr(400mhz,dmso-d6)δ12.08(s,1h),8.14(d,j=7.6hz,1h),7.74(dt,j1=8.0hz,j2=1.2hz,1h),7.67(d,j=8.0hz,1h),7.49(d,j=8.0hz,2h),7.44(dt,j1=8.0hz,j2=0.8hz,1h),7.11(d,j=8.0hz,2h),3.84(s,3h);
13
c{1h}nmr(100mhz,dmso-d6)δ174.0,160.6,152.3,139.1,133.0,129.8,126.5,125.1,125.0,124.7,124.6(q,j=180.8hz),118.8,113.7,107.5(q,j=17.5hz),55.5;
19
f{1h}nmr(376mhz,dmso-d6)δ-53.46.
[0052]
2e:white solid,22mg,35%yield.1h nmr(400mhz,dmso-d6)δ12.14(s,1h),8.16
(d,j=8.0hz,1h),7.74(t,j=7.2hz,1h),7.64(d,j=8.0hz,1h),7.54(t,j=8.0hz,1h),7.44(t,j=8.0hz,1h),7.40(d,j=7.6hz,1h),7.20(d,j=8.0hz,1h),7.11(t,j=7.6hz,1h),3.78(s,3h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.8,158.0,149.0,139.3,133.0,131.5,129.3,125.1,125.0,124.7,124.4(q,j=270.8hz),123.3,120.2,118.6,111.5,108.8(q,j=26.5hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-51.54;hrms(esi)m/z calcd for c
17h13
f3no2[m h]
320.0898,found 320.0895.
[0053]
2f:white solid,43mg,65%yield.1h nmr(400mhz,dmso-d6)δ12.11(s,1h),8.14(d,j=8.0hz,1h),7.73(t,j=6.8hz,1h),7.66(d,j=8.0hz,1h),7.46(t,j=8.0hz,1h),7.19(s,1h),7.09(d,j=8.0,1h),7.03(d,j=8.0,1h),6.14(s,2h);
13
c{1h}nmr(100mhz,dmso-d6)δ174.0,151.9,148.6,147.1,139.1,133.1,127.9,125.2,125.0,124.8,124.6(q,j=271.2hz),122.6,118.8,109.0,108.3,107.5(q,j=26.4hz),101.8;
19
f{1h}nmr(376mhz,dmso-d6)δ-53.64;hrms(esi)m/z calcd for c
17h11
f3no3[m h]
334.0691,found 334.0695.
[0054]
2g:white solid,32mg,44%yield.1h nmr(400mhz,dmso-d6)δ12.36(s,1h),8.18(d,j=8.0hz,1h),7.76-7.81(m,2h),7.46-7.65(m,5h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.9,150.1,139.2,135.4,132.4,130.2,127.8,125.1,124.4(q,j=271.2hz),121.3,118.8,108.3(q,j=26.2hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-55.94;hrms(esi)m/z calcd for c
16h10
brf3no[m h]
367.9898,found 367.9899.
[0055]
2h:white solid,57mg,77%yield.1h nmr(400mhz,dmso-d6)δ12.24(s,1h),8.16(d,j=8.0hz,1h),7.87(s,1h),7.79(d,j=8.0hz,2h),7.75(d,j=7.2hz,2h),7.65(d,j=8.0hz,1h),7.58(d,j=8.0hz,1h),7.52(t,j=7.6hz,1h),7.46(t,j=7.2hz,1h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.9,150.5,139.1,136.4,133.3,132.8,130.7,130.5,127.6,125.2,125.0,124.4(q,j=271.7hz),121.4,118.9,107.7(q,j=26.7hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-53.71;hrms(esi)m/z calcd for c
16h10
brf3no[m h]
367.9898,found 367.9889.
[0056]
2i:white solid,50mg,69%yield.1h nmr(400mhz,dmso-d6)δ12.18(s,1h),8.16(d,j=8.0hz,1h),7.73-7.78(m,3h),7.65(d,j=8.0hz,1h),7.53(d,j=8.0hz,2h),7.45(t,j=7.6hz,1h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.9,151.1,139.1,133.5,133.2,131.3,130.4,125.2,125.0,124.9,124.4(q,j=271.0hz),123.5,118.8,107.7(q,j=26.7hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-53.62;hrms(esi)m/z calcd for c
16h10
brf3no[m ]h]
367.9898,found 367.9899.
[0057]
2j:white solid,24mg,34%yield.1h nmr(400mhz,dmso-d6)δ12.29(s,1h),8.16(d,j=8.0hz,1h),7.87(s,1h),7.76-7.80(m,3h),7.63(d,j=8.0hz,1h),7.47(t,j=7.6hz,1h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.8,149.1,139.1,137.4,134.0,133.4,129.6,127.2,125.3,125.1,125.0,124.3(q,j=271.0hz),118.9,113.8,107.8(q,j=27.7hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-53.90;hrms(esi)m/z calcd for c
16
h9cl2f3no[m h]
358.0013,found 358.0002.
[0058]
2k:white solid,39mg,54%yield.1h nmr(400mhz,dmso-d6)δ12.27(s,1h),8.18(d,j=8.0hz,1h),8.02(s,1h),7.96(d,j=7.6hz,1h),7.90(d,j=7.6hz,1h),7.81(d,j=
7.6hz,1h),7.77(t,j=7.2hz,1h),7.66(d,j=8.0hz,1h),7.47(d,j=7.6hz,1h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.9,150.6,139.2,135.3,133.3,132.6,129.6,129.1(q,j=31.9hz),126.7,126.7,125.3,125.0,125.0,124.4(q,j=270.9hz),124.0(q,j=270.8hz),118.9,107.9(q,j=26.5hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-53.71,-61.10;hrms(esi)m/z calcd for c
17h10
f6no[m h]
358.0667,found 358.0667.
[0059]
2l:white solid,30mg,40%少eld.1h nmr(400mhz,dmso-d6)δ12.35(s,1h),8.18(dd,j1=8.0hz,j2=1.2hz,1h),7.71-7.80(m,3h),7.65(m,j=8.0hz,1h),7.59(t,j=7.2hz,1h),7.48(dt,j1=8.0hz,j2=1.2hz,1h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.6,146.3,145.3,139.2,133.3,132.2,130.8,127.4,127.3,125.1,125.0,124.1(q,j=271.0hz),120.4,119.9(q,j=256.6hz),118.7,108.3(q,j=26.8hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-56.49,-56.62;hrms(esi)m/z calcd for c
17h10
f6no2[m h]
374.0616,found 374.0624.
[0060]
2m:white solid,42mg,69%yield.1h nmr(400mhz,dmso-d6)δ12.34(s,1h),7.82(dd,j1=8.8hz,j2=2.4hz,1h),7.67-7.78(m,2h),7.57-7.59(m,5h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.2,160.5,158.0,152.4,135.9,134.2,130.1,128.4,128.2,126.6,126.5,124.4(q,j=270.9hz),122.1,121.9,121.8,109.4(q,j=22.7hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-53.69,-115.72;hrms(esi)m/z calcd for c
16h10
f4no[m h]
308.0699,found 308.0704.2n:white solid,50mg,68%yield.1h nmr(400mhz,dmso-d6)δ12.35(s,1h),8.24(d,j=2.0hz,1h),7.92(dd,j1=8.8hz,j2=1.6hz,1h),7.64(d,j=8.8hz,1h),7.58-7.63(m,5h);
13
c{1h}nmr(100mhz,dmso-d6)δ172.7,152.7,138.1,135.9,134.1,130.2,128.4,128.2,127.2,126.6,124.3(q,j=271.3hz),121.5,117.6,108.1(q,j=26.7hz);
19
f{1h}nmr(376mhz,dmso-d6)δ-53.81;hrms(esi)m/z calcd for c
16h10
brf3no[m h]
367.9898,found 367.9896.
[0061]
2o:white solid,55mg,79%yield.1h nmr(400mhz,dmso-d6)δ11.91(s,1h),7.48(s,1h),7.40(d,j=8.0hz,2h),7.35(d,j=8.0 hz,2h),7.12(s,1h),3.87(s,3h),3.85(s,3h),2.40(s,3h);
13
c{1h}nmr(100mhz,dmso-d6)δ172.8,153.7,150.7,147.6,139.6,134.8,131.8,128.8,128.2,127.5(q,j=271.1hz),119.1,106.7(q,j=26.3hz),104.2,99.7,55.8,55.7,21.0;
19
f{1h}nmr(376mhz,dmso-d6)δ-53.28;hrms(esi) m/z calcd for c
19h17
f3no3[m h]
364.1160,found 364.1165.
[0062]
2p:white solid,54mg,81%yield.1h nmr(400mhz,dmso-d6)δ12.02(s,1h),7.53-7.58(m,5h),7.44(s,1h),7.07(s,1h),6.19(s,2h);
13
c{1h}nmr(100mhz,dmso-d6)δ172.6,152.1,150.7,146.3,136.2,134.4,129.9,128.4,128.2,124.6(q,j=271.0hz),120.8,106.7(q,j=26.9hz),102.5,101.5,97.3;
19
f{1h}nmr(376mhz,dmso-d6)δ-53.55;hrms(esi)m/z calcd for c
17h11
f3no3[m h]
334.0691,found 334.0695.
[0063]
2q:white solid,55mg,83%yield.1h nmr(400mhz,dmso-d6)δ11.08(s,1h),8.43(d,j=8.8hz,1h)7.90-7.95(m,5h),7.61(d,j=8.8hz,1h),4.30(s,3h),2.69(s,3h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.9,160.1,153.1,138.7,134.4,129.9,128.6,128.1,124.5(q,j=271.0hz),124.4,123.2,120.4,119.9,112.7,109.7,107.1(q,j=26.4hz),56.3,9.7;
19
f{1h}nmr(376mhz,dmso-d6)δ-53.10;hrms(esi)m/z calcd for c
18h15
f3no2[m h]
1.39(m,8h),0.85(t,j=7.2hz,3h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.9,155.0,139.0,132.9,125.0,124.7,124.5,118.2,32.9,31.1,29.7,29.0,28.3,22.1,14.0;
19
f{1h}nmr(376mhz,dmso-d6)δ-54.85;hrms(esi)m/z calcd for c
17h21
f3no[m h]
312.1575,found 312.1564.
[0071]
2y:white so1id,25mg,49%yield.1h nmr(400mhz,dmso-d6)δ8.20(d,j=7.2hz,1h),7.90(d,j=8.4hz,1h),7.83(t,j=6.4hz,1h),7.50(t,j=6.8hz,1h),5.97(s,1h),4.73(s,2h),3.94(s,3h);
13
c{1h}nmr(100mhz,dmso-d6)δ173.0,154.6,141.0,133.5,126.5,125.6,125.0,125.0(q,j=272.2hz),117.6,108.8(q,j=26.6hz),57.4,35.9;
19
f{1h}nmr(376mhz,dmso-d6)δ-51.79;hrms(esi)m/z calcd for c
12h11
f3no2[m h]
258.0742,found 258.0747.
[0072]
2z:white solid,32mg,56%yield.1h nmr(400mhz,dmso-d6)δ8.24(d,j=8.0hz,1h),7.92-7.93(m,2h),7.58-7.62(m,1h),4.04(s,3h),3.78(s,3h);
13
c{1h}nmr(100mhz,dmso-d6)δ172.7,162.3,145.7,140.2,134.2,126.3,126.1,125.5,123.3(q,j=270.3hz),118.3,106.0(q,j=24.7hz),54.6,38.0;
19
f{1h}nmr(376mhz,dmso-d6)δ-58.25;hrms(esi)m/z calcd for c
13h11
f3no3[m h]
286.0691,found 286.0697.
[0073]
2aa:white so1id,29mg,48%yield.1h nmr(400mhz,dmso-d6)δ8.86(s,1h),8.25(d,j=8.0hz,1h),7.72(t,j=7.6hz,1h),7.66(d,j=8.0hz,1h),7.46(t,j=7.6hz,1h),7.34-7.38(m,2h),7.25-7.30(m,3h),5.68(s,2h);
13
c{1h}nmr(100mhz,dmso-d6)δ172.6,144.9,139.6,136.0,133.2,129.0,127.9,127.2,126.4,125.9,125.0,124.0(q,j=268.4hz),118.0,108.9(q,j=28.4hz),55.6;
19
f{1h}nmr(376mhz,dmso-d6)δ-56.71;hrms(esi)m/z calcd for c
17h13
f3no[m h]
304.0949,found 304.0953.
[0074]
实施例3
[0075]
此外,为了进一步证明该方法的实用性以及4-喹啉酮类的其他全氟烷基化反应,我们合成了具有长碳链的全氟烷基亚磺酸钠。首先,我们在实施例1得到的最佳反应条件下进行了2-苯基-4(1h)-喹啉酮(1a)与naso2c6f
13
和naso2c8f
17
的反应。具体实验步骤如下:
[0076]
制备全氟己基和全氟辛基4(1h)-喹啉酮类衍生物(2ab~2ap)
[0077]
在10毫升圆底烧瓶中,将4(1h)-喹啉酮(0.2mmol,1.0eq)、rfso2na(0.4mmol,2.0eq)和(nh4)2s2o8(0.4mmol,2.0eq)溶解在4.0毫升dmso中。然后,在n2下,将混合物在60℃搅拌12小时。通过tlc检测到转化完成,将反应冷却至室温,用饱和nahco3溶液(40ml)淬灭,并用etoac(3
×
30ml)萃取。合并的有机相进一步用饱和nacl(50ml)洗涤,用无水na2so4干燥。然后,在真空下浓缩有机相,得到粗产物,用硅胶色谱法用pe∶ea(3∶1)作为洗脱剂纯化,得到纯产物。
[0078]
对得到的化合物2ab~2ap的结构进行鉴定,其氢谱、碳谱和氟谱见图4~图6,图4为本发明实施例3得到的产物2ab的氢谱图;图5为本发明实施例3得到的产物2ab的碳谱图;图3为本发明实施例3得到的产物2ab的氟谱图。它们的谱图数据如下:2ab:white solid,104mg,83%yield.1h nmr(400mhz,dmso-d6)δ12.21(s,1h),8.14(d,j=7.2hz,1h),7.76(t,j=7.2hz,1h),7.65(d,j=8.0hz,1h),7.44-7.56(m,6h);
13
c{1h}nmr(100mhz,dmso-d6)δ174.2,154.2,138.9,134.6,133.3,127.9,125.2,125.1,125.1,118.8;
19
f{1h}nmr(376mhz,dmso-d6)δ-80.23(t,j=10.9hz,3f),-99.67(t,j=15.0hz,2f),-118.09(s,2f),-121.51
一-122.55(m,8f),-125.79(s,2f);hrms(esi)m/z calcd for c
23h11f17
no[m h]
640.0564,found 640.0567.
[0079]
2ac:white solid,107mg,88%yield.1h nmr(400mhz,dmso-d6)δ12.31(s,1h),8.15(dd,j1=8.0hz,j2=1.2hz,1h),7.83-7.86(m,3h),7.71-7.76(m,2h),7.63(d,j=8.0hz,1h),7.44(td,j1=8.0hz,j2=0.8hz,1h);
13
c{1h}nmr(100mhz,dmso-d6)δ174.2,159.0,152.4,139.0,135.5,133.3,132.4,129.1,128.7,126.2,126.2,125.4,125.3,125.2,125.0,122.6,118.9,108.9,106.3;
19
f{1h}nmr(376mhz,dmso-d6)δ-61.86
‑‑
61.94(m,3f),-80.85
‑‑
81.00(m,3f),-100.04
‑‑
100.14(m,2f),-118.015
‑‑
118.46(m,2f),-122.86
‑‑
123.05(m,4f),-126.32
‑‑
126.42(m,2f);hrms(esi)m/z calcd for c
22h10f16
no[m h]
608.0501,found 608.0507.
[0080]
2ad:white solid,116mg,82%yield.1h nmr(400mhz,cdcl3)δ10.96(s,1h),8.03(d,j=8.0hz,1h),7.76(d,j=7.2hz,1h),7.70(t,j=7.2hz,1h),7.60(s,1h),7.52(d,j=7.6hz,1h),7.39(t,j=7.2hz,2h),7.25(d,j=7.2hz,1h);
13
c{1h}nmr(100mhz,cdcl3)δ175.9,138.8,133.6,130.7,128.5,124.9,122.2,118.6;
19
f{1h}nmr(376mhz,cdcl3)δ-63.17
‑‑
63.24(m,3f),-80.69
‑‑
80.94(m,3f),-100.97(s,2f),-118.69(s,2f),-122.84
‑‑
122.87(m,8f),-126.27(s,2f);hrms(esi)m/z calcd for c
24h10f20
no[m h]
708.0443,found 708.0417.
[0081]
2ae:white so1id,131mg,91%yield.1h nmr(400mhz,acetone-d6)δ11.02(s,1h),8.24(dd,j1=7.2hz,j2=1.2hz,1h),7.76-7.78(m,1h),7.67-7.71(m,1h),7.67(d,j=8.4hz,2h),7.54(d,j=8.4hz,2h),7.38(td,j1=7.2hz,j2=1.2hz,1h);
13
c{1h}nmr(100mhz,acetone-d6)δ175.3,153.9,140.0,135.0,134.0,131.9,131.1,126.7,126.5,125.8,124.2,119.2,107.9(t,j=9.6hz);
19
f{1h}nmr(376mhz,acetone-d6)δ-81.63
‑‑
81.70(m,3f),-100.74
‑‑
100.84(m,2f),-118.86
‑‑
118.95(m,2f),-122.21
‑‑
122.27(m,6f),-123.32
‑‑
123.33(m,2f),-126.72
‑‑
126.82(m,2f);hrms(esi)m/z calcd for c
23
h9f
17
obr[m h]
717.9669,found 717.9659.
[0082]
2af:white solid,102mg,77%yield.1h nmr(400mhz,cdcl3 cd3od)δ8.23(d,j=8.0hz,1h),7.54-7.65(m,2h),7.36-7.39(m,1h),7.00-7.18(m,3h),2.33(s,6h);
13
c{1h}nmr(100mhz,cdcl3 cd3od)δ176.3,154.6,138.8,137.4,134.5,133.0,130.80,125.6,125.4,124.9,118.0,107.5,20.80;
19
f{1h}nmr(376mhz,cdcl3 cd3od)δ-77.23
‑‑
77.32(m,3f),-97.07
‑‑
97.13(m,2f),-114.37
‑‑
114.62(m,2f),-117.99
‑‑
119.08(m,8f),-122.52(s,2f);hrms(esi)m/z calcd for c
25h15f17
no[m h]
668.0882,found 668.0864.
[0083]
2ag:white solid,99mg,72%yield.1h nmr(400mhz,acetone-d6)δ10.90(s,1h),8.24(dd,j1=8.0hz,j2=1.2hz,1h),7.77(td,j=7.6hz,1h),7.68(d,j=8.0hz,1h),7.45(td,j1=7.6hz,j2=1.2hz,1h),7.09(d,j=1.2hz,1h),7.03(d,j=8.0hz,1h),6.96(d,j=8.0hz,1h),6.10(d,j=6.4hz,2h);
13
c{1h}nmr(100mhz,acetone-d6)δ175.4,154.6,149.5,148.1,140.0,133.8,129.4,126.6,126.4,125.6,123.2,119.1,109.7,108.5,102.7;
19
f{1h}nmr(376mhz,acetone-d6)δ-81.63
‑‑
81.81(m,3f),-100.74
‑‑
100.94(m,2f),-118.58
‑‑
118.63(m,2f),-122.19
‑‑
123.30(m,8f),-126.71
‑‑
126.81(m,2f);hrms(esi)m/z calcd for c
24h11f17
no3[m h]
684.0468,found 684.0440.
[0084]
2ah:white solid,122mg,85%yield.1h nmr(400mhz,acetone-d6)δ11.07(s,1h),8.35(d,j=2.4hz,1h),7.88(dd,j1=8.8hz,j2=2.0hz,1h),7.68(d,j=8.8hz,1h),7.57-7.50(m,5h);
13
c{1h}nmr(100mhz,acetone-d6)δ174.1,155.4,138.9,136.8,135.6,130.5,128.9,128.9,128.8,121.6,121.6,118.9,108.3(t,j=19.2hz);
19
f{1h}nmr(376mhz,acetone-d6)δ-81.63
‑‑
81.69(m,3f),-100.99
‑‑
101.09(m,2f),-118.81-一118.89(m,2f),-122.22
‑‑
123.34(m,8f),-126.72
‑‑
126.82(m,2f);hrms(esi)m/z calcd for c
23h10
brf
17
no[m h]
717.9669,found 717.9659.
[0085]
2ai:white solid,122mg,85%yield.1h nmr(400mhz,acetone-d6 cd3od)δ7.52(s,1h),7.49(s,5h),7.00(s,1h),6.17(s,2h);
13
c{1h}nmr(100mhz,acetone-d6 cd3od)δ174.6,153.7,147.9,137.0,135.9,130.4,129.0,128.8,122.3,103.6,102.9,97.6;
19
f{1h}nmr(376mhz,acetone-d6 cd3od)δ-81.74
‑‑
81.94(m,3f),-100.68
‑‑
100.78(m,2f),-118.78
‑‑
118.82(m,2f),-122.30
‑‑
123.39(m,8f),-126.80
‑‑
126.90(m,2f);hrms(esi)m/z calcd for c
24h11f17
no3[m h]
684.0462,found 684.0452.
[0086]
2aj:white solid,80mg,76%yield.1h nmr(400mhz,cdcl3 cd3od)δ8.24(d,j=8.0hz,1h),7.60-7.62(m,2h),7.52(d,j=8.0hz,1h),7.33-7.36(m,1h),6.80-6.85(m,1h),6.55-6.56(m,1h);
13
c{1h}nmr(100mhz,cdcl3 cd3od)δ176.1,145.2,144.4,143.1,138.8,133.2,127.9,125.9,125.3,118.1,113.4,111.4;
19
f{1h}nmr(376mhz,cdcl3 cd3od)δ-80.95
‑‑
81.15(m,3f),-104.40
‑‑
104.49(m,2f),-118.16
‑‑
118.20(m,2f),-122.19
‑‑
123.06(m,4f),-126.24
‑‑
126.50(m,2f);hrms(esi)m/z calcd for c
19
h9f
13
no2[m h]
530.0420,found 530.0414.
[0087]
2ak:white solid,90mg,83%yield.1h nmr(400mhz,acetone-d6)δ8.25(dd,j1=8.0hz,j2=1.2hz,1h),7.79(d,j=2.4hz,1h),7.75(td,j1=7.6hz,j2=1.2hz,1h),7.69(q,j=7.6hz,1h),7.58-7.60(m,1h),7.45(j1=7.2hz,j2=1.2hz,1h),7.32(d,j=4.8hz,1h);
13
c{1h}nmr(100mhz,acetone-d6)δ175.3,150.9,139.9,135.1,133.9,129.1,127.2,126.7,126.5,126.5,125.7,119.0;
19
f{1h}nmr(376mhz,acetone-d6)δ-81.69
‑‑
81.76(m,3f),-102.97
‑‑
102.07(m,2f),-118.97
‑‑
119.08(m,2f),-122.46
‑‑
122.50(m,2f),-123.20
‑‑
123.27(m,2f),-126.76
‑‑
126.85(m,2f);hrms(esi)m/z calcd for c
19
h9f
13
nos[m h]
546.0197,found 546.0162.
[0088]
2al:white solid,74mg,75%yield.1h nmr(400mhz,dmso-d6)δ10.49(s,1h),7.93(d,j=7.6hz,1h),7.55(d,j=7.2hz,1h),7.30(t,j=7.6hz,1h),2.62(t,j=8.0hz,3h),2.56(s,3h);
13
c{1h}nmr(100mhz,dmso-d6)δ174.0,153.7,137.4,134.0,126.7,125.3,124.5,123.1,19.6,17.5;
19
f{1h}nmr(376mhz,dmso-d6)δ-80.25(t,j=10.9hz,3f),-101.96(t,j=15.8hz,2f),一120.37(s,2f),-121.83(s,2f),-122.47(s,2f),-125.76
‑‑
122.86(m,2f);hrms(esi)m/z calcd for c
17h11f13
no[m h]
492.0628,found 492.0621.
[0089]
2am:white solid,104mg,80%yield.1h nmr(400mhz,cdcl3 cd3od)δ8.46(dd,j1=8.0hz,j2=1.2hz,1h),8.05(s,1h),7.62(t,j=8.0hz,1h),7.31-7.47(m,5h),7.16(d,j=7.6hz,2h),5.45(s,2h);
13
c{1h}nmr(100mhz,cdcl3 cd3od)δ174.2,145.3(t,j=10.5hz),139.5,134.1,133.4,129.5,128.8,128.1,127.4,126.1,125.6,116.7,109.0(t,j=21.5hz);
19
f{1h}nmr(376mhz,cdcl3 cd3od)δ-80.87-81.00(m,3f),-109.78
‑‑
109.87(m,
2f),-121.18
‑‑
122.83(m,10f),-126.19
‑‑
126.29(m,2f);hrms(esi)m/z calcd for c
24h12f17
no[m h]
654.0720,found 654.0719.
[0090]
实验发现,反应在4小时内反应不完全,得到所需产物2ab和2ac的产率为56%和53%。接下来,我们将反应时间延长到12小时,反应产物2ab和2ac产率都有所提高,分别为85%和83%(表3)。接着,我们选择含有不同取代基的4-喹啉酮类与naso2c6f
13
或naso2c8f
17
进行反应。结果见表3。表3为4-喹啉酮类的全氟烷基化的反应结果。
[0091]
表3 4-喹啉酮类的全氟烷基化
a,b
[0092][0093]
r1=h,benzyl;r2=h,alkyl,aryl;r3=h,br,alkoxy;rf=c6f
13 or c8f
17
.
[0094][0095]a反应条件:1(0.2mmol)、rfso2na(0.4mmol)和(nh4)2s2o8(0.4mmol)在dmso(4.0ml)中于60℃下在n2下搅拌12小时。b分离产率。
[0096]
从表3给出的数据可以看出,所有选定的化合物对转化都有良好的耐受性,得到的产物2ac~2ap产率在69-91%之间。其中,2-苯基环上带有吸电子基团的4-喹啉酮类化合物(2ad-2ag)比具有电子供体基团(2ah和2ai)的产率更高。此外,在4-喹啉酮类的芳烃环中,
取代基电子性质对产物(2aj和2ak)的产率没有显示出不利影响。接下来,在最佳条件下,将2-杂芳基环(呋喃和噻吩)取代的4-喹啉酮类作为底物,获得的相应产物(2al和2am)产率分别为76%和83%。最后,2,8-二甲基喹啉-4(1h)-酮和n-苄基-4-喹啉酮类与全氟烷基亚磺酸钠和(nh4)2s2o8的反应,也生成了相应的产物(2an-2ap)且产率良好,实验证明了本发明提供的制备方法具有4-喹啉酮类c3-h全氟烷基化的潜力。
[0097]
结论
[0098]
从实施例1~实施例3的记载可以看出,本发明开发了一种简便易行的制备c-3全氟烷基化4-喹啉酮类化合物的方法,即使用全氟烷基亚硫酸钠作为理想的全氟烷基自由基源,在c-3位对4-喹啉酮类进行全氟烷基化,这为4-喹啉酮的全氟基化的反应提供了一种重要的新方法。全氟烷基化反应表现出广泛的官能团耐受性,并得到了产率中等至良好的相应产物。此外我们通过机理的研究,证明了全氟烷基自由基参与了该过程。该方法为广谱4-喹啉酮类化合物的官能化提供了简便易行的途径,实验合成的化合物对继续合成具有生物活性的化合物具有很高的价值,该方法对未来药物的发现和修饰也具有显著影响。
[0099]
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。