1.本发明属于有机合成技术领域,尤其是指一种双芳氧功能化的咪唑盐稀土金属配合物及其在催化末端炔烃与二氧化碳羧化反应中的应用。
背景技术:
2.在化学和制药工业中,炔酸类化合物作为一种重要的有机合成中间体,在多种生物活性分子的合成中发挥了关键的作用,如具有抗疟疾特性的螺茚酮类化合物和具有抗真菌特性和抗癌细胞增殖的螺苯呋喃酮类化合物均需要通过合适的炔酸及其衍生物制备获得。因此,有关炔酸类化合物的合成方法受到了人们的广泛关注。通过末端炔烃与二氧化碳的羧化反应制备炔酸类化合物是一种简便、绿色的重要方法。目前,对此类反应有较好催化效果的催化剂主要包括铜、银、金等过渡金属化合物,稀土金属配合物以及有机分子催化剂。
3.关于过渡金属化合物催化体系的报道:
4.(1)2010年,zhang,y.g.课题组用铜和铜的氮杂环卡宾配合物催化端基炔和二氧化碳的羧化反应,催化剂用量2-5mol%,常温常压下反应16-24小时就能以高收率获得目标产物。(参见:zhang,y.g.;yu,d.y.pnas 2010,107,20184-20189.)。
5.(2)2010年,gooβen,l.j.课题组使用一种铜配合物催化端基炔和二氧化碳的羧化反应,在该催化体系中,对于脂肪类炔烃均能在50℃,1个大气压下反应16小时,获得目标产物,产率良好。但对于芳基炔烃,需要在5个大气压下才能实现顺利转化,操作较为复杂且危险。(参见:gooβen,l.j.;manjolinho,f.;lange,p.p.adv.synth.catal.2010,352,2913-2917.)。
6.(3)2011年,lu,x.b.课题组用碘化银催化端基炔和二氧化碳的羧化反应,以1mol%的催化剂用量,50℃下反应12个小时得到高产率的目标产物,但整个体系需要在2个大气压的条件下才能顺利进行,操作不便。(参见:lu,x.b.;zhang,x.;zhang,w.z.ren,x.;zhang,l.l.org.lett.2011,13,2402-2405.)。
7.(2)2018年,cheng,p.课题组使用一种双核的钼醇盐作为催化剂催化末端炔烃和二氧化碳的转化,仅需1.5mol%负载量,50℃,1个大气压下反应10小时,就能高效转化,但适用的反应底物较少。(参见:chen,h.j.;cheng,h.d.;fang,s.;ma,j.g.;cheng,p.green chem.,2018,20,989
–
996.)
8.(4)2019年,bao,m.课题组开发了首例无配体的简单铜盐和季铵盐在低沸点溶剂下构成的催化体系催化末端炔烃与二氧化碳的羧化反应,在常温常压下,反应20小时即可获得目标产物,但反应的底物范围有限,产率中等到良好。催化剂种类仍局限于铜、银催化剂。(参见:hong,s.h.;kim,s.h.;kim,k.h.angew.chem.int.ed.2014,53,771
–
774.)。
9.关于稀土金属催化体系的报道:
10.(1)2015年,zhao,b.课题组制备了一种桥联双酰胺基稀土胺化物,以四氢呋喃为
溶剂,将此配合物用于催化末端炔和二氧化碳的羧化反应中,催化剂用量为4mol%,在40℃,常压下反应24小时就可以以高收率得到目标产物。在温和的条件下,成功地合成了多种具有良好官能团耐受性的丙炔酸。(参见:cheng,h.;zhao,b.;yao,y.m.;lu,c.r.green chem.,2015,17,1675-1682.)
11.关于有机试剂催化体系的报道:
12.(1)2014年,kappe,c.o.课题组提出运用有机锂试剂催化端基炔和二氧化碳的羧化反应,整个体系在流动中进行,在少于5秒的时间内,就能得到较高的产率。但体系需在10个大气压下进行,反应条件苛刻,操作上存在安全隐患。(参见:kappe,c.o.;pieber,b.;glasnov,t.rsc adv.2014,4,13430-13433.)。
13.(2)2019年,bao,m.课题组开发了一种在低沸点溶剂中将季铵盐和无机碱结合使用的催化体系,作为催化末端炔烃和二氧化碳反应的新策略。在四正丁基醋酸铵和碳酸钾的双重作用下,能够在20个大气压,90℃下反应20小时,以优异收率获得相应的炔酸产物,由于反应温度需加热到90℃,存在一定的安全问题。(参见:wang,w.h.;feng,x.j.;sui,k.;fang,d.q.,bao.j.co
2 util.,2019,32,140-145.)。
14.(3)2021年,liu,n.课题组提出了一种末端炔烃与co2直接羧化的有机催化策略。将吡啶桥联的苯并咪唑盐双功能有机催化剂和cs2co3的结合使用,实现了在60℃和常压下反应24小时制备一系列丙炔酸衍生物,具有高收率和广泛的底物范围。这种有机催化方法为末端炔烃和co2的羧化提供了一种良好的有机分子催化的方法。(参见:shi,j.;bu,q.;liu b.;dai,b.;liu n.j.org.chem.,2021,86,1850-1860.)
15.尽管以上催化体系在催化末端炔烃和二氧化碳的反应中都表现出了不同程度的优点,但仍然具有很大的局限性。例如,金属配合物中金属种类单一,催化剂用量大,底物范围受限,反应时间过长,实验过程需要用到高温高压等危险条件等。因此,为了实现末端炔烃与二氧化碳高效转化为炔酸类化合物,开发一种简单易制备,反应条件温和,底物适应性好的催化剂是具有重要意义的。
技术实现要素:
16.为解决上述技术问题,本发明提供了一种双芳氧功能化的咪唑盐稀土金属配合物及其在催化末端炔烃与二氧化碳羧化反应中的应用。
17.本发明的第一个目的在于提供一种双芳氧功能化的咪唑盐稀土金属配合物,所述咪唑盐稀土金属配合物结构式:其中,所述re
为钇、镱、钐、钕或镧。
18.本发明的第二个目的在于提供双芳氧功能化的咪唑盐稀土金属配合物的制备方法,包括以下步骤:将re[n(sime3)2]3溶解于有机溶剂中得到re[n(sime3)2]3溶液,并逐滴加入h2lcl溶液,反应12~18小时,得到所述咪唑盐稀土金属配合物;其中,re为钇、镱、钐、钕或镧。
[0019]
在本发明的一个实施例中,所述h2lcl溶液中h2lcl通过以下方法制备得到:将2,4-二叔丁基-6-氯甲基苯酚溶解于有机溶剂中,并加入碱和咪唑,在80-110℃反应12-24小时,反应结束后,固液分离取固相,即得所述h2lcl;所述碱选自碳酸氢钠碳酸钠和碳酸钾中的一种或多种。
[0020]
在本发明的一个实施例中,所述2,4-二叔丁基-6-氯甲基苯酚与咪唑的摩尔比为2-4:1。
[0021]
在本发明的一个实施例中,所述re[n(sime3)2]3与h2lcl的摩尔比为1:1-3。
[0022]
本发明的第三个目的在于提供所述的咪唑盐稀土金属配合物在催化端基炔和二氧化碳羧化反应中的应用。
[0023]
催化反应的反应过程为:
[0024][0025]
在本发明的一个实施例中,所述反应的反应溶剂为甲苯、四氢呋喃、氯仿、二甲基亚砜和n,n-二甲基甲酰胺中的一种或多种。
[0026]
在本发明的一个实施例中,所述反应中还包括助催化剂,所述助催化剂选自为碳酸铯、碳酸钾、碳酸钠、三乙胺和1,8-二氮杂二环十一碳-7-烯(dbu)中的一种或多种。
[0027]
在本发明的一个实施例中,所述反应中端基炔、助催化剂与咪唑盐稀土金属配合物的摩尔比为100:100~400:1。
[0028]
在本发明的一个实施例中,所述反应的温度为25-60℃,反应时间为16-24小时。
[0029]
本发明的上述技术方案相比现有技术具有以下优点:
[0030]
1.本发明开发了一种新型的双芳氧功能化的咪唑盐稀土金属配合物,该配合物结构明确,易于制备,分离纯化简单,产率高;助催化剂碳酸铯易得。
[0031]
2.本发明公开的催化剂表现出了极高的催化活性,在末端炔烃与二氧化碳的羧基化反应中,催化剂用量仅为底物的1mol%,助催化剂用量是底物的2倍,目标产物的收率高,分离提纯的方法简单。
[0032]
3.本发明公开的制备方法中原料易得,底物适应性广,目标产物产率高,反应时间短,反应条件温和,在一个大气压下即可进行操作,操作过程简单安全。
附图说明
[0033]
为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中:
[0034]
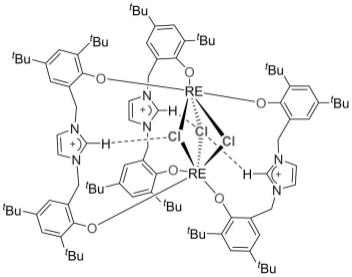
图1是本发明所用优选的y的催化剂的晶体结构。
具体实施方式
[0035]
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0036]
本发明的核心是将双芳氧功能化的咪唑盐作为配体制备双芳氧功能化的咪唑盐稀土金属配合物,该化合物的通式为:l3re2cl3。
[0037]
对比例1:200mol%的碳酸铯在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0038]
在无水无氧、氩气氛围中,在反应瓶中依次加入0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,抽干溶剂,得到产物,计算产率为63%。
[0039]
对比例2:1mol%的l3y2cl3在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0040]
在无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,计算产率为12%。
[0041]
实施例1:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0042]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为97%,核磁数据:1h nmr(400mhz,cdcl3):10.05(s,1h);7.63-7.59(m,2h,arh);7.51-7.44(m,1h,arh);7.40-7.36(m,2h,arh)。
[0043]
通过与对比例1和对比例2的结果比较,可以说明当l3y2cl3作为催化剂与助催化剂碳酸铯同时使用时,对末端炔烃与二氧化碳的羧化反应的催化效果显著提升,目标产物的收率接近当量转化的结果。
[0044]
实施例2:1mol%的l3y2cl3与100mol%的碳酸铯在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0045]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.1629克(5.00
×
10-4
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠
水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为90%。
[0046]
实施例3:0.5mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0047]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0045克(2.51
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为82%。
[0048]
实施例4:1mol%的l3yb2cl3与200mol%的碳酸铯在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0049]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0098克(5.01
×
10-6
摩尔)l3yb2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为95%。
[0050]
实施例5:1mol%的l3sm2cl3与200mol%的碳酸铯在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0051]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0096克(5.01
×
10-6
摩尔)l3sm2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为92%。
[0052]
实施例6:1mol%的l3nd2cl3与200mol%的碳酸铯在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0053]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0095克(5.01
×
10-6
摩尔)l3nd2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为93%。
[0054]
实施例7:1mol%的l3la2cl3与200mol%的碳酸铯在40℃常压下催化苯乙炔和二氧
化碳的羧化反应:
[0055]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0095克(5.01
×
10-6
摩尔)l3la2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为86%。
[0056]
实施例8:1mol%的l3y2cl3与200mol%的碳酸铯在25℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0057]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在25℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为25%。
[0058]
实施例9:1mol%的l3y2cl3与200mol%的碳酸铯在60℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0059]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在60℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为98%。
[0060]
实施例10:1mol%的l3y2cl3与200mol%的碳酸钠在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0061]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.1059克(1.00
×
10-3
摩尔)碳酸钠和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到得到产物,计算产率为6%。
[0062]
实施例11:1mol%的l3y2cl3与200mol%的碳酸钾在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0063]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.1382克(1.00
×
10-3
摩尔)碳酸钾和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二
氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到得到产物,计算产率为8%。
[0064]
实施例12:1mol%的l3y2cl3与200mol%的三乙胺在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0065]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.138毫升(9.93
×
10-4
摩尔)三乙胺和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为15%。
[0066]
实施例13:1mol%的l3y2cl3与200mol%的dbu在40℃常压下催化苯乙炔和二氧化碳的羧化反应:
[0067]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.149毫升(9.97
×
10-4
摩尔)dbu和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为30%。
[0068]
实施例14:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下甲苯中催化苯乙炔和二氧化碳的羧化反应:
[0069]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升甲苯,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到得到产物,计算产率为7%。
[0070]
实施例15:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下四氢呋喃中催化苯乙炔和二氧化碳的羧化反应:
[0071]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升四氢呋喃,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为14%。
[0072]
实施例16:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下n,n-二甲基甲酰胺中催化苯乙炔和二氧化碳的羧化反应:
[0073]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升n,n-二甲基甲酰胺,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为20%。
[0074]
实施例17:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下氯仿中催化苯乙炔和二氧化碳的羧化反应:
[0075]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升氯仿,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,加入硅胶拌样,通过快速柱层析分离得到产物,产率为12%。
[0076]
实施例18:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下反应16小时催化苯乙炔和二氧化碳的羧化反应:
[0077]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)苯乙炔,在40℃的恒温浴中搅拌反应16小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为68%。
[0078]
实施例19:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化4-叔丁基苯乙炔和二氧化碳的羧化反应:
[0079]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.090毫升(4.98
×
10-4
摩尔)4-叔丁基苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为96%。核磁数据:1h nmr(400mhz,cdcl3):10.66(s,1h,cooh),7.59-7.57(d,2h,arh),7.45-7.43(d,2h,arh),1.35(s,9h,ch3)。
[0080]
实施例20:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化4-乙炔联苯和二氧化碳的羧化反应:
[0081]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.089克(4.99
×
10-4
摩尔)4-乙炔联苯,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为96%。核磁数据:1h nmr(400mhz,dmso-d6):1h nmr(400mhz,dmso)δ:13.76(s,1h,cooh),7.79-7.77(d,2h,arh),7.74-7.71(dd,4h,arh),7.52-7.48(t,2h,arh),7.44-7.40(t,1h,arh)。
[0082]
实施例21:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化4-甲基苯乙炔和二氧化碳的羧化反应:
[0083]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.064毫升(4.96
×
10-4
摩尔)对甲基苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为90%。核磁数据:1h nmr(400mhz,dmso-d6)δ:7.52-7.49(d,2h,arh),7.28-7.26(d,2h,arh),2.35(s,3h,ch3)。
[0084]
实施例22:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化4-三氟甲基苯乙炔和二氧化碳的羧化反应:
[0085]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.089毫升(5.45
×
10-4
摩尔)4-三氟甲基苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为96%。核磁数据:1h nmr(400mhz,dmso-d6)δ:7.86-7.81(m,4h,arh)。
[0086]
实施例23:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化4-氟苯乙炔和二氧化碳的羧化反应:
[0087]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.060毫升(5.23
×
10-4
摩尔)4-氟苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为98%。核磁数据:1h nmr(400mhz,dmso-d6)δ:13.81(s,1h,cooh),7.73-7.70(m,2h,arh),7.35-7.31(t,2h,arh)。
[0088]
实施例24:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化4-氰基苯乙炔
和二氧化碳的羧化反应:
[0089]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.064克(5.03
×
10-4
摩尔)4-氰基苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为98%。核磁数据:1h nmr(400mhz,dmso-d6)δ:7.95-7.93(d,2h,arh),7.82-7.80(d,2h,arh)。
[0090]
实施例25:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化4-乙炔基苯甲醛和二氧化碳的羧化反应:
[0091]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.065克(4.99
×
10-4
摩尔)4-乙炔基苯甲醛,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为98%。核磁数据:1h nmr(400mhz,dmso-d6)δ:13.98(s,1h,cooh),10.06(s,1h,cho),7.99-7.97(d,2h,arh),7.85-7.83(d,2h,arh)。
[0092]
实施例26:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化对硝基苯乙炔和二氧化碳的羧化反应:
[0093]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.074克(5.03
×
10-4
摩尔)对硝基苯乙炔,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为96%。核磁数据:1h nmr(400mhz,dmso-d6)δ:8.30-8.27(d,2h,arh),7.92-7.90(d,2h,arh)。
[0094]
实施例27:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化2-乙炔噻吩和二氧化碳的羧化反应:
[0095]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.051毫升(5.09
×
10-4
摩尔)2-乙炔噻吩,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为99%。核磁数据:1h nmr(400mhz,dmso-d6)δ:13.85(s,1h,cooh),7.89-7.87(d,1h,arh),7.68-7.66(dd,1h,arh),7.21-7.18(dd,1h,arh)。
[0096]
实施例28:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化1-乙炔基萘和二氧化碳的羧化反应:
[0097]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.070毫升(4.92
×
10-4
摩尔)1-乙炔基萘,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,加入硅胶拌样,通过快速柱层析分离得到产物,产率为99%。核磁数据:1h nmr(400mhz,dmso-d6)δ:13.88(s,1h,cooh),8.24-8.22(d,1h,arh),8.13-8.11(d,1h,arh),8.04-8.02(d,1h,arh),7.93-7.92(d,1h,arh),7.72(s,1h,arh),7.65-7.64(d,1h,arh),7.60-7.58(d,1h,arh)。
[0098]
实施例29:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化9-乙炔基菲和二氧化碳的羧化反应:
[0099]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.102克(5.04
×
10-4
摩尔)9-乙炔基菲,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为99%。核磁数据:1h nmr(400mhz,dmso-d6)δ:14.01(s,1h,cooh),8.98
–
8.90(m,1h,arh),8.88-8.86(d,1h,arh),8.43(s,1h,arh),8.32-8.31(d,1h,arh),8.10-8.08(d,1h,arh),7.82(s,3h),7.74-7.71(t,1h)。
[0100]
实施例30:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化1-乙炔基芘和二氧化碳的羧化反应:
[0101]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.3258克(1.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.113克(4.99
×
10-4
摩尔)1-乙炔基芘,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为99%。核磁数据:1h nmr(400mhz,dmso-d6)δ:14.01(s,1h,cooh),8.49-8.39(m,4h,arh),8.33-8.32(d,3h,arh),8.24-8.22(d,1h,arh),8.18-8.14(t,1h,arh)。
[0102]
实施例31:1mol%的l3y2cl3与200mol%的碳酸铯在40℃常压下催化1,3-二乙炔苯和二氧化碳的羧化反应:
[0103]
无水无氧、氩气氛围中,在反应瓶中依次加入0.0090克(5.01
×
10-6
摩尔)l3y2cl3,0.6516克(2.00
×
10-3
摩尔)碳酸铯和1毫升二甲基亚砜,将反应装置内的氩气排尽后,在二氧化碳气袋保护下,再加入0.055毫升(5.01
×
10-4
摩尔)1,3-二乙炔苯,在40℃的恒温浴中搅拌反应20小时。反应结束后,加入10毫升去离子水淬灭反应,将反应后的混合物全部转入分液漏斗中,加入10毫升6摩尔每升的盐酸溶液酸化,无水乙醚萃取四次,萃取液再用饱和
氯化钠水溶液洗涤一遍,分液,无水硫酸钠干燥后过滤,通过快速柱层析分离得到产物,产率为95%。核磁数据:1h nmr(400mhz,dmso-d6)δ:13.92(s,2h,cooh),7.87(s,1h,arh),7.80-7.78(dd,j=7.8,2h,arh),7.60-7.56(t,1h,arh)。
[0104]
本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。通过上述实施例可以看出,本发明使用了一种新型的双芳氧功能化的咪唑盐稀土金属配合物l3re2cl3(h2lcl=1,3-bis(4,6-di-tert-butyl-2-hydroxybenzyl)-imidazoliumchloride,re=y,yb,sm,nd,la)与碱组成的双组分催化体系催化末端炔烃与二氧化碳的直接羧基化反应。其中,上述碱来源广泛,为碳酸铯、碳酸钾、碳酸钠、三乙胺及dbu中的一种;催化剂双芳氧功能化的咪唑盐稀土金属配合物l3re2cl3结构明确,制备简单,产率高。在该体系下,反应条件温和,底物适应性广泛,对苯乙炔类底物及各种杂芳环炔烃、稠芳环炔烃均能在较低温度、常压的条件下以优异收率获得目标产物。整个实验过程操作简单,后处理方便,安全性高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
