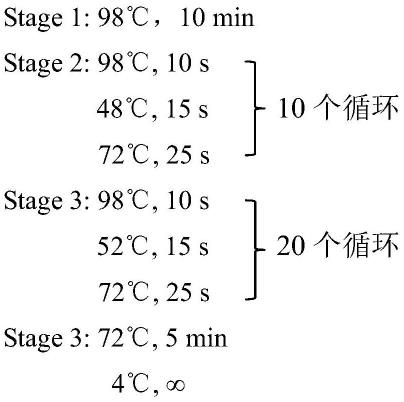
1.本发明涉及一种用于检测样品中的免疫球蛋白的方法,用于该方法的融合蛋白,以及尤其可以用于该方法中的具有改进特性的突变萤光素酶。
背景技术:
2.为了在受试者中测试过去或现在对感染的适应性免疫应答的证据,必须使用快速诊断测试或基于实验室的免疫测定形式进行针对传染剂或过敏原的血清学测定。
3.市场上有范围广泛的血清学测试。例如,基于实验室的免疫测定可以是酶免疫测定(eia)、放射免疫测定(ria)、荧光免疫测定(fia)、化学发光免疫测定(clia)或电致发光测定(ecl)。
4.然而,无论是任何用于血清学测试的方案,它都必须符合安全、质量和性能标准(关于分析的和临床的灵敏度和特异性)。
5.市场上用于检测和/或量化指示过去或现在感染的免疫球蛋白的大多数标准血清学测试都是敏感的,但它们需要相对大量的血浆(这在测试幼儿时可能是有问题的),并且还受到成本和需要特定仪器来分析测试结果的限制。因此,需要进一步开发以提高血清学测试的灵敏度,同时显著减少所需的样品体积和成本,同时不牺牲测定的稳健性、重现性和准确性。
技术实现要素:
6.现在,申请人已发现通过将骆驼科动物重链抗体(vhh)的可变结构域与源自oplophorus gracilirostris萤光素酶催化结构域的萤光素酶融合,在进行特异性免疫球蛋白的检测时可以减少样品体积,同时保持所需的特异性和灵敏度,动态范围增大并且测定时间更短。本技术的血清学测定设计可以用于快速诊断测试。因此,能够设计用于检测和/量化对任何感兴趣的传染病以及过敏或自身免疫性疾病具有特异性的免疫球蛋白的测定。
7.因此,本发明的一个主题是一种融合蛋白,其包含:
[0008]-n-末端结构域,其包含作为骆驼科动物重链抗体(vhh)的可变结构域或单链可变片段(scfv)并且针对免疫球蛋白的抗体
[0009]
和
[0010]-c-末端结构域,其包含具有萤光素酶活性的多肽:
[0011]-具有氨基酸序列seq id no:1或
[0012]-与氨基酸序列seq id no:1具有至少80%的氨基酸序列同一性。
[0013]
申请人还发现,使用nanokaz萤光素酶的特定突变体,其血清学测试的结果愈发改善。
[0014]
因此,本发明还涉及一种萤光素酶,其与氨基酸序列seq id no:1具有至少80%的氨基酸序列同一性并且包含至少一个选自以下的氨基酸替换:
[0015]-将在对应于seq id no:1第18位的位置的酪氨酸(y)替换为精氨酸(r),
[0016]-将在对应于seq id no:1第48位的位置的亮氨酸(l)替换为赖氨酸(k),
[0017]-将在对应于seq id no:1第56位的位置的异亮氨酸(i)替换为丙氨酸(a),
[0018]-将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f),
[0019]-将在对应于seq id no:1第134位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0020]-将在对应于seq id no:1第163位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0021]
和
[0022]-将在对应于seq id no:1第166位的位置的半胱氨酸(c)替换为丝氨酸(s)。
具体实施方式
[0023]
萤光素酶突变体
[0024]
如本文所用,“萤光素酶”是指产生生物发光的一类氧化酶。生物发光是在涉及通过酶氧化底物的生化反应中产生的光的发射。
[0025]
萤光素酶通常存在于低等生物体中,如细菌、真菌、昆虫、鞭毛藻、放射虫、刺胞动物、甲壳类动物、水母和头足类动物。在这些不同的萤光素酶中,来自深海虾oplophorus的萤光素酶具有有前景的特性(shimomura o,masugi t,johnson fh,haneda y.,properties and reaction mechanism of the bioluminescence system of the deep-sea shrimp oplophorus gracilirostris.biochemistry.1978年3月21日;17(6):994-8)。然而,这种异二聚体结构的具有萤光素酶活性的19kda亚基(kaz)没有保留天然酶的许多期望的特征,因为它在没有调节亚基的情况下不稳定并且表达不佳。已通过kaz序列中的三个氨基酸替换v44i、a54i和y138i(ekaz)使得对天然底物腔肠素的活性增加了七倍(inouye s,sato j,sahara-miura y,yoshida s,hosoya t.luminescence enhancement of the catalytic 19kda protein(kaz)of oplophorus luciferase by three amino acid substitutions.biochem biophys res commun.2014;445(1):157-162.)。
[0026]
已通过以下的蛋白质表面疏水氨基酸突变为亲水残基而优化了酶的折叠:a4e、f68d、l72q、m75k、p115e、和/或n166r。
[0027]
然后,hall等人已设计了一种源自oplophorus萤光素酶的19kda亚基的萤光素酶,其具有改进的稳定性,称为nanoluc、nluc以及nanokaz,具有以下突变:a4e、q11r、q18l、l27v、a33n、k43r、v44i、a54i、f68d、l72q、m75k、i90v、p115e、q124k、y138i、和n166r(hall mp,unch j,binkowski bf,valley mp,butler bl,wood mg,otto p,zimmerman k,vidugiris g,machleidt t,robers mb,benink ha,eggers ct,slater mr,meisenheimer pl,klaubert dh,fan f,encell lp,wood kv.engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate.acs chem biol.2012年11月16日;7(11):1848-57)。
[0028]
然而,nanokaz萤光素酶的特性仍然需要改进。
[0029]
现在,申请人已发现尤其是对新获得专利的底物,与nanokaz相比,nanokaz的特定突变体具有改进的溶解度和/或催化活性和/或每摩尔催化底物的光子发射(wo2018/
197727,coutant等人,2019,2020)。
[0030]
因此,本发明涉及一种萤光素酶,其与氨基酸序列seq id no:1具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的氨基酸序列同一性并且包含至少一个选自以下的氨基酸替换:
[0031]-将在对应于seq id no:1第18位的位置的酪氨酸(y)替换为精氨酸(r),
[0032]-将在对应于seq id no:1第48位的位置的亮氨酸(l)替换为赖氨酸(k),
[0033]-将在对应于seq id no:1第56位的位置的异亮氨酸(i)替换为丙氨酸(a),
[0034]-将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f),
[0035]-将在对应于seq id no:1第134位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0036]-将在对应于seq id no:1第163位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0037]
和
[0038]-将在对应于seq id no:1第166位的位置的半胱氨酸(c)替换为丝氨酸(s)。
[0039]
为了比较两个密切相关的多核苷酸或多肽序列的目的,可以使用比对程序(如可在blast.ncbi.nlm.nih.gov获得,2015年3月9日最后一次访问)使用标准设置来计算第一序列和第二序列之间的“同一性%”。同一性%是相同残基数除以参考序列中的残基数并乘以100。以上和权利要求书中提及的同一性%数字是通过该方法计算的百分比。同一性%的可选定义是相同残基数除以比对的残基数并乘以100。可选方法包括使用有空位的方法(gapped method),其中在评分参数中的空位分数(gap score)或空位罚分(gap cost)中考虑比对中的空位,例如一个序列相对于另一个序列的缺失。更多信息参见情况说明书,可在ftp.ncbi.nlm.nih.gov/pub/factsheets/howto_blastguide.pdf获得,2015年3月9日最后一次访问。
[0040]
萤光素酶可以包含至少1个、至少2个、至少3个、至少4个、至少5个、至少6个或至少7个或1、2、3、4、5、6或7个选自以下的氨基酸替换:
[0041]-将在对应于seq id no:1第18位的位置的酪氨酸(y)替换为精氨酸(r),
[0042]-将在对应于seq id no:1第48位的位置的亮氨酸(l)替换为赖氨酸(k),
[0043]-将在对应于seq id no:1第56位的位置的异亮氨酸(i)替换为丙氨酸(a),
[0044]-将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f),
[0045]-将在对应于seq id no:1第134位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0046]-将在对应于seq id no:1第163位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0047]
和
[0048]-将在对应于seq id no:1第166位的位置的半胱氨酸(c)替换为丝氨酸(s)。
[0049]
在一个实施方案中,将在对应于seq id no:1第134位的位置的色氨酸(w)替换为苏氨酸(t)。在可选的实施方案中,将在对应于seq id no:1第134位的位置的色氨酸(w)替换为谷氨酸(e)。
[0050]
在一个实施方案中,将在对应于seq id no:1第163位的位置的色氨酸(w)替换为
苏氨酸(t)。在可选的实施方案中,将在对应于seq id no:1第163位的位置的色氨酸(w)替换为谷氨酸(e)。
[0051]
在一个实施方案中,将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f)。
[0052]
在一个实施方案中,将在对应于seq id no:1第134位的位置的色氨酸(w)替换为苏氨酸(t)。
[0053]
在一个实施方案中,将在对应于seq id no:1第163位的位置的色氨酸(w)替换为苏氨酸(t)。
[0054]
在一个实施方案中,将在对应于seq id no:1第56位的位置的异亮氨酸(i)替换为丙氨酸(a)。
[0055]
在一个实施方案中,将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f),并将在对应于seq id no:1第134位的位置的色氨酸(w)替换为苏氨酸(t)。
[0056]
在一个实施方案中,将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f),并将在对应于seq id no:1第166位的位置的半胱氨酸(c)替换为丝氨酸(s)。
[0057]
在一个实施方案中,将在对应于seq id no:1第18位的位置的酪氨酸(y)替换为精氨酸(r),并将在对应于seq id no:1第48位的位置的亮氨酸(l)替换为赖氨酸(k),将在对应于seq id no:1第134位的位置的色氨酸(w)替换为谷氨酸(e),并将在对应于seq id no:1第163位的位置的色氨酸(w)替换为谷氨酸(e)。
[0058]
在一个实施方案中,将在对应于seq id no:1第18位的位置的酪氨酸(y)替换为精氨酸(r),将在对应于seq id no:1第48位的位置的亮氨酸(l)替换为赖氨酸(k),将在对应于seq id no:1第134位的位置的色氨酸(w)替换为谷氨酸(e),将在对应于seq id no:1第163位的位置的色氨酸(w)替换为谷氨酸(e),并将在对应于seq id no:1第166位的位置的半胱氨酸(c)替换为丝氨酸(s)。
[0059]
在一个实施方案中,将在对应于seq id no:1第18位的位置的酪氨酸(y)替换为精氨酸(r),将在对应于seq id no:1第48位的位置的亮氨酸(l)替换为赖氨酸(k),将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f),将在对应于seq id no:1第134位的位置的色氨酸(w)替换为谷氨酸(e),并将在对应于seq id no:1第163位的位置的色氨酸(w)替换为谷氨酸(e)。
[0060]
在一个实施方案中,将在对应于seq id no:1第18位的位置的酪氨酸(y)替换为精氨酸(r),将在对应于seq id no:1第48位的位置的亮氨酸(l)替换为赖氨酸(k),将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f),将在对应于seq id no:1第134位的位置的色氨酸(w)替换为谷氨酸(e),将在对应于seq id no:1第163位的位置的色氨酸(w)替换为谷氨酸(e),并将在对应于seq id no:1第166位的位置的半胱氨酸(c)替换为丝氨酸(s)。
[0061]
本发明还涉及一种萤光素酶,其具有选自以下的氨基酸序列:seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13、seq id no:14、seq id no:15、seq id no:16、和seq id no:17。
[0062]
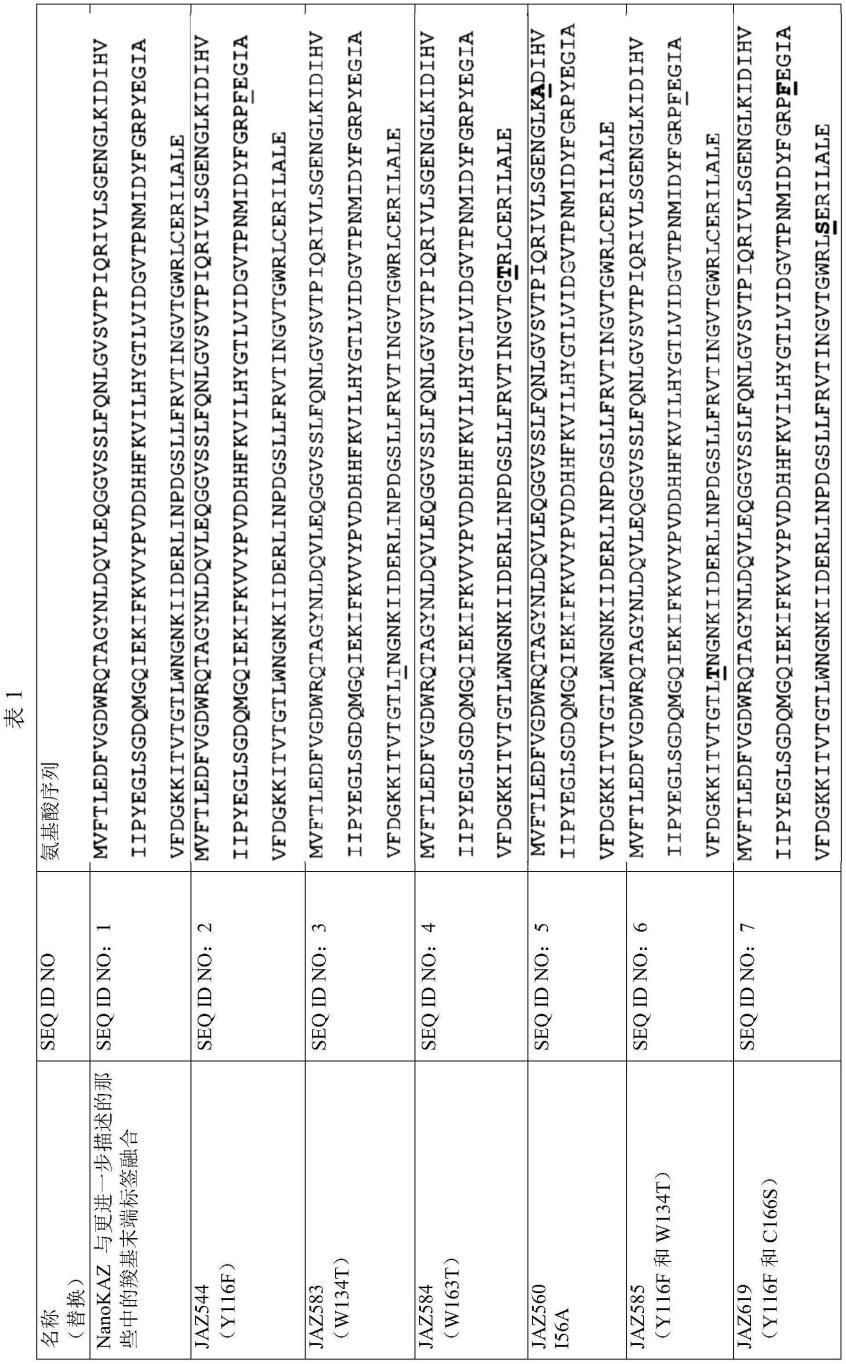
各种萤光素酶的氨基酸序列公开于下表1中。
[0063]
[0064]
[0065][0066]
优选地,萤光素酶具有氨基酸序列seq id no:1至seq id no:11,更优选seq id no:2、seq id no:6、seq id no:8、seq id no:10或seq id no:11。最优选地,萤光素酶具有
氨基酸序列seq id no:8、seq id no:11或seq id no:6。
[0067]
本发明还涉及具有萤光素酶活性的多肽,其包含2或3个选自以下的氨基酸序列:seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13、seq id no:14、seq id no:15、seq id no:16、和seq id no:17。
[0068]
此类多肽可以具有选自以下的氨基酸序列:seq id no:42、seq id no:43、seq id no:44和seq id no:45。
[0069]
本发明还涉及具有萤光素酶活性的多肽,其具有氨基酸序列seq id no:46。
[0070]
[0071][0072]
本发明的萤光素酶可以在n-末端、c-末端或两者处具有一个或多个异源氨基酸序列,其任选地直接或间接与感兴趣的分子相互作用。异源序列可以是标签,如用于纯化目的
的标签或感兴趣的肽或蛋白质。萤光素酶也可以与有机分子(如有机分子结合剂)连接。
[0073]
亲和标签可以用于萤光素酶氨基酸序列的c端,用于纯化、用于第二结合探针、用于结合珠、用于结合固体底物的目的。此类标签的氨基酸序列的例子在下表3中给出。
[0074]
表3
[0075]
名称seq id no氨基酸序列his-tagseq id no:18hhhhhhavitagseq id no:19glndifeaqkiewhesbp 37seq id no:20dekttgwrgghvveglageleqlrarlehhpqgqreptwin-strep-tagseq id no:21wshpqfekgggsgggsggsawshpqfekha-tagseq id no:22ypydvpdyamyc-tagseq id no:23eqkliseedl
[0076]
感兴趣的肽或蛋白质可以选自:骆驼科动物重链抗体的可变结构域(vhh)、单链可变片段(scfv)、重链可变区(vh)、免疫球蛋白(ig)、白介素、细胞因子、趋化因子、受体胞外域、肽抗原、肽过敏原、受体胞外域、病毒衣壳肽片段、细菌表面肽片段和细胞表面肽片段,但不限于此。
[0077]
接头可以插入于感兴趣的肽(例如vhh、scfv、vh、ig,但不限于此)或有机分子结合剂的氨基端和羧基端萤光素酶之间,用于连接两个结构域。接头可以具有0至10个残基。
[0078]
在一个实施方案中,可以直接连接用于连接两个结构域的感兴趣的肽或有机分子结合剂的氨基端和羧基端萤光素酶氨基酸序列,而不使用接头。
[0079]
接头的氨基酸序列公开于下表4中。
[0080]
表4.接头的氨基酸序列
[0081]
seq id no:氨基酸序列-无接头gsgsaaaaaaseq id no:24aaagsseq id no:25ggggsseq id no:26ggggsggggs
[0082]
当检测或测量目的必须或需要时,将接头插入于氨基端蛋白质结合结构域(vhh、scfv、vh、ig,但不限于此)、有机分子结合剂或感兴趣的肽序列和羧基端萤光素酶之间以连接两个结构域,具有蛋白酶特异性切割位点以用于释放萤光素酶的目的。此类凝血酶特异性的可切割接头的氨基酸序列如下,具有5至14个残基。凝血酶切割位点公开于下表5中。
[0083]
表5.凝血酶切割位点
[0084]
名称seq id no:氨基酸序列凝血酶切割位点seq id no:27lvprggs-凝血酶切割位点-gsseq id no:28gslvprgsaaags-凝血酶切割位点-gsseq id no:29aaagslvprgsg4s-凝血酶切割位点-g4sseq id no:30ggggslvprggggs
[0085]
特别地,本发明还涉及包含本发明的萤光素酶的融合蛋白。萤光素酶可以与感兴趣的肽连接。
[0086]
如上所述,感兴趣的肽可以选自:骆驼科动物重链抗体的可变结构域(vhh)、单链可变片段(scfv)、重链可变区(vh)、免疫球蛋白(ig)、白介素、细胞因子、趋化因子、受体胞外域、肽抗原、肽过敏原、受体胞外域、病毒衣壳肽片段、细菌表面肽片段和细胞表面肽片段,但不限于此。
[0087]
合适地,本发明的萤光素酶或包含萤光素酶的融合蛋白是重组的。重组是指萤光素酶或融合蛋白是以下中的至少一种的产物:突变或克隆步骤、或产生与自然界中发现的萤光素酶不同的萤光素酶(特别是与在自然界中发现的oplophorus的萤光素酶不同)的其他程序。
[0088]
本发明还涉及编码本发明的萤光素酶或包含本发明的萤光素酶的融合蛋白的多核苷酸。
[0089]
合适地,本发明的多核苷酸是重组的。如上所述,重组是指多核苷酸是以下中的至少一种的产物:克隆、限制或连接步骤、或产生与自然界中发现的多核苷酸不同的多核苷酸的其他程序。
[0090]
多核苷酸可以进一步编码与萤光素酶连接的感兴趣的多肽,其中所述感兴趣的多肽和所述萤光素酶能够表达为融合蛋白。
[0091]
有利地,可以对多核苷酸进行密码子优化以在宿主细胞中表达本发明的萤光素酶或包含萤光素酶的融合蛋白。
[0092]
感兴趣的多核苷酸可以包含选自以下的核苷酸序列:seq id no:31、seq id no:32、seq id no:33、seq id no:34、seq id no:35、seq id no:36、seq id no:37、seq id no:38、seq id no:39、seq id no:40、seq id no:41、seq id no:60、seq id no:61和seq id no:62。经表达优化的多核苷酸的实施方案的这些核苷酸序列总结于下表6中。
[0093]
[0094]
[0095]
[0096]
[0097]
[0098]
[0099]
[0100]
[0101][0102]
本发明还涉及包含本发明的多核苷酸的载体。
[0103]
如本文所用,载体(或质粒)是指用于将异源dna引入细胞中以使其表达或复制的
分离元件。此类载体的选择和使用对于本领域技术人员是众所周知的。表达载体包括能够表达与调节序列(如启动子)可操作地连接的dna的载体,所述调节序列能够影响此类dna片段的表达。因此,表达载体是指重组dna构建体,如质粒、噬菌体、重组病毒或其他载体,其在引入适当的宿主细胞后即引起所克隆dna的表达。适当的表达载体对于本领域技术人员是众所周知的。
[0104]
重组载体是包含重组多核苷酸的载体。
[0105]
有利地,载体包含可操作地连接至启动子的多核苷酸。
[0106]
如本文所用,可操作地连接是指dna与核苷酸的调节序列和效应序列(如启动子、增强子、转录和翻译终止位点、和其他信号序列)的功能关系。
[0107]
例如,dna可操作地连接至启动子是指dna与启动子之间的物理关系和功能关系,使得此类dna的转录通过rna聚合酶从启动子起始,所述rna聚合酶特异性识别、结合和转录所述dna。
[0108]
如本文所用,启动子是指控制可操作地连接至它的dna转录的dna片段。
[0109]
本发明的多核苷酸或载体可以进入细胞,通常是原核或真核细胞。载体可以保留在细胞质中,或者可以使用慢病毒载体或基因组编辑(即crispr-cas9,但不限于此)将多核苷酸掺入基因组中。
[0110]
因此,本发明还涉及包含本发明的多核苷酸或本发明的表达载体的细胞。
[0111]
在一个实施方案中,萤光素酶或包含萤光素酶的融合蛋白由原核或真核细胞分泌,在细胞质中表达或在细菌的情况下在周质中表达。
[0112]
在一个实施方案中,使用转录和翻译试剂盒在体外合成萤光素酶或包含萤光素酶的融合蛋白。
[0113]
本发明还涉及包含本发明的细胞或多核苷酸或载体的非人转基因动物。
[0114]
本发明还涉及一种试剂盒,其包含:
[0115]-本发明的萤光素酶、包含萤光素酶的融合蛋白、多核苷酸、表达载体或细胞
[0116]-萤光素酶的底物。
[0117]
优选地,试剂盒包含萤光素酶或融合蛋白和底物。
[0118]
腔肠素是虾oplophorus萤光素酶的天然底物,但使用furimazine可以获得信号的改善。
[0119]
因此,底物可以选自腔肠素、furimazine或其衍生物。
[0120]
furimazine衍生物及其处于稳态的前底物(pro-substrate)o-乙酰化部分公开于专利申请wo2018/197727a1中。此类furimazine衍生物在强度、信噪比和/或持续时间方面提供了更好的生物发光信号。
[0121]
因此,底物可以选自:
[0122]
8-苄基-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0123]
8-苄基-2-((5-乙基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0124]
8-苄基-2-((4,5-二甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0125]
8-苄基-6-(2-氟苯基)-2-(呋喃-2-基甲基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0126]
8-苄基-2-(3-甲基苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0127]
8-苄基-2-(3-甲氧基苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0128]
2,8-二苄基-6-(2-氟苯基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0129]
8-苄基-6-(2,6-二氟苯基)-2-(呋喃-2-基甲基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0130]
8-苄基-6-苯基-2-((5-(三氟甲基)呋喃-2-基)甲基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0131]
2,8-二苄基-6-(2,6-二氟苯基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0132]
8-苄基-6-(2-氟苯基)-2-((5-甲基呋喃-2-基)甲基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0133]
8-苄基-2-((5-环丙基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0134]
8-苄基-2-(3-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0135]
8-苄基-2-((5-乙基呋喃-2-基)甲基)-6-(2-氟苯基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0136]
8-苄基-6-(3-氟苯基)-2-((5-甲基呋喃-2-基)甲基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0137]
8-苄基-2-(2-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0138]
8-苄基-2-((5-乙基噻吩-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0139]
8-苄基-2-((4,5-二甲基呋喃-2-基)甲基)-6-(2-氟苯基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0140]
2-苄基-8-(2-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0141]
2-苄基-8-(3-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0142]
8-(3-氟苄基)-2-(呋喃-2-基甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0143]
8-(2-氟苄基)-2-(3-甲基苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0144]
8-(2-氟苄基)-2-(3-甲氧基苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0145]
8-(2-氟苄基)-2-(呋喃-2-基甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0146]
8-(2-氟苄基)-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0147]
8-(3-氟苄基)-2-(3-甲氧基苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0148]
8-(3-氟苄基)-2-(3-甲基苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0149]
2-((5-乙基呋喃-2-基)甲基)-8-(3-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0150]
8-(2-氯苄基)-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0151]
8-(3-氟苄基)-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0152]
2-((5-乙基呋喃-2-基)甲基)-8-(2-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0153]
8-(3-氟苄基)-6-(2-氟苯基)-2-((5-甲基呋喃-2-基)甲基)咪唑并[1,2-a]吡嗪-3(7h)-酮
[0154]
8-(2,3-二氟苄基)-2-(呋喃-2-基甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0155]
8-(2,3-二氟苄基)-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3
(7h)-酮
[0156]
2-苄基-8-(2,3-二氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0157]
8-(2,6-二氟苄基)-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0158]
8-(2,3-二氟苄基)-2-((4,5-二甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0159]
8-(2,3-二氟苄基)-2-((5-乙基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0160]
8-(2,6-二氟苄基)-2-((5-乙基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0161]
2-((4,5-二甲基呋喃-2-基)甲基)-8-(2-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0162]
2-((4,5-二甲基呋喃-2-基)甲基)-8-(3-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0163]
8-(2,3-二氟苄基)-2-((4-乙基-5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0164]
8-(2,3-二氟苄基)-2-((5-乙基-4-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮,和
[0165]
8-苄基-2-(呋喃-2-基甲基)-6-(3-羟基苯基)咪唑并[1,2-a]吡嗪-3(7h)-酮。
[0166]
这些底物分别公开于wo2018/197727a1中,具有以下名称:q3、q12、q16、q21、q14、q18、q20、q27、q28、q29、q34、q36、q41、q51、q54、q56、q58、q61、q72、q73、q81、q82、q83、q84、q85、q101、q100、q99、q98、q97、q96、q105、q107、q108、q117、q121、q124、q127、q129、q131、q132、q135、q143和q149。
[0167]
在优选的实施方案中,底物是8-(2,3-二氟苄基)-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮(如wo2018/197727a1第129页的表1中所公开的q-108)。
[0168]
本发明还涉及一种用于产生本发明的萤光素酶的方法,所述方法包括以下步骤:
[0169]-提供具有以下氨基酸序列的萤光素酶:seq id no:1或其变体,所述变体与氨基酸序列seq id no:1具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的氨基酸序列同一性,和
[0170]-至少1、2、3、4、5、6、7个选自以下的步骤:
[0171]-将在对应于seq id no:1第18位的位置的酪氨酸(y)替换为精氨酸(r),
[0172]-将在对应于seq id no:1第48位的位置的亮氨酸(l)替换为赖氨酸(k),
[0173]-将在对应于seq id no:1第56位的位置的异亮氨酸(i)替换为丙氨酸(a),
[0174]-将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f),
[0175]-将在对应于seq id no:1第134位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0176]-将在对应于seq id no:1第163位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0177]
和
[0178]-将在对应于seq id no:1第166位的位置的半胱氨酸(c)替换为丝氨酸(s),或其组合。
[0179]
本发明还涉及一种产生本发明的萤光素酶或包含本发明的萤光素酶的融合蛋白的方法,所述方法包括以下步骤:
[0180]-在允许萤光素酶表达的条件下将本发明的载体引入细胞,和/或
[0181]-在允许萤光素酶表达的条件下培养本发明的细胞。
[0182]
本发明还涉及本发明的萤光素酶或包含本发明的萤光素酶的融合蛋白在发光反应中的用途;所述用途包含添加萤光素酶的底物。
[0183]
本发明提供一种方法,其包括以下步骤:
[0184]
(a)将萤光素酶或融合蛋白暴露于底物,和
[0185]
(b)检测发光。
[0186]
在暴露之前,可以将根据本发明的多核苷酸引入细胞和/或可以表达萤光素酶或融合蛋白。
[0187]
所述方法可以是体外的、离体的或体内的。
[0188]
融合蛋白
[0189]
如发明内容所述,本发明涉及一种融合蛋白,其包含:
[0190]-n-末端结构域,其包含作为骆驼科动物重链抗体(vhh)的可变结构域或单链可变片段(scfv)的针对免疫球蛋白的抗体
[0191]
和
[0192]-c-末端结构域,其包含具有萤光素酶活性的多肽:
[0193]-具有氨基酸序列seq id no:1或
[0194]-与氨基酸序列seq id no:1具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的氨基酸序列同一性。
[0195]
在一个实施方案中,融合蛋白包含
[0196]-n-末端结构域,其包含针对免疫球蛋白的单链可变片段(scfv)
[0197]
和
[0198]-c-末端结构域,其包含具有萤光素酶活性的多肽:
[0199]-具有氨基酸序列seq id no:1或
[0200]-与氨基酸序列seq id no:1具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的氨基酸序列同一性。
[0201]
单链可变片段(scfv)是免疫球蛋白重链(vh)和轻链(vl)可变区通过接头连接的融合蛋白。
[0202]
在另一个实施方案中,融合蛋白包含:
[0203]-n-末端结构域,其包含针对免疫球蛋白的骆驼科动物重链抗体(vhh)的可变结构域
[0204]
和
[0205]-c-末端结构域,其包含具有萤光素酶活性的多肽:
[0206]-具有氨基酸序列seq id no:1或
[0207]-与氨基酸序列seq id no:1具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的氨基酸序列同一性。
[0208]
vhh是骆驼科动物重链抗体的可变结构域。事实上,在骆驼科的成员中,相当大比例的血清抗体是同型二聚体igg,分子量为约80kd(hamers-casterman等人,1993nature,363,446-448)。这些重链免疫球蛋白(ig)含有三个结构域,其可变区称为vhh。重组vhh(约12-14kd大小)构成完整的抗原结合结构域并表现出广泛的抗原结合库(repertoire)。其高变区经扩展并表现出独特的特征,如将三至四个疏水框架残基(与常规抗体中的vl相互作用)替换为更亲水的氨基酸。为了稳定经扩大的cdr,vhh除了典型的二硫键外还可以在单峰骆驼的cdr1和cdr3之间及美洲驼的cdr2和cdr3之间拥有额外的二硫键(harmsen和de haard 2007appl microbiol biotechnol.,77,13-22;muyldermans 2001j biotechnol.,74,277-302)。经扩大的cdr3环可以采用凸形构象,而常规互补位仅限于凹形或平面结构(muyldermans 2001j biotechnol.,74,277-302)。这些特征允许vhh识别对于常规抗体免疫原性差的独特表位(lafaye等人,2009mol immuno.,46,695-704;wernery 2001j vet med b infect dis vet public health.,48,561-568)。尽管vhh根据定义是单价抗体,默认排除任何亲合力效应,但其生物活性(体外测量为ic50)可以与传统的二价抗体分子相似(thys等人,2010antiviral res.,87,257-264)。
[0209]
vhh可以从已知的vhh中选择。根据本发明可以使用的已知vhh的例子公开于下表3中。
[0210]
表3
[0211][0212][0213]
因此,根据本发明的融合蛋白的vhh可以具有选自以下的氨基酸序列:seq id no:57、seq id no:58和seq id no:59。
[0214]
根据本发明将使用的vhh也可以选自文库。
[0215]
已描述了从经免疫的骆驼或美洲驼的vhh文库中选择抗原特异性vhh的方法,如噬菌体展示。将vhh基因克隆至噬菌体展示载体中,通过淘选获得抗原结合物,并在细菌中表达选择的vhh。与常规抗体片段(fab或scfv)相比,重组vhh具有许多优点,因为只需克隆一个结构域,而且这些vhh表达良好,在水环境中高度可溶,并且在高温稳定。
[0216]
vhh也可以是定制设计的,从源自骆驼科动物vhh支架或源自人源化scfv支架的合
成文库中筛选。
[0217]
例如,vhh可通过包括以下步骤的方法获得:
[0218]
(a)用免疫球蛋白或其片段免疫骆驼科动物,优选羊驼(lama pacos),
[0219]
(b)分离经免疫的骆驼科动物的外周淋巴细胞,获得总rna并合成相应的cdna(方法为本领域已知;例如参见lafaye等人,1995 res immunol.,146,373-82;勘误:1996,res immunol.,147,61),
[0220]
(c)构建编码vhh结构域的cdna片段文库,
[0221]
(d)使用pcr将步骤(c)中获得的编码vhh结构域的cdna转录为mrna,将mrna转换为核糖体展示格式,并通过核糖体展示选择vhh结构域。
[0222]
可以将编码vhh的多核苷酸和编码具有萤光素酶活性的多肽的多核苷酸插入载体中。将编码vhh的多核苷酸和编码具有萤光素酶活性的多肽的多核苷酸连接,以表达本发明的融合蛋白。
[0223]
然后可以将载体引入细胞中,例如通过转化细菌细胞,以使细胞表达融合蛋白。
[0224]
可以通过接头将融合蛋白和/或vhh的n-末端结构域和c-末端结构域与具有萤光素酶活性的多肽连接。优选的接头具有选自以下的氨基酸序列:gs、aaa、seq id no:24、seq id no:25和seq id no:26。
[0225]
融合蛋白可以在n-末端、c-末端或两者处包含一个或多个异源氨基酸序列。特别地,它可以包含标签,如用于纯化目的的聚组氨酸标签。
[0226]
本发明还涉及编码本发明的融合蛋白的多核苷酸以及包含该多核苷酸的载体。
[0227]
合适地,本发明的融合蛋白或其编码多核苷酸是重组的。
[0228]
有利地,载体包含可操作地连接至启动子的多核苷酸。
[0229]
有利地,可以对多核苷酸进行密码子优化以表达融合蛋白。
[0230]
本发明的多核苷酸或载体可以进入细胞。
[0231]
因此,本发明还涉及包含本发明的多核苷酸或本发明的载体的细胞。
[0232]
vhh所针对的免疫球蛋白可以来自人或非人动物,优选人。
[0233]
免疫球蛋白可以是igg1、igg2、igg3、igg4、iga、igm、igd或ige。优选地,免疫球蛋白是igg、ige、igm或iga。感兴趣的免疫球蛋白将取决于测定的目的。例如,当测定的目的是诊断过敏时,将主要优选ige,其次优选igg。igm可以用于诊断血液中近期的感染。igg可以用于诊断血液中较早的感染。iga可以用于诊断血液、粘膜或唾液中的感染。
[0234]
通常,免疫球蛋白针对抗原。
[0235]
抗原可以选自过敏原、病毒、细菌、真菌和寄生虫或其片段或部分。
[0236]
例如,过敏原可以是以下各项的成分(主要是蛋白质):乳(特别是牛乳)、大豆、蛋、小麦、鳕鱼、海鲜、贝类、鱼、坚果、花生、屋尘螨(d.pteronyssinus)、链格孢(alternaria)、猫、狗、草或桦树花粉、尘螨、麻醉剂(箭毒,但不限于此)、抗生素(阿莫西林,但不限于此)、乳胶、织物、毒液(来自黄蜂和蜂,但不限于此)。
[0237]
病毒可以是例如严重急性呼吸综合征冠状病毒2(sars cov2)或严重急性呼吸综合征冠状病毒1(sars cov1)。病毒片段可以包含从病毒中分离的蛋白质、合成的或表达为重组体,如刺突蛋白(s)或核蛋白(n)、或对应于结构性或功能性结构域的片段、或任何大小的片段。
[0238]
免疫球蛋白也可以是自身抗体。
[0239]
在优选的实施方案中,vhh针对免疫球蛋白的恒定片段(fc)。
[0240]
在一个实施方案中,具有萤光素酶活性的多肽是具有氨基酸序列seq id no:1的萤光素酶。
[0241]
具有萤光素酶活性的多肽可以与氨基酸序列seq id no:1具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的氨基酸序列同一性。
[0242]
在一个实施方案中,具有萤光素酶活性的多肽是如上所公开的突变体萤光素酶。
[0243]
因此,具有萤光素酶活性的多肽可以与氨基酸序列seq id no:1具有至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的氨基酸序列同一性,并且包含至少一个选自以下的氨基酸替换:
[0244]-将在对应于seq id no:1第18位的位置的酪氨酸(y)替换为精氨酸(r),
[0245]-将在对应于seq id no:1第48位的位置的亮氨酸(l)替换为赖氨酸(k),
[0246]-将在对应于seq id no:1第56位的位置的异亮氨酸(i)替换为丙氨酸(a),
[0247]-将在对应于seq id no:1第116位的位置的酪氨酸(y)替换为苯丙氨酸(f),
[0248]-将在对应于seq id no:1第134位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0249]-将在对应于seq id no:1第163位的位置的色氨酸(w)替换为选自苏氨酸(t)和谷氨酸(e)的氨基酸,
[0250]
和
[0251]-将在对应于seq id no:1第166位的位置的半胱氨酸(c)替换为丝氨酸(s)。
[0252]
具有萤光素酶活性的多肽可以具有选自以下的氨基酸序列:seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12、seq id no:13、seq id no:14、seq id no:15、seq id no:16、和seq id no:17。
[0253]
具有萤光素酶活性的多肽还可以具有选自以下的氨基酸序列:seq id no:42、seq id no:43、seq id no:44、seq id no:45和seq id no:46。
[0254]
本发明还涉及一种试剂盒,其包含:
[0255]-本发明的融合蛋白,和
[0256]-具有萤光素酶活性的多肽的底物。
[0257]
如上所述,腔肠素是虾oplophorus萤光素酶的天然底物,但使用furimazine可以获得信号的改善。
[0258]
因此,底物可以选自腔肠素、furimazine或其衍生物。
[0259]
furimazine的衍生物公开于专利申请wo2018/197727a1中。此类furimazine衍生物在强度、信噪比和/或持续时间方面提供了更好的生物发光信号。
[0260]
因此,底物可以选自:
[0261]
8-苄基-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0262]
8-苄基-2-((5-乙基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0263]
8-苄基-2-((4,5-二甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
3(7h)-酮
[0293]
8-(2,3-二氟苄基)-2-(呋喃-2-基甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0294]
8-(2,3-二氟苄基)-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0295]
2-苄基-8-(2,3-二氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0296]
8-(2,6-二氟苄基)-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0297]
8-(2,3-二氟苄基)-2-((4,5-二甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0298]
8-(2,3-二氟苄基)-2-((5-乙基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0299]
8-(2,6-二氟苄基)-2-((5-乙基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0300]
2-((4,5-二甲基呋喃-2-基)甲基)-8-(2-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0301]
2-((4,5-二甲基呋喃-2-基)甲基)-8-(3-氟苄基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0302]
8-(2,3-二氟苄基)-2-((4-乙基-5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮
[0303]
8-(2,3-二氟苄基)-2-((5-乙基-4-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮,和
[0304]
8-苄基-2-(呋喃-2-基甲基)-6-(3-羟基苯基)咪唑并[1,2-a]吡嗪-3(7h)-酮。
[0305]
这些底物分别公开于wo2018/197727a1中,具有以下名称:q3、q12、q16、q21、q14、q18、q20、q27、q28、q29、q34、q36、q41、q51、q54、q56、q58、q61、q72、q73、q81、q82、q83、q84、q85、q101、q100、q99、q98、q97、q96、q105、q107、q108、q117、q121、q124、q127、q129、q131、q132、q135、q143和q149。
[0306]
在优选的实施方案中,底物是8-(2,3-二氟苄基)-2-((5-甲基呋喃-2-基)甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮(如wo2018/197727a1第129页的表1中所公开的q-108)。
[0307]
试剂盒还可以包含用于检测萤光素酶活性的试剂、对照和/或支持物。
[0308]
优选地,抗原固定在支持物上。支持物可以是载玻片、板(例如多孔板)、试纸(例如硝酸纤维素试纸或pvdf膜或纸)、管、盘、环、棒、螺旋桨、纤维或纤维集合。
[0309]
本发明还涉及本发明的融合蛋白用于检测和/或量化样品中的免疫球蛋白的用途。
[0310]
样品可以例如选自:全血、血清、血浆、脑脊液、精液、尿液、鼻咽涂片、口咽涂片、阴道涂片、粪便、汗液、唾液、气管冲洗液和支气管冲洗液。
[0311]
本发明还涉及用于检测样品中免疫球蛋白的存在的方法,所述方法包括以下步骤:
[0312]
(a)使样品与本发明的融合蛋白接触,
[0313]
(b)加入具有萤光素酶活性的多肽的底物,和
[0314]
(c)检测发光。
[0315]
通常,具有萤光素酶活性的多肽是本发明的融合蛋白的具有萤光素酶活性的多肽。
[0316]
由于也可以通过发射发光的手段来测量样品中免疫球蛋白的水平,因此本发明还涉及一种用于量化样品中免疫球蛋白水平的方法,所述方法包括以下步骤:
[0317]
(a)使样品与本发明的融合蛋白接触,
[0318]
(b)加入具有萤光素酶活性的多肽的底物,和
[0319]
(c)量化发光。
[0320]
通常,具有萤光素酶活性的多肽是本发明的融合蛋白的具有萤光素酶活性的多肽。
[0321]
本发明的方法还可以包括将抗原固定至支持物的步骤和/或提供抗原固定于其上的支持物的步骤。
[0322]
可以通过表面吸附、化学连接或非共价相互作用进行固定。
[0323]
所述方法可以包括使样品与固定化抗原接触的步骤。
[0324]
融合蛋白与免疫球蛋白的相互作用可以受到以下挑战:稀释、加热或加入盐、酸、碱或有机或矿物缓冲剂或相互作用的任何竞争剂、或侧流或声频。
[0325]
在检测发光时,每秒的光子数最终可以根据其波长来计算。
[0326]
所述方法还可以包括将发射的发光与对照进行比较的步骤。
[0327]
本发明还涉及用于量化样品中每个亲和间隔的免疫球蛋白水平以评估多克隆免疫球蛋白混合物的亲和范围的方法,所述方法包括以下步骤:
[0328]
(a)在游离抗原的稀释系列的存在下,使样品与固定化抗原接触,
[0329]
(b)使样品与本发明的融合蛋白接触,和
[0330]
(c)加入具有萤光素酶活性的多肽的底物,
[0331]
(d)量化发光并绘制光强度与抗原浓度的关系图。
[0332]
通常,对其水平进行量化的免疫球蛋白是融合蛋白的抗体所针对的免疫球蛋白。抗原是免疫球蛋白所针对的抗原。具有萤光素酶活性的多肽是本发明的融合蛋白的具有萤光素酶活性的多肽。
[0333]
将通过以下附图和实施例进一步说明本发明。然而,这些实施例和附图不应以任何方式解释为限制本发明的范围。
附图说明
[0334]
图1是显示与ige的fc部分结合的抗ige纳米抗体-萤光素酶串联物(sdab026-nanokaz)的卡通表示。
[0335]
图2显示了使用ige lulisa分析针对屋尘螨过敏原der p 2的重组ige、igg1或igg4在pbs中的稀释系列。rlu:相对光单位。
[0336]
图3显示了使用ige lulisa分析重组人抗卵白蛋白(ova)ige在pbs中的稀释系列。
[0337]
图4显示了使用重组抗卵白蛋白(ova)ige比较ige lulisa和ige elisa之间的灵敏度。
[0338]
图5显示了使用重组ova sige比较ige lulisa与标准immunocap相比的动态范围和灵敏度。
[0339]
图6显示了使用来自高度花生过敏受试者的血浆样品比较ige lulisa与标准immunocap相比的动态范围和灵敏度。
[0340]
图7显示了抗ige纳米抗体-萤光素酶融合蛋白的浓度对通过lulisa生物发光检测ige的影响。灰色区域显示了在用于本研究中所有其他实验的sdab026-nanokaz浓度下获得的值。
[0341]
图8显示了使用来自六名花生过敏受试者的血浆稀释系列通过lulisa检测花生sige,这些血浆以指定浓度稀释于pbs中,并与结合至板的花生提取物一起孵育。通过lulisa进行花生sige水平的生物发光检测。箭头表示图9中使用的血浆稀释度。灰色区域显示了花生sige lulisa检测的线性范围。
[0342]
图9显示了使用来自健康供体和花生过敏受试者的1μl血浆测量针对总花生提取物的sige。
[0343]
图10显示了使用来自健康供体和花生过敏受试者的1μl血浆测量针对花生过敏原arah 1的sige。
[0344]
图11显示了使用来自健康供体和花生过敏受试者的1μl血浆测量针对花生过敏原arah 2的sige。
[0345]
图12显示了用于过敏患者中花生sige的lulisa和immunocap之间的比较。
[0346]
图13显示了用于过敏患者中arah 1 sige的lulisa和immunocap之间的比较。
[0347]
图14显示了用于过敏患者中arah 2 sige的lulisa和immunocap之间的比较。
[0348]
图15显示了试纸上的ige lulisa(a),试纸上的ige lulisa与immunocap的相关性(b),试纸上的ige lulisa与板的相关性(c)。
[0349]
图16显示了sars-cov2蛋白n特异性igg的lulisa的须状图(须、最小值、最大值;箱:第二和第三四分位数,由中位数分隔)。
[0350]
图17显示了sars-cov2蛋白s特异性igg的lulisa的须状图。
[0351]
图18显示了来自aphp-cochin(n=20)和efs(n=4)的血清中sars-cov2蛋白n特异性igg与sars-cov2蛋白s特异性igg的滴定之间的相关性。
[0352]
图19显示了来自aphp-cochin(n=20)和efs(n=4)的血清中sars-cov1蛋白n特异性igg与sars-cov2蛋白n特异性igg的滴定之间的相关性。
[0353]
图20显示了来自aphp-cochin(n=20)和efs(n=4)的血清中sars-cov1蛋白s特异性igg与sars-cov2蛋白s特异性igg的滴定之间的相关性。
[0354]
图21显示了快速测试(5min)与常规测试(120min)中sars-cov2蛋白n特异性igg的滴定之间的相关性,为两个重复值的平均。
[0355]
图22是本发明的方法的三个实施方案的示意图(通过吸附、共价键、非共价键将抗原固定于支持物上)。
[0356]
实施例
[0357]
实施例1:具有改进特性的突变萤光素酶
[0358]
nanokaz/nanoluc是强化诱变的结果,用于优化酶的产生和光强度,具有来自oplophorus gracilirostris的萤光素酶催化结构域的最小长度。然而,在提高酶的催化活
性之外,四项观察引起了发现克服以下情况的突变:1)反应产物引起的酶失活,2)高底物浓度引起的反应抑制,3)氧化反应的低量子产率,4)酶将被材料表面(管、孔、膜
……
)吸附的倾向。
[0359]
材料和方法:
[0360]
nanokaz(seq no:1)是来自oplophorus gracilirostris的萤光素酶催化结构域的优化序列(wo2012/061530)。
[0361]
基因nanokaz(seq no:33[jaz526])已由eurofins(德国)合成,具有羧基端his6-标签和对应于pet23序列(novagen)的侧翼区。根据gibson方法,使用nebuilder hifi组装预混液(master mix)(new england biolabs)组装互补片段,组装了pcr纯化的pet23载体和合成基因。已通过pcr在seq id no:2[jaz544]、3[jaz583]、4[jaz584]、5[jaz560]、6[jaz585]、7[jaz619]中引入了单突变或双突变。基因seq no:40[jaz536]已由eurofins(德国)合成,具有羧基端his6-标签和对应于pet23序列(novagen)的侧翼区。已通过pcr在seq no:41[jaz570]、42[jaz572]、43[jaz573]中引入了单突变或双突变。通过gibson方法,使用nebuilder hifi组装预混液(new-england biolabs)组装携带特定突变的基因的互补片段,引入了多个突变。
[0362]
以下基因均已由eurofins(德国)合成,具有羧基端his6-标签和对应于pet23序列(novagen)的侧翼区:seq id no:42[jaz621],其具有seq id no:1的双倍重复;seq id no:43[jaz622],在seq id no:1的双倍重复中,第116位的酪氨酸(y)双重替换为苯丙氨酸(f);seq id no:44[jaz476],其具有seq id no:1的三倍重复;seq id no:45[jaz620],在seq id no:1的三倍重复中,第116位的酪氨酸(y)三重替换为苯丙氨酸(f);和seq id no:46[scoprii68],在涵盖seq id no:1的antares序列中,第116位的酪氨酸(y)替换为苯丙氨酸(f)。
[0363]
产物(5ml)用于转化neb 5-α感受态大肠杆菌,并在培养皿中、在lb/琼脂/氨苄青霉素上生长过夜。分离的菌落在液体培养基中生长,分离质粒并进行核苷酸测序以确认在正确位置存在突变。
[0364]
结果:
[0365]
参照nanokaz/furimazine,第116位残基酪氨酸突变为苯丙氨酸(seq id no:2[jaz544])使nanokaz对furimazine的催化活性提高了250%,对q108的催化活性提高了1400%。突变催化结构域的双倍重复(seq id no:45)或三倍重复(seq id no:45)使催化活性分别提高了2600%和3500%。底物扩散速率限制了单结构域活性的2倍或3倍预期改进(1400%)。我们已显示了萤光素酶活性随着时间而降低,其速率取决于底物的性质(coutant等人,1999)。q80活性下降快,q103活性下降慢。不幸地,光发射越高,则酶失活越快。在光强度(闪光)或长(发光)寿命之间有折衷。我们已显示了减少是由于酶失活。第166位半胱氨酸突变为残基丝氨酸(seq id no:7[jaz619])降低失活的速率。
[0366]
在疏水后袋(back pocket)附近的第134位色氨酸突变为苏氨酸(seq id no:3[jaz583])适度降低高浓度底物的抑制作用。在室温、在最大反应速率的furimazine浓度(54mm)下,对于由一分子nanokaz(seq id no:1)催化的每1460个furimazine分子,我们计数了1个光子。底物的选择将该量子产率从非常低调节至中等。底物浓度越低,则量子产率越高;但不幸地,反应速率越低,并且光子发射越低。第116位残基酪氨酸突变为苯丙氨酸
(seq id no:2[jaz544])中等地提高了光子发射计数。第134位(seq id no:3[jaz583])和第163位(seq id no:4[jaz584])色氨酸的突变突出于蛋白质表面,对于提高酶的溶解度和减少表面吸附(其影响具有较高噪音的测定)是最有效的。
[0367]
突变的组合在光强度、寿命和溶解度方面提供了改进的特性。根据应用所需的具体特性来选择最佳折衷方案:光强度/预期灵敏度、寿命/实验持续时间、溶解度/实验条件。
[0368]-seq id no:1[nanokaz,jaz526]对furimazine的催化活性为100%,对q108为250%。
[0369]-seq id no:2[jaz544]seq id no:1第116位酪氨酸(y)被替换。对furimazine的催化活性为seq id no:1的200%,对q108为1450%。
[0370]-seq id no:3[jaz583]seq id no:1第134位色氨酸(w)替换为苏氨酸(t)。对furimazine的催化活性为seq id no:1的100%
[0371]-seq id no:4[jaz584]seq id no:1第163位色氨酸(w)替换为苏氨酸(t)。对furimazine的催化活性为seq id no:1的50%。
[0372]-seq id no:5[jaz560]seq id no:1第56位异亮氨酸(i)替换为丙氨酸(a)。对furimazine的催化活性为seq id no:1的120%,对q108为600%。
[0373]-seq id no:6[jaz585]seq id no:1第116位酪氨酸(y)替换为苯丙氨酸(f),第134位色氨酸(w)替换为苏氨酸(t)。对furimazine的催化活性为seq id no:1的200%,对q108为1400%。
[0374]-seq id no:7[jaz619]seq id no:1第116位酪氨酸(y)替换为苯丙氨酸(f),第166位半胱氨酸(c)替换为丝氨酸(s)。对furimazine的催化活性为seq id no:1的200%。
[0375]-seq id no:8[jaz536]seq id no:1第18位酪氨酸(y)替换为精氨酸(r),第48位亮氨酸(l)替换为赖氨酸(k),第134位色氨酸(w)替换为谷氨酸(e),第163位色氨酸163(w)替换为谷氨酸(r)。对furimazine的催化活性为seq id no:1的80%。
[0376]-seq id no:9[jaz570]seq id no:1第18位酪氨酸(y)替换为精氨酸(r),第48位亮氨酸(l)替换为赖氨酸(k),第134位色氨酸(w)替换为谷氨酸(e),第163位色氨酸163(w)替换为谷氨酸(e),第166位半胱氨酸(c)替换为丝氨酸(s)。对furimazine的催化活性为seq id no:1的150%。
[0377]-seq id no:10[jaz572]seq id no:1第18位酪氨酸(y)替换为精氨酸(r),第48位亮氨酸(l)替换为赖氨酸(k),第134位色氨酸(w)替换为谷氨酸(e),第163位色氨酸163(w)替换为谷氨酸(e),第116位酪氨酸(y)替换为苯丙氨酸(f)。对furimazine的催化活性为seq id no:1的180%。
[0378]-seq id no:11[jaz573]seq id no:1第18位酪氨酸(y)替换为精氨酸(r),第48位亮氨酸(l)替换为赖氨酸(k),第134位色氨酸(w)替换为谷氨酸(e),第163位色氨酸(w)替换为谷氨酸(e),第116位酪氨酸(y)替换为苯丙氨酸(f),第166位半胱氨酸(c)替换为丝氨酸(s)。对furimazine的催化活性为seq id no:1的150%。
[0379]
数个序列允许通过双倍重复或三倍重复催化结构域来增加信号。它们主要用于需要光强度用于实时成像、快速动力学或深层组织观察的体外或体内成像应用。其在测定中的应用对于诊断没有用,因为其增加信号和噪音。如果底物浓度低,则底物向活性位点的扩散速率明显地限制活性。
nanokaz)。
[0394]
sige结合部分来自针对sige进行选择羊驼的人源化重链抗体(单域抗体,sdab026)(jabs f,plum m,laursen ns,jensen rk,molgaard b,miehe m等人,trapping ige in a closed conformation by mimicking cd23 binding prevents and disrupts fcepsilonri interaction.nat commun 2018;9:7,wo2014/087010a1)。sdab026识别人ige的恒定cε3区。sdab026对ige的亲和力与治疗性抗ige抗体奥马珠单抗(omalizumab)的亲和力相似(kd分别为1.4nm和2.6nm,3,5),报道其抑制ige与两种受体fcεri和cd23之间的相互作用。
[0395]
基因sdab026已由eurofins合成,具有对应于pet23-nanokaz序列的侧翼区。已使用相应的正向和反向寡核苷酸(正向:5’atggtcttcacactcgaagatttc3’(seq id no:49);反向:5’catggtatatctccttcttaaagttaaa3’(seq id no:50),eurofins)、使用q5 dna聚合酶和dntp混合液扩增了合成基因sdab026。
[0396]
通过琼脂糖凝胶电泳纯化pcr产物。使用nebuilder hifi组装预混液(new-england biolabs)组装经纯化的pet23-nanokaz载体和合成基因sdab026。
[0397]
组装产物(5ml)用于转化neb 5-α感受态大肠杆菌,并在培养皿中、在lb/琼脂/氨苄青霉素上生长过夜。分离的菌落在液体培养基中生长,分离质粒并进行核苷酸测序以确认存在sdabs026-nanokaz插入物。
[0398]
抗ige纳米抗体萤光素酶串联物sdab026-nanokaz([纳米抗体抗ige]-[nanokaz]-[his6])的完整序列示于下表中:
[0399][0400]
从序列计算sdab026-nanokaz的估计分子量(mw)为34.1kd。
[0401]
抗ige纳米抗体-萤光素酶融合蛋白(sdab026-nanokaz)的表达、纯化和验证
[0402]
pet23-sdab026-nanokaz用于转化大肠杆菌(e.coli)bl21(de3,new-england biolabs),以在大肠杆菌中实现高表达。在18℃使细胞生长,并加入iptg(sigma-aldrich)以诱导产生sdab026-nanokaz。通过离心收获细胞(1.5l)后,将沉淀物重悬于50mm tris-hcl ph 8.0、50mm nacl中,其中含有蛋白酶抑制剂(sigma-aldrich)和溶菌酶(0.1mg/ml,sigma-aldrich)。通过冻融循环裂解法破坏细胞。然后加入dnase i(sigma-aldrich)以从样品中去除dna。
[0403]
以1250g离心粗提物30min。收集上清液并加入nacl(500mm)、咪唑(20mm,sigma-aldrich)和triton x-100(0.1%,sigma-aldrich)。使用akta纯色谱系统(ge-healthcare),将经澄清的裂解液以4ml/min加载至经平衡的hi-trap5ml柱(ge-healthcare)上。使用运行缓冲液(50mm tris-hcl ph 8.0、nacl 50mm、20mm咪唑)用20倍柱体积以5ml/min洗涤柱。用50mm tris-hcl ph 8.0、50mm nacl中20mm至200mm的咪唑梯度以
pbs/tween 20 0.1%洗涤孔四次。经纯化的sdab026-jaz572(1ng/ml)对于sdab026-nanokaz是优选的,以获得更高的信号和更低的背景,尤其是对于高浓度的游离过敏原,而在如此长的孵育时间内ige与固定过敏原低结合。最终,可以将tween 20 0.1%、bsa 0.1mg/ml或明胶0.1mg/ml用于降低背景。对潜在过敏的患者的ige测定应当避免使用牛乳(milk)。用100μl pbs/tween 20 0.1%洗涤孔四次。清空每个孔并加载50μl的13.5μm hikazine-108(8-苄基-2-(呋喃-2-基甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮),然后立即读取。在轨道上震荡板1秒,并使用多孔板光度计(lb960centro,berthold)积分每孔0.5秒的光发射强度。生物发光强度与目标浓度的关系以条形图显示。
[0408]
ige immunocap
[0409]
由phadia,thermo fisher对运送的样品进行immunocap分析。
[0410]
ige elisa方案
[0411]
如上所述,在室温包被透明平底96或384孔板(maxisorp,nunc)2小时。清空孔并在室温用50μl pbs中的100μg/ml牛血清白蛋白(sigma)使包被饱和1小时。用100μl pbs/tween 20 0.1%(sigma)洗涤孔四次。在pbs中稀释重组抗ova人嵌合ige(克隆x4a4d12/g9/h8,来自arkab的赠礼)、抗尘螨p2人嵌合ige(克隆ch1,来自arkab的赠礼)或来自花生过敏受试者的血浆,并在室温、在其各自的过敏原包被的孔中孵育1小时,50ml/孔。用100μl pbs/tween 200.1%洗涤孔四次。将50μl与碱性磷酸酶缀合的山羊igg抗人ige(在pbs中1:700稀释,sigma-aldrich)加载至每个孔中,并在室温孵育1小时。用100μl pbs/tween 20 0.1%洗涤孔四次。清空所有孔,每孔加入50μl的1mg/ml磷酸酶底物pnpp(4-硝基苯基磷酸二钠盐,sigma-aldrich),在室温孵育3小时或在4℃孵育过夜。用多孔板分光光度计(sapphire,tecan)在405nm处测量吸光度,并与lulisa结果进行比较。
[0412]
统计分析
[0413]
使用非配对mann-whitney u检验来比较来自健康供体和花生过敏受试者的血浆样品之间ige水平的差异。认为p值《0.05为具有统计显著性。
[0414]
指尖血液样品
[0415]
用一名健康志愿者进行测试以设立项目应用程序,其用于从trousseau医院过敏患者的缩小队列中进行血液采样,用于ige lulisa测定及平行的immunocap和elisa。
[0416]
在用酒精对指尖进行消毒后,使用具有无菌一次性小刀的采血笔进行测试,该方法通常用于糖尿病患者自己检查时的葡萄糖测定。吸取1μl并与预加载于1000μl吸头(一次性)内的50μl pbs、bsa(50μg/ml)、肝素(10ui/ml)、sdab026-nanokaz(1ng)溶液混合,该吸头末端为以聚乙烯过滤器为框架的纸质过滤器。使稀释的血液过滤通过吸头末端,并加载至用特定过敏原预包被的96孔板中,并在室温孵育5min。用pbs洗涤孔并加入100μl萤光素酶底物(furimazine类似物),并立即使用板光度计(lb960 centro,berthold)在1秒过程中测量生物发光。测量与阴性和阳性对照同时进行,用于内部校准。
[0417]
结果
[0418]
通过萤光素酶联免疫吸附测定(lulisa)敏感地且特异地检测过敏原特异性ige
[0419]
为了建立使用lulisa特异性检测sige的概念验证,制备了针对屋尘螨过敏原der p 2的重组ige、igg1(主要igg亚类)或igg4(在过敏原特异性免疫疗法期间过量产生的主要igg亚类)在pbs中的稀释系列。使用ige lulisa分析了3组样品。
[0420]
正如预期的那样,浓度依赖性信号仅出现在含有抗der p 2 sige的样品中,检测限为约5
×
10-13
m sige(约1pg/ml;约0.0004kua/l)(图2)。
[0421]
对重组人抗卵白蛋白ige进行了类似的实验。在pbs中以指定浓度稀释重组人抗卵白蛋白(ova)ige,并与板结合的ova一起孵育。通过lulisa使用抗ige sdab026-nanokaz进行抗体水平的生物发光检测。
[0422]
对重组抗卵白蛋白(ova)ige也获得了高灵敏度,lulisa可检测到低至5pg/ml(约0.002kua/l)的浓度的抗ova ige(图3和图4)。
[0423]
在pbs中以指定浓度稀释重组抗卵白蛋白(ova)ige。使用lulisa或elisa,用来自相同稀释样品的等分试样评估ova sige的水平。对于sige的检测,lulisa的灵敏度也远高于标准elisa的灵敏度(图4)。
[0424]
接着,使用在30名健康供体合并的血浆中稀释的重组ova sige,比较了ige lulisa与标准immunocap相比的动态范围和灵敏度(图5)。该头对头比较显示,与immunocap相比,lulisa的分析灵敏度显著提高(约250倍)(图5)。
[0425]
使用来自高度花生过敏受试者的血浆样品(其再次稀释于来自30名健康供体的血浆池中)的稀释系列,进行了类似的实验(图6)。immunocap允许检测稀释高达4050倍的血浆中的花生sige,而通过lulisa在稀释100,000至300,000倍的过敏血浆中仍然检测到花生sige(图6)。
[0426]
然后研究了抗ige纳米抗体-萤光素酶融合蛋白的浓度对通过lulisa生物发光检测ige的影响。来自花生过敏受试者的1μl血浆(花生特异性ige immunocap值:2186ku/l)稀释于50μl pbs中,并与板结合的花生提取物一起孵育(单独的pbs用作对照)。在指定浓度的抗ige纳米抗体-萤光素酶串联物(sdab026-nanokaz)下,通过lulisa进行花生特异性ige水平的生物发光检测。在该花生过敏血浆样品的固定(1:50)稀释度下,抗ige纳米抗体-萤光素酶融合蛋白的稀释系列给出浓度依赖性信号,并证实ige lulisa的生物发光背景信号非常低(图7)。
[0427]
总之,这些结果表明ige lulisa具有非常高的灵敏度和特异性,因此潜在地可以用于量化来自sige非常低的患者的样品中的ige。与immunocap相比,ige lulisa的主要优点在于它需要的样品体积极少。对于图6中使用的花生过敏患者的样品,使用小于1纳升的初始患者样品仍然可以检测到花生sige。因此,即使患者的样品量有限,也可以使用ige lulisa来设想针对潜在过敏原阵列的非常大型的sige筛选。
[0428]
然后通过使用来自31名健康供体的1μl血浆(从法国血库efs获得,过敏状况未知)和82-105名花生过敏受试者(在其加入机构审查委员会批准的以下研究时收集:peanut oral immunotherapy study:safety,efficacy and discovery trial;clinicaltrials.gov识别号:nct02103270)测量针对总花生提取物或针对主要花生过敏原ara h 1和ara h 2的sige,来寻求进一步验证该方法。
[0429]
来自具有滴定的高花生sige的参考样品的稀释系列用于测定的校准,以确保在我们方法的检测线性范围内分析所有血浆样品(图8)。
[0430]
正如预期的那样,与健康供体相比,在花生过敏受试者的血浆样品中检测到显著更高水平的花生sige、ara h 1 sige和ara h 2 ige(图9、图10和图11)。
[0431]
过敏患者的lulisa和immunocap之间的头对头比较显示,两种方法之间存在高度
相关性(花生sige、ara h 1 sige和ara h 2 sige分别为r2=0.89、0.84和0.83)(图12、图13和图14)。使用sige水平高于immunocap检测截止值(0.1kua/l)的所有血浆样品来计算这些相关性。花生sige的所有样品都是这种情况。然而,arah 1 sige的82个样品中的17个(19.7%)和arah 2 sige的96个样品中的3个(3.1%)低于immunocap的检测限(图12、图13和图14)。然而,如通过进行双盲、安慰剂对照的食物挑战(dbpcfc)和皮肤点刺测试所评估的,所有这些受试者都对花生具有明确的临床反应性(表4)。
[0432]
表4
[0433][0434]
总之,这些结果表明ige lulisa对于sige的临床检测具有高灵敏度和准确性,并且需要的血浆体积非常少。
[0435]
在immunocap之外,已报道了其他数种用于检测sige的方法,包括immulite和最近的同种型特异性凝集pcr(isap)(hamilton rg等人,2008,tsai ct等人,2018)。immulite表现为最接近lulisa的方法,因为它使用化学发光方法来检测sige。然而,报告的immulite对sige的检测限与immunocap相同(0.1kua/l)。与lulisa类似,可以使用1μl临床样品通过isap检测sige。然而,两种测试是基于不同的方法,因为isap需要化学合成的过敏原-dna(针对每种类型的过敏原)和第二抗ige抗体-dna偶联物,用于通过定量pcr检测sige。
[0436]
ige lulisa用于对牛乳过敏的婴儿进行血清ige测试的试纸测试(横向流动)中。结果示于图15中。
[0437]
此类测试旨在证明lulisa在紧急条件下的应用,用于检测参加手术的患者对箭毒(麻醉剂)、阿莫西林(抗生素)和乳胶(手套)的特异性ige,或用于在儿科紧急情况下检测新生婴儿对牛乳化合物的过敏。
[0438]
使指尖血液采样适应于以常规和及时方式接受奥马鲁单抗治疗的患者的sige lulisa,用于根据检测到的游离sige的量来调整注射剂量。
[0439]
lulisa与elisa相比所需的样品量少且性能扩展,允许扩展应用,如对潜在具有多于一种ige分子种类的血清绘制亲和力曲线或光谱。使用一系列与恒定浓度血清混合的过敏原稀释液进行lulisa竞争。ige检测量与光强度相关。每个过敏原浓度区间的ige检测量是评估是否对于过敏原存在非常高(皮摩尔以下)、高(纳摩尔级)、中等(10至100纳摩尔)或低(微摩尔及以上)亲和力免疫球蛋白的方法。肥大细胞、嗜碱性粒细胞和巨噬细胞表面的ige受体亲和力越高、饱和度和聚集性越强,则组胺和细胞因子应答更高,过敏性休克的风险也更高。亲和谱是用于追踪接受脱敏治疗的患者的相关工具,用于指导治疗策略以停止过敏原量增加的挑战,用抗组胺药控制短期反应或用igg fc受体结合位点竞争剂(奥马珠单抗)清除高亲和力ige。
[0440]
总之,ige lulisa是一种超高灵敏度的检测sige的新方法,仅需非常少(1μl或更少)的血浆样品体积。与经典比色(elisa)或荧光(immunocap)ige检测方法相比,使用生物发光显著提高了灵敏度,并具有扩展的浓度动态范围。该方法是完全可自动化的,并使用商业化的板和标准光度计来生物发光检测ige。因此,ige lulisa应当比传统的immunocap更具有成本效益。
[0441]
实施例3:用于sars cov-2血清学的萤光素酶免疫吸附测定
[0442]
材料和方法:
[0443]
人血浆和血清
[0444]
样品获自corser队列的血清(n=164;icareb),巴黎公立医院集团(assistance publique desde paris,aphp)cochin的重症监护和康复服务(intensive medicine and resuscitation service)观察和监测方案中纵向随访的血清(n=20),和在2019年12月采样的法国血库(etablissementdu sang,efs)健康供体的血清和血浆(冷冻血浆n=20,冷冻血清n=20)。来自664名健康供体的大流行前冷冻血清获自法国血库(etablissementdu sang,efs)。
[0445]
融合蛋白抗igg纳米抗体-萤光素酶
[0446]
设计并合成编码抗igg纳米抗体-萤光素酶融合蛋白(pet23-fc1-nanokaz或pet23-fc10-nanokaz,分别为seq id no:62编码fc1、seq id no:63编码fc10、seq id no:10编码jaz572;或pet23-fc1-jaz572或pet23-fc10-jaz572,分别为seq id no:62编码fc1、seq id no:63编码fc10、seq id no:10编码jaz572)的质粒
[0447]
nanokaz是来自oplophorus gracilirostris(wo2012/061530)的萤光素酶催化结构域的优化序列。jaz572(seq id no:10)源自nanokaz,其具有提高的催化活性以增加光子发射和信号,并具有降低的聚集和表面吸附行为以降低噪音并有助于更好的信噪比。
[0448]
基因nanokaz和jaz572已由eurofins(德国)合成,具有羧基端his6-标签和对应于pet23序列(novagen)的侧翼区。已用正向和反向寡核苷酸(正向:5'ctcgagcaccaccaccaccaccac3'(seq id no:47);反向:5'ggtatatctccttcttaaagttaaac3'(seq id no:48),eurofins),使用q5 dna聚合酶、dntp混合液(new england biolabs)扩增了pet23质粒。通过琼脂糖凝胶(1%,macherey nagel)电泳纯化pcr产物。使用nebuilder hifi组装预混液(new england biolabs)组装经纯化的pet23载体和合成基因(pet23-nanokaz或pet23-jaz572)。
[0449]
igg结合部分来自针对igg选择的羊驼人源化重链抗体(单域抗体)(us 10,259,886 b2)。fc1识别人igg1、igg2、igg3和igg4的恒定片段区,在平衡时具有以下解离常数:kd分别为0.57nm、1.73nm、47.8nm、0.30nm,对所有igg的kd为3.25nm(us 10,259,886b2)。fc10识别人igg1、igg2、igg3和igg4的恒定片段区,在平衡时具有以下解离常数:kd分别为2.62nm、7.29nm、8.99nm、12.3nm,对所有igg的kd为3.25nm(us 10,259,886b2)。
[0450]
基因fc1和fc10已由eurofins合成,具有对应于pet23-nanokaz序列的侧翼区。已用相应的正向和反向寡核苷酸并使用q5 dna聚合酶和dntp混合液扩增了合成基因fc1或fc10。
[0451]
通过琼脂糖凝胶电泳纯化pcr产物。使用nebuilder hifi组装预混液(new-england biolabs)组装经纯化的pet23-nanokaz和pet23-jaz572载体和合成基因fc1或fc10。
[0452]
组装产物(5ml)用于转化neb 5-α感受态大肠杆菌,并在培养皿中、在lb/琼脂/氨苄青霉素上生长过夜。分离的菌落在液体培养基中生长,分离质粒并进行核苷酸测序以确认存在fc1-nanokaz或fc10-nanokaz、fc1-jaz573、fc10-jaz573插入物。
[0453]
抗igg纳米抗体萤光素酶串联物fc1-nanokaz或fc10-nanokaz([纳米抗体抗igg]-[nanokaz]-[his6])的完整序列如下表中例子所示:
[0454]
[0455][0456]
从序列计算的fc1-nanokaz和fc10-nanokaz的估计分子量(mw)分别为34115和33588道尔顿。
[0457]
抗igg纳米抗体-萤光素酶融合蛋白的表达、纯化和验证与抗ige纳米抗体-nanokaz(sdab026-nanokaz)相同
[0458]
通过萤光素酶联免疫吸附测定(lulisa)检测sars-cov2蛋白n和s特异性igg的方案
[0459]
igg萤光素酶免疫吸附测定(lulisa)方案
[0460]
通过吸附用50μl/孔的磷酸盐缓冲盐水ph 7.4(sigma)中的1μg/ml的核蛋白、刺突蛋白或其片段包被平底白色96或384孔板(fluoronunc c96 maxisorp,nunc),在室温包被2小时或在4℃包被过夜。板上的吸附有利于电荷相互作用。吸附的替代方法是通过羧基、胺或巯基部分、或在官能化的孔表面进行糖基化或用聚赖氨酸包被来共价结合靶点。最终清空孔,但不必须用bsa(1mg/ml)或3%脱脂乳中和。用100μl pbs/tween 20 0.1%洗涤孔3至6次。在室温,将血清(通常为1/200)、血浆或体液的稀释液在各自的抗原包被孔中孵育30min至1小时,其在磷酸盐缓冲盐水中,50μl/孔,最终含脱脂乳3%,牛血清白蛋白1mg/ml,牛血清1-3%和/或tween 20 0.1%。用100μl pbs/tween 20 0.1%洗涤孔三至六次。磷酸盐缓冲盐水中经纯化的vhh-nanokaz 1ng/ml(5.107rlu.s-1
.ml-1
,最终含脱脂乳3%、牛血清白蛋白1mg/ml或牛血清1-3%和/或tween20 0.1%)进行加载(50μl/孔),并在室温下孵育20-30min。用100μl pbs/tween20 0.1%洗涤孔四次。在该步骤中,可以在pbs中储存板直至测量。清空每个孔并加载50μl的27μm furimazine(8-苄基-2-(呋喃-2-基甲基)-6-苯基咪唑并[1,2-a]吡嗪-3(7h)-酮)或13μm q108,然后立即读取。在轨道上震荡板5秒,并使用多孔板光度计(lb960 centro,berthold)积分每孔0.5-1秒的光发射强度。
[0461]
结果
[0462]
在corser队列的血清(n=164;icareb)中,在巴黎公立医院集团(assistance publique desde paris,aphp)cochin的重症监护和康复服务的观察和监测方案中纵向随访的血清(n=20)中,和在2019年12月采样的法国血库(efs)健康供体的血清和血
浆(冷冻血浆n=20,冷冻血清n=20)中,已通过萤光素酶联免疫吸附测定(lulisa)滴定了sars-cov2蛋白n特异性igg。
[0463]
结果示于图16中。
[0464]
在来自巴黎公立医院集团(assistance publique desde paris,aphp)cochin的重症监护和康复服务的观察和监测方案中纵向随访的血清(n=20)中,和来自efs的健康供体的冷冻血清(n=4)中,已通过lulisa滴定了sars-cov2刺突蛋白(s)特异性igg。
[0465]
结果示于图17中。
[0466]
来自aphp-cochin(n=20)和efs(n=4)的血清中sars-cov2蛋白n特异性igg和sars-cov2蛋白s特异性igg的滴定之间的相关性示于图18中。
[0467]
然后比较了患者血清(aphp-cochin n=20)和健康供体的冷冻血清(efs n=4)中对sars-cov1蛋白n和sars-cov2蛋白n以及对sars-cov1蛋白s和sars-cov2蛋白s特异性的igg。
[0468]
结果示于图19和图20中。
[0469]
对来自aphp-cochin(n=20)和efs(n=4)的血清,按一式两份,通过减少孵育时间可以在5分钟内进行96孔板上的紧急测试:对于在室温或甚至更好在37℃,孵育血清3分钟,每个洗涤步骤17秒(洗板机zoom ht,berthold),抗igg vhh-nanokaz孵育1分钟。决定系数r2为0.75。结果示于图21中。
[0470]
参考文献
[0471]
在整个本技术中,各种参考文献描述了本发明所属的现有技术状态。这些参考文献的公开内容在此通过引用并入本技术。
[0472]
coutant ep,gagnot g,hervin v,baatallah r,goyard s,jacob y,rose t,janin yl.bioluminescence profiling of nanokaz/nanoluc luciferase using a chemical library of coelenterazine analogues.chemistry.2020年1月16日;26(4):948-958.
[0473]
jabs f,plum m,laursen ns,jensen rk,molgaard b,miehe m等人.trapping ige in a closed conformation by mimicking cd23 binding prevents and disrupts fcepsilonri interaction.nat commun 2018;9:7.
[0474]
canonica gw,ansotegui ij,pawankar r等人.a wao-aria-ga(2)len consensus document on molecular-based allergy diagnostics.world allergy organ j.2013;6(1):17.
[0475]
van hage m,hamsten c,valenta r.immunocap assays:pros and cons in allergology.j allergy clin immunol.2017;140(4):974-977.
[0476]
inouye s,sato j,sahara-miura y,yoshida s,hosoya t.luminescence enhancement of the catalytic 19kda protein(kaz)of oplophorus luciferase by three amino acid substitutions.biochem biophys res commun.2014;445(1):157-162.
[0477]
gasser p,tarchevskaya ss,guntern p等人.the mechanistic and functional profile of the therapeutic anti-ige antibody ligelizumab differs from omalizumab.nat commun.2020;11(1):165.
[0478]
mukai k,gaudenzio n,gupta s等人.assessing basophil activation by using flow cytometry and mass cytometry in blood stored 24hours before analysis.j allergy clin immunol.2017;139(3):889-899e811.
[0479]
hamilton rg,franklin adkinson n,jr.in vitro assays for the diagnosis of ige-mediated disorders.j allergy clin immunol.2004;114(2):213-225;quiz 226.
[0480]
tsai ct,mukai k,robinson pv等人.isotype-specific agglutination-pcr(isap):a sensitive and multiplex method for measuring allergen-specific ige.j allergy clin immunol.2018;141(5):1901-1904e1915.
[0481]
li tm,chuang t,tse s,hovanec-burns d,el shami as.development and validation of a third generation allergen-specific ige assay on the continuous random access immulite 2000analyzer.ann clin lab sci.2004;34(1):67-74.
[0482]
tomabechi y,hosoya t,ehara h,sekine si,shirouzu m,inouye s.crystal structure of nanokaz:the mutated 19kda component of oplophorus luciferase catalyzing the bioluminescent reaction with coelenterazine.biochem biophys res commun.2016;470(1):88-93.
[0483]
shimomura o,masugi t,johnson fh,haneda y.,properties and reaction mechanism of the bioluminescence system of the deep-sea shrimp oplophorus gracilirostris.biochemistry.1978年3月21日;17(6):994-8.
[0484]
hall mp,unch j,binkowski bf,valley mp,butler bl,wood mg,otto p,zimmerman k,vidugiris g,machleidt t,robers mb,benink ha,eggers ct,slater mr,meisenheimer pl,klaubert dh,fan f,encell lp,wood kv.engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate.acs chem biol.2012年11月16日;7(11):1848-57。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。