cd4 t细胞系在慢病毒感染滴度检测中的用途及方法
技术领域
1.本发明涉及基因工程领域,特别是涉及cd4 t细胞系在慢病毒感染滴度检测中的用途及方法。
背景技术:
2.重组慢病毒(lentivirus)基因治疗载体是目前应用最为广泛的基因治疗载体之一,大多数重组慢病毒是以hiv-1(人类免疫缺陷i型病毒)为基础发展而来。具有广泛的宿主范围、极低的免疫原性和优异的感染效率,能够有效的将目的基因的表达框架整合到包括分裂期及非分裂期细胞的基因组中。基于hiv的复制缺陷型的自我失活型,以vsvg为膜蛋白的第三代假包膜慢病毒载体能够有效的将目的基因的表达框架整合到包括分裂期及非分裂期的广泛的细胞基因组中,并且不受到细胞分裂影响的高效表达目的基因,使得以慢病毒为载体的基因治疗药物在临床上有可能达到一次治疗、终身有效的目标。目前已经被成功应用到多个上市基因及细胞治疗药物和临床在研基因治疗药物中,具有极大的商业化价值。
3.慢病毒载体将目的基因的表达框架整合到目的细胞基因组中是其持续终身高效表达目的基因的前提条件。将目的基因的表达框架拷贝整合到人体内细胞基因组中是慢病毒载体基因治疗药物给药的最终目的,即整合到细胞基因组中的目的拷贝数,即为慢病毒载体基因治疗药物的真实有效剂量。
4.理想的基因治疗药物给药应该达到目的基因在目的细胞群体中整合正好符合给药剂量的拷贝数。所有药物研究中药物的剂量不仅与药效相关,更与药物带来的毒性及安全性息息相关,剂量是药物应用中最为重要的指标,整合的基因表达框架拷贝数是基因治疗药物研发中必须要精确控制的剂量相关指标。事实上,慢病毒载体基因治疗药物为一次应用即整合进细胞基因组,药物相关毒性及安全性将不可逆的持续终身。药物剂量,即目的基因拷贝数控制的重要性,更远胜于常规药物的代谢途径。
5.要达到在目的细胞群体中整合正好符合给药剂量的目的基因拷贝数,就必须对慢病毒载体的生物学活性,即感染滴度进行准确的测量及检测。在各种离体及在体基因治疗应用中,慢病毒载体的粗制品、半成品、中间产物、洗脱物质、原料药、终产品制剂等均以感染滴度检测为指导慢病毒载体各种层次应用的第一重要指标。
6.绝大部分商业化的慢病毒基因治疗载体采用具有广泛宿主范围的vsv-g包膜,慢病毒载体感染滴度检测当前的主流方法是以培养的贴壁293t细胞为目的细胞的感染滴度检测方法,包括预先接种293t细胞;待细胞贴壁完成后以待测慢病毒载体样本感染贴壁后293t细胞;通过检测一段时间后293t细胞内整合进细胞基因组的目的基因拷贝数与细胞内源性基因拷贝数的比值,推算出该慢病毒载体的感染滴度。但接种贴壁293t细胞的慢病毒载体感染滴度检测方法有如下的一些缺陷:
7.1)感染滴度检测过程中,慢病毒颗粒与细胞的非培养表面相互作用,但是并不能与培养表面相互作用,减少了病毒感染细胞的几率,影响了慢病毒载体感染滴度的准确测
量。
8.2)预先接种贴壁的293t细胞在贴壁的过程中伴随着细胞的增殖,感染发生时的精确细胞数量,较难以通过常规的悬浮细胞技术方法准确控制。
9.3)细胞在贴壁的过程增加了慢病毒载体感染滴度检测的操作周期。
10.4)hiv-1病毒在体内主要感染血液中的cd4 t细胞,虽然采用vsv-g包膜的慢病毒基因治疗载体具有广泛的宿主范围,但293t细胞来源于人胚胎肾上皮细胞,并非特异hiv病毒感染的宿主细胞,所以有可能不是对慢病毒基因治疗载体感染最敏感的细胞系之一。
技术实现要素:
11.鉴于以上所述现有技术的缺点,本发明的目的在于提供cd4 t细胞系在慢病毒感染滴度检测中的用途及方法,用于解决现有技术中的问题。
12.为实现上述目的及其他相关目的,本发明首先提供cd4 t细胞系在慢病毒感染滴度检测中的用途。
13.所述cd4 t细胞系包括mt4细胞、c8166细胞或jurkat细胞。
14.所述jurkat选自jurkat-e6细胞。
15.本发明还提供一种慢病毒感染滴度的检测方法,所述检测方法包括如下步骤:将待测慢病毒接种到cd4 t细胞系的细胞悬液中,继续培养接种待测慢病毒后的cd4 t细胞系,培养结束后检测所述待测慢病毒的感染滴度。
16.优选的,将待测慢病毒稀释后再接种到cd4 t细胞系的细胞悬液中。
17.优选的,所述cd4 t细胞系选自mt4细胞、c8166细胞或jurkat细胞。
18.如上所述,本发明的cd4 t细胞系在慢病毒感染滴度检测中的用途,具有以下有益效果:
19.1.mt4等血液来源的cd4 白血病t细胞系对慢病毒感染的敏感性显著高于来源于人胚胎肾上皮细胞的293t细胞系,其中mt4细胞系对同一慢病毒载体感染滴度的检测值比293t细胞系高5-10倍,即更接近于待测慢病毒的真实感染滴度,可以用作精确测量慢病毒感染滴度的检测细胞系。
20.2.接种细胞后可以立即进行感染操作,方便精确控制感染发生时的精确细胞数量,同时还可以缩短慢病毒载体感染滴度检测的操作周期。
21.3.基于悬浮细胞的感染滴度检测技术,方便高通量大规模检测,相对于贴壁细胞也更有利于全自动工作站操作,减少人工操作误差和干扰。
22.4.应用范围包括各种规模的慢病毒基因治疗载体感染滴度生物学活性指标的质量检测。
附图说明
23.图1-1显示为本发明的慢病毒载体构建体pccl-sin-ef1α-wpre-egfp的示意图。
24.图1-2显示为本发明的慢病毒载体构建体pccl-sin-pgk-wpre-egfp的示意图。
25.图2-1显示为293t作为检测细胞系时,pgk-egfp慢病毒的生物滴度随培养天数的变化趋势图。
26.图2-2显示为293t作为检测细胞系时,ef1a-egfp慢病毒的生物滴度随培养天数的
变化趋势图。
27.图3-1显示为mt4作为检测细胞系时,pgk-egfp慢病毒的感染效率随培养天数的变化趋势。
28.图3-2显示为mt4作为检测细胞系时,ef1α-egfp慢病毒的感染效率随培养天数的变化趋势。
具体实施方式
29.为了获得更接近真实的慢病毒感染滴度生物学活性指标,以用于精确指导重组慢病毒的离体及在体基因治疗的最佳剂量应用;为了使慢病毒感染滴度检测数据更加准确、稳定可靠,方法更加方便操作,易于通量放大,本发明首先提供cd4 t细胞系在慢病毒感染滴度检测中的用途。
30.所述cd4 t细胞系为人源的悬浮细胞系。利用这种敏感的人源悬浮细胞系,对重组慢病毒的生物学活性尤其是感染滴度进行精确检测。与广泛应用的传统贴壁293t来源的检测细胞系相比,能获得慢病毒的更接近真实生物学活性指标,能用于精确指导重组慢病毒的离体及在体基因治疗应用,应用范围包括各种规模的慢病毒的定性、定量质量检测。
31.在一种实施方式中,所述cd4 t细胞系包括mt4细胞、c8166细胞、jurkat细胞。
32.所述mt4细胞是人血液来源的cd4 急性淋巴母细胞白血病t细胞系。在一种实施方式中,所述mt4细胞为源自欧洲认证细胞培养物收藏中心ecacc编号为08081402的细胞。
33.在一种实施方式中,所述c8166细胞为来源于欧洲认证细胞培养物收藏中心ecacc编号为88051601的细胞。
34.在一种实施方式中,所述jurkat选自jurkat-e6细胞。所述jurkat-e6细胞是jurkat-fhcrc细胞株(jurkat细胞株的衍生)的一个克隆。在一种实施方式中,所述jurkat-e6细胞为美国标准生物品收藏中心atcc编号为tib-152的细胞。
35.同时用293t细胞、k562细胞、mt4细胞、c8166细胞、jurkat细胞检测慢病毒的感染滴度,本技术的发明人意外的发现,以mt4细胞、c8166细胞、jurkat细胞为检测细胞系时待测慢病毒的感染滴度高于k562、293t等悬浮细胞系。更意外的是,以mt4为检测细胞系时待测慢病毒的感染滴度最高,即高于c8166、jurkat-e6、k562、293t等悬浮细胞系,因此,mt4细胞可首选作为慢病毒感染滴度检测细胞系。
36.病毒滴度主要有两种表示方式:
37.1.直接滴度,也称为物理滴度,通过严格测定病毒的实际颗粒数量得到,通常以病毒颗粒数量/ml表示,即vp/ml。
38.2.感染滴度,也称为功能滴度,表示有多少病毒实际感染了靶细胞。功能滴度可采用转染单位/ml表示,即tu/ml,也可能用蚀斑/ml表示,即pfu/ml,或者以感染单元/ml表示,即ifu/ml。表示方法取决于病毒载体。感染滴度比直接滴度更准确的反映病毒载体的生物活性,因为可以测定有多少病毒具有实际进入靶细胞的潜力。
39.本发明还提供一种慢病毒感染滴度的检测方法,所述检测方法包括如下步骤:将待测慢病毒接种到cd4 t细胞系的细胞悬液中,继续培养cd4 t细胞系,培养结束后检测所述待测慢病毒的感染滴度。
40.所述待测慢病毒可以是任意经过慢病毒包装的方法得到的慢病毒,例如可以是携
带荧光报告基团的慢病毒,也可以是携带或不携带任何基团的慢病毒。为简化实验过程,本技术中的实施例以携带荧光报告基团的慢病毒进行实验。
41.在一种实施方式中,将待测慢病毒稀释后再接种到cd4 t细胞系的细胞悬液中。本发明中对待测慢病毒的稀释比例不做具体限制。待测慢病毒的稀释比例例如为5~4000倍。在一种实施方式中,可以用cd4 t细胞系的培养基稀释待测慢病毒。
42.在一种实施方式中,在多孔细胞培养板中进行实验时,cd4 t细胞系的细胞悬液中cd4 t细胞系的细胞数量为每孔4.00e 04~1.60e 05个。在一较佳实施方式中,cd4 t细胞系的细胞悬液中cd4 t细胞系的细胞数量为每孔1.00e 05~1.60e 05个。
43.在一种实施方式中,接种待测慢病毒后,继续培养时间为2~6天。
44.在一种实施方式中,在多孔细胞培养板中进行实验时,cd4 t细胞系的细胞悬液的体积为每孔30~200μl。
45.在一种实施方式中,所述多孔板为96孔板。利用其他规格的细胞培养板时可根据上述96孔细胞培养板的数据进行换算。
46.培养结束后可以通过流式细胞术或荧光定量pcr检测待测慢病毒的感染滴度。采用流式细胞术时的步骤如下:用流式细胞仪检测培养结束后cd4 t细胞系的病毒阳性率,进而计算得到所述待测慢病毒的感染滴度。
47.所述病毒阳性率是指被所述待测慢病毒感染的cd4 t细胞系占细胞总数的百分比。在本发明的实施例中,用荧光报告基因gfp表达百分率(gfp%)表示病毒阳性率。
48.采用流式细胞术检测待测慢病毒的感染滴度的计算方法如下:细胞流式分析后,将荧光百分比5-30%之间的数据代入以下公式计算:
49.滴度(tu/ml)=细胞数*荧光百分比*103/病毒原液体积(μl)
50.若不同荧光百分比代入公式后得到的感染滴度数值不同,则选择多次出现的值作为感染滴度,若有多个数值多次出现,则选择多次出现的数值中最大的一个数值作为待测慢病毒的感染滴度。
51.对于不携带荧光报告基因的慢病毒,则采用荧光定量pcr检测待测慢病毒的感染滴度。荧光定量pcr的方法为本领域技术人员所熟知的。例如:提取细胞总dna,以总dna为模板运行定量pcr,根据定量pcr的结果以细胞内整合进细胞基因组的目的基因拷贝数与细胞内源性基因拷贝数的比值,推算出待测慢病毒的感染滴度。
52.在一种实施方式中,所述cd4 t细胞系选自mt4细胞、c8166细胞或jurkat细胞。
53.在一种实施方式中,所述慢病毒感染滴度的检测方法中还可以包括其他本领域熟知的步骤或细节,例如将待测慢病毒接种到cd4 t细胞系的细胞悬液中时可以加入病毒助感染试剂,其所占比例也是本领域人员所熟知的。再例如,所述cd4 t细胞系的培养条件和培养基均为根据细胞所来源的细胞培养中心推荐的条件和培养基,本领域技术人员也可以在专业认知或各实验室条件的基础上进行调整培养条件和培养基。所述检测方法中使用的试剂若无特别说明均为市售试剂。
54.本发明实施例通过瞬时转染贴壁293t细胞的方法,获得携带gfp报告基因的多个慢病毒,并使用纯化后的慢病毒,以不同的方式接种到不同的感染滴度检测细胞系,在不同的检测时间点收获细胞后,以流式细胞仪的方法检测报告基因的表达。本发明实施例按照上述流程比较了293t细胞系,以及多个血液来源的cd4 t细胞系在慢病毒感染滴度检测方
面的差异,详细分析了细胞接种数量、方式、时间、细胞培养体积、病毒载体感染比率、感染时间等因素对慢病毒感染滴度的影响。
55.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
56.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式―一个”、―一”和―这个”包括复数形式。
57.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
58.实施例1携带gfp报告基因的慢病毒载体构建体的获得
59.本发明中使用的慢病毒载体骨架来源于康霖生物科技(杭州)有限公司自备第3代慢病毒载体骨架。该慢病毒载体包含嵌合型ltr启动子、hiv-1包装信号(ψ)、中心聚嘌呤区(cppt)、rev应答元件(rre)、多嘌呤片段(ppt)、自失活长末端重复序列、土拨鼠乙肝病毒转录后调控元件(wpre)、sv40病毒的多腺苷酸化信号(sv40 pa signal)、sv40病毒的复制起始位点(sv40ori)。利用前述慢病毒载体构建的携带gfp荧光蛋白报告基因的慢病毒载体构建体pccl-sin-ef1α-wpre-egfp和pccl-sin-pgk-wpre-egfp的示意图分别如图1-1和图1-2所示,二者可分别获得ef1a-egfp慢病毒和pgk-egfp慢病毒。
60.将上述慢病毒载体构建体(pccl-sin-ef1α-wpre-egfp,pccl-sin-pgk-wpre-egfp)、包装质粒(pkl-kan-gagpol;pkl-kan-rev)和包膜质粒(pkl-kan-vsvg)按照4:2.6:1:1比例同时共转染293t细胞,在该293t细胞系中进行慢病毒的包装。转染方法为pei阳离子聚合物介导的真核细胞瞬时转染,pei阳离子聚合物为购自polysciences的pei-max转染试剂(购自polysciences,货号:24765-1),转染操作参照生产商推荐标准化操作进行。转染完成48小时后,收获慢病毒(转染细胞培养上清),首先在台式吊桶式机上,室温4000rpm离心5分钟去除细胞碎片,再以顺序步骤的切向流、分子筛、离子交换树脂的常规纯化方法去除病毒生产过程中产生的各种杂质,并将制备好的病毒重悬液分装冻存于-80度备用,分别标记样本为:待测样本ef1α-egfp和待测样本pgk
–
egfp。
61.实施例2感染滴度检测方法
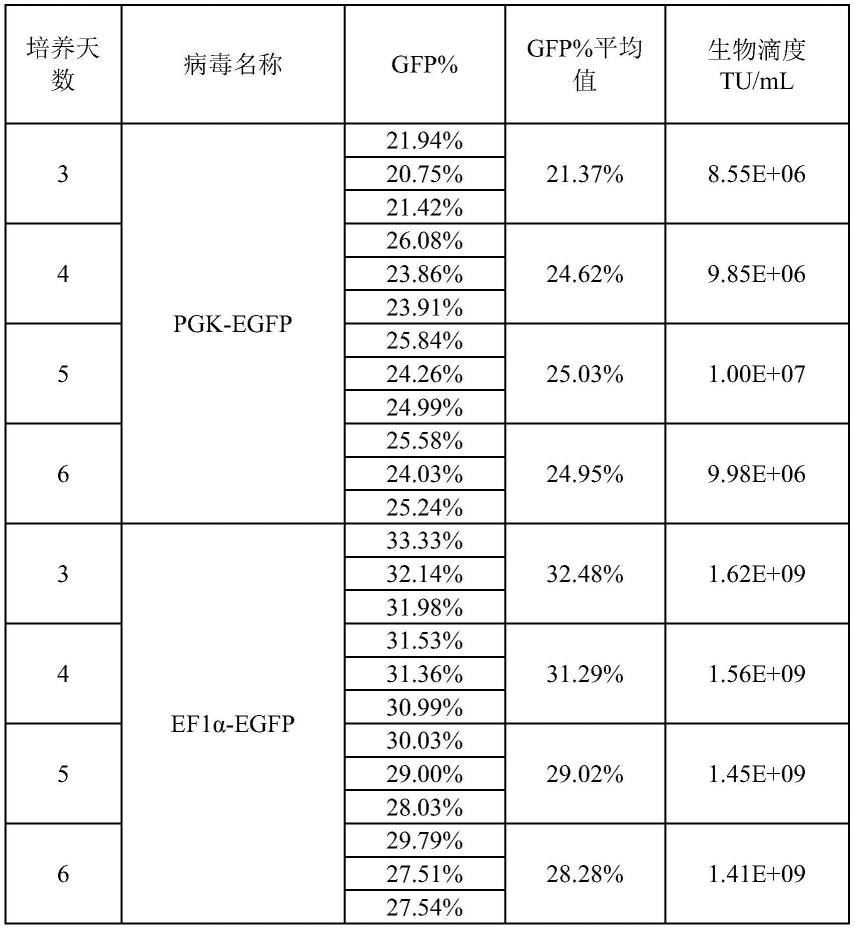
62.感染滴度检测细胞系的获得:
63.人胚胎肾上皮细胞来源的293t细胞(atcc-ccl-243)购自美国标准生物品收藏中心;
64.人血液来源的cd4 急性淋巴母细胞白血病t细胞系——mt4(欧洲认证细胞培养物收藏中心ecacc-08081402)购自上海素尔生物科技有限公司;
65.c8166(欧洲认证细胞培养物收藏中心ecacc-88051601)购自南京科佰生物科技有限公司;
66.jurkat-e6(美国标准生物品收藏中心atcc-tib-152)购自美国标准生物品收藏中心;
67.各细胞培养按照细胞培养中心推荐的培养条件下,经稳定传代后冻存以液氮保存备用。
68.感染滴度检测方法:
69.将待测慢病毒样本以不同稀释比例稀释到室温的新鲜细胞培养基中,再以不同体积接种于预铺在96孔或48孔细胞培养板中的各种检测细胞系。经过一定时间的培养后,通过常规离心的方法收集细胞,通过本领域熟知的方法,以基于gfp信号的流式细胞术数据计算出慢病毒初始收获液感染滴度。流式细胞术法具体步骤如下:同时收集部分细胞,以流式细胞缓冲液(磷酸盐缓冲液pbs;2%胎牛血清fbs)重悬细胞后,送入流式细胞仪运行检测,仪器为(安捷伦科技(中国)有限公司novocyte flow cytometer systems)。
70.以荧光报告基因gfp表达阳性细胞占待测慢病毒感染的cd4 t细胞总数的百分比(gfp%)表示病毒阳性率,待测慢病毒的感染滴度的计算方法如下:细胞流式分析后,将荧光百分比5-30%之间的数据代入以下公式计算:滴度(tu/ml)=细胞数*荧光百分比*103/病毒原液体积(μl)。
71.实施例3感染滴度检测条件对293t检测细胞系为靶细胞的检测系统的影响
72.培养时间的影响
73.以实施例2所述的相同检测方法,将293t检测细胞以每孔细胞数量为5.00e 04个细胞的密度接种于48孔细胞培养板中,接种细胞培养体积为200μl/孔,接种细胞12小时后,将待测病毒以培养基为稀释液稀释到体积为100μl后感染细胞,以流式细胞术的方法检测待测样本ef1α-egfp和待测样本pgk
–
egfp的感染滴度,其中待测样本ef1α
–
egfp稀释80倍和待测样本pgk
–
egfp稀释10000倍,培养时间为感染后3-6天,数据如下:
74.表1
[0075][0076]
待测病毒感染滴度随培养天数的变化趋势图分别如图2-1和2-2所示。待测样本pgk-egfp感染滴度培养3-6天趋于稳定;待测样本ef1α-egfp 3天达到最高值,后逐渐趋于稳定,有略微下降趋势。
[0077]
接种细胞数量的影响
[0078]
将293t检测细胞以不同的密度接种于48孔细胞培养板中,接种细胞培养体积为200μl/孔,接种细胞12小时后,将待测病毒以培养基为稀释液稀释到体积为100μl后感染细胞,待测样本ef1α
–
egfp稀释80倍,以流式细胞术的方法检测待测样本pgk
–
egfp的感染滴度。接种细胞数量对病毒感染效率的影响数据如表2所示,当接种细胞数量在1.5e 05时,测得病毒感染滴度趋于稳定。
[0079]
表2
[0080][0081]
以上检测数据显示:待测样本pgk-egfp感染滴度最高为2.12e 07感染单位每毫升(transduction units,tu/ml);待测样本ef1α-egfp感染滴度最高为1.45e 09感染单位每毫升(transduction units,tu/ml)。
[0082]
实施例4感染滴度检测条件对悬浮mt4检测细胞系为靶细胞的检测系统的影响
[0083]
培养时间的影响
[0084]
以实施例2所述的相同检测方法,将mt4检测细胞以每孔细胞数量为1.00e 05个细胞的密度接种于96孔细胞培养板中,细胞培养体积为50μl/孔,将待测病毒以培养基为稀释液稀释到体积为20μl后感染细胞,以流式细胞术的方法检测待测样本ef1α-egfp和待测样本pgk
–
egfp的感染滴度,其中待测样本ef1α
–
egfp稀释80倍和待测样本pgk
–
egfp稀释10000倍,培养时间为感染后3-6天,数据如下:
[0085]
表3
[0086]
[0087][0088]
待测样本pgk-egfp和ef1α-egfp的感染效率随培养天数的变化趋势如图3-1和3-2所示,可见二者均在第4-6天趋于稳定。
[0089]
接种细胞数量的影响
[0090]
将mt4检测细胞以不同细胞密度接种于96孔细胞培养板中,细胞培养体积为50μl/孔,将待测病毒以培养基为稀释液稀释到体积为20μl后感染细胞,其中待测样本ef1α
–
egfp稀释80倍和待测样本pgk
–
egfp稀释10000倍,培养时间为感染后3天,以流式细胞术的方法检测待测样本ef1α-egfp和待测样本pgk
–
egfp的感染滴度,接种细胞数量对病毒感染效率的影响数据如表4所示,当接种细胞数量在1.40e 05时,测得两种慢病毒的感染滴度均达到最高值,继续增大接种细胞数量后,两种慢病毒的感染滴度均稍有下降。
[0091]
表4
[0092]
[0093][0094]
细胞培养体积的影响
[0095]
将mt4检测细胞以1.00e 05个细胞/孔的细胞密度接种于96孔细胞培养板中,细胞培养体积为30μl-150μl/孔不等,将待测病毒以培养基为稀释液稀释到体积为20μl后感染细胞,其中待测样本ef1α
–
egfp稀释200倍和待测样本pgk
–
egfp稀释10000倍,培养时间为感染后3天,以流式细胞术的方法检测待测样本ef1α-egfp和待测样本pgk
–
egfp的感染滴度,不同的细胞培养体积对病毒感染效率的影响数据如表5所示,当细胞数量、病毒数量、感染后培养时间一定时,细胞培养体积越小,慢病毒的滴度越高。(50μl为铺满96孔培养板底部最小体积)
[0096]
表5
[0097]
[0098]
[0099][0100]
以上感染滴度检测数据显示,以mt4为检测细胞系时:待测样本pgk-egfp感染滴度最高为1.03e 08感染单位每毫升(transduction units,tu/ml);待测样本ef1α-egfp感染滴度最高为1.29e 10感染单位每毫升(transduction units,tu/ml)。分别比以293t为检测细胞系时测的感染滴度高4.86倍和8.9倍。
[0101]
实施例5多个cd4 t细胞检测细胞系的数据比较
[0102]
以实施例2所述的相同检测方法,以mt4、c8166、jurkat-e6、k562等悬浮细胞系为
检测靶细胞,以1.00e 05个细胞/孔的细胞密度接种于96孔细胞培养板中,细胞培养体积为30μl/孔,将待测病毒以培养基为稀释液稀释到体积为20μl后感染细胞,培养时间为感染后3天检测待测样本pgk
–
egfp,数据如表6-1至6-4所示。由于cd4 t细胞为悬浮细胞,293t细胞为贴壁细胞,贴壁细胞无法与悬浮细胞在相同的实验条件下进行对比,因此本实施例中未考察相同条件下293t细胞与cd4 t细胞的检测结果,293t细胞的检测结果可参考实施例3中293t的最佳实验条件得出的检测结果,即待测样本pgk-egfp感染滴度最高为2.12e 07tu/ml,可见相同的病毒用293t细胞检测得到的滴度远低于本实施例中用cd4 t细胞检测得到的滴度。
[0103]
表6-1以mt4为检测靶细胞
[0104][0105]
表6-2以c8166为检测靶细胞
[0106][0107][0108]
表6-3以jurkat-e6为检测靶细胞
[0109][0110]
表6-4以k562为检测靶细胞
[0111][0112]
以上感染滴度检测数据显示,以mt4为检测细胞系时:待测样本pgk-egfp感染滴度高于c8166、jurkat-e6、k562等悬浮细胞系检测靶细胞,意外的发现mt4为优先的慢病毒感染滴度检测细胞系。
[0113]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。