1.本发明属于抗肿瘤技术领域,特别涉及一种右旋氧杂蒽酮衍生物在制备抗肿瘤药物中的应用。
背景技术:
2.在医学上,癌(cancer)是指起源于上皮组织的恶性肿瘤,是恶性肿瘤中最常见的一类。相对应的,起源于间叶组织的恶性肿瘤统称为肉瘤。有少数恶性肿瘤不按上述原则命名,如肾母细胞瘤、恶性畸胎瘤等。一般人们所说的“癌症”习惯上泛指所有恶性肿瘤。癌症具有细胞分化和增殖异常、生长失去控制、浸润性和转移性等生物学特征,其发生是一个多因子、多步骤的复杂过程,分为致癌、促癌、演进三个过程,与吸烟、感染、职业暴露、环境污染、不合理膳食、遗传因素密切相关。
3.恶性肿瘤有很多种,其性质类型各异、累及的组织和器官不同、病期不同、对各种治疗的反应也不同,因此大部分患者需要进行综合治疗。以肺癌为例,其具有较高的发病率和死亡率,其死亡率在所有恶性肿瘤中居首位,其主要治疗方法是放化疗,随着手术、放化疗以及近年来得到极大关注的免疫疗法等治疗手段取得不断突破,肺癌患者的预后较前已经有了明显改善,但仍有很大一部分患者确诊时己处于肺癌晚期,伴随着进一步治疗出现化疗耐药和免疫耐受等原因,目前肺癌的五年生存率仅为18.1%左右。因此,寻求新的治疗药物降低或抑制肺癌的发生已迫在眉睫。
4.研究人员发现,abx化合物(anthrabenzoxocinone)是一小类结构新颖、活性优良的化合物,其具有两个罕见的芳环骨架,包括一个非连续共轭的苯环和个手性氧杂桥环骨架,此外,该类化合物还具有一个独特的偕二甲基蒽醌结构,该结构是一类新型的高效抑制细菌fas ii蛋白的药效基团;说明abx化合物具有良好抗耐药菌活性,但abx化合物在抗肿瘤方面的应用未见报道。
技术实现要素:
5.本发明意在提供一种具备抗肿瘤作用的右旋氧杂蒽酮衍生物(( )-abx化合物)及其制备方法。
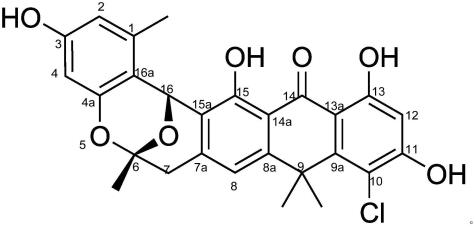
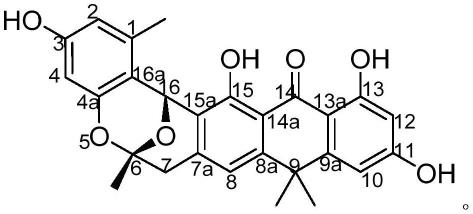
6.一种右旋氧杂蒽酮衍生物(( )-abx化合物),( )-abx化合物的结构式为:
[0007][0008]
一种右旋氧杂蒽酮衍生物的制备方法,包括以下步骤:
[0009]
步骤一、streptomycessp.fjs 31-2次级代谢产物的分离
[0010]
(1)将包含链霉菌streptomyces sp fjs 31-2菌株的发酵培养基连同菌体捣碎,加入乙酸乙酯提取得到乙酸乙酯提取浸膏;
[0011]
(2)使用丙酮及甲醇溶解乙酸乙酯提取浸膏,与硅胶粉搅拌混匀,待溶剂挥发完全后采用正相硅胶柱层析进行分离纯化,分离纯化时,采用洗脱剂氯仿-丙酮按照100%、95%、90%、80%、67%、50%、33%、0%的比例进行梯度洗脱,得到洗脱液;
[0012]
(3)使用旋转蒸发仪将洗脱液进行真空浓缩,浓缩后进行tlc分析,根据显色分析结果合并相似的组分,共合并获得20个组分,组分依次标记为fr.1、fr.2、fr.3、fr.4、fr.5、fr.6、fr.7、fr.8、fr.9、fr.10
……
fr.20;
[0013]
步骤二、( )-abx的分离纯化
[0014]
(4)将组分fr.9用甲醇溶解后,经葡聚糖凝胶sephadex lh-20柱层析,甲醇洗脱,管收集,经tlc检测,合并14~20管,得组分ⅰ;
[0015]
(5)组分ⅰ用甲醇溶解,经hplc分析进行制备,选用甲醇(a)-水(b)作为流动相,洗脱过程:0.00-15.00min,20%(a)-100%(a);15.01min-20.00min,100%(a);当hplc图谱到达12.757min时出现的峰即为( )-abx化合物。
[0016]
本方案的有益效果:使用本方法,可以便捷高效的实现对( )-abx化合物(右旋氧杂蒽酮衍生物)的制备。
[0017]
进一步,所述硅胶粉的规格为100~200目。
[0018]
进一步,步骤(2)梯度洗脱时,流速为1s/滴。
[0019]
进一步,步骤(4)中甲醇洗脱时,流速为8s/滴。
[0020]
基于( )-abx化合物,本技术还提供一种右旋氧杂蒽酮衍生物在制备抗肿瘤药物中的应用,以填补( )-abx化合物在抗肿瘤活性方面的研究空白,扩大( )-abx化合物的用途。
[0021]
经活性测试证明,( )-abx化合物具有良好的抗肿瘤效果,尤其是对肺癌、鼻咽癌和甲状腺癌细胞具有良好的抑制作用。
[0022]
本技术中,( )-abx化合物从链霉菌fjs 31-2的发酵产物中分离得到;链霉菌fjs 31-2的保藏号为:cgmcc 4.7321。
[0023]
链霉菌fjs 31-2的保藏单位名称:中国微生物菌种保藏管理委员会普通微生物中心,保藏日期:2016年6月2日,分类命名:链霉菌streptomyces sp,保藏单位地址:北京市朝阳区北辰西路1号院3号。
附图说明
[0024]
图1为( )-abx的高效液相色图谱;
[0025]
图2为( )-abx化合物的1h nmr光谱图;
[0026]
图3为( )-abx化合物的
13
c nmr光谱图;
[0027]
图4为( )-abx化合物的圆二色谱图;
[0028]
图5为( )-abx化合物对肺癌细胞h1299和h226作用24h的细胞效应图;
[0029]
图6为( )-abx化合物对肺癌细胞h1299和h226的克隆形成作用及克隆形成实验量化图;
[0030]
图7为( )-abx化合物对h1299和h226肺癌细胞迁移的影响对比图;
[0031]
图8为( )-abx化合物对h1299和h226肺癌细胞侵袭的影响对比图;
[0032]
图9为hoechst 33342染色检测( )-abx化合物对h1299和h226肺癌细胞的凋亡作用对比图;
[0033]
图10为流式细胞术检测( )-abx化合物对h1299和h226肺癌细胞的凋亡作用对比图;
[0034]
图11为( )-abx化合物作用h1299和h226肺癌细胞24h后凋亡相关基因表达情况对比图;
[0035]
图12为( )-abx化合物作用h1299和h226肺癌细胞24h后对凋亡蛋白表达水平的影响对比图;
[0036]
图13为( )-abx化合物对肺癌小鼠的作用及小鼠肿瘤组织中ki67的表达情况对比图;
[0037]
图14为( )-abx化合物对鼻咽癌肿瘤细胞(cne1)的ic50值;
[0038]
图15为空白组鼻咽癌肿瘤细胞(cne1)24h的细胞效应图;
[0039]
图16为( )-abx化合物8μm浓度下对鼻咽癌肿瘤细胞(cne1)作用24h的细胞效应图;
[0040]
图17为( )-abx化合物16μm浓度下对鼻咽癌肿瘤细胞(cne1)作用24h的细胞效应图;
[0041]
图18为( )-abx化合物32μm浓度下对鼻咽癌肿瘤细胞(cne1)作用24h的细胞效应图;
[0042]
图19为( )-abx化合物64μm浓度下对鼻咽癌肿瘤细胞(cne1)作用24h的细胞效应图;
[0043]
图20为( )-abx化合物128μm浓度下对鼻咽癌肿瘤细胞(cne1)作用24h的细胞效应图;
[0044]
图21为( )-abx化合物256μm浓度下对鼻咽癌肿瘤细胞(cne1)作用24h的细胞效应图;
[0045]
图22为( )-abx化合物对甲状腺癌细胞tpc-1的ic50图;
[0046]
图23为空白组甲状腺癌细胞tpc-124h的细胞效应图;
[0047]
图24为( )-abx化合物8μm浓度下对甲状腺癌细胞tpc-1作用24h的细胞效应图;
[0048]
图25为( )-abx化合物16μm浓度下对甲状腺癌细胞tpc-1作用24h的细胞效应图;
[0049]
图26为( )-abx化合物32μm浓度下对甲状腺癌细胞tpc-1作用24h的细胞效应图;
[0050]
图27为( )-abx化合物64μm浓度下对甲状腺癌细胞tpc-1作用24h的细胞效应图;
[0051]
图28为( )-abx化合物128μm浓度下对甲状腺癌细胞tpc-1作用24h的细胞效应图;
[0052]
图29为( )-abx化合物256μm浓度下对甲状腺癌细胞tpc-1作用24h的细胞效应图。
具体实施方式
[0053]
下面通过具体实施方式进一步详细说明:
[0054]
(一)( )-abx化合物的制备方法
[0055]
(1)streptomyces sp.fjs 31-2次级代谢产物的分离
[0056]
将包含链霉菌streptomyces sp fjs 31-2菌株的发酵培养基连同菌体捣碎,加入乙酸乙酯提取得到乙酸乙酯提取浸膏;使用丙酮及甲醇溶解乙酸乙酯提取浸膏(32g),与硅胶粉(100-200目,1.3kg)搅拌混匀,溶剂挥发完全后采用正相硅胶柱层析(100-200目,1.3kg)进行分离纯化。链霉菌fjs 31-2的保藏号为:cgmcc 4.7321。链霉菌fjs 31-2的保藏单位名称:中国微生物菌种保藏管理委员会普通微生物中心,保藏日期:2016年6月2日,分类命名:链霉菌streptomyces sp,保藏单位地址:北京市朝阳区北辰西路1号院3号。
[0057]
采用洗脱剂氯仿-丙酮(100%、95%、90%、80%、67%、50%、33%、0%),依次按以上比例进行梯度洗脱,每个梯度洗脱3l,每瓶收集150ml,流速为1s/滴。将洗脱液使用旋转蒸发仪进行40℃真空浓缩,进行tlc点板分析,根据显色分析结果合并相似的组分,共合并获得20个组分,组分依次标记为fr.1、fr.2、fr.3、fr.4、fr.5、fr.6、fr.7、fr.8、fr.9、fr.10
……
fr.20。
[0058]
(2)( )-anthrabenzoxocinone的分离纯化
[0059]
将组分fr.9(4.224g)用少量甲醇溶解后,经葡聚糖凝胶sephadex lh-20(200g)柱层析,甲醇洗脱,流速为8s/滴,5ml/管收集,经tlc检测,合并14-20管,得组分ⅰ(20mg);合并23-40管,得组分ⅱ(171mg);合并40-95管,得组分ⅲ(1.3g)。
[0060]
组分ⅰ(20mg)用甲醇溶解成适当的浓度,经hplc分析进行制备,选用甲醇(a)-水(b)作为流动相,洗脱过程:0.00-15.00min,20%(a)-100%(a);15.01min-20.00min,100%(a)。当保留时间为5.972min时,收集主峰12.757min,真空浓缩收集液用于下一步的纯度分析,当主峰纯度为95%以上时,称重合并得( )-abx化合物(8mg)。
[0061]
(二)化合物结构解析
[0062]
( )-abx化合物的结构式如下:
[0063][0064]
浅黄色粉末,
13
c nmr和dept谱给出碳信号δc:167.7,167.4,159.6,159.0,157.0,154.5,152.4,144.8,138.0,125.5,119.5,115.8,113.2,109.1,108.4,103.0及101.7,根据这些信号的化学位移值可以初步推断出该化合物具有三个苯环结构,结合其它的碳信号δ
c 192.8,仲碳信号δ
c 35.0,季碳信号δ
c 35.0和δ
c 99.7,氢谱1h nmr信号δh:13.5(1h,s),12.8(1h,s),7.16(1h,s),6.75(1h,d,j=2.0hz),6.33(1h,d,j=2.1hz),6.27(1h,d,j=2.0hz),6.16(1h,d,j=2.2hz),2.52(3h,s),1.95(3h,s),1.88(3h,s),1.64(3h,s),3.24(1h,d,j=18.0hz)和3.24(1h,d,j=18.0hz),从而确定化合物结构,其1h-nmr和
13
c-nmr数据详见表1。
[0065]
表1 化合物( )-abx的1h-nmr谱和
13
c-nmr谱(actone-d6,δppm)信号归属
[0066][0067]
(三)( )-abx抗肿瘤效应分析
[0068]
(1)cck-8法检测细胞增殖能力
[0069]
①
细胞培养:弃去培养基,pbs液清洗2次,加入1ml 0.25%胰蛋白酶消化细胞,将细胞悬液转移至15ml离心管,800rpm,离心3min。取3ml完全培养基重新悬浮细胞,并转移至培养瓶中吹打均匀,置于37℃、5%co2培养箱中培养。
[0070]
②
细胞铺板:取出培养的细胞,0.25%胰蛋白酶消化细胞,收集细胞悬液,调整细胞密度为5
×
104个/ml,取100μl细胞悬液,分别加入96孔板中,置于37℃、5%co2培养箱培养24h。
[0071]
③
细胞给药:依次将该药物孔稀释成2μm、4μm、8μm、16μm、32μm、64μm、128μm、256μm等8个浓度作为测试浓度,每个药物组平行6个复孔,37℃、5%co2培养箱作用24h后结束培养。
[0072]
④
吸光度测定:pbs清洗96孔板,每孔加入90μl培养基和10μl cck8试剂,37℃孵育4h,采用酶标仪检测490nm处的od值。
[0073]
⑤
实验分析:
[0074]
根据各组od
490
值的平均值,按以下公式能够计算处细胞生长抑制率,采用graphpadprism6.0统计软件来计算ic
50
。
[0075][0076]
ic
50
(half maximal inhibitory concentration)是指药物的半抑制浓度。它能指示某一药物或者物质(抑制剂)在抑制某些生物程序,如细胞死亡一半时的浓度或剂量,ic
50
值可以用来衡量药物诱导凋亡的能力,即诱导能力越强,该数值越低,也可以反向说明某种细胞对药物的耐受程度。
[0077]
(2)细胞克隆实验
[0078]
根据ic50选择三个药物浓度(10、20、40μm),进行细胞克隆形成实验。
[0079]
将对数生长期的细胞以600-800个/孔接种6孔板中培养24h,使用不同浓度的药物进行干预处理,分别加入化合物( )-abx使其终浓度为10、20、40μm。每2d更换1次含药物的培养基,连续培养10d。弃去原培养液,用pbs洗涤2次。随后,用预冷的4%多聚甲醛固定细胞15min,用0.1%结晶紫染色20min。最后,在显微镜下取3个随机视野进行观察,判断菌落形成情况,进行计数克隆。
[0080]
(3)细胞划痕实验
[0081]
将10
×
105个细胞接种于6孔板中培养24h,用200μl枪头在6孔板中划线,pbs清洗划掉的细胞,分别加入分别加入化合物( )-abx使其终浓度为10、20、40μm,药物作用24h后更换为无血清培养基,置于37℃、5%co2中培养,按0、12、24、48h拍照。
[0082]
(4)细胞迁移和侵袭实验
[0083]
细胞迁移:取对数生长期细胞h1299和h226细胞接种于6孔板中,分别加入化合物( )-abx使其终浓度为10、20、40μm作用24h后,细胞密度调整为1
×
106个/ml,transwell小室中加入200μl细胞悬液;transwell下室加入500μl含20%fbs,1640培养基;置于37℃、5%co2培养箱中培养24h后,pbs洗2遍,甲醇固定20min,0.1%结晶紫染色20min,用棉签轻轻擦掉上层未迁移的细胞,400
×
显微镜下观察细胞并计数。
[0084]
细胞侵袭:将matrigel胶稀释后加入transwell小室中,37℃孵育至少4-5小时,弃去小室中残余液体,每孔加入70μl无血清培养基,37℃孵育30min后进行实验,其余操作步骤同细胞迁移实验。
[0085]
(四)( )-abx诱导肺癌细胞发生凋亡
[0086]
(1)hoechst33342凋亡染色
[0087]
将h1299和h226细胞密度调整为1
×
105个/ml,取100μl细胞悬液接种于96孔板中,37℃、5%co2培养24h后,分别加入化合物( )-abx使其终浓度为10、20、40μm作用24h后,用4%的多聚甲醛固定15min,加入hoechst33342(10μg/ml)染色液100μl进行染色,37℃、5%co2培养箱中孵育20-30min,置于荧光显微镜下拍照观察细胞凋亡情况。
[0088]
(2)细胞凋亡检测
[0089]
采用fitc-annexin法检测细胞凋亡率:
[0090]
细胞经不同浓度( )-abx(10、20、40μm)处理24h后,先离心收集培养液中漂浮的细胞,再用胰蛋白酶消化收集细胞悬液,将同一培养皿中的细胞收集于同一ep管中,用pbs清洗细胞2次,每组加入195μl annexin-fitc结合液,混匀后黑暗条件下依次加入5μ
lannexin-fitc和10μl碘化丙啶(pi),室温避光孵育20min,随后置于冰浴中,流式细胞仪上机检测分析不同药物浓度下的488nm处的荧光值,检测需在1h内完成,避免荧光猝灭。
[0091]
(3)qrt-pcr检测( )-abx化合物对凋亡相关基因表达的影响
[0092]
按照宝生物rnaiso plus*试剂说明书进行总rna的提取。利用宝生物primescripttm rt reagent kit(drr037a),采用20μl pcr体系反转录条件如下:37℃、15min,85℃、5s(失活反转录酶)。取反转录后的cdna品为模板,扩增bax、bcl2基因,按sybrr premix ex taqtm rt-pcr kitⅱ试剂盒说明书配制pcr反应体系。在cfx96荧光定量pcr仪上设置real time pcr反应条件为:95℃预变性30sec;95℃变性5sec,60℃退火30sec,共进行40个循环;从55℃开始,每0.5℃采集1次荧光,每次10sec,共采集81次。
[0093]
(4)western blot
[0094]
ripa裂解液裂解细胞,测定细胞蛋白浓度,每个样品取20μg蛋白经sds-page凝胶电泳分离后,转移到硝酸纤维素pvdf膜上。用5%牛奶封闭2h,加入一定稀释倍数的一抗,4℃孵育过夜。第2天,用tbst洗膜后在室温孵育hrp标记的二抗1h,tbst洗膜后加入ecl发光液,凝胶成像仪曝光,以β-actin为内参。
[0095]
(五)小鼠肺癌模型建立
[0096]
balb/c-nu小鼠6只,雄性,spf级,4-5周龄,由北京华阜康生物科技股份有限公司购买,许可证号:scxk(京)2019-0008,裸鼠皮下注射肺癌细胞(细胞密度为2
×
107个/ml)100μl,14天后以皮下长出肿瘤为建模成功。成模裸鼠随机分为肺癌组和( )-abx治疗组(2mg/kg),每组3只,治疗组隔天腹腔给药200μl(2mg/kg),给药治疗28天,肺癌组则腹腔注射等体积的生理盐水。各组小鼠继续原条件喂养30天后结束实验。
[0097]
(1)裸鼠成瘤实验
[0098]
准备肿瘤细胞:
[0099]
1、取对数生长期的肺癌细胞,用适量pbs(约2ml)清洗细胞表面2次,左右轻轻摇晃培养瓶,并弃去pbs;
[0100]
2、加入1ml 0.25%胰酶消化细胞,置于37℃细胞培养箱内消化1min;
[0101]
3、待细胞消化完全后,用完全培养基3ml(10%培养基,hyclone)终止消化,并轻轻吹打培养瓶底,将细胞移入离心管;
[0102]
4、将离心管置于4℃离心机内,800rpm离心3min;
[0103]
5、弃上清,离心管口过酒精外焰灭菌,加入1mlpbs重悬细胞;取10μl细胞悬液进行计数
[0104]
6、根据细胞计数板计数所得细胞数,将细胞密度调整为2
×
107个/ml,将细胞重悬液移入1.5mlep中,最后置于冰盒中携带至动物房,以降低细胞代谢。
[0105]
肿瘤细胞接种:
[0106]
1、左手拇指和食指捏紧裸鼠颈背部皮肤,小拇指夹住裸鼠尾巴,接种前用75%酒精消毒接种部位(裸鼠腋下靠背部);
[0107]
2、从进针部位向前穿刺约1cm,进行皮下注射,注射体积为100μl;
[0108]
3、注射完毕后,缓慢退出针头,尽量避免漏液;
[0109]
4、每3天1次观察成瘤情况,连续2周。
[0110]
(2)免疫组化
[0111]
烘片,将组织切片置于65℃烘箱烘烤2h,取出后冷却至室温。
[0112]
脱蜡和水化,将组织切片依次放于二甲苯i10min,二甲苯ii 10min,无水乙醇i 5min,无水乙醇ii 5min,95%乙醇10min,80%乙醇10min,pbs洗3次,每次3min。
[0113]
抗原修复,将柠檬酸抗原修复液(ph=6.4)置于高压锅中加热煮沸后,放入组织切片,加压3min后取出冷却至室温。pbs洗3次,每次3min。
[0114]
去除内源性过氧化物酶,滴加3%h2o2于组织切片上,孵育10min后pbs清洗切片3次,每次3min。
[0115]
封闭,用吸水纸轻轻拭去切片上多余的水分,然后滴加50μl 5%正常山羊血清,室温封闭30min。
[0116]
孵育一抗,用吸水纸轻轻拭去切片上多余的水分,置于湿盒中,在组织表面滴加配好的抗体50μl至完全覆盖组织表面,将湿盒放入4℃冰箱孵育过夜。
[0117]
生物素标记的抗小鼠的二抗孵育,将生物素标记的抗小鼠的二抗用5%的山羊血清稀释。将组织切片从冰箱中取出37℃孵育15min,用pbs洗3次,每次3min,将组织切片取出,甩干,滴加50μl二抗,烤箱孵育30min。
[0118]
dab显色,将组织切片甩干,用纸巾擦干组织周围的液体,放置于背景浅的白纸上,将配好的dab显色液滴加到组织上全部覆盖组织,在镜下观察特异性着色良好且背景不出现着色,一般在5min以内,将组织放于自来水中终止显色。
[0119]
苏木素复染,将组织切片周围的液体擦干,置于苏木素液中染1-2min,ddh2o清洗,然后在1%盐酸酒精中分化1-2秒,自来水浸泡5min,直至细胞核返蓝。
[0120]
脱水和封片,将组织切片在通风橱中依次放入80%乙醇5min,95%乙醇5min,无水乙醇i 5min,无水乙醇ii 5min,二甲苯i 5min,二甲苯ii 5min。脱水处理后,将切片置于通风橱中晾干,滴加适量中性树胶,盖上盖玻片。
[0121]
拍摄图片和定量分析
[0122]
每张切片在显微镜下观察,并随机选择视野进行拍摄。
[0123]
实验结果:
[0124]
(1)( )-abx化合物抑制肺癌细胞增殖,促进肺癌细胞的死亡
[0125]
首先,为了探索( )-abx对肺癌h1299、h226细胞的活性抑制作用,分别使用不同浓度的( )-abx作用于细胞24h,结果发现,经过( )-abx处理后,细胞收缩变圆形态发生变化,漂浮死细胞增多,细胞数目减少,抑制细胞增殖,诱导细胞发生死亡(如附图5所示),且随着( )-abx作用浓度的增加,h1299、h226细胞的活力逐渐降低,抑制率增加,( )-abx对两种细胞的ic50分别为18.07μm、19.71μm,如下表2所示:
[0126]
表2 化合物对肿瘤细胞的抑制作用(n=6)
[0127][0128]
(2)( )-abx化合物抑制肺癌细胞克隆形成能力
[0129]
平板克隆实验显示(如附图6所示),h1299、h226细胞经(10、20、40μm)处理24小时后,细胞的克隆形成数显著减少。随着药物的增加,细胞克隆能力逐渐减弱。以上结果提示( )-abx化合物能显著抑制肺癌细胞的增殖,其抑制程度呈现浓度依赖性。
[0130]
(3)( )-abx化合物抑制肺癌细胞的迁移和侵袭
[0131]
细胞迁移和侵袭实验表明,药物作用后,细胞迁移能力与空白组比减少,细胞迁移增殖能力减弱,且随药物浓度的增加,迁移增殖能力变弱(如附图7所示),侵袭能力也逐渐减弱(如附图8所示)。
[0132]
(4)( )-abx化合物诱导肺癌细胞发生凋亡
[0133]
为了探索化合物在肺癌细胞发挥细胞毒性的具体机制,我们检测了( )-abx化合物对两种肺癌细胞凋亡的诱导作用,首先,hoechst33342染色用于检测细胞核形态的变化,如附图9所示,用化合物作用细胞24小时,细胞均显示出典型的凋亡形态变化,凋亡的细胞的细胞核呈致密浓染,或呈碎块状致密浓染,且随药物浓度的增加凋亡作用不断增强(附图9)。接下来,使用流式细胞仪分析了细胞凋亡百分比,检测结果显示(如附图10所示):( )-abx化合物处理后,凋亡细胞显著增多,不同浓度的化合物(0μm;10μm;20μm;40μm)对两种肺癌细胞的凋亡率分别2.1%、4%、11.4%、55.9%和4.4%、3.5%、11%、46.5%(图11),凋亡率基本上随化合物浓度的增加而增加,这些结果都表明化合物可通过诱导细胞凋亡而促进细胞死亡。
[0134]
(5)化合物对肺癌细胞中凋亡相关基因和蛋白表达水平的影响
[0135]
不同浓度的化合物((0μm;10μm;20μm;40μm))作用于肺癌细胞24h后,qrt-pcr检测了抑凋亡基因bcl-2和促凋亡基因bax的表达,结果显示( )-abx化合物处理后bcl-2基因表达下调,bax基因表达下调(如附图11所示)。western blotting实验进一步在分子水平上检测了抑凋亡蛋白bcl-2和促凋亡蛋白bax的表达(如附8所示),我们发现( )-abx化合物以浓度依赖的方式增加了bax的表达水平,同时降低了bcl-2的表达水平,所有这些发现,证明
( )-abx化合物在肺癌细胞中均诱导凋亡而促进细胞死亡。
[0136]
(6)( )-abx化合物抑制小鼠肿瘤的生长
[0137]
成功建立了小鼠肺癌模型,治疗组隔天腹腔给药200μl(2mg/kg),连续给药治疗28天,对照组则腹腔注射等体积的生理盐水。最后实验结果显示,与对照组相比,经治疗的治疗组的小鼠的肿瘤大小和体积逐渐变小(附图13a和b),且免疫组化结果显示对照组ki67的表达升高,化合物治疗后ki67的表达显著降低(附图13c),表明对照组肿瘤生长的速度较快,治疗组肿瘤生长的速度较慢,这表明化合物在小鼠体内抑制了肿瘤组织的生长。
[0138]
ki67是一种增殖相关抗原,可根据其表达的高低来判断肿瘤生长速度的快慢,表达高说明肿瘤生长的速度较快,表达低则说明肿瘤相对来说生长速度较慢。
[0139]
(三)( )-abx化合物对鼻咽癌肿瘤细胞的抑制作用
[0140]
考察( )-abx对鼻咽癌肿瘤细胞(cne1)的活性抑制作用,采用空白对照组和分别使用不同浓度(0μm、8μm、16μm、32μm、64μm、128μm、256μm)的( )-abx作用于细胞24h,结果如附图15~21所示,结果显示,随着( )-abx作用浓度的增加,鼻咽癌肿瘤细胞(cne1)的活力逐渐降低,抑制率增加,( )-abx对鼻咽癌肿瘤细胞(cne1)的ic50为31.22μm,如下表3所示:
[0141]
表3 ( )-abx化合物对鼻咽癌肿瘤细胞的抑制作用(n=6)
[0142][0143]
考察( )-abx对甲状腺癌细胞tpc-1的活性抑制作用,采用空白对照组和分别使用不同浓度(0μm、8μm、16μm、32μm、64μm、128μm、256μm)的( )-abx作用于细胞24h,结果如附图23~29所示,结果显示,随着( )-abx作用浓度的增加,甲状腺癌细胞tpc-1的活力逐渐降低,抑制率增加,( )-abx对甲状腺癌细胞tpc-1的ic50为20.58μm,如下表4所示:
[0144]
表4 化合物对甲状腺癌细胞的抑制作用(n=6)
[0145]
[0146][0147]
以上所述的仅是本发明的实施例,方案中公知的具体结构及特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明结构的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。