管理皮肤糖尿病多发神经病变的神经源性组织纳米转染
1.相关申请的交叉引用
2.本技术要求以下专利申请的优先权:2020年5月1日提交的美国临时专利申请号63/018,900,其披露内容明确地并入本文。
3.美国政府支持声明
4.本发明根据国立卫生研究院颁发的dk114718、gm108014、nr015676、ns042617和ns085272在政府支持下完成。政府享有本发明的某些权利。
5.通过援引并入电子提交的材料
6.与本技术同时提交的计算机可读核苷酸/氨基酸序列表通过援引以其全文并入并标识如下:2021年4月21日创建的名为“335002_st25.txt”的4千字节acii(文本)文件。
背景技术:
7.糖尿病性神经病变是一种严重的糖尿病并发症,其可能影响多达50%的糖尿病患者。高血糖(葡萄糖)可损伤全身的神经,并且最经常损伤个体的腿和脚中的神经。然而,根据受影响的神经,糖尿病性神经病变症状的范围可从腿和脚的疼痛和麻木到消化系统、泌尿道、血管和心脏的问题。
8.支持经历糖尿病性外周神经病变(dpn)患者的神经纤维的现有方法依赖于用于纠正神经元的细胞内信号传导途径、生物化学和细胞器功能的药理学疗法。然而,此类干预主要由于缺乏功效和/或由于不良副作用而未能通过先前的ii期或iii期临床试验。神经生长因子(ngf)由角质形成细胞大量产生并且在dpn开始时耗尽。ngf在体外撤除导致远端轴突变性。神经营养因子补充,即外源性ngf注射,已作为dpn的预防措施在临床上进行了测试。然而,由于诸如注射部位疼痛、功效可疑以及可能需要共同施用其他营养因子等障碍,单独治疗性施用外源性ngf尚未通过临床试验。
9.除了试图维持糖尿病患者的健康血糖水平的策略之外,仍然需要更有效的治疗策略来预防糖尿病性神经病变、减轻与dpn相关的症状或减缓其进展。
技术实现要素:
10.根据本披露的一个实施例,提供了用于预防或治疗糖尿病性神经病变的组合物和方法。最近,已经报道了一种用于皮肤的体内重编程的新型非病毒组织纳米转染技术(tnt)。申请人发现,编码无刚毛鳞甲家族bhlh转录因子1(ascl1)、主神经转录因子brn2(由pou3f2编码)和髓磷脂转录因子1样蛋白(myt1l)的核酸序列的tnt递送实现了皮肤成纤维细胞向成熟的电生理学活性诱导的神经元(in)细胞的直接转化(d.gallego-perez等人,nat nanotechnol.[自然纳米技术](2017)12:974-979)。然而,尽管该发现集中于重编程的细胞,但申请人现已发现,响应于皮肤成纤维细胞的体内重编程而生成的神经营养性环境(neurotrophic environment)产生皮肤的神经营养性背景(neurotrophic milieu),其可用于拯救和/或保护在慢性糖尿病条件下易受变性损害的预先存在的神经纤维。
[0011]
根据本披露的一个实施例,提供了用于在体内增加ngf和nt3表达的皮肤基质细胞
表达的组合物和方法。在一个实施例中,该方法包括经由组织纳米转染将编码ascl1、brn2和myt1l的核酸序列引入所述患者的皮肤基质细胞中的步骤。
[0012]
根据本披露的一个实施例,提供了用于将人真皮成纤维细胞重编程为诱导的神经元(in)细胞的组合物和方法,其中该重编程的真皮成纤维细胞具有增强局部神经营养性环境和减轻与糖尿病性神经病变相关的症状的能力。在一个实施例中,待重编程的人真皮细胞位于作为神经性疼痛来源的局部组织区域中。在一个实施例中,通过用编码选自ascl1、brn2和myt1l的一种或多种基因产物的一种或多种核酸序列转染来重编程人真皮细胞。如本文所述,ascl1、brn2和myt1l的组合施用在本文中称为“abm”施用。
[0013]
在一个实施例中,组织纳米转染(tnt)用于递送ascl1、brn2和myt1l(tntabm)以在体内将皮肤成纤维细胞直接转化为电生理活性诱导的神经元细胞(in)。除了皮肤成纤维细胞的神经源性转化外,tntabm还引起皮肤基质的神经营养性富集,并且此类皮肤神经营养性背景的富集可拯救在慢性糖尿病条件下存在的应激的预先存在的神经纤维。局部皮肤tntabm引起内源性ngf和其他共调节的神经营养因子诸如nt3的升高。
[0014]
根据一个实施例,提供了治疗患者神经病变的方法。该方法包括在经历由神经损伤引起的虚弱、麻木和疼痛的局部组织(包括与受试者的手和脚相关的局部组织)中体内重编程人真皮成纤维细胞。在一个实施例中,通过将编码ascl1、brn2和myt1l的核酸序列引入靶人真皮成纤维细胞的胞质溶胶中而对局部组织的人真皮成纤维细胞进行重编程,其中所得的重编程的人真皮成纤维细胞相对于原始成纤维细胞表现出一种或多种神经源性特性,包括以下特性中的一种或多种:1)增强的ngf表达;2)增强的神经营养因子基因nt3的表达;以及真皮中增加的与所述重编程的细胞相关的tuj1 细胞的数量。在一个实施例中,重编程的人真皮成纤维细胞继续表达成纤维细胞特异性蛋白-1(fsp-1)。在一个实施例中,该方法用于治疗糖尿病患者的外周神经病变。在一个实施例中,使用体内组织纳米转染进行人真皮成纤维细胞的转染。
[0015]
在一个实施例中,提供了稳定或刺激糖尿病患者组织中pgp9.5 成熟神经纤维的方法。该方法包括以下步骤:通过将编码ascl1、brn2和myt1l的核酸序列引入所述患者的真皮成纤维细胞中而在体内重编程真皮成纤维细胞以变成神经源性的,从而产生重编程的真皮成纤维细胞。在一个实施例中,用编码ascl1、brn2和myt1l的核酸序列转染外周组织诸如手和脚的局部真皮成纤维细胞,任选地经由组织纳米转染,以提供外周神经的形态功能恢复。
附图说明
[0016]
图1a-图1i:在小鼠胚胎细胞(mef)细胞中经由纳米通道电穿孔(nepabm)转染递送编码ascl1、brn2和myt1l(abm)的基因诱导了神经营养因子。通过纳米通道电穿孔在mef细胞中递送ascl1、brn2和myt1l经由免疫染色证实。表型表征揭示了nep后2周或nep后4周诱导的神经元样细胞。nep后第1周(图1a)和第4周(图1b)的ngf表达显示4周的ngf升高。图1c提供了nep后4周来自分化的mef培养基的ngf elisa的结果的定量(n=10)。对于nep后1周(图1d、图1f和图1h;n=4)和4周(图1e、图1g和图1i;n=6)的细胞呈现了来自脑源性神经营养因子(bdnf;图1d和图1e)、神经营养蛋白-3(nt3;图1f和图1g)和神经营养蛋白-4/5(nt4/5;图1h和图1i)的mrna的rt-qpcr分析数据。神经营养蛋白-3(nt3)在nepabm后4周显示出表
达的显著增加。数据表示为平均值
±
sem,*p《0.05。
[0017]
图2a-图2c:将ascl1、brn2和myt1l(tntabm)组织纳米转染(tnt)递送到c57bl/6小鼠的背部皮肤中导致基质重编程。共聚焦显微图像显示用dapi复染的ascl1、brn2、myt1l的三重原位杂交。呈现了表示tnt后24小时皮肤中abm基因表达的rt-qpcr分析生成的数据的图(图2a;n=4)。免疫染色显示皮肤中有tuj1纤维,并且在图2b的柱状图中提供了每mm表皮长度的tuj1 纤维长度的定量(n=6)。皮肤的共聚焦显微图像显示fsp和tuj1的共定位,并且图2c提供了每个视野tuj1和fsp阳性细胞的定量。数据表示为平均值
±
sem(n=3-4),*p《0.05。
[0018]
图3a-图3f:tntabm增加了c57bl/6小鼠皮肤中的神经营养因子。呈现了来自ngf的rt-qpcr分析(图3a;n=6)、通过elisa定量的ngf表达(图3b;n=8)(*p《0.01)和显示表皮中ngf的共聚焦显微图像的定量(图3c;n=4)的数据的柱状图。
[0019]
来自皮肤中bdnf、nt3或nt4/nt5表达的rt-qpcr分析的数据的柱状图分别呈现于图3d、图3e和图3f中。数据表示为平均值
±
sem(n=6),*p《0.05。
[0020]
图4a-图4e:tntabm增加了db/db小鼠皮肤中的ngf产生和pgp9.5 神经纤维。图4a(n=6)提供了皮肤表皮的免疫染色tuj1 纤维中每mm的tuj1 纤维长度的定量。通过elisa定量组织ngf,并且数据呈现于图4b(n=9、10)中,*p《0.01。
[0021]
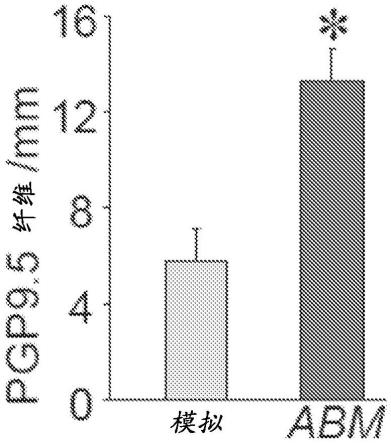
提供了4周(图4c)和9周(图4d)的ihc图像的定量。提供了基于tntabm后9周表皮中ngf的免疫染色对每mm表皮长度的pgp9.5 纤维数量的定量(图4e)。免疫染色表明皮肤中pgp9.5 纤维的数量增加。数据为平均值
±
se(n=4),*p《0.01。
具体实施方式
[0022]
定义
[0023]
在描述和要求保护本发明时,将根据下面阐述的定义使用以下术语。
[0024]
如本文所用,术语“约”意指大于或小于10%所陈述的值或值的范围,但不意图将任何值或值的范围仅限制于此较宽的定义。前面有术语“约”的每个值或值的范围也旨在涵盖所陈述的绝对值或值的范围的实施例。
[0025]
如本文所用,术语“纯化的”和类似术语涉及以基本上不含在天然或自然环境中通常与分子或化合物相关的污染物的在形式分离分子或化合物。如本文所用,术语“纯化的”不要求绝对纯度;相反,其旨在作为相对定义。术语“纯化的多肽”在本文中用于描述已经与其他化合物分离的多肽,这些其他化合物包括但不限于核酸分子、脂质和碳水化合物。
[0026]
术语“分离的”要求从其原始环境(例如,如果天然存在的话,则是天然环境)中去除所提及的物质。例如,存在于活动物中的天然存在的多核苷酸不是分离的,但从天然系统中的一些或全部共存物质中分离的相同多核苷酸是分离的。
[0027]
组织纳米转染(tnt)是基于电穿孔的技术,其能够将核酸序列和蛋白以纳米尺度递送到细胞的胞质溶胶中。更特别地,tnt使用通过阵列纳米通道的高强度和聚焦的电场,其良性地纳米穿孔并置的组织细胞成员,并且电泳驱动货物(例如,核酸或蛋白)进入细胞中。
[0028]
如本文所用,“控制元件”或“调控序列”是功能基因的非翻译区,包括增强子、启动子、5'和3'非翻译区,其与宿主细胞蛋白相互作用以进行转录和翻译。这些元件的强度和特
异性可不同。“真核调控序列”是功能基因的非翻译区,包括增强子、启动子、5'和3'非翻译区,其与真核细胞的宿主细胞蛋白相互作用以在包括哺乳动物细胞的真核细胞中进行转录和翻译。
[0029]
如本文所用,“启动子”是当在相对于基因转录起始位点的相对固定位置时起作用的一个或多个dna序列。“启动子”含有rna聚合酶和转录因子基本相互作用所需的核心元件,并且可含有上游元件和应答元件。
[0030]
如本文所用,“增强子”是独立于距转录起始位点的距离而起作用并且可以是转录单位的5'或3'的dna序列。此外,增强子可在内含子内以及编码序列本身内。它们的长度通常在10与300bp之间,并且它们以顺式起作用。增强子的功能是增加从附近启动子的转录。增强子,与启动子一样,也经常含有介导转录调节的应答元件。增强子经常决定表达的调节。
[0031]“内源”增强子/启动子是与基因组中的给定基因天然连接的增强子/启动子。“外源”或“异源”增强子/启动子是通过遗传操作(即分子生物学技术)与基因并列放置的增强子/启动子,使得该基因的转录由连接的增强子/启动子指导。如本文所用,关于细胞的外源序列是从细胞外部的来源引入细胞的序列。
[0032]
如本文所用,术语“非编码(非规范)氨基酸”涵盖不是以下20种氨基酸中任一种的l-异构体的任何氨基酸:ala、cys、asp、glu、phe、gly、his、ile、lys、leu、met、asn、pro、gln、arg、ser、thr、val、trp、tyr。
[0033]
如本文所用,术语“同一性”涉及两个或更多个序列之间的相似性。同一性通过将相同残基的数量除以残基的总数并将结果乘以100以获得百分比来测量。因此,完全相同序列的两个拷贝具有100%同一性,而相对于彼此具有氨基酸缺失、添加或取代的两个序列具有较低程度的同一性。本领域技术人员将认识到,几种计算机程序,诸如使用诸如blast(basic local alignment search tool[基本局部比对搜索工具],altschul等人(1993)j.mol.biol.[分子生物学杂志]215:403-410)的算法的那些,可用于确定序列同一性。
[0034]
如本文所用,术语“严格杂交条件”意指如果探针与靶序列之间存在至少95%和优选地至少97%的序列同一性,则通常会发生杂交。严格杂交条件的实例是在包含50%甲酰胺、5x ssc(150mm nacl,15mm柠檬酸三钠)、50mm磷酸钠(ph 7.6)、5x邓哈特溶液(denhardt's solution)、10%硫酸葡聚糖和20μg/ml变性剪切载体dna诸如鲑鱼精dna的溶液中孵育过夜,随后在0.1x ssc中在约65℃下洗涤杂交支持物。其他杂交和洗涤条件是众所周知的,并且在sambrook等人,molecular cloning:a laboratory manual,second edition[分子克隆:实验室手册,第二版],cold spring harbor,n.y.[纽约冷泉港](1989),特别是第11章中举例说明。
[0035]
如本文所用,术语“药学上可接受的载剂”包括任何标准药物载剂,诸如磷酸盐缓冲盐水溶液、水、乳液诸如油/水或水/油乳液以及各种类型的润湿剂。该术语还涵盖由美国联邦政府的管理机构批准的或在美国药典中列出的用于动物(包括人)的任何剂。
[0036]
如本文所用,术语“磷酸盐缓冲盐水”或“pbs”是指包含氯化钠和磷酸钠的水溶液。pbs的不同配制品是本领域技术人员已知的,但出于本发明的目的,短语“标准pbs”是指具有137mm nacl、10mm磷酸盐、2.7mm kcl的终浓度和7.2-7.4的ph的溶液。
[0037]
如本文所用,术语“治疗”包括减轻与特定障碍或病症相关的症状和/或预防或消
除所述症状。
[0038]
如本文所用,药物的“有效”量或“治疗有效量”是指无毒但足以提供期望效果的药物。“有效”的量将随受试者而变化,或甚至随时间在受试者内变化,这取决于个体的年龄和一般状况、施用模式等。因此,不总是可能指定精确的“有效量”。然而,在任何个别情况下,合适的“有效”量可由本领域普通技术人员使用常规实验来确定。
[0039]
如本文所用,氨基酸“取代”是指一个氨基酸残基被不同的氨基酸残基替换。
[0040]
如本文所用,术语“保守氨基酸取代”在本文中被定义为以下五组之一内的交换:
[0041]
i.小的脂族、非极性或弱极性残基:
[0042]
ala、ser、thr、pro、gly;
[0043]
ii.极性、带负电荷残基及其酰胺:
[0044]
asp、asn、glu、gln;
[0045]
iii.极性、带正电荷残基:
[0046]
his、arg、lys;鸟氨酸(orn)
[0047]
iv.大的、脂族非极性残基:
[0048]
met、leu、ile、val、cys、正亮氨酸(nle)、同型半胱氨酸(hcys)
[0049]
v.大的、芳族残基:
[0050]
phe、tyr、trp、乙酰苯丙氨酸、萘丙氨酸(nal)
[0051]
如本文所用,术语“患者”在没有进一步指明的情况下旨在涵盖在有或没有医师监督的情况下接受药物或医疗程序的任何温血脊椎驯养动物(包括例如但不限于家畜、马、猫、狗和其他宠物)或人。
[0052]
术语“载剂”意指化合物、组合物、物质或结构,当与化合物或组合物组合时,其有助于或促进化合物或组合物的制备、储存、施用、递送、有效性、选择性或用于其预期用途或目的的任何其他特征。例如,可选择载剂以使活性成分的任何降解最小化并使受试者中的任何不良副作用最小化。
[0053]
术语“抑制”是指活性、应答、病症、疾病或其他生物参数的降低。这可包括但不限于活性、应答、病症或疾病的完全消融。这也可包括例如与天然或对照水平相比活性、应答、病症或疾病减少10%。因此,与天然或对照水平相比,减少可以是10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或其间的任何量的减少。
[0054]
术语“多肽”指通过肽键或经修饰的肽键彼此连接的氨基酸,例如肽等排体等,并且可含有除20种基因编码的氨基酸之外的经修饰的氨基酸。多肽可通过天然过程诸如翻译后加工或通过本领域熟知的化学修饰技术进行修饰。修饰可发生在多肽中的任何地方,包括肽骨架、氨基酸侧链和氨基或羧基末端。
[0055]
术语“氨基酸序列”是指经由肽键连接在一起的一系列两个或更多个氨基酸,其中氨基酸连接的顺序由表示氨基酸残基的缩写、字母、字符或词语的列表指定。本文所用的氨基酸缩写是氨基酸的常规单字母代码并表示如下:a,丙氨酸;b,天冬酰胺或天冬氨酸;c,半胱氨酸;d,天冬氨酸;e,谷氨酸盐、谷氨酸;f,苯丙氨酸;g,甘氨酸;h,组氨酸;i,异亮氨酸;k,赖氨酸;l,亮氨酸;m,甲硫氨酸;n,天冬酰胺;p,脯氨酸;q,谷氨酰胺;r,精氨酸;s,丝氨酸;t,苏氨酸;v,缬氨酸;w,色氨酸;y,酪氨酸;z,谷氨酰胺或谷氨酸。
[0056]
如本文所用,短语“核酸”是指天然存在的或合成的寡核苷酸或多核苷酸,无论是
dna或rna或dna-rna杂交体,单链或双链,有义或反义,其能够通过沃森-克里克碱基配对与互补核酸杂交。核酸还可包括核苷酸类似物(例如,brdu)和非磷酸二酯核苷间键(例如,肽核酸(pna)或硫代二酯键)。特别地,核酸可包括但不限于dna、rna、cdna、gdna、ssdna、dsdna、或其任何组合。
[0057]
如本文所用,“核苷酸”是含有碱基部分、糖部分和磷酸酯部分的分子。核苷酸可通过它们的磷酸酯部分和糖部分连接在一起,从而产生核苷间键。术语“寡核苷酸”有时用于指含有连接在一起的两个或更多个核苷酸的分子。核苷酸的碱基部分可以是腺嘌呤-9-基(a)、胞嘧啶-1-基(c)、鸟嘌呤-9-基(g)、尿嘧啶-1-基(u)和胸腺嘧啶-1-基(t)。核苷酸的糖部分是核糖或脱氧核糖。核苷酸的磷酸酯部分是五价磷酸酯。核苷酸的非限制性实例是3'-amp(3'-腺苷一磷酸)或5'-gmp(5'-鸟苷一磷酸)。
[0058]
核苷酸类似物是含有对碱基、糖和/或磷酸酯部分的一些类型的修饰的核苷酸。对核苷酸的修饰是本领域熟知的,包括例如5-甲基胞嘧啶(5-me-c)、5-羟甲基胞嘧啶、黄嘌呤、次黄嘌呤和2-氨基腺嘌呤以及在糖或磷酸酯部分处的修饰。
[0059]
核苷酸替代物是具有与核苷酸类似的功能特性但不含有磷酸酯部分的分子,诸如肽核酸(pna)。核苷酸替代物是以沃森-克里克或hoogsteen方式识别核酸但通过非磷酸酯部分的部分连接在一起的分子。核苷酸替代物在与适当的靶核酸相互作用时能够遵循双螺旋型结构。
[0060]
术语“载体”或“构建体”指能够将与载体序列连接的另一核酸转运到细胞中的核酸序列。术语“表达载体”包括含有适于由细胞表达的形式的基因构建体(例如与转录控制元件连接)的任何载体(例如质粒、粘粒或噬菌体染色体)。“质粒”和“载体”可互换使用,因为质粒是常用形式的载体。此外,本发明旨在包括提供等同功能的其他载体。
[0061]
术语“可操作地连接”是指核酸与另一核酸序列的功能关系。启动子、增强子、转录和翻译终止位点和其他信号序列是可与其他序列可操作地连接的核酸序列的实例。例如,dna与转录控制元件的可操作连接是指dna与启动子之间的物理和功能关系,使得通过特异性识别、结合和转录dna的rna聚合酶从启动子启动此类dna的转录。
[0062]
如本文所用,“干扰rna”是参与转录后基因沉默的任何rna,其定义包括但不限于由有义链和反义链组成的双链rna(dsrna)、小干扰rna(sirna)和微rna(mirna)。
[0063]
如本文所用,“锁核酸”(lna)是经修饰的rna核苷酸,其中核糖部分用连接2'氧和4'碳的额外桥修饰。例如,锁核酸序列包含以下结构的核苷酸:
[0064]
如本文所用,术语“神经病变”被定义为涉及一种或多种外周神经功能障碍的病症或疾病,其通常在手和脚中导致由神经损伤引起的虚弱、麻木和疼痛。“糖尿病性神经病变”被定义为导致患有糖尿病(i型或ii型)的受试者的神经病变。
[0065]
如本文所用,术语“皮肤基质细胞”涵盖存在于邻近表皮的真皮层中的间充质细胞,其释放促进细胞分裂的生长因子。例如,皮肤基质细胞包括成纤维细胞和周细胞。
[0066]
实施例
[0067]
本文披露了用于在需要神经保护措施的患者中治疗神经病变以及稳定或刺激pgp9.5 成熟神经纤维产生的方法和组合物。在一个实施例中,患者是患有i型或ii型糖尿病的患者。更特别地,在一个实施例中,本披露涉及用于重编程皮肤细胞以相对于原始未修饰的细胞表现出一种或多种神经源性特性的组合物和方法。在一个实施例中,通过将编码ascl1、brn2和myt1l的核酸序列引入人真皮成纤维细胞中,在体内转染人真皮成纤维细胞。如本文所披露的,皮肤组织细胞的此类体内重编程导致患者中相关组织微环境的改变(这对邻近的外周神经是有益的),并且可用于治疗目的,诸如从糖尿病患者中可预测的损失路径中拯救预先存在的神经纤维。
[0068]
在一个实施例中,提供了治疗患者中的神经病变和/或减少患者皮肤pgp9.5 成熟神经纤维损失的方法。在一个实施例中,该方法包括通过将编码ascl1、brn2和myt1l的核酸序列引入人真皮成纤维细胞而在体内重编程人真皮成纤维细胞的步骤。在一个实施例中,相对于原始成纤维细胞,重编程的人真皮成纤维细胞表现出一种或多种神经源性特性,包括以下特性中的至少一种:
[0069]
增强的ngf表达;
[0070]
选自由bdnf、nt3和nt4/5组成的组的神经营养因子基因的增强的表达;以及
[0071]
真皮中增加的与所述重编程的细胞相关的相关tuj1 细胞的数量。在一个实施例中,重编程的真皮成纤维细胞继续表达成纤维细胞特异性蛋白-1(fsp-1)。
[0072]
在一个实施例中,本发明涉及包含神经源性成纤维细胞的组合物,该神经源性成纤维细胞当存在于皮肤组织中时引起皮肤基质的神经营养性富集,包括内源性ngf和其他共调节的神经营养因子诸如nt3的升高,以及使用此类组合物在需要神经保护措施的患者中治疗神经病变和/或稳定或刺激pgp9.5 成熟神经纤维的产生的方法。本文披露的神经源性成纤维细胞来源于经验证的表达成纤维细胞特异性蛋白-1(fsp-1)的人真皮成纤维细胞(hadf),其已经被操纵以具有促进更神经源性环境的能力。将此类重编程的成纤维细胞用编码以下三种基因产物的核酸转录:ascl1、brn2和myt1l,其在皮肤成纤维细胞中的表达将细胞转化为电生理活性诱导的神经元细胞(in)并导致皮肤的神经营养性背景的富集。在一个实施例中,此类重编程的成纤维细胞在体内产生。
[0073]
根据一个实施例,提供了用于重编程人真皮成纤维细胞以相对于原始成纤维细胞表现出一种或多种神经源性特性的方法,其中该方法包括增强ascl1、brn2和myt1l在所述细胞中的活性和/或表达。在一个实施例中,重编程的成纤维细胞继续表达成纤维细胞特异性蛋白-1(fsp-1)并表现出至少以下特性:
[0074]
1.增强的ngf表达;
[0075]
2.选自由bdnf、nt3和nt4/5组成的组的神经营养因子基因的增强的表达;或
[0076]
3.真皮中增加的与所述重编程的细胞相关的相关tuj1 细胞的数量。
[0077]
根据一个实施例,提供了用于重编程人真皮成纤维细胞以相对于原始成纤维细胞表现出一种或多种神经源性特性的方法,其中该方法包括将以下物质细胞内递送到成纤维细胞中:一种或多种选自由无刚毛鳞甲家族bhlh转录因子1(ascl1)、主神经转录因子brn2(由pou3f2编码)和髓磷脂转录因子1样蛋白(myt1l)组成的组的蛋白,或者编码一种或多种选自由ascl1、brn2和myt1l蛋白组成的组的蛋白的多核苷酸;或将成纤维细胞暴露于细胞
外囊泡,该细胞外囊泡由含有或表达一种或多种选自由ascl1、brn2和myt1l组成的组的蛋白或者编码一种或多种选自由ascl1、brn2和myt1l蛋白组成的组的蛋白的多核苷酸的细胞产生。
[0078]
在一个实施例中,重编程成纤维细胞的方法包括增加细胞内ascl1、brn2和myt1l蛋白浓度,包括例如通过用一种或多种编码ascl1、brn2和myt1l的核酸序列转染细胞。转染可在体内或体外进行。在一个实施例中,将编码ascl1、brn2和myt1l的核酸序列体内递送至人真皮成纤维细胞的胞质溶胶中。根据本发明,可使用将大分子引入细胞中的任何标准技术。已知的递送方法可大致分为两种类型。在第一种类型中,涉及机械、热或电手段的基于膜破裂的方法可用于破坏细胞膜的连续性,其具有增强的透化作用以允许期望的大分子的直接穿透。在第二种类型中,使用各种病毒、外来体、囊泡和纳米颗粒胶囊的基于载剂的方法允许通过细胞的胞吞作用和融合过程摄取载剂以递送载剂有效负载。
[0079]
在一个实施例中,细胞内递送经由病毒载体或能够与细胞膜相互作用以将其内容物递送到细胞中的其他递送媒介物进行。在一个实施例中,细胞内递送经由三维纳米通道电穿孔、通过组织纳米转染装置递送、或通过深层局部组织纳米电喷射装置递送而进行。在一个实施例中,使用硅空心针阵列通过组织纳米转染(tnt)将重编程组合物体内递送到成纤维细胞的胞质溶胶中。
[0080]
在基于透化作用的破裂递送方法中,电穿孔已被建立为通用工具。通过仔细控制电场分布,可以最小的细胞毒性实现高效递送。根据一个实施例,通过使用组织纳米转染(tnt)将核酸序列递送到体细胞的胞质溶胶中。组织纳米转染(tnt)是一种电动基因转移技术,其将质粒、rna和寡核苷酸递送到活组织,从而在免疫监视下在体内引起组织功能的直接转化,而不需要任何实验室程序。与通常用于体内组织重编程的病毒基因转移不同,tnt避免了对病毒载体的需要,并因此使基因组整合或细胞转化的风险最小化。
[0081]
目前体内重编程的方法可涉及体内或体外转染细胞,随后植入。尽管本发明的一个实施例需要细胞的体外重编程,随后进行移植,但细胞植入物通常具有低存活率和差的组织整合。另外,体外转染细胞涉及附加的调节和实验室障碍。
[0082]
根据一个实施例,用本文披露的重编程组合物体内转染真皮成纤维细胞。用于大量体内转染的常用方法是递送病毒载体或电穿孔。尽管根据本披露可使用病毒载体将重编程组合物递送到真皮成纤维细胞,但病毒载体存在可能启动不期望的免疫反应的缺点。此外,许多病毒载体引起基因的长期表达,这对于基因疗法的一些应用是有用的,但对于其中持续的基因表达是不必要的或甚至是不期望的应用,瞬时转染是可行的选择。病毒载体还涉及可能具有不期望的副作用的插入诱变和基因组整合。然而,根据一个实施例,某些非病毒载剂,诸如脂质体或外来体,可用于将重编程混合物体内递送到体细胞。
[0083]
tnt提供了一种用于局部基因递送的方法,该方法在免疫监视下在体内引起组织功能的直接转化,而不需要任何实验室程序。通过使用tnt和质粒,有可能在时间和空间上控制基因的过表达或抑制靶基因的表达。用tnt进行空间控制允许转染靶区域,诸如皮肤组织的一部分,而不转染其他组织。关于tnt装置的细节已在美国公布专利申请号20190329014和20200115425中有所描述,其披露内容通过援引明确地并入。
[0084]
组织纳米转染允许通过阵列纳米通道施加高强度和聚焦的电场将货物(例如重编程因子)直接胞质递送到细胞中,其良性地纳米穿孔并置的组织细胞成员,并且电泳驱动货
物进入细胞中。
[0085]
根据一个实施例,提供了通过本文披露的方法中的任一种产生的神经源性成纤维细胞,其中该神经源性成纤维细胞表达成纤维细胞特异性蛋白-1(fsp-1)和至少一种选自由ascl1、brn2和myt1l组成的组的蛋白。在一个实施例中,神经源性成纤维细胞的特征在于ascl1、brn2和myt1l中的一种或多种的表达升高,任选地ascl1、brn2和myt1l中的全部的表达升高。
[0086]
根据本发明,本文披露的神经源性成纤维细胞的体内产生可用于稳定或刺激患者组织(包括糖尿病患者组织)中pgp9.5 成熟神经纤维的产生。在一个实施例中,该方法包括在体内重编程真皮成纤维细胞以变成神经源性的,或将已在体外重编程为神经源性的神经源性成纤维细胞引入患者的步骤。在一个实施例中,通过使所述真皮成纤维细胞与编码蛋白ascl1、brn2和myt1l的核酸序列在增强所述核酸序列的细胞摄取的条件下接触,已对真皮成纤维细胞进行重编程。在一个实施例中,重编程包括经由tnt将编码蛋白ascl1、brn2和myt1l的核酸序列递送到人真皮成纤维细胞的胞质溶胶中。
[0087]
在一个实施例中,提供了治疗糖尿病患者的外周神经病变的方法,其中该方法包括在接近神经性疼痛部位的组织中引入神经源性成纤维细胞或将成纤维细胞重编程以变成神经源性的。在一个实施例中,该方法包括用编码蛋白ascl1、brn2和myt1l的核酸序列转染真皮成纤维细胞。
[0088]
实例1
[0089]
神经源性成纤维细胞状态的诱导
[0090]
材料和方法
[0091]
小鼠
[0092]
所有动物研究均根据印第安纳大学机构实验室动物护理和使用委员会(institutional laboratory animal care and use committee of indiana university)批准的方案进行。将小鼠在22℃
±
2℃的标准条件下维持12小时的光/暗循环,并随意获取食物和水。c57bl/6小鼠购自杰克逊实验室(jackson laboratories)。瘦素受体自发突变(leprdb)纯合型lepr db/db小鼠(bks.cg7 m / leprdb/j,或db/db;库存号000642)(8-10周龄)购自缅因州巴尔港(bar harbor,me)的杰克逊实验室。
[0093]
细胞培养
[0094]
原代小鼠胚胎成纤维细胞(mef)购自密理博西格玛公司(millipore sigma)(pmef-hlc)。mef在补充有10%胎牛血清、100ug/ml链霉素、100u/ml青霉素、0.25ug/ml两性霉素和1x mem非必需氨基酸(全部来自赛默飞世尔科技公司(thermofisher scientific))的dmem中生长。将细胞在37℃下在95%空气和5%co2中在潮湿气氛中维持。
[0095]
用于体外重编程的纳米通道电穿孔
[0096]
对于纳米通道电穿孔(nep),将细胞在常规维持培养基(如上所提及的dmem)中以约0.15-0.18
×
106个细胞/孔的密度直接在transwell膜(康宁公司(corning),目录号3460)的顶端表面上生长。在纳米通道电穿孔(nep)转染之前使细胞粘附并铺展过夜。细胞加载后,用pbs替换顶端室中的培养基,然后将transwell插入物安装在与质粒溶液直接接触的定制金电极上。然后将反电极浸入顶端室的pbs中,使用biorad gene pulser xcell电源在电极两端施加方波脉冲(275v,35ms持续时间脉冲,1-10个脉冲)。之后立即用新鲜培养
基替换pbs,然后将细胞在37℃下孵育过夜。将ascl1、brn2、myt1l(abm)质粒以2:1:1的摩尔比混合,如d.gallego-perez等人,nat nanotechnol.[自然纳米技术](2017)12:974-979中所述。
[0097]
诱导神经元方案
[0098]
nep后,将mef在聚-d-赖氨酸氢溴酸盐(美国密理博西格玛公司)涂覆的玻璃盖玻片或板上在常规维持培养基中培养24小时。24小时后,用神经元诱导培养基替换培养基。通过用1x n2补充物、100ug/ml链霉素、100u/ml青霉素、0.25ug/ml两性霉素、1x mem非必需氨基酸和10ng/ml人bfgf补充dmem基础培养基来制备神经元诱导培养基。将用abm cdna表达质粒转染的mef细胞分化一周、两周或四周。
[0099]
用于体内重编程的组织纳米转染
[0100]
对于体内重编程,使用c57bl/6小鼠(8-10周龄)或db/db小鼠(27周龄)进行组织纳米转染(tnt)以递送编码ascl1、brn2和myt1l(abm)的核酸序列(tnt
abm
指定tnt用abm进行细胞转染)。如前所述使用tnt装置(d.gallego-perez等人,nat nanotechnol.[自然纳米技术](2017);12:974-979)。简而言之,待用于转染的皮肤的背部区域在tnt之前24h被脱毛。然后将皮肤剥落以去除死细胞/角蛋白细胞层,从而暴露表皮中的有核细胞。将abm质粒混合物(2:1:1摩尔比)以0.05-0.1ug/ul的浓度加载到贮库中。将涂覆金的电极(阴极)浸入质粒溶液中,并将25g针反电极(阳极)插入与tnt平台表面并置的真皮中。然后在电极两端施加脉冲电刺激(10个脉冲,振幅250v,每个脉冲10ms的持续时间)以纳米穿孔暴露的细胞膜并驱动质粒货物通过纳米通道进入细胞。除非另有说明,否则对照样品涉及用模拟质粒溶液的tnt处理。tnt
abm 24h后,在oct中收集小鼠皮肤样品(12mm钻取活检)。在10μm厚的切片上进行皮肤组织学和mrna原位表达。
[0101]
dna质粒制备
[0102]
使用质粒dna纯化试剂盒(zymopure ii质粒midiprep试剂盒,目录号d4201)制备模拟(空载体)、ascl1、brn2和myt1l质粒。由nanodrop 2000c分光光度计(赛默科技公司(thermoscientific))获得dna浓度。如先前所述(d.gallego-perez等人,nat nanotechnol.[自然纳米技术](2017)12:974-979),通过加拿大不列颠哥伦比亚省里士满的应用生物材料公司(applied biological materials inc.,richmond,bc,canada),用gfp(ascl1)、rfp(brn2)或cfp(myt1l)构建ascl1、brn2和myt1l质粒(骨架,pcagg)。pcagen(空)是connie cepko(addgene质粒#11160)赠送的。
[0103]
rna分离和mrna的实时定量pcr
[0104]
使用总rna提取和纯化分离试剂盒根据制造商的方案(加拿大安大略省索罗尔德的诺冠生物科技公司(norgen biotek,thorold,on,canada))提取总rna。对于基因表达研究,通过使用superscript
tm vilo
tm cdna合成试剂盒(赛默飞世尔科技公司)实现总cdna合成。使用sybr green-i通过实时pcr定量ascl1、brn2、myt1l、ngf、bdnf、nt3、nt4/5的mrna丰度。gapdh用作管家对照。使用以下引物组:
[0105]
m_gapdh f 5'-atgaccacagtccatgccatcact-3'(seq id no:1)
[0106]
m_gapdh r 5'-tgttgaagtcgcaggagacaacct-3'(seq id no:2)
[0107]
m_ascl1 f:5'-cgacgagggatcctacga c-3'(seq id no:3)
[0108]
m_ascl1 r:5'-cttcctctgccctcgaac-3'(seq id no:4)
[0109]
m_brn2_f:5'-ggtggagttcaagtccatcta c-3'(seq id no:5)
[0110]
m_brn2_r:5'-tggcgtccacgtagtagtag-3'(seq id no:6)
[0111]
m_myt1l_f:5'-atacaagagctgttcagctgtc-3'(seq id no:7)
[0112]
m_myt1l_r:5'-gtcgtgcatatttgccactg-3'(seq id no:8)
[0113]
m_ngf f:5'-accaatagctgcccgagtgaca-3'(seq id no:9)
[0114]
m_ngf r:5'-gagaactcccccatgtggaagact-3'(seq id no:10)
[0115]
m_bdnf f:5'-cgtggggagctgagcgtgtg-3'(seq id no:11)
[0116]
m_bdnf r:5'-gcccctgcagccttccttgg-3'(seq id no:12)
[0117]
m_nt3 f:5'-gcccaaagcagaggcaccca-3'(seq id no:13)
[0118]
m_nt3 r:5'-gctaccaccgggttgcccac-3'(seq id no:14)
[0119]
m_nt4/5 f:5'-agtctgcagtcaacgcccgc-3'(seq id no:15)
[0120]
m_nt4/5 r:5'-tgcgacgcagtgagtggctg-3'(seq id no:16)
[0121]
免疫细胞化学(icc)
[0122]
在用神经元转化因子abm或模拟质粒纳米转染的小鼠胚胎成纤维细胞(mef)上进行icc。简而言之,将细胞用4%甲醛在室温下固定15min,用0.1%triton x-100透化处理15min,随后在室温下用10%正常山羊血清封闭1h。封闭后,进行一抗处理,随后用pbs洗涤三次。
[0123]
应用二抗以观察map2(艾博抗公司(abcam),ab5392;159 1:1000)、βiii微管蛋白(tuj1)(艾博抗公司,ab52623;1:200,genetex gtx85469;1:500)和160神经丝200(密理博西格玛公司n4142;1:200)蛋白的表达模式。通过随后与适当的荧光标记的二抗(alexa 488-标记的α-兔,1:200;alexa 568-标记的α-鸡,1:200)一起孵育来观察信号。荧光图像使用fluoview fv1000光谱共聚焦显微镜和激光扫描共聚焦显微镜(lsm 880,蔡司公司(zeiss))获取。
[0124]
免疫组织化学和显微镜检查
[0125]
对12mm钻取活检样品的10um厚石蜡或冷冻切片进行组织免疫染色。使用所指示的特异性抗体在皮肤样品的石蜡和冷冻切片上进行βiii微管蛋白(tuj1)(艾博抗公司,ab52623;1:100;基因泰克公司(genetex,inc.)gtx85469,1:500)、s100a4(艾博抗公司,ab41532;1:200)、神经生长因子-β(nfg)(密理博西格玛公司,ab1526;1:200)、蛋白基因产物9.5(pgp9.5)(密理博西格玛公司,ab1761;1:200)的免疫染色。简而言之,将oct或石蜡包埋的组织以10um厚冷冻切片,用冷丙酮固定,用10%正常山羊血清封闭并与特异性抗体一起孵育。通过随后与适当的荧光标记的二抗(alexa 488标记的α-兔,1:200;alexa 488标记的α-鸡,1:200;alexa 568标记的α-兔,1:200)一起孵育并用dapi复染,观察信号。使用axio scan.z1载玻片扫描仪(蔡司显微镜)或激光扫描共聚焦显微镜(蔡司公司)收集图像。图像分析软件zen(蔡司公司)用于定量荧光强度。此外,使用zen(蔡司公司)中的细胞计数模块对视场(fov)中的荧光阳性细胞进行手动细胞计数。对于每个图像,对三至六个此类fov进行计数,并且将数据表示为阳性百分比。使用zen black软件进行共定位。
[0126]
酶联免疫吸附测定(elisa)
[0127]
对于细胞培养实验,在培养基中测量ngf产生,并将其归一化为从细胞裂解物测量的总蛋白浓度。对于皮肤组织样品,从二十个100μm厚的切片中分离蛋白。将组织切片收集
在hbss中,用hbss洗涤3次以去除oct并重悬浮于匀浆缓冲液[50mm tris-hcl ph 7.5-8.0、150mm nacl、1%triton x-100、0.5%脱氧胆酸钠、10ul蛋白酶抑制剂混合物(密苏里州圣路易斯的西格玛公司(sigma,st.louis,mo))和10ul pmsf(100mm)]中。将组织在冰上匀浆三次,每次30s,用电动匀浆器(pellet pestle motor)(新泽西州的金布尔大通公司(kimble chase,nj))破碎5至10s,随后在冰上超声处理三次,每次10s,破碎10s。将匀浆物在4℃下以21,000g离心5min。收集上清液并储存在-80℃下直至进行elisa。根据制造商的说明书进行二辛可宁酸蛋白测定(伊利诺伊州罗克福德的皮尔斯公司(pierce,rockford,il))以标准化每毫克蛋白的ngf值。使用ngf快速elisa试剂盒(比奥森斯有限公司(biosensis pty ltd))确定ngf蛋白水平。
[0128]
rna原位杂交(荧光多重rnascope)
[0129]
使用低温恒温器(徕卡显微系统公司(leica microsystems))切割皮肤切片(10um),并将其安装在superfrost plus gold载玻片(飞世尔科技公司(fisher scientific),#22-035-813)上。随后将载玻片储存在-80℃。使用定制软件针对靶rna设计成对的双-z寡核苷酸探针。抗ascl1 mrna(313291-c2)、brn2(460561-c3)和myt1l(483401)的探针以及用于原位杂交和dapi标记的所有其他试剂购自高级细胞诊断公司(advanced cell diagnostics,acd,加利福尼亚纽瓦克(newark,ca))。使用rnascope多重荧光试剂v2试剂盒根据制造商的说明书手动进行组织预处理、杂交、扩增和检测。在rnascope杂交期间,同时处理阳性探针(目录号321811)、阴性探针(目录号321831)和abm探针。使用fv3000 olympus显微镜获取荧光图像。
[0130]
结果
[0131]
经由纳米通道电穿孔递送abm(nepabm)导致mef在转染后2周和4周转化为in细胞。如神经丝200 染色所示,诱导的神经元(in)细胞在4周时显示出显著升高的ngf表达(图1b)。在nepabm后4周,在mef培养基中诱导ngf蛋白产生,如图1c所示。nepabm后1周(图1d)和4周(图1e)的脑源性神经营养因子(bdnf)、nepabm后1周(图1f)和4周(图1g)的神经营养蛋白-3(nt3)和nepabm后1周(图1h)和4周(图1i)的神经营养蛋白-4/5(nt4/5)的定量分析显示,nepabm后4周(图1g)nt3的表达显著增加。
[0132]
通过原位检测ascl1、brn2和myt1l的表达,证实了abm经由tnt
abm
向鼠背部皮肤的成功局部递送(图2a)。早期显现为tuj1 的in细胞在tnt
abm
后4周在真皮中明显丰富(图2b)。tuj1 in细胞共表达成纤维细胞特异性蛋白(fsp),这标志着这些in细胞是成纤维细胞来源的。(图2c)。
[0133]
tnt
abm
在tnt
abm
后1周增强了鼠皮肤中ngf的表达(参见图3a),随后在tnt
abm
后4周增强了ngf蛋白产生(图3b)。基于免疫染色,升高的ngf表达位于表皮中(图3c)。包括bdnf(图3d)、nt3(图3e)和nt4/5(图3f)的神经营养因子基因表达的定量分析显示在tnt
abm
后1周有显著的nt3表达(图3e)。
[0134]
在db/db小鼠背部皮肤上的局部tnt
abm
显示在4周时真皮中tuj1 细胞增加(图4a)。转染组织中ngf的丰度通过elisa进行定量(数据呈现于图4b中(n=9、10),*p《0.01),并且4周时(图4c)和9周时(图4d)的ihc图像的定量显示在tnt
abm
后4周ngf显著增加。在小鼠中,在tntabm后,由表皮产生的ngf升高持续长达9周。当神经病变的发作被充分记录时,这些db/db小鼠在那时是36周龄。通过pgp9.5 染色测量的成熟神经元在数量上显著高于tntmock
(图4e)。
[0135]
讨论
[0136]
体内重编程通常依赖于植入有限数量的已在体外重编程的细胞。此类方法通常与宿主免疫系统相冲突。局部tnt介导的体内重编程提供细胞在免疫监视下在活体内转化的优点。成功的体内细胞转化表明此类重编程仅在与局部免疫系统成功协商后发生。因此,此类体内细胞重编程过程更可能生成具有翻译意义的可持续结果。
[0137]
细胞的体内重编程诱导预期通过旁分泌机制影响相同微环境内的非重编程细胞的因子的释放。体内重编程的产物是成功转化的细胞以及支持转化细胞和周围神经细胞存活和功能的改良的组织微环境。成人皮肤中由tnt
abm
生成的in细胞长期维持并获得电生理活性。
[0138]
如本文所披露的,响应于tnt
abm
而产生的tuj1 神经细胞与fsp 细胞共定位,表明in的成纤维细胞来源,如先前所确立的。这项工作的一个有趣的发现是皮肤基质富集ngf和nt3表达。体外条件下ngf和nt3诱导的不一致时间线可通过实验条件的差异来解释,诸如基质和血液携带因子的复杂性。
[0139]
在老年糖尿病小鼠中观察到ngf和nt3表达的延迟诱导,表明在糖尿病条件下成功的神经源性重编程存在障碍。dpn的临床评估包括感觉测试、神经传导速度测试或通过蛋白基因产物9.5(pgp9.5)免疫染色在皮肤活检中的神经纤维计数。pgp9.5 肽能和非肽能表皮内神经纤维(ienf)的计数越来越被认为是用于定量评估dpn中的小神经损失的“金标准”。这些早期结构变化已在db/db小鼠中确立。在这项工作中,db/db小鼠中的局部皮肤tnt
abm
诱导了升高的ngf产生长达9周。此类升高的皮肤ngf与较高丰度的pgp9.5 成熟神经纤维相关。众所周知,在db/db中,皮肤pgp9.5 成熟神经纤维在该年龄显著减少。因此,响应于局部皮肤tnt
abm
,内源性ngf和其他共调节的神经营养因子的升高有效避免糖尿病中皮肤pgp9.5 成熟神经纤维的损失。总之,这是证明在体内重编程条件下组织微环境的变化可用于治疗目的的第一项研究,诸如在糖尿病条件下从可预测的损失路径中拯救预先存在的神经纤维。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。