1.本技术涉及一种微生物污染程度的检测方法及设备,属于生物化学检测领域。
背景技术:
2.传统的微生物污染程度的检测方法主要为微生物培养法和ph方法,其中微生物方法操作复杂,劳动强度大,对操作人员的技术水平要求高,检测速度慢、通常需要7-19天,需要无菌操作环境;ph方法主要通过检测样品中ph的变化来判断微生物污染程度,通常需要5-14天,需要无菌操作环境,另外并非所有微生物的生长繁殖都会改变ph,因此ph方法易出现假阴性结果。由于这些检测方法检测速度较慢,可适用于保质期较长的罐头类食品的检测,而乳制品等自动化程度较高且保质期较短的食品则不适用这样的检测方法。
3.atp是一种能量分子,普遍存在于有机体中,atp含量与微生物活细胞数量成一定正比关系。因此,通过检测样品中atp的含量判断微生物的污染程度是一种非常有市场前景的、快速检测样品中微生物污染的方法。这种方法的步骤大体包括:首先通过atp降解剂去除微生物细胞外的游离atp(若是植物源性食品,要先提取植物体细胞atp);再酶解游离atp和/或植物体细胞atp;然后裂解微生物活细胞以释放出微生物活细胞内的atp;再后在荧光素酶的存在下,atp可与荧光素快速反应并发光;最后通过检测仪捕获atp发光反应的发光信号并报告结果。这种方法存在的问题是:atp降解酶在反应中活力不足,游离atp去除不完全,微生物细胞裂解不充分,缺乏优质的反应体系,同一套检测方法对不同的样品难以均获得准确度、精密度、灵敏度俱佳的检测结果等。
技术实现要素:
4.为了解决上述技术问题,发明人联合多家科研单位共同研发,将整套atp检测方法流程中的每个环节拆分开来,逐一进行改良,分工协作,最终摸索出了一套高效的微生物污染程度检测系统,包括试剂盒、检测方法及设备。
5.本技术提供一种检测仪,包括流体系统、光电系统、微孔板承载系统和软件系统;所述流体系统由分液系统和注射系统组成;所述光电系统由高灵敏的光电倍增管和信号收集器组成。
6.在一些实施方式中,流体系统中采用反向泵将使用后残留在管线中的试剂泵回试剂瓶中。
7.在一些实施方式中,光电倍增管采用百叶窗设计。
8.本技术还提供一种试剂盒,其特征在于,所述试剂盒包括atp降解酶、atp降解缓冲液和/或微生物细胞裂解剂;可选的,所述试剂盒还包括植物细胞atp提取剂;可选的,所述试剂盒还包括发光反应试剂和发光反应缓冲液;其中:所述atp降解缓冲液中包括zn2 离子;或者所述微生物细胞裂解剂包括三甲基甘氨酸;或者所述植物细胞atp提取剂包括脂肪醇聚氧乙烯聚二甘油醚。
9.本技术还提供一种用于检测样品微生物污染程度的系统,其特征在于,包括上述
的检测仪和/或上述的试剂盒。
10.本技术还提供一种检测atp含量的方法或鉴定微生物污染程度的方法,其特征在于,包括使用上述的检测仪,或使用上述的试剂盒,和/或使用上述的系统。
11.在一些实施方式中,所述方法包括:样品制备;通过atp降解剂降解游离atp和/或植物体细胞atp;用微生物细胞裂解剂裂解微生物活细胞以释放出微生物活细胞内的atp;使atp与荧光素反应并发光;通过检测仪捕获发光信号并反馈结果。
12.在一些实施方式中,atp与荧光素反应的发光反应缓冲液中包括mg2 、海藻糖、bsa和二硫苏糖醇。
13.在一些实施方式中,样品制备包括使样品在适于微生物生长的温度下(例如36℃)中保温(如24-72小时,优选为48小时)的步骤。
14.在一些实施方式中,所述方法进一步包括通过检测发光强度判断微生物的污染程度,当rlu值小于150时,结果为阴性;当rlu值为151-300时,结果为疑似阳性;当rlu值大于300,结果为阳性,表明存在微生物污染。
附图说明
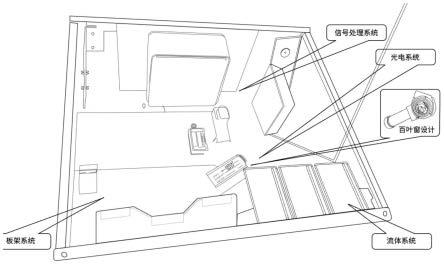
15.图1检测仪主要结构。
16.图2流体系统外观。
17.图3光电倍增管外观。
具体实施方式
18.下面参考附图来说明本技术的实施例。在本技术的一个附图或一种实施方式中描述的元素和特征可以与一个或更多个其他附图或实施方式中示出的元素和特征相结合。应当注意,为了清楚的目的,附图和说明中省略了与本技术无关的、本领域普通技术人员已知的部件或处理的表示和描述。
19.本技术中的“样品”包括食品、燃油、水体等任何适宜的样品。
20.本技术中的“食品”包括乳制品、超高温灭菌食品、植物蛋白饮料、婴幼儿灌装辅助食品及罐头类食品、饮料、牛奶、纯奶、巧克力奶、乳饮料、豆奶、炼乳、果泥和肉泥等。
21.本技术的试剂盒包括atp降解酶、atp降解缓冲液和/或微生物细胞裂解剂;可选的,所述试剂盒还包括植物体细胞atp提取剂;可选的,所述试剂盒还包括发光反应试剂和发光反应缓冲液。
22.本技术中的atp降解剂包括atp降解酶和atp降解缓冲液。其中,atp降解酶包括三磷酸腺苷双磷酸酶和/或腺苷磷酸脱氨酶。atp降解缓冲液包括zn
2
离子,例如包括znso4、琥珀酸和氢氧化钠。
23.本技术中的细胞裂解剂包括三甲基甘氨酸,例如包括十八烷基三甲基氯化铵、三甲基甘氨酸和edta。
24.本技术的脂肪醇聚氧乙烯聚二甘油醚可由如下步骤制成:
25.在四口烧瓶中加入脂肪醇聚氧乙烯醚(aeo7)和三氟化硼乙醚络合物(占aeo摩尔量的1%),升温至58℃后,缓慢滴加一定量的环氧氯丙烷(aeo7与环氧氯丙烷的摩尔比例为1:1.2),滴加完成后继续反应3h。减压除去过量的环氧氯丙烷,然后加入质量分数为40%的
氢氧化钠溶液(aeo7与naoh的摩尔比例为1:1.2),然后恒温闭环反应4.5h,反应结束后减压除水,过滤即得脂肪醇聚氧乙烯缩水甘油醚中间体。
26.在四口烧瓶中加入甘油、脂肪醇聚氧乙烯缩水甘油醚和质量分数10%的氢氧化钠乙醇溶液,升温至58℃,减压除去乙醇和水,然后充入氮气,并升温至150℃反应3.5h,然后用乙醇洗涤、过滤、干燥,即得脂肪醇聚氧乙烯系列聚二甘油醚。其中,脂肪醇聚氧乙烯聚二甘油醚氧乙烯基的数量可为3-9(如7)。
27.本技术得植物体细胞atp提取剂可由如下步骤制备而成:
28.称量1.8-2.2g脂肪醇聚氧乙烯聚二甘油醚(n=7),加入800ml无atp水中,溶解后定容至1l。每瓶4.5ml。
29.本技术的atp降解剂可由如下步骤制备而成:
30.atp降解酶制备:称量三磷酸腺苷双磷酸酶(即腺苷三磷酸双磷酸酶)和腺苷磷酸脱氨酶(即腺苷酸脱氨酶)水解脱氨生成次黄嘌呤核苷-5
′
-磷酸(次黄核苷酸)反应的酶粉末,使每瓶中三磷酸腺苷双磷酸酶和腺苷磷酸脱氨酶活性分别为58-62u和28-32u。
31.atp降解缓冲液制备:称量1.1-1.2mg znso4·
7h2o、8.500-8.742g琥珀酸、0.120-0.134g氢氧化钠,用800ml无atp水溶解,混匀后定容至1l,每瓶15ml。
32.使用时将1瓶atp降解缓冲液与1瓶atp降解酶混匀,称为atp降解剂。
33.本技术的微生物细胞裂解剂可由如下步骤制备而成:
34.称量495-505mg十八烷基三甲基氯化铵、3.50-4.50g三甲基甘氨酸、0.142-0.150mg edta,加入800ml无atp水中,溶解后定容至1l。每瓶23.75ml。
35.本技术的发光反应试剂可由如下步骤制备而成:
36.称量248-252μg荧光素酶、1.810-1.818μg d-荧光素钠装入瓶中。
37.本技术的发光反应缓冲液可由如下步骤制备而成:
38.称量610-620μg七水硫酸镁、97.69-107.69mg海藻糖、120-130mg二硫苏糖醇和140-160mg牛血清白蛋白,加入800ml无atp水中,混匀,用10%的氢氧化钠将ph调至7.8,并定容至1l。每瓶23.75ml。
39.使用时将1瓶发光反应缓冲液与1瓶发光反应试剂混匀,称为发光反应溶液。
40.本技术方法的主要步骤包括:样品制备(可选的,如保温培养或孵育);用植物细胞提取剂提取植物细胞atp(若为植物源性食品,否则无需该步骤);通过atp降解剂降解游离atp和/或植物体细胞atp;用微生物细胞裂解剂裂解微生物活细胞以释放出微生物活细胞内的atp;在荧光素酶的存在下,使atp可与荧光素快速反应并发光;通过检测仪捕获atp发光反应的发光信号并反馈结果。
41.具体而言,本技术的微生物污染(程度)的检测方法或atp含量测定方法,例如包括如下步骤:
42.1)样品制备
43.植物蛋白饮料
44.a)将样品在36℃保温48小时。
45.b)吸取30μl植物体细胞atp提取剂到试管中。
46.c)取出培养箱中的样品,充分摇晃使样品混合均匀。
47.d)小心打开包装,吸取1ml样品到对应的含植物体细胞atp提取剂的试管中,盖紧
离心管帽。
48.e)涡旋10次,使试剂与样品充分混匀。
49.f)将试管置于室温下静置15分钟,取50μl用于检测。
50.乳制品、饮料等
51.将样品在36℃保温48小时,取50μl用于检测。
52.婴幼儿灌装辅助食品及罐头类食品
53.a)在无菌环境下,取样品25g(ml)至225ml tsb液体培养基中,混匀,培养24h;
54.b)取培养后的培养液25ml,转移到225ml tsb液体培养基中,混匀,培养48h;
55.c)取50μl培养后样品,上机检测。
56.2)测定步骤
57.a)移取50μl样品至微孔板微孔中,将微孔板置于板架上。
58.b)在仪器软件页面,输入第一个样品孔的位置和样品数量,然后点击“start”。
59.c)检测仪自动进行以下操作:
60.i.在每个微孔中添加50μl atp降解剂,孵育10分钟。
61.ii.在第一个待测微孔中添加95μl微生物细胞裂解剂,反应7秒钟。
62.iii.再向第一个待测微孔中添加95μl发光反应溶液。1秒后用检测仪检测光信号,单位为rlu(相对发光单位)。
63.3)结果判定
64.rlu值小于150时,结果为阴性,表明无微生物污染。
65.rlu值为151-300时,结果为疑似阳性,表明可能存在微生物污染,需重新取5个样品进行检测,若5个样品中有3个或3个以上样品的检测结果仍为150-300,或者1个及1个以上样品的结果大于300,则报告为无微生物污染。
66.rlu值大于300,结果为阳性,表明存在微生物污染。
67.本技术用于检测微生物污染的检测仪包括流体系统、光电系统、微孔板承载系统和软件系统等。流体系统由分液系统和注射系统组成,并采用了反向泵,可将使用后管线中的试剂泵回试剂瓶中,节约试剂;光电系统由高灵敏的光电倍增管和信号收集器组成,与光电二极管相比,灵敏度更高,同时采用百叶窗设计,便于用户自行维护。
68.本技术另外提供一种植物体细胞atp提取剂,包括脂肪醇聚氧乙烯聚二甘油醚。
69.在一种实施方式中,脂肪醇聚氧乙烯聚二甘油醚的浓度为0.2%。
70.在一种实施方式中,脂肪醇聚氧乙烯聚二甘油醚的氧乙烯基的数量为3-9。
71.本技术进一步提供一种试剂盒,其特征在于,所述试剂盒包括上述的atp提取剂。
72.在一种实施方式中,试剂盒还包括atp降解酶、atp降解缓冲液和/或微生物细胞裂解剂。
73.在一种实施方式中,试剂盒还包括发光反应试剂和/或发光反应缓冲液。
74.本技术还提供上述atp提取剂或试剂盒在提取植物细胞atp中的用途。
75.本技术还提供上述atp提取剂或试剂盒在检测微生物污染中的应用。
76.本技术还提供了一种鉴定样品中微生物污染程度的方法,其特征在于,使用上述的atp提取剂或试剂盒进行鉴定。
77.本技术另外提供一种微生物细胞裂解剂,包括三甲基甘氨酸。
78.在一些实施方式中,裂解剂进一步包括十八烷基三甲基氯化铵和edta。
79.在一些实施方式中,裂解剂的制备方法为:称量495-505mg十八烷基三甲基氯化铵、3.5-4.5g三甲基甘氨酸、0.142-0.150mg edta,加入800ml无atp水中,溶解后定容至1l。
80.本技术还提供一种试剂盒,其特征在于,所述试剂盒包括上述的微生物细胞裂解剂。
81.在一些实施方式中,试剂盒还包括atp降解酶、atp降解缓冲液和/或植物细胞atp提取剂。
82.在一些实施方式中,试剂盒还包括发光反应试剂和/或发光反应缓冲液。
83.上述的裂解剂、或上述的试剂盒在裂解微生物细胞中的用途。
84.上述的裂解剂、或上述的试剂盒在检测微生物污染中的应用。
85.本技术还提供一种鉴定样品中微生物污染程度的方法,使用上述的裂解剂或上述的试剂盒。
86.本技术还提供一种检测样品中atp含量的方法,其特征在于,使用上述的裂解剂或上述的试剂盒。
87.本技术另外提供一种atp降解缓冲液,包括zn
2
离子。
88.在一种实施方式中,atp降解缓冲液包括znso4、琥珀酸和氢氧化钠。
89.本技术还提供一种atp降解剂,包括上述的缓冲液以及atp降解酶。
90.在一种实施方式中,atp降解酶包括三磷酸腺苷双磷酸酶和/或腺苷磷酸脱氨酶。
91.本技术还提供一种试剂盒,包括上述的atp降解缓冲液。
92.在一种实施方式中,试剂盒进一步包括atp降解酶、植物细胞atp提取剂和/或微生物细胞裂解剂。
93.在一种实施方式中,试剂盒还包括发光反应试剂和/或发光反应缓冲液。
94.上述的atp降解缓冲液、或上述的atp降解剂、或上述的试剂盒在降解atp中的用途。
95.上述的atp降解缓冲液、或上述的atp降解剂、或上述的试剂盒在检测微生物污染中的应用。
96.本技术还提供一种鉴定样品中微生物污染程度的方法,其特征在于,使用上述的atp降解缓冲液、或上述的atp降解剂、或上述的试剂盒。
97.实验例1发光反应缓冲液中mg
2
、海藻糖、bsa和二硫苏糖醇的含量。
98.制备mg
2
、海藻糖、bsa和二硫苏糖醇的水溶液,ph为7.8,作为发光反应缓冲液。采用正交试验确定各成分的最佳含量。将1瓶发光反应缓冲液与1瓶发光反应试剂混合,获得发光反应溶液。用无atp水配置10-3
m的atp溶液,用uht纯奶稀释至10-7
m。取50μl 10-7
m的uht奶溶液,加入95μl发光反应溶液,用检测仪测定发光强度(相对发光单位rlu),每次测定做3个平行,结果取平均值。
99.表1正交实验结果l9
3,4
[0100][0101]
由表1可见,极差结果显示,4种试剂的含量对检测结果的影响为mg
2
>海藻糖>二硫苏糖醇>bsa,mg
2
、海藻糖、二硫苏糖醇和bsa的最佳含量分别为2.5μmol(615.92μg mgso4·
7h2o)、0.3mmol(102.69mg)、125mg和150mg。
[0102]
实验例2样品的孵育时间
[0103]
选择uht纯奶、uht巧克力奶、乳饮料、豆奶、炼乳、果泥和肉泥,将蜡样芽孢杆菌atcc#11778、枯草芽孢杆菌atcc#6051、荧光假单胞菌atcc#13525、大肠埃希氏菌atcc#25922、李斯特菌atcc#33090、鼠伤寒沙门氏菌atcc#14028,金黄色葡萄球菌atcc#6538、米曲霉atcc#1010,酿酒酵母atcc#4098分别加入不同类型样品中,获得浓度为1cfu/包的样品。分别孵育24h、36h、48h、60h和72h后,采用本技术方法进行检测,每个样品做10平行。检测结果见表2-表8。
[0104]
表2uht纯奶检测结果
[0105][0106]
表3uht巧克力奶检测结果
[0107][0108]
表4乳饮料检测结果
[0109][0110]
表5豆奶检测结果
[0111][0112]
表6炼乳检测结果
[0113]
[0114][0115]
表7果泥检测结果
[0116][0117]
表8肉泥检测结果
[0118][0119]
[0120]
由表2-表8可见,孵育时间为24h时,所有检测结果均为阴性,当孵育时间为36h时,部分检测结果为阳性,当孵育时间为48h、60h和72h时,所有检测结果均为阳性。因此,选择48h为最佳孵育时间。
[0121]
实验例3光电倍增管与二极管灵敏度对比。
[0122]
分别采用本技术检测仪和普通光电二极管制成的检测仪来检测uht纯奶、乳饮料、豆奶、炼乳、果泥和肉泥的加标样品,加标菌种为鼠伤寒沙门氏菌、大肠杆菌、蜡样芽孢杆菌、枯草芽孢杆菌、米曲霉和酿酒酵母,加标浓度为1cfu/包,每个样品做10个平行,检测结果见表9。
[0123]
表9光电倍增管与二极管灵敏度对比
[0124][0125][0126]
由表9可见,采用本方法检测uht纯奶、乳饮料、豆奶、炼乳、果泥和肉泥的1cfu加标样品,阳性率均为100%,而光电二极管的阳性率为0-8.33%,因此采用光电倍增管的检测仪的灵敏度明显高于采用二极管的检测仪。
[0127]
实验例4本技术检测方法或检测仪的灵敏度评价
[0128]
选择uht纯奶、uht巧克力奶、乳饮料、豆奶、炼乳、果泥和肉泥,将蜡样芽孢杆菌atcc#11778、枯草芽孢杆菌atcc#6051、荧光假单胞菌atcc#13525、大肠埃希氏菌atcc#25922、李斯特菌atcc#33090、鼠伤寒沙门氏菌atcc#14028,金黄色葡萄球菌atcc#6538、米曲霉atcc#1010,酿酒酵母atcc#4098分别加入不同类型样品中,获得浓度为1cfu/包的样品。采用本技术所述方法进行检测,每个样品做3平行。检测结果见表10-表18。
[0129]
表10蜡样芽孢杆菌atcc#11778
[0130]
样品初始cfu/包48小时rlu平均值结果uht纯奶127676阳性uht巧克力奶125362阳性乳饮料128829阳性豆奶179637阳性炼乳111107阳性果泥112409阳性肉泥125362阳性
[0131]
表11枯草芽孢杆菌atcc#6051
[0132][0133][0134]
表12荧光假单胞菌atcc#13525
[0135][0136]
表13大肠杆菌atcc#11775
[0137][0138]
表14李斯特菌atcc#33090
[0139][0140][0141]
表15鼠伤寒沙门氏菌atcc#14028
[0142]
样品初始cfu/包48小时rlu平均值结果uht纯奶11630阳性uht巧克力奶11871阳性乳饮料12098阳性豆奶1664阳性炼乳11386阳性果泥1651阳性
[0143]
表16金黄色葡萄球菌atcc#6538
[0144][0145]
表17米曲霉atcc#1010
[0146]
样品初始cfu/包48小时rlu平均值结果uht纯奶1567阳性uht巧克力奶11381阳性乳饮料11533阳性豆奶1547阳性炼乳11786阳性果泥1318阳性
[0147]
表18酿酒酵母atcc#4098
[0148][0149]
由表10-表18可以看出,对于蜡样芽孢杆菌atcc#11778、枯草芽孢杆菌atcc#6051、荧光假单胞菌atcc#13525、大肠埃希氏菌atcc#25922、李斯特菌atcc#33090、鼠伤寒沙门氏菌atcc#14028,金黄色葡萄球菌atcc#6538、米曲霉atcc#1010,酿酒酵母atcc#4098加标浓度均为1cfu/包的uht纯奶、uht谷物早餐奶、uht巧克力奶、乳饮料、豆奶和炼乳,检测结果均为阳性,由此看出本技术所述方法对上述样品的检测灵敏度均为1cfu/包。
[0150]
实验例5本技术检测方法或检测仪的准确度评价
[0151]
选择uht纯奶、uht巧克力奶、乳饮料、豆奶、炼乳、果泥和肉泥,将蜡样芽孢杆菌atcc#11778、枯草芽孢杆菌atcc#6051、荧光假单胞菌atcc#13525、大肠埃希氏菌atcc#25922、李斯特菌atcc#33090、鼠伤寒沙门氏菌atcc#14028、金黄色葡萄球菌atcc#6538、米曲霉atcc#1010,酿酒酵母atcc#4098,铜绿假单胞菌atcc#27853分别加入每种样品中,获得浓度为5cfu/包的样品。
[0152]
分别采用本技术所述方法和微生物培养法检测所有加标样品以及每种产品的阴
性对照(未加标),每个样品做3个平行,检测结果见表19-表26。
[0153]
表19阴性产品(未加标)
[0154][0155]
表20uht纯奶
[0156][0157]
表21uht巧克力奶
[0158]
[0159][0160]
表22豆奶
[0161][0162]
表23乳饮料
[0163][0164]
表24炼乳
[0165]
[0166][0167]
表25果泥
[0168][0169]
表26肉泥
[0170][0171]
[0172]
由表26可以看出,采用本技术所述方法检测所有阴性样品,结果均为阴性。
[0173]
由表19-表26可以看出,所有加标样品经本技术所述方法检测检测结果均大于300,为阳性;所有样品培养后检测结果也均为阳性。由此可见,本技术所述方法的检测结果与微生物培养法一致。
[0174]
实验例6本技术检测方法或检测仪的精密度评价。
[0175]
将uht灭菌乳用蜡样芽孢杆菌atcc#11778加标,获得浓度为1cfu/包的样品,采用本技术所述方法进行检测,做96次重复。结果见表27。
[0176]
表27浓度为1cfu/包的灭菌乳检测结果
[0177][0178]
由表27可以看出,96个测试间的变异系数为3.3%,小于10%。
[0179]
分别准备经标准方法确认无菌的灭菌乳、谷物早餐奶、豆奶、乳饮料、炼乳各50份样品,其中25份样品作为阴性对照,另外25份样品加入大肠埃希氏菌atcc#25922,使其浓度为1cfu/包。
[0180]
分别在3家实验室按照本方法进行验证,对于每类样品,各实验室均选择同一品牌和同一规格,各实验室测定结果见表28。
[0181]
表28不同实验室间独立验证的结果
[0182][0183]
由表28可以看出,3家实验室的检测结果相同,不存在显著差异。
[0184]
综上,本技术通过改良的方案检测样品中atp的含量,判断其被微生物的污染程度,对各类样品均普遍适用,且结果准确、精密度高、灵敏度高。
[0185]
最后应说明的是:以上各实施例仅用以说明本技术的技术方案,而非对其限制;尽管参照前述各实施例对本技术进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本技术各实施例技术方案的范围,其均应涵盖在本技术的权利要求和说明书的范围当中。本技术并不局限于文中公开的特定实施例,而是包括落入权利要求的范围内的所有技术方案。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。