1.本发明涉及菌群冻存保护液的领域,特别涉及一种适用于人体肠道菌群的冻存保护液。
背景技术:
2.粪便微生物群移植(fmt)是一种微生物群替代疗法,通过将健康供体的粪便移植到患者体内,是一种古老的治疗方法。越来越多的案例也证明了fmt对艰难梭菌感染(cdi)有着高有效性,近年来对fmt用于治疗肠道微生物相关的各种疾病的潜力进行了广泛研究,肠道中含有大量的微生物,这些关键的微生物角色被认为与人体的健康和疾病发挥着重要的作用,是通过从健康共生状态到生态失调的转变来触发炎症反应。进而,菌群失调可能诱发许多复杂疾病,如ⅱ型糖尿病、类风湿性关节炎、过敏、炎症性肠病、牙周炎甚至极端肥胖。
3.目前常用25%甘油冷冻保存菌悬液,被广泛应用于fmt实践,甘油为保护剂,低温冷冻条件下,使微生物的新陈代谢趋于停止,从而达到长期有效的保藏。迄今为止,在许多研究中,25%甘油保存的冷冻粪便经常用于fmt治疗。
4.专利申请201980018083.8公开了一种粪便微生物群均质混合物的方法。如此获得的粪便微生物群均质混合物具有细菌多样性和提高的生存力。所述粪便微生物群均质混合物可以用于治疗肠道生态失调和用于治疗与此类生态失调相关的病理学状况。该申请中提到采用多元醇或者二糖、三糖或多糖,或者其混合物作为冷冻保护剂。同时,还可以选用甘油、甘露醇、山梨醇、丙二醇、乙二醇、海藻糖及类似物、蔗糖、半乳糖-乳糖以及其混合物。
5.然而,在fmt的过程中,服用甘油冻存保的菌悬液有可能带来一些副作用,例如恶心,呕吐、腹泻等症状,为了解决这一问题,急需要对fmt的菌悬液保护液进行优化。
技术实现要素:
6.为解决上述问题,本发明的首要目的是提供一种适用于人体肠道菌群的冻存保护液,该保护液能够提高细菌保存的活性,避免带来副作用。
7.为实现上述目的,本发明采用的技术方案是:
8.一种适用于人体肠道菌群的冻存保护液,该保护液主要包含有菊粉、山梨糖醇、蔗糖、酵母提取物及nacl,其中各个组分的用量为:菊粉3%-10%,山梨糖醇3%-10%,蔗糖2%-4%,酵母提取物0.1%-0.5%,余量为浓度为0.9%的nacl;按照配比配置保护液,混合均匀即可。
9.进一步,所述保护液主要成份为:5-10%菊粉、3%-5%山梨糖醇、2%-4%蔗糖、0.1%-0.5%酵母提取物,80.5.%-89.9%的0.9%nacl,按照配比配置保护液,混合均匀即可。
10.进一步,所述保护液主要成份为:5-10%山梨糖醇、3%-5%菊粉、2%-4%蔗糖和0.1%-0.5%酵母提取物,80.5.%-89.9%的0.9%nacl,按照配比配置保护液,混合均匀即
可。
11.申请人在经过深入的研究工作之后,发现菊粉和山梨糖醇在酵母提取物的作用下,能够形成fmt微生物群所适合的保存环境,适用于fmt微生物群的静态保存,由此,能够提高fmt微生物群的保存活性,避免对菌群的不良影响。
12.活性的高低往往是fmt疗效的关键,甘油作为传统的冷冻保藏添加剂,能够减缓损伤细菌的各种生理活动、形态特征和基因组,保持细菌的活性,但是的摄入过多甘油会有可能导致腹泻,头晕等问题,测试了不同保护剂对混合供体粪菌保护的影响,以此冻存保护液的替代品来替代甘油,效果最好,足够数量的菌量才能发挥fmt的作用,所以也是衡量fmt的标准,本技术所设计的保护液在菌量上无显著差异,无论是在单位菌量上还是存活率均高于甘油组,由此证明,本发明采用的保护液,存活率效果显著提高。
附图说明
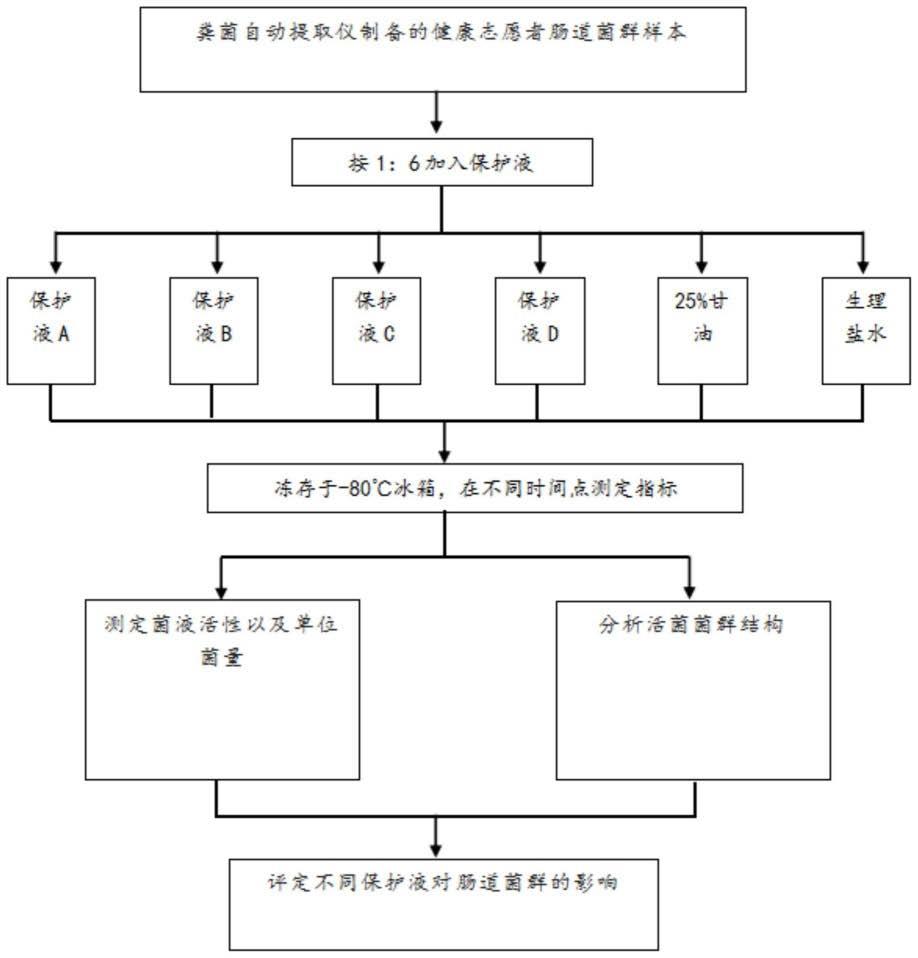
13.图1为本发明的试验过程示意图。
14.图2为360天内存活率的变化示意图。
15.图3为360天内单位菌量的变化示意图。
16.图4为不同保护液7天肠道菌群活菌丰度图。
17.图5为不同保护液14天肠道菌群活菌丰度图。
18.图6为不同保护液30天肠道菌群活菌丰度图。
19.图7为不同保护液60天肠道菌群活菌丰度图。
20.图8为不同保护液90天肠道菌群活菌丰度图。
21.图9为不同保护液120天肠道菌群活菌丰度图。
22.图10为不同保护液180天肠道菌群活菌丰度图。
23.图11为不同保护液300天肠道菌群活菌丰度图。
24.图12为不同保护液360天肠道菌群活菌丰度图。
25.图13不同保护液7天肠道菌群活菌组成结构图。
26.图14不同保护液14天肠道菌群活菌组成结构图。
27.图15不同保护液30天肠道菌群活菌组成结构图。
28.图16不同保护液60天肠道菌群活菌组成结构图。
29.图17不同保护液90天肠道菌群活菌组成结构图。
30.图18不同保护液120天肠道菌群活菌组成结构图。
31.图19不同保护液180天肠道菌群活菌组成结构图。
32.图20不同保护液300天肠道菌群活菌组成结构图。
33.图21不同保护液360天肠道菌群活菌组成结构图。
34.图22为7天存活率的变化示意图。
35.图23为7天单位菌量的变化示意图。
36.图24为14天存活率的变化示意图。
37.图25为14天单位菌量的变化示意图。
38.图26为30天存活率的变化示意图。
39.图27为30天单位菌量的变化示意图。
40.图28为103供体7、14和30天肠道菌群活菌丰度图。
41.图29为104供体7、14和30天肠道菌群活菌丰度图。
42.图30为123供体7、14和30天肠道菌群活菌丰度图。
43.图31为103供体7、14和30天肠道菌群活菌组成结构图。
44.图32为104供体7、14和30天肠道菌群活菌组成结构图。
45.图33为123供体7、14和30天肠道菌群活菌组成结构图。
具体实施方式
46.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
47.本发明所实现的适用于人体肠道菌群的冻存保护液,该保护液主要包含有菊粉、山梨糖醇、蔗糖、酵母提取物及nacl,其中各个组分的用量为:菊粉3%-10%,山梨糖醇3%-10%,蔗糖2%-4%,酵母提取物0.1%-0.5%,余量为浓度为0.9%的nacl;按照配比配置保护液,混合均匀即可。
48.图1所示,为本发明的试验方法示意图。依据此方法进行下列实验。
49.一、试验一:三位志愿者肠道菌群混合样本的冻存保护。
50.1.试验材料
51.1.1试验仪器:水浴锅、制冰机、-80℃冰箱、涡旋振荡仪、离心机、磁力搅拌器、灭菌锅。
52.1.2试验试剂:qiaamp fast dna stool mini kit(50);live/deadtm baclighttmbacterial viability kit死活荧光染料、pma(叠氮溴化丙锭)染料、生理盐水、甘油。
53.1.3试验材料:三位健康志愿者的新鲜粪便样本、a、b、c和d保护液。
54.2.试验方法:
55.2.1冻存保护液配制
56.根据前期调研,我们制备了4种不同配方的保护液:
57.a保护液主要成份为:5.0%-10.0%葡萄糖、3.0%-5.0%海藻糖、0.1%-0.5%谷氨酸钠、2.0%-4.0%菊粉,80.5.%-89.9%的0.9%nacl溶液,按照配比配置保护液,将其混合均匀;
58.b保护液(本发明的实施一)主要成份为:5-10%菊粉、3%-5%山梨糖醇、2%-4%蔗糖、0.1%-0.5%酵母提取物,80.5.%-89.9%的0.9%nacl溶液,按照配比配置保护液,将其混合均匀;
59.c保护液主要成份为:5-10%海藻糖、3%-5%葡萄糖、0.1%-1%谷氨酸钠、2%-4%山梨糖醇,80.5.%-89.9%的0.9%nacl溶液,按照配比配置保护液,将其混合均匀;
60.d保护液(本发明的实施二)主要成份为:5-10%山梨糖醇、3%-5%菊粉、2%-4%蔗糖和0.1%-0.5%酵母提取物,80.5.%-89.9%的0.9%nacl溶液,按照配比配置保护液,将其混合均匀;
61.甘油组主要成份为:25%甘油、75%的纯化水,按照配比配置甘油保护液,将其混
合均匀;
62.生理盐水组主要成份为:0.9%nacl(生理盐水)。
63.所有保护液按比例配置好放入锥形瓶中,置于高压灭菌锅121℃,20分钟,高压灭菌。
64.2.2收集供体菌体
65.分别收集三个健康志愿者的新鲜粪便各100-200g,溶解于750-1000ml的生理盐水中,经粪便自动提取仪处理去除残渣,得到600-850ml菌悬液,将供体菌悬液放入磁力搅拌器中混匀,各取500ml,将三个供体的菌悬液按1:1:1的比例倒入烧杯,再用磁力搅拌器混匀,分装入50ml离心管,每管40ml,共18管,离心管提前称重,放入离心机进行离心收集菌体得到肠道菌群,离心力为5000g,时间7分钟,倒出上清液,肠道菌群由于重力作用将沉淀在管底,收集菌泥,菌泥重量为3-4.5g。
66.2.3试验分组
67.将步骤2.2收集好的菌泥按照1:6加入步骤2.1配比好的保护液,分别加入a、b、c、d、25%甘油和生理盐水分为六个组,使用涡旋振荡仪振荡重悬,将混匀后的菌液倒入烧杯,使用磁力搅拌仪混匀,边混匀边将配比好的菌液加入至2ml离心管,每管1.6ml,每个保护液收集30-40管,放入冻存盒到-80℃冰箱保存。
68.2.4测试时间
69.取2.3配制好的生理盐水组作为初始样本,取初始、7天、14天、30天、60天、90天、120天、180天、300天和360天测试不同保护液冻存的存活率、单位菌量和pma处理及dna提取,每组三个重复。
70.2.5.活菌检测
71.2.5.1解冻
72.每次测量存活率和单位菌量时,先将装有保护液的2ml离心管从-80℃冰箱取出,放置37℃水浴锅解冻5分钟(初始样本除外)
73.2.5.2流式细胞仪检测
74.将步骤2.5.1解冻后梯度稀释100倍,具体步骤:将步骤2.5.1解冻后的菌液取100μl至2ml的灭菌离心管,与900μl的0.9nacl混匀,得到粪菌稀释液a;再将粪菌稀释液a取100μl,至新的2ml灭菌离心管与900μl的0.9nacl混匀,得到粪菌稀释液b。
75.按照live/deadtmbaclighttmbacterial viability kit对稀释后的菌泥进行染色,具体步骤为:向2ml灭菌管中加入987μl的0.9nacl,1.5μl的syt09和1.5μl的pi染料,最后加入10μl粪菌稀释液b,混匀并于黑暗条件下孵化15min。暗反应后,采用bd accuri c6流式细胞仪,设置参数,分析菌泥的活菌率和单位菌数。
76.2.6pma处理及dna提取
77.用pma染料对步骤2.5.2后的样本进行处理,吸取500μl样本到1.5ml的无菌透明离心管中,加入pma母液至体系的终浓度为100μm,充分混匀制备pma-菌悬液,室温避光孵育30min,然后将样品置于冰上,500w的卤素灯20cm处光照20min,4℃,5000r/min条件下离心3-5min,使用qiaamp fast dna stool mini kit(qiagen)试剂盒提取dna样本。用分光光度计进行dna检测,合格后基于16s rrna v3-v4区段进行pcr文库构建,通过illumina hiseq2500仪器进行高通量测序,借助生信分析平台对测序数据通过usearch进行otu聚类
分析,以获得不同时间下不同保护液的菌群丰度和组成信息。
78.2.7数据分析
79.试验数据均采用spss 22.0univariate方法单因素分析,对f检验达到显著水平的因子进行方差分析并进行duncan氏组间多重比较,各组试验数据均以(平均值
±
标准差)表示。统计显著性水平为p<0.05,极显著性水平为p<0.01。
80.3.结果分析
81.3.1不同保护液对存活率和单位菌量的影响,如图2、图3所示。
82.由上图可知,图2、图3显示测试了360天内存活率和单位菌量的变化,从存活率上来看,b、d保护液存活率效果显著高于保护液a、c、甘油和生理盐水组(p<0.05),保护液d第360天存活率有82.71%,高于其余各组(p<0.05),保护液b存活率为77.64%和保护液d存活率存在显著差异(p<0.05);保护液c存活率为66.76%,甘油组存活率为68.18%,两者无显著差异(p>0.05)。
83.从单位菌量上来看,保护液a、b、c、d和甘油组无显著差异(p<0.05),保护液a、b、c和d单位菌量都高于生理盐水组(p<0.05),但与甘油组无显著差异(p>0.05)。
84.3.2不同保护液对菌群结构的影响,
85.如图4-21所示,图4-12为不同保护液7、14、30、60、90、120、180、300和360天肠道菌群活菌丰度图,图13-21为不同保护液7、14、30、60、90、120、180、300和360天肠道菌群活菌组成结构图,其中,da为保护液a组、db为保护液b组、dc为保护液c组、dd为保护液d组、de为25%甘油组、df为生理盐水组。
86.由上述图可知,显示测定了活菌的菌群丰度和主成分分析,从丰度上来看,肠道菌群活菌主要还是以prevotella、bacteroides、alloprevotella、peptostreptococcaceae和phascolarctobacterium属为主,不同保护液bacteroides属都随着时间的增加相对丰度在慢慢减少,但生理盐水组bacteroides属到第360天相对丰度依旧高于其余各组;prevotella属无论是在任何时间下相对丰度都是最高的,但是随着时间的推移,相对丰度在慢慢降低,甘油组prevotella属随着时间的变化,同时间段的相对丰度还是高于其余各组;保护液a、b、c和d的相对丰度较为相似,保护液b在的相对丰度上会更接近甘油组。
87.从活菌的pca图看,保护液a、b、c和d的结构更相似,菌群差异较小,而生理盐水组与其余各组菌群结构相似度较低,保护液b的菌群结构最接近与甘油组。
88.二、试验二:单个志愿者肠道菌群样本冻存保护。
89.前期试验通过将三个志愿者肠道菌群样本混合,分别测试了a、b、c、d保护液的冻存保护效果,试验得出b和d保护液效果相较于保护液a和c保护效果更好。但是在目前的生产制备中,一般是采用单供体制备菌液,为了验证前期结果,也探究b、d保护液对单个志愿者肠道菌群冻存的影响,在本次试验中供体的菌液不混合,三个志愿者编号为103、104和123,每个志愿者的肠道菌群样本只加入加入保护液b和d、25%甘油和生理盐水,进行验证。
90.1.试验材料
91.1.1试验仪器:同试验一。
92.1.2试验试剂:同试验一。
93.1.3试验材料:三个志愿者肠道菌群液,分别收集自三个健康志愿者(103、104和123)、b和d保护液。
94.2.试验方法:
95.2.1冻存保护液配制
96.b、d、甘油和生理盐水组配置同试验一。
97.2.2收集供体菌体
98.分别收集三个健康志愿者的新鲜粪便各100-200g,溶解于750-1000ml的生理盐水中,经粪便自动提取仪处理去除残渣,得到600-850ml菌悬液,将供体菌悬液放入磁力搅拌器中混匀,取500ml,分装入50ml离心管,每管40ml,每个供体收集6管,共18管,离心管提前称重,放入离心机进行离心收集菌体得到肠道菌群,离心力为5000g,时间7分钟,倒出上清液,肠道菌群由于重力作用将沉淀在管底,收集菌泥,菌泥重量为3-4.5g,三个志愿者的菌泥分别标记为103/104/123。
99.2.3试验分组
100.将步骤2.2收集好的菌泥按照1:6加入步骤2.1配比好的保护液,分别加入b、d、25%甘油和生理盐水分为四个组,使用涡旋振荡仪振荡重悬,将混匀后的菌液倒入烧杯,使用磁力搅拌仪混匀,边混匀边将配比好的菌液加入至2ml离心管,每管1.6ml,每个保护液收集30-40管,放入冻存盒到-80℃冰箱保存。
101.2.4测试时间
102.取2.3配制好的生理盐水组作为初始样本,取初始、7天、14天和30天测试不同保护液冻存的存活率、单位菌量和pma处理及dna提取,每组三个重复。
103.2.5活菌检测
104.2.5.1解冻
105.同试验一。
106.2.5.2流式细胞仪检测
107.同试验一。
108.2.6pma处理及dna提取
109.同试验一。
110.2.7数据分析
111.同试验一。
112.3.结果分析
113.3.1不同保护液对存活率和单位菌量的影响
114.如图22-27所示,图22、24、26为7天、14天和30天存活率的变化示意图,图23、25、27则为7天、14天和30天单位菌量的变化示意图。
115.由图得知,测试了初始、7天、14天和30天的存活率和单位菌量的变化,并且对比了第30天不同保护液对菌液存活率和单位菌量的显著差异,从存活率上看,各个组在第7天有明显的下降趋势,但是在7天后趋于平稳,在103志愿者中,b保护液30天存活率为72.17%,d保护液为67.83%,两者差异显著,b保护液存活率高于d保护液存活率4.34%(p<0.05),在123志愿者中,b保护液30天存活率为77.37%,d保护液存活率为73.21%,高于d保护液存活率4.16%,两者差异显著(p<0.05),而在104志愿者中,b和d保护液对存活率无显著差异(p>0.05)。无论在任何供体,b和d保护液在存活率上均高于甘油组(p<0.05)。
116.从单位菌量上看,b和d保护液对菌量的影响均无显著差异(p>0.05),甘油组对菌
量的保护效果与b、d保护液也无显著差异(p>0.05)。
117.3.2不同保护剂对菌群结构的影响
118.如图28-33所示,其中,图28-30为103、104和123供体7、14和30天肠道菌群活菌丰度图,图31-33为103、104和123供体7、14和30天肠道菌群活菌组成结构图。
119.由上图可知,从丰度上我们可以看出,与其它菌属相比,三个供体活菌基本以bacteroides属为主,相对丰度占据较高,103供体主要活菌为bacteroides、parabacteroides、romboutsia、roseburia和escherichia-shigella属,104供体主要活菌为bacteroides、romboutsia、roseburia、prevotellaceae和faecalibacterium属,123供体主要活菌为bacteroides、prevotella、parabacteroides、phascolarctobacterium和butyricimonas属,其中103志愿者b、d和甘油组在第7和14天相对丰度相差不大,而生理盐水组与其它组相比roseburia、escherichia-shigella和blautia属相对丰度升高;在第30天d保护液相对于b保护液roseburia属相对丰度升高,其余丰度相似,而生理盐水组与甘油组在第30天相对丰度相似。104供体中,d保护液在任何时间段faecalibacterium属相较于其余各组相对丰度升高,生理盐水组prevotellaceae属相对丰度在任何时间段高于其余各组。在123志愿者中,生理盐水组phascolarctobacterium属相对于其余各组在任何时间段都是相对较少的,而甘油组parabacteroides属相对于其余各组在任何时间段都是相对较多的。
120.根据pca图看,在第7天和14天,各组菌群结构都较为相似,到了30天,d组的菌群结构更接近于初始,b和d组在菌群结构上也相对接近,生理盐水组与各组都相似度较差。
121.以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。