1.本发明涉及高分子合成技术领域,具体涉及一种光敏剂材料、制备方法及其在制备聚合物中的应用。
背景技术:
2.近年来,高分子领域的科研工作者在光催化方面取得了显著进展,这类光催化剂可以利用太阳能制备出具有良好控制性的聚合物,特别是基于可逆失活自由基聚合(rdrp)。到达地球表面的太阳光光谱中有95%是由可见光和近红外(nir)光构成,其中红外光占据了近50%。利用长波长可见光和近红外光的光子进行光调控rdrp可以抑制副反应的发生(如单体的自引发、已经形成的聚合物的降解)。此外,扩大光激发波长范围可以提高光子在大多数反应介质中的穿透力,避免反应物的竞争吸收。
3.细菌叶绿素α(bchlα)、四苯基卟啉(rtpp)、两亲性离子聚甲炔、钙钛矿和上转换纳米颗粒均可作为光催化剂在近红外光的照射下可用来调控rdrp,虽然这些光催化剂已经取得了实质性的进展,但只能催化聚合特定的聚合物单体单元,且在近红外光下聚合的单体转化率比在可见光下聚合的单体转化率要低得多。
4.现有研究中分别基于纳米结构正磷酸银光催化剂和自组装羧基卟啉光催化剂开发了光诱导电子转移可逆加成断裂链转移(pet-raft)聚合体系,在这种聚合体系中,利用近红外辐射可以实现相当多的特定单体的转化,但毒性和光催化剂残留问题阻碍了这类光聚合体系的进一步应用。在此基础上开发了非均相光催化剂,如碳纳米点、吩噻嗪基共轭微孔聚合物、卟啉-金属有机框架及其纳米片,这类光催化剂能够高效且良好的控制聚合,但辐照波长总是局限于可见光区域。因此,开发具有宽频带和近红外吸收性能的多相光催化剂对大规模生产聚合物有很大的推动作用。理想情况下,多相光催化剂应在可见光和近红外范围内具有较高的吸收系数,适当的氧化还原电位可以减少rdrp引发剂的用量、调节可逆失活过程及平衡尺寸来确保多相催化剂的高表面积和可回收性。考虑到多相光催化剂、rdrp引发剂和单体的多样性,到目前为止,有效地设计和优化这些材料依然是一个巨大的挑战。
5.鉴于上述缺陷,本发明创作者经过长时间的研究和实践终于获得了本发明。
技术实现要素:
6.本发明的目的在于解决如何开发在可见光和近红外范围内具有较高的吸收系数的高表面积和可回收性的多相光催化剂,提供了一种光敏剂材料、制备方法及其在制备聚合物中的应用。
7.为了实现上述目的,本发明公开了一种光敏剂材料的制备方法,包括以下步骤:
8.s1:将含苯基的光化学活性单体、二甲氧基苯和三价铁催化剂同时添加到有机溶剂中进行充分搅拌,通过傅克反应,分阶段升温搅拌反应一段时间得到交联骨架;
9.s2:将步骤s1中得到的交联骨架进行研磨,随后用有机溶剂进行冲洗,再用有机溶
剂进行索式提取,得到粉末;
10.s3:将步骤s2中得到的粉末分散到有机溶剂中,添加改性剂进行处理,得到光敏剂材料。
11.所述步骤s1中含苯基的光化学活性单体为三苯基膦、三苯基氧化膦、苯系物(如苝、苯并苝、芴、9-芴醇、9-苯基蒽、9,9'-联蒽)、菲咯啉类(如4,7-二甲基-1,10-菲咯啉、4,7-二甲氧基-1,10-菲咯啉、4,7-二苯基-1,10-菲咯啉、3,4,7,8-四甲基-1,10-菲咯啉、2,9-二甲基-4,7-联苯-1,10-邻二氮杂菲、2,9-二苯基-1,10-菲咯啉)、苯基取代联吡啶类(如5-苯基-2,2'-联吡啶、5-苯基-2,3'-联吡啶、5-苯基-2,4'-联吡啶、6-苯基-2,2'-联吡啶、4,6-二苯基-2,2'-联吡啶、2,6-二苯基-4,4'-联吡啶、4,4'-二苯基-2,2'-联吡啶、4,3':4',4
”‑
三联吡啶、4,2':3',4
”‑
三联吡啶等)或其他卟啉基(四苯基卟啉、四对甲氧苯基卟啉、5,15-二苯基卟啉、5,10,15,20-四(萘-2-基)卟啉、5,10,15,20-四(4-吡啶基)卟啉、5,10,15,20-四(对甲苯基)卟啉、5,10,15,20-四(4-甲氧苯基)卟啉、5,10,15,20-四(2-甲基苯基)卟啉、5,10,15,20-四(3-甲氧基苯基)卟啉等)单体中的任意一种,苯或苯基取代物主要为苯、1,4-二甲氧基苯中的任意一种、三价铁催化剂为无水三氯化铁,有机溶剂为硝基苯。
12.所述步骤s1中升温阶段为先升温至20~100℃反应2~6h,再升温至100~200℃反应18~22h。
13.所述步骤s1中含苯基的光化学活性单体与二甲氧基苯的摩尔比为1:5~60,含苯基的光化学活性单体与三价铁催化剂的摩尔比为1:5~60。
14.所述步骤s2中用来冲洗交联骨架的有机溶剂依次为甲醇、四氢呋喃和丙酮,索式提取使用的有机溶剂依次为甲醇和四氢呋喃。
15.所述步骤s2中索式提取的时间为12~120h,温度为50~100℃。
16.所述步骤s3中有机溶剂为甲醇,改性剂为胺类物质(如二乙烯三胺、三乙烯四胺、多乙烯多胺等)、水合肼、碱金属基无机盐(如硼氢化钠、三乙酰氧基硼氢化钠、氯化钠、氯化镁、氯化钙、氯化钾、氯化锂、氯化铷、氯化铯、溴化钠、溴化钾、溴化锂、溴化铷、溴化铯、碘化钠、碘化锂、碘化钾、碘化铷、碘化铯等)中的任意一种。
17.所述步骤s3中粉末与还原剂的质量比为1:0.1~10,反应温度为50~100℃。
18.本发明还公开了采用上述制备方法制得光敏剂材料以及这种光敏剂材料在制备聚合物中的应用。
19.本发明设计的光敏剂可吸收宽频波长的光,产生光电子转移进而介导自由基聚合,制备得到良好控制性的聚合物。
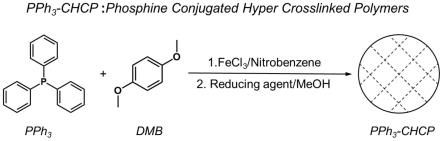
20.与现有技术比较本发明的有益效果在于:
21.1、本发明中光敏剂材料的制备方法简单,成本低,且可以多次循环使用;
22.2、本发明制得的光敏剂材料吸收波长较宽,在可见光和近红外范围内具有较高的吸收系数,在长波段光或太阳光照射下具有很高的催化效率;
23.3、本发明制得的光敏剂材料可以基于原子转移自由基聚合和可逆加成断裂自由聚合催化丙烯酸酯类单体、甲基丙烯酸酯类单体、丙烯酰胺类单体、甲基丙烯酰胺类单体、苯乙烯类单体、醋酸乙烯酯的聚合,制备得到良好控制性的聚合物;
24.4、本发明制得的光敏剂材料可以在密封的玻璃瓶内催化上百毫升丙烯酸酯类单体、甲基丙烯酸酯类单体、丙烯酰胺类单体、甲基丙烯酰胺类单体、苯乙烯类单体、醋酸乙烯
酯的聚合,制备得到良好控制性的聚合物,具有很强的工业化前景。
25.5、本发明制得的光敏剂材料在催化丙烯酸酯类单体、甲基丙烯酸酯类单体、丙烯酰胺类单体、甲基丙烯酰胺类单体、苯乙烯类单体、醋酸乙烯酯的聚合时无需对其进行除氧工作,证明该催化体系具有一定的耐氧性,非常符合工业生产的要求。
附图说明
26.图1为光敏剂材料pph
3-chcp的合成示意图及结构示意图;
27.图2为超交联聚合物pph
3-hcp和光敏剂材料pph
3-chcp核磁共振磷谱图;
28.图3为超交联聚合物pph
3-hcp和光敏剂材料pph
3-chcp的热失重谱图;
29.图4为超交联聚合物pph
3-hcp和光敏剂材料pph
3-chcp的x射线光电子能谱图;
30.图5为光敏剂材料pph
3-chcp的co2吸附-解吸曲线谱图;
31.图6为光敏剂材料pph
3-chcp的扫描电子显微镜谱图;
32.图7为光敏剂材料pph
3-chcp的透射电子显微镜谱图;
33.图8为光敏剂材料pph
3-chcp的紫外光谱图;
34.图9为光敏剂材料pph
3-chcp的循环伏安(cv)曲线谱图;
35.图10为光敏剂材料pph
3-chcp的光电流响应曲线谱图;
36.图11为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma的凝胶渗透色谱图;
37.图12为光敏剂材料pph
3-chcp循环使用的效率图;
38.图13为太阳光照射条件下,用pph
3-chcp作为光敏剂催化100ml mma单体进行atrp聚合后制备得到的pmma的凝胶渗透色谱图;
39.图14为太阳光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma的凝胶渗透色谱图;
40.图15为太阳光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma-b-pmma的凝胶渗透色谱图;
41.图16为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pmma的凝胶渗透色谱图;
42.图17为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pmea的凝胶渗透色谱图;
43.图18为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的ptfea的凝胶渗透色谱图;
44.图19为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的poegma的凝胶渗透色谱图;
45.图20为蓝光照射条件下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pbza的凝胶渗透色谱图;
46.图21为蓝光照射条件下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pba的凝胶渗透色谱图;
47.图22为蓝光照射条件下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pma-b-pmea的凝胶渗透色谱图;
48.图23为光敏剂材料phen-chcp的紫外光谱图;
49.图24为太阳照射条件下,用phen-chcp作为光敏剂通过atrp聚合法制备得到的pma的凝胶渗透色谱图。
具体实施方式
50.以下结合附图,对本发明上述的和另外的技术特征和优点作更详细的说明。
51.实施例1
52.如图1所示,按照pph
3-chcp的合成示意图合成得到pph
3-chcp:
53.氮气氛围下,依次称取400mg的三苯基膦(pph3)、1.6g二甲氧基苯(dmb)、5.6g无水三氯化铁加入到两口瓶中,再加入20ml硝基苯作为溶剂,随后将两口瓶移至70℃油浴锅中冷凝回流搅拌反应3小时,再将反应体系升温至130℃反应21小时。反应结束后,将瓶内溶液进行过滤,并依次使用甲醇、四氢呋喃、丙酮对得到的沉淀物进行冲洗,洗至滤液至澄清透明,并依次用甲醇和四氢呋喃溶液进行索氏提取24小时,索提结束后放入45℃真空干燥箱中干燥12h,得到1.89g深褐色的超交联聚合物pph
3-hcp(产率为94.5%)。
54.氮气氛围下,称取400mg的pph
3-hcp放入到100ml的两口瓶中,加入50ml甲醇进行分散,分散完全后加入500mg硼氢化钠,随后将反应体系升温到80℃反应4小时,再冷却到室温反应4小时。反应结束后将混合溶液进行离心分离,并将底物依次用5mol/l氢氧化钠溶液、去离子水、甲醇溶液离心洗涤三次,随后将处理后的pph
3-hcp放入45℃真空干燥箱中干燥8h,得到310mg的光敏剂pph
3-chcp(产率为77.5%)。
55.图2为超交联聚合物pph
3-hcp和光敏剂材料pph
3-chcp核磁共振磷谱图,从图中可以看到光敏剂pph
3-hcp在宽频波长下具有良好的吸收,带隙为1.50。
56.图3为超交联聚合物pph
3-hcp和光敏剂材料pph
3-chcp的热失重谱图,从图中可以看到在温度升至800℃时,光敏剂pph
3-chcp仍有一定质量的保留。
57.图4为超交联聚合物pph
3-hcp和光敏剂材料pph
3-chcp的x射线光电子能谱图,从图中可以看到pph
3-hcp和pph
3-chcp中的c、o、p、cl吸收峰基本一致,但pph
3-chcp在497ev和1072ev附近出现了na的吸收峰。
58.图5为光敏剂材料pph
3-chcp的co2吸附-解吸曲线,经计算可以得出光敏剂材料pph
3-chcp的比表面积为119m2/g。
59.图6为光敏剂材料pph
3-chcp的扫描电子显微镜谱图,从图中可以看出光敏剂材料pph
3-chcp为紧密的层状堆叠结构。
60.图7为光敏剂材料pph
3-chcp的透射电子显微镜谱图,从图中可以看出光敏剂材料pph
3-chcp的尺寸大小,其长为1μm,宽为0.5μm。
61.图8为光敏剂材料pph
3-chcp的紫外光谱图,从图中可以看到光敏剂pph
3-chcp在200nm到900nm有较强的紫外吸收峰,表明其催化范围较宽,经计算其带隙能为1.50ev。
62.图9为光敏剂材料pph
3-chcp的循环伏安(cv)曲线,从图中可以看出光敏剂材料pph
3-chcp的氧化还原电位为0.42v,表明其homo能级较大,在被激发后容易发生电子转移。
63.图10为光敏剂材料pph
3-chcp的光电流响应曲线,从图中可以看出光敏剂材料pph
3-chcp在可见光照射下具有较强的电荷转移和分离能力。
64.氮气氛围下,称取0.8mgpph
3-chcp,0.8ml丙烯酸甲酯(ma),0.4mg溴化铜(cubr2)、
1.4mg三[2-(二甲氨基)乙基]胺(me6tren)置于10ml的聚合瓶中,再向聚合瓶中加入0.8ml二甲基亚砜(dmso)作为溶剂,待ma、cubr2、me6tren和pph
3-chcp完全分散后通过三次冷冻-抽气-充气-抽气-解冻的循环过程排除溶液中溶解的少量氧气,最后用微量进样器向聚合瓶内打入7μlα-溴异丁酸乙酯(ebib),并将聚合瓶移至温度为25℃,绿色led灯光照射的环境下恒温搅拌反应8h。反应结束后,将反应混合物溶解在二氯甲烷(dcm)中,随后进行过滤,并将滤液旋干,然后在甲醇中进行沉降,收集沉淀物,并将其放置在35℃环境下真空干燥6h,得到聚合物聚丙烯酸甲酯(pma)。
[0065]
图11为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma的凝胶渗透色谱图,从图中可以看出该催化剂的催化性能较高,聚合单体的转化率达到了99%,且聚合控制性良好,pma的数均分子量为17600,分子量分布为1.06。
[0066]
图12为光敏剂材料pph
3-chcp循环使用的效率图;从图中可以看出该光敏剂经过5次循环使用后,依然具有很强的催化效率,单体转化率均能达到99%,pma分子量均保持在17300左右,分子量分布均保持在1.06左右,在实际实验过程中,光敏剂的循环使用次数可达数十次。
[0067]
实施例2
[0068]
氮气氛围下,分别称取100mg pph
3-chcp,100ml甲基丙烯酸甲酯(mma),44mg cubr2、180mg三(2-吡啶基甲基)胺(tpma)、400mg三乙醇胺(teoa)、100ml dmso置于250ml的密闭玻璃瓶中进行搅拌,待其完全分散后再向玻璃瓶内加入840μlα-溴苯乙酸乙酯(ebpa),并将玻璃瓶移至室外太阳光照射的环境下搅拌反应8h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物聚甲基丙烯酸甲酯(pmma)。
[0069]
图13为太阳光照射条件下,用pph
3-chcp作为光敏剂催化100ml mma单体进行atrp聚合后制备得到的pmma的凝胶渗透色谱图,从图中可以看出,在放大体系后进行聚合,依然可以保持很好的聚合控制性,单体的转化率达到了99%,pmma的数均分子量为22700,分子量分布为1.15。
[0070]
实施例3
[0071]
分别称取100mgpph
3-chcp,100ml ma,52mg cubr2、170mgme6tren、100ml dmso置于250ml的密闭玻璃瓶中进行搅拌,待其完全分散后向玻璃瓶内加入860μlebib,并将玻璃瓶移至室外太阳光照射的环境下搅拌反应4h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0072]
图14为太阳光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma的凝胶渗透色谱图,从图中可以看出该催化剂可以在太阳光的照射下催化上百毫升ma的聚合,且控制性良好,其产物pma的数均分子量为17300,分子量分布为1.08。
[0073]
实施例4
[0074]
氮气氛围下,分别称取100mgpph
3-chcp、100ml ma,52mg cubr2、170mgme6tren、100ml dmso置于500ml的密闭玻璃瓶中进行搅拌,待其完全分散后向玻璃瓶内加入860μlebib,并将玻璃瓶移至室外太阳光照射的环境下搅拌反应4h。反应结束后将玻璃瓶移至氮气氛围下,再向玻璃瓶中加入100ml mma,100ml dmso进行搅拌,待其完全分散后将玻璃瓶移至室外太阳光照射的环境下继续搅拌反应6h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到嵌段共聚物pma-b-pmma。
[0075]
图15为太阳光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma-b-pmma的凝胶渗透色谱图,从图中可以看出该催化剂可以在太阳光的照射下催化大体系嵌段共聚物的合成,且控制性良好,聚合第一阶段pma的数均分子量为17300,分子量分布为1.08,聚合第二阶段pma-b-pmma的数均分子量为34000,分子量分布为1.18。
[0076]
实施例5
[0077]
氮气氛围下,分别称量1.6mgpph
3-chcp,1.6ml ma,0.6mg cubr2、2.7mgme6tren、1.6mldmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入14μlebib,并将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应3h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0078]
称取10mg蓝光照射下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的聚合物pma,用1ml无水thf溶解后通过凝胶渗透色谱仪进行分子量检测,测得其pma的数均分子量为16400,分子量分布为1.08。
[0079]
实施例6
[0080]
氮气氛围下,分别称量1.6mgpph
3-chcp,0.8ml ma,0.4mg cubr2、1.4mgme6tren、0.8mldmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μlebib,并将聚合瓶移至橙色led灯光照射环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0081]
对橙光照射下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为17900,分子量分布为1.06。
[0082]
实施例7
[0083]
氮气氛围下,分别称量1.6mg pph
3-chcp,0.8ml ma,0.4mg cubr2、1.4mg me6tren、0.8ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μl ebib,并将聚合瓶移至红色led灯光照射环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0084]
对红光照射下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为17100,分子量分布为1.06。
[0085]
实施例8
[0086]
氮气氛围下,分别称量0.8mg pph
3-chcp,0.8ml ma,0.2mg cubr2、1.6mg me6tren、0.8ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μl ebib,并将聚合瓶移至白色led灯光照射环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0087]
对白光照射下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为16900,分子量分布为1.07。
[0088]
实施例9
[0089]
氮气氛围下,分别称量1.6mgpph
3-chcp,0.8ml ma,0.4mg cubr2、0.9mgme6tren、0.8mldmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μlebib,并将聚合瓶移至近红外(λ
max
=800nm)灯光照射的环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0090]
对近红外(λ
max
=800nm)灯光照射下,用pph
3-chcp作为光敏剂通过atrp聚合法制
备得到的pma进行分子量检测,测得其pma的数均分子量为16600,分子量分布为1.09。
[0091]
实施例10
[0092]
氮气氛围下,分别称量1.6mgpph
3-chcp,0.8ml ma,0.4mg cubr2、1.4mgme6tren、0.8mldmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μlebib,并将聚合瓶移至近红外(λ
max
=940nm)灯光照射的环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0093]
对近红外(λ
max
=940nm)灯光照射下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为17100,分子量分布为1.06。
[0094]
实施例11
[0095]
氮气氛围下,分别称量0.8mgpph
3-chcp,0.8ml ma,0.4mg cubr2、1.4mgme6tren置于10ml聚合瓶中,再向聚合瓶中加入0.8ml n,n-二甲基甲酰胺(dmf)作为溶剂,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μlebib,并将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应8h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0096]
对绿光照射下,用pph
3-chcp作为光敏剂、dmf作为溶剂,通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为17000,分子量分布为1.05。
[0097]
实施例12
[0098]
氮气氛围下,分别称量0.8mgpph
3-chcp,0.8ml ma,0.4mg cubr2、1.4mgme6tren置于10ml聚合瓶中,再向聚合瓶中加入0.8ml乙腈(mecn)作为溶剂,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μlebib,并将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应4h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0099]
对绿光照射下,用pph
3-chcp作为光敏剂、mecn作为溶剂通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为15700,分子量分布为1.06。
[0100]
实施例13
[0101]
氮气氛围下,分别称量1mg pph
3-chcp,1ml mma,0.4mg cubr2、1.4mg tpma、4mgteoa、1ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,再向聚合瓶内加入8μl ebpa,并将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应8h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pmma。
[0102]
图16为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pmma的凝胶渗透色谱图,从图中可以看出mma单体转化率达到了99%,pmma的数均分子量为19600,分子量分布为1.12。
[0103]
实施例14
[0104]
氮气氛围下,分别称量0.6mg pph
3-chcp,1.2ml丙烯酸-2-甲氧乙基酯(mea),0.4mg cubr2、0.9mg me6tren、1.2ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μl ebib,并将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应8h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物聚丙烯酸-2-甲氧乙基酯(pmea)。
[0105]
图17为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pmea的凝胶渗透色谱图,从图中可以看出mea单体转化率达到了99%,pmea的数均分子量为29200,分子量分布为1.08。
[0106]
实施例15
[0107]
氮气氛围下,分别称量1.2mg pph
3-chcp,1.2ml丙烯酸-2,2,2-三氟乙酯(tfea),0.4mg cubr2、0.9mg me6tren、1.2ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μl ebib,并将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应16h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物聚丙烯酸-2,2,2-三氟乙酯(ptfea)。
[0108]
图18为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的ptfea的凝胶渗透色谱图,从图中可以看出tfea单体转化率达到了99%,ptfea的数均分子量为23400,分子量分布为1.06。
[0109]
实施例16
[0110]
氮气氛围下,分别称量1.6mg pph
3-chcp,0.8ml寡聚(乙二醇)甲基丙烯酸酯(oegma,mw=300),0.4mg cubr2、1.4mg tpma、4mg teoa、40mg溴化钠(nabr)、2.4ml超纯水置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μl ebpa,并将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应10h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物聚寡聚(乙二醇)甲基丙烯酸酯(poegma)。
[0111]
图19为绿光照射条件下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的poegma的凝胶渗透色谱图,从图中可以看出oegma单体转化率达到了99%,poegma的数均分子量为16900,分子量分布为1.29。
[0112]
实施例17
[0113]
氮气氛围下,分别称取1mg pph
3-chcp,1ml mma,4mg cubr2、1.8mg tpma、4mg teoa、1ml dmso置于10ml的聚合瓶中进行搅拌,待其完全分散后再向聚合瓶内加入8μl ebpa,并将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应10h,反应结束后将反应体系移至无氧环境中,随后向反应体系中分别加入已经除过氧的1ml苯乙烯(st)、1ml dmso,并再次将聚合瓶移至绿色led光照射的环境下恒温搅拌反应14h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到嵌段共聚物pmma-b-pst。
[0114]
对绿光照射下,用pph
3-chcp作为光敏剂通过atrp聚合法制备得到的pmma-b-pst进行分子量检测,测得其聚合第一阶段pma的数均分子量为16800,分子量分布为1.08,聚合第二阶段pmma-b-pst的数均分子量为32600,分子量分布为1.22。
[0115]
实施例18
[0116]
氮气氛围下,分别称量3.4mg pph
3-chcp,0.85ml mma,11.2mg 2-[[(丁基硫代)硫氧代甲基]硫代]丙酸(btpa)、0.85ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应4h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0117]
对蓝光照射下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为17000,分子量分布为1.08。
[0118]
实施例19
[0119]
氮气氛围下,分别称量20mg pph
3-chcp,10ml mma,132mg btpa、10ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至太阳光照射环境下搅拌反应3h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0120]
对太阳光照射下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为12700,分子量分布为1.06。
[0121]
实施例20
[0122]
氮气氛围下,分别称量3.3mg pph
3-chcp,0.55ml ma,11.2mg btpa、1.1ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0123]
对绿光照射下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为9400,分子量分布为1.04。
[0124]
实施例21
[0125]
氮气氛围下,分别称量1mg pph
3-chcp,1ml mma,13.1mg 4-氰基-4-(苯基羰基硫)戊酸(cpadb)、1ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应24h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pmma。
[0126]
对蓝光照射下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pmma进行分子量检测,测得其pmma的数均分子量为19200,分子量分布为1.19。
[0127]
实施例22
[0128]
氮气氛围下,分别称量2.8mg pph
3-chcp,0.7ml丙烯酸苯甲酯(bza),5.4mg btpa、0.7ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物聚丙烯酸苯甲酯(pbza)。
[0129]
图20为蓝光照射条件下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pbza的凝胶渗透色谱图,从图中可以看出bza单体转化率达到了95%,pbza的数均分子量为25600,分子量分布为1.10。
[0130]
实施例23
[0131]
氮气氛围下,分别称量2.8mg pph
3-chcp,0.7ml丙烯酸正丁酯(ba),5.9mg btpa、0.7ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应11h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物聚丙烯酸正丁酯(pba)。
[0132]
图21为蓝光照射条件下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pba的凝胶渗透色谱图,从图中可以看出ba单体转化率达到了92%,pba的数均分子量为24200,分子量分布为1.06。
[0133]
实施例24
[0134]
氮气氛围下,分别称量2.4mg pph
3-chcp,0.6ml n,n-二甲基丙烯酰胺(dma),7mg btpa、0.6ml超纯水置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物聚n,n-二甲基丙烯酰胺(pdma)。
[0135]
对蓝光照射下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pdma进行分子量检测,测得其pdma的数均分子量为16800,分子量分布为1.08。
[0136]
实施例25
[0137]
氮气氛围下,分别称量3.4mg pph
3-chcp,0.85ml醋酸乙烯酯(vac),11mg btpa、0.85ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应16h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物聚醋酸乙烯酯(pvac)。
[0138]
对蓝光照射下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pvac进行分子量检测,测得其pvac的数均分子量为15200,分子量分布为1.10。
[0139]
实施例26
[0140]
氮气氛围下,分别称量3.4mg pph
3-chcp,0.85ml ma,11.2mg btpa、0.85ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应4h。反应结束后,将反应体系移至无氧环境中,随后向反应体系中分别加入已经除过氧的1.2ml mea、1.2ml dmso,并再次将聚合瓶移至蓝色led灯光照射的环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到共聚物聚丙烯酸甲酯-b-聚丙烯酸-2-甲氧乙基酯(pma-b-pmea)。
[0141]
图22为蓝光照射条件下,用pph
3-chcp作为光敏剂通过raft聚合法制备得到的pma-b-pmea的凝胶渗透色谱图,从图中可以看出第一阶段pma的数均分子量为15700,分子量分布为1.07,聚合第二阶pma-b-pmea的数均分子量达到了31900,分子量分布为1.12。
[0142]
实施例27
[0143]
氮气氛围下,分别称量500mgpph
3-hcp、3g氯化锂、50ml甲醇溶液置于100ml的两口瓶中,将温度升至80℃恒温反应4小时,再冷却到室温反应4小时。反应结束后将混合溶液进行离心分离,并将底物依次去离子水、甲醇溶液离心洗涤三次,随后将处理后的pph
3-hcp放入45℃真空干燥箱中干燥8h,得到410mg的光敏剂pph
3-chcp-li(产率为82.0%)。
[0144]
氮气氛围下,分别称量0.8mg pph
3-chcp-li,0.8ml ma,0.4mg cubr2、1.4mgme6tren、0.8ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μl ebib,并将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应5h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0145]
对蓝光照射下,用pph
3-chcp-li作为光敏剂通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为16600,分子量分布为1.05。
[0146]
实施例28
[0147]
氮气氛围下,分别称量500mg pph
3-hcp、3g氯化钠、50ml甲醇溶液置于100ml的两口瓶中,将温度升至80℃恒温反应4小时,再冷却到室温反应4小时。反应结束后将混合溶液进行离心分离,并将底物依次去离子水、甲醇溶液离心洗涤三次,随后将处理后的pph
3-hcp放入45℃真空干燥箱中干燥8h,得到422mg的光敏剂pph
3-chcp-na(产率为84.4%)。
[0148]
氮气氛围下,分别称量0.8mg pph
3-chcp-na,0.8ml ma,0.4mg cubr2、1.4mgme6tren、0.8ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μl ebib,并将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应5h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0149]
对蓝光照射下,用pph
3-chcp-na作为光敏剂通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为17100,分子量分布为1.07。
[0150]
实施例29
[0151]
氮气氛围下,分别称量500mg pph
3-hcp、3g氯化钾、50ml甲醇溶液置于100ml的两口瓶中,将温度升至80℃恒温反应4小时,再冷却到室温反应4小时。反应结束后将混合溶液进行离心分离,并将底物依次去离子水、甲醇溶液离心洗涤三次,随后将处理后的pph
3-hcp放入45℃真空干燥箱中干燥8h,得到417mg的光敏剂pph
3-chcp-k(产率为83.4%)。
[0152]
氮气氛围下,分别称量0.8mg pph
3-chcp-k,0.8ml ma,0.4mg cubr2、1.4mgme6tren、0.8ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μlebib,并将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应5h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0153]
对蓝光照射下,用pph
3-chcp-k作为光敏剂通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为18600,分子量分布为1.06。
[0154]
实施例30
[0155]
氮气氛围下,分别称量500mg pph
3-hcp、3g氯化镁、50ml甲醇溶液置于100ml的两口瓶中,将温度升至80℃恒温反应4小时,再冷却到室温反应4小时。反应结束后将混合溶液进行离心分离,并将底物依次去离子水、甲醇溶液离心洗涤三次,随后将处理后的pph
3-hcp放入45℃真空干燥箱中干燥8h,得到402mg的光敏剂pph
3-chcp-mg(产率为80.4%)。
[0156]
氮气氛围下,分别称量0.8mg pph
3-chcp-mg,0.8ml ma,0.4mg cubr2、1.4mgme6tren、0.8ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,最后向聚合瓶内加入7μl ebib,并将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应5h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0157]
对蓝光照射下,用pph
3-chcp-mg作为光敏剂通过atrp聚合法制备得到的pma进行分子量检测,测得其pma的数均分子量为18300,分子量分布为1.06。
[0158]
实施例31
[0159]
氮气氛围下,依次称取479mg4,7-二甲基-1,10-菲咯啉、1.6g二甲氧基苯、5.6g无水三氯化铁加入到两口瓶中,再加入20ml硝基苯作为溶剂,随后将两口瓶移至70℃油浴锅中冷凝回流搅拌反应8小时,再将反应体系升温至120℃反应16小时。反应结束后,将瓶内溶液进行过滤,并依次使用甲醇、四氢呋喃、丙酮对得到的沉淀物进行冲洗,洗至滤液至澄清透明,并依次用甲醇和四氢呋喃溶液进行索氏提取24小时,索提结束后放入真空干燥箱中进行干燥,得到1.92g深褐色的超交联聚合物phen-hcp(收率为92.4%)。
[0160]
氮气氛围下,称取400mg phen-hcp放入到100ml的两口瓶中,加入50ml甲醇进行分散,分散完全后加入400mg水合肼,随后将反应体系升温到75℃反应4小时,再冷却到室温反应8小时。反应结束将混合溶液进行离心分离,并将底物依次用5mol/l氢氧化钠溶液、去离子水、甲醇溶液离心洗涤三次,随后将处理后的phen-hcp放入真空干燥箱后进行干燥,得到302mg的光敏剂phen-chcp(收率为75.5%)。
[0161]
图23为光敏剂材料phen-chcp的紫外光谱图,从图中可以看到光敏剂phen-chcp在200nm到900nm有较强的紫外吸收峰,表明其催化范围较宽,经计算其带隙能为1.60ev。
[0162]
氮气氛围下,分别称量1mg phen-chcp,1ml mma,0.4mg cubr2、1.4mg tpma、4mgteoa、1ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,再向聚合瓶内加入8μl ebpa,并将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应8h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pmma。
[0163]
对绿光照射下,用光敏剂材料phen-chcp作为光敏剂通过atrp聚合法制备得到的pmma进行分子量检测,测得其pmma的数均分子量为22000,分子量分布为1.11。
[0164]
将光敏剂材料phen-chcp从聚合物中分离出来进行循环使用,经过5次循环使用后,光敏剂phen-chcp依然具有很强的催化效率,单体转化率均能达到99%,pmma分子量均保持在21000左右,分子量分布均保持在1.12左右,在实际实验过程中,光敏剂的循环使用次数可达数十次。
[0165]
实施例32
[0166]
氮气氛围下,分别称量1.6mg phen-chcp,1.6ml ma,0.8mg cubr2、2.8mg me6tren、1.6ml dmso置于10ml聚合瓶中,待其完全分散后再向聚合瓶内加入7μl ebib,并将聚合瓶移至太阳光照射环境下搅拌反应4h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pma。
[0167]
图24为太阳照射条件下,用phen-chcp作为光敏剂通过atrp聚合法制备得到的pma的凝胶渗透色谱图,从图中可以看出,在不额外对单体进行除氧工作时,ma单体转化率依然达到了95%,pma的数均分子量为16000,分子量分布为1.07。
[0168]
实施例33
[0169]
氮气氛围下,分别称取1.3mg phen-chcp,1.3ml ba,4mg cubr2、1.4mg me6tren、1.3ml dmso置于10ml的聚合瓶中进行搅拌,待其完全分散后再向聚合瓶内加入7μlebib,并将聚合瓶移至绿色led灯光照射环境下恒温搅拌反应12h,反应结束后将反应体系移至无氧环境中,随后向反应体系中分别加入已经除过氧的1.2ml mea、1.2ml dmso,并再次将聚合瓶移至绿色led光照射的环境下恒温搅拌反应12h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到嵌段共聚物pba-b-pmea。
[0170]
对绿光照射下,用光敏剂材料phen-chcp作为光敏剂通过atrp聚合法制备得到的pba-b-pmea进行分子量检测,测得其聚合第一阶段pba的数均分子量为22400,分子量分布为1.11,聚合第二阶段pba-b-pmea的数均分子量为38300,分子量分布为1.14。
[0171]
实施例34
[0172]
氮气氛围下,依次称取937mg四苯基卟啉、1.6g二甲氧基苯、5.6g无水三氯化铁加入到两口瓶中,再加入20ml硝基苯作为溶剂,随后将两口瓶移至80℃油浴锅中冷凝回流搅拌反应6小时,再将反应体系升温至140℃反应18小时。反应结束后,将瓶内溶液进行过滤,并依次使用甲醇、四氢呋喃、丙酮对得到的沉淀物进行冲洗,洗至滤液至澄清透明,并依次用甲醇和四氢呋喃溶液进行索氏提取24小时,索提结束后放入真空干燥箱中进行干燥,得到2.30g深褐色的超交联聚合物tpp-hcp(收率为90.7%)。
[0173]
氮气氛围下,称取400mg tpp-hcp放入到100ml的两口瓶中,加入50ml甲醇进行分散,分散完全后加入600mg二乙烯三胺,随后将反应体系升温到70℃反应6小时,再冷却到室温反应6小时。反应结束将混合溶液进行离心分离,并将底物依次用5mol/l氢氧化钠溶液、去离子水、甲醇溶液离心洗涤三次,随后将处理后的tpp-hcp放入真空干燥箱后进行干燥,得到322mg的光敏剂tpp-chcp(收率为80.5%)。
[0174]
氮气氛围下,分别称量1mg tpp-chcp,1ml mma,13.1mg cpadb、1ml dmso置于10ml聚合瓶中,待其完全分散后进行除氧工序,随后将聚合瓶移至蓝色led灯光照射环境下恒温搅拌反应24h。反应结束后将生成物进行复溶、旋干、沉降、干燥得到聚合物pmma。
[0175]
对蓝光照射下,用光敏剂材料tpp-chcp作为光敏剂通过atrp聚合法制备得到的pmma进行分子量检测,测得其pmma的数均分子量为15500,分子量分布为1.12。
[0176]
以上所述仅为本发明的较佳实施例,对本发明而言仅仅是说明性的,而非限制性的。本专业技术人员理解,在本发明权利要求所限定的精神和范围内可对其进行许多改变,修改,甚至等效,但都将落入本发明的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
