ddx24在促进宫颈鳞癌淋巴管生成和淋巴结转移中的应用
技术领域
1.本发明涉及妇科疾病治疗技术领域,更具体地,涉及ddx24在促进宫颈鳞癌淋巴管生成和淋巴结转移中的应用。
背景技术:
2.宫颈癌(cc)是妇女因癌症死亡的第四大原因,也是一项重大的全球卫生挑战。宫颈鳞状细胞癌(cscc)是宫颈癌中最常见的病理组织类型,约占cc病例的70%。盆腔淋巴结转移作为宫颈癌的主要转移途径,是宫颈癌相关死亡的关键原因,也是宫颈癌复发的独立因素之一。尽管目前宫颈癌治疗在手术、放疗和化疗上都有很大的进步,但对于cscc的淋巴结转移仍缺乏有效、可靠的预防和治疗手段。因此,了解肿瘤通过淋巴管扩散的潜在机制势在必行。
3.在淋巴转移过程中,一方面淋巴管从原有的淋巴管中萌发(即淋巴管生成)增加了肿瘤细胞进入淋巴管的几率,另一方面肿瘤细胞发生上皮-间充质转化(epithelial-mesenchymal transition,emt)获得侵袭迁移到淋巴管的动力。因此,靶向淋巴管生成和emt通路有望成为治疗淋巴转移的主要策略。例如,阻断vegfc/d-vegfr3通路可有效阻断乳腺癌和胃癌的肿瘤淋巴管生成,抑制淋巴结转移。然而,由于其发病机制尚不明确,临床上仍缺乏有效的治疗cscc淋巴转移的策略。
4.rna解旋酶是所有真核细胞中的一大类必需酶,参与rna代谢的几乎所有方面(如转录、剪接、运输、翻译和降解)。dead-box rna解旋酶(dead-box rna helicases,ddxs)是最大的解旋酶家族,该蛋白家族在人类中至少有80个成员。ddxs中有许多蛋白如ddx3、ddx49、ddx24、ddx19a等参与肿瘤的发生和转移。ddx24是研究最少的ddxs之一,在几种癌症中上调,且在体外促进癌症生长独立于p53通路。虽然ddx24的过表达与宫颈癌有关,但ddx24在cscc进展和转移中的调控机制仍不明确。
技术实现要素:
5.为了克服现有技术存在的上述问题,本发明探索了ddx24在cscc中介导癌细胞emt和淋巴管生成的重要作用。研究强调了cscc淋巴转移的机制解释和潜在的治疗靶点。
6.本发明的首要目的是提供ddx24基因在宫颈鳞状细胞癌中的应用。
7.本发明的第二个目的是提供一种提高宫颈鳞状细胞癌患者临床预后准确率的药盒或者试剂盒。
8.本发明的目的通过以下技术方案实现:
9.ddx24基因或其表达产物在开发、筛选宫颈鳞状细胞癌功能产品方面的应用,所述功能产品对ddx24基因或其表达产物具有抑制作用;或对ddx24基因或其表达产物具有抑制作用的功能产品在制备预防和/或缓解和/或治疗宫颈鳞状细胞癌的产品方面的应用。
10.众所周知,dead-box蛋白参与大多数rna代谢过程,在许多情况下,除了依赖于atp的rna解旋酶活性外,还发挥其他作用。越来越多的证据表明,ddxs参与了肿瘤发生发展。然
而,他们在cscc中的角色有些争议。例如,ddx41和elf4a3(被称为ddx48)正调控宫颈癌的进展,而ddx3通过mdm2/slug/e-cadherin通路抑制宫颈癌细胞的生长和侵袭能力。在调节转移方面,我们之前已经证明ddx19a通过诱导nox1介导的ros生成促进cscc转移。通过shrna文库筛选,预测ddx24是宫颈癌的潜在生物标志物。然而,ddx24在cscc的肿瘤发生和淋巴结转移中的生物学作用尚不清楚。本发明的研究结果证实了ddx24对cscc肿瘤生长具有正向调节作用的假设,并进一步证明了ddx24介导的cscc淋巴结转移和肿瘤发生的机制。
11.因此,优选的,所述功能产品具有下调ddx24基因的表达、转录或其表达产物的功能;或者所述功能产品具有下调ddx24/agrn基因的表达转录或其表达产物的功能。
12.本发明中发现的ddx24下游因子agrn,其属于一种糖基化蛋白聚糖。前期研究表明agrn分泌到基底膜并稳定神经肌肉连接(nmjs)中的乙酰胆碱受体(achrs)。近年来,越来越多的研究表明,agrn在肿瘤发生中的重要作用。agrn在口腔鳞状细胞癌的迁移、侵袭和放化疗抵抗中起重要作用。此外,在肝癌和同种异体肾移植中,agrn分别参与肿瘤血管生成和淋巴管生成。然而,agrn在cscc淋巴结转移中的生物学作用尚不清楚。在这项研究中,证明了ddx24通过调节cscc中agrn的表达促进淋巴管生成。
13.ddx24通过agrn依赖的方式促进癌细胞emt和淋巴管生成。本研究的新发现提供了一系列有希望的靶点,可用于治疗cscc的淋巴转移。
14.因此,优选的,本发明上述功能产品:
15.(1)抑制宫颈鳞状细胞癌的癌细胞增殖、迁移、侵袭,和/或;
16.(2)抑制宫颈鳞状细胞癌的上皮-间充质转化,和/或;
17.(3)抑制宫颈鳞状细胞癌淋内皮细胞的增殖、迁移,和/或;
18.(4)抑制宫颈鳞状细胞癌内皮细胞的淋巴管形成,和/或;
19.(5)抑制宫颈鳞状细胞癌的淋巴结转移。
20.更优选的,所述功能产品包括ddx24/agrn核酸抑制剂、ddx24/agrn蛋白抑制剂、ddx24/agrn基因缺陷或沉默的免疫相关细胞、其分化细胞或者基因重组构建体中的一种或者多种。
21.具体的,所述功能产品包括以下任一种:
22.(i)以ddx24/agrn,或ddx24/agrn转录本为靶序列,且能够抑制ddx24/agrn基因表达产物的表达或基因转录的小干扰rna、dsrna、shrna、微小rna、反义核酸;
23.(ii)能表达或者形成(i)中所述小干扰rna、dsrna、shrna、微小rna、反义核酸构建体;
24.(iii)含有ddx24/agrn,或ddx24/agrn互补序列且能够在转入体内后形成抑制ddx24/agrn基因表达产物的表达或者基因转录的干扰分子的构建体;
25.(iv)抑制或敲除ddx24/agrn基因序列后的免疫相关细胞、其分化细胞或构建体。
26.而后,本发明研究还发现ddx24是一个很有前景的cscc淋巴转移的预后生物标志物,ddx24表达升高与cscc患者预后差、淋巴结转移相关;在mrna和蛋白水平上,agrn表达均与ddx24呈正相关。重要的是,agrn升高也与预后不良相关。以上结果表明,agrn是ddx24在cscc中的下游靶点。
27.因此,本发明还保护一种提高宫颈鳞状细胞癌患者临床预后准确率的药盒或者试剂盒,所述药盒或者试剂盒包括:用于检测ddx24和/或agrn表达水平的物质。
28.与现有技术相比,本发明的有益效果是:
29.本发明揭示了ddx24在促进cscc淋巴转移中的关键作用。ddx24表达升高与cscc患者预后差、淋巴结转移相关。ddx24的过表达增强了cscc细胞的侵袭、迁移和emt,并通过agrn信号通路促进淋巴管生成。我们进一步证实,在小鼠模型中,ddx24能够促进淋巴管生成和淋巴结转移。结果表明,ddx24为cscc的淋巴转移提供了有利的条件,揭示了恶性细胞与淋巴内皮之间的互作。
附图说明
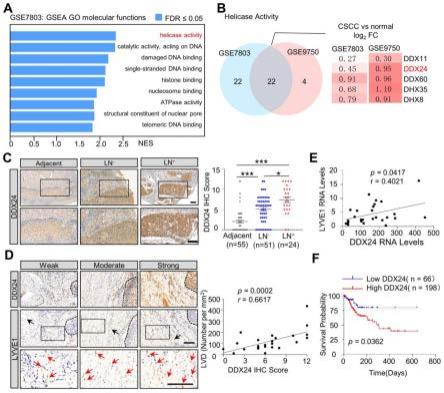
30.图1为ddx24在淋巴结转移的cscc患者肿瘤组织中表达上调分析,其中,图1a是基因集富集分析(gene set enrichment analysis,gsea)显示宫颈癌细胞癌组织与正常宫颈组织在gse7803数据集中的差异基因;图1b是gse7803和gse9750数据集中解旋酶活性重叠基因的维恩图;图1c是ddx24蛋白在癌旁组织(adjacent)和无淋巴结转移(ln-)或有淋巴结转移(ln )组织的颈部鳞状细胞癌(cscc)中的表达,比例尺:100μm;结果为平均值
±
均值标准误;tukey多重比较测验;*p《0.05;***p《0.001;图1d是免疫组化染色(ihc)显示cscc组织中lyve1阳性微血管与弱、中、强ddx24表达的代表性显微图及相关性,黑色虚线:肿瘤,红色箭头:lyve1阳性微淋巴管,黑色箭头:血管,比例尺:200μm,pearson相关系数;图1e是gse9750数据集中cscc组织中ddx24和lyve1mrna表达水平的相关性,pearson相关系数;图1f是kaplan-meier曲线显示了ddx24表达水平低(n=66)或高(n=198)的cc患者的总生存期,结果在tcga中通过oncolnc(http://www.oncolnc.org/)进行探索;
31.图2为ddx24在体外促进cscc细胞的迁移和侵袭分析,其中,图2a-2b是定量实时pcr(qrt-pcr)和western blot分析证实ddx24在siha细胞中过表达(图2a)或敲低(图2b),以gapdh作为上样对照,结果为平均值
±
均值标准误;每组n=3,student’st检验,***p《0.001;图2c-2d为与空载体(vector)组和混乱sirna对照组(ctrl)相比,ddx24过表达(图2c)和ddx24沉默(图2d)siha细胞迁移和侵袭的代表性显微图,比例尺:200μm,结果为平均值
±
均值标准误,每组n=3,student's t检验,*p《0.05,**p《0.01,***p《0.001;图2e-2f为western blot显示过表达(图2e)和沉默(图2f)siha细胞中emt标记物和基质金属蛋白酶(e-cadherin,n-cadherin,mmp9和slug),以gapdh作为上样对照,结果为平均值
±
均值标准误,每组n=3,student's t检验,*p《0.05,**p《0.01,***p《0.001;
32.图3为ddx24在cscc细胞中体外刺激淋巴管生成的分析,其中,图3a-3b为ki67免疫荧光分析的代表性图像和定量检测人淋巴内皮细胞(hlecs)与来自于ddx24过表达(图3a,n=4组)或ddx24沉默(图3b,n=3组)siha细胞的培养基(cm)培养的增殖能力,绿色:ki67,蓝色:dapi,白色箭头:ki67阳性细胞,比例尺:20μm,结果为平均值
±
均值标准误,student’s t检验,*p《0.05,**p《0.01,***p《0.001;图3c-3d为迁移实验的代表性图像和量化,以检测用来自ddx24过表达(图3c)或ddx24沉默(图3d)siha细胞的cm培养的hlecs的迁移能力,比例尺:200μm,结果为平均值
±
均值标准误,每组n=3,student’s t检验,***p《0.001;图3e-3f为管腔形成实验的代表性图像和定量检测cm培养的hlecs的迁移能力,cm来源于ddx24过表达(图3e)或ddx24沉默(图3f)的siha细胞,比例尺:200μm,结果为平均值
±
均值标准误,每组n=3,student’st检验,***p《0.001;图3g-3h为western blot显示在ddx24过表达(图3g)和沉默(图3h)siha细胞中vegfr3磷酸化akt(p-akt),磷酸化erk1/2(p-erk1/2),总akt
(t-akt)和总erk1/2(t-erk1/2),以gapdh作为上样对照,比例尺:200μm,结果为平均值
±
均值标准误,每组n=3,student’s t检验,*p《0.05,**p《0.01,***p《0.001;
33.图4为细胞外基质蛋白agrn在cscc中受ddx24调控分析,其中,图4a为通过mf分析获得的细胞外基质结构组成通路;图4b为ddx24沉默ms751和siha细胞中细胞外基质组织通路重叠基因的venn图;图4c为qrt-pcr验证两个候选基因的表达,结果为平均值
±
均值标准误,每组n=3,student’s t检验,***p《0.001;图4d-4e为western blot和dot blot分析显示,在ddx24过表达(图4d)和沉默(图4e)siha细胞裂解液和上清液中分别表达了agrn和ddx24,以gapdh作为上样对照,结果为平均值
±
均值标准误,每组n=3;student’s t检验,*p《0.05,**p《0.01,***p《0.001;图4f-4g为免疫荧光法的代表性图像和定量分析ddx24过表达(图4f)或ddx24沉默(图4g)siha细胞中agrn的表达,绿色:agrn,蓝色:dapi,白盒:扩大,比例尺:20μm,结果为平均值
±
均值标准误,每组n=3,student’s t检验,***p《0.001;图4h为gse7803数据集中cscc组织中ddx24和agrn mrna表达水平的相关性,pearson相关系数;图4i为免疫组化染色(ihc)观察cscc组织中具有代表性的显微照片及其与agrn、ddx24表达的相关性,黑色的星号:肿瘤,比例尺:200μm,fisher精确检验;图4j为ddx24免疫组化染色评分(ihc评分)与cscc组织中agrn的相关性,pearson相关系数;图4k为gse7803中正常(正常,n=10)和宫颈鳞癌(cscc,n=21)组织中agrn mrna的表达,student’st检验;图4l为kaplan-meier曲线显示agrn表达水平低(fpkm≤29.23)或高(fpkm》29.23)的患者的总生存期,log-rank检验;
34.图5为ddx24通过agrn信号通路诱导cscc淋巴管生成的分析,其中,图5a为western blot和dot blot分析显示siha细胞中分别有agrn沉默的siha细胞裂解液和上清液中有agrn,以gapdh和ponceau为对照,结果为平均值
±
均值标准误,每组n=3,student’s t检验,***p《0.001;图5b为ki67细胞免疫荧光法的代表性图像和定量检测hlecs与来自于agrn沉默siha细胞的cm培养的增殖能力,绿色:ki67,蓝色:dapi,白色箭头:ki67阳性细胞,比例尺:20μm,结果为平均值
±
均值标准误,每组n=3,student’st检验,**p《0.01;图5c为细胞划痕实验的代表性图像和定量检测hlecs与来自于agrn沉默siha细胞的cm培养的迁移能力,黑色虚线:0小时划痕边缘,红色虚线:36小时的划痕边缘,比例尺:200μm,结果为平均值
±
均值标准误,每组n=4,student’s t检验,***p《0.001;图5d为管腔形成实验的代表性图像和定量检测hlecs与来自siha细胞的cm培养的管腔形成能力,scale bar,200μm,结果为平均值
±
均值标准误,每组n=3,student’st检验,***p《0.001;图5e为cscc组织中lyve1阳性微血管与弱、中、强agrn表达的代表性显微图及相关性,黑色虚线:肿瘤,红色箭头:lyve1阳性微血管,黑色箭头:血管,黑盒:扩大,比例尺:200μm,pearson相关系数;图5f为gse7803数据集中cscc组织中ddx24和agrn mrna表达水平的相关性;图5g为western blot和dot blot分别对siha细胞裂解液和上清液中的agrn和ddx24进行分析,以gapdh和ponceau为对照,结果为平均值
±
均值标准误;每组n=3;turkey多重比较测验,*p《0.05,**p《0.01;ns,不显著;图5h为ki67细胞免疫荧光法的代表性图像和定量检测siha细胞衍生cm培养hlecs的增殖能力,绿色:ki67,蓝色:dapi,白色箭头:ki67阳性细胞,比例尺:20μm;结果为平均值
±
均值标准误;每组n=3;tukey多重比较测验;**p《0.01;ns,不显著;图5i为细胞划痕实验的代表性图像和定量检测hlecs与来自siha细胞的cm培养的迁移能力,黑色虚线表示0h时,红色虚线表示36h时,比例尺为200μm,结果为平均值
±
均值标准误;每组n=3;tukey多重比
较测验;**p《0.01;ns,不显著;图5j为管腔形成实验的代表性图像和定量检测hlecs与来自siha细胞的cm培养的迁移能力,比例尺:200μm,结果为平均值
±
均值标准误;每组n=3;tukey多重比较测验;**p《0.01;ns,不显著;
35.图6为ddx24促进cscc体内淋巴转移分析,其中,图6a是体内肿瘤淋巴结转移实验设计示意图,dox,4mg/ml多西环素;ivis,活体光学成像系统;图6b是第60天用过表达ddx24或空载体siha细胞接种balb/c-nu裸鼠足底照片,足底肿瘤信号被阻断,图中信号显示肿瘤已转移至腘窝淋巴结(pln);图6c是第60天脚垫长出siha肿瘤的小鼠照片,黑色箭头:足部肿瘤;pln,腘淋巴结(黑色虚线圈);iln,腹股沟淋巴结(白色虚线圈);图6d-6e是小鼠iln(图6d)和pln(图6e)体积的代表性照片和定量,比例尺:1cm,student’s t检验;图6f是小鼠足底部位agrn、ddx24、lyve1表达代表性显微图,红色箭头,lyve1阳性微血管;比例尺:200μm;图6g-6h是小鼠足部agrn(图6g)和lvd(图6h)表达量的测定,结果为平均值
±
均值标准误;每组n=8;student’s t检验;**p《0.01;***p《0.001;图6i-6j是ddx24表达与agrn(j)或lvd(k)的相关性;pearson相关系数;
36.图7为ddx24高表达于cscc患者组织中,其中图7a为gse9750数据集中基因集富集分析显示宫颈癌细胞癌组织与正常宫颈组织差异基因;图7b-7c为gse7803数据集和gse9750数据集检测正常宫颈组织(normal)和宫颈鳞状细胞癌(cscc)中ddx24 mrna表达水平,student’s t检验;结果以平均值
±
sem表示;
37.图8为ddx24可增加cscc细胞的迁移和侵袭能力,其中图8a为gse9750数据库中各种宫颈癌细胞系中ddx24 mrna的相对表达;图8b-8c为通过实时荧光定量pcr(qrt-pcr)和western blot检测ms751细胞中ddx24的过表达(图8b)或敲低效果(图8c),以gapdh作为加载对照;每组n=3,student’s t检验;结果以平均值
±
sem表示,*p《0.05,**p《0.01;图8d-8e为transwell迁移和侵袭实验的代表性图片显示,与空载体(vector)组和干扰sirna对照组(ctrl)相比,过表达(8d)和沉默(8e)ddx24的ms751细胞迁移和侵袭,比例尺为200μm,student’s t检验,每组n=3;结果以平均值
±
sem表示,**p《0.01,***p《0.001;
38.图9为ddx24在cscc细胞中促进体外淋巴管生成,其中,图9a-9b为transwell迁移实验的代表性图像和定量检测cm培养的hlecs的迁移能力,cm来自于ddx24过表达(9a)或ddx24沉默(9b)的ms751细胞,标尺为200μm,每组n=3,student’s t检验,结果以平均值
±
sem表示,***p《0.001;图9c-9d成管实验的代表性图像和定量检测cm培养的hlecs的迁移能力,cm来自于ddx24过表达(图9c)或ddx24沉默(图9d)的ms751细胞,标尺为200μm,每组n=3,student’s t检验,结果以平均值
±
sem表示,**p《0.01,***p《0.001;
39.图10为细胞外基质蛋白agrn在cscc中受ddx24调控,其中图10a为实时荧光定量pcr定量分析ddx24过表达siha细胞和ms751细胞中血管内皮生长因子(vegf)家族,每组n=3,student’s t检验,结果以平均值
±
sem表示,**p《0.01,***p《0.001,ns,不显著;图10b为ddx24沉默siha细胞和ms751细胞血管内皮生长因子(vegf)家族的rna测序分析;图10c为基因富集分析ddx24敲除siha细胞和ms751细胞后的cscc细胞转录组学分析;图10d为基因本体分析ddx24敲除siha细胞和ms751细胞后cscc细胞的转录组学;图10e为实时荧光定量pcr检测ms751细胞中上述两个基因,每组n=3;tukey多重比较检验,结果以平均值
±
sem表示,**p《0.01,***p《0.001,n,不显著;图10f-10g为western blot和dot blot分别对ddx24过表达(10f)和沉默(10g)的ms751细胞裂解液和上清液中的agrn和ddx24进行分析,以
gapdh和ponceau为对照,每组n=3,student’s t检验,结果以平均值
±
sem表示,*p《0.05;**p《0.01;***p《0.001。
具体实施方式
40.下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
41.本发明实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
42.实验过程
43.1、材料和方法
44.1.1、细胞培养
45.人cscc细胞系siha、ms751和人淋巴内皮细胞(hlec)购自美国型培养收藏公司(atcc,manassas,va,usa)。siha细胞在dulbecco改良的eagle培养基(dmem)中添加10%胎牛血清(life technologies,carlsbad,ca,usa)培养。ms751细胞在rpmi-1640培养基(life technologies,carlsbad,ca,usa)中生长,培养基中添加青霉素g(100u/ml)、链霉素(100mg/ml)和10%胎牛血清(fbs,life technologies)。人淋巴内皮细胞培养于内皮细胞培养基(ecm;添加5%胎牛血清(fbs;(生命科技)和内皮生长介质补充(生命科技)。本研究中所有细胞系在37℃、5%co2培养箱中培养。
46.1.2、实时定量pcr
47.用总rna试剂盒i(omega)提取细胞总rna。用nanodrop 2000(thermofisher,usa)测定总rna的浓度和质量。通过反转录pcr试剂盒(vazyme,china)将细胞mrna反转录为cdna,然后。使用sybr green master mix(vazyme,中国)和icycler thermocycle(bio-rad,美国)根据制造商的说明书进行qrt-pcr。
48.1.3、蛋白提取和western blot分析
49.用裂解缓冲液(beyotime biotechnology,中国)提取细胞蛋白,用bca试剂(beyotime biotechnology)测定蛋白总浓度。蛋白质在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)凝胶上分离,然后转移到聚偏氟乙烯(pvdf)膜上。用5%脱脂乳在tbst中室温封闭膜1小时,然后在4℃与一抗孵育过夜。用tbst洗膜3次,30min,室温下与相应的hrp二抗孵育1小时。最后,用tbst洗涤膜三次,30分钟,用supersignal
tm
west pico plus chemiluminescent substrate(thermo scientific
tm
,usa)检测蛋白信号。
50.1.4、组织标本及临床病理特征
51.组织芯片(tma)包含30对与癌旁组织匹配的cscc组织,45例随访数据来自中山大学附属第五医院cscc组织。病理证实为cscc。本研究经中山大学附属第五医院医学伦理委员会(2022-k108-1)批准,所有患者均提供知情同意。手术切除前患者未接受任何化疗或介入性治疗。
52.1.5、细胞迁移和侵袭实验
53.采用transwell实验评价肿瘤细胞的体外侵袭和迁移能力。transwell室
(corning,ny,usa)配备了8-μm孔嵌入用于这些测试。在迁移实验中,小室不包被基质,而在侵袭实验中小室包被100μl 1:8稀释的基质(bd biosciences,usa)。简单地说,用无血清培养基稀释后的细胞悬液(肿瘤细胞:5
×
10cells/well,hlec:4
×
10cells/well)100μl置于上室,下室加入10%fbs培养基。孵育24-48小时后,75%乙醇固定15分钟,0.1%结晶紫染色20分钟。最后,用棉签将上腔内未迁移的细胞取出,下腔内被侵袭的细胞拍照并计数,用image j进行计数。
54.1.6、质粒和小干扰rna的转染
55.ddx24过表达系统采用慢病毒感染系统,该系统购自上海genechem有限公司(中国上海)。用1μg/ml的聚苯乙烯慢病毒感染siha细胞。2周后用2μg/ml的puromycin筛选稳定的克隆。按照说明书使用lipofectamine 3000试剂(invitrogen,carlsbad,ca)进行质粒转染和sirna转染。本研究使用的质粒sirna由ribobio(广州,中国)设计合成。
56.1.7、生物信息学分析
57.根据gene expression omnibus(gene expression omnibus,geo)数据集(gse9750和gse7803)(见网址https://www.ncbi.nlm.nih.gov/geo)检测正常宫颈组织和宫颈鳞状细胞癌(cervical squamous cell cancer,cscc)组织中ddx24 mrna的表达。通过geo2r对两个数据库(gse9750和gse7803)的差异基因进行分析(网址https://www.ncbi.nlm.nih.gov/geo/geo2r/)。利用webgestalt对两个数据库(gse9750和gse7803)的差异基因进行基因集富集分析(gene set enrichment analysis)(网址http://www.webgestalt.org/)。两个细胞系(siha ddx24 ctrl vs siha ddx24 kd1)和ms751ddx24 ctrl vs ms751 ddx24 kd1)的基因集富集分析采用r.的fgsea包进行,两个细胞系的差异基因(|logfc|》0.5)的基因本体(go)分析采用r.的clusterprofiler包进行,venn图采用srplot(参见upl http://www.bioinformatics.com.cn/srplot)进行。
58.1.8、细胞划痕实验
59.简单地说,将hlecs接种在96孔板上,ecm培养基中含有5%的fbs。24小时后用scarificator(essen bioscience)刮拭细胞,pbs冲洗2次。细胞由incucyte(essen bioscience)在相衬条件下拍照。
60.1.9、动物实验
61.动物实验均经中山大学附属第五医院动物保护委员会(00084)批准。动物模型如前所述建立。简单来说,4周龄雌性balb/c裸鼠购自广州盐城生物科技有限公司。异氟醚麻醉小鼠,将siha细胞悬浮于0.03ml的pbs中,缓慢注入小鼠足底。30天后,小鼠腹腔注射150mg/ml荧光素钾盐(perkinelmer)进行体内成像,通过体内光谱成像系统(ivis)检测足部和转移淋巴结肿瘤。60d后切除原发肿瘤、腘窝淋巴结(pln)、腹股沟淋巴结(iln)并石蜡包埋。取连续5.0μm切片,进行免疫组化分析。未通过ihc检测到爪垫上有肿瘤的小鼠(即使ivis图像显示爪垫上有肿瘤)将被淘汰。pln和iln的体积计算公式如下:
62.volume=0.52
×
length
×
width263.1.10、免疫组化染色及评分
64.组织切片在65℃烘烤2小时,二甲苯脱蜡30分钟,然后用蒸馏水复水。将载玻片置于0.01m柠檬酸盐缓冲液(ph6.0)中微波炉加热10min进行抗原回收,3%过氧化氢阻断内源性过氧化物酶活性20min。随后,在室温下用10%山羊血清(中山生物)孵育30min,在4℃湿
室中与阻断血清稀释的一抗孵育过夜。加入0.1%tween-20的磷酸盐缓冲盐水(pbst)冲洗30分钟后,用二抗孵育1小时,用3,3'-二氨基联苯胺(dab,中山生物技术)染色。最后,切片用苏木精反染,脱水,然后按顺序用盖片固定。ddx24及agrn染色强度评分为:0(阴性)、1(弱)、2(中)、3(强)。阳性肿瘤细胞百分比评分分别为1(0-25%)、2(26-50%)、3(51-75%)、4(76-100%)。根据染色强度与阳性肿瘤细胞百分比的乘积计算各切片的免疫反应评分。
65.对于淋巴管密度(lvd),肿瘤内和瘤周的lvd由之前描述的方法确定。在所有病例中,lvd是通过在选定区域的5个密度最高的场中计算lyve-1阳性血管来确定的。瘤内和瘤周lvd分别定义为位于肿瘤内和位于肿瘤外但距肿瘤2mm以内的lvd。
66.1.11、统计分析
67.结果以平均值
±
均值标准误表示。所有统计分析均使用graphpad prism 5软件(graphpad software,inc.,la jolla,ca)进行。p《0.05认为显著,p《0.05、p《0.01和p《0.001分别表示为*、**和***。
68.1.12、伦理认可和同意参与
69.本工作经中山大学附属第五医院医学伦理委员会(2022-k108-1)批准完成。本研究小鼠按中山大学附属第五医院动物护理委员会(00084)批准的动物规范进行护理和处理。
70.2、结果分析
71.2.1、ddx24在淋巴结转移的cscc患者肿瘤组织中表达上调
72.为了调查cscc组织中基因表达情况,我们分析了gene expression omnibus数据库(geo,https://www.ncbi.nlm.nih.gov/geo/)中的两个数据集——gse9750(32个原发性cscc样本和21个正常宫颈上皮样本)和gse7803(21个浸润性宫颈鳞细胞癌和10个正常宫颈鳞状上皮样本)。使用差异表达基因(cscc vs.正常宫颈)进行基因集富集分析(gene set enrichment analysis,gsea)分析后发现cscc上调了解旋酶活性通路(图1a和图7a)。在cscc中升高的解旋酶中,dead-box rna解旋酶24(dead-box rna helicase24,ddx24)在cscc组织中显著上调,且研究最少(图1b和图7b,7c)。鉴于我们之前报道了ddx24与静脉和淋巴形成之间的联系,这促使我们研究ddx24在cscc淋巴转移中的作用。
73.为了进一步验证ddx24蛋白在cscc中的表达,我们采用免疫组化(ihc)染色检测75例cscc和55例相邻对照的组织芯片(tissue microarray,tma)。有趣的是,ddx24在有淋巴结转移的cscc组织中的表达高于相邻的正常组织和无淋巴结转移的组织(图1c)。此外,ddx24蛋白水平与cscc组织淋巴管密度正相关(图1d),与此相呼应的是,ddx24 mrna水平与lyve1 mrna水平正相关(图1e)。此外,kaplan-meier分析显示,ddx24表达增加的患者总生存期较短(图1f)。综上所述,这些数据表明ddx24表达与cscc淋巴结转移之间存在潜在联系。
74.2.2、ddx24在体外促进cscc细胞的迁移和侵袭
75.为了探究ddx24促进cscc转移的潜在作用,我们首先使用cscc细胞系进行了体外的研究。基于ddx24在不同宫颈癌细胞系中的基础表达(图8a),ms751和siha两株细胞系用于过表达和敲低ddx24实验。我们通过western blot和qrt-pcr验证了ddx24过表达及敲低效果(图2a,2b和图8b,8c),进一步实验发现过表达ddx24增强了cscc细胞侵袭迁移能力,而沉默ddx24则显著抑制了肿瘤细胞的侵袭迁移能力(图2c,2d和图8d,8e)。此外,我们分析了
ddx24在肿瘤细胞上皮-间充质转化(emt)过程中的作用,结果发现在ddx24过表达时上皮标记物e-cadherin的表达降低且间充质标记物如基质金属肽酶9(mmp9)、n-cadherin和slug表达升高(图2e)。相反,在cscc细胞中沉默ddx24会产生相反的结果(图2f)。以上结果提示,ddx24可能通过促进emt而促进cscc细胞的侵袭和迁移能力。
76.2.3、ddx24在cscc细胞中刺激体外淋巴管生成
77.除了癌细胞的emt,淋巴结转移的另一个关键因素是原发肿瘤病灶中的淋巴管生成。因此,我们评估了ddx24在cscc细胞中对淋巴内皮细胞功能的影响。与对照组相比,过表达ddx24的cscc细胞培养基(cm)可以明显促进人淋巴内皮细胞(hlecs)的增殖,而在cscc中沉默ddx24可以抑制hlecs的生长(图3a,3b)。此外,cscc中ddx24还可以正向调节hlecs的迁移和成管能力(图3c-3f和图9a-9d)。
78.为了进一步验证ddx24介导的淋巴管生成,我们评估了与表达不同水平ddx24的cscc细胞cm孵卵后hlecs中参与淋巴管生成的关键分子的变化,包括vegfr3、akt和erk1/2。正如预期的那样,在ddx24过表达siha细胞的cm刺激下,hlecs中vegfr3、磷酸化akt(p-akt)和磷酸化erk1/2(p-erk1/2)的水平上调(图3g)。当ddx24被抑制时,则得到相反的结果(图3h)。综上所述,这些数据表明,ddx24在cscc细胞中调节体外淋巴管生成。
79.2.4、细胞外基质蛋白agrn在cscc中受ddx24调控
80.为了进一步了解ddx24介导的hlecs与cscc细胞间的互作机制,我们首先检测了过表达或沉默ddx24的cscc细胞中血管内皮生长因子(vegf)家族蛋白的表达。然而,当ddx24过表达时,通过qrt-pcr或rna测序检测这些因子并无差异(图10a,10b)。为了进一步探究cscc细胞产生的促进淋巴管生成的因子,我们通过基因转录组测序分析了ddx24敲低后cscc转录组变化。gsea鉴定的ddx24沉默细胞系中变化最显著的通路是细胞外基质相关的通路,如细胞外基质结构成分通路(图4a和图10c)。为了进一步验证我们的结果,我们还进行了基因本体(go)分析(图10d)。成纤维细胞生长因子受体4(fgfr4)和细胞外基质蛋白agrin(agrn)显著改变(图4b、4c和图10e)。考虑到调控hlecs与cscc细胞间串扰并被cscc表达的分子更可能是配体,因此agrn被认为是最有希望的候选分子。
81.为证实ddx24对cscc细胞中agrn的调控作用,我们发现过表达ddx24时,细胞裂解液和上清液中的agrn蛋白水平升高,而缺乏ddx24时,细胞裂解液和上清液中的agrn蛋白水平降低(图4d,4e和图10f,10g),cscc细胞中对agrn的免疫荧光分析进一步证实了上述结果(图4f,4g),并且在mrna和蛋白水平上,agrn表达均与ddx24呈正相关(图4h-4j)。重要的是,agrn升高也与预后不良相关(图4k,4l)。以上结果表明,agrn是ddx24在cscc中的下游靶点。
82.2.5、ddx24通过agrn信号通路诱导cscc的淋巴管生成
83.接下来我们探讨cscc细胞中agrn的表达是否会影响淋巴管生成。通过western blot和dot blot证实成功构建agrn敲低的siha细胞系(图5a)。结果表明,肿瘤细胞敲低agrn后,上清可以抑制hlecs的增殖、迁移和管腔形成能力(图5b-5d)。随后,我们对cscc中agrn表达与淋巴管密度(lvd)的相关性进行评估。如图5e所示,cscc组织中agrn蛋白水平与lvd呈强相关,与之相呼应的是,agrn mrna水平与lyve1mrna水平呈正相关(图5f)。
84.为了进一步证实agrn位于ddx24的下游,我们在过表达ddx24的细胞中沉默agrn来评估淋巴管生成能力(图5g)。可以预期的是,ddx24诱导的hlecs增殖、迁移和成管能力的提高在agrn缺乏时基本被消除(图5h-5j)。综上所述,ddx24依赖于agrn诱导淋巴管生成。
85.2.6、ddx24可促进cscc体内淋巴转移
86.为了进一步验证ddx24在cscc淋巴转移中的作用,我们参照文献建立了裸鼠体内淋巴结转移模型。我们首先构建了一个强力霉素(dox)诱导的ddx24过表达siha细胞系,该细胞系携带荧光素酶报告基因。然后将这些细胞接种到裸鼠的脚垫中,通过体内成像系统(ivis;图6a,6b)接种2个月后的腘窝淋巴结(pln)和腹股沟淋巴结(iln)体积测量显示,过表达ddx24组的两个淋巴结均明显大于对照组(图6c-6e)。ihc分析证实了过表达ddx24的原发病变中上调了agrn和lyve1的表达(图6f-6h)。值得注意的是,agrn的表达和lvd的数量均与ddx24水平相关(图6i,6j)。综上所述,这些发现表明,ddx24/agrn轴在体内可促进cscc的淋巴转移。
87.本发明揭示了ddx24在促进cscc淋巴转移中的关键作用。ddx24表达升高与cscc患者预后差、淋巴结转移相关。ddx24的过表达增强了cscc细胞的侵袭、迁移和emt,并通过agrn信号通路促进淋巴管生成。我们进一步证实,在小鼠模型中,ddx24能够促进淋巴管生成和淋巴结转移。结果表明,ddx24为cscc的淋巴转移提供了有利的条件,揭示了恶性细胞与淋巴内皮之间的互作。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。