1.本发明涉及一种中药提取物,更具体的说涉及一种天麻粗多糖的制备方法及其在制备肠道保护及和免疫调节活性药物中的应用。
背景技术:
2.天麻(gastrodiaelatablme)作为一种传统中药,已经广泛地作为一种药物用于疾病的治疗中和作为一种食材用于日常饮食中。最近的研究表明,天麻在体外和体内均具有抗氧化、抗炎和神经保护作用。多糖是天麻的主要生物活性成分,然而,我们发现很少有关于天麻多糖体内免疫活性的研究报道。
3.近年来,开发天然多糖以保护肠道健康已成为研究热点。多糖具有增强免疫、抗氧化、抗肿瘤、抗炎和维持肠道健康等生理功能。食物来源的天然多糖已显示通过直接作用于免疫细胞、改善微生物群和促进短链脂肪酸的产生来调节免疫反应,包括从霍山石斛、冬虫夏草和枸杞中提取的多糖,可以刺激细胞因子的产生,改善肠黏膜屏障,促进产生短链脂肪酸的有益微生物的增殖。
技术实现要素:
4.因此,本发明旨在通过研究天麻多糖对ctx诱导的小鼠免疫抑制和肠道损伤的保护作用。采用16s-rdna测序来探索天麻多糖对肠道微生物群的调节作用。证明了天麻多糖的免疫调节和肠上皮保护作用,解决了天麻多糖在开发为新型潜在的益生元和免疫调节剂的技术问题。
5.其中,天麻粗多糖的制备方法,包括以下步骤:
6.1)称取天麻药材饮片,分别用重量10倍量水85
±
5℃温浸提取3次,每次2h,合并滤液并过滤,得到提取液;
7.2)60℃条件下减压浓缩提取液至密度为1.03~1.08的浸膏;
8.3),浸膏加水溶解然后,加入乙醇使混合溶液的醇浓度为70%,0~4℃冷藏12h,过滤,收集上清液,保留沉淀;
9.4)上清液回收乙醇至无醇味,再加入乙醇使混合溶液的醇浓度为70%,0~4℃冷藏12h,过滤,保留沉淀
10.5)保留合并步骤3)和步骤4)的沉淀,冷冻干燥成粉末,即得天麻粗多糖。
11.所述的天麻粗多糖在制备肠道保护药物中的应用。
12.所述的天麻粗多糖在制备天麻多糖在缓解肠道黏膜损伤药物中的应用。
13.所述的天麻粗多糖在制备天麻多糖在修复肠道屏障损伤药物中的应用。
14.所述的天麻粗多糖在制备免疫调节活性药物中的应用。
15.所述的天麻粗多糖在制备逆转免疫器官指数降低药物中的应用。
16.所述的天麻粗多糖在制备促进血清中iga、igg和igm的产生改善免疫抑制药物中
的应用。
17.所述的天麻粗多糖在制备通过促进细胞因子的产生改善免疫抑制药物中的应用。
18.所述的天麻粗多糖在制备对肠道菌群调节作用的药物中的应用。
19.所述的天麻粗多糖在制备促进肠道细菌代谢短链脂肪酸的药物中的应用。
20.本发明的有益技术效果是:本发明提供的天麻多糖对ctx诱导的小鼠肠道屏障损伤和免疫抑制的保护作用。其中,天麻多糖在改善保护免疫器官和增强免疫得效果,增强肠道健康是天麻多糖调节宿主免疫反应的关键途径,其能够有效恢复受损的黏膜完整性。
21.同时,本发明提供的天麻多糖是被肠道菌群发酵成scfas后作为必需的营养来源,可用于维持肠道稳态,对改善慢性炎症性疾病、保护肠黏膜、促进结肠细胞健康具有重要意义。另外,本发明提供的天麻多糖可以通过刺激特定肠道细菌的数量和活性来缓解肝损伤。
附图说明
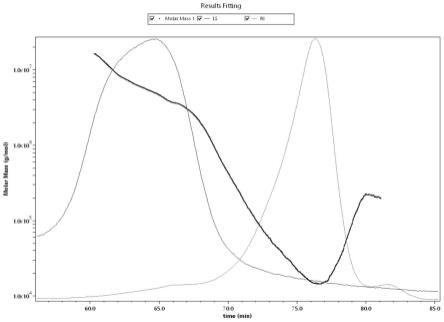
22.图1天麻粗多糖绝对分子量分析图;
23.图2天麻粗多糖分子构型图;
24.图3标准样品离子色谱图;
25.图4样品离子色谱图;
26.图5天麻多糖对免疫抑制小鼠肠粘膜形态的影响;
27.图6天麻多糖对结肠超微结构的影响;
28.图7天麻多糖对免疫抑制小鼠免疫器官指数的影响;
29.图8天麻多糖对免疫抑制小鼠血清中iga、igg和igm的影响;
30.图9天麻多糖对免疫抑制小鼠血清中il-2、il-4、il-10、tnf-α和ifn-γ的影响;
31.图10门水平上不同组别小鼠含量前10位的菌群物种相对丰度;
32.图11天麻多糖对小鼠粪便中scfas的影响;
33.其中;附图1中,图注:以检测的保留时间(time,min)为横坐标,以摩尔质量molarmass(g/mol)为纵坐标;分子构型图以摩尔质量(molarmass,g/mol)为横坐标,以均方根半径(r.m.s.radius,nm)为纵坐标;红线—多角度激光光散射信号;蓝线—示差信号;黑线—由两种信号拟合出的样品信号;
34.附图2中,以log(molarmass)为横坐标,以log(r.m.s.radius)为纵坐标,其斜率可以作为分子构型的参考;
35.附图4中,样品计算结果:样品中各组分含量(ug/mg)=c*v*f/m;其中c为仪器读取浓度,单位ug/ml;v为样品提取液体积,单位ml;f为稀释因子;m为样品称取总量,单位mg。
36.附图5中(结肠组织切片的he染色,100
×
;
37.附图7中,a:小鼠胸腺指数;b:小鼠脾脏指数。n=6,*p《0.05,**p《0.01,***p《0.001与模型组相比;#p《0.05,##p《0.01,###p《0.001,####p《0.0001与空白组相比;
△
p《0.05与阳性药物组相比;
38.附图8中,a:血清中iga含量;b:血清中igg含量;c:血清中igm含量。n=6,*p《0.05,**p《0.01,***p《0.001与模型组相比;#p《0.05,##p《0.01,###p《0.001与空白组相比;
39.附图9中,a:血清中il-2含量;b:血清中il-4含量;c:血清中il-10含量;d:血清中
tnf-α含量;e:血清中ifn-γ含量。n=6,*p《0.05,**p《0.01,***p《0.001 与模型组相比;#p《0.05,##p《0.01,###p《0.001与空白组相比;
40.附图10中,control:空白组;model:模型组;low:低剂量多糖组;high:高剂量多糖组;
41.附图11中,1-空白组、2-模型组、3-低剂量多糖组、4-高剂量多糖组,通过gc-ms方法检测到不同组小鼠粪便中scfa的确切含量,从左至右检测指标分别乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸。*p《0.05,**p《0.01,***p《0.001与模型组相比;#p《0.05,##p《0.01,###p《0.001与空白组相比;
△
p《0.05与低剂量天麻多糖组相比。
具体实施方式
42.实施例1天麻多糖的制备
43.1、样品制备:
44.鲜天麻采挖后,及时清洗,置沸水中煮5min,沥干,75℃鼓风干燥8h,置通风干燥处堆放回潮24h;再50℃鼓风干燥12h,再置通风干燥处堆放回潮24h;重复上述干燥-回潮工艺 4次,即得天麻药材饮片。上述天麻药材饮片,精密称定,加药材重量10倍量85
±
5℃温浸水提取3次,2h/次,过滤,合并滤液,浓缩至相当密度:1.03~1.08,60℃,加入乙醇使混合溶液的醇浓度为70%,0~4℃冷藏12h,过滤,保留沉淀;上清液回收乙醇至无醇味,再加入乙醇使混合溶液的醇浓度为70%,0~4℃冷藏12h,过滤,保留合并2次沉淀,冷冻干燥成粉末,即得天麻粗多糖样品。
45.2、样品检测:
46.取干净的色谱瓶,精确称量天麻粗多糖样品(冻干粉)5mg(
±
0.05mg),加入1ml 2mtfa酸溶液,121℃加热2小时。通氮气,吹干。加入甲醇清洗,再吹干,重复甲醇清洗2-3 次。加入无菌水溶解,转入色谱瓶中待测。
47.色谱系统采用的是thermo ics5000离子色谱系统(ics5000,thermo fisher scientific, usa),利用电化学检测器对单糖组分进行分析检测。
48.采用dionex
tm carbopac
tm pa20(150*3.0mm,10um)液相色谱柱;进样量为5ul。流动相a(0.1m naoh),流动相b(0.1m naoh,0.2m naac),流速0.5ml/min;柱温为30℃;洗脱梯度:0min a相/b相(95:5v/v),30min a相/b相(80:20v/v),30.1min a相/b相 (60:40v/v),45min a相/b相(60:40v/v),45.1min a相/b相(95:5v/v),60min a 相/b相(95:5v/v)。
49.采用凝胶色谱-示差-多角度激光光散射系统对天麻粗多糖进行分子量的定性定量评价,得到绝对分子量分析图。
50.从绝对分子量分析图可以看出,天麻粗多糖属于不均一性多糖。由分子构型图可推测,该不均一性多糖可能为分子量较大的较致密的球状构型。经测定与计算,其平均分子量为mw (kda)292.596,uncertainty不确定度为:0.02037。结果如图1、图2所示。
51.利用软件chromeleon处理色谱数据。下图3、图4所示为标准样品离子色谱图和样品离子色谱图,横坐标为检测的保留时间(time,min),纵坐标为离子检测的响应值(response,nc)。结果表1所示。
52.表1天麻多糖成分含量
[0053][0054]
实施例2天麻多糖的活性测定
[0055]
1、实验方法的建立
[0056]
1.1实验动物和药物处理
[0057]
30只spf级balb/c雄性小鼠(8周龄,22~26g体重),由湖南斯莱克景达实验动物有限公司提供,动物生产许可证号:scxk(湘)2019-0004。实验动物饲养及组织取材均于重庆市中药研究院实验动物研究所实验设施内进行(syxk(渝)2017-0003)。
[0058]
将小鼠适应性饲养1后随机均分为5组,每组6只,包括:空白组、模型组、阳性药物组(盐酸左旋咪唑20mg/kg)、低剂量多糖组(天麻多糖200mg/kg)和高剂量多糖组(天麻多糖400mg/kg)。阳性药物组、低剂量多糖组、高剂量多糖组小鼠灌胃相应药物,给药体积为 1ml/20g,对照组和模型组小鼠灌胃等量蒸馏水,连续灌胃21天。在灌胃第18天,模型组、阳性药物组、低剂量多糖组和高剂量多糖组腹腔注射环磷酰50mg/kg,连续给药4天进行造模,同时,空白组腹腔注射等量生理盐水。末次造模及给药后,禁食不禁水3h,分别接取小鼠粪便,置于-80℃保存,用于肠道菌群和scfas分析。在末次给药12h后麻醉处死小鼠,收集血液,于3500rmp离心10min,取上层血清用于测定血清细胞因子。取小鼠结肠组织均分为3部分,1/3置于-80℃冰箱保存备用,1/3置于于2.5%戊二醛固定液(电镜专用)进行固定,其余部分置于4%多聚甲醛固定进行固定。所有动物实验均严格按照伦理准则进行,并经重庆市中药研究院实验动物福利伦理审查委员会批准。
[0059]
1.2苏木素-伊红染色(he)检测小鼠结肠组织病理学改变情况
[0060]
将经4%多聚甲醛固定的小鼠结肠组织取出,乙醇脱水处理、二甲苯脱醇、石蜡包埋,然后将肝组织在切片机上制备成4μm的肝脏病理切片。按标准步骤对各组小鼠结肠组织切片进行he染色,中性树脂封片后在光学显微镜下观察肝脏的病理变化。最后用中性树胶封片,并在光学显微镜下观察并拍照。
[0061]
1.3扫描电子显微镜检测小鼠结肠上皮超微结构改变情况
[0062]
小鼠结肠组织在4℃下用2.5%戊二醛固定过夜后,用0.1m pbs洗涤3次;用1%锇酸固定1h后,用蒸馏水洗涤;用梯度乙醇处理样品,并用纯丙酮脱水,在树脂中包埋过夜并在 70℃下聚合;将组织切成薄片并用醋酸铀和柠檬酸铅染色后用扫描电子显微镜(sem)观察。
[0063]
1.4小鼠脏器重量和脏器系数
[0064]
每组小鼠在实验结束时称重,并剖解后分别取出脾脏和胸腺并称重,脏器系数的计算公式如下:脏器系数(mg/g)=器官湿重(mg)/小鼠体重(g)。
[0065]
1.4.1elisa法检测血清iga、igg和igm变化情况
[0066]
使用elisa法测定肝脏组织中血清iga、igg和igm水平,操作方法按试剂盒说明书执行,使用酶标仪测吸光度后,根据标准曲线和样品稀释倍数计算出相应的各项指标数据。
[0067]
1.4.2粪便的基因组dna提取和16s-rdna测序分析
[0068]
通过dna提取试剂进行粪便基因组dna的提取,采用nanodrop对dna进行定量,并通过1%琼脂糖凝胶电泳检测。通过上游引物338f:5'-actcctacgggaggcagcag-3'和下游引物806r:5'-ggactachvgggtwtctaat-3'扩增细菌16s v3-v4区作为引物对应区域,pcr扩增后通过axyprep dna gel recovery试剂盒纯化,并通过quantus
tm fluorometer 对pcr产物开展定量检测,依据样本测序量情况对其进行混合。使用nextflex rapiddna-seq kit进行建库,并通过illumina miseq pe300平台进行测序。分别用fastp软件和 flash软件开展拼接和质量控制,以对原始序列进行数据优化处理,使用uparse软件开展otu聚类的序列分析,相似度为97%。用rdp classifier软件开展物种分类的注释,对数据库进行比对,其比对阔值为70%。使用百迈客云平台工具对物种丰度差异分析,包括根据 otu的丰度分析alpha-diversity和beta-diversity,分析了门和属水平上优势细菌的相对丰度。
[0069]
1.4.3短链脂肪酸(scfas)检测
[0070]
取150mg粪便样本于2ml ep管中,加入1ml纯水,涡旋10秒;加入钢珠,40hz研磨仪处理4min,超声5min(冰水浴),重复3次;将样本4℃离心,5000rpm离心20min;移取 0.8ml上清液于2ml ep管中;加入0.1ml 50%h2so4,加入0.8ml提取液(含内标2-甲基戊酸,25mg/l,甲基叔丁基醚),涡旋10s,振荡10min,超声10min(冰水浴),在将样本4℃离心,10000rpm离心15min;-20℃静置30min;取出上清于进样瓶中,使用岛津gc2030-qp2020 nx气相色谱质谱联用仪进行gc-ms检测,通过标准曲线计算scfas含量。
[0071]
1.4.4数据分析
[0072]
所有数据均以均数
±
标准差(mean
±
sd)表示,使用graphpad prism 8.0.1软件对数据进行统计分析及作图,采用student’s t-test检验比较两组间的差异,p《0.05表示差异具有统计学意义。
[0073]
2、实验结果
[0074]
2.1天麻多糖对小鼠肠道病理损伤的影响
[0075]
ctx治疗诱导的肠黏膜损伤可导致肠隐窝细胞凋亡,导致绒毛高度和隐窝深度降低。为了研究天麻多糖对肠道黏膜的保护作用,我们对小鼠结肠组织进行了he分析。结果如图 4所示,对照组小鼠结肠组织学形态正常,绒毛细而完整,排列整齐。相比之下,模型组肠黏膜损伤严重,绒毛萎缩,隐窝较浅,结构较疏松。这些现象在天麻多糖和阳性药物(盐酸左旋咪唑)处理的小鼠中得到缓解,绒毛被拉长且排列紧密。结果表明,天麻多糖可有效缓解ctx所致小鼠肠道黏膜损伤。结果如图5所示。
[0076]
2.2天麻多糖对小鼠肠道肠屏障的影响
[0077]
使用扫描电子显微镜对小鼠结肠上皮超微结构进行观察,结果如图5所示,空白组微绒毛排列整齐,形状大小一致,紧密连接,空隙较少。与空白组相比,模型组肠道微高度不一致,表面凹凸不平,微绒毛分布不规则,部分微绒毛缺损,塌陷萎缩。阳性药物组、低剂量和高剂量天麻多糖组的微绒毛比较平坦,间隙小,整体比较平坦。结果表明,天麻多糖可以修复ctx对小鼠的肠道屏障的损伤。结果如图6所示。
[0078]
2.3天麻多糖对免疫器官指数的影响
[0079]
天麻多糖对ctx诱导的小鼠胸腺和脾脏器官指数的影响如图7所示。与空白组相比,模型组小鼠经ctx处理后胸腺指数和脾脏指数显著下降(p《0.01,p《0.0001),表明ctx 对模型组小鼠的胸腺和脾脏造成了严重损伤。阳性药物组(盐酸左旋咪唑)和天麻多糖给药
后,小鼠脾脏和胸腺指数均有不同程度的恢复,表明它们缓解了ctx引起的免疫损伤。此外,与阳性药物组相比,高剂量天麻多糖能够更显著地改善ctx引起的脾脏损伤(p《0.05)。这些研究结果表明,天麻多糖可以显著逆转ctx引起的小鼠免疫器官指数的降低。
[0080]
2.4天麻多糖对血清中iga、igg和igm水平的影响
[0081]
通过测量血清中免疫球蛋白(iga、igg和igm)的水平来观察天麻多糖对小鼠的免疫调节作用,结果如图8所示,模型组小鼠血清中iga、igg和igm水平均显著低于空白对照组(p《0.05),提示ctx具有对免疫活性的抑制作用。与模型组相比,阳性药物组和天麻多糖高低剂量组均明显逆转这一现象(p《0.05)。结果表明,天麻多糖可以通过促进血清中iga、 igg和igm的产生来改善ctx诱导的免疫抑制。
[0082]
2.5天麻多糖对血清中细胞因子il-2、il-4、il-10、tnf-α和ifn-γ水平的影响
[0083]
通过测量血清中细胞因子的水平来观察天麻多糖对ctx抑制小鼠免疫活性的改善作用。如图9所示,模型组血清中il-2、il-4、il-10、tnf-α、ifn-γ水平显著低于空白组(p《 0.05,p《0.01,p《0.001),明确ctx具有对免疫活性的抑制作用。与模型组相比,阳性药物组、天麻多糖低剂量和高剂量组中的抑制现象明显改善。其中,天麻高剂量组血清il-2、 il-4、il-10、tnf-α和ifn-γ水平均显著高于模型组(p《0.05,p《0.01,p《0.001)。il-10 水平在阳性药物组和天麻低剂量多糖组中升高,但无显着差异。结果表明,天麻多糖可以通过促进细胞因子的产生来改善ctx诱导的免疫抑制。
[0084]
2.6天麻多糖对ctx诱导小鼠肠道菌群失调的影响
[0085]
为明确天麻多糖对肠道菌群的调节作用,我们对小鼠粪便细菌dna的16s-rdna进行了高通量基因测序及分析。根据聚类otus代表序列注释信息,将所有样本中相对丰度前10 位的物种绘制成累加柱形图进行展示,结果如图10所示,在门(phylum)水平上,与对照组和模型组比较,天麻多糖低剂量组和高剂量组小鼠肠道内的有益菌拟杆菌门 (bacteroidetes)相对丰度上升,有害菌厚壁菌门(firmicutes)有下降趋势。结果表明ctx 降低了小鼠粪便中微生物群的丰富度,而天麻多糖则对肠道微生物群具有调节作用,并能够增加有益菌群的丰富度,降低有害菌群的丰度。
[0086]
2.7天麻多糖对scfas生产的影响
[0087]
短链脂肪酸(scfas)是肠道中重要的细菌代谢物,主要由乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸组成。为了评估天麻粗多糖对微生物群产生scfas的影响,我们通过靶向代谢组学测定确定不同组小鼠粪便中乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸的含量,结果如从图11所示。与模型组相比,低剂量天麻粗多糖组可显著增加乙酸、丙酸、异丁酸、丁酸和戊酸的含量(p《0.05),高剂量天麻粗多糖组可显著增加乙酸、丙酸和戊酸的含量(p《 0.05);同时,在低剂量天麻粗多糖组和高剂量天麻粗多糖组之间,除丁酸的含量有显著差异外,其他scfas在两组之间没有显著差异。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。