1.本发明涉及成分,特别是甜味成分,例如用于减糖、低糖或零糖饮料或食品产品的成分。更具体地,本发明涉及源自植物浸液,特别是甜菊(例如甜叶菊(stevia rebaudiana))浸液的成分。
背景技术:
2.南美植物甜叶菊以其甜味的叶而闻名。所述甜味来自甜菊植物中的天然化合物,称为甜菊醇糖苷。然而,甜菊也有苦味,有类似甘草的香气,有时还有金属味和涩味。甜菊的这些其它感官属性是不受欢迎的,并限制了其作为天然形式的甜味成分的用途。
3.先前已开发出源自或基于甜菊的甜味成分和添加剂。许多源自甜菊的甜味剂的一个问题是它们仍倾向于具有甘草余味,就其在软饮料中的味道而言,这对许多消费者来说是不受欢迎的。与甜菊来源的甜味剂相关的另一个问题是它们的味道在舌头上停留的时间比消费者习惯的糖时间分布更长。这意味着使用这些甜味剂的应用和市场规模相当有限。
4.解决甜菊天然味道局限性的一般方法是萃取、分离和/或浓缩负责甜味的化合物,即甜菊醇糖苷。这些化合物是许多甜味剂的主要成分(或前体),所述甜味剂以通用名称
‘
甜菊’和几个商品名销售。在甜叶菊叶中发现了超过50种甜菊醇糖苷,包括甜菊苷、甜菊醇二糖苷、杜克苷(dulcoside)a和许多莱鲍迪苷(rebaudioside)。据报道,来自甜叶菊的甜菊醇糖苷比蔗糖甜30至350倍。它们是热稳定的、ph稳定的,并且通常被描述为不可发酵的(参见例如journal of medicinal plants research;第7(46)卷,第3343-3353页,2013年12月10日)。另外,它们在摄入时不会引起血糖反应,因为人类不能代谢甜菊醇糖苷,这使得它们作为天然糖替代品对于糖尿病患者和其它食用碳水化合物受控饮食的人具有吸引力(参见例如s.m.savita等(2004),journal of human ecology,第15(4)卷,第261-264页)。甜菊醇糖苷和相关的甜味分子(例如二萜和三萜甜味分子,例如甜叶苷(suavioside)和罗汉果苷)也存在于相关物种,例如全缘叶甜菊(stevia phlebophylla)中;植物掌叶悬钩子(rubus chingii)(蔷薇科)和甜茶(rubus suavissimus)(中国黑莓)中;以及葫芦藤、罗汉果(siraitia grosvenorii)或罗汉果(monk fruit)的果实中。
5.在典型的甜菊叶中,高达95%以上的甜菊醇糖苷含有1-4个葡萄糖单元。更高糖基化的甜菊醇糖苷(>4个葡萄糖单位)具有改善的味道,但仅以非常低的浓度存在,并且因此显著更昂贵。鉴于所用的大量溶剂和必需的纯化步骤数量,目前用于分离这些糖基化程度更高的糖苷的溶剂萃取并不理想。许多公司利用酶对甜菊萃取物进行糖基化。然而,酶促糖基化的甜菊醇糖苷在欧盟并未获准作为甜味剂,并且获得监管部门批准用于食品并非易事。另一种方法是使用重组(即转基因)微生物,如细菌和酵母来产生所需的甜菊醇糖苷化合物。然而,许多消费者宁愿避免涉及使用转基因生物的产品,所以这也不理想。
6.因此,需要基于甜菊的具有卓越的味道凭证、更广泛的消费者吸引力和更大的实用性的替代性天然甜味成分。本发明是根据这些考虑而设计的。
技术实现要素:
7.本发明人针对此问题设计了一种新颖和创造性的方法,所述方法专注于作为天然植物成分的甜菊本身,并使用天然工艺来改变和改善其风味,且因此增加其作为甜味剂的效用。这与目前在其它地方采用的大多数方法形成鲜明对比,所述方法基于从甜菊植物中萃取或分离特定化合物,或以合成方式产生那些化合物。
8.因此,本发明提供了一种基于发酵的甜菊浸液的天然成分。在一些方面,本发明提供了一种天然成分,其包含发酵的甜菊浸液。
9.本发明的成分具有因发酵而改变(改善)的味道和感官特征(即,当与未发酵的甜菊浸液相比时)。例如,不受欢迎的风味化合物,包括导致苦甘草调和/或木质调和/或青味、草味、
‘
茶样’风味的化合物可减少或不存在。此外,在一些实施方案中,某些风味化合物可在发酵的浸液中存在、富集或增强,其有助于改善味道。
10.在一个方面,本发明提供了一种例如用于食物或饮料的成分,即甜味成分,其包含发酵的甜菊浸液,其中所述浸液已使用优选为酵母或细菌或其组合的微生物进行发酵。
11.在这些方面,酵母和/或细菌可例如通过筛选工艺进行选择,以便在最终(发酵)产品中产生预定的感官和/或味道特征。
12.在另一方面,本发明提供一种基于发酵的甜菊浸液的成分,其中发酵的浸液能够通过使甜菊(例如鲜甜菊叶或干甜菊叶)与水接触并加热以产生浸液,接着使发酵微生物与所述浸液直接接触(例如通过直接向所述浸液中添加发酵微生物)来获得。
13.在另一方面,本发明提供一种例如用于食物或饮料的成分,即甜味成分,其包含发酵的甜菊浸液,其中发酵的浸液通过使甜菊(例如鲜甜菊叶或干甜菊叶)与水接触并任选地加热以产生浸液,接着使发酵微生物与所述浸液直接接触(例如通过直接向所述浸液中添加发酵微生物)来制备。
14.在另一方面,本发明提供了一种基于发酵的甜菊浸液的成分,其中所述浸液已使用至少两种不同微生物的组合进行发酵。在一些实施方案中,已使用至少一种酵母和至少一种细菌的组合发酵了浸液。
15.本发明的另一方面是一种成分,例如甜味成分,其包含水溶液中的甜菊醇糖苷并具有如本文所述的物理化学特性,例如ph、光密度、乳酸和乙酸含量。
16.在另一方面,还提供了一种固体成分,例如甜味成分,其通过或能够通过干燥本文所述的成分获得。在一些实施方案中,可将固体成分配制成例如粒状甜味剂或甜味片剂。
17.在一个方面,本发明提供了一种制备成分,即甜味成分的工艺,所述工艺包括使甜菊(例如鲜甜菊叶或干甜菊叶)与水接触并加热以产生浸液,接着使发酵微生物直接与所述浸液接触(例如通过直接向所述浸液中添加发酵微生物)。
18.例如,所述工艺可包括以下步骤:
19.(a)使甜菊(例如切割、天然或干燥的甜菊叶)与水接触,优选加热至40-90℃的温度,或在40-80℃的温度下,或在50-70℃的温度下,以产生浸液;
20.(b)(任选地)向浸液中添加碳水化合物原料,优选糖;
21.(c)(任选地)过滤浸液以去除剩余的甜菊;
22.(d)使浸液与发酵微生物接触,例如通过向浸液中添加发酵微生物;
23.(e)在适合微生物的条件下发酵浸液;以及
24.(f)(任选地)过滤发酵的浸液以去除微生物。
25.本发明还提供了可使用本文所述的工艺获得的成分。还提供了使用如本文所述的工艺获得的成分。
26.在本发明的产品和工艺的一些实施方案中,用于发酵浸液的微生物是或包含酵母,例如酵母科的酵母。在一些实施方案中,用于发酵的微生物是选自以下的酵母:酿酒酵母(saccharomyces cerevisiae)、乳酸克鲁维酵母(kluyveromyces lactis)、马克斯克鲁维酵母(kluyveromyces marxianus)、鲁氏接合酵母(zygosaccharomyces rouxii)、膜醭毕赤酵母(pichia membranifaciens)、杰丁塞伯林德纳氏酵母(cyberlindnera jadinii)如季也蒙迈耶氏酵母(meyerozyma guilliermondii)。
27.在本发明的产品和工艺的一些实施方案中,用于发酵浸液的微生物是或包含细菌,例如产乳酸细菌。
28.在一些实施方案中,多于一种微生物用于发酵。例如,两种或更多种酵母的组合、两种或更多种细菌的组合、或一种或多种酵母与一种或多种细菌的组合。在这些实施方案中,用多于一种微生物进行的发酵可依序或同时进行。
29.在一些实施方案中,用于发酵的微生物包含一种或多种酵母与一种或多种细菌的组合,其中所述酵母优选选自乳酸克鲁维酵母、马克斯克鲁维酵母、鲁氏接合酵母、膜醭毕赤酵母、杰丁塞伯林德纳氏酵母和季也蒙迈耶氏酵母,且其中所述细菌优选为乳杆菌属,并且更优选选自德氏乳杆菌(lactobacillus delbrueckii)、食果糖乳杆菌(lactobacillus fructivorans)和嗜酸乳杆菌(lactobacillus acidophilus)。
30.在另一方面,本发明提供如本文所述的甜味成分在生产食品或饮料产品中的用途。还提供了一种食品或饮料产品,优选减糖、低糖或无糖食品或饮料产品,其包含如本文所述的甜味成分。
31.本发明明确包括本文所述的方面和优选特征的任何组合,除非这种组合是明显不允许的或明确避免的。
附图说明
32.现在将参考以下附图论述说明本发明的原理的实施方案和实验:
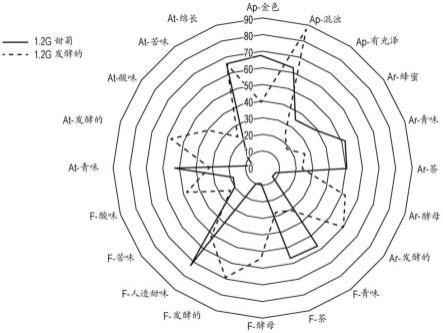
33.图1.根据本发明制备的发酵的甜菊浸液的感官特征(参见实施例2;使用酿酒酵母酵母发酵2天的不同浓度的甜菊浸液)。将结果与未发酵的甜菊浸液进行比较。评估的形态包括外观(ap)、香气(ar)、风味(f)、余味(at)。图1a显示了1.2g/l甜菊的特征(未发酵与发酵);图1b显示了5g/l甜菊的特征(未发酵与发酵);图1c显示了10g/l甜菊的特征(未发酵与发酵)。
34.图2.a,“发酵样品”(灰色)相对于“未发酵对照”(黑色)(实施例7,表1,样品10,hplc方法i)的y轴上的强度随x轴上的时间变化的基峰色谱图(bpc);b,在目标峰(用箭头标记)的洗脱时间处的ms谱(y轴上的强度随x轴上的m/z变化);b1,ms谱峰(rt 13min);b2,ms谱峰(rt 22,5min)。
35.图3.a,“发酵样品”(灰色)相对于“未发酵对照”(黑色)(实施例7,表1,样品07,hplc方法i)的y轴上的强度随x轴上的时间变化的基峰色谱图(bpc);b,在目标峰(用箭头标记)的洗脱时间处的ms谱(y轴上的强度随x轴上的m/z变化);b1,ms谱峰(rt 13min);b2,ms
谱峰(rt 22,5min)。
36.图4.a,“发酵样品”(灰色)相对于“未发酵对照”(黑色)(实施例7,表2,样品05_06,hplc方法i)的y轴上的强度随x轴上的时间变化的基峰色谱图(bpc);b,在目标峰(用箭头标记)的洗脱时间处的ms谱(y轴上的强度随x轴上的m/z变化);b1,ms谱峰(rt 13min);b2,ms谱峰(rt 22,5min)。
37.图5.a,“发酵样品”(灰色)相对于“未发酵对照”(黑色)(实施例7,表2,样品07_08,hplc方法i)的y轴上的强度随x轴上的时间变化的基峰色谱图(bpc);b,在目标峰(用箭头标记)的洗脱时间处的ms谱(y轴上的强度随x轴上的m/z变化);b1,ms谱峰(rt 13min);b2,ms谱峰(rt 22,5min)。
38.图6.a,“发酵样品”(灰色)相对于“未发酵对照”(黑色)(实施例7,表1,样品19,hplc方法i)的y轴上的强度随x轴上的时间变化的基峰色谱图(bpc);b,在目标峰(用箭头标记)的洗脱时间处的ms谱(y轴上的强度随x轴上的m/z变化);b1,ms谱峰(rt 13min);b2,ms谱峰(rt 22,5min)。
39.图7.根据本发明制备的发酵的甜菊浸液的完整感官特征(训练有素的小组)。参见实施例7;表1;样品10(虚线)和19(虚线)。将结果与未发酵的参考样品(参考;实线)进行比较。评估的形态包括外观(ap)、香气(ar)、风味(f)、口感(mf)、余味(at)。加框属性显示95%置信度下的统计显著差异。
40.图8.a,“发酵样品”(灰色)相对于“未发酵对照”(黑色)(实施例7b,样品s015b;hplc方法ii)的y轴上的强度随x轴上的时间变化的基峰色谱图(bpc);b,在甜茶苷标准峰(用箭头标记)的洗脱时间处的ms谱(y轴上的强度随x轴上的m/z变化)。
41.图9.酥饼品尝的感官结果。外观、整体风味、甜度、苦度、整体质地、脆度和绵长余味(at)属性的结果显示于蜘蛛图中。比较了酥饼a(全糖)、b(半糖 本发明的发酵的甜菊浸液)、c(半糖 未发酵的甜菊浸液)和d(半糖 reb a)。
42.图10.示例性甜菊浸液步骤,使用连续流柱。甜菊(8kg)在柱中用热水(80℃)(初始体积65l)覆盖。在初始浸泡步骤(约15分钟)和随后的洗脱步骤中连续添加更多的水,在所述洗脱步骤中打开柱底部的阀门以流出浸液(在另外约35分钟内)。使用的热水总体积=130l。总浸液时间=50分钟。收集的最终浸液体积=80l。
具体实施方式
43.现在将参考附图论述本发明的方面和实施方案。另外的方面和实施方案对于本领域技术人员来说将显而易见。此文本中提及的所有文档均以引用方式并入本文中。
44.本文描述一种成分,例如一种甜味成分,其基于或包含发酵的甜菊浸液。
45.如本文所用,术语
‘
甜菊’主要是指来自甜菊(即甜叶菊)的植物材料。替代植物材料可包括来自相关植物的那些,所述植物包括但不限于全缘叶甜菊、掌叶悬钩子(蔷薇科)、甜茶(中国黑莓)和罗汉果(siraitia grosvenorii)。除非另有说明,否则本文所用的术语
‘
甜菊’明确包括这些相关植物(即,包含二萜和三萜甜味化合物的植物,例如甜菊醇糖苷、罗汉果苷和甜叶苷)。植物材料包括但不限于叶、树皮、藤蔓、茎、种子、豆、坚果、汁液、油、奶、芽、果实、浆果、根和/或花。在优选实施方案中,植物材料包括叶。在一些实施方案中,植物材料可包括废植物材料,例如果渣,其包括皮、果肉、种子或茎或废叶。植物材料可包括新
鲜植物材料(例如鲜叶)或干燥植物材料(例如干叶)。必要时可将其切割或切碎,或整片使用(例如整片叶)。适用于本发明的甜菊植物材料的制品(例如干甜菊叶)易于从例如商业来源获得。
46.在一些实施方案中,本发明的工艺和产品中所用的甜菊包括甜菊叶。
47.在一些实施方案中,本发明的工艺和产品中所用的甜菊包括干甜菊(例如干甜菊叶)。干甜菊是已从其中去除水的甜菊植物材料(例如叶),例如使用本领域已知的方法(例如空气干燥、对流干燥、冷冻干燥)。如本文所用,干叶可与在特定条件(固化工艺)下处理的固化叶区分开来,所述特定条件可去除水但也对植物材料本身进行化学改性。在本发明的一些实施方案中,所提供的甜菊植物材料在使用前没有经过化学处理(例如通过固化)。
48.在一些实施方案中,本发明的工艺和产品中所用的甜菊包括未固化的甜菊叶。在一些实施方案中,本发明的工艺和产品中所用的甜菊包括干燥、未固化的甜菊叶。
49.在一些实施方案中,本发明的工艺和产品中所用的甜菊包括切割的甜菊,例如切割的甜菊叶。优选地,使用刀片或刀(而不是例如网或研磨机)进行切割。优选地,不要把叶切得太细。不希望受理论束缚,在一些实施方案中,可能优选避免甜菊的过细颗粒(例如粉尘或粉末)。优选地,本发明的工艺和产品中使用的甜菊未被磨碎、粉化或粉碎。
50.在一些实施方案中,本发明的工艺和产品中所用的甜菊包括切割的甜菊叶。在一些实施方案中,本发明的工艺和产品中所用的甜菊包括切割、干燥的甜菊叶。在一些实施方案中,本发明的工艺和产品中所用的甜菊包括切割、未固化的甜菊叶。在一些实施方案中,本发明的工艺和产品中所用的甜菊包括切割、干燥、未固化的甜菊叶。在一些实施方案中,将甜菊叶切成约1mm至约10mm的尺寸(即中值直径)。
51.本发明的成分是基于甜菊的浸液。术语
‘
浸液’通常用于例如饮料工业中,是指通过将茶叶、草药等浸泡在液体、优选水中制成的饮料。更一般地,并且如本文所用,术语
‘
浸液’是指通过使植物材料(即本文所述的甜菊植物材料)与水优选在高温下接触而获得的液体组合物。
52.优选地,浸液在低于沸点(即低于100℃)的温度下产生,使得来自植物材料的有机化合物(例如包括但不限于甜菊醇糖苷的风味和芳香化合物)温和地溶解于水中。这可以区别于现有技术中用于产生甜菊
‘
萃取物’的方法,其中植物材料例如在水和/或其它溶剂中剧烈煮沸,有时重复煮沸,即在多个萃取步骤中煮沸,且接着通常进一步浓缩,例如在真空中浓缩,以最大限度地提高从植物中去除的有机化合物的产量。本发明中使用的浸液与这些高度浓缩的甜菊
‘
萃取物’不同。
53.下文进一步描述了产生用于本发明的甜菊浸液的方法和工艺。
54.为了产生根据本发明的成分,例如甜味成分,可对甜菊浸液进行发酵步骤。发酵通常可定义为一种代谢工艺,其中微生物(例如酵母、真菌或细菌;活性细胞或静止细胞)将碳水化合物(即淀粉或糖)转化为醇或酸和/或二氧化碳。底物(发酵培养基)中存在的其它有机化合物的发酵改性同时发生,导致底物化学组成的进一步变化。食品和饮料产品中使用的术语
‘
发酵’已由联合国粮农组织定义(参见:http://www.fao.org/biotech/c11doc.htm)为微生物、植物或动物来源的微生物和/或酶(复合蛋白质)对有机物质进行生物转化的工艺。如本文所用的术语
‘
发酵的’可相应地解释。然而,在特定实施方案中,它可以更具体地指通过接种合适的微生物,优选在合适的碳水化合物原料存在下进行发酵工艺
的产品。
55.适用于本发明的发酵方法和工艺在下文进一步描述。
56.本发明的成分具有因发酵工艺而改变(改善)的味道和感官特征(即,当与未发酵的甜菊浸液相比时)。令人惊讶且有利地,本发明人已发现,通过使甜菊浸液(例如甜菊叶浸液)经受天然发酵工艺,即通过将发酵微生物(如酵母或细菌)添加至浸液,且接着在适当条件下发酵,可获得改善的味道和感官特征。例如,不受欢迎的风味化合物,包括导致苦甘草调和/或木质调和/或青味、草味、
‘
茶样’风味的化合物可从发酵的浸液中减少或消除。
57.当与未发酵的甜菊浸液相比时,在一些实施方案中,发酵的浸液具有减少的苦甘草风味;在一些实施方案中,发酵的浸液具有减少的木质风味;和/或在一些实施方案中,发酵的浸液具有减少的青味/草味。
58.在一些实施方案中,某些挥发性化合物的量可在发酵后的浸液中减少,所述化合物包括但不限于萜类化合物,例如α-蒎烯、β-波旁烯、α-香柠檬烯和桉油烯醇。
59.在一些实施方案中,某些挥发性化合物的量可在发酵后的浸液中增加,所述化合物包括但不限于乙醇、2-甲基-1-丙醇、3-甲基丁醛、2-甲基丁醇、3-甲基丁酸、2-甲基丁酸、3-甲基乙酸丁酯、2-甲基乙酸丁酯、丁氧基乙酸、苯甲醛、己酸乙酯、苯乙醛、α-二甲基苯乙烯、苯乙醇、辛酸、辛酸乙酯、壬酸、癸酸、β-大马酮(damascenone)、9-癸烯酸和癸酸乙酯。
60.此外,在一些实施方案中,有助于改善味道的某些风味化合物可存在于发酵的浸液中和/或可在发酵的浸液中增强或增加。换句话说,当与发酵前的组成相比时,浸液的发酵可转变或改变甜菊浸液的组成。不希望受理论束缚,认为在一些实施方案中,具有风味增强特性的特定甜菊醇糖苷和/或相关化合物的相对比例可通过发酵增加。在一些实施方案中,令人惊讶的是,甜菊醇糖苷化合物的相对比例基本上没有变化,但感官特征仍然显著改变和/或改善。不希望受理论束缚,这被认为主要是由于本发明发酵工艺导致的组成的其它变化的结果。
61.在一些实施方案中,发酵的浸液的组成变化通过光谱分析中,例如lc-ms光谱中新标记的存在来指示。例如,本发明人已注意到,在本发明的一些实施方案中,在发酵的浸液中检测到具有m/z 1127和m/z 701的新峰,在未发酵的甜菊浸液中未发现所述峰(即低于可检测限度)(在负模式下使用bruker amazonsl iontrap的质谱检测,扫描范围500-1200m/z)。分别在rt 13分钟和23分钟检测到峰(使用phenomenex synergi柱的lc-ms:2.5μhydro-rp 100a,100*2;溶剂a:0,04%乙酸;溶剂b:甲醇 0,04%乙酸;流量:等度50%b,0,25ml/min)。
62.不希望受理论束缚,认为这些峰可能代表由发酵反应产生、富集或增强的甜菊醇糖苷或相关化合物。因此,在本发明的一些实施方案中,本文所述的甜味成分包含发酵的甜菊浸液,其包含至少一种在未发酵的浸液中未检测到的分子量为约1128(对应于负模式下的m/z 1127)的甜菊醇糖苷化合物。在一些实施方案中,甜味成分包含发酵的甜菊浸液,其包含至少一种在未发酵的浸液中未检测到的分子量为约702(对应于负模式下的m/z 701)的甜菊醇糖苷化合物。
63.本发明人还发现,在一些实施方案中,某些甜菊醇糖苷化合物,特别是甜茶苷的相对比例可通过发酵工艺增加。不希望受理论束缚,由于甜茶苷与其它甜菊醇糖苷,例如reba和rebg相比具有更少的糖(糖苷)单元,因此在这些实施方案中,这些甜菊醇糖苷中的一些
有可能在发酵工艺期间已转化为甜茶苷。
64.在一些实施方案中,本发明的甜味成分中的甜茶苷与莱鲍迪苷a、莱鲍迪苷b、莱鲍迪苷c、莱鲍迪苷d、甜菊苷、莱鲍迪苷f、莱鲍迪苷m、莱鲍迪苷n、杜克苷a、莱鲍迪苷i、莱鲍迪苷g、甜茶苷、甜菊醇二糖苷和莱鲍迪苷e的总和的重量比为约0.5%至约15%、约1.0%至约15%、约1.5%至约15%、约2.0%至约15%、约2.5%至约15%、约3.0%至约15%、约3.5%至约15%、约4.0%至约15%、约4.5%至约15%、约5.0%至约15%、约5.5%至约15%、约6.0%至约15%、约6.5%至约15%、约0.5%至约14%、约0.5%至约13%、约0.5%至约12%、约0.5%至约11%、约0.5%至约10%、约0.5%至约9.5%、约0.5%至约9.0%、约0.5%至约8.5%、约0.5%至约8.0%、约1.0%至约14%、约1.5%至约13%、约2.0%至约12%、约2.5%至约11%、约3.0%至约10%、约3.5%至约9.5%、或约4.0%至约9.0%。
65.在一些实施方案中,本发明的甜味成分中的甜茶苷与莱鲍迪苷a、莱鲍迪苷b、莱鲍迪苷c、莱鲍迪苷d、甜菊苷、莱鲍迪苷f、莱鲍迪苷m、莱鲍迪苷n、杜克苷a、莱鲍迪苷i、莱鲍迪苷g、甜茶苷、甜菊醇二糖苷和莱鲍迪苷e的总和的摩尔比为约0.5%至约15%、约1.0%至约15%、约1.5%至约15%、约2.0%至约15%、约2.5%至约15%、约3.0%至约15%、约3.5%至约15%、约4.0%至约15%、约4.5%至约15%、约5.0%至约15%、约5.5%至约15%、约6.0%至约15%、约6.5%至约15%、约0.5%至约14%、约0.5%至约13%、约0.5%至约12%、约0.5%至约11%、约0.5%至约10%、约1.0%至约14%、约1.5%至约13%、约2.0%至约12%、约2.5%至约11%、或约3.0%至约10%。
66.有利地,本发明人已发现,通过适当选择发酵微生物和优化工艺条件,有可能产生与目标特征匹配的发酵的浸液。在一些实施方案中,目标特征包括预定的感官和/或味道特征。在一些实施方案中,目标特征包括(附加地或替代地)预定的分析标准。分析标准可包括例如组合物中某些化合物的存在或不存在,或某些组分(例如特定甜菊醇糖苷化合物)的特定比率,其可通过光谱方法进行评估。更广泛地说,分析标准可包括例如某些光谱标记的存在或不存在,例如lc-ms光谱中某些峰的存在或不存在。
67.在一些实施方案中,指示目标感官特征的分析标准可包括发酵的浸液的ph,如下文进一步描述。在一些实施方案中,指示目标感官特征的分析标准可包括发酵的浸液的光密度,如下文进一步描述。在一些实施方案中,指示目标感官特征的分析标准可包括一种或多种代谢物,包括但不限于乳酸和乙酸的含量或浓度,如下文进一步描述。
68.本文所述的甜味成分包括发酵的甜菊浸液,其中发酵的浸液优选能够通过以下方式获得,或通过以下方式获得:使甜菊(例如干甜菊叶)与水接触并加热,接着使发酵微生物直接与所述浸液接触/将发酵微生物直接添加至所述浸液。
69.本文一般描述了制备本发明的甜味成分的工艺。例如,所述工艺可包括以下步骤:
70.(a)使甜菊与水接触,并优选加热,以产生浸液;
71.(b)(任选地)向浸液中添加碳水化合物(例如糖)或碳水化合物源;
72.(c)(任选地)过滤浸液以去除剩余的甜菊;
73.(d)使浸液与发酵微生物接触(例如向浸液中添加所述发酵微生物);
74.(e)在适合微生物的条件下发酵浸液;和
75.(f)(任选地)过滤发酵的浸液。
76.以上标签(a)至(f)不应被视为限制性的。如本领域技术人员将理解的,可以任何
技术上合理的顺序来执行所述步骤。还将理解,尽管被写为单独的
‘
步骤’,但在一些实施方案中,某些动作可同时执行。例如,如下文进一步解释的,在一些实施方案中,碳水化合物可与发酵微生物(例如预活化酵母)一起添加至浸液中。
77.浸液步骤(即以上实例中的步骤(a))包括使甜菊植物材料与水接触(即混合、组合),并且优选地加热。
78.在一些实施方案中,浸液步骤包括加热至高于约40℃的温度。在一些实施方案中,浸液步骤包括加热至高于约50℃的温度。在一些实施方案中,浸液步骤包括加热至高于约60℃的温度。
79.在一些实施方案中,浸液步骤包括加热至低于约100℃的温度。在一些实施方案中,浸液步骤包括加热至低于约90℃的温度。在一些实施方案中,将浸液加热至低于约85℃的温度。在一些实施方案中,将浸液加热至低于约80℃的温度。在一些实施方案中,将浸液加热至低于约70℃的温度。
80.在一些实施方案中,温度为约40-90℃。在一些实施方案中,温度为约40-85℃。在一些实施方案中,温度为约50-90℃。在一些实施方案中,温度为约40-90℃。在一些实施方案中,温度为约50-85℃。在一些实施方案中,温度为约40-80℃。在一些实施方案中,温度为约50-80℃。在一些实施方案中,温度为约40-70℃。在一些实施方案中,温度为约50-70℃。在一些实施方案中,温度为约60℃。在一些实施方案中,温度为约70℃。在一些实施方案中,温度为约80℃。
81.在一些实施方案中,浸液步骤的持续时间-即甜菊植物材料与(热)水接触的时间长度:
‘
浸泡’时间-小于约120分钟。在一些实施方案中,浸液步骤的持续时间小于约90分钟。在一些实施方案中,浸液步骤的持续时间小于约75分钟。在一些实施方案中,浸液步骤的持续时间小于约60分钟。在一些实施方案中,浸液步骤的持续时间小于约45分钟。在一些实施方案中,浸液步骤的持续时间小于约30分钟。
82.在一些实施方案中,浸液步骤的持续时间长于约10分钟。在一些实施方案中,浸液步骤的持续时间长于约15分钟。在一些实施方案中,浸液步骤的持续时间长于约20分钟。
83.在一些实施方案中,浸液步骤的持续时间为10至75分钟。在一些实施方案中,浸液步骤的持续时间为15至60分钟。在一些实施方案中,浸液步骤的持续时间为30至60分钟。在一些实施方案中,浸液步骤的持续时间为15至45分钟。在一些实施方案中,浸液步骤的持续时间为30至45分钟。在一些实施方案中,浸液步骤的持续时间为约30分钟。在一些实施方案中,通过将甜菊与水以大于约15g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以大于约20g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以大于约30g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以大于约60g/l的浓度(w/v)混合来产生浸液。
84.在一些实施方案中,通过将甜菊与水以低于约180g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以低于约150g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以低于约120g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以低于约100g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以低于约90g/l的浓度(w/v)混合来产生浸液。
85.在一些实施方案中,通过将甜菊与水以约15g/l至约150g/l的浓度(w/v)混合来产
生浸液。在一些实施方案中,通过将甜菊与水以约15g/l至约100g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以约15g/l至约90g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以约20g/l至约100g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以约20g/l至约90g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以约20g/l至约60g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以约20g/l至约50g/l的浓度(w/v)混合来产生浸液。在一些实施方案中,通过将甜菊与水以约20g/l至约50g/l的浓度(w/v)混合来产生浸液。
86.在一些实施方案中,浸液可在连续柱工艺(参见图10)中产生,其中对于初始浸泡步骤,添加初始体积的水(任选地如上所述加热)以覆盖甜菊,并在第二萃取步骤中添加剩余体积的水,其中浸液是从柱底部收集的。在此类实施方案中,如上所述的浓度(w/v)可相对于所用水的总体积计算。
87.可在发酵步骤之前将额外的水添加至浸液中(例如与微生物一起或在单独的步骤中,例如在浸液之后补足蒸发的水或将浸液稀释至所需浓度)。上述浓度是指在
‘
浸泡’(浸液工艺)期间存在的甜菊植物材料的量。
88.在一些实施方案中,优选将至少一种碳水化合物添加至甜菊浸液中,以在发酵反应期间被微生物用作碳源。碳水化合物优选包含糖,例如:葡萄糖、蔗糖(sucrose)、果糖、乳糖或其任何组合。其它碳水化合物包括但不限于淀粉、纤维素、半纤维素、果胶、菊粉、普鲁兰多糖(pullulan)和蔗糖(saccharose)。在一些实施方案中,不添加碳水化合物,但可添加碳水化合物源以产生用于原位发酵的原料。例如,纤维可通过添加的酶,例如纤维素酶转化为糖。
89.碳水化合物或碳水化合物源可方便地在浸液工艺之前或期间与甜菊植物材料一起添加至水中。在将微生物添加至浸液之前,也可将一些或所有碳水化合物添加至微生物中。例如,特别是当微生物为酵母时,在将酵母添加至浸液之前,可使用一些糖来
‘
活化’酵母。
90.添加至浸液中的碳水化合物的总量(即在发酵步骤开始时存在的碳水化合物的量)优选大于约2g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量(即在发酵步骤开始时存在的碳水化合物的量)优选大于约4g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量(即在发酵步骤开始时存在的碳水化合物的量)优选大于约5g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量大于约10g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量大于约15g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量大于约20g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量大于约25g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量等于或大于约30g/l。
91.添加至浸液中的碳水化合物的总量(即在发酵步骤开始时存在的碳水化合物的量)优选小于约60g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量小于约50g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量小于约40g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量小于约35g/l。
92.在一些实施方案中,添加至浸液中的碳水化合物的总量为2g/l至50g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量为2g/l至35g/l。在一些实施方案中,添加至
浸液中的碳水化合物的总量为5g/l至50g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量为10g/l至40g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量为20g/l至50g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量为20g/l至40g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量为30g/l至50g/l。在一些实施方案中,添加至浸液中的碳水化合物的总量为约30g/l。
93.在优选实施方案中,使用的碳水化合物原料是糖。在一些实施方案中,糖选自葡萄糖和蔗糖。在一些实施方案中,糖是蔗糖。
94.添加至浸液中的糖的总量(即发酵步骤开始时存在的糖的量)优选为大于约5g/l(0.5bx)。在一些实施方案中,添加至浸液中的糖的总量为大于约10g/l(1bx)。在一些实施方案中,添加至浸液中的糖的总量为大于约15g/l(1.5bx)。在一些实施方案中,添加至浸液中的糖的总量为大于约20g/l(2bx)。在一些实施方案中,添加至浸液中的糖的总量为大于约25g/l(2.5bx)。在一些实施方案中,添加至浸液中的糖的总量为等于或大于约30g/l(3bx)。
95.添加至浸液中的糖的总量(即发酵步骤开始时存在的糖的量)优选为小于约60g/l(6bx)。在一些实施方案中,添加至浸液中的糖的总量为小于约50g/l(5bx)。在一些实施方案中,添加至浸液中的糖的总量为小于约40g/l(4bx)。在一些实施方案中,添加至浸液中的糖的总量为小于约35g/l(3.5bx)。
96.在一些实施方案中,添加至浸液中的糖的总量为5g/l(0.5bx)至50g/l(5bx)。在一些实施方案中,添加至浸液中的糖的总量为10g/l(1bx)至40g/l(4bx)。在一些实施方案中,添加至浸液中的糖的总量为20g/l(2bx)至50g/l(5bx)。在一些实施方案中,添加至浸液中的糖的总量为20g/l(2bx)至40g/l(4bx)。在一些实施方案中,添加至浸液中的糖的总量为30g/l(3bx)至50g/l(5bx)。在一些实施方案中,添加至浸液中的糖的总量为约30g/l(3bx)。
97.在一些实施方案中,在添加发酵微生物之前过滤浸液以去除甜菊植物材料(即甜菊叶)。在替代实施方案中,植物材料可通过其它已知方法去除,例如离心或倾析。本文提及的过滤意图在适当时也包括这些方法。在其它实施方案中,发酵微生物不经过滤直接添加至浸液中:在一些实施方案中,可接着在稍后阶段将植物材料连同其它不想要的固体(例如来自发酵微生物的生物质)一起去除。
98.产生根据本发明的成分的工艺可包括使用微生物发酵如上所述产生的甜菊浸液的步骤。为了开始发酵工艺,将合适的微生物(或其制品)添加至甜菊浸液中。
99.优选地,将微生物直接添加至来自浸液步骤的液体产物中(在过滤和/或冷却后,如果适用)。优选地,如上文所述制备的甜菊浸液直接用于随后的发酵步骤,除了在一些实施方案中,可过滤浸液以去除甜菊植物材料和/或在一些实施方案中,它可以通过添加另外的液体(水)来稀释和/或在一些实施方案中,它可以被冷却(例如用于临时存储)和/或加热至适当的发酵温度。特别地,在优选实施方案中,甜菊浸液在发酵之前不进行任何化学改性、溶剂萃取或浓缩步骤。
100.在一些实施方案中,可单独或与微生物一起(例如作为微生物制品的一部分)添加额外水。在一些实施方案中,将微生物添加至包含额外水的液体制品中。在一些实施方案中,将微生物添加至包含水和发酵所需的一些或全部糖的液体制品中。
101.在本发明的一些实施方案中,微生物是或包含选自以下的真菌:曲霉属;黑粉菌
属;或其组合。在一些实施方案中,用于发酵的微生物包括一种或多种选自以下的真菌:米曲霉(aspergillus oryzae)、玉米黑粉菌(ustilago maydis);或其组合。
102.在本发明的一些实施方案中,用于发酵浸液的微生物是或包含酵母,例如酵母科的酵母。
103.在本发明的一些实施方案中,微生物是或包含选自以下的酵母:酵母属;毕赤酵母属;接合酵母属;克鲁维酵母属;克勒克氏酵母属(kloeckera spp.);酒香酵母属(brettanomyces spp.);梅奇酵母属(metschnikowia spp.);短梗霉属(aureobasidium spp.);伊萨酵母属(issatchenkia spp.);孢圆酵母属(torulaspora spp.);拉钱斯氏酵母属(lachancea spp.);有孢汉逊酵母属(hanseniaspora spp.);塞伯林德纳氏酵母属;和迈耶氏酵母属或其组合。在一些实施方案中,微生物是选自以下的酵母:酵母属;克鲁维酵母属;接合酵母属;毕赤酵母属;塞伯林德纳氏酵母属;和迈耶氏酵母属;或其组合。
104.在一些实施方案中,微生物是或包含选自以下的酵母:酿酒酵母;葡萄汁酵母(s.uvarum);贝酵母(s.bayanus);少孢酵母(s.exigus);卡尔酵母(s.carlsbergensis);德尔布有孢圆酵母(t.delbrueckii);耐热拉钱斯氏酵母(lachancea thermotolerans);异常毕赤酵母(p.anomala);克鲁维毕赤酵母(p.kluyveri);卡利比克毕赤酵母(p.caribbicica);季也蒙毕赤酵母(p.guillier mondii);拜耳接合酵母(z.baili);马克斯克鲁维酵母(k.marxianus);乳酸克鲁维酵母(k.lactis);美极梅奇酵母(m.pulcherrima);出芽短梗霉(a.pul lulans)、东方伊萨酵母(i.orientalis);柠檬形克勒克氏酵母(k.apiculata);爪哇克勒克氏酵母(k.javanica);葡萄汁有孢汉逊酵母(h.uvarum);嗜高压有孢汉逊酵母(h.osmophilia);或其组合。
105.在一些实施方案中,用于发酵的微生物包含一种或多种选自以下的酵母:酿酒酵母、乳酸克鲁维酵母、马克斯克鲁维酵母、鲁氏接合酵母、膜醭毕赤酵母、杰丁塞伯林德纳氏酵母和季也蒙迈耶氏酵母。在一些实施方案中,用于发酵的微生物包含一种或多种选自以下的酵母:鲁氏接合酵母、杰丁塞伯林德纳氏酵母和季也蒙迈耶氏酵母。在一些实施方案中,用于发酵的微生物是或包含季也蒙迈耶氏酵母。
106.在本发明的一些实施方案中,用于发酵浸液的微生物是或包含细菌,例如产乳酸细菌。
107.在本发明的一些实施方案中,用于发酵的微生物是或包含细菌,例如产乳酸细菌,例如选自乳杆菌属(例如嗜酸乳杆菌或食果糖乳杆菌)、明串珠菌属(leuconostoc)、片球菌属(pediococcus)、乳球菌属(例如棉子糖乳球菌)、链球菌属(streptococcus)、气球菌属(aerococcus)、肉杆菌属(carnobacterium)、肠球菌属(enterococcus)、酒球菌属(oenococcus)、芽孢乳杆菌属(sporolactobacillus)、四联球菌属(tetragenococcus)、漫游球菌属(vagococcus)或魏斯氏菌属(weissella)。在其它实施方案中,用于发酵的细菌选自发酵单胞菌属,优选运动发酵单胞菌(z.mobilis);或芽孢杆菌属,例如嗜热脂肪芽孢杆菌(b.stearothermophilus)或地衣芽孢杆菌(b.licheniformis)。
108.在本发明的一些实施方案中,用于发酵的微生物是或包含来自乳杆菌属的细菌。在一些实施方案中,用于发酵的微生物是或包含选自以下的细菌:嗜酸乳杆菌、食果糖乳杆菌、格氏乳杆菌(l.gasseri)、詹氏乳杆菌(l.jensenii)、德氏乳杆菌、德氏乳杆菌保加利亚亚种、淀粉乳杆菌(l.amylovorus)、卷曲乳杆菌(l,crispatus)和瑞士乳杆菌
(l.helveticus)。在一些实施方案中,用于发酵的微生物是或包含嗜酸乳杆菌、食果糖乳杆菌和德氏乳杆菌。在一些实施方案中,用于发酵的微生物是或包含嗜酸乳杆菌。
109.在一些实施方案中,多于一种微生物用于发酵。例如,两种或多种酵母的组合;两种或多种细菌的组合;两种或多种真菌的组合;一种或多种真菌与一种或多种细菌的组合;一种或多种酵母与一种或多种真菌的组合;或一种或多种酵母与一种或多种细菌的组合。
110.在特定实施方案中,用于发酵的微生物包含一种或多种酵母与一种或多种细菌的组合,其中所述酵母优选选自乳酸克鲁维酵母、马克斯克鲁维酵母、鲁氏接合酵母、膜醭毕赤酵母、杰丁塞伯林德纳氏酵母和季也蒙迈耶氏酵母,且其中所述细菌优选为乳杆菌属,并且更优选选自德氏乳杆菌、食果糖乳杆菌和嗜酸乳杆菌。
111.在一些实施方案中,用于发酵的微生物包含选自酿酒酵母、乳酸克鲁维酵母、马克斯克鲁维酵母、鲁氏接合酵母、膜醭毕赤酵母、杰丁塞伯林德纳氏酵母和季也蒙迈耶氏酵母的酵母与至少一种细菌,优选如上所述的产乳酸细菌的组合。
112.在一些实施方案中,用于发酵的微生物包含酵母和至少一种产乳酸细菌的组合,例如选自以下的细菌:嗜酸乳杆菌、食果糖乳杆菌、格氏乳杆菌、詹氏乳杆菌、德氏乳杆菌、德氏乳杆菌保加利亚亚种、淀粉乳杆菌、卷曲乳杆菌(l,crispatus)和瑞士乳杆菌,优选选自嗜酸乳杆菌、食果糖乳杆菌和德氏乳杆菌。
113.在这些实施方案中,用多于一种微生物进行的发酵可单独、依序或同时进行。
114.在一些实施方案中,用多于一种微生物进行的发酵同时进行。例如,在一些实施方案中,将两种或更多种酵母一起添加至甜菊浸液中,并且各自的发酵同时进行。在其它实施方案中,将一种或多种酵母和一种或多种细菌一起添加至甜菊浸液(双重接种物)中,并且各自的发酵同时进行。
115.在一些实施方案中,用多于一种微生物进行的发酵依序进行。例如,可首先用一种或多种酵母进行发酵,且随后可用一种或多种细菌进行进一步发酵。或者,可首先用一种或多种细菌进行发酵,且随后可用一种或多种酵母进行进一步发酵。
116.本发明的一个有利特征是,取决于微生物的选择和所使用的工艺条件,可从甜菊植物材料中获得多种不同的成分,例如甜味成分,其具有不同的特性(包括但不限于感官特性,例如味道、外观、香气和口感)。
117.适用于本发明的微生物一般描述于本文中。在本发明的一些实施方案中,可通过筛选工艺选择用于发酵工艺的合适微生物或微生物组合。这种筛选工艺可能有助于识别能够产生特定所需终点的微生物的物种和/或菌株。例如,筛选可用于识别能够产生特定风味和/或去除未发酵的甜菊中存在的特定风味的微生物。或者或另外,筛选可用于识别能够在发酵反应中产生、富集或增强特定化合物(例如特定甜菊醇糖苷和/或特定挥发物)和/或去除(即降解或化学改性)未发酵的甜菊中存在的其它化合物的微生物。
118.因此,在本发明的一些实施方案中,选择发酵步骤中使用的微生物以匹配最终产品中的特定目标特征。在本发明的一些实施方案中,选择用于发酵步骤的微生物以便在最终产品中产生预定感官和/或味道特征。在本发明的一些实施方案中,选择用于发酵步骤的微生物以便在最终产品中产生预定分析/化学特征。
119.这样的筛选工艺可例如包括对合适的甜菊浸液进行一次或多次测试发酵(例如通过遵循诸如本文所述的工艺)并对所得发酵样品进行分析和/或感官测试(如本领域所熟知
的),以确定获得的分析和/或感官特征是否或在何种程度上对应于预定目标。
120.如本领域所理解的,发酵步骤在适合所用微生物的条件下进行。
121.在一些实施方案中,发酵步骤可以是分批的、补料分批的或连续的。
122.在一些实施方案中,发酵可在基本上厌氧的条件下进行。在一些实施方案中,发酵可在基本上好氧的条件下进行。
123.在一些实施方案中,在添加至甜菊浸液之前,微生物可被活化。在一些实施方案中,特别是当微生物为酵母时,活化包括将微生物与水混合,并且优选地,添加适量的糖,以开始微生物中发酵的代谢工艺。
124.将所得微生物制品(即微生物加水,如果适用的话加糖)直接添加至甜菊浸液中,以开始本文所述工艺的发酵步骤。如别处所述,此制品中包括的任何水和糖都有助于甜菊浸液的总水和糖含量,且因此形成发酵培养基的一部分。
125.在一些实施方案中,出于活化目的,将糖以约10∶1至约50∶1(糖/酵母w/w)的比率添加至微生物。在一些实施方案中,糖以约15∶1至约35∶1w/w的比率添加至微生物。在一些实施方案中,糖以约20∶1至约30∶1w/w的比率添加至微生物。在一些实施方案中,糖以约25∶1w/w的比率添加。
126.在一些实施方案中,发酵微生物以至少约0.1g/l的量存在于浸液(发酵培养基)中。在一些实施方案中,发酵微生物以至少约0.2g/l的量存在。在一些实施方案中,发酵微生物以至少约0.3g/l的量存在。在一些实施方案中,发酵微生物以至少约0.4g/l的量存在。在一些实施方案中,发酵微生物以约0.4g/l的量存在于发酵培养基中。在一些实施方案中,发酵微生物以不超过约0.6g/l的量存在于发酵培养基中。在一些实施方案中,发酵微生物以不超过约0.8g/l的量存在。在一些实施方案中,发酵微生物以不超过约1g/l的量存在。在一些实施方案中,发酵微生物以不超过约2g/l的量存在。
127.在一些实施方案中,发酵步骤在15℃至40℃的温度下进行。在一些实施方案中,发酵步骤在20℃至35℃的温度下进行。在一些实施方案中,发酵步骤在25℃至30℃的温度下进行。在一些实施方案中,发酵步骤在26℃至28℃的温度下进行。在一些实施方案中,发酵步骤在低于35℃的温度下进行。在一些实施方案中,发酵步骤在低于32℃的温度下进行。在一些实施方案中,发酵步骤在低于30℃的温度下进行。在一些实施方案中,发酵步骤在高于15℃的温度下进行。在一些实施方案中,发酵步骤在高于20℃的温度下进行。在一些实施方案中,发酵步骤在高于25℃的温度下进行。
128.在一些实施方案中,发酵的持续时间为至少2小时。在一些实施方案中,发酵的持续时间为至少4小时。在一些实施方案中,发酵的持续时间为至少24小时。在一些实施方案中,发酵的持续时间为至少48小时。在一些实施方案中,发酵的持续时间为至少72小时(3天)。在一些实施方案中,发酵步骤的持续时间可少于14天。在一些实施方案中,发酵步骤的持续时间可少于10天。在一些实施方案中,发酵步骤的持续时间可少于7天。在一些实施方案中,发酵步骤的持续时间可少于5天。在一些实施方案中,发酵步骤的持续时间可少于4天。
129.在一些实施方案中,发酵步骤的持续时间为约1天。在一些实施方案中,发酵步骤的持续时间为约2天。在一些实施方案中,发酵步骤的持续时间为约3天。
130.在本发明的一些实施方案中,发酵的持续时间由碳水化合物原料(即糖)的消耗量
决定。这可以通过本领域已知的方法监测。目的是将浸液(发酵培养基)中的糖含量降低至零,或尽可能接近零。
131.因此,在一些实施方案中,继续发酵直到添加的碳水化合物被完全或几乎完全消耗。例如,发酵后的残留碳水化合物/糖含量可小于25g/l、小于20g/l、小于15g/l、小于10g/l、小于5g/l、小于2g/l、或小于1g/l。在一些实施方案中,微生物在发酵反应期间消耗至少5g/l糖、至少10g/l糖、优选至少15g/l糖、最优选至少20g/l糖。在优选实施方案中,发酵后,浸液基本上不含糖。因此,在一些实施方案中,本发明的发酵甜菊浸液可用作
‘
无糖’甜味成分。
132.在一些实施方案中,发酵开始时浸液的ph可小于约7。在一些实施方案中,发酵开始时浸液的ph可小于约6.5。在一些实施方案中,发酵开始时浸液的ph可小于约6。在一些实施方案中,发酵开始时浸液的ph可小于约5.5。
133.在一些实施方案中,发酵开始时浸液的ph可大于约4。在一些实施方案中,发酵开始时浸液的ph可大于约4.5。在一些实施方案中,发酵开始时浸液的ph可大于约5。
134.在一些实施方案中,发酵开始时浸液的ph可为约5至约7。在一些实施方案中,发酵开始时浸液的ph可为约5至约6.5。在一些实施方案中,发酵开始时浸液的ph可为约5至约6。
135.在一些实施方案中,发酵结束时浸液的ph可大于约2.5。在一些实施方案中,发酵结束时浸液的ph可大于约3。在一些实施方案中,发酵结束时浸液的ph可大于约3.1。在一些实施方案中,发酵结束时浸液的ph可大于约3.5。在一些实施方案中,发酵结束时浸液的ph可大于约4。在一些实施方案中,发酵结束时浸液的ph可大于约4.5。
136.在一些实施方案中,发酵结束时浸液的ph可小于约5。在一些实施方案中,发酵结束时浸液的ph可小于约4.5。在一些实施方案中,发酵结束时浸液的ph可小于约4。在一些实施方案中,发酵结束时浸液的ph可小于约3.9。在一些实施方案中,发酵结束时浸液的ph可小于约3.8。在一些实施方案中,发酵结束时浸液的ph可小于约3.5。
137.在一些实施方案中,发酵结束时浸液的ph可为约2.5至约4.5。在一些实施方案中,发酵结束时浸液的ph可为约3至约4.5。在一些实施方案中,发酵结束时浸液的ph可为约3至约4。在一些实施方案中,发酵结束时浸液的ph可为约3.1至约3.9。在一些实施方案中,发酵结束时浸液的ph可为约3.1至约3.8。
138.不希望受理论束缚,认为在发酵工艺中观察到的光密度降低也指示生物转化过程。可使用本领域已知的方法用uv-可见分光光度计测量和监测浸液的光密度。例如,在一些实施方案中,可使用细胞密度计,例如ultrospec
tm
10 classic(由biochrom提供)。
139.在一些实施方案中,发酵结束时在600nm波长处测量的浸液的光密度(od
600
)可小于约1。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可小于约0.9。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可小于约0.8。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可小于约0.7。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可小于约0.6。
140.在一些实施方案中,发酵结束时浸液的光密度(od
600
)可大于约0.1。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可大于约0.12。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可大于约0.15。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可大于约0.2。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可大于约0.25。
141.在一些实施方案中,发酵结束时浸液的光密度(od
600
)可在约0.1至约1范围内。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可在约0.12至约0.9范围内。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可在约0.15至约0.9范围内。在一些实施方案中,发酵结束时浸液的光密度(od
600
)可在约0.15至约0.8范围内。
142.不希望受理论束缚,在一些实施方案中,已发现某些代谢物的含量指示最终成分中的良好感官结果。特别地,在一些实施方案中,可优化发酵结束时浸液中的乳酸和乙酸的量,以实现所需的感官结果(例如
‘
干净’味道的成分或饮料)。
143.在一些实施方案中,发酵结束时浸液中的乳酸量小于约15g/l。在一些实施方案中,发酵结束时浸液中的乳酸量小于约12g/l。在一些实施方案中,发酵结束时浸液中的乳酸量小于约10g/l。在一些实施方案中,发酵结束时浸液中的乳酸量小于约8g/l。
144.在一些实施方案中,发酵结束时浸液中的乳酸量大于约0.1g/l。在一些实施方案中,发酵结束时浸液中的乳酸量大于约0.2g/l。在一些实施方案中,发酵结束时浸液中的乳酸量大于约0.5g/l。在一些实施方案中,发酵结束时浸液中的乳酸量小于约1g/l。
145.在一些实施方案中,发酵结束时浸液中的乳酸量为约0至约12g/l。在一些实施方案中,发酵结束时浸液中的乳酸量为约0至约10g/l。在一些实施方案中,发酵结束时浸液中的乳酸量为约0.5至约10g/l。
146.在一些实施方案中,发酵结束时浸液中的乙酸量小于约4g/l。在一些实施方案中,发酵结束时浸液中的乙酸量小于约3g/l。在一些实施方案中,发酵结束时浸液中的乙酸量小于约2.5g/l。在一些实施方案中,发酵结束时浸液中的乙酸量小于约2g/l。
147.在一些实施方案中,发酵结束时浸液中的乙酸量大于约0.1g/l。在一些实施方案中,发酵结束时浸液中的乙酸量大于约0.2g/l。在一些实施方案中,发酵结束时浸液中的乙酸量大于约0.5g/l。
148.在一些实施方案中,发酵结束时浸液中的乙酸量为约0至约3g/l。在一些实施方案中,发酵结束时浸液中的乙酸量为约0至约2.5g/l。在一些实施方案中,发酵结束时浸液中的乙酸量为约0.2至约2.5g/l。
149.因此,本发明的另一方面是一种成分,例如甜味成分,其包含水溶液中的甜菊醇糖苷并具有如本文所述的物理化学特性,例如ph、光密度、乳酸和乙酸含量。所述成分可使用本文所述的发酵工艺获得。
150.在一些实施方案中,本发明因此提供了一种成分,例如甜味成分,其包含水溶液中的甜菊醇糖苷,并且具有例如:
151.约3.1至约3.9的ph;
152.约0.15至0.8的od
600
;
153.约0至约10g/l的乳酸含量;和
154.约0至约2.5g/l的乙酸含量。
155.优选地,所述成分包含至少50ppm的总甜菊醇糖苷。在一些实施方案中,所述成分包含至少100ppm的总甜菊醇糖苷。在一些实施方案中,所述成分包含至少200ppm的总甜菊醇糖苷。在一些实施方案中,所述成分包含至少500ppm的总甜菊醇糖苷。
156.如上所述,在一些实施方案中,所述工艺任选地包括在添加发酵微生物之前过滤浸液以去除甜菊植物材料的步骤。
157.在一些实施方案中,所述工艺任选地包括在添加发酵微生物之前对甜菊浸液进行灭菌或巴氏杀菌(例如通过加热)以降低被其它微生物污染的风险的步骤。
158.在一些实施方案中,所述工艺任选地包括一个或多个步骤,其中将额外液体(例如水)添加至浸液中。
159.在一些实施方案中,在发酵步骤之后,可去除或减少一些或所有剩余的固体,包括例如来自微生物的生物质,以留下适合用作甜味成分的发酵的浸液。在一些实施方案中,发酵的浸液被过滤(或离心等)以去除固体。
160.所得发酵的浸液准备好用作液体形式的成分,例如甜味成分。在一些实施方案中,最终产品可在包装和/或使用之前进行巴氏杀菌或灭菌。
161.在一些实施方案中,本发明的成分是巴氏杀菌的。在一些实施方案中,本发明的工艺包括巴氏杀菌步骤。在一些实施方案中,巴氏杀菌包括加热至至少70℃、至少80℃、至少90℃、或至少95℃的温度。
162.在一些实施方案中,所述成分可在包装和/或使用前被浓缩和/或干燥。
163.在一些实施方案中,本发明的成分被干燥以提供固体成分。
164.可通过本领域已知的方法进行干燥。在一些实施方案中,干燥包括例如蒸发,任选地在减压下;冷冻干燥;喷雾干燥。取决于载体/助剂,产品也可通过以下方式获得:喷雾造粒;熔融造粒;凝聚;凝固;挤出;熔体挤出;乳化工艺;涂布或其它合适的封装工艺,以及任选地所述工艺的合适组合
165.在一些实施方案中,所得固体成分可配制成粒状或粉状产品,例如粒状或粉状甜味剂。在一些实施方案中,可将固体成分配制成片剂,例如甜味剂片剂。
166.本文所述的成分可用于食品或饮料产品的生产。因此,本发明的另一方面为如本文所述的甜味成分在生产食品或饮料产品中的用途。另一方面为一种食品或饮料产品,优选减糖、低糖或无糖饮料产品,其包含如本文所述的甜味成分。
167.在一些实施方案中,食品或饮料产品是饮料,包括但不限于果汁汽水(squash)、甜酒、果汁、浸液、碳酸饮料或另一软饮料。
168.在一些实施方案中,有利地,本发明的甜味成分可以比先前已知的基于甜菊的甜味剂,特别是溶剂萃取的甜菊制品具有更少的起泡效果。
169.在一些实施方案中,食品或饮料产品是食物,包括但不限于甜食物品。在一些实施方案中,食物是饼干、蛋糕或其它烘焙食品。在一些实施方案中,食物是甜食或巧克力产品。在一些实施方案中,食物是口香糖。在一些实施方案中,食物选自调味品,包括但不限于调味酱、番茄酱、调料或佐餐调味酱。在一些实施方案中,食物是谷物产品,例如早餐谷物,或零食(例如来自马铃薯、玉米、花生)。在一些实施方案中,食物是动物产品,例如奶制品(包括但不限于乳品、冰淇淋、奶酪等)或蛋制品。在其它实施方案中,食物是蔬菜或水果产品(例如水果制品、蔬菜产品)。在另外的实施方案中,食物选自豆制品,包括但不限于豆腐、豆豉或豆浆。在一些实施方案中,食物可以是香料混合物或其它调味品。
170.在一些实施方案中,甜味成分以约0.2%(v/v)、约0.5%、约1%、约1.5%或约2%的量添加至食品或饮料中。在一些实施方案中,甜味成分以至多约2.5%(v/v)、至多约3%、至多约4%、至多约5%或至多约10%的量添加至食品或饮料中。在一些实施方案中,甜味成分以约0.5%(v/v)的量添加至食品或饮料中。在一些实施方案中,甜味成分以约1%(v/v)
的量添加至食品或饮料中。在一些实施方案中,甜味成分以约1.5%(v/v)的量添加至食品或饮料中。
171.在一些实施方案中,按总制品计,成分以约0.01mg/l、优选大于约0.1mg/l、优选大于约1mg/l的量添加。在另外的实施方案中,按制品的总重量计,制品包含总量在0.01至10 000mg/l、0.1至1000mg/l、优选0.1至500mg/l、特别优选0.1至100mg/l范围内的成分。
172.在一些实施方案中,甜味成分以约0.2%(w/w)、约0.5%、约1%、约1.5%或约2%的量添加至食品或饮料中。在一些实施方案中,甜味成分以至多约2.5%(w/w)、至多约3%、至多约4%、至多约5%或至多约10%的量添加至食品或饮料中。在一些实施方案中,甜味成分以约0.5%(w/w)的量添加至食品或饮料中。在一些实施方案中,甜味成分以约1%(w/w)的量添加至食品或饮料中。在一些实施方案中,甜味成分以约1.5%(w/w)的量添加至食品或饮料中。
173.在一些实施方案中,甜味成分替代饮料或食品产品中约2g/l当量的糖。在一些实施方案中,甜味成分替代饮料或食品产品中至多约3g/l当量的糖。在一些实施方案中,甜味成分替代饮料或食品产品中至多约4g/l当量的糖。在一些实施方案中,甜味成分替代饮料或食品产品中至多约5g/l当量的糖。在一些实施方案中,甜味成分替代饮料或食品产品中至多约10g/l当量的糖。
174.在一些实施方案中,甜味成分替代饮料或食品产品中约2g/kg当量的糖。在一些实施方案中,甜味成分替代饮料或食品产品中至多约3g/kg当量的糖。在一些实施方案中,甜味成分替代饮料或食品产品中至多约4g/kgl当量的糖。在一些实施方案中,甜味成分替代饮料或食品产品中至多约5g/kg当量的糖。在一些实施方案中,甜味成分替代饮料或食品产品中至多约10g/kg当量的糖。
175.***
176.在前文描述中,或所附权利要求中或附图中公开的以其特定形式或者在用于执行所公开的功能的装置、或者用于获得所公开的结果的方法或工艺方面表述的特征在适当时可单独地或以此类特征的任何组合用于以多样化形式实现本发明。
177.虽然已经结合上文描述的示例性实施方案描述了本发明,但当给出本公开时,许多等同修改和变型对于本领域技术人员而言将是显而易见的。因此,上文阐述的本发明的示例性实施方案应被视为是说明性的而非限制性的。在不脱离本发明的精神和范围的情况下可对所描述的实施方案作出各种改变。
178.为了避免任何疑义,本文提供的任何理论解释是出于提高读者的理解的目的而提供的。发明人不希望受这些理论解释中的任一者的束缚。
179.本文中所使用的任何章节标题仅出于组织目的,并且不应被视为限制所述的主题。
180.贯穿包括随附权利要求书的本说明书,除非上下文另外要求,否则词语“包含(comprise)”和“包括(include)”以及变型(诸如“包含(comprises/comprising)”和“包括(including)”)将被理解为暗指包括规定的整数或步骤或者整数或步骤的群组,但不排除任何其它整数或步骤或者整数或步骤的群组。
181.必须注意,除非上下文另外明确规定,否则说明书和随附权利要求中所使用的单数形式“一个”、“一种”和“所述”包括复数指示物。范围在本文中可被表述为从“约”一个特
定值和/或到“约”另一个特定值。当表述这种范围时,另一个实施方案包括从一个特定值和/或到另一个特定值。类似地,当通过使用先行词“约”将值表达为近似值时,将理解所述特定值形成另一实施方案。与数值相关的术语“约”是任选的并且意指例如 /-10%。
182.实施例
183.一般方法
184.1.甜菊醇糖苷hplc分析方法(实施例2至6)
185.1.引言
186.使用改编自jefca 2017专论甜菊醇糖苷hplc方法的方法分析样品。它们在agilent hplc 1100系统上运行,梯度方法与phenomenex luna 5μm c18(2),100a,(250mm
×
4.6mm,5μm)柱一起使用,检测器设置为210nm。通过与外部标准品比较来定量甜菊醇糖苷含量。
187.2.实验
188.试剂和标准品
189.甜菊醇糖苷标准溶液jefca混合物0.2mg/ml从含有以下甜菊苷的chromadex(型号00010175)获得:莱鲍迪苷a、莱鲍迪苷b、莱鲍迪苷c、莱鲍迪苷d、莱鲍迪苷f、杜克苷a、甜菊醇二糖苷。hplc级去离子水和hplc级乙腈获自vwr。
190.流动相
191.溶剂a:去离子水
192.溶剂b:乙腈
193.所采用的hplc方法是与jefca中所报道相同的梯度方法。
[0194][0195][0196]
标准制品
[0197]
使用chromadex提供的标准溶液。
[0198]
仪器和条件
[0199]
包括四元泵、设置在50℃的温控柱室、自动进样器和vwd吸光度检测器的agilent 1100 hplc系统用于分析。检测器设置在210nm。数据采集是使用water empower 3软件完成的。用于hplc的柱是反相luna 5μm c18(2),100a,(250mm
×
4.6mm,5μm)phenomenex。
[0200]
分析程序
[0201]
对于rp-hplc方法,柱用30ml流动相(85∶15去离子水∶乙腈)冲洗。样品在运行开始和结束时与标准品等同看待,以确保保留时间的准确性。样品注射体积20μl。取用不同体积的jefca标准混合物使用柱上稀释法构建校准曲线。
[0202][0203][0204]
2.挥发物分析hplc方法
[0205]
通过顶空固相微萃取(spme)萃取挥发物以用于gc/ms分析
[0206]
将适量样品转移至20ml小瓶中,接着将其密封。小瓶在75℃下在搅拌下平衡5分钟。接着在75℃下在使用碳分子筛(carboxen)/聚二甲基硅氧烷/二乙烯基苯涂布的spme纤维进行搅拌的情况下对小瓶的顶空采样5分钟。吸附在纤维上的挥发物通过在270℃下在gc/ms的注射口中的热解吸进行分析。
[0207]
挥发物的gc/ms分析
[0208]
使用agilent7890a气相色谱仪(gc)和agilent7200精确质量q-tof质谱仪(ms)通过ctccombi-pal自动进样器进行分析。
[0209]
gc/ms条件如下:
[0210]
柱:30mm
×
0.25mm熔融石英,带zb-半挥发物固定相
[0211]
氦气载气流速:1mlmin-1
[0212]
注射器温度:270℃
[0213]
柱温:40℃下5min;接着以4℃min-1
至200℃;接着以30℃min-1至350℃,保持3分钟
[0214]
ms分析模式:扫描(33-350m/z)
[0215]
通过与mist质谱数据库的光谱匹配来初步识别峰。
[0216]
3.感官测试-示例性方法
[0217]
使用定量描述分析(qda)进行感官测试。qda评估样品之间是否存在差异以及差异是什么(定性=描述元素,以及样品差异的程度=定量元素)。这种方法由感官小组成员运行,所述小组成员是一组消费者,他们已经过感官敏锐度筛查并接受过感官训练,以明确表达他们在饮用饮料时的感受。他们还接受了一系列感官方法的培训。从感官小组获得的测量结果是客观的。至少有6-7名小组成员参与研究,并且结果一式两份,以确保可重复性。
[0218]
样品首先一次全部呈现给经过感官训练的小组,他们在圆桌讨论期间初步就最能
描述产品的感官属性或描述符达成一致,以发展感官词汇。一位感官科学家主持讨论并收集小组选择的属性,所述属性对他们来说很清楚,易于定义并描述所研究样品之间的差异。
[0219]
接着在感官室中进行感官评估,每个小组成员在里面单独评估样品。小组成员以从低到高(每个属性的0-100)的未定义线标度一次对一个样品进行评定。样品以随机和平衡的顺序呈现,以避免一阶和结转效应。数据收集通过fizz(sensory software)在线完成,并使用fizz和xlstat进行数据分析。数据分析的结果是蜘蛛图(参见例如图1和图7)。执行anova(方差分析)形式的统计显著性测试和lsd测试。这确定了样品在哪些属性上有显著差异(如果有的话)。p值取为<0.05(使用95%置信度)。
[0220]
实施例1-制备发酵的甜菊浸液的一般方案。
[0221]
在所需温度下将甜菊叶(干)添加至水中。使叶在此温度下浸泡(冲泡阶段)所需的浸泡时间,且任选地接着过滤浸液以去除用过的叶。在需要时添加更多(冷)水,以将浸液稀释至所需体积和/或降低其温度。可将碳水化合物原料(例如糖)添加至浸液中(例如在浸泡过程中,或在其后的任何时间点)。
[0222]
或者,在一些实施方案中,可使用制备甜菊浸液的连续柱法(参见图10)。
[0223]
微生物(例如酵母)通过悬浮于水中并在必要时预活化(例如通过添加糖)来制备。
[0224]
在需要时将浸液加热或冷却至适合发酵的温度。接着将微生物制品添加至浸液中,使其发酵。
[0225]
发酵工艺使用本领域已知的方法进行分析监测。
[0226]
用于基本分析的示例性ph计、密度计和折光计:
[0227]
ph计:mettler toledo seven easy
[0228]
折光计:bellingham和stanley rfm340
[0229]
密度计:anton paar dma 4500m
[0230]
还可评估发酵进程的监测,例如使用光谱方法,例如由cetotec gmbh制造的
‘
acetoscan’机器。
[0231]
可在发酵步骤完成后去除微生物(例如通过过滤)。
[0232]
示例性过滤包括具有纤维素滤片(来自eaton过滤产品的beco kd3 200x200滤片;额定为10微米)的板框过滤器。对于600升发酵液,典型地会使用30片,得到800-1000克可刮去的酵母。供液泵加压至30psi;过滤过程中典型的预期损失为15-20升液体。
[0233]
所得产品任选地进行巴氏杀菌(例如通过加热)-参见实施例3。
[0234]
实施例2-用酿酒酵母发酵
[0235]
实验参数:
[0236]
罐编号原材料、供应商和剂量g/la甜菊(mane),1.2g/lb甜菊(mane),5g/lc甜菊(mane),10g/l
[0237]
[0238][0239]
甜菊浸液制备:
[0240]
糖:使用每罐30g/l总糖,得到每罐约3bx。对于5l发酵液,这相当于150g糖。添加100g并与叶一起溶解在浸液中。剩余部分的糖(50g)用于酵母活化(下文)。
[0241]
酵母:使用了0.4g/l的酿酒酵母菌株。对于所有罐,每罐总共预活化2g。酵母被单独活化,总共2g与剩余部分的糖(50g)一起溶解在1l水中并保持105分钟。
[0242]
在将酵母添加至浸液中之前,检查溶液的温度是否低于30℃,以确保不会杀死酵母。
[0243]
水:在添加活化酵母溶液之前添加5l水的剩余部分,以快速将温度降至30℃以下
[0244]
结果:
[0245]
发酵反应监测:
[0246][0247][0248]
甜菊醇糖苷分析:
[0249][0250]
感官特征:
[0251]
如图1中所示,通过发酵实现了甜菊浸液感官特征的显著改变。
[0252]
挥发物分析:
[0253]
使用分析型hplc进行的挥发物分析显示了以下组成变化。
[0254]
发酵后萜类化合物的减少:
[0255]
化合物描述符α-蒎烯清新、甜的、松树、泥土味β-波旁烯草药味、木质、花香、香脂α-香柠檬烯木质、温暖、茶桉油烯醇泥土味、草药味、果味
[0256]
发酵后增加:
[0257][0258][0259]
实施例3-用酿酒酵母发酵;添加巴氏杀菌步骤
[0260]
实验参数:
[0261]
罐编号原材料、供应商和剂量g/la甜菊(natura),1.2g/lb甜菊(natura),5g/lc甜菊(natura),10g/l
[0262]
浸液(步骤1):
ꢀꢀ
热水1500ml时间(泡茶)30min
温度(开始)65℃温度(结束)/℃
ꢀꢀꢀ
发酵(步骤2):
ꢀꢀ
糖(3bx)30g/l酵母2g浸液(来自步骤1)1500ml冷水2500ml酵母用水1000ml
[0263]
使用与实施例2相同的方法制备和发酵(使用酿酒酵母菌株)甜菊浸液。
[0264]
结果:
[0265]
发酵反应监测:
[0266][0267][0268]
甜菊醇糖苷分析:
[0269][0270]
巴氏杀菌步骤:
[0271]
通过使用水浴加热对发酵的浸液进行巴氏杀菌,使用温度计手动测量温度并记录
以得到巴氏杀菌曲线,如下表所示:
[0272][0273][0274]
巴氏杀菌也可使用miele pasteur和带有自动测量温度的探头的数据记录器进行。
[0275]
实施例4-用酿酒酵母发酵;与其它植物成分比较
[0276]
实验参数:
[0277][0278]
浸液(步骤1):
ꢀꢀ
热水1400ml时间(泡茶)30min温度(开始)65℃温度(结束)/℃
ꢀꢀꢀ
发酵(步骤2):
ꢀꢀ
糖(3bx)30g/l
酵母1.2g浸液(来自步骤1)1000ml冷水1400ml酵母用水600ml
[0279]
使用如实施例2所述的方法制备和发酵(使用酿酒酵母菌株)浸液。
[0280]
结果:
[0281]
发酵反应监测:
[0282][0283]
甜菊醇糖苷分析:
[0284][0285]
实施例5-浸液步骤的优化
[0286]
实验参数:
[0287]
[0288][0289]
浸液:
ꢀꢀ
热水可变ml时间(泡茶)可变min温度(开始)60℃温度(结束)/℃
[0290]
甜菊浸液制备:
[0291]
制备了七种不同的甜菊浸液(但在本试验中未发酵);每个罐中1.5l的总浸液:
[0292]
90/60-90g/l,在60℃下浸泡,使用所有的水,仅补足叶所使用的量并保持60分钟。
[0293]
90/30-90g/l,在60℃下浸泡,使用所有的水,仅补足叶所使用的量并保持30分钟。
[0294]
30/60-30g/l,在60℃下浸泡,使用所有的水,仅补足叶所使用的量并保持60分钟。
[0295]
30/30-30g/l,在60℃下浸泡,使用所有的水,仅补足叶所使用的量并保持30分钟。
[0296]
90 1/2-90g/l,在60℃下浸泡,使用一半的水量并补足余量并保持60分钟。
[0297]
30 1/2-30g/l,在60℃下浸泡,使用一半的水量并补足余量并保持60分钟。
[0298]
30 1/3-30g/l,在60℃下浸泡,使用三分之一的水量并补足余量并保持60分钟。
[0299]
结果:
[0300]
甜菊醇糖苷分析:
[0301]
完整分析示于表5中。
[0302][0303]
实施例6-用酿酒酵母发酵甜菊浸液
[0304]
实验参数:
[0305]
罐编号原材料、供应商和剂量g/lsnsa30r甜菊,natura sas,30g/lp30甜菊,paraguay,30g/lp60甜菊,paraguay,60g/l
[0306]
使用如实施例2所述的方法制备和发酵(使用酿酒酵母菌株)甜菊浸液。
[0307]
结果:
[0308]
发酵反应监测:
[0309][0310]
[0311][0312]
实施例7a-发酵微生物的筛选
[0313]
如本文所述制备的30g/l甜菊浸液的小样品(15ml)补充有30-50g/l葡萄糖,且接
着接种各种发酵微生物(参见下表7-1)并在28℃下在100ml摇瓶中摇动培育。以小规模新鲜产生微生物生物质,用作浸液中的接种物。发酵持续时间为48小时,目的是完全消耗糖。在室温下将收获的样品在15ml或50ml pp管(例如falcon,corning)中离心10分钟(例如在thermo scientific multifuge x3r中以4500rpm)。将上清液转移至新的pp管中并在75℃水浴(例如sw22,julabo)中巴氏杀菌20分钟。实验重复两次。
[0314]
发酵的样品用矿泉水进行1∶10稀释。一组品尝员按喜好程度对它们进行了排名。以更大规模(500ml)重复最成功的发酵(即提供最喜欢的味道结果的发酵)以验证结果并为hplc分析提供样品(表7-2)。
[0315]
hplc方法i:使用phenomenex synergi柱进行hplc分析:2.5μm hydro-rp 100a,100*2;溶剂a:0.04%乙酸;溶剂b:甲醇 0.04%乙酸;流量:等度50%b,0.25ml/min。总运行时间为30min。负模式下的ms检测,500-1200m/z;负模式下的ms片段化,bruker amazonsl iontrap(自动或手动);样品在流动相中被1∶10稀释并在注射前过滤(hptfe 0,22μm);注射体积:10μl。
[0316]
将光谱和片段化图案与reb a、reb d和reb i的标准品进行比较。这些参考化合物的保留时间分别为21分钟(m/z 965.47)、8.4分钟(m/z 1127.71)和20分钟(m/z 1127.69)。
[0317]
根据本发明的发酵样品的示例性hplc光谱示于图2至6中。
[0318]
感官结果(训练有素的小组):
[0319]
示例性发酵样品的感官特征示于图7中。
[0320]
参考样品(未发酵):绿色外观(最深)、灰/木质调(香气和风味)、没有发酵调(香气和风味)。
[0321]
样品10(鲁氏接合酵母):颜色非常浅,温和的灰/木质调(香气),发酵调(香气)。风味不是很木质,并且有温和的发酵调,口感发涩。
[0322]
样品19(季也蒙迈耶氏酵母):浅色,灰/木质和发酵香调,发酵(最多)和木质风味,口感发涩。
[0323][0324][0325]
[0326]
实施例7b-示例性样品的甜菊醇糖苷的定量
[0327]
补充有30g/l葡萄糖的15ml体积的甜菊浸液(30g/l)接种有菌株编号k(新鲜产生的生物质)并在28℃下在100ml摇瓶中摇动培育(样品编号s015b)。发酵持续时间为48小时,目的是完全消耗糖。如实施例7a中那样进行收获。针对一组更大的标准品分析了样品和对照(定性分析,图8)并进行了定量评估(表7-3)。
[0328]
hplc方法ii:使用以下各者进行hplc分析:kinetex c18 2.6μm 150*2,1mm柱;溶剂a:0.1%甲酸,溶剂b:乙腈 0.1%甲酸;流量:二元梯度0.2ml/min,从20%b开始。
[0329]
总运行时间为54min。负模式下的ms检测,300-1300m/z。样品在流动相(80%a/20%b)中被1∶10稀释并在注射前过滤(hptfe 0,22μm);注射体积:10μl
[0330]
将光谱和片段化图案与reb e、reb d、reb m、reb i、reb a、reb f、reb c、reb b以及甜菊苷、杜克苷a、甜茶苷、甜菊醇二糖苷的标准品进行比较。
[0331]
发酵样品#s015b的hplc光谱示于图8中。
[0332]
分析结果:
[0333]
表7-3:示例性甜菊醇糖苷[ppm]分析,样品编号s015b*
[0334][0335]
*方法:food and chemical toxicology 41(2003)359-374
[0336]
实施例8-发酵微生物的筛选
[0337]
如本文所述制备的60g/l甜菊浸液的小样品(15ml)补充有30g/l葡萄糖,且接着接种各种发酵微生物并在100ml摇瓶中进行培育。微生物菌株在摇瓶中小规模培养,2天后收获,悬浮于用过的培养基中,且随后用作浸液中的接种物。发酵步骤的持续时间为48小时。如实施例7a中那样进行收获。
[0338]
[0339][0340]
分析结果:
[0341]
hplc方法i:糖、酸分析
[0342]
·
柱:rezex
tm roa-organic acid h (8%),300
×
4.6mm
[0343]
·
溶剂a:0,1%(v/v)三氟乙酸(tfa)
[0344]
·
流量:等度
[0345]
·
总运行时间:30min
[0346]
·
通过dad(210nm)和rid进行检测
[0347]
·
样品用适当体积的2%(v/v)和水稀释2倍或5倍(取决于预期的代谢物浓度),最终浓度为1%(v/v)tfa,并在注射前过滤(hptfe 0.22μm)
[0348]
·
注射体积:10μl
[0349]
·
目标分析物:乙酸、甲酸、果糖、葡萄糖、甘油、乳酸和琥珀酸
[0350]
样品编号葡萄糖[g/l]乳糖[g/l]甘油[g/l]乳酸[g/l]phma10,0011,023,846,223,55ma20,0012,294,477,203,43ma30,010,002,902,593,79ma41,140,002,672,333,71ma50,150,003,765,413,52ma60,000,003,445,223,55ma712,180,004,086,763,43ma812,270,004,066,673,44ma90,000,002,163,653,75ma100,000,002,723,953,7ma110,000,000,000,006,23ma1215,350,002,102,394,08
[0351]
hplc方法ii:定性甜菊醇糖苷分析
[0352]
·
柱:kinetex c18 2,6μm 150*2,1mm
[0353]
·
溶剂a:0,1%甲酸
[0354]
·
溶剂b:acn 0,1%甲酸
[0355]
·
流量:二元梯度0,2ml/min,从20%b开始
[0356]
·
总运行时间:54min
[0357]
·
负模式下的ms检测,300-1300m/z
[0358]
·
样品在流动相(80%a/20%b)中被1∶10稀释并在注射前过滤(hptfe 0,22μm)
[0359]
·
注射体积:10μl
[0360]
·
目标分析物:reb e、d、m、i、a、f、c、b以及甜菊苷、杜克苷a、甜茶苷、甜菊醇二糖苷
[0361]
[0362]
[0363][0364]
感官结果:
[0365]
发酵样品如下应用于饮料组合物中:
[0366]
准备将被1∶4稀释(1份基料兑4份水)的浓缩饮料基料。
[0367]
以10g/l添加成分
[0368]
补足剩余的水。
[0369]
黑醋栗饮料:
[0370]
基本成分:
[0371]
水、浓缩黑醋栗汁(6%)、糖、增稠剂(聚右旋糖)、酸度调节剂(葡萄糖酸钠)、胡萝卜和木槿萃取物、维生素c、天然黑醋栗调味剂、酸(柠檬酸)。
[0372]
发酵样品由4名训练有素的品尝员品尝,以1至5的描述符对每一者进行评分。全糖饮料用作阳性基准(fs=全糖),且含人造甜味剂的饮料用作阴性对照(h=含人造甜味剂的基料)。
[0373][0374]
实施例9-发酵微生物的筛选
[0375]
如本文所述制备的60g/l甜菊浸液的小样品(50ml)补充有30g/l糖,且接着接种各
种发酵微生物并在28℃下在300ml摇瓶中摇动培育。微生物菌株在摇瓶中小规模培养,2天后收获,悬浮于用过的培养基中,且随后用作浸液中的接种物。发酵步骤的持续时间为3天。
[0376]
如实施例7a中那样进行收获。
[0377]
[0378][0379]
分析结果:
[0380]
hplc方法i:糖、酸分析
[0381]
·
柱:rezex
tm roa-organic acid h (8%),300
×
4.6mm
[0382]
·
溶剂a:0,1%(v/v)三氟乙酸(tfa)
[0383]
·
流量:等度
[0384]
·
总运行时间:30min
[0385]
·
通过dad(210nm)和rid进行检测
[0386]
·
样品用适当体积的2%(v/v)和水稀释2倍或5倍(取决于预期的代谢物浓度),最终浓度为1%(v/v)tfa,并在注射前过滤(hptfe 0.22μm)
[0387]
·
注射体积:10μl
[0388]
·
目标分析物:乙酸、甲酸、果糖、葡萄糖、甘油、乳酸和琥珀酸
[0389][0390]
hplc方法ii:定性甜菊醇糖苷分析
[0391]
·
柱:kinetex c18 2,6μm 150*2,1mm
[0392]
·
溶剂a:0,1%甲酸
[0393]
·
溶剂b:acn 0,1%甲酸
[0394]
·
流量:二元梯度0,2ml/min,从20%b开始
[0395]
·
总运行时间:54min
[0396]
·
负模式下的ms检测,300-1300m/z
[0397]
·
样品在流动相(80%a/20%b)中被1∶10稀释并在注射前过滤(hptfe 0,22μm)
[0398]
·
注射体积:10μl
[0399]
·
目标分析物:reb e、d、m、i、a、f、c、b以及甜菊苷、杜克苷a、甜茶苷、甜菊醇二糖苷
[0400]
[0401]
[0402]
[0403][0404]
感官结果:
[0405]
发酵样品如下应用于饮料组合物中:
[0406]
准备将被1∶4稀释(1份基料兑4份水)的浓缩饮料基料。
[0407]
以10g/l添加成分
[0408]
补足剩余的水。
[0409]
苹果/樱桃饮料:
[0410]
基本成分:
[0411]
成分:水、糖、浓缩果汁5%(苹果、樱桃)、天然调味品(苹果、樱桃)、酸(柠檬酸、抗坏血酸)、酸度调节剂(葡萄糖酸钠)、色素(胡萝卜、木槿萃取物)、甜味剂(甜菊醇糖苷)
[0412]
由训练有素的专家品尝发酵样品,将样品与内部基准进行比较。
[0413][0414][0415]
实施例10-发酵微生物的筛选
[0416]
如本文所述制备的60g/l甜菊浸液的小样品(50ml)补充有30g/l糖,且接着接种各种发酵微生物并在300ml摇瓶中进行培育。微生物菌株在摇瓶中小规模培养,2天后收获,悬浮于用过的培养基中,且随后用作浸液中的接种物。发酵步骤的持续时间为3天。如实施例7a中那样进行收获。
[0417]
[0418][0419]
分析结果:
[0420]
hplc方法i:糖、酸分析
[0421]
·
柱:rezex
tm roa-organic acid h (8%),300
×
4.6mm
[0422]
·
溶剂a:0,1%(v/v)三氟乙酸(tfa)
[0423]
·
流量:等度
[0424]
·
总运行时间:30min
[0425]
·
通过dad(210nm)和rid进行检测
[0426]
·
样品用适当体积的2%(v/v)和水稀释2倍或5倍(取决于预期的代谢物浓度),最终浓度为1%(v/v)tfa,并在注射前过滤(hptfe 0.22μm)
[0427]
·
注射体积:10μl
[0428]
·
目标分析物:乙酸、甲酸、果糖、葡萄糖、甘油、乳酸和琥珀酸
[0429][0430]
感官结果(训练有素的专家):
[0431]
发酵样品如下应用于饮料组合物中:
[0432]
准备将被1∶4稀释(1份基料兑4份水)的浓缩饮料基料。
[0433]
以10g/l添加成分
[0434]
补足剩余的水。
[0435]
苹果/樱桃饮料:
[0436]
基本成分:
[0437]
成分:水、糖、浓缩果汁5%(苹果、樱桃)、天然调味品(苹果、樱桃)、酸(柠檬酸、抗坏血酸)、酸度调节剂(葡萄糖酸钠)、色素(胡萝卜、木槿萃取物)、甜味剂(甜菊醇糖苷)
[0438]
由训练有素的专家品尝发酵样品,将样品与内部基准进行比较
[0439]
样品编号甜度描述mc1干净的甜味,没有绵长的余味,减少甜菊的苦味mc2干净的甜味,没有绵长的余味,减少甜菊的苦味mc3干净的甜味,没有绵长的余味,减少甜菊的苦味mc4干净的甜味,没有绵长的余味,减少甜菊的苦味mc5干净的甜味,没有绵长的余味,减少甜菊的苦味mc6干净的甜味,没有绵长的余味,减少甜菊的苦味
mc7干净的甜味,没有绵长的余味,减少甜菊的苦味mc8干净的甜味,没有绵长的余味,减少甜菊的苦味mc9干净的甜味,没有绵长的余味,减少甜菊的苦味mc10干净的甜味,没有绵长的余味,减少甜菊的苦味mc11干净的甜味,没有绵长的余味,减少甜菊的苦味mc12干净的甜味,没有绵长的余味,减少甜菊的苦味
[0440]
实施例11
[0441]
为了探索本发明的成分作为食品(例如酥饼)的甜味成分的效用,进行了以下试验。
[0442]
目的是了解消费者的看法以及四种酥饼之间的主要区别:
[0443]-全糖(酥饼a)
[0444]-半糖 根据本发明的发酵的甜菊浸液(酥饼b)
[0445]-半糖 未发酵的甜菊浸液(酥饼c)
[0446]-半糖 reb a(酥饼d)
[0447]
成分:
[0448]
根据以下配方制作每批1kg的酥饼(量以wt%为单位):
[0449] abcd黄油45454545面粉30303030糖20101010聚右旋糖-101010发酵的甜菊浸液-5.7
‑‑
未发酵的甜菊浸液
‑‑
5.7-reb a
‑‑‑
0.045水5
‑‑5[0450]
赤藓糖醇配方用于确定每种甜味剂的等效量,以达到相同的理论甜度。
[0451]
将所有面团擀成大约1cm厚和5cm直径,并在160℃的烤箱中烹制25分钟。
[0452]
饼干被冷却并包装好发送给参与者品尝。
[0453]
方法:
[0454]
·
共有11人在在线测试中对样品进行了评估。
[0455]
·
参与者根据一份关于他们个人味道和感受的问卷调查来评估样品,这是一种主观方法。
[0456]
·
在在线调查应用程序上捕获数据,且接着使用xlstat进行分析。
[0457]
·
对于每个问题,通过anova和多极差检验(lsd)对数据进行统计分析,将产品按照先后顺序和样品均值之间的显著差异分配到不同的组(用字母标识)。
[0458]
·
所有提到的差异在95%置信水平上都是显著的。
[0459]
在总体喜好和味道喜好方面,样品之间没有发现显著差异。
[0460]
示例性感官结果(jar问题)示于图9中。
[0461]-外观:b和d非常相似。其它样品颜色较浅
[0462]-整体风味:b是最不强烈的
[0463]-甜度:b和a在甜度上的感觉相似(恰到好处)。
[0464]-苦度:d是最苦的。
[0465]-整体质地:d是最干的,并且a是恰到好处的。
[0466]-脆度:d是最脆的。a和c的感觉相似。
[0467]-余味绵长(at):c比其它样品略微更绵长。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。