1.本发明涉及皮肤益生技术领域,尤其涉及皮肤益生元、其制备方法及其应用。
背景技术:
2.皮肤作为最大的暴露器官,其最主要的功能是在机体内外环境之间形成有效的保护屏障,以抵御物理性、化学性、生物性的侵袭,同时降低体内水分、电解质的流失。
3.人类皮肤微生物,主要包括细菌、病毒、真菌和瞒虫等,1cm2的皮肤可含有多达10亿个微生物,其稳定性取决于皮肤微生物和人类宿主的特性以及防御机制之间的微妙平衡。
4.从皮肤表面微生物相互作用的动力学上,将微生物在宿主内的相互作用分为三种关系。这些关系可能对其中一个物种产生负面、正面影响或者根本没有影响。产生正面作为的成为皮肤益生菌,产生负面作用的称为皮肤致病菌。例如,如上皮细胞具有toll样受体(tlrs)识别微生物的先天能力。病原微生物刺激tlrs可诱导不同的基因表达模式,从而激活多种免疫反应。己经证明表皮葡萄球菌通过启动tlr2介导的抑制炎症的串扰机制来调节tlr3依赖性炎症,该细菌能够菌还通过tlr2依赖机制诱导角质形成细胞表达内源性抗菌肽,以杀死致病微生物。常见的皮肤致病菌,例如链格孢霉,免疫抑制、局部外伤或系统疾病中引起皮肤感染。
技术实现要素:
5.有鉴于此,本发明提供了一种皮肤益生元、其制备方法及其应用,该皮肤益生元是通过二裂酵母对乳酸菌溶胞产物和燕窝提取物进行发酵制得,具有促进益生菌在皮肤表面生长和抑制治病菌的功效,具有广泛应用于皮肤益生等相关制品中的广泛应用前景。
6.本发明实施例公开了皮肤益生元的制备方法,包括以下步骤:
7.获得二裂酵母的活化液;
8.将所述活化液转接至种子培养基中培养,得到种子液,所述种子培养基包含10~45mg/ml乳酸菌溶胞产物,10~50mg/ml燕窝提取物;
9.将所述种子液转接至发酵培养基中培养,得到发酵液,所述发酵培养基包含15~45mg/ml乳酸菌溶胞产物,15~65mg/ml燕窝提取物;
10.对所述发酵液进行分离纯化得到冻干粉,即为皮肤益生元。
11.进一步地,“获得二裂酵母的活化液”包括将二裂酵母的平板菌落转接至活化培养基中培养制得的步骤;其中,所述活化培养基包含5~15mg/ml乳酸菌溶胞产物,5~15mg/ml燕窝提取物。
12.进一步地,所述乳酸菌溶胞产物通过干酪乳杆菌(lactobacillus casei)发酵产生,其包含菌体及在发酵过程中合成的全部活性成分。
13.进一步地,所述燕窝提取物的制备方法包括:
14.将白燕盏用研钵将其研成细粉,用去离子水分散后,于60℃水浴下放置3~4h,过10min搅拌一次保证均匀受热,过滤,残渣加水再重复上述步骤对其提取一次,再次过滤,合并滤液于4℃5000r/min离心15min,取上清液即得燕窝提取液,冷冻干燥,即可得到燕窝提取物。
15.进一步地,所述活化培养基包含5~15mg/ml乳酸菌溶胞产物,5~15mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
16.进一步地,所述种子培养基包含10~45mg/ml乳酸菌溶胞产物,10~50mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
17.进一步地,所述发酵培养基包含15~45mg/ml乳酸菌溶胞产物,15~65mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
18.另一方面,本发明公开了所述的制备方法制得的皮肤益生元,其包含重量百分含量为67.3%~98.9%的总糖,其中的多糖重均分子量为263487~272458之间,分子量分散系数为1.18~1.36之间。
19.另一方面,本发明公开了一种组合物,按重量份计包括50~60份混合菌粉、105~108份透明质酸、100~150份白凡士林、150-170份轻质液状石蜡、115-125份硬脂酸、85~90份聚山梨酯、30~35份油酸山梨坦、1~6份山梨酸钾、1000-1500份水以及如权利要求8所述的皮肤益生元50~100份;其中,50~60份混合菌粉、105~108份透明质酸、100~150份白凡士林、150-170份轻质液状石蜡、115-125份硬脂酸、85~90份聚山梨酯、30~35份油酸山梨坦、1~6份山梨酸钾和1000-1500份水配制成独立包装的软膏。
20.另一方面,本发明公开了所述的皮肤益生元在制备皮肤益生制品中的应用。
21.与现有技术相比,本发明至少具有以下有益效果之一:
22.本发明中涉及的皮肤益生元是通过利用二裂酵母对对乳酸菌溶胞产物和燕窝提取物进行发酵制得,该皮肤益生元包含重量百分含量为67.3%~98.9%的总糖,其中的多糖重均分子量为263487~272458之间,分子量分散系数为1.18~1.36之间;并且包含岩藻糖、鼠李糖、n-乙酰葡萄糖胺、n-乙酰半乳糖胺和葡萄糖的单糖组成。该皮肤益生元能够于体外大肠杆菌、金黄色葡萄球菌、须癣毛癣菌和白色念珠菌、拉微球菌、链格孢霉和烟曲霉的生长,并且还能促进两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长,不仅具有益生作用,还具有抑菌作用。最后,本发明还通过动物实验证实了该皮肤益生元与益生菌粉配合使用能够显著抑制皮肤治病菌的生长,具有抗皮肤真菌感染的功效。
附图说明
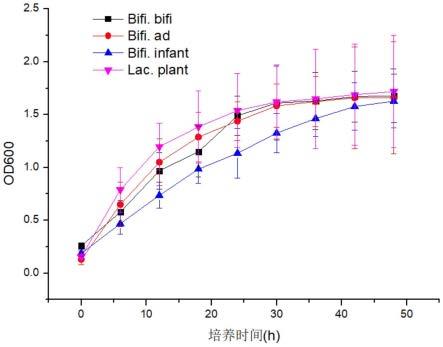
23.图1为本发明实施例1提供的皮肤益生元对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长曲线图。
24.图2为本发明实施例2提供的皮肤益生元对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长曲线图。
25.图3为本发明实施例3提供的皮肤益生元对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长曲线图。
26.图4为本发明实施例4提供的皮肤益生元对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长曲线图。
27.图5为本发明实施例5提供的皮肤益生元对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长曲线图。
28.图6为本发明实施例6提供的皮肤益生元对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长曲线图。
29.图7为本发明对比例1提供的皮肤益生元对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长曲线图。
30.图8为本发明对比例2提供的皮肤益生元对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长曲线图。
31.图9为本发明对比例3提供的皮肤益生元对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长曲线图。
具体实施方式
32.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。本发明中未详细单独说明的试剂均为常规试剂,均可从商业途径获得;未详细特别说明的方法均为常规实验方法,可从现有技术中获知。
33.需要说明的是,本发明的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序,也不对其后的技术特征起到实质的限定作用。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本发明的实施例能够以除了在这里图示或描述的那些以外的顺序实施。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
34.本发明实施例公开了一种皮肤益生元,其通过二裂酵母对乳酸菌溶胞产物和燕窝提取物进行发酵,对发酵产物进行分离纯化制得。
35.1、乳酸菌溶胞产物
36.在一些实施例中,本发明实施例提供的乳酸菌溶胞产物是通过干酪乳杆菌(lactobacillus casei)发酵产生的,其包含菌体及在发酵过程中合成的全部活性成分,例如其购自山东昂立达。
37.2、燕窝提取物
38.在一个燕窝提取物的制备实施例中,称取10g白燕盏(北京同仁堂),用研钵将其研成细粉放入80ml小烧杯中,加入20ml去离子水,在60℃水浴下放置3~4h,过10min搅拌一次保证均匀受热,过滤,残渣加水再重复上述步骤对其提取一次,再次过滤,合并滤液于4℃
5000r/min离心15min,取上清液即得燕窝提取液,冷冻干燥,即可得到燕窝提取物。
39.3、二裂酵母发酵
40.(1)发酵菌株
41.二裂酵母,学名叫二裂酵母,最初是由法国儿科医生henry tissier从食用母乳的婴儿粪便中提取出来的,最初被运用在治疗肠道感染方面的疾病上而且它还能明显增加血液中过氧化物歧化酶的含量和生物活性,促进体内自由基的清除。本发明选用的二裂酵母菌株为二裂酵母(bifidobacterium bifidum),货号bmz133001,明舟生物。
42.(2)菌株活化
43.将该二裂酵母菌株从-80℃冰箱取出,将保存的菌液于无菌条件下接种至含有5ml活化培养基的试管中,放于厌氧工作站中24h。将培养后的二裂酵母在pyg选择培养基中进行平板划线,将平板放于厌氧工作站中培养72h,挑取平板上生长的二裂酵母菌落(圆形,中等大小,凸起,边缘整齐,蓝蕴白底菌落)于活化培养基中培养24h,获得二裂酵母活化液。在一些实施例中,pyg选择培养基包含38mg/ml蛋白胨,9.6mg/ml葡萄糖,19mg/ml酵母提取物,0.15mg/ml氯化钠,0.96mg/ml半胱氨酸盐酸盐,0.15mg/ml氯化钙,0.15mg/ml硫酸镁,1.5mg/ml磷酸氢二钾、0.77mg/ml碳酸氢钠、0.06g/lx-gal(用于筛选具有β-半乳糖苷酶活性的蓝白斑菌落)。用100ml去离子水混合均匀,调节ph值为7.2,在高压锅中115℃高压灭菌15分钟。
44.(3)活化培养基
45.在一个实施例1中,该活化培养基包含10mg/ml乳酸菌溶胞产物,10mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。在厌氧条件下,将该活化培养基煮沸和冷却后加入半胱氨酸。在高压灭菌前将培养基的ph使用2m的naoh调成6.8,然后在高压锅中115℃高压灭菌15min。
46.在一个实施例2中,该活化培养基包含15mg/ml乳酸菌溶胞产物,5mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。在厌氧条件下,将该活化培养基煮沸和冷却后加入半胱氨酸。在高压灭菌前将培养基的ph使用2m的naoh调成6.8,然后在高压锅中115℃高压灭菌15min。
47.在一个实施例3中,该活化培养基包含5mg/ml乳酸菌溶胞产物,15mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。在厌氧条件下,将该活化培养基煮沸和冷却后加入半胱氨酸。在高压灭菌前将培养基的ph使用2m的naoh调成6.8,然后在高压锅中115℃高压灭菌15min。
48.在一个对比例1中,该活化培养基包含10mg/ml酪蛋白胨,10mg/ml牛肉膏,10mg/ml酵母膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,
40mg/l碳酸氢钠和8mg/l氯化钠。在厌氧条件下,将该活化培养基煮沸和冷却后加入半胱氨酸。在高压灭菌前将培养基的ph使用2m的naoh调成6.8,然后在高压锅中115℃高压灭菌15min。
49.(4)种子液
50.在实施例1中,将其活化的活化液按照3v/v%接种量转接至液体的种子培养基中,于37℃厌氧工作站中培养24小时,获得种子液。其中,种子培养基包含15mg/ml乳酸菌溶胞产物,15mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
51.在实施例2中,将其活化的活化液按照3v/v%接种量转接至液体的种子培养基中,于37℃厌氧工作站中培养24小时,获得种子液。其中,种子培养基包含15mg/ml乳酸菌溶胞产物,15mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
52.在实施例3中,将其活化的活化液按照3v/v%接种量转接至液体的种子培养基中,于37℃厌氧工作站中培养24小时,获得种子液。其中,种子培养基包含15mg/ml乳酸菌溶胞产物,15mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
53.在实施例4中,将实施例1获得的活化液按照3v/v%接种量转接至液体的种子培养基中,于37℃厌氧工作站中培养24小时,获得种子液。其中,种子培养基包含45mg/ml乳酸菌溶胞产物,10mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
54.在实施例5中,将实施例1获得的活化液按照3v/v%接种量转接至液体的种子培养基中,于37℃厌氧工作站中培养24小时,获得种子液。其中,种子培养基包含10mg/ml乳酸菌溶胞产物,50mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
55.在对比例1中,将其活化的活化液按照3v/v%接种量转接至液体的种子培养基中,于37℃厌氧工作站中培养24小时,获得种子液。其中,种子培养基包含10mg/ml酪蛋白胨,10mg/ml牛肉膏,10mg/ml酵母膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1mltween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
56.在对比例2中,将对比例1得到的活化液按照3v/v%接种量转接至液体的种子培养基中,于37℃厌氧工作站中培养24小时,获得种子液。其中,种子培养基包含15mg/ml乳酸菌溶胞产物,15mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,
10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
57.在对比例3中,将实施例1获得的活化液按照3v/v%接种量转接至液体的种子培养基中,于37℃厌氧工作站中培养24小时,获得种子液。其中,种子培养基包含10mg/ml酪蛋白胨,10mg/ml牛肉膏,10mg/ml酵母膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
58.(5)发酵液
59.在实施例1中,将其得到的种子液按照1v/v%接种量转接至液体的种子培养基中,于37℃厌氧工作站中培养72小时,获得发酵液。其中厌氧工作站的气体环境为10%二氧化碳、10%氢气和80%混合气体(组分为氢气5%,二氧化碳10%,剩余气体为氮气)。其中,发酵培养基包含45mg/ml乳酸菌溶胞产物,65mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
60.实施例2、实施例3、实施例4、实施例5、对比例1、对比例2和对比例3采用上述相同的发酵条件和发酵培养基进行发酵,得到各自对应的发酵液。
61.在一个实施例6中,其发酵条件与实施例1相同,其发酵培养基包含45mg/ml乳酸菌溶胞产物,65mg/ml燕窝提取物,10mg/ml酪蛋白胨,10mg/ml牛肉膏,5mg/ml大豆蛋白胨,10mg/ml葡萄糖,0.5mg/ml一水硫酸锰,0.1ml tween 80,50mg/l半胱氨酸盐,二水氯化钙1mg/l,2mg/l七水硫酸镁,4mg/l磷酸二氢钾,4mg/l磷酸氢二钾,40mg/l碳酸氢钠和8mg/l氯化钠。
62.4、发酵液的处理
63.收集各实施例和对比例提供的发酵液,5000r/min离心5min,取上清液。将入3倍体积的无水乙醇混合,10000r/min离心5min,收集析出物,再次加入3倍重量的无水乙醇重悬后,10000r/min离心2min收集沉淀。将收集到的沉淀溶于少量去离子水中,然后再加入4倍体积的80%(m/v)三氯乙酸,室温下搅拌45min,4℃静置45min后10000r/min离心15min,去掉沉淀并收集上清液。用旋转蒸发仪对上清液进行浓缩,缩小体积后在上清液中加入三倍体积的无水乙醇(95%),4℃静置过夜,冷冻干燥,即可得到一种冻干粉,即为本技术实施例所述的皮肤益生元。
64.5、冻干粉中多糖分析
65.采用苯酚硫酸法检测上述制得的冻干粉中总糖含量,结果如表1所示。对表1中的各实施例和对比例提供的冻干粉中总糖含量进行多重比较和显著性差标记,结果可知,实施例1~6提供的冻干粉中总糖含量显著高于对比例1~3。
66.参照“胆木和裸花紫珠多糖的分子量测定[j]暨南大学学报(自然科学与医学版),2018-06-14”公开的方法,采用高效液相凝胶色谱法联合cad检测器,以葡聚糖作为标准溶液,运用chromeleon 7extension pack gpctemplates软件作图分析,根据葡聚糖对照品标准曲线和方程测定实施例1~6和对比例1~3中多糖的重均分子量和分子量分布。结果如表
1所示,本技术实施例1~6得到的冻干粉中多糖重均分子量为263487~272458之间,重均分子量显著低于对比例1~3,分子量分散系数为1.18~1.36之间,分散系数显著低于对比例1~3。由此说明,本技术实施例1~6提供的冻干粉中多糖成分更加单一,分子量更低。
[0067]
表1
[0068][0069]
对上述各实施例和对比例制得的单糖组成进行分析,采用甘露糖(man)、阿拉伯糖(arab)、岩藻糖(fuc)、果糖(fru)、半乳糖(gala)、鼠李糖(rha)、葡萄糖(glu)、葡萄糖醛酸(glu-ac)、木糖(xyl)、n-乙酰氨基葡萄糖(glu-nac)和n-乙酰-d-半乳糖胺(gala-nac)cas#:1811-31-0作为标准品,将标准品与无菌水混合,配制为含有上述各种标准品混合母液,其中每中单糖浓度分别为1.25mm、5mm、10mm和20mm,采用如“strydom dj.chromatographic separation of1-phenyl-3-methyl-5-pyrazolone-derivatized neutral,acidic and basic aldoses.journal of chromatography a,1994,678(1):1723”所示的方法分别对标准品和上述实施例1~6和对比例1~3提供冻干粉进行衍生化,然后进行hplc检测。hplc检测条件为:色谱柱:zorbax eclipse xdb-c18分离柱(4.6mmx150mm,sam),紫外检测器(245nm),柱温:25℃,流动相a为含10%乙腈的0.1m乙酸缓冲液(乙酸铵-乙酸,ph5.5),流动相b为含25%乙睛的0.1m乙酸缓冲液(乙酸铵-乙酸,ph5.5),洗脱程序为0
→
40min,40%
→
100%流动相b,流速为1.0ml/min,进样体积为20μl。根据hplc谱图中不同浓度的标准品中各单糖吸收峰峰面积与其浓度制作标准曲线,拟合得到标准方程,如此将实施例和对比例提供的冻干粉中hplc谱图中单糖吸收峰面积代入标准方程,即可计算冻干粉中各单糖含量,根据各单糖含量计算其摩尔比例,结果如表2所示,表2中,“-”表示未检出。
[0070]
由表2可知,实施例1~6提供的冻干粉中包含岩藻糖、鼠李糖、n-乙酰葡萄糖胺、n-乙酰半乳糖胺和葡萄糖,并且各单糖比例也比较接近,而对比例1和3分别提供的冻干粉中不包含鼠李糖,并且其他几种单糖组成也与实施例1~6提供的单糖比例显著不同。
[0071]
表2单糖组成(摩尔百分比)
[0072][0073][0074]
6、抑菌性分析
[0075]
选取大肠杆菌(bncc336902,e.coli,北京普天同创)、金黄色葡萄球菌(bncc186335,s.aureus,北京普天同创)、须癣毛癣菌(b80199,trichophy.menta,明舟生物)、白色念珠菌(bncc263676,c.alb.ber.,北京普天同创)、里拉微球菌(bncc337476,micro.lyl,北京普天同创)、链格孢霉(bmz074983,alt.sp.,明舟生物)、烟曲霉(bncc338385,asp.fum,北京普天同创)作为实验菌种。取细菌原菌种划线接种到蛋白胨营养琼脂斜面上,37℃培养20h左右,将菌斑用少量灭菌生理盐水分散,获取浓度为106/ml的菌悬液。取不同真菌菌种划线接种到pda培养基斜面上,28摄氏度培养3~5d,用适量灭菌生理盐水洗下菌斑,同样制成浓度为106/ml的菌悬液。将灭菌后的培养基冷却至50℃左右,倒取适量于无菌培养皿中,待其凝固。用移液枪移取0.1ml菌悬液于相应的平板中,制成含菌平板。
[0076]
将实施例1~6和对比例1~3分别提供的冻干粉分别用无菌水配制成浓度为0.5mg/ml的供试品溶液,将直径为6mm的无菌圆形滤纸片浸入供试品溶液中充分吸附后,置于上述不同的含菌平板上,置于恒温培养箱进行培养,细菌37℃培养18-24h左右,真菌28℃培养48h左右,取出观察。采用十字交叉法测定抑菌圈的直径。结果如表3和表4所示。
[0077]
表3抑菌圈(mm)
[0078]
[0079][0080]
表3示出了各实施例和对比例配制的0.5mg/ml的供试品溶液对于大肠杆菌、金黄色葡萄球菌、须癣毛癣菌和白色念珠菌的抑菌圈结果,并对每列数据进行多重比较和显著性差异标记。结果可知,实施例1~6提供的冻干粉对此四种致病菌的抑菌效果优于对比例1~3。
[0081]
表4抑菌圈(mm)
[0082]
实施方式micro.lylalt.sp.asp.fum实施例14.39
±
0.25a3.26
±
0.19a3.05
±
0.13ab实施例24.27
±
0.21a3.18
±
0.16a2.97
±
0.11b实施例34.36
±
0.23a3.22
±
0.14a3.02
±
0.16ab实施例44.48
±
0.19a3.29
±
0.17a3.05
±
0.18ab实施例54.42
±
0.16a3.38
±
0.15a3.13
±
0.17a实施例64.53
±
0.14a3.42
±
0.14a3.16
±
0.14a对比例1---对比例21.78
±
0.15b1.89
±
0.23b-对比例3---
[0083]
表4示出了各实施例和对比例配制的0.5mg/ml的供试品溶液对里拉微球菌、链格孢霉和烟曲霉的抑菌圈结果,并对每列数据进行多重比较和显著性差异标记,表4中“-”表示未检出。由表4可知,实施例1~6提供的冻干粉对此三种致病菌的抑菌效果优于对比例1~3,而对比例1和3提供的冻干粉并未检出有抑菌效果。
[0084]
7、益生性分析
[0085]
本实验例采用两歧双歧杆菌(bncc337499,bifi.bifi)、青春双歧杆菌(bncc134301,bifi.ad)、婴儿双歧杆菌(bncc341709,bifi.infant)和植物乳杆菌(bncc194165,lac.plant),取四个菌株的冻干管,用无菌水溶解后,加入无菌的mrs培养基中,于厌氧培养箱中在37℃下培养48h。待培养结束后,通过平板划线法,在固体培养基上培养出单个菌落。再挑选单个菌落接种到灭菌的液体培养基中,于厌氧培养箱中在37℃下培养48h,得到四株菌的活化液。
[0086]
取试管若干支,分别加入9ml液体培养基(hb8527,北京普天同创),加塞密封好以后,在高压灭菌锅中121℃灭菌20min。称取将实施例1~6和对比例1~3分别提供的冻干粉分别用无菌水配制成浓度为5mg/ml的供试品溶液,过0.22μm水系滤膜除去细菌等杂质,取1ml加入到上述液体培养基中,配制成最终浓度分别为0.5mg/ml的液体培养基。
[0087]
接种已经活化的相应试验菌株于对应的液体培养基中,接种比例5%。于厌氧培养箱中在37℃下培养48h,测定四株益生菌在包含不同供试品溶液的液体培养基中的增殖率,每6h取样于600nm处检测吸光值即可表征菌体浓度,以培养时间为横坐标、以各时间点的
600nm吸光值为纵坐标绘制生长曲线。
[0088]
实施例1~6和对比例1~3分别提供的冻干粉对四种益生菌的生长影响结果如图1~9所示,实施例1~6明显具有促进四种益生菌的生长促进作用。而对比例1~3提供的冻干粉除对两歧双歧杆菌具有一定的促进作用,对于青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的生长促进作用较弱,甚至对植物乳杆菌几乎无生长促进作用。
[0089]
基于本技术实施例1~6提供的冻干粉对治病菌尤其是对皮肤治病菌须癣毛癣菌和白色念珠菌的抑菌作用,以及对两歧双歧杆菌、青春双歧杆菌、婴儿双歧杆菌和植物乳杆菌的益生作用,本技术发明人利用该冻干粉制备成为一种皮肤益生元,其与上述益生菌配合使用可以起到皮肤保养和抗炎作用。
[0090]
为此,本技术实施例公开了一种组合物,按重量份计包括50~60份混合菌粉、105~108份透明质酸、100~150份白凡士林、150-170份轻质液状石蜡、115-125份硬脂酸、85~90份聚山梨酯、30~35份油酸山梨坦、1~6份山梨酸钾、1000-1500份水以及如权利要求8所述的皮肤益生元50~100份;其中,50~60份混合菌粉、105~108份透明质酸、100~150份白凡士林、150-170份轻质液状石蜡、115-125份硬脂酸、85~90份聚山梨酯、30~35份油酸山梨坦、1~6份山梨酸钾和1000-1500份水配制成独立包装的软膏。
[0091]
在一些实施例中,该组合物具有抗菌预防皮肤衰老功能的益生菌群组合物的制备方法。该组合物中软膏的制备方法包括:称取配方量透明质酸,加入50ml双蒸水,待透明质酸溶解于水中后,封闭过夜保存,作为水相;次日称取配方量的白凡士林、轻质液状石蜡、硬脂酸、聚山梨酯、油酸山梨坦作为油相成分,混合后加热至85℃,得混合物a;量取配方量的双蒸水、山梨酸钾和混合菌粉,一并混入透明质酸溶液中作为水相成分,加热至85℃,得混合物b;将混合物a和混合物b相混合后,用电子搅拌器搅拌30分钟,至各成分搅拌均匀,得混合液c;将混合液c放入35℃水浴中进行陈化72小时,即可得到软膏。
[0092]
在一些实施例中,混合菌粉的制备方法包括:将冷冻保存的两歧双歧杆菌、青春双歧杆菌、长双歧杆菌、婴儿双歧杆菌、短双歧杆菌和植物乳杆菌在固体mb平板上划线进行活化,挑取单菌落接种于ms液体培养基中,36℃、转速为220rpm进行摇床培养15h,收获发酵液,与0.125倍重量的壳聚糖和0.05倍重量大豆磷脂混合后在35℃下以300rpm的搅拌速度搅拌25min,得到改性发酵液,对改性发酵液于2600rpm离心4min,得到固体物进行空冷冻干燥处理得到初级混合菌粉;将初级混合菌粉置于反应器中,将反应器的温度控制到20℃,按照2.5l/min的体积流量依次切换通入n
2 5min、co
2 10min、干空气17min、n2 6min进行活化,活化结束得到混合菌粉,经活菌计数,本技术实施例提供的混合菌粉中的益生菌的总数量不低于10
10
cfu/g。以此提供的组合物进行皮肤益生试验,具体如下。
[0093]
(1)供试品
[0094]
在一个实施例中,该组合物包括,所述组合物包括独立包装的软膏和上述实施例1~6提供的皮肤益生元,按重量份计,由以下成分组成:55份混合菌粉,106份透明质酸、135份白凡士林,165份轻质液状石蜡,1120份硬脂酸,85份聚山梨酯,35份油酸山梨坦,3份山梨酸钾和1250份水,以及独立包装的上述实施例1~6提供的冻干粉80份。为形成对比,本技术还提供了一些组合物,其按照此实施例,将其中的冻干粉改为对比例1~3提供。以实施例1~6和对比例1~3分别提供的组合物和软膏作为供试品。
[0095]
(2)试验动物
[0096]
动物试验用兔1.5~2.0kg,天津市百农实验动物繁育科技有限公司。
[0097]
1.2药物配制高剂量组每次涂药1.00g/kg,中剂量组每次涂药0.50g/kg,低剂量组每次涂药0.25g/kg,对照组为空白基质组。
[0098]
(3)试验方法
[0099]
试验在室内常温下进行,选取健康实验用兔,于实验室饲养观察3d,正常则用于试验。于试验前24h在动物背部脊柱两侧用80g/l的硫化钠脱毛。每侧脱毛面积为15-20cm2,保持皮肤完整,分笼饲养。向脱毛皮肤表皮多点注射106cfu/ml的皮肤致病菌链格孢霉(bmz074983,alt.sp.,明舟生物)1.5ml,注射完成后,若出现红肿,并取其中一兔组织块进行微生物培养,若坚持到病原菌,则表示造模成功。
[0100]
将造模成功的兔随机分为分为模型组、试验组、对照1组和对照2组。模型组不用药。试验组分别每天定时涂抹实施例1~6为基础制得的组合物,可先将软膏和冻干粉充分混合后涂抹于脱毛区,涂抹量为0.5g/cm2;对照1组以相同的方法和剂量涂抹实施例1~6为基础制得的组合物,对照2组以相同的方法和剂量涂抹上述实施例提供的软膏。连续涂抹14日,取脱毛区组织块均将过滤后采用il-6试剂盒(e-el-m2453c,武汉伊莱瑞特)检测其白细胞介素含量,拭子于脱毛区皮肤表面取样活菌计数法检测皮肤表面的致病菌数量。
[0101]
(4)结果
[0102]
试验期间,每日2次记录兔表现情况(包括皮肤、毛发、眼睛、勃膜、饮食、四肢活动、排便有无异常变化)、死亡情况(观察动物呼吸、中枢神经系统有无中毒症状表现及死亡),并对死亡兔作解剖观察。每5天称兔体质量,第30天处死存活兔,作解剖观察和皮肤组织病理学检查。结果各组试验兔,在试验后无中毒反应出现,无死亡,各组动物均未出现异常变化,活动正常,行为活泼,毛发光亮,饮食、排便无异常,口、眼、鼻无异常分泌物,用药前后试验兔体质量无明显变化。
[0103]
表5感染菌数(105个/ml)
[0104][0105]
表5示出了各供试品对于链格孢霉引起的皮肤治病干预后的皮肤菌数结果,并对每列数据进行多重比较和显著性统计标记。由此可知,试验组中各试验图脱毛区皮肤的感染菌数菌分别于试验第2天、第8天和第14天均显著低于对照1组、对照2组和模型组。由此说明,采用本技术实施例提供的冻干粉与包含混合菌粉的软膏配合使用,能够促进润膏中混合菌粉的益生生长,从而更加有利于其发挥抑制致病菌的生长。
[0106]
表6il-6(pg/ml)
[0107][0108]
表6示出了各供试品对于链格孢霉引起的皮肤治病干预后的皮肤组织中il-6炎症水平,并对每列数据进行多重比较和显著性统计标记。由此可知,试验组中各试验图脱毛区皮肤的il-6炎症水平分别于试验第2天、第8天和第14天均显著低于对照1组、对照2组和模型组。由此说明,采用本技术实施例提供的冻干粉与包含混合菌粉的软膏配合使用,能够促进润膏中混合菌粉的益生生长,从而更加有利于其发挥抑制致病菌的生长,抑制感染炎症发生。
[0109]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。