1.本发明涉及一种修复周围神经损伤的细胞基质神经移植物及其制备方法,属于可植入人体的医用生物材料技术领域。
背景技术:
2.周围神经损伤在临床上极为常见,不仅严重影响了病人的生活质量,而且増加了病人的经济负担。现有技术对于短距离的外周神经缺损,通常采用显微外科对位缝合的修复方法。而长距离的粗大外周神经缺损修复,则通过自体神经移植、支架材料移植的方法来实现;其中自体神经移植是神经移植修复的金标准,即利用手术切除一段自体神经,如前臂内侧或外侧皮神经、尺神经、股神经或桡神经分支,再移植修补受损神经,移植体中施万细胞被激活,分泌大量的神经营养因子,使轴突能够较快地再生。但是由于供体来源有限、免疫排斥、神经直径匹配度不一致、供区永久性失神经等问题限制了自体神经移植的临床应用。而生物支架材料的应用是使神经沿一定的方向生长,且预防神经瘤的产生,但修复再生过程时间长,神经再生速度较慢,而效应器和感受器萎缩较快。
3.组织工程化神经移植物是由支架材料、支持细胞、细胞外基质、神经生长因子等部分组成的有机统一体,可作为桥梁引导断裂的神经纤维由损伤近端向远端延伸,但其临床转化面临着诸多问题,如细胞或因子的类型和数量、细胞活力或因子活性、细胞表型稳定性、治疗时间、调控干预及高成本等问题。
4.脱细胞基质(acm)作为一个可行的组织工程移植物正逐渐被研究人员所青睐并用于修复组织损伤。将同种异体或异种神经(或非神经)组织通过各种物理、化学和酶解等方法去细胞处理,可以产生组织来源的脱细胞基质。组织来源的脱细胞基质是一种适合于制备神经支架的非细胞生物材料,可作为自体神经移植物的替代物,用于修复外周神经缺损。与用单个细胞外基质成分制备的支架相比,组织来源的脱细胞基质支架(也称为非细胞神经移植)具有更好的保留原生组织的基本结构和促进周围神经再生的能力。尽管组织或器官来源的脱细胞基质支架具有支持组织或细胞生长的生物化学和物理因素,但获得质量一致的供体组织仍然是一个关键限制。此外,他们还存在一些缺陷,如潜在免疫原性、病原体的转移、不可控制的降解与制造成本过高等相关问题。因此,临床周围神经损伤后的修复和再生仍是一个巨大的挑战。
技术实现要素:
5.本发明的目的在于克服现有技术中的不足,提供一种修复周围神经损伤的细胞基质神经移植物及其制备方法,利于细胞的黏附和迁移,促进神经再生及功能恢复。
6.为达到上述目的,本发明所采用的技术方案是:第一方面,本发明提供一种修复周围神经损伤的细胞基质神经移植物,包括脱细胞基质及支架,所述脱细胞基质为干细胞分泌形成后脱细胞得到,保留了细胞外基质的各种重要的成分以及框架,有利于神经细胞的黏附以及轴突再生的导向,加快周围神经再生
及功能恢复;所述脱细胞基质包绕在支架周围。
7.结合第一方面,进一步的,所述干细胞为人源性骨髓间充质干细胞,方便进行组织工程神经移植物的临床转化。
8.进一步的,所述支架为生物可降解支架,包括壳聚糖与重组人胶原蛋白,其特点是生物相容性好,可降解,为神经轴突再生提供可引导生长方向的作用。
9.第二方面,本发明还提供上述任一项所述一种修复周围神经损伤的细胞基质神经移植物的制备方法,包括如下步骤:制备脱细胞基质;将脱细胞基质包绕在支架周围,构建成细胞基质神经移植物初始形态;将细胞基质神经移植物初始形态放置于2-6℃,至少24小时,进行自组装形成管状结构;所述管状结构经冷冻干燥处理,构建为细胞基质神经移植物。通过该方法制得的细胞基质神经移植物不含有由于制备工艺带入的外源性毒性物质,具有良好生物相容性和生物可降解性,以及良好的力学性能。
10.结合第二方面,进一步的,所述脱细胞基质以支架为轴,卷至多层,包绕在生物可降解支架周围,可以自组装形成管状结构,为神经细胞生长提供了必须的途径,以及引导和取向性生长作用。
11.进一步的,所述脱细胞基质以生物可降解支架为轴,卷至6、9或12层,包绕在生物可降解支架周围。
12.进一步的,所述冷冻干燥的温度为-80℃。
13.进一步的,所述脱细胞基质的制备过程如下:将人源性骨髓间充质干细胞稀释种入大皿,待细胞饱和度≥90%,加入含抗坏血酸的无血清培养基刺激7-14天,促进细胞分泌细胞外基质;使用磷酸盐缓冲液清洗,加入灭菌超纯水低渗后,去除灭菌超纯水,加入细胞裂解液萃取,再使用磷酸盐缓冲液清洗,获得脱细胞基质。
14.与现有技术相比,本发明所达到的有益效果:本发明通过培养细胞后脱细胞获得天然的细胞外基质,保留了细胞外基质的各种重要成分以及框架,有利于神经细胞的黏附以及轴突再生的导向,加快周围神经再生及功能恢复;细胞基质神经移植物不含有由于制备工艺带入的外源性毒性物质,具有良好生物相容性和生物可降解性,以及良好的力学性能;选用人源性骨髓间充质干细胞,使用无血清培养基,方便进行组织工程神经移植物的临床转化;将脱细胞基质包绕在生物可降解支架周围,可以自组装形成管状结构,为神经细胞生长提供了必须的途径,以及引导和取向性生长作用;利用本发明方法制备的细胞基质神经移植物,避免同种异体细胞移植的免疫原性,适宜大规模人群的使用。
附图说明
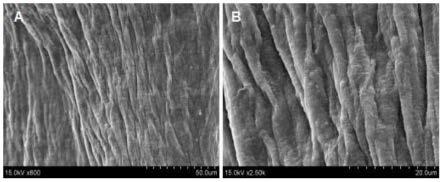
15.图1为本发明实施例提供的脱细胞基质制备前后光镜图,其中图a为脱细胞前干细胞光镜图,图b为脱细胞后基质光镜图;图2为本发明实施例提供的脱细胞基质的collagenⅳ及fibronectin免疫化学图,其中图a为collagenⅳ染色,图b为fibronectin染色;图3为本发明实施例提供的脱细胞基质的扫描电镜图,其中图a为2500倍镜下电镜图,b为5000倍镜下电镜图;图4 为本发明实施例提供的细胞基质神经移植物的扫描电镜图,其中图a为800倍镜下电镜图,b为2500倍镜下电镜图;图5 为本发明实施例提供的再生神经电生理检测结果示意图,其中左侧为各组复合肌动作电位波形图,其中图a为细胞基质组,b为自体组,c为假手术组;右侧图为各组内不同样本再生神经复合肌动作电位波幅比较图,****p<0.001;图6为本发明实施例提供的再生神经中段横切面的透射电镜图,上部为各组髓鞘局部放大20000倍透射电镜图,其中图a为细胞基质组,b为自体组,c为假手术组;下部为各组髓鞘板层数比较图,****p<0.001;图7为本发明实施例提供的靶肌湿重比结果示意图,上部为各组腓肠肌外观形态图,其中图a为细胞基质组,b为自体组,c为假手术组;下部为各组腓肠肌湿重比分析,***p<0.001,****p<0.001;图8为本发明实施例提供的运动终板重建结果图,其中上部为运动终板成熟度示意图;中部为各组运动终板观察,其中图a为细胞基质组,b为自体组,c为假手术组;下部为不同分期运动终板比例统计分析柱状图;图9为本发明实施例提供的靶肌纤维横截面积结果图,其中上部为各组腓肠肌肌纤维横截面观察图,其中图a为细胞基质组,b为自体组,c为假手术组;下部为各组腓肠肌肌纤维横截面积统计比较图,**p<0.001,****p<0.001。
具体实施方式
16.下面结合附图对本发明作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
17.实施例一:脱细胞基质的制备选用p3代hbmscs细胞(购自atcc细胞库)以105个/ml种入大皿,待细胞饱和度达到≥90%,加入含抗坏血酸的无血清培养基进行刺激,本实施例选择刺激7-14天,以促进细胞分泌细胞外基质;使用磷酸盐缓冲液清洗3次后,加入灭菌的超纯水,37℃
±
0.5℃低渗至少10分钟;去除灭菌超纯水,加入细胞裂解液,由3% triton x-100和2% sds组成,37℃
±
0.5℃萃取不超过5分钟,磷酸盐缓冲液清洗3次,获得脱细胞基质。
18.本实施例中人源性骨髓间充质干细胞用抗坏血酸刺激10天,随着时间的延长其分泌的细胞外基质渐厚,后期细胞老化,贴壁性能减退,细胞外基质会出现“卷边”现象,导致样品不合格。
19.本实施例获得的脱细胞基质浸泡于磷酸盐缓冲液中,在2-6℃低温范围内保存,本实施例选择在4℃的低温环境下,可以保存大约2周时间。所得的脱细胞基质,其光镜图如图1中b所示,图1中a为脱细胞前干细胞光镜图。
20.通过 collagen
ⅳꢀ
及 fibronectin 免疫化学鉴定该脱细胞基质的部分成分:将所得的脱细胞基质以 4%多聚甲醛室温固定30分钟,磷酸盐缓冲液清洗3次后加入一抗:rabbit anti collagenⅳ(1:100),sheep anti fibronectin (1:100) 4℃孵育过夜;磷酸盐缓冲液清洗3次后加入二抗:cy3-goat anti-rabbit igg (h l) (1:600)及donkey anti-sheep(af647) (1:500),4℃孵育过夜;磷酸盐缓冲液清洗3次,dapi染色封片,荧光共聚焦显微镜(dmr,leica)检测,如图2所示,为本发明实施例提供的脱细胞基质的collagenⅳ及fibronectin免疫化学图,其中图a为collagenⅳ染色,图b为fibronectin染色。
21.本发明使用培养的细胞衍生的脱细胞基质,相比于组织来源的脱细胞基质,排除了培养和扩展时的病原体转移;可突破组织或器官来源细胞外基质原有的结构限制,在与组织工程生物材料相结合后,能获得可控的生物降解速度和有效的机械性能,同时保持了支架所需的几何形状和灵活性。
22.本发明使用的组织工程神经移植物中的细胞基质是由培养的细胞分泌形成后脱细胞获得,用hbmsc衍生的脱细胞基质与生物可降解支架组合,构建了一种新型的细胞基质神经移植物。移植后降低或没有免疫原性,适宜大规模人群的使用;且本发明bmsc为人来源,期间均为无血清培养,为组织工程神经移植物的临床转化打下了夯实基础。
23.实施例二脱细胞基质的电镜检测如图3所示,为本发明实施例提供的脱细胞基质的扫描电镜图,其中图a为2500倍镜下电镜图,b为5000倍镜下电镜图。扫描电镜结果显示脱细胞基质呈致密的纤维网状结构,网状纤维之间分布有大小不一的球形物质,纤维排列有一定的方向性。
24.本实施例中进行脱细胞基质的电镜检测的具体方法如下:将脱细胞基质放置于14mm的圆形玻片上,以4%戊二醛4℃冰箱固定2~4小时,磷酸盐缓冲液漂洗3次,10分钟/次;1%锇酸室温避光固定2小时,双蒸水漂洗3次,10分钟/次;随后进行梯度乙醇脱水(乙醇浓度依次为30%、50%、70%、80%、95%),每次至少10分钟,最后浸泡于无水乙醇中过夜,次日更换新鲜无水乙醇,无水乙醇-醋酸异戊酯置换(比例依次为 1:1, 1:2,纯醋酸异戊酯)后临界点干燥仪干燥,镀晶、粘托后于日立s-3400ii型扫描电镜下观察。
25.实施例三细胞基质神经移植物的构建使用游标卡尺测量,将厚度约0.12mm胶冻样膜状脱细胞基质围绕生物可降解支架卷至6、9或12层三种规格,包绕在生物可降解支架周围,构建细胞基质神经移植物初始形态。将细胞基质神经移植物初始形态放置2-6℃,至少24小时,进行自组装形成管状结构,本实施例选取4℃,自组装24小时,然后-80℃冷冻干燥,构建细胞基质神经移植物。
26.图4 为本发明实施例提供的细胞基质神经移植物的扫描电镜图,其中图a为800倍
镜下电镜图,b为2500倍镜下电镜图;扫描电镜结果显示移植物呈现一定的方向性,纤维之间分布有大小不一的球形物质。
27.扫描电镜的具体方法如下:将细胞基质神经移植物从中间纵行切开,以4%戊二醛4℃冰箱固定2~4小时,磷酸盐缓冲液漂洗3次,10分钟/次;1%锇酸室温避光固定2小时,双蒸水漂洗3次,10分钟/次;随后进行梯度乙醇脱水(乙醇浓度依次为30%、50%、70%、80%、95%),每次10分钟,浸泡于无水乙醇中过夜,次日更换新鲜无水乙醇,无水乙醇-醋酸异戊酯置换(比例依次为 1:1,1:2,纯醋酸异戊酯)后临界点干燥仪干燥,镀晶、粘托后于日立s-3400ii型扫描电镜下观察。
28.实施例四使用细胞基质神经移植物修复大鼠坐骨神经缺损使用细胞基质神经移植物修复大鼠坐骨神经缺损,通过电生理、透射电镜、免疫组化等方法检测神经再生速度及坐骨神经功能恢复状况,具体步骤如下:首先建立大鼠坐骨神经10mm缺损模型并随机分为a、b、c 3组,a组用细胞基质神经移植物修复大鼠坐骨神经缺损,称为细胞基质组;b组用自体神经修复大鼠坐骨神经缺损,称为自体组;c组暴露坐骨神经,不做缺损,称为假手术组。术后12周,在适度麻醉下暴露术侧坐骨神经,进行神经电生理学检测。
29.如图5所示,为本发明实施例提供的再生神经电生理检测结果示意图,其中左侧为各组复合肌动作电位波形图,a为细胞基质组,b为自体组,c为假手术组;右侧图为各组再生神经复合肌动作电位波幅比较图,****p<0.001,图中不同形状符号代表不同组别,个数代表样本数。从图中可以看出细胞基质组、自体组及假手术组cmap平均波幅分别为:15.49
±
1.82mv,15.33
±
2.98mv,21.56
±
1.67mv。其中,细胞基质组与自体组没有统计学差异(p》0.05)。
30.取再生神经中段切片行透射电镜检测,如图6所示,为本发明实施例提供的再生神经中段横切面的透射电镜图,上部为各组髓鞘局部放大20000倍透射电镜图,a为细胞基质组,b为自体组,c为假手术组,下部为各组髓鞘板层数比较图,****p<0.001。从图中可以看出细胞基质组、自体组及假手术组髓鞘板层数分别为:41
±
5,46
±
6,90
±
17。其中,细胞基质组与自体组没有统计学差异(p》0.05)。
31.对术后靶肌湿重比及运动终板检测是评价再生神经对靶肌重支配功能重建的重要指标。早期肌肉发生失神经支配,随着时间的推移,再生神经又会实现对靶肌的重支配。如图7所示,为本发明实施例提供的靶肌湿重比结果示意图,上部为各组腓肠肌外观形态图,a为细胞基质组,b为自体组,c为假手术组;下部为各组腓肠肌湿重比分析,***p<0.001,****p<0.001;从图中可知:术后12周,细胞基质组、自体组及假手术组的腓肠肌肌肉湿重比分别为:0.48
±
0.22,0.58
±
0.16,0.88
±
0.06。其中,细胞基质组与自体组之间没有统计学差异(p》0.05)。
32.运动终板是神经末梢与其所支配靶肌处的神经-肌肉接头,具有突触结构,α-银环蛇毒对突触后膜上的乙酰胆碱受体进行特异性标记。取细胞基质组和自体组及假手术组大鼠桥接术后12周术侧腓肠肌,固定脱水后冰冻纵切,进行运动终板染色并进行成熟度分析。
33.运动终板的成熟度在不同时期分为:(1)早期:“plaque”,形态小,无孔状结构;(2)成熟期:“pretzel”,形态大、网状,呈多孔结构;(3)中期:“intermediate”(处于成熟期和早期之间)。如图8所示,为本发明实施例提供的运动终板重建结果图,其中上部为运动终板成熟度示意图,pretzel为成熟期,intermediate为过渡期,plaque为未成熟期;中部为各组运动终板观察,图a为细胞基质组,b为自体组,c为假手术组;下部为不同分期运动终板比例统计分析柱状图。
34.假手术组的运动终板多处于成熟期,斑块较大呈蝶翅状,具有网状多孔,细胞基质组和自体组中再生神经支配到的运动终板面积较小且为细长。术后12周运动终板量化统计,假手术组与其他两组相比运动终板大多处于成熟期(52%);细胞基质组处于成熟期的运动终板比例(44%)与自体组(46%)相比没有显著的统计学差异(p》0.05)。
35.如图9所示,为本发明实施例提供的靶肌纤维横截面积结果图,取细胞基质组和自体组及假手术组大鼠桥接术后 12周术侧腓肠肌,固定脱水后冰冻横切,用laminin染肌纤维胞外间质,图9中上部为各组腓肠肌肌纤维横截面观察图,a为细胞基质组,b为自体组,c为假手术组;下部为各组腓肠肌肌纤维横截面积统计比较图,**p<0.001,****p<0.001。从图中统计细胞基质组、自体组及假手术组的肌纤维横截面积分别为:923.4
±
98.85μm2,1131
±
92.23μm2,1606
±
229.9μm2,细胞基质组与自体组之间没有统计学差异(p》0.05)。
36.本发明使用的细胞基质神经移植物不含有由于制备工艺带入的外源性毒性物质,具有良好生物相容性和生物可降解性,还具有良好的力学性能。使用生物可降解支架,并形成管状结构,为神经细胞生长提供了必须的途径和必要的引导与取向性生长作用;使用的脱细胞基质能够有效的促进神经再生及功能恢复。
37.本发明针对现有技术不足提供了一种利于细胞黏附和迁移,能够促进神经再生的一种细胞基质神经移植物及其制备方法;利用体外去细胞技术去除干细胞,获得脱细胞基质,然后包绕在生物可降解支架周围,形成细胞基质神经移植物,以修复周围神经缺损。本发明能够克服自体神经移植缺点,同时可以避免同种异体细胞移植的免疫原性,提供利于神经细胞增殖和迁移的具有一定取向性的脱细胞基质,建立一个有利于再生轴突生长的局部微环境,以达到神经快速生长、功能恢复的理想目标,为临床治疗提供可行方案。
38.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变形,这些改进和变形也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
