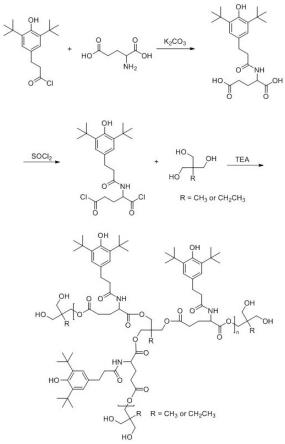
1.本发明涉及植物生物技术领域,尤其涉及一种异叶水蓑衣原生质体制备的酶解液、制备及瞬时转化方法。
背景技术:
2.植物叶形随环境产生显著变化的现象称为异形叶。异叶水蓑衣(hygrophila difformis),又名水罗兰,是爵床科水蓑衣属的水生植物,约有90种,具有明显的异形叶,其叶形多样,根据陆生和水生环境的不同,表现出从简单叶到复杂叶的差异。除此之外,其他一些环境因素(温度、co2浓度等)和植物激素(乙烯、脱落酸等)也能够显著影响其叶形变化。
3.植物原生质体是指去除细胞壁后被质膜所包围的、具有生命力和全能性的裸露细胞,其结构包括细胞膜、细胞质(包括各种细胞器、细胞骨架系统及胞基质)和细胞核等部分。由于没有细胞壁的限制,且容易摄取外源dna等遗传物质,原生质体成为遗传转化、新型育种的理想材料之一,在植物细胞生物学、分子生物学、体细胞杂交等研究领域具有广泛的应用价值。一般来说,制备植物原生质体有机械法和酶解法两种方法,机械法是指将植物材料置于高渗溶液中,使细胞发生质壁分离,原生质体收缩成球形,然后通过研磨,释放出原生质体;酶解法是指通过加入各种酶,达到细胞的解离和细胞壁的分离的目的。通过机械法得到的原生质体虽不受酶的影响,但产量低,且仅适用于少部分植物材料;酶解法具有作用温和,解离出的原生质体产量高,活力好等优点,现在已被广泛使用。
4.植物原生质体遗传转化是指以原生质体为受体,通过一定的途径或技术将外源基因导入植物原生质体内,获得能使外源基因稳定表达的转基因植株的技术。当外源基因导入植物细胞中以后,其表达方式有瞬时表达和稳定表达两种。稳定表达是指外源基因片段导入到原生质体并整合到植物基因组中进行表达,并且可以传递给后代;而在瞬时表达中,外源基因则不会整合到植物基因组上。相较于稳定基因表达技术,瞬时表达技术在转化过程中,外源基因进入受体细胞后,存在于游离的载体上,并未与受体基因组染色体相整合。
5.异叶水蓑衣由于其异形叶表型明显且具有植株小、生长速度快、易繁殖、基因组小、染色体少、愈伤组织诱导率较高、组织培养体系易建立等优势,是研究异形叶的理想植物。现虽已建立异叶水蓑衣组织培养方法和农杆菌介导的遗传转化体系,以及以异叶水蓑衣作为实验材料的异形叶研究模型,但是,目前关于异叶水蓑衣原生质体的制备研究及瞬时转化方法仍无报道。
技术实现要素:
6.本发明提供的一种异叶水蓑衣原生质体制备的酶解液、制备及瞬时转化方法,旨在解决上述背景技术中存在的问题。
7.为了实现上述技术目的,本发明主要采用如下技术方案:
8.本发明的目的之一是提供一种异叶水蓑衣原生质体制备的酶解液,包括0.5-4%纤维素酶、0.1-1.2%离析酶、0.2-1.0m d-甘露醇、10-30mm且ph为4-7的吗啉乙磺酸、5-15mm cacl2、和0.05-0.15%bsa。
9.优选的,包括2%纤维素酶、0.5%离析酶、0.6m d-甘露醇、20mm且ph为5.7吗啉乙磺酸、10mm cacl2、和0.1%bsa。
10.本发明的目的之一是提供利用上述的酶解液制备异叶水蓑衣原生质体的方法,包括如下步骤:
11.s31:选取生长状态良好的异叶水蓑衣愈伤组织置于培养皿中,用单面刀片切割成适宜大小;
12.s32:将切割后的植物材料置于酶解液中,充分酶解,得到酶解混合液;
13.s33:将所述酶解混合液过滤离心得到原生质体。
14.进一步的,步骤s32中的酶解条件为26℃避光振荡4小时,振荡频率为100-120r/min。
15.优选的,步骤s33中,原生质体的获得方法具体为:将所述酶解混合液用w5溶液润湿过的200目尼龙网过滤,去除残渣,滤液转移到2ml离心管中,1000r/min离心3min,弃上清,再加入预冷的w5溶液清洗一遍,离心弃上清,即收集得到异叶水蓑衣原生质体。
16.更进一步的,获得原生质体后还包括对原生质体计数和原生质体活性检测的步骤。
17.优选的,所述原生质体计数的方法为:采用血球计数板来统计原生质体密度,每个样品计数三次,取平均值,其中,原生质体产量(个/ml)=血球计数板5个大方格内总原生质体个数
×5×
104×
稀释倍数。
18.优选的,所述原生质体活性检测的方法为,采用荧光素双醋酸酯染色法检测原生质体活性:取100μl原生质体溶液,加入2μl fda溶液,混匀,避光孵育5-10min,加入w5溶液洗涤两次,制片,使用倒置荧光显微镜观察计数,其中,原生质体活性=(一个视野中激发光下发出绿色荧光的原生质体数/明场下所有原生质体数)
×
100%。
19.本发明的目的之三是提供一种异叶水蓑衣原生质体的瞬时转化方法,包括以下步骤:
20.s91:配制好含有40%peg4000、0.2m甘露醇、100mm cacl2的转化溶液peg-ca
2
待用;
21.s92:将制备好的原生质体取100μl至2ml离心管中,置于冰上30min,吸取上清,再向离心管中加入预冷的mmg溶液重悬,然后加入10μg质粒,再加入110μl步骤s91制得的得到的转化溶液peg-ca
2
,混匀,室温下避光诱导转化混合物10-20min;
22.s93:诱导转化后加入1ml w5溶液,终止转化,1000r/min离心3min,吸取上清液,再加入1ml的w5溶液,黑暗培养16-24h。
23.本发明的目的之四是提供一种异叶水蓑衣原生质体的瞬时转化方法在外源基因表达中的应用。
24.与现有技术相比,本发明具有如下有益效果:
25.本发明通过改进后的原生质体的制备与转化方法,可以获得大量异叶水蓑衣原生质体,用于便捷高效的瞬时转化体系的建立。
26.本发明首次建立了快速高效的原生质体制备及瞬时转化体系,原生质体瞬时转化可运用于检测转基因的表达效果、启动子分析、转录后基因沉默、抑制子功能鉴定、亚细胞定位、基因相互作用等,通常在瞬时表达载体上插入可以在特定荧光下观察的蛋白质的基因,方便目的基因的识别,多用于快速、高效的检测方法。
附图说明
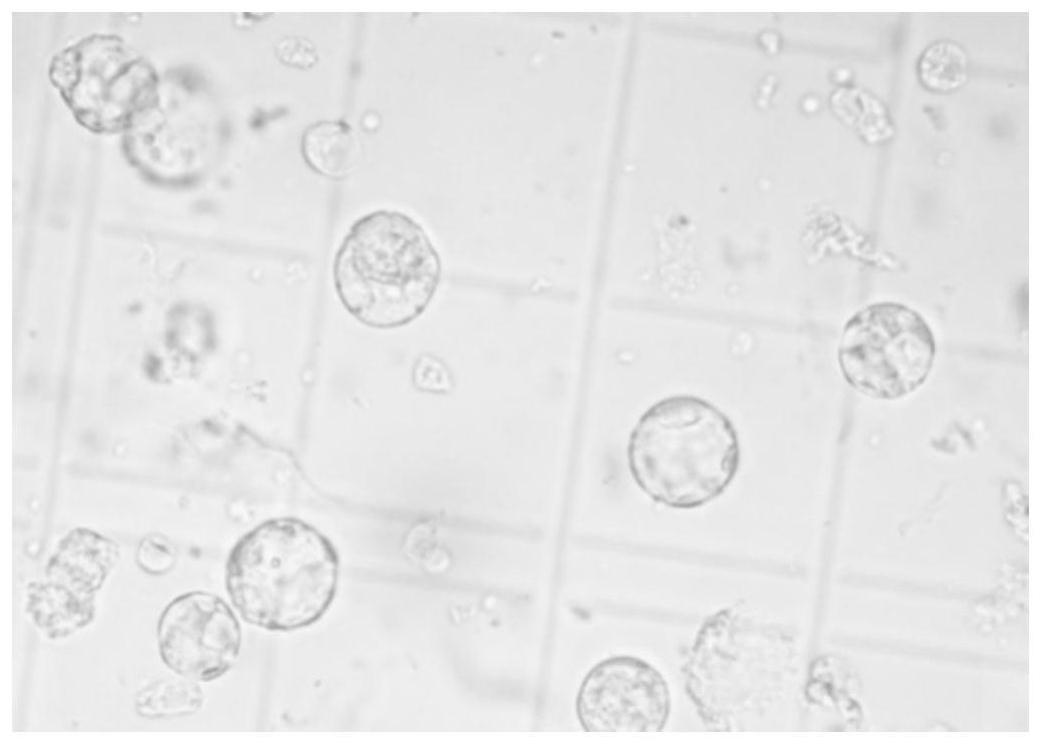
27.图1为从异叶水蓑衣愈伤组织中解离出的原生质体;
28.图2为原生质体的活性检测;a为明场下的原生质体,b为fda染色后的原生质体,其中荧光的为有活性的原生质体;
29.图3为不同酶类组合对原生质体制备的影响;(c1:1%纤维素酶c2:1.5%纤维素酶c3:2%纤维素酶m1:0.5%离析酶m2:1%离析酶m3:1.5%离析酶)
30.图4为不同酶解时间对原生质体制备的影响;
31.图5为不同渗透压对原生质体制备的影响;
32.图6为peg介导的异叶水蓑衣原生质体瞬时表达;a为白光下荧光显微镜拍摄的异叶水蓑衣原生质体,b为激发光下pcambia1302-egfp载体转化过的原生质体。
具体实施方式
33.以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。具体实施方式中使用的材料,如无特殊说明,均可直接购买获得。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
34.实施例中溶液组成如下:
35.w5溶液:154mm nacl,125mm cacl2,5mm kcl,4mm mes。
36.mmg溶液:0.4m mannitol、15mm mgcl2、4mm mes,ph 5.7。
37.一种异叶水蓑衣原生质体制备的酶解液,包括0.5-4%纤维素酶、0.1-1.2%离析酶、0.2-1.0m d-甘露醇、10-30mm且ph为4-7的吗啉乙磺酸、5-15mm cacl2、和0.05-0.15%bsa。
38.可选的,包括2%纤维素酶、0.5%离析酶、0.6m d-甘露醇、20mm且ph为5.7吗啉乙磺酸、10mm cacl2、和0.1%bsa。
39.其中,纤维素酶和离析酶可以达到细胞的解离和细胞壁的分离的目的,酶解法具有作用温和,原生质体产量高,活力好等优点。且采用上述比例的酶解液,制备得到的原生质体的产量及活性均达到最高。
40.实施例1
41.异叶水蓑衣原生质体制备方法,包括以下步骤:
42.(1)酶解液的配制:先于离心管中加入cellulase r-10、macerozyme r-10、20mm吗啉乙磺酸(mes,ph 5.7,高温高压灭菌)、0.6m甘露醇(mannitol),55℃水浴加热10min,至两种酶完全溶解,冷却至室温后加入10mm cacl2、和0.1%bsa,再加入无菌水定容;
43.(2)选取生长状态良好的异叶水蓑衣愈伤组织置于培养皿中,用单面刀片切割成适宜大小;
44.(3)将切好的植物材料约0.2g于2ml步骤(1)得到的酶解溶液中,26℃避光振荡
(100-120r/min)4小时使之充分酶解;
45.(4)酶解结束后,用w5溶液(154mm nacl,125mm cacl2,5mm kcl,4mm mes)润湿过的200目尼龙网过滤,去除残渣,滤液转移到2ml离心管中,1000r/min离心3min,弃上清,再加入预冷的w5溶液清洗一遍,离心弃上清,便收集得到异叶水蓑衣原生质体,随后加入100μl w5,重新悬浮,置于冰上待用;
46.得到的原生质体显微图如图1所示。
47.(5)原生质体计数:采用血球计数板来统计原生质体密度,每个样品计数三次,取平均值;
48.(6)原生质体产量(个/ml)=血球计数板5个大方格内总原生质体个数
×5×
104×
稀释倍数;
49.(7)原生质体活性检测:采用荧光素双醋酸酯(fda)染色法检测原生质体活性。取100μl原生质体溶液,加入2μl fda溶液(取5mg fda溶于1ml丙酮,4℃避光保存),混匀,避光孵育5-10min,加入w5溶液洗涤两次,制片,使用倒置荧光显微镜观察计数。原生质体活性=(一个视野中激发光下发出绿色荧光的原生质体数/明场下所有原生质体数)
×
100%。
50.根据上述方法进行活性检测的结果如图2所示,图中可看出含有大量的有活性的原生质体。
51.实施例2
52.考察不同参数对原生质体产量或活力的影响。
53.(1)对于相同植物材料,酶类浓度组成不同,会影响原生质体的制备,本发明选用了cellulase r-10与macerozyme r-10,探究这两种酶在不同浓度组合条件下的原生质体产量;
54.(2)以d-甘露醇作为渗透压调节剂,设置了0.2m、0.4m、0.6m、0.8m四种浓度条件,探究不同甘露醇浓度对原生质体产量和活力的影响;
55.(3)酶解时间对原生质体的制备也有较大的影响,时间过短酶解不充分,时间过长细胞破裂,因此设置了2h、4h、6h、8h四个梯度,以找出最合适的酶解时间。
56.结果如图3、图4、图5所示,综合产量和活性来看,原生质体制备的最优条件为2%纤维素酶与0.5%离析酶的酶类组合,渗透压为0.6m,酶解时间4h,原生质体产量可达2.39
×
106个/ml,活性达89%。
57.实施例3
58.异叶水蓑衣原生质体瞬时转化的方法,包括以下步骤:
59.(1)配制好含有40%peg4000、0.2m甘露醇、100mm cacl2的转化溶液待用,peg溶液应于转化开始前1h配制,使其慢慢溶解;
60.(2)将制备好的原生质体取100μl至2ml离心管中,置于冰上30min,小心吸取上清,再向离心管中加入预冷的mmg溶液(0.4m mannitol、15mm mgcl2、4mm mes,ph 5.7)轻轻重悬,然后加入10μg质粒,再加入110μl步骤(1)得到的peg-ca
2
溶液,轻柔混匀,室温下避光诱导转化混合物10-20min;
61.(3)完成后加入1ml w5溶液,轻轻混匀以终止转化,1000r/min离心3min,小心吸取上清液,再加入1ml左右的w5溶液,黑暗培养16-24h。
62.以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创
造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。