一种高效光催化还原co2的锡掺杂带有氧空位的四氧化三钴材料的制备方法及其应用
技术领域
1.涉及一种用于光催化还原二氧化碳选择性生成甲烷的锡掺杂的四氧化三钴杂化材料,属于纳米材料领域、及光催化技术领域。
背景技术:
2.光催化还原co2将其转化为一些高附加值的衍生物能够同时缓解温室效应和能源危机,特别是将其转化为ch4,有望满足日益增长的基本燃料和化工原料需求。光催化还原co2的过程会产生多种产物,而将选择性的将co2转化为ch4仍然是一个巨大的挑战。与只需要两个电子参与反应所生成的co相比,ch4的生成是一个动力学困难的过程,涉及八个电子转移。目前已经有很多策略,例如通过掺杂或者空位工程促进co2的吸附,形成内建电场。或者通过形貌控制工程促进光生载流子的分离转移等手段来促进光催化还原co2甲烷化的过程。然而目前的大部分策略都侧重于还原半反应co2分子的活化,而氧化半反应h2o的解离通常被忽略。水分子在催化剂表面解离会产生oh-以及质子,其中oh-能够消耗光生空穴来降低光生载流子的复合率,而质子则会迁移到吸附co2的活性位点,来驱动质子-电子耦合转移过程。
3.因此,基于以上研究背景,从光生电荷的有效分离及创建h2o活化位点两个方面考虑,本发明制备了锡掺杂的带有氧空位的四氧化三钴杂化材料,同时将材料与未改性的纯相四氧化三钴活性进行了系统对比。一方面,掺杂的锡可作为h2o活化位点,促进h2o的氧化,为 co2甲烷化提供质子;另一方面,锡的掺杂引入氧空位也可促进电荷分离,增加参与光催化反应的电荷密度,从而提高光催化活性。该发明所制备的锡掺杂的带有氧空位的四氧化三钴杂化材料实现了光催化还原co2高效甲烷化过程。
技术实现要素:
4.本发明采用钴和锡的前驱体在碱性水溶液通过油浴合成钴和锡的氢氧化物,随后在空气气氛下经过高温煅烧得到锡掺杂的带有氧空位的四氧化三钴杂化材料。
5.本发明所用的锡掺杂的带有氧空位的四氧化三钴杂化材料的方法如下:将1.96g的 co(no3)2·
6h2o投加至200ml的(nh4)2co3(1.44g)水溶液中,搅拌至形成均一的溶液。将不同量的sncl4·
5h2o(4.8mg、11.2mg、16mg、24mg)加入到上述所制备的溶液中,在油浴锅中进行升温反应,同时磁力搅拌,油浴温度为70℃、反应时间为5h。然后进行干燥,得到锡-钴的氢氧化物粉末。最后将所得到的锡-钴的氢氧化物粉末置于马弗炉中,在空气气氛围下400℃煅烧3小时,升温速率为2℃/min,得到锡掺杂的带有氧空位的四氧化三钴杂化材料。
6.在不引入锡源(sncl4·
5h2o)的情况下,以上述相同的方法制备纯相四氧化三钴材料。
附图说明
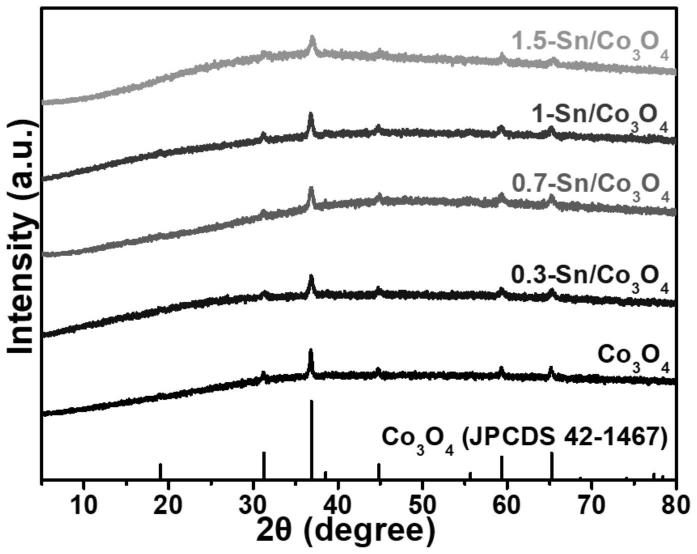
7.图1为实施例1中的纯相四氧化三钴以及实施例2-5中的锡掺杂的带有氧空位的四氧化三钴材料的xrd图谱,发现用金属sn的掺杂对co3o4晶体结构无明显影响。
8.图2(a)为实施例1中的co3o4的tem图,图2(b)和图2(c)分别为实施例4中的为1-sn/co3o4的tem图和hrtem图。co3o4和1-sn/co3o4都呈多孔片状结构,sn的掺杂不会影响co3o4的形貌。通过图2(c),1-sn/co3o4的hrtem发现宽度为0.466nm和0.285 nm的两种晶格条纹,分别对应co3o4的(111)晶面和(220)晶面。
9.图3(a)(b)图为实施例1中co3o4和实施例2-5中sn/co3o4在光催化还原co2活性图,图3(c)为co3o4和sn/co3o4光催化还原co2转化生成co和ch4的产率,图3(d)为co3o4和sn/co3o4光催化还原co2转化生成co和ch4的消耗的电子数以及ch4的选择性。随着 sn掺杂量的增加,co的产率逐渐下降(图3a)。少量sn的掺杂能够大大提升光催化还原co2过程中ch4的产率,其中1-sn/co3o4样品的ch4产率最高(图3b)。同时也对其反应产生co 和ch4过程中所消耗的电子数进行了计算(图3d),在掺杂了sn后,参与反应的电子数明显增加,且随着sn掺杂量的增加,产物对ch4的选择性也逐渐增加,可以达到95%以上。
10.图4为实施例1中co3o4和实施例4中1-sn/co3o4的室温荧光光谱及时间分辨荧光光谱图。通过室温荧光测试(图4a)看出sn的掺杂能够降低光生载流子的复合。对co3o4和 1-sn/co3o4进行瞬态荧光光谱测试(图4b),sn掺杂后,寿命增加,证明有更多的光生载流子参与到反应中。
11.图5为实施例1中co3o4和实施例4中1-sn/co3o4的固体紫外(a)、带隙宽(b)、vb-xps (c)以及能带结构(d)图。从固体紫外看出样品具有良好的吸光性能(图5a),且掺杂了 sn后其吸收边带出现红移,带隙变窄(图5b)。通过图5(c)的vb-xps测试得到co3o4和 1-sn/co3o4的价带位置分别是0.92ev和0.97ev,结合带宽,可得到掺杂sn前后的co3o4的能带排列位置(图5d)。
12.图6为实施例1中co3o4和实施例4中1-sn/co3o4的co 2p(a)、o 1s(b)和sn 3d(c) 图。在o1s中,位于529.8ev(o1),531.1ev(o2)和532.3ev(o3)处的峰分别对应于晶格氧,氧空位(ovs)以及表面羟基氧(图6a)。1-sn/co3o4的o2占比要高于co3o4,证明sn掺杂会增加氧空位的浓度。在掺杂了sn之后1-sn/co3o4的co 2p峰向低结合能方向移动,可能是由于sn掺杂引入氧空位后co原子周围电荷密度增加所致(图6b)。由于sn的掺杂量较少所以sn 3d的信号比较弱(图6c),位于486.4ev和495.4ev位置处的两个峰证明sn是以 4价态存在的。
13.图7(a)图为实施例1中co3o4和实施例4中1-sn/co3o4的在光照下的dmpo-·
oh捕获实验,图7(b)图为sn/co3o4光催化还原co2机理图。在co2还原过程中以h2o为牺牲剂,h2o的氧化会为ch4的产生提供质子,同时会产生o2或
·
oh。质子的生成取决于h2o 氧化的这一过程,因此可以通过测试
·
oh生成量的多少来间接反映质子的产生效率。以dmpo 为捕获剂,根据信号强度可以推断sn的掺杂促进了
·
oh的产生,因此sn掺杂会导致更多质子在光催化还原过程中生成,最终选择性生成ch4。这一结果表明sn掺杂对光催化还原co2过程的h2o氧化半反应起关键作用。根据上述分析初步推断出sn/co3o4光催化还原co2选择性生成ch4的机理(图7b):首先在光激发下sn/co3o4产生光生电子(e-)和空穴(h
), h
更加倾向于在sn位点发生氧化反应,氧化h2o生成
·
oh和h
。而sn掺杂会引起氧空位,导致氧空位周围co位点的电子密度增加,e-在co上进行还原反应,同时在sn位点生成的 h
转移到co位点进行加氢,最终促
进其光催化还原co2过程中ch4的选择性生成。
14.以上实验结果证明我们所合成的锡掺杂的带有氧空位的四氧化三钴材料具有优异的光催化转化co2合成ch4活性、选择性及稳定性。
15.尽管本发明的内容已经通过上述优选实施例作了详细介绍,但是应当认识到上述的描述不应被认为是对本发明的限制。
具体实施方式
16.本发明下面将通过具体的实施例进行更详细的描述,但本发明的保护范围并不受限于这些实施例。
17.实施例1
18.纯相四氧化三钴的合成
19.将1.96g的co(no3)2·
6h2o投加至200ml的(nh4)2co3(1.44g)水溶液中,搅拌至形成均一的溶液,在油浴锅中进行升温反应,同时磁力搅拌,油浴温度为70℃、反应时间为5h。然后进行干燥,得到锡-钴的氢氧化物粉末。最后将所得到的锡-钴的氢氧化物粉末置于马弗炉中,在空气气氛围下400℃煅烧3小时,升温速率为2℃/min,得到锡掺杂的带有氧空位的四氧化三钴杂化材料(co3o4)。
20.实施例2
21.锡掺杂的带有氧空位的四氧化三钴杂化材料的合成
22.将4.8mg sncl4·
5h2o添加到实施例1中co(no3)2·
6h2o的(nh4)2co3溶液中搅拌均匀,制备步骤同上,标记为0.3-sn/co3o4。
23.实施例3
24.锡掺杂的带有氧空位的四氧化三钴杂化材料的合成
25.将11.2mg sncl4·
5h2o添加到实施例1中co(no3)2·
6h2o的(nh4)2co3溶液中搅拌均匀,制备步骤同上,标记为0.7-sn/co3o4。
26.实施例4
27.锡掺杂的带有氧空位的四氧化三钴杂化材料的合成
28.将16mg sncl4·
5h2o添加到实施例1中co(no3)2·
6h2o的(nh4)2co3溶液中搅拌均匀,制备步骤同上,标记为1-sn/co3o4。
29.实施例5
30.锡掺杂的带有氧空位的四氧化三钴杂化材料的合成
31.将24mg sncl4·
5h2o添加到实施例1中co(no3)2·
6h2o的(nh4)2co3溶液中搅拌均匀,制备步骤同上,标记为1.5-sn/co3o4。
32.实验与数据
33.本发明提供的光催化还原co2的活性考察方法如下:
34.称取30mg光催化剂加入水中并超声处理30分钟,将溶液转移到培养皿中并在烘箱中在 80℃下干燥,直到形成薄膜。成膜后,将其转移至所购买的光催化反应器中,加入0.1ml 去离子水,在光反应之前,使用机械泵对反应器进行抽真空处理,然后,将高纯co2引入反应器以达到0.08mpa的压力。打开氙灯对反应器中的样品进行照射,所采用的光是紫外-可见全光谱。每隔1h,通过气相色谱仪上监测和收集co2的催化还原产物,总计反应时间为4 h。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。