1.本发明涉及生物技术领域,尤其涉及病毒的纯化方法。
背景技术:
2.伪狂犬病(porcine pseudorabies)是由伪狂犬病毒(pseudorabies virus,prv)引起的多种家畜和野生动物的一种急性传染病,以发热、奇痒、脑脊髓炎为主要发病症状。该病在猪群中呈暴发性流行。可引起妊娠母猪流产、死胎,公猪不育,新生仔猪大量死亡,育肥猪呼吸困难、生长停滞等,是危害全球养猪业的重大传染病之一。
3.近几年多起案例已经证实,prv可以感染人,这加重了该病的防控压力。目前针对伪狂犬病尚无特效治疗药物,疫苗的免疫接种是预防和控制猪伪狂犬病的有效措施。国内外常用的疫苗种类主要是基因缺失弱毒疫苗和ge基因缺失灭活疫苗,这些疫苗都在一定程度上起到了积极的预防作用,同时支撑了伪狂犬病的净化。
4.疫苗的质量主要与抗原的浓度、纯度等因素直接相关。对于伪狂犬灭活苗而言,除了抗原高效价能够直接提升抗体水平外,抗原的纯度也至关重要。目前提高抗原纯度的方法主要有:中空纤维超滤浓缩、蔗糖密度梯度离心、层析纯化等,相比而言,层析纯化的应用放大更有优势,但需要兼顾好纯度、收率和处理效率。
5.capto core系列是cytiva推出的一类新型介质,具有核心微球技术以及复合模式,辛胺配基使其具有大小分离和吸附层析的双重功能。介质由激活的配基核心和惰性壳层组成,惰性壳层可排阻大分子(core 700排阻相对分子质量为700,000[700kda],core 400排阻相对分子质量为400,000[400kda]),阻止其经壳层上的孔进入核心,这些大分子在流穿过程中被收集起来的同时,较小的杂质会与微球内在配基结合。该模式的填料可以确保较宽的ph工作范围和naoh的在位清洗,相比于传统的凝胶过滤层析,最主要的特点是可以显著提高层析的上样量,提升纯化效率。
[0006]
为了提高prv疫苗的抗原纯度,降低疫苗的副反应,行业专家采用了不同的方法:有利用中空纤维超滤的方法进行纯化,杂蛋白的去除率可达到90%以上。还有采用中空纤维 凝胶过滤层析纯化的方式提升抗原的纯度,杂蛋白去除率和病毒的收率都能达到高达99%以上。肝素填料亲和层析也是一种纯化方法,可以一步层析就能收获伪狂犬病毒浓缩液,病毒的收率达到80%。
[0007]
目前伪狂犬的层析纯化技术存在以下问题:一方面凝胶过滤层析一般纯化上样量较小,导致实际生产需要的柱床较高(60cm以上)、柱体积较大,同时需要连续重复上样,致使处理周期延长。另一方面肝素亲和层析与凝胶过滤层析相比,虽然提高了上样量,收率达到80%,但需要prv粗提液在亲和柱中停留较长的时间,以增强病毒与柱子的结合,这也延长了层析处理的周期。
[0008]
因此,寻求一种周期短、方法简单的层析纯化方法至关重要。
技术实现要素:
[0009]
有鉴于此,本发明提供了病毒的纯化方法。本发明提供的病毒的纯化方法,在保证回收率和杂蛋白去除率较高的情况下,大大提高了伪狂犬病毒液的层析纯化效率。本发明提供的病毒的纯化方法简单,效果好,综合成本低,保证了猪伪狂犬病毒抗原的纯度,可大大降低接种猪群的副反应,同时为养殖户带来较高的社会效益和经济效益。本发明提供的病毒的纯化方法因装柱高度控制在10~20cm,适合市面上各种规格的层析柱,通过固定装柱高度,匹配相应的罐体、管道,可以轻易地实现工艺的线性放大。
[0010]
为了实现上述发明目的,本发明提供以下技术方案:
[0011]
本发明提供了病毒的纯化方法,获得浓缩的病毒,经高度为10~20cm的capto core 700和/或capto core 400填柱料纯化,收集流穿液,获得纯化的病毒。
[0012]
在本发明的一些实施方案中,上述纯化方法中所述填柱料为capto core 400。
[0013]
在本发明的一些实施方案中,上述纯化方法中所述病毒与所述填柱料的体积比为(2~4):1。
[0014]
在本发明的一些实施方案中,上述纯化方法中所述纯化采用平衡液平衡和/或采用洗脱液洗脱;所述平衡液和/或所述洗脱液包括ph值为7.0~7.4的20mm磷酸盐。
[0015]
在本发明的一些实施方案中,上述纯化方法中所述平衡液与所述填柱料的体积比为(5~10):1。
[0016]
具体的,在本发明的一些实施方案中,上述纯化方法中所述平衡液与所述填柱料的体积比为5:1。
[0017]
在本发明的一些实施方案中,上述纯化方法中所述洗脱液与所述填柱料的体积比为2:1。
[0018]
在本发明的一些实施方案中,上述纯化方法中所述收集流穿液后、所述获得纯化的病毒之前还包括清洗的步骤。
[0019]
在本发明的一些实施方案中,上述纯化方法中所述清洗采用清洗液;所述清洗液包括1mnaoh和/或1mnaoh与30%异丙醇。
[0020]
在本发明的一些实施方案中,上述纯化方法中所述清洗液与所述填柱料的体积比为(2.5~5):1。
[0021]
具体的,在本发明的一些实施方案中,上述纯化方法中所述清洗液与所述填柱料的体积比为3:1。
[0022]
在本发明的一些实施方案中,上述纯化方法中所述获得浓缩的病毒包括:取病毒细胞离心,集上清,膜浓缩后,获得所述病毒。
[0023]
在本发明的一些实施方案中,上述纯化方法中所述病毒以流速2cm/min上样。
[0024]
在本发明的一些实施方案中,上述纯化方法中所述膜浓缩的倍数为10倍。
[0025]
具体的,在本发明的一些实施方案中,所述病毒优选为伪狂犬病毒。
[0026]
在本发明的一些实施方案中,cv(column volume)表示柱体积,1cv代表1个柱体积。
[0027]
在本发明的一些实施方案中,tcid
50
(median tissue culture infective dose)表示半数组织培养感染剂量,又称50%组织细胞感染量。即指能在培养板孔或试管内引起半数细胞病变或死亡(cytopathic effect,cpe)所需的病毒量,用以表征病毒的滴度。
[0028]
在本发明的一些实施方案中,cip表示在位清洗,指的是不拆卸工艺系统设备的主要组件而进行的过程设备清洗。
[0029]
本发明提供了病毒的纯化方法,获得浓缩的病毒,经高度为10~20cm的capto core 700和/或capto core 400填柱料纯化,收集流穿液,获得纯化的病毒。
[0030]
本发明的有益效果包括:
[0031]
(1)本发明通过capto core 400复合层析填柱料进行伪狂犬病毒的纯化,伪狂犬细胞培养收获液经过离心、超滤10倍浓缩后上样,单次上样量可达到2~4个柱体积,层析收率可以达到90%以上,杂蛋白去除率达到94%以上。上样量按照3cv计算,本发明的层析纯化效率是凝胶过滤的40倍(凝胶过滤层析按照7.5%cv的上样量)。
[0032]
(2)本发明提供的病毒的纯化方法,在保证回收率和杂蛋白去除率较高的情况下,大大提高了伪狂犬病毒液的层析纯化效率。
[0033]
(3)本发明提供的病毒的纯化方法简单,效果好,综合成本低,保证了猪伪狂犬病毒抗原的纯度,可大大降低接种猪群的副反应,同时为养殖户带来较高的社会效益和经济效益。
[0034]
(4)本发明提供的病毒的纯化方法因装柱高度控制在10~20cm,适合市面上各种规格的层析柱,通过固定装柱高度,匹配相应的罐体、管道,可以轻易地实现工艺的线性放大。
附图说明
[0035]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0036]
图1示本发明实施例2中利用capto core 400对prv病毒浓缩液成品的层析纯化图谱;
[0037]
图2示本发明实施例7中利用sepharose 4ff填料对prv病毒浓缩液成品的层析纯化图谱。
具体实施方式
[0038]
本发明公开了病毒的纯化方法。
[0039]
应该理解,表述
“……
中的一种或多种”单独地包括每个在所述表述后叙述的物体以及所述叙述的物体中的两者或更多者的各种不同组合,除非从上下文和用法中另有理解。与三个或更多个叙述的物体相结合的表述“和/或”应该被理解为具有相同的含义,除非从上下文另有理解。
[0040]
术语“包括”、“具有”或“含有”,包括其语法同义语的使用,通常应该被理解为开放性和非限制性的,例如不排除其他未叙述的要素或步骤,除非另有具体陈述或从上下文另有理解。
[0041]
应该理解,只要本发明仍可操作,步骤的顺序或执行某些行动的顺序并不重要。此外,两个或更多个步骤或行动可以同时进行。
[0042]
本文中的任何和所有实例或示例性语言如“例如”或“包括”的使用,仅仅打算更好地说明本发明,并且除非提出权利要求,否则不对本发明的范围构成限制。本说明书中的任
何语言都不应解释为指示任何未要求保护的要素对于本发明的实践是必不可少的。
[0043]
此外,用以界定本发明的数值范围与参数皆是约略的数值,此处已尽可能精确地呈现具体实施例中的相关数值。然而,任何数值本质上不可避免地含有因个别测试方法所致的标准偏差。因此,除非另有明确的说明,应当理解本公开所用的所有范围、数量、数值与百分比均经过“约”的修饰。在此处,“约”通常是指实际数值在一特定数值或范围的正负10%、5%、1%或0.5%之内。
[0044]
本发明提供的病毒的纯化方法包括如下步骤:
[0045]
1)伪狂犬细胞培养液超滤浓缩:通过悬浮细胞培养或者贴壁细胞培养收获的tcid
50
≥10
7.5
prv收获液,首先经过4℃低温6000rpm离心20min,收集上清,上清液再经过300kd膜包超滤浓缩10倍,收获超滤浓缩液,4℃保存备用。
[0046]
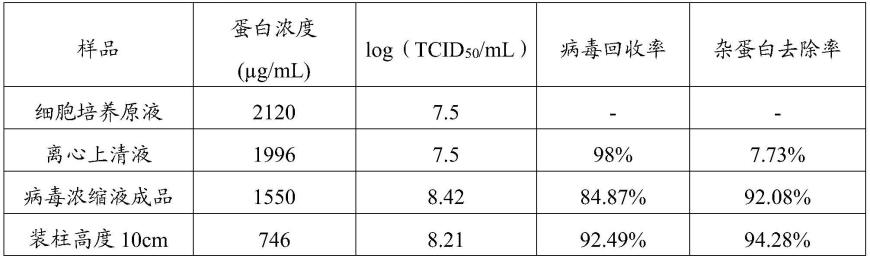
2)伪狂犬超滤液层析纯化
[0047]
(1)层析柱固定:将capto core 400或者capto core 700介质搅拌均匀加入到16mm
×
30cm的层析柱中,固定柱床高度为10cm,柱体积为20ml,用双蒸水以1ml/min的流速冲洗3cv。
[0048]
(2)层析通路无菌处理:将层析进样口、出样口在无菌操作下放入到0.5m naoh溶液中,进行循环在线清洗,处理时间30min。
[0049]
(3)平衡:上样前用平衡缓冲液(20mm pbs缓冲液)以2cm/min的线速度平衡不少于5cv。
[0050]
(4)上样:将步骤1)获得的3cv prv或5cv prv超滤浓缩液涌入到capto core 400层析柱中。收集流穿液,即得prv层析纯化液。prv纯化色谱分析见图1。
[0051]
(5)层析柱清洗:上样结束后,继续用平衡缓冲液进行冲洗直到紫外吸收的基线归零,更换清洗液,清洗液为1mnaoh溶液或者1mnaoh和30%异丙醇混合液,清洗液冲洗流速为2cm/min。
[0052]
3)杂蛋白去除率、收率计算
[0053]
(1)杂蛋白去除率:使用bca试剂盒(thermo fisher scientific)检测prv细胞收获液、超滤浓缩液、层析纯化液的总蛋白含量,计算杂蛋白去除率:
[0054]
杂蛋白去除率(%)=(prv细胞收获液蛋白浓度
×
体积-prv纯化液
×
体积)/prv细胞收获液蛋白浓度
×
体积。
[0055]
(2)半数组织细胞感染量(tcid
50
):通过vero t细胞的终点稀释法测定病毒的tcid
50
。用纯化的prv病毒抗原、prv超滤浓缩液和prv细胞培养液用无血清dmem做倍比稀释(10-5
、10-6
、10-7
和10-8
),同时设空白细胞对照。结果如表1所示。采用3cv的上样量,capto core700收率可以达到84.35%,capto core 400收率可以达到92.49%。
[0056]
其中,病毒回收率的计算方法如下:
[0057]
回收率=(层析纯化液体积
×
层析纯化液中病毒滴度)/(上样体积
×
上样液中的病毒滴度)。
[0058]
本发明中,所用原料、试剂及仪器包括:
[0059]
sdl层析纯化系统:sdl-100-v2,购自苏州赛普生物科技有限公司;台式冷冻离心机,购自湖南湘仪实验室仪器开发有限公司;2cassettes: p2c300c05(300kd),购自默克密理博;5l猪伪狂犬病毒病毒液,≥10
7.5
tcid
50
/ml,由本公司生产;bca蛋白定量试
剂盒,购自thermo fisher scientific。0.5m naoh 5l;无菌0.02m pbs 5l;无菌超纯水5l,均可由市场购得。
[0060]
预处理
[0061]
1)系统的组装和完整性检测
[0062]
无菌条件下,将超滤系统(在超滤夹具中安装孔径为300kd的超滤膜包)与相应配套软管在超净工作台中按照组装要求进行组装。压力保持法检测超滤系统的完整性。
[0063]
2)清洗及灭菌
[0064]
将0.5m naoh溶液注满超滤系统的进料瓶,浸泡处理20min,开启循环泵300rpm,进行系统的清洗及灭菌处理30min。
[0065]
3)水洗及通量检测
[0066]
cip结束后,排尽系统内的naoh溶液。将无菌超纯水注满系统的进料瓶,开启循环泵,300rpm循环30min,弃尽系统内的液体,如此反复水洗,直至系统内ph为7.0左右。
[0067]
4)pbs处理
[0068]
水洗结束后,弃尽最后一次超纯水。将无菌pbs溶液注满进料瓶,开启循环泵300rpm循环冲洗20min。
[0069]
上述技术方案中,步骤2)中用到的naoh溶液起到清洗、灭菌的作用。
[0070]
下面结合实施例,进一步阐述本发明:
[0071]
实施例1病毒液的离心澄清和超滤浓缩
[0072]
1)病毒的离心澄清
[0073]
将伪狂犬病毒液在无菌条件下进行分装,6000rpm离心20min进行澄清处理,收集离心上清液,置于无菌的5l蜀牛瓶中。
[0074]
2)初级浓缩
[0075]
离心澄清后,将进样管、回流管放入储有步骤1)获得的离心上清液的5l蜀牛瓶中,开启循环泵,400rpm循环,经300kd超滤膜包进行纯化处理,弃去透过液,剩余1l初级浓缩病毒液。
[0076]
3)浓缩液第一次洗滤
[0077]
将进样管放入1l pbs的1l蜀牛瓶中,注入到步骤2)获得的初级浓缩病毒液中,重悬,开启循环泵,400rpm循环10min,重复两次,弃去透过液,进料蜀牛瓶中剩余截留液300ml,记为二级浓缩病毒液。
[0078]
4)浓缩液第二次洗滤
[0079]
将300ml pbs注入进料蜀牛瓶中的步骤3)获得的二级浓缩病毒液,重悬,开启循环泵,400rpm循环10min,弃去透过液,进料蜀牛瓶中剩余截留液300ml,记为三级浓缩病毒液。
[0080]
5)浓缩液第三次洗滤
[0081]
将300ml pbs注入进料蜀牛瓶中的步骤4)获得的三级浓缩病毒液,重悬,开启循环泵,400rpm循环30min,弃去透过液,将超滤系统中残留的液通过蠕动泵打入到进料蜀牛瓶中,蜀牛瓶中剩余截留液500ml,即为病毒浓缩液成品。
[0082]
6)超滤液的收集
[0083]
将经过上述处理后的步骤5)得到的病毒浓缩液成品进行收集,保存于4℃。
[0084]
实施例2猪伪狂犬病毒层析纯化方法
[0085]
该方法通过capto core 400复合填料层析纯化来实现,该方法包括以下步骤:
[0086]
1)层析柱固定:将capto core 400介质搅拌均匀加入到16mm
×
30cm的层析柱中,固定柱床高度为10cm,柱体积约为20ml,用双蒸水以3ml/min的流速冲洗3cv。
[0087]
2)层析通路无菌处理:将层析进样口、出样口在无菌操作下放入到0.5m naoh溶液中,进行循环在线清洗,以3ml/min的流速冲洗2cv。
[0088]
3)平衡:上样前用平衡缓冲液(pbs缓冲液)以3ml/min的流速平衡不少于5cv。
[0089]
4)上样:将实施例1步骤6)获得的病毒浓缩液成品上样3cv,收集流穿液,即得到prv层析纯化液。prv纯化色谱分析如图1所示。
[0090]
5)层析柱清洗:上样结束后,继续用平衡缓冲液进行冲洗直到紫外吸收的基线归零,更换清洗液,清洗液为1m naoh和30%异丙醇混合液,清洗液冲洗流速为3ml/min。
[0091]
6)有效性检测
[0092]
对实施例1步骤1)获得的离心上清液、实施例1步骤6)获得的病毒浓缩液成品、实施例2步骤4)获得的prv层析纯化液进行病毒滴度及蛋白浓度检测,以分析浓缩工艺的有效性。其中病毒滴度的检测方法为:
[0093]
将浓缩后灭活前的病毒用细胞维持液做10倍系列稀释,取10-1
~10-10
10个稀释度接种96孔培养板鸡胚成纤维细胞(cef)单层,每个稀释度重复8孔,每孔0.1ml,5%co2、37℃培养120小时,观察细胞病变(cpe),计算tcid
50
。
[0094]
蛋白含量的测定方法为:取各样品用bca蛋白浓度试剂盒进行测定,结果如表1和表2所示。
[0095]
实施例3
[0096]
提供capto core 400复合填料纯化猪伪狂犬超滤液,对比相同上样体积,不同固定柱床高度层析的差异,固定的柱床高度为15cm,具体操作方法参照实施例2。将实施例2步骤4)收集的prv层析纯化液进行检定,检测项目包括:蛋白含量、tcid
50
,计算抗原回收率和杂蛋白去除率,结果如表1和表2所示。
[0097]
实施例4
[0098]
提供capto core 400复合填料纯化猪伪狂犬超滤液,对比相同上样体积,不同固定柱床高度的差异,固定的柱床高度为20cm,具体操作方法参照实施例2。将实施例2步骤4)收集的prv层析纯化液进行检定,检测项目包括:蛋白含量、tcid
50
,计算抗原回收率和杂蛋白去除率,结果如表1和表2所示。
[0099]
表1
[0100]
[0101][0102]
备注:离心上清液是实施例1步骤1)获得的;病毒浓缩液成品是实施例1步骤6)获得的。
[0103]
表2统计数据分析
[0104]
装柱高度10cm和15cm10cm和20cm15cm和20cm病毒回收率p值0.00270.03190.0785杂蛋白去除率p值0.00980.20770.0291
[0105]
由表1和表2可知,随着装柱高度的提升,病毒回收率也相应的有所提升,而杂蛋白去除率变化不明显。根据统计学结果分析,装柱高度10cm和装柱高度15cm之间,病毒回收率和杂蛋白去除率差异非常显著;装柱高度10cm和装柱高度20cm之间,病毒回收率差异显著,杂蛋白去除率没有明显差异。考虑装柱高度超过15cm后,同样流速下层析柱压力较高,综合考虑各组病毒回收率和杂蛋白去除率之间的差异,因此装柱高度优选10~20cm。
[0106]
实施例5
[0107]
提供capto core 400复合填料纯化猪伪狂犬超滤液,与实施例2步骤4)(上样体积3cv)进行对比,相同填料、相同柱高、不同上样体积(2cv、4cv、5cv)层析的差异,具体操作方法参照实施例2。将实施例2步骤4)收集的prv层析纯化液进行检定,检测项目包括:蛋白含量、tcid
50
,计算抗原回收率和杂蛋白去除率,结果如表3和表4所示。
[0108]
表3
[0109][0110]
表4统计数据分析
[0111]
上样量病毒回收率p值杂蛋白去除率p值2cv和3cv0.00180.13562cv和4cv0.000030.026272cv和5cv8.1056e-090.010853cv和4cv0.000270.060493cv和5cv2.5366e-060.014244cv和5cv0.000150.03627
[0112]
由表3和表4结果可知,随着上样量增加到一定体积,病毒回收率和杂蛋白去除率有一定降低。根据统计学结果分析,上样量不同,病毒回收率差异非常显著,杂蛋白去除率除2cv和3cv、3cv和4cv之外,其余之间差异显著。考虑上样体积超过4cv后,同样填料、同样流速下填料吸附蛋白的能力降低,综合考虑回收率和杂蛋白去除率,上样体积优选2cv~4cv。
[0113]
实施例6
[0114]
提供capto core 400和capto core 700复合填料纯化猪伪狂犬超滤液,对比不同填料、相同上样体积(3cv)层析的差异,填料对比试验重复3次,分别记为试验1、试验2、试验3,具体操作方法参照实施例2。将实施例2步骤4)收集的prv层析纯化液进行检定,检测项目包括:蛋白含量、tcid
50
,计算抗原回收率和杂蛋白去除率,结果如表5和表6所示。
[0115]
表5
[0116][0117]
表6统计数据分析
[0118]
填料capto core 400和capto core 700病毒回收率p值0.00454杂蛋白去除率p值0.07086
[0119]
由表5和表6可知,capto core 400填料的层析收率要较好于core 700填料,两种方法的杂蛋白去除率相差不大。根据统计学结果分析,填料不同,病毒回收率之间差异非常显著,杂蛋白去除率除之间差异不显著。因此优选capto core 400填料。
[0120]
实施例7
[0121]
通过凝胶过滤sepharose 4ff层析纯化来实现,该方法包括以下步骤:
[0122]
1)层析柱固定:将sepharose 4ff介质搅拌均匀加入到16mm
×
100cm的层析柱中,固定柱床高度为60cm,柱体积约为120ml,用双蒸水以1ml/min的流速冲洗2cv。
[0123]
2)层析通路无菌处理:将层析进样口、出样口在无菌操作下放入到0.5m naoh溶液中,进行循环在线清洗,以1ml/min的流速冲洗2cv。
[0124]
3)平衡:上样前用平衡缓冲液(pbs缓冲液)以1ml/min的流速平衡不少于2cv。
[0125]
4)上样:将实施例1步骤6)获得的病毒浓缩液成品上样7.5%cv。收集第一个流穿峰,即得到prv层析纯化液。prv纯化色谱分析如图2所示。
[0126]
5)层析柱清洗:上样结束后,继续用平衡缓冲液进行冲洗直到紫外吸收的基线归零。更换清洗液,清洗液为0.5mnaoh,清洗液冲洗流速为1ml/min。
[0127]
将步骤4)收集的prv层析纯化液进行检定,检测项目包括:蛋白含量、tcid
50
,计算抗原回收率和杂蛋白去除率,结果如表7和表8所示。
[0128]
表7
[0129][0130]
表8统计数据分析
[0131]
填料capto core 400和sepharose 4ff病毒回收率p值0.06198杂蛋白去除率p值0.02434层析纯化时间p值0.02599
[0132]
在装柱填料体积相同的情况下,capto core 400填料与sepharose 4ff填料单次层析纯化时间对比,结果如表9所示。
[0133]
表9
[0134][0135]
由表7~表9可知,sepharose 4ff填料的层析杂蛋白去除率要好于capto core 400填料,但在装柱填料体积相同的情况下,capto core 400填料批次上样量是sepharose 4ff填料的40倍,层析纯化时间是sepharose 4ff填料的75%左右,即纯化相同体积的prv超滤液,capto core 400填料纯化所用时间仅为sepharose 4ff填料纯化所用时间的1/50。根据统计学结果分析,填料不同,病毒回收率之间差异不明显,杂蛋白去除率以及层析纯化时间之间差异显著。因此利用capto core 400填料层析更方便、快捷,上样体积具有明显优势,处理周期也大大缩短。在蛋白收率和杂蛋白去除率方面效果也较好。综合考虑,capto core 400填料更具有纯化优势。
[0136]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
