一种3d培养羊膜间充质干细胞种子库构建方法
技术领域
1.本发明属于干细胞培养技术领域,具体涉及一种3d培养羊膜间充质干细胞种子库构建方法。
背景技术:
2.羊膜是胚胎期发育的产物,位于胎盘的最内层,不含血管,细胞成分相对简单,主要由外胚层的上皮细胞和中胚层的间充质干细胞组成,具有来源丰富、无创操作、分离过程简单,具有很强的分化潜能以及低免疫原性等优势,同时胎盘在胎儿娩出后即成为废弃物,无伦理争议,是理想的间充质干细胞临床研究及应用来源。
3.目前通常使用酶解法对羊膜进行消化,如胰蛋白酶和胶原酶,消化后细胞进行接种培养,从而获得羊膜间充质干细胞。但是使用胰蛋白酶消化存在诸多问题,如对细胞损伤大,消化时间长,消化下来的细胞不容易保持细胞的干性,不易贴壁生长,细胞成活率低,细胞不纯以及p0代细胞得率过低等。
4.因此,需要提供一种针对上述现有技术不足的改进技术方案。
技术实现要素:
5.本发明的目的在于提供一种3d培养羊膜间充质干细胞种子库构建方法,以解决或改善现有技术中提取羊膜间充质干细胞的过程中,采用胰蛋白酶消化而造成的对细胞损伤大、消化时间长、消化得到的细胞不容易保持细胞干性、不易贴壁生长、细胞存活率低、细胞不纯和p0代细胞得率过低中的至少一项问题。
6.为了实现上述目的,本发明提供如下技术方案:一种3d培养羊膜间充质干细胞种子库构建方法,包括下述步骤:(1)先后采用第一消化液和第二消化液对羊膜组织进行消化,消化结束后除去所述第二消化液,分离得到原代羊膜间充质干细胞;(2)对经步骤(1)处理得到的所述原代羊膜间充质干细胞进行培养,待细胞融合度达到80%-90%时,采用胰酶替代物消化,得到p0代羊膜间充质干细胞;(3)对所述p0代羊膜间充质干细胞进行3d生物反应器培养,得到p1代羊膜间充质干细胞;(4)对所述p1代细胞进行冻存,即得所述种子库;所述第一消化液包括胰酶替代物和分散酶;所述第二消化液包括胶原酶a和脱氧核糖核酸酶i。
7.优选地,所述胰酶替代物为tryple select,浓度为1x;所述分散酶的浓度为1-3mg/ml。
8.优选地,所述第二消化液中,胶原酶a的浓度为1-3mg/ml,脱氧核糖核酸酶i的浓度为50-200u/ml。
9.优选地,所述生物反应器内含有微载体;所述生物反应器中接种的细胞浓度为(1-3)
×
107cells/g微载体。
10.优选地,步骤(3)中:培养结束后,先采用微载体裂解液裂解所述微载体,释放细胞;再采用tryple select对所得细胞进行消化;所述微载体裂解液的浓度为1.5x;所述
tryple select的浓度为1x。
11.优选地,所述生物反应器的培养条件为:ph7.3-7.4,温度36.8-37.2℃。
12.优选地,所述p0代羊膜间充质干细胞接种于生物反应器后,搅拌条件为:a.d0先35-40rpm搅拌5-10min,再0-1rpm搅拌50-70min,循环24次;b.d1-d2 35-40rpm恒速搅拌;c.d3-d5 40-45rpm恒速搅拌;步骤b中,还包括向所述生物反应器中补加培养基的步骤;步骤c中,还包括更换培养基的步骤:若所述生物反应器中,葡萄糖含量降低至初始葡萄糖含量的2/3,更换1/3培养基;若所述生物反应器中,葡萄糖含量降低至初始葡萄糖含量的1/2,更换1/2培养基。
13.优选地,步骤(1)中,所述消化在37℃恒温摇床中进行,所述恒温摇床的转速为100-200rpm;所述第一消化液消化的时间为1-2h,除去所述第一消化液的步骤包括过100目筛和pbs漂洗;所述第二消化液消化的时间为1.5-2h,除去所述第二消化液的步骤包括离心,所述离心的离心力为400g,离心时间为5-10min。
14.优选地,步骤(1)之前还包括采用清洗液对羊膜进行清洗并剪成所述羊膜组织的步骤;所述清洗液为含0.2%-0.6%庆大霉素的磷酸盐缓冲液;步骤(1)中,所述第一消化液与所述羊膜组织的体积比为1:1;所述第二消化液与经所述第一消化液处理所得产物的体积比为1:1;所述羊膜组织为(1-3)cm
×
(1-3)cm的组织块。
15.优选地,步骤(2)和(3)中所采用的培养基为t4完全培养基;所述t4完全培养基包括t4间充质干细胞基础培养基和终浓度为1-10%的血小板裂解液。
16.有益效果:
17.本发明的3d培养羊膜间充质干细胞种子库构建方法通过先后采用第一消化液和第二消化液来对羊膜进行消化,以便于在羊膜间充质干细胞提取时,能够更有效地从羊膜组织中分离羊膜间充质干细胞,提高p0代细胞得率;且提取得到的羊膜间充质干细胞活性好、纯度高、工艺重复性好。
18.本发明的3d培养羊膜间充质干细胞种子库构建方法通过采用特定的羊膜消化液,并结合两步消化法对羊膜间充质干细胞进行分离,分离效果好。
19.本发明的3d培养羊膜间充质干细胞种子库构建方法中,可在较短的体外培养时间下,获取更多的羊膜间充质干细胞。
20.本发明的3d培养羊膜间充质干细胞种子库构建方法,可采用3d生物反应器进行种子库细胞培养,可实现大规模培养,有利于实现细胞疗法的商业化,后续的临床使用可以辐射更多的患者,填补目前临床需求的空白。
21.本发明的3d培养羊膜间充质干细胞种子库构建方法得到的种子库细胞的传代次数少(p1代细胞),体外扩张时间短,更容易保持较好的干性和归巢性,有助于发挥其临床效果。
附图说明
22.构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。其中:
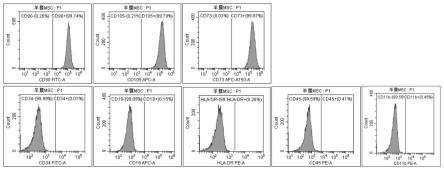
23.图1为本发明实施例提供的从羊膜中分离得到的羊膜间充质干细胞的三阳五阴流式检测结果图。
具体实施方式
24.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
25.下面将结合实施例来详细说明本发明。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
26.本发明针对目前羊膜间充质干细胞提取过程中存在的问题,提供一种3d培养羊膜间充质干细胞种子库构建方法,包括下述步骤:(1)先后采用第一消化液和第二消化液对羊膜组织进行消化,消化结束后除去消化液,分离得到原代羊膜间充质干细胞;(2)对经步骤(1)处理得到的原代羊膜间充质干细胞进行培养,待细胞融合度达到80%-90%时,采用胰酶替代物消化,得到p0代羊膜间充质干细胞;(3)对p0代羊膜间充质干细胞进行3d生物反应器培养,得到p1代羊膜间充质干细胞;(4)对p1代细胞进行冻存,即得种子库;第一消化液包括胰酶替代物和分散酶;第二消化液包括胶原酶a和脱氧核糖核酸酶i。
27.通过先后采用第一消化液和第二消化液对羊膜进行消化,能够更有效的从羊膜组织中分离羊膜间充质干细胞,进而显著提高p0细胞得率。并且,可使后续培养得到的羊膜间充质干细胞活性好、纯度高,工艺重复性好。此外,较高的p0细胞得率,使得后续可选择3d生物反应器(3d生物反应器需要至少1.5亿细胞的接种量,接种量过低会影响扩增倍数,进而会导致后续种子库细胞的代次过高)对羊膜间充质干细胞进行培养,实现羊膜间充质干细胞的高效培养,获取代次更低的种子库细胞。
28.本发明优选实施例中,胰酶替代物为tryple select,浓度为1x;分散酶的浓度为1-3mg/ml(例如,1mg/ml、2mg/ml或3mg/ml)。
29.本发明优选实施例中,第二消化液中,胶原酶a的浓度为1-3mg/ml(例如,1mg/ml、2mg/ml或3mg/ml),脱氧核糖核酸酶i的浓度为50-200u/ml(例如,50u/ml、100u/ml、150u/ml或200u/ml)。
30.本发明优选实施例中,生物反应器内含有微载体;生物反应器中接种的细胞浓度为(1-3)
×
107cells/g微载体(例如,1
×
107cells/g微载体、2
×
107cells/g微载体或3
×
107cells/g微载体)。
31.本发明优选实施例中,步骤(3)中:培养结束后,先采用微载体裂解液裂解微载体,释放细胞;再采用tryple select对所得细胞进行消化;微载体裂解液的浓度为1.5x;tryple select的浓度为1x。
32.本发明优选实施例中,生物反应器的培养条件为:ph7.3-7.4(通过控制co2浓度,实现培养液ph的控制),温度36.8-37.2℃(例如,36.8℃、37.0℃或37.2℃),溶氧90%。
33.本发明优选实施例中,p0代羊膜间充质干细胞接种于生物反应器后,搅拌条件为:a.d0(第0天)先35-40rpm(例如,35rpm、38rpm或40rpm)搅拌5-10min(例如,5min、8min或10min),再0-1rpm搅拌50-70min(例如,50min、60min或70min),循环24次(以有助于p0代羊膜间充质干细胞与微载体的贴合);b.d1-d2(第1-2天)35-40rpm(例如,35rpm、38rpm或40rpm)恒速搅拌;c.d3-d5(第3-5天)40-45rpm(例如,40rpm、42rpm或45rpm)恒速搅拌;p0代羊膜间充质干细胞与微载体贴合后,细胞溶氧需求增大,需要保持恒速搅拌;随着细胞量的增多,需要提高搅拌转速。
34.本发明优选实施例中,步骤b中,还包括向生物反应器中补加培养基的步骤;步骤c中,还包括更换培养基的步骤:若生物反应器中,葡萄糖含量降低至初始葡萄糖含量的2/3,更换1/3培养基;若生物反应器中,葡萄糖含量降低至初始葡萄糖含量的1/2,更换1/2培养基。
35.本发明优选实施例中,步骤(1),消化在37℃恒温摇床中进行,恒温摇床的转速为100-200rpm(例如,100rpm、150rpm或200rpm);第一消化液消化的时间为1-2h(例如,1h、1.5h或2h),除去第一消化液的步骤包括过100目筛和pbs漂洗;第二消化液消化的时间为1.5-2h(例如,1.5h、1.8h或2h),除去第二消化液的步骤包括离心,离心的离心力为400g,离心时间为5-10min(例如,5min、8min或10min)。
36.本发明优选实施例中,步骤(1)之前还包括采用清洗液对羊膜进行清洗并剪成羊膜组织的步骤;清洗液为含0.2%-0.6%(体积分数;例如,0.2%、0.4%或0.6%)硫酸庆大霉素的磷酸盐缓冲液。用镊子将羊膜从胎盘中剥离后,可用清洗液清洗2-3次,直至羊膜表面无血丝和血块,之后再用剪刀将羊膜剪成组织块。
37.本发明优选实施例中,步骤(1)中,第一消化液与羊膜组织的体积比为1:1;步骤(2)中,第二消化液与经步骤(1)处理所得产物的体积比为1:1;步骤(1)中,羊膜组织为(1-3)cm
×
(1-3)cm(例如,1cm
×
1cm、1cm
×
3cm、2cm
×
3cm或3cm
×
3cm)的组织块。
38.本发明优选实施例中,步骤(2)和(3)中所采用的培养基为t4完全培养基;t4完全培养基包括t4间充质干细胞基础培养基和终浓度为1-10%的血小板裂解液(即,t4完全培养基中血小板裂解液的体积分数为1-10%;例如,t4完全培养基中血小板裂解液的体积分数为1%、5%或10%)。
39.下面通过具体实施例对本发明的3d培养羊膜间充质干细胞种子库构建方法进行详细说明。
40.下面实施例中:用到的主要设备如下表1所示:
41.表1设备清单
42.设备名称生产厂家型号生物安全柜escoac2-4s1台式离心机beckmanavantij-15rco2培养箱escoccl-170b-8细胞计数仪countstarrigel s2恒温摇床bluepardthz-100
43.下面实施例中,用到的主要试剂如下表2所示:
44.表2试剂清单
45.试剂厂家规格硫酸庆大霉素华中药业2ml/支t4完全培养基自配500ml/瓶胶原酶asigma500mgdispase iisigma1gdnase
ꢀⅰ
invitrogen2000u/支pbsbiological industries500ml/瓶
tryple selectgibco500ml/瓶
46.其中,t4完全培养基通过向t4间充质干细胞基础培养基中,加入终浓度为5%的血小板裂解液配制得到。
47.实施例1
48.本实施例的3d培养羊膜间充质干细胞种子库构建方法:
49.本实施例所采用的第一消化液为:tryple select(1x) 2mg/ml dispaseii(分散酶);
50.第二消化液为:1mg/ml胶原酶a 50u/ml脱氧核糖核酸酶i(dnase i)。
51.其中,第一消化液通过将tryple select和dispaseii混合后制备得到;第二消化液通过将胶原酶和脱氧核糖核酸酶i与pbs均匀混合后制备得到;各原料的浓度均为终浓度。
52.本实施例的3d培养羊膜间充质干细胞种子库构建方法,包括下述步骤:
53.(1)羊膜组织分离前进行溶液配制。配制清洗液:清洗液为含0.4%庆大霉素(一种热稳定型抗生素)的pbs(磷酸缓冲盐溶液),如配制500ml清洗液,则在500ml pbs(磷酸缓冲盐溶液)中加入2ml硫酸庆大霉素即可。
54.(2)取2个无菌不锈钢盘,加入适量清洗液,将整胎盘从运送容器中取出至不锈钢盆中。用镊子将羊膜从胎盘中剥离放入新的不锈钢盘中,用清洗液清洗2-3次,直至羊膜表面无血丝与血块。将清洗干净的羊膜转移至新的不锈钢盘中,用剪刀剪成约2cm
×
2cm的组织小块。
55.(3)将组织小块转移至500ml血清瓶内加入等体积的第一消化液(tryple select(1x) 2mg/ml dispaseii(中性蛋白酶,也称为分散酶)混合溶液),置于37℃恒温摇床,100-200rpm消化120min以释放羊膜上皮细胞。消化完成后将血清瓶内组织倒入100目钢筛进行过滤,再用无菌镊将羊膜转移至装有pbs的15cm培养皿漂洗2-3次以去除初步分离酶溶液。
56.(4)根据羊膜组织体积配制第二消化液,第二消化液包含胶原酶a1mg/ml和dnase i 50u/ml。向羊膜组织中加入等体积第二消化液,置于37℃恒温摇床,100-200rpm消化2h,没有肉眼可见的组织时,加入等体积的pbs溶液终止消化,颠倒混匀后,分装至50ml离心管中,400g离心10min,弃上清,用30ml pbs重悬沉淀物,再次400g离心5min。
57.(5)弃上清,用适量t4完全培养基重悬沉淀物,将所有细胞合并至一处,即为分离得到的原代羊膜间充质干细胞。
58.(6)将上述步骤(5)分离得到的原代羊膜间充质干细胞经ao/pi计数后,根据计数结果按照20000cells/cm2接种至t175培养瓶(cellbind处理)中,培养瓶对应的底面积与建议培养基量见下表3,充分摇晃以使细胞在培养瓶中均匀分布,置于37.0℃、5.0%的二氧化碳培养箱中培养。
59.(7)p0代细胞传代:原代羊膜间充质干细胞培养8天后,在显微镜下观察细胞生长情况,细胞融合度大于80%时确认进行传代。弃尽培养上清,加入适量pbs清洗细胞表面1次。弃尽上述pbs,向每个培养瓶中加入消化酶(tryple select消化酶,消化酶的加入量参考下表3),使其均匀覆盖瓶底部,在常温条件下消化3min。轻轻摇晃后肉眼观察到细胞剥落呈流沙状或在镜下观察细胞呈圆球状后表明消化完成。向每个培养瓶中加入不少于消化酶体积的pbs终止消化。将培养瓶中所有的液体转移至离心管中,并使用适量pbs清洗培养瓶
(清洗液的建议量参考下表3),再将液体转移到上述离心管中,400g,离心5min。离心结束后,弃上清,得p0代羊膜间充质干细胞。
60.(8)用t4完全培养基重悬计数(细胞计数时浓度不宜过低或过高,推荐计数浓度在5
×
10
5-3
×
106/ml),取20μl进行计数。
61.(9)根据消化计数结果,取一定体积的细胞悬液,使所取活细胞数量满足2
×
107/g微载体(市售购买得到的多孔微载体),将细胞悬液加入已复温含微载体的容器中,轻轻混匀,转入已灭菌的蓝盖瓶中,连接管路通过生物反应器控制器的蠕动泵泵入生物反应器中,含有细胞的悬液泵入的速度建议不高于200rpm,以减少对细胞的损伤,补加t4完全培养基至约5l。
62.表3各培养容器培养基、消化酶、清洗液及重悬体积建议加液量
[0063][0064]
(10)p1代细胞收获:细胞培养期间每天进行动态数据监测,包括葡萄糖含量测定、细胞计数以及am/pi染色,必要时进行培养基补换液操作(3d生物反应器培养时,控制培养液的ph为7.3-7.4,温度为36.8-37.2℃,溶氧90%;p0代羊膜间充质干细胞接种于生物反应器后,d0(第0天)先35rpm搅拌5min,再1rpm搅拌55min,循环24次,以有助于p0代羊膜间充质干细胞与微载体的贴合;d1-d3(第1-3天)恒速35rpm;d4-d5(第4-5天)恒速45rpm;补液是指在d2补充t4完全培养基;换液是若葡萄糖含量降低至初葡萄糖含量的2/3,则更换1/3新鲜t4完全培养基;若葡萄糖含量降低至初葡萄糖含量的1/2,则更换1/2新鲜t4完全培养基),生物反应器细胞一般培养5天进行收获,收获前生物反应器停止转动,沉淀微载体,用带滤网的管路泵出培养基上清,加入提前配制好的微载体裂解液(浓度3mg/ml,与上述微载体配套使用,市售购买得到),生物反应器调整转速至40rpm,裂解时间通常为60min,微载体裂解完成后,泵出细胞悬液,分装至250ml离心管中,450g,离心5min。
[0065]
(11)离心完成后弃上清,加入适量tryple select消化酶(消化酶的加入量参考上表3),将细胞合并至250ml离心管中定容至80ml,置于37℃恒温摇床150rpm转速条件下消化10min,加入不少于tryple select消化酶2倍体积的pbs以终止消化,450g,离心5min。弃上清,细胞沉淀使用200ml pbs重悬洗涤一次,450g离心5min,离心结束,弃上清,加入200ml pbs重悬细胞,通过100μm过滤器过滤至新的250ml方瓶中,混匀,ao/pi计数(细胞计数时浓度不宜过低或过高,推荐计数浓度在5
×
10
5-6
×
106/ml),根据计数结果配制所需体积的冻存液,混匀后按照相应规格分装至冻存容器中,使用程序降温仪冻存后转移至液氮罐深低温储存,冻存细胞即为本实施例的3d培养羊膜间充质干细胞种子库构建方法构建得到的羊
膜间充质干细胞种子库。
[0066]
对比例1
[0067]
本对比例的羊膜消化液:第一消化液和第二消化液均为tryple select(1x)。
[0068]
对比例2
[0069]
本对比例的羊膜消化液:
[0070]
第一消化液为:tryple select(1x);
[0071]
第二消化液为:2mg/ml胶原酶a 2mg/ml dispaseii 50u/ml dnasei。
[0072]
对比例3
[0073]
本对比例的羊膜消化液:
[0074]
第一消化液为:tryple select(1x) 2mg/ml dispaseii;
[0075]
第二消化液为:0.75mg/ml胶原酶i 50u/ml dnase i。
[0076]
对比例4
[0077]
本对比例的羊膜消化液:
[0078]
第一消化液为:tryple select(1x) 2mg/ml dispaseii;
[0079]
第二消化液为:1mg/ml胶原酶i 50u/ml dnase i。
[0080]
对比例5
[0081]
本对比例的羊膜消化液:
[0082]
第一消化液为:tryple select(1x) 2mg/ml dispaseii;
[0083]
第二消化液为:0.75mg/ml胶原酶ii 50u/ml dnase i。
[0084]
对比例6
[0085]
本对比例的羊膜消化液:
[0086]
第一消化液为:tryple select(1x) 2mg/ml dispaseii;
[0087]
第二消化液为:1mg/ml胶原酶ii 50u/ml dnase i。
[0088]
对比例7
[0089]
本对比例的羊膜消化液:
[0090]
第一消化液为:tryple select(1x) 2mg/ml dispaseii;
[0091]
第二消化液为:0.75mg/ml胶原酶a 50u/ml dnase i。
[0092]
实验例
[0093]
1、分别采用实施例1及对比例1-2的第一消化液和第二消化液,按照实施例1的步骤对等量羊膜(1/3羊膜)进行羊膜间充质干细胞的分离,对分离得到的羊膜间充质干细胞(原代羊膜间充质干细胞)的活率和细胞量进行检测,检测结果如下表4所示:
[0094]
表4不同消化液分离得到的细胞量及细胞活率
[0095]
羊膜消化液活率细胞量(1/3羊膜)实施例194.02%2.63e 07对比例174.83%1.58e 05对比例279.14%1.41e 07
[0096]
由上表4可知:采用本发明中所用的消化酶组合,所分离的细胞活率高、收率高,培养8-10天后,p0收获细胞数量多,足够用于生物反应器上罐培养,实现种子库高效大规模培养。而对比方法所获得的羊膜间充质原代细胞活性差,细胞收率低,后续难以接种培养。
[0097]
2、采用上述实施例1的3d培养羊膜间充质干细胞种子库构建方法对3个批次的羊膜进行消化,实现羊膜间充质干细胞的分离后(检测分离得到的细胞量和细胞活率,即下表5中的“原代分离细胞量”和“活率”),继续培养8-10天后(按照实施例1中的相应步骤),检测收获得到的细胞数量(即下表5中的“p0代细胞收获量”)和细胞活率。
[0098]
检测结果如下表5所示:
[0099]
表5
[0100]
细胞批次体积/块数活率原代分离细胞量p0代细胞收获量批次145ml(165)90.88%6.51e 072.87e 08批次247ml(146)95.61%7.65e 073.23e 08批次328ml(124)94.75%5.13e 071.76e 08
[0101]
由表5可知:采用本发明实施例1的第一消化液和第二消化液对3个批次的羊膜(每个批次用到的羊膜量均为一整张羊膜)进行消化,原代分离细胞量在五千万以上,体外培养8-10天后,收获细胞量(p0代细胞收获量)不低于1.5亿,足够用于后续的3d生物反应器上罐培养。
[0102]
3、同时我们进行了羊膜间充质干细胞原代消化酶筛选评估研究,目的为了筛选出最优的酶组合用于羊膜间充质干细胞原代消化,初步确定消化程序。为此我们进行了对比例3-8的羊膜消化液,控制变量为tryple select(第一消化液)的消化时间、胶原酶的种类、胶原酶消化时间以及胶原酶浓度范围。结果如表6所示。
[0103]
表6不同浓度不同类型的胶原酶消化后细胞活率
[0104]
[0105][0106]
表7不同浓度不同类型的胶原酶消化2h后p0细胞收获量
[0107]
[0108][0109]
其中,表6和表7中,每个实验用到的羊膜的量均相同(将羊膜剪碎后均分,每个实验所用到的羊膜量约为5ml左右)。
[0110]
综合以上实验结果可以看出,消化时间方面:tryple select消化30min,仅少量上皮细胞掉落,且细胞贴壁第五天观察有大量的上皮细胞;tryple select消化60min时,上皮细胞卷缩,并出现局部掉落,细胞贴壁第五天观察有部分上皮细胞,相较消化30min有减少趋势;tryple select消化90min,可观察到大量上皮细胞掉落。tryple select消化170min及210min,仅剩少量上皮细胞,上皮掉落情况趋于稳定,没有太大变化。考虑到第一步工艺tryple select作用类似于胰酶,可以分解组织间的蛋白成分,消化过久可能通过上皮层掉落部位对间充质层进行消化,因此消化时间不宜太久。
[0111]
从胶原酶消化1h、2h、3h的组织剩余情况来看,消化1h还有大量的组织残余,而且不能吹散;消化2h有少量组织,但组织松散,可以吹散;消化3h已没有明显组织块。因此后续胶原酶消化时间选择2h,考察了tryple select消化时间及胶原酶种类和浓度对p0细胞收获量的影响(详见上表7)。
[0112]
胶原酶浓度及种类方面:tryple消化后再用不同浓度不同类型的胶原酶消化后细胞活率分析,tryple select消化60min后,三种胶原酶消化2h活率80%以上,tryple select消化后再用不同浓度不同类型的胶原酶消化2h后p0细胞收获量胶原酶a的收获量较多,且很稳定,其中1mg/ml的胶原酶a收获量高于0.75mg/ml的胶原酶a。
[0113]
4、对三批次的羊膜分离得到的原代细胞进行纯度鉴定(三阳五阴流式分析),实验结果如图1所示;
[0114]
由图1可知,三阳(cd73 、cd90 、cd105 )均大于99.5%,五阴(cd34-、cd19-、hla-dr-、cd45-、cd11b-)均小于1%,均小于现行要求中的三阳大于95%、五阴小于2%的要求,通过本发明的方法分离的羊膜间充质干细胞的纯度高。
[0115]
5、对上述得到的p0代细胞分别接种于细胞工厂(2层工厂)和生物反应器中进行传代培养;其中,在生物反应器中的培养按照实施例3中的步骤(4)-(6)进行;在细胞工厂中的培养与实施例3中的步骤(4)-(6)的区别仅在于:培养容器不同、省略加入微载体和对微载体进行裂解的步骤;其余均与实施例3中的步骤(4)-(6)保持一致。
[0116]
实验结果如下表8所示:
[0117]
表8
[0118][0119]
其中,2d培养时,培养天数达到3天后,继续培养细胞会出现生长抑制,细胞会脱落,不能通过继续增加培养天数实现细胞的扩增。
[0120]
由上表可知,3d培养扩增倍数优于普通的2d培养,现阶段的2d培养技术采用多层培养皿,在安全柜中操作步骤繁琐,所需人员较多,因而容易造成污染。2d贴壁培养产量受到很大的局限,一次培养能够生产的细胞数在108细胞左右。同一批次生产的细胞的量少,在后续的质检和临床应用中有很大的局限性。而3d立体化培养,一批中试生产的细胞量可达百亿级细胞(例如,可以通过增大生物反应器的容量,来获取更多的细胞量,一批次中试生成的细胞量可达(30~100)
×
108)左右,且通过提高发酵罐的体积,可进一步增加单批次的产能,通过发酵罐3d培养获得的细胞,批次间的稳定性更优,易对工艺进行严格控制并形成产品的稳定质量控制。3d立体化培养对培养基用量和人力成本的要求也大大的降低,减少原料和人力成本的同时进一步减少污染的风险。3d培养与2d贴壁培养相比,在细胞体积形态控制、干性维持、分泌因子、蛋白表达、增殖能力、归巢能力以及免疫调节能力都存在一定的优势,且有研究表明3d培养的细胞动物实验效果优于2d培养的细胞。3d三维培养的方式逐渐成为业界细胞培养的发展方向,不仅从细胞“量”的方面解决临床对细胞数量和稳定性的需求,同时从细胞“质”方面的提高了细胞的生理状态,减少了细胞的体积,在临床上也显示出更加优越的效果。同时,由3d三维培养带来的细胞生产管理和细胞的质量控制方面优势,既能减少生产成本和细胞污染风险,又能提高细胞质量稳定性,获得细胞质量标准的提升。
[0121]
以上所述仅为本发明的优选实施例,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。