1.本发明涉及一种拟胚体大规模生产的方法及应用,属于拟胚体技术领域。
背景技术:
2.胚胎干细胞(embryonic stem cell,简称es)或诱导多能干细胞(induced pluripotent stem cells,简称ips)是在体外一定的培养条件下形成的,具有内、中、外三胚层结构,形态学上与哺乳动物早期的胚胎发育阶段有着很高相似度的一种球状结构,又被称为拟胚体(embryoid bodies,eb,简称ebs)。目前很多分化系统都是基于拟胚体分化体系建立的,如造血干细胞、自然杀伤细胞、神经干细胞和心肌细胞等,其分化策略都是先制备出拟胚体,然后用不同的措施定向诱导分化为目的细胞。之所以经拟胚体途径,目的是模拟体内胚胎发育过程,拟胚体中的内、中、外三胚层的细胞互相支持,互相提供分化生长的微环境。
3.现有技术中,拟胚体的生产方法主要有自发形成法、悬滴法和离心法三种,均存在弊端,具体如下:
4.自发形成法:是将细胞团块悬浮在康宁(corning)低附着培养皿或聚hema涂层培养皿中,通过数量比为1:1传代到一个康宁(corning)低附着培养皿中,以便在37℃培养箱中过夜自聚集。第二天,形成各种尺寸的拟胚体。该方法的缺点是形成的拟胚体大小不均一,无法进行质量控制,导致后续分化工艺不稳定,无法大规模培养。
5.悬滴法:为了形成悬滴拟胚体,将单细胞滴(2000个细胞/20μl)悬垂培养在培养皿的盖子上,再将培养皿的盖子在37℃培养箱中孵育过夜。第二天形成大小一致的拟胚体。该方法能够形成大小均一的拟胚体,缺点是操作复杂,单位容器面积下产生拟胚体效率低,对人员操作要求高,人力成本高,无法完成大规模生产。
6.离心法:使用前用dmem/f12冲aggrewell培养板的每个孔。将1.5
×
106个细胞/1.5ml添加到每个孔以生成所需大小的拟胚体。以100
×
g离心aggrewell板3min-5min。将aggrewell培养板在37℃培养箱中孵育过夜。第二天形成统一大小的拟胚体。在aggrewell培养板中轻轻地上下移取培养基以去除拟胚体微孔并将它们转移到康宁(corning)低附着培养皿或聚hema涂层培养皿。该方法能够形成大小均一的拟胚体,缺点在于大规模培养时,需要频繁使用离心机,还需要使用大量aggrewell培养板,人力和物力成本高,时间长,不适合大规模工业化生产。
7.随着细胞治疗技术的发展,传统的科研型拟胚体形成方法满足不了大规模工业生产的需求。鉴于此,有必要提供一种大规模工业化生产拟胚体的方法,以提供大小均一,品质可控的拟胚体,以克服现有技术的不足。
技术实现要素:
8.本发明的目的之一,是提供一种拟胚体大规模生产的方法。
9.本发明解决上述问题的技术方案如下:一种拟胚体大规模生产的方法,包括如下
步骤:
10.步骤(1):制备分散相
11.取ipsc单细胞,加入dpbs缓冲液,配置成浓度为5万/ml-200万/ml的细胞悬液;
12.将上述细胞悬液与生物水凝胶进行混合,直至混合物中生物水凝胶的质量百分浓度为2%-5%;
13.再加入交联剂,得到分散相,分散相中生物水凝胶的质量百分浓度为1%;
14.步骤(2):制备油包水液滴
15.通过第一移液枪枪头将步骤(1)得到的分散相注入到微流控装置的液相通道中;
16.通过第二移液枪枪头将油相注入到微流控装置的油相通道中;
17.在液相通道和油相通道的交汇处,形成大小均一的油包水液滴;
18.步骤(3):紫外光照射
19.将步骤(2)得到的油包水液滴,进行紫外光照射,即得到拟胚体。
20.本发明的大规模生产拟胚体的方法的原理说明:
21.第一点,本发明的步骤(1)中,ipsc由授权专利cn202110690889.0说明书第0125段-第0153段中实验组的方法制备而得。ipsc也可以由专利申请cn201910110768.7或专利申请cn202110733296.8中的制备方法制备而得,还可以由本领域公知方法或商品化试剂盒制备而得。
22.生物水凝胶在使用前需要用0.22μm无菌过滤头过滤除菌。过滤损耗与浓度成正比,浓度越高损耗越多。混合物中生物水凝胶的质量百分浓度为2%-5%,可以保证过滤损耗率<10%。
23.第二点,本发明的步骤(2)中,现有技术中,并没有微流控装置用于生产拟胚体的报道。本发明的发明人经过长期大量的试验摸索,惊喜且意外地发现,该微流控装置用于生产拟胚体,得到的拟胚体大小均一,能够流水线式自动化形成,适合大规模生产。
24.上述微流控装置可以市售购买,如可以购自上海澎赞生物科技有限公司。
25.本发明的拟胚体大规模生产的方法的有益效果是:
26.本发明能够实现拟胚体大规模工业化生产,得到的拟胚体大小均一,操作简单,成本低廉,对设备要求低,生产效率高,市场前景广阔。
27.在上述技术方案的基础上,本发明还可以做如下改进。
28.进一步,步骤(1)中,所述生物水凝胶为甲基丙烯酸化水凝胶、聚乙醇酸、聚乳酸、羟基烷酸酯、丁二酸丁二醇酯、聚己内酯、胶原蛋白和基质胶中的任意一种。
29.采用上述进一步的有益效果是:上述材料均可以作为生物水凝胶,能达到相同的技术效果。
30.优选地,所述生物水凝胶为甲基丙烯酸化水凝胶。
31.更进一步,所述甲基丙烯酸化水凝胶由如下方法制备而成:
32.步骤(1.1):取10.0g明胶,使用磁力搅拌器,于60℃溶解在100ml的dpbs缓冲液中,得到溶液ⅰ;
33.步骤(1.2):在溶液ⅰ中,加入8.0ml甲基丙烯酸酐,使用磁力搅拌器,于50℃剧烈搅拌下反应3h,得到溶液ⅱ;
34.步骤(1.3):在溶液ⅱ中,加入五倍溶液ⅱ体积的40℃的dpbs缓冲液,得到溶液ⅲ;
35.步骤(1.4):使用snakeskin透析袋,将溶液ⅲ透析5d-10d,得到溶液ⅳ,即为甲基丙烯酸化水凝胶;
36.采用上述进一步的有益效果是:上述甲基丙烯酸化水凝胶是由明胶经过甲基丙烯酸酐改性而成,通过甲基丙烯酸酐的羧基与明胶上的羟基反应,将碳碳双键引入明胶中,使得甲基丙烯酸化水凝胶可在光引发剂的作用下,通过光固化原理对细胞进行包覆,形成拟胚体结构。
37.其中,步骤(1.3)中,在溶液ⅱ中,加入溶液ⅱ五倍体积的40℃的dpbs缓冲液,是为了终止反应。
38.步骤(1.4)中,使用snakeskin透析袋,将溶液ⅲ透析5d-10d,是为了去除任何盐和未反应的甲基丙烯酸酐。得到的甲基丙烯酸化水凝胶冻干7d,可以获得白色多孔泡沫,储存于-80℃,备用。
39.上述明胶可以市售购买,如可以购自sigma-aldrich,货号为v900863。
40.上述甲基丙烯酸酐可以市售购买,如可以购自sigma-aldrich,货号为760-93-0。
41.上述dpbs缓冲液可以市售购买,如可以购自invitrogen,货号为14190144。
42.上述snakeskin透析袋可以市售购买,如可以购自invitrogen,货号为68100。
43.进一步,步骤(1)中,所述交联剂为2-羟基-4'-(2-羟基乙氧基)-2-甲基苯丙酮。
44.采用上述进一步的有益效果是:交联剂是和生物水凝胶一起,在光的作用下发生光固化反应,形成拟胚体。
45.上述2-羟基-4'-(2-羟基乙氧基)-2-甲基苯丙酮可以市售购买,如可以购自sigma-aldrich,货号为106797-53-9。
46.进一步,步骤(2)中,所述油相为含氟油。
47.采用上述进一步的有益效果是:以含氟油作为油相,可以更好地形成尺寸均一的液滴。
48.更进一步,所述含氟油为hfe-7500油或fc-40油。
49.采用上述更进一步的有益效果是:hfe-7500油或fc-40油均可以作为含氟油,具有相同的技术效果。
50.上述hfe-7500可以市售购买,如可以购自3m公司,货号为hfe-7500。
51.进一步,步骤(2)中,所述分散相通道的口径与所述第一移液枪枪头的最大口径相适配,所述油相通道的口径与所述第二移液枪枪头的最大口径相适配。
52.采用上述进一步的有益效果是:分散相通道的口径与第一移液枪枪头的最大口径相适配,这样分散相可以快速、准确地进入到分散相通道中。油相通道的口径与第二移液枪枪头的最大口径相适配,这样油相可以快速、准确地进入到油相通道中。
53.进一步,步骤(2)中,所述油包水液滴的粒径为150μm-250μm。
54.采用上述更进一步的有益效果是:采用上述油包水液滴的粒径,可以快速短时间内制备大量形态均一、直径为150μm-250μm的拟胚体。
55.进一步,步骤(3)中,所述紫外光照射的波长为365nm,功率为6.9mw/cm2,时间为10s-20s。
56.采用上述进一步的有益效果是:采用上述参数,可以实现油包水液滴聚合形成拟胚体。
57.本发明的目的之二,是提供上述拟胚体的应用。
58.本发明解决上述问题的技术方案如下:上述拟胚体在类器官分化、功能细胞分化、肿瘤微球和微载体中的应用。
59.本发明的拟胚体的应用的有益效果是:
60.本发明制备得到的拟胚体,用于类器官分化、功能细胞分化、肿瘤微球和微载体等领域,分化成功率高且分化效果好,具有广泛的应用前景。
61.其中,类器官分化,包括大脑,肝,肾,心脏和眼球等;功能细胞分化,包括胰岛小体、nk、内皮细胞、神经干细胞、多巴胺能神经元和造血干细胞等。
62.优选地,所述类器官为大脑类器官。
63.优选地,所述功能细胞为胰岛细胞。
64.优选地,所述微载体为水凝胶微载体。
附图说明
65.图1为本发明的实施例1的步骤(2)中,制备油包水液滴的示意图。
66.图2为本发明的实施例1的步骤(3)中,得到的拟胚体的形态图,比例尺为0.3mm。
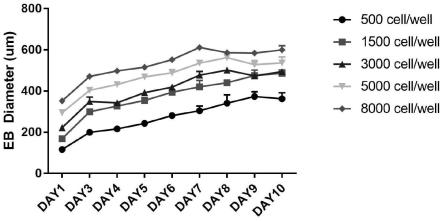
67.图3为本发明的实施例2中,由不同细胞数形成的拟胚体的直径。
68.图4为本发明的实验例1中,免疫荧光检测大脑类器官标志蛋白,其中a、e、h图为定位于细胞核的dapi,b图为定位于细胞骨架的tuj1,c图为定位于细胞核的sox2,d为a、b、c图的融合图,f图为定位于细胞骨架的foxg1,g图为e、f图的融合图,i图为定位于细胞膜的fzd9,j图为h、i图的融合图。
69.图5为本发明的实验例2中,免疫荧光检测胰岛小体标志蛋白基因表达。其中,a图为定位于细胞核的dapi,b图为定位于胰岛α细胞的胰高血糖素(gcg),c图为定位于胰岛β细胞的胰岛素(ins),d图为a、b、c图的融合图,e图为定位于细胞核的dapi,f图为定位于胰岛α细胞的胰高血糖素(gcg),g图为定位于胰岛β细胞的胰岛素(ins),h图为e、f、g图融合图,i图为定位于细胞核的dapi,j图为定位于胰岛α细胞的胰高血糖素(gcg),k图为定位于胰岛β细胞的胰岛素(ins),l图为i、j、k图融合图。
70.图6为本发明的实验例3中,lncap细胞细胞肿瘤微球形态,从左至右分别为三个lncap细胞细胞肿瘤微球。
71.图7为本发明的实验例4中,微载体上ipsc生长状态,从左至右,分别为第3天、第6天和第9天的ipsc生长状态。
具体实施方式
72.除非另有说明,本文使用的所有技术和科学术语具有本领域普通技术人员所通常理解的含义。
73.术语“或”是指列举的可选择要素中的单个要素,除非上下文明确地另外指出。
74.术语“和/或”是指所列举的可选择要素中的任意一个、任意两个、任意三个、任意更多个或其全部。
75.术语“包括”或“包含”指包括所述的要素、整数或步骤,但是不排除任意其他要素、整数或步骤。当使用“包括”或“包含”时,除非另有指明,否则也涵盖由所述及的要素、整数
或步骤组成的情形。
76.术语“诱导多能干细胞(ipsc)”指通过人工诱导某些基因的表达从某些成体细胞(如成纤维细胞)获得的具有全能性或多能性的干细胞。在本领域已知的一些方法中,可通过将某些干细胞相关基因转染到非多能细胞如成体成纤维细胞来获得ipsc。转染可以通过使用病毒如逆转录病毒或慢病毒的病毒转导来实现。在一些方法中,转染基因可包括转录因子oct4、sox2、klf4和c-myc,尽管同时转染其他基因有可能提高诱导效率。在另一些方法中,可利用慢病毒系统采用oct4、sox2、nanog和lin28基因转化体细胞。在ipsc中诱导表达的基因包括但不限于oct-3/4;sox基因家族的某些成员(例如soxl、sox2、sox3和sox15);klf家族的某些成员(例如klfl、klf2、klf4和klf5)、myc家族的某些成员(例如c-myc、l-myc和n-myc)、nanog、lin28、tert、fbx15、eras、ecat15-1、ecat15-2、tcl1、β-catenin、ecat1、esg1、dnmt3l、ecat8、gdf3、fth117、sal14、rex1、utf1、stella、stat3、grb2、prdm14、nr5a1、nr5a2或e-cadherin,或其任何组合。目前已经可以从市场上购得用于制备ipsc的各种试剂,如重编程载体、表达盒、培养基等,甚至商业化的ipsc。
77.术语“拟胚体(embryoid bodies,eb)”是指胚胎干细胞(es)或诱导多能干细胞(ips)在体外一定的培养条件下形成的,具有内、中、外三胚层结构,形态学上与哺乳动物早期的胚胎发育阶段有着很高相似度的一种球状结构。在成熟的人拟胚体中,可以辨别携带各种细胞类型标记的细胞,例如神经细胞,造血细胞,肝细胞,心肌细胞和胰岛细胞。在本文的一个实例中,可将拟胚体在特定培养体系中进一步分化为大脑类器官;在本文的一个实例中,可将拟胚体在特定培养体系中进一步分化为胰岛小体;在本文的一个实例中,可将拟胚体在特定培养体系中进一步分化为肿瘤球;可预期地,本发明制备的拟胚体还可在其他特定培养体系中进一步分化为造血细胞、肝细胞、心肌细胞等。
78.术语“生物水凝胶”是一类具有三维交联网络结构,并可以通过亲水性聚合物链构造,同时能被水溶胀却不溶于水的高聚物与介质共同组成的多元体系。它在水中吸收大量的水分,并能迅速溶胀,且溶胀之后也能够继续保持水凝胶原有结构而不被溶解,能够对环境的细微变化作出快速反应,同时其具有很优良的生物相容性,在性质上又类似于细胞外基质部分,因此比其他很多合成生物材料都要接近活体组织。在本文的一个实例中,使用甲基丙烯酸化水凝胶制备拟胚体。可预想地,本文中的生物水凝胶还可以是聚乙醇酸、聚乳酸、羟基烷酸酯、丁二酸丁二醇酯、聚己内酯、胶原蛋白、基质胶。
79.术语“类器官”是指具有3d三维结构的细胞团,是指通过人工培养过程制备的器官的微型化和简化版本,不是从动物采集或获得的。构成类器官的细胞的来源不受限制。类器官可以来源于组织、干细胞,例如胚胎干细胞或诱导性多能干细胞,并且可以从其自我更新和分化能力进行三维培养。类器官可能具有在细胞生长过程中允许与周围环境相互作用的环境。本文中,将制备得到的拟胚体在适宜培养基中进一步诱导分化,可成功分化成大脑类器官,其中有神经干细胞、成熟神经元和海马结构形成。
80.术语“水凝胶微载体”是指由水溶性高分子、多糖和蛋白质组分中的一种或多种水溶性合成高分子,经过化学交联或光交联得到的。水溶性合成高分子选自明胶、甲基丙烯酸酐化明胶、海藻酸钠、丝素、壳聚糖和胶原蛋白中的一种或几种混合。如专利公开cn109837235a中水凝胶微载体在细胞的黏附、扩增、冻存和消化中的应用,专利公开cn112048033b中水凝胶微载体及其制备方法和应用。本文中,按照制备拟胚体的方式也可
以制备水凝胶微载体,能够作为细胞培养载体,能够用于细胞的黏附、扩增、原位冻存和收获。
81.以下结合具体附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
82.实施例1拟胚体制备
83.本实施例的拟胚体大规模生产的方法,包括如下步骤:
84.步骤(1):制备分散相
85.取ipsc单细胞,加入dpbs缓冲液,配置成浓度为5万/ml-200万/ml的细胞悬液。
86.将上述细胞悬液与甲基丙烯酸化水凝胶进行混合,直至混合物中甲基丙烯酸化水凝胶的质量百分浓度为2%-5%。
87.其中,所述甲基丙烯酸化水凝胶由如下方法制备而成:
88.步骤(1.1):取10.0g明胶,使用磁力搅拌器,于60℃溶解在100ml的dpbs缓冲液中,得到溶液ⅰ;
89.步骤(1.2):在溶液ⅰ中,加入8.0ml甲基丙烯酸酐,使用磁力搅拌器,于50℃剧烈搅拌下反应3h,得到溶液ⅱ;
90.步骤(1.3):在溶液ⅱ中,加入五倍溶液ⅱ体积的40℃的dpbs缓冲液,得到溶液ⅲ;
91.步骤(1.4):使用snakeskin透析袋,将溶液ⅲ透析5d-10d,得到溶液ⅳ,即为甲基丙烯酸化水凝胶。
92.再加入2-羟基-4'-(2-羟基乙氧基)-2-甲基苯丙酮作为交联剂,得到分散相,分散相中甲基丙烯酸化水凝胶的质量百分浓度为1%。
93.步骤(2):制备油包水液滴
94.如图1所示,通过第一移液枪枪头将步骤(1)得到的分散相,注入到微流控装置的液相通道中;
95.以hfe-7500油作为油相,通过第二移液枪枪头,将油相注入到微流控装置的油相通道中;
96.在液相通道和油相通道的交汇处,形成大小均一、粒径为150μm-250μm的油包水液滴。
97.步骤(3):紫外光照射
98.将步骤(2)得到的油包水液滴,进行紫外光照射,紫外光照射的波长为365nm,功率为6.9mw/cm2,时间为10s-20s,即得到拟胚体。该拟胚体的形态图,如图2所示。
99.由图2可知,该拟胚体大小均一,直径为150μm-250μm。
100.实施例2分散相中不同细胞密度对拟胚体形成的影响
101.本实施例研究实施例1的步骤(1)中,分散相中ipsc单细胞的密度对拟胚体形成的影响。
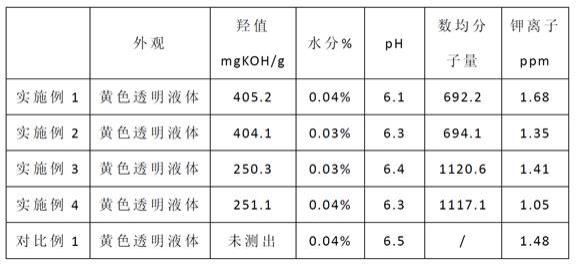
102.试剂、厂家和规格如表1所示:
103.表1
[0104][0105]
步骤(1):配制tryple工作液:吸取5ml dpbs缓冲液至新的15ml离心管中,再加入5ml tryple原液,混匀后即为tryple工作液。
[0106]
步骤(2):根据传代所需的培养基量,配制含1%ps、10μm y-27632(rocki)和4mg/ml pva的e8完全培养基,每毫升培养基加1μl y-27632(10mm)储存液。
[0107]
步骤(3):从培养箱取出汇合度达到70%-80%的ipsc细胞,吸弃上清,用dpbs缓冲液洗两遍。
[0108]
步骤(4):加tryple工作液后,置于培养箱孵育2min-5min,期间可镜下观察,细胞收缩变圆且分散开即可。
[0109]
步骤(5):轻轻拍打培养瓶/板,使细胞脱离板底,然后用移液器轻轻吹打几次,最后加入dmem/f12终止消化。吸取适量的细胞悬液计数。
[0110]
步骤(6):配平后离心,200g,5min,离心结束后吸弃上清,轻震离心管底部,按照500cells/20μl、1500cells/20μl、3000cells/20μl、5000cells/20μl和8000cells/20μl的细胞密度,加入5ml含10μm y-27632和4mg/ml pva的e8完全培养基重悬。细胞充分混匀后,20μl细胞悬液滴至培养皿盖内侧,培养皿中加入5ml dpbs缓冲液,将盖子反转盖上之后,置于37℃,5%co2培养箱中静置培养。
[0111]
步骤(7):培养24h后,细胞每天换液,培养十天,每天记录拟胚体直径。
[0112]
由图3可知,拟胚体的直径为150μm-250μm,合适的细胞数量在500-3000细胞/拟胚体,对应细胞浓度为5
×
104/ml-2
×
106/ml。
[0113]
实验例3拟胚体进一步分化为大脑类器官
[0114]
将实施例1得到的拟胚体用于生产类器官。
[0115]
试剂、厂家和规格如表2所示:
[0116]
表2
[0117][0118]
培养基配制
[0119]
(1)low-bfgf hesc medium培养基:
[0120]
low-bfgf hesc medium 500ml,由dmem-f12389 ml、kosr 100ml、glutamax 5ml、mem-neaa 5ml和2-mercaptoethanol 1ml组成,0.2μm过滤,bfgf 4ng/ml现配现加。
[0121]
(2)neural induction medium培养基:
[0122]
dmem-f12中添加n2 supplement 1%、glutamax supplement 1%、mem-neaa1%和heparin 1μg/ml,0.2μm过滤后。
[0123]
(3)cerebral organoid differentiation medium培养基:
[0124]
cerebral organoid differentiation medium 250ml,由dmem-f12115ml、neurobasal medium 125ml、n2 supplement 1.25ml、insul in 62.5ul、glutamax supplement 2.5ml、mem-neaa 1.25ml、penicillin-streptomycin 2.5ml、2-mercaptoethanol 227.5μl、b27 supplement 2.5ml或者b27supplement without vitamin a 2.5ml组成,0.2μm过滤。
[0125]
第1天:实施例1得到的拟胚体体积大约在200μm,每个拟胚体中含有3000个细胞。
拟胚体培养在low-bfgf hesc medium培养基中。
[0126]
第2天:使用low-bfgf hesc medium培养基全换液,加入10μm的y-27632dihydrochloride。
[0127]
第4天:使用low-bfgf hesc medium培养基半换液,加入10μm的y-27632dihydrochloride。
[0128]
第6天:当eb直径达到500μm,边缘透明发亮后,细胞全换液,使用神经诱导培养基。
[0129]
第8天:使用神经诱导培养基半换液。
[0130]
第10天:细胞全换液,使用cerebal organoid differentiation medium without vitamin a。
[0131]
第12天:吸去培养基,细胞全换液,使用cerebal organoid differentiation medium without vitamin a培养基。
[0132]
第14天:吸去培养基,细胞全换液,使用cerebal organoid differentiation medium without vitamin a培养基。
[0133]
第16天:加入80ml cerebal organoid differentiation medium with vitamin a培养基到生物反应器内。用1ml枪头(剪头)转移30个类器官至一个125ml的旋转生物反应器。放入培养箱内培养。每周全换液一次,培养30-35天。
[0134]
第35天:免疫荧光检测大脑类器官标志蛋白免疫荧光检测大脑类器官标志蛋白,如图4所示。
[0135]
dapi为细胞核染料,tuj1是一种被认为参与神经元细胞类型特异性分化的微管蛋白。微管蛋白是微管的主要结构,是细胞骨架的组成成分,在细胞结构的维护,有丝分裂,减数分裂,细胞内的运输等等方面发挥作用。tuj1存在于未成熟的神经元胞体,树突,轴突和轴突末端。tuj1的表达(绿色)说明在分化的大脑类器官中有神经干细胞的表达。
[0136]
dapi为细胞核染料,sox2不仅仅在es细胞表达,也在早期胚胎神经细胞中限制性表达,随后发挥抑制神经干细胞分化的作用。sox2的表达(红色)说明在分化的大脑类器官中有神经干细胞的表达。
[0137]
dapi为细胞核染料,转录调节因子foxg1在皮质神经发生过程中,持续在有丝分裂后神经元中表达,直至成年,在有丝分裂后神经元亚型特化过程中发挥重要作用。foxg1的表达(红色)说明在分化的大脑类器官中有成熟神经元的表达。
[0138]
dapi为细胞核染料,wnt受体之一frizzled9(fzd9)特异性地表达在小鼠端脑皮质以及由此发育而来的海马结构中。fzd9的表达(红色)说明在分化的大脑类器官中有海马结构的形成。
[0139]
综上,本发明制备得到的拟胚体可成功分化为大脑类器官,在分化的大脑类器官中有神经干细胞和成熟神经元的表达以及海马结构的形成。
[0140]
实验例4拟胚体进一步分化为胰岛小体
[0141]
将实施例1得到的拟胚体用于胰岛分化。
[0142]
试剂、厂家和规格如表3所示:
[0143]
表3
[0144][0145]
试剂配制方法,如表4所示。
[0146]
表4
[0147][0148]
配制胰岛小体分化各个阶段的基础培养基,如表5所示。
[0149]
表5
[0150][0151]
步骤(1):定向内胚层的诱导(第1天-第3天)。
[0152]
第1天:实施例1得到的拟胚体,每个拟胚体中含有3000个细胞,使得拟胚体体积大约在200um,dpbs缓冲液清洗一遍,更换悬浮培养基:islet-s1 100ng/ml activina 3μm chir99021 1:50its 0.25mm vitamin c;孵育24h;
[0153]
第2天:更换悬浮培养基:islet-s1 100ng/ml activina 1:50its 0.25mm vitamin c;
[0154]
第3天:重复第2天。
[0155]
步骤(2):原肠管阶段的诱导(第4天-第6天)
[0156]
第4天-第6天:更换悬浮培养基:islet-s2 50ng/ml fgf-7 its-x 1:50.000 0.25mm vitamin c。
[0157]
步骤(3):胰腺祖细胞诱导1阶段(第7天-第8天)
[0158]
第7天:更换悬浮培养基:islet-s3 50ng/ml fgf-7 0.25μm sant1 2μm ra 200nm ldn193189 500nm pdbu 0.25mm vitamin c its-x 1:200。
[0159]
第8天:更换悬浮培养基:islet-s3 50ng/ml fgf-7 0.25μm sant1 2μm ra 500nm pdbu 0.25mm vitamin c its-x 1:200。
[0160]
步骤(4):胰腺祖细胞诱导2阶段(第9天-第13天)
[0161]
第9天-第13天:更换悬浮培养基:islet-s3 50ng/ml fgf-7 0.25μm sant1 100nm ra its-x 1:200 0.25mm vitamin c。
[0162]
步骤(5):未成熟β细胞阶段的诱导(第14天-第20天)
[0163]
第14天-第17天:islet-s3 0.25μm sant1 100nm ra 1μm xxi 10μm alk5i ii 1μm t3 20ng/ml betacellulin its-x 1:200 0.25mm vitaminc heparin 10ug/ml。
[0164]
第18天-第20天:更换悬浮培养基:islet-s3 25nm ra 1μm xxi 10μm alk5i ii 1μm t3 20ng/ml betacellulin 0.25mm vitamin c。
[0165]
步骤(6):成熟β细胞阶段的诱导(第21天-第34天)
[0166]
第21天-第35天:更换悬浮培养基:islet-s4 1000x al 1000x t3-2,每2天换次液。
[0167]
步骤(7):免疫荧光检测胰岛小体标志蛋白基因表达
[0168]
如图5所示。
[0169]
dapi为细胞核染料,胰高血糖素(gcg)是胰岛α细胞特异性表达基因,gcg的表达(绿色)说明胰岛小体中有α细胞。
[0170]
dapi为细胞核染料,胰岛素(ins)是胰岛β细胞特异性表达基因,gcg的表达(红色)说明胰岛小体中有β细胞。
[0171]
综上,本发明制备得到的拟胚体可成功分化为具有胰岛α细胞和胰岛β细胞的胰岛小体。
[0172]
实验例5拟胚体进一步分化为肿瘤球
[0173]
将实施例1得到的拟胚体用于生产肿瘤球。
[0174]
试剂、厂家和规格如表6所示:
[0175]
表6
[0176]
名称厂家货号lncap细胞procellcl-0143dpbsgibco14190144胰酶thermofisherscientificr001100p/sthermofisherscientific15140122fbshyclonef8318
[0177]
步骤(1):细胞准备:培养gfp标记的lncap细胞,培养基为rpmi-1640 10%fbs 1%p/s,当细胞汇合度达到80%-90%时,弃去培养基,用适量dpbs缓冲液润洗培养皿底部,弃去dpbs缓冲液。
[0178]
步骤(2):加入5ml 0.25%胰酶,37℃静置消化之后加入5ml完全培养基终止消化,用移液枪吸取混合液,轻轻吹打培养皿底,以便收集到更多的细胞团块。
[0179]
步骤(3):将收集到的混合液于1000r/min下离心5min,弃去上清液,用完全培养基稀释至每毫升100万个细胞。
[0180]
步骤(4):按照上述形成eb的方法操作,形成肿瘤球。
[0181]
步骤(5):将肿瘤球转移至rpmi-1640 10%fbs 1%p/s培养基,培养24小时,荧光显微镜下拍照记录。如图6所示。
[0182]
图中可以看细胞聚集成微球,微球表面光滑,呈现悬浮生长状态,说明本发明制备得到的拟胚体可成功分化形成肿瘤球。
[0183]
实验例6微载体制备
[0184]
步骤(1):制备分散相
[0185]
配置生物水凝胶的质量百分浓度为2%-5%;
[0186]
再加入交联剂,得到分散相,分散相中生物水凝胶的质量百分浓度为1%;
[0187]
步骤(2):制备油包水液滴
[0188]
通过第一移液枪枪头将步骤(1)得到的分散相注入到微流控装置的液相通道中;
[0189]
通过第二移液枪枪头将油相注入到微流控装置的油相通道中;
[0190]
在液相通道和油相通道的交汇处,形成大小均一的油包水液滴;
[0191]
步骤(3):紫外光照射
[0192]
将步骤(2)得到的油包水液滴,进行紫外光照射,即得到水凝胶微载体。
[0193]
试剂、厂家和规格如表7所示:
[0194]
表7
[0195]
名称厂家货号matrigel康宁354277碱性磷酸酶试剂盒碧云天p0321m
[0196]
使用dpbs缓冲液将ipsc单细胞配置为500-1000万/ml浓度,与将实施例1得到的水凝胶微载体按数量比为100:1混合,并置于低亲附培养皿中培养;
[0197]
连续培养6天,使用碱性磷酸酶试剂盒染色。如图7所示。
[0198]
第二天:可以看见细胞团块附着在水凝胶微载体;
[0199]
第六天:可以看见细胞在水凝胶微载体表面生长,覆盖了整个水凝胶微载体表面;碱性磷酸酶染色(ap)为蓝色,说明水凝胶微载体表面生长的细胞具有碱性磷酸酶活性,提示,ipsc可以在水凝胶微载体表面生长。
[0200]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。