利用crispr/cas系统的基因组编辑的治疗性用途
1.本技术是国际申请日2014年4月4日、国际申请号 pct/us2014/033082于2015年12月3日进入中国国家阶段、申请号 201480031807.x、发明名称“利用crispr/cas系统的基因组编辑的治疗性用途”的申请的分案申请。
2.相关申请
3.本技术要求2013年4月4日提交的美国临时申请序列号 61/808,594的权益,其教义以引用的方式整体并入本文。
4.政府支持
5.本发明是根据由国立卫生研究院(national institutes of health)授予的r01-hl118744、r00-hl098364和r01-dk095384在政府支持下完成的。政府对本发明拥有某些权利。
6.发明背景
7.成簇规律间隔的短回文重复序列(crispr)/crispr相关的(cas)系统是靶向哺乳动物细胞中的所需基因组位点的一类新型基因组编辑工具。最近公开的ii型crispr/cas系统使用cas9核酸酶,所述cas9 核酸酶通过与杂交至20个核苷酸dna序列的合成引导rna复合并且紧接由cas9识别的ngg基序之前而被靶向基因组位点(因此, (n)
20
ngg靶dna序列)。这在所述ngg基序的上游三个核苷酸处产生双链断裂。所述双链断裂引发非同源末端连接,非同源末端连接是易错的且有助于敲除基因等位基因的移码突变;或同源介导修复,其可与外源引入的双链或单链dna修复模板的使用一起用于敲入或修正基因组中的突变。因此,crispr/cas系统可以是用于治疗性应用的有用工具,但遗憾的是先前公开的报道展示在人干细胞中仅2%-4%的等位基因靶向效率(mali等,science 339:823-826(2013))。
8.发明概述
9.本文所述的研究展示了使用crispr/cas系统的等位基因靶向方法以高达80%的效率产生突变细胞。具体地说,本文所述的工作出人意料地且意外地证明一种多重引导策略(例如,使用两种或更多种核糖核酸,所述核糖核酸将cas蛋白引导至靶多核苷酸序列并且与所述靶多核苷酸序列杂交)可高效且有效地缺失原代体细胞(例如,人血液细胞,例如cd34 细胞和t细胞)中的靶多核苷酸序列(例如,b2m、hprt、 ccr5和/或cxcr4),相比之下单一引导策略已由本发明人证明为可高效地缺失细胞系(例如293t)中的靶多核苷酸序列,但未能高效地缺失原代体细胞中的靶多核苷酸序列。这些极大改进的方法允许 crispr/cas系统首次有效地用于治疗性目的。提供将crispr/cas系统递送至人干细胞的方法。此外,提供特异性地鉴定有用的rna引导序列的方法,连同适用于靶向特异性基因(例如,b2m、hprt、ccr5 和/或cxcr4)的特定引导序列。此外,提供利用本文公开的组合物和方法的治疗方法(例如,治疗hiv感染的方法)。
10.在一些方面,本发明提供一种改变细胞中的靶多核苷酸序列的方法,所述方法包括使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和一至两种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效
率是约50%至约80%。
11.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和一至两种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
12.在一些方面,本发明提供一种同时改变细胞中的多个靶多核苷酸序列的方法,所述方法包括使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约80%。
13.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将cas 蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
14.在一些实施方案中,所述cas蛋白是酿脓链球菌(streptococcuspyogenes)cas9蛋白或其功能部分。在一些实施方案中,所述功能部分包含选自由以下组成的组的可操作连接的cas9蛋白功能性结构域的组合:dna结合结构域、至少一个rna结合结构域、解旋酶结构域以及核酸内切酶结构域。在一些实施方案中,所述功能性结构域形成复合体。
15.在一些实施方案中,所述cas蛋白是来自任何细菌物种的cas9蛋白或其功能部分。在一些实施方案中,所述功能部分包含选自由以下组成的组的可操作连接的cas9蛋白功能性结构域的组合:dna结合结构域、至少一个rna结合结构域、解旋酶结构域以及核酸内切酶结构域。在一些实施方案中,所述功能性结构域形成复合体。
16.在一些实施方案中,所述cas蛋白与一至两种核糖核酸复合。在一些实施方案中,所述cas蛋白与多种核糖核酸复合。
17.在一些实施方案中,所述靶基序是20个核苷酸的dna序列。在一些实施方案中,每个靶基序是20个核苷酸的dna序列。在一些实施方案中,所述靶基序是以g开始的20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,每个靶基序是以g开始的20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,所述靶基序是20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,每个靶基序是20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,所述靶基序是 g(n)
19
ngg。在一些实施方案中,每个靶基序是g(n)
19
ngg。在一些实施方案中,所述靶基序是(n)
20
ngg。在一些实施方案中,每个靶基序是(n)
20
ngg。
18.在一些实施方案中,所述靶多核苷酸序列被裂解以使得产生双链断裂。在一些实施方案中,每个靶多核苷酸序列被裂解以使得产生双链断裂。在一些实施方案中,所述靶多核苷酸序列被裂解以使得产生单链断裂。在一些实施方案中,每个靶多核苷酸序列被裂解以使得产生单链断裂。
19.在一些实施方案中,所述改变是插入缺失(indel)。在一些实施方案中,所述改变导致所述靶多核苷酸序列的表达降低。在一些实施方案中,所述改变导致所述靶多核苷酸序列的表达降低。在一些实施方案中,所述改变导致所述靶多核苷酸序列的敲除。
20.在一些实施方案中,所述改变导致所述靶多核苷酸序列的敲除。在一些实施方案中,所述改变使得所述靶多核苷酸序列从不想要的序列修正为所需序列。在一些实施方案中,所述改变使得所述靶多核苷酸序列从不想要的序列修正为所需序列。在一些实施方案中,所述改变是纯合改变。在一些实施方案中,每个改变是纯合改变。
21.在一些实施方案中,在所述靶多核苷酸序列的裂解之后,发生同源介导修复。在一些实施方案中,使用外源引入的dna修复模板进行同源介导修复。在一些实施方案中,所述外源引入的dna修复模板是单链的。在一些实施方案中,所述外源引入的dna修复模板是双链的。
22.在一些实施方案中,在所述靶多核苷酸序列的裂解之后,发生同源介导修复。在一些实施方案中,使用外源引入的dna修复模板进行同源介导修复。在一些实施方案中,所述外源引入的dna修复模板是单链的。在一些实施方案中,所述外源引入的dna修复模板是双链的。
23.在一些实施方案中,所述细胞是外周血细胞。在一些实施方案中,所述细胞是干细胞或多能细胞。在一些实施方案中,所述细胞是造血干细胞。在一些实施方案中,所述细胞是cd34
细胞。在一些实施方案中,所述细胞是cd34
流动的外周血细胞。在一些实施方案中,所述细胞是cd34
脐带血细胞。在一些实施方案中,所述细胞是cd34
骨髓细胞。在一些实施方案中,所述细胞是cd34
cd38-谱系
ꢀ‑
cd90
cd45ra-细胞。在一些实施方案中,所述细胞是肝细胞。
24.在一些实施方案中,所述靶多核苷酸序列是ccr5。在一些实施方案中,所述一至两种核糖核酸中的至少一种包含选自由图1的核糖核酸序列组成的组的序列。在一些实施方案中,所述一至两种核糖核酸中的至少一种包含与选自由图1的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。
25.在一些实施方案中,所述靶多核苷酸序列是cxcr4。在一些实施方案中,所述一至两种核糖核酸中的至少一种包含选自由图2的核糖核酸序列组成的组的序列。在一些实施方案中,所述一至两种核糖核酸中的至少一种包含与选自由图2的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。
26.在一些实施方案中,所述靶多核苷酸序列包含ccr5的多个不同部分。在一些实施方案中,所述多种核糖核酸中的每种包含选自由图1 的核糖核酸序列组成的组的不同序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由图1的核糖核酸序列组成的组的不同序列具有单个核苷酸错配的序列。
27.在一些实施方案中,所述靶多核苷酸序列包含cxcr4的多个不同部分。在一些实施方案中,所述多种核糖核酸中的每种包含选自由图2 的核糖核酸序列组成的组的不同序
列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由图2的核糖核酸序列组成的组的不同序列具有单个核苷酸错配的序列。
28.在一些实施方案中,所述靶多核苷酸序列包含ccr5的至少一部分和cxcr4的至少一部分。在一些实施方案中,所述多种核糖核酸中的每种包含选自由图1的核糖核酸序列和图2的核糖核酸序列组成的组的不同序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由图1的核糖核酸序列和图2的核糖核酸序列组成的组的不同序列具有单个核苷酸错配的序列。
29.在一些实施方案中,所述病症是遗传性病症。在一些实施方案中,所述病症是单基因病症。在一些实施方案中,所述病症是人免疫缺陷病毒(hiv)感染。在一些实施方案中,所述病症是获得性免疫缺陷综合征(aids)。
30.在一些实施方案中,所述一至两种核糖核酸被设计成与紧邻由cas 蛋白识别的脱氧核糖核酸基序的靶基序杂交。在一些实施方案中,所述一至两种核糖核酸中的每种被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交,所述靶基序位于定位在所述靶基序之间的突变等位基因侧翼。在一些实施方案中,所述多种核糖核酸被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交。在一些实施方案中,所述多种核糖核酸被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交,所述靶基序位于定位在所述靶基序之间的突变等位基因侧翼。在一些实施方案中,选择所述一至两种核糖核酸以使得与除所述靶多核苷酸序列之外的核酸序列的杂交最小化。在一些实施方案中,选择所述多种核糖核酸以使得与除所述靶多核苷酸序列之外的核酸序列的杂交最小化。
31.在一些实施方案中,选择所述靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少两个错配。在一些实施方案中,选择每个靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少两个错配。在一些实施方案中,选择所述靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少一个错配。
32.在一些实施方案中,选择所述靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少一个错配。在一些实施方案中,所述一至两种核糖核酸与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少两个错配。
33.在一些实施方案中,所述多种核糖核酸中的每种与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少两个错配。在一些实施方案中,所述一至两种核糖核酸与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少一个错配。在一些实施方案中,所述多种核糖核酸中的每种与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少一个错配。
34.在一些实施方案中,在每个基因座处改变效率是约50%至约80%。在一些实施方案中,所述改变效率是至少约5%。在一些实施方案中,所述改变效率是至少约10%。在一些实施方案中,所述改变效率是约 50%至约80%。
35.在一些实施方案中,所述cas蛋白由修饰的核酸编码。在一些实施方案中,所述修饰的核酸包含核糖核酸,所述核糖核酸含有至少一个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、2-硫代
ꢀ‑
尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、5,6-二氢尿苷-5
’‑ꢀ
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸。在一些实施方案中,所述核糖核酸
中的至少一种是修饰的核糖核酸,所述修饰的核糖核酸包含一至两个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、2-硫代
‑ꢀ
尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、5,6-二氢尿苷-5
’‑ꢀ
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸。
36.在一些实施方案中,从质粒表达所述cas蛋白或所述核糖核酸中的任一种。
37.在一些实施方案中,使用经优化以用于在干细胞中增加表达的启动子表达所述cas蛋白或所述核糖核酸中的任一种。在一些实施方案中,所述启动子选自由以下组成的组:巨细胞病毒(cmv)早期增强子元件和鸡β-肌动蛋白启动子、鸡β-肌动蛋白启动子、延伸因子-1α启动子以及泛素启动子。
38.在一些实施方案中,所述方法还包括选择表达cas蛋白的细胞。在一些实施方案中,选择细胞包括facs。在一些实施方案中,facs 用于选择共表达cas和荧光蛋白的细胞,所述荧光蛋白选自由绿色荧光蛋白和红色荧光蛋白组成的组。
39.在一些方面,本发明提供一种改变细胞中的靶多核苷酸序列的方法,所述方法包括使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和一至两种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约8%至约80%。
40.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和一至两种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中所述改变效率是约 8%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
41.在一些方面,本发明提供一种同时改变细胞中的多个靶多核苷酸序列的方法,所述方法包括使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约8%至约80%。
42.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将 cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约8%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
43.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有选自由图1的核糖核酸序列组成的组的序列。
44.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸包含与选自由图1的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。
45.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有选自由图2的核糖核酸序列组成的组的序列。
46.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸包含与选自由图2的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。
47.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有选自由以下组成的组的序列:图1的核糖核酸序列、图2的核糖核酸序列、与图1的核糖核酸序列具有单个核苷酸错配的序列以及与图2的核糖核酸序列具有单个核苷酸错配的序列。
48.在一些实施方案中,所述组合物还包含编码cas蛋白的核酸序列。在一些实施方案中,所述组合物还包含编码cas9蛋白或其功能部分的核酸序列。在一些实施方案中,所述核酸包含修饰的核糖核酸,所述核糖核酸包含至少一个选自由以下组成的组的修饰的核苷酸:假尿苷、 5-甲基胞苷、2-硫代-尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、5,6-二氢尿苷-5
’‑
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸。
49.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一种另外核糖核酸,所述至少一种另外核糖核酸具有选自由图1的核糖核酸序列组成的组的序列。
50.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一种另外核糖核酸,所述至少一种另外核糖核酸具有选自由图2的核糖核酸序列组成的组的序列。
51.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一个另外核糖核酸序列,所述至少一个另外核糖核酸序列包含与选自由图1的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。
52.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一个另外核糖核酸序列,所述至少一个另外核糖核酸序列包含与选自由图2的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。
53.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一种另外核糖核酸,所述至少一种另外核糖核酸具有选自由以下组成的组的序列:图1的核糖核酸序列、图2的核糖核酸序列、与图1的核糖核酸序列具有单个核苷酸错配的序列以及与图2的核糖核酸序列具有单个核苷酸错配的序列。
54.在一些实施方案中,所述组合物还包含编码荧光蛋白的核酸序列,所述荧光蛋白选自由绿色荧光蛋白和红色荧光蛋白组成的组。
55.在一些实施方案中,所述组合物还包含可操作地连接至所述嵌合核酸的启动子。在一些实施方案中,所述启动子被优化以用于在人干细胞中增加表达。在一些实施方案中,所述启动子选自由以下组成的组:巨细胞病毒(cmv)早期增强子元件和鸡β-肌动蛋白启动子、鸡β
‑ꢀ
肌动蛋白启动子、延伸因子-1α启动子以及泛素启动子。
56.在一些实施方案中,所述cas蛋白包含cas9蛋白或其功能部分。
57.在一些方面,本发明提供一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂
盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及选自由以下组成的组的至少一个核糖核酸序列:图1的核糖核酸序列、图2的核糖核酸序列、与图1的核糖核酸序列具有单个核苷酸错配的序列以及与图2的核糖核酸序列具有单个核苷酸错配的序列。在一些实施方案中,所述试剂盒还包括选自由以下组成的组的一种或多种细胞系、培养物或群体:人多能细胞、原代人细胞和非转化的细胞。在一些实施方案中,所述试剂盒还包括dna修复模板。
58.在一些实施方案中,所述细胞包含原代细胞。在一些实施方案中,所述细胞包含原代体细胞。在一些实施方案中,所述细胞包含自体原代体细胞。在一些实施方案中,所述细胞包含同种异体原代体细胞。在一些实施方案中,所述靶多核苷酸序列是b2m。在一些实施方案中,所述一至两种核糖核酸中的至少一种包含经优化以靶向b2m基因的序列。在一些实施方案中,所述一至两种核糖核酸中的至少一种包含与经优化以靶向b2m基因的序列具有单个核苷酸错配的序列。在一些实施方案中,所述靶多核苷酸序列包含b2m的多个不同部分。在一些实施方案中,所述多种核糖核酸中的每种包含经优化以靶向b2m基因的不同序列。在一些实施方案中,所述多种核糖核酸中的每种包含与经优化以靶向b2m基因的不同序列具有单个核苷酸错配的序列。在一些实施方案中,所述一至两种核糖核酸包含两个引导核糖核酸序列。
59.在一些实施方案中,所述一至两种核糖核酸包含两个引导核糖核酸序列。在一些实施方案中,所述靶多核苷酸序列包含ccr5。在一些实施方案中,所述细胞包含原代cd34 造血祖细胞。在一些实施方案中,所述两个引导核糖核酸序列包含与选自由seq id no:1-139组成的组的不同序列互补的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含与选自由seq id no:1-139 组成的组的偏移序列互补的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含与选自由seq id no: 1-139组成的组的ccr5中的偏移靶位点杂交且使cas蛋白靶向所述偏移靶位点的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含来自seq id no:298-303的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含选自由以下组成的组的一对引导核糖核酸:seq id no:299 和303、seq id no:298和300、seq id no:299和300、seq id no: 298和303、seq id no:299和301、seq id no:298和299、seq idno:301和303、seq id no:298和302、以及seq id no:298和301。在一些实施方案中,所述两个引导核糖核酸序列包含与选自由seq idno:304-333组成的组的不同序列互补的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含与选自由 seq id no:304-333组成的组的偏移序列互补的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含与选自由seq id no:304-333组成的组的ccr5中的偏移靶位点杂交且使cas蛋白靶向所述偏移靶位点的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述靶多核苷酸序列包含cxcr4。在一些实施方案中,所述细胞包含原代cd34 造血祖细胞。在一些实施方案中,所述两个引导核糖核酸序列包含与选自由seq id no:140-297组成的组的不同序列互补的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含与选自由seq id no:140-297 组成的组的偏移序列互补的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含与选自由seq id no: 140-297组成的组的cxcr4中的偏移靶位点杂交且使cas蛋白靶向所述偏移靶位点的两个引
导核糖核酸序列的任何组合。在一些实施方案中,所述靶多核苷酸序列包含b2m。在一些实施方案中,所述细胞包含原代细胞。在一些实施方案中,所述两个引导核糖核酸序列包含与 b2m基因中的不同序列互补的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含与b2m基因中的偏移序列互补的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含与b2m中的偏移靶位点杂交且使cas 蛋白靶向所述偏移靶位点的两个引导核糖核酸序列的任何组合。
60.在一些方面,本发明提供一种改变原代细胞中的靶多核苷酸序列的方法,所述方法包括使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和至少两种核糖核酸相接触,其中所述至少两种核糖核酸包含将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交的引导核糖核酸,其中所述靶多核苷酸序列被裂解。在一些实施方案中,表达cas蛋白的细胞的改变效率是约50%至约80%。
61.在一些方面,本发明提供一种改变原代细胞中的靶多核苷酸序列的方法,所述方法包括使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和至少两种核糖核酸相接触,其中所述至少两种核糖核酸包含将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交的引导核糖核酸,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约80%。
62.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和至少两种核糖核酸相接触来离体改变原代细胞中的靶多核苷酸序列,其中所述至少两种核糖核酸包含将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交的引导核糖核酸,其中所述靶多核苷酸序列被裂解;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。在一些实施方案中,表达cas蛋白的细胞的改变效率是约50%至约80%。
63.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和至少两种核糖核酸相接触来离体改变原代细胞中的靶多核苷酸序列,其中所述至少两种核糖核酸包含将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交的引导核糖核酸,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
64.在一些方面,本发明提供一种同时改变原代细胞中的多个靶多核苷酸序列的方法,所述方法包括使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触,其中所述核糖核酸包含将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交的引导核糖核酸,其中所述靶多核苷酸序列被裂解。在一些实施方案中,表达cas蛋白的细胞的改变效率是约50%至约 80%。
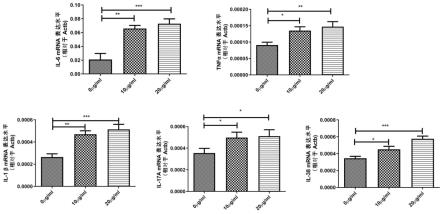
65.在一些方面,本发明提供一种同时改变原代细胞中的多个靶多核苷酸序列的方法,所述方法包括使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触,其中所述核糖核酸包含将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交的引导核糖核酸,其中所述靶多核苷酸序列被裂解,并且
其中表达cas蛋白的细胞的改变效率是约50%至约80%。
66.在一些方面,本公开提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触来离体改变原代细胞中的靶多核苷酸序列,其中所述核糖核酸包含将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交的引导核糖核酸,其中所述靶多核苷酸序列被裂解;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。在一些实施方案中,表达cas蛋白的细胞的改变效率是约50%至约80%。
67.在一些方面,本公开提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触来离体改变原代细胞中的靶多核苷酸序列,其中所述核糖核酸包含将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交的引导核糖核酸,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
68.在一些实施方案中,所述cas蛋白是酿脓链球菌cas9蛋白或其功能部分。在一些实施方案中,所述功能部分包含选自由以下组成的组的可操作连接的cas9蛋白功能性结构域的组合:dna结合结构域、至少一个rna结合结构域、解旋酶结构域以及核酸内切酶结构域。在一些实施方案中,所述功能性结构域形成复合体。在一些实施方案中,所述cas蛋白是来自任何细菌物种的cas9蛋白或其功能部分。在一些实施方案中,所述功能部分包含选自由以下组成的组的可操作连接的 cas9蛋白功能性结构域的组合:dna结合结构域、至少一个rna结合结构域、解旋酶结构域以及核酸内切酶结构域。在一些实施方案中,所述功能性结构域形成复合体。在一些实施方案中,所述cas蛋白与一至两种核糖核酸复合。在一些实施方案中,所述cas蛋白与多种核糖核酸复合。
69.在一些实施方案中,所述靶基序是20个核苷酸的dna序列。在一些实施方案中,每个靶基序是20个核苷酸的dna序列。在一些实施方案中,所述靶基序是以g开始的20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,每个靶基序是以g开始的20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,所述靶基序是20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,每个靶基序是20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,所述靶基序是 g(n)
19
ngg。在一些实施方案中,每个靶基序是g(n)
19
ngg。在一些实施方案中,所述靶基序是(n)
20
ngg。在一些实施方案中,每个靶基序是(n)
20
ngg。在一些实施方案中,所述靶基序包含选自由seq id no: 1-297或304-333组成的组的序列。在一些实施方案中,所述靶基序包含选自由seq id no:1-297或304-333组成的组的序列。在一些实施方案中,所述靶多核苷酸序列被裂解以使得产生双链断裂。在一些实施方案中,每个靶多核苷酸序列被裂解以使得产生双链断裂。在一些实施方案中,所述靶多核苷酸序列被裂解以使得产生单链断裂。在一些实施方案中,每个靶多核苷酸序列被裂解以使得产生单链断裂。在一些实施方案中,所述改变是插入缺失。在一些实施方案中,所述改变导致所述靶多核苷酸序列的表达降低。在一些实施方案中,所述改变导致所述靶
多核苷酸序列的表达降低。在一些实施方案中,所述改变导致所述靶多核苷酸序列的敲除。在一些实施方案中,所述改变导致所述靶多核苷酸序列的敲除。在一些实施方案中,所述改变使得所述靶多核苷酸序列从不想要的序列修正为所需序列。在一些实施方案中,所述改变使得所述靶多核苷酸序列从不想要的序列修正为所需序列。在一些实施方案中,所述改变是纯合改变。
70.在一些实施方案中,每个改变是纯合改变。在一些实施方案中,在所述靶多核苷酸序列的裂解之后,发生同源介导修复。在一些实施方案中,使用外源引入的dna修复模板进行同源介导修复。在一些实施方案中,所述外源引入的dna修复模板是单链的。在一些实施方案中,所述外源引入的dna修复模板是双链的。在一些实施方案中,在所述靶多核苷酸序列的裂解之后,发生同源介导修复。在一些实施方案中,使用外源引入的dna修复模板进行同源介导修复。在一些实施方案中,所述外源引入的dna修复模板是单链的。在一些实施方案中,所述外源引入的dna修复模板是双链的。在一些实施方案中,所述细胞是外周血细胞。在一些实施方案中,所述细胞是干细胞或多能细胞。在一些实施方案中,所述细胞是造血干细胞。在一些实施方案中,所述细胞是cd34
细胞。在一些实施方案中,所述细胞是cd34
流动的外周血细胞。在一些实施方案中,所述细胞是cd34
脐带血细胞。在一些实施方案中,所述细胞是cd34
骨髓细胞。在一些实施方案中,所述细胞是cd34
cd38-谱系-cd90
cd45ra-细胞。在一些实施方案中,所述细胞是肝细胞。在一些实施方案中,所述细胞是原代细胞。在一些实施方案中,所述靶多核苷酸序列是ccr5。
71.在一些实施方案中,所述两种核糖核酸包含选自由seq id no: 298-303组成的组的不同序列。在一些实施方案中,所述两个引导核糖核酸序列包含选自由以下组成的组的一对引导核糖核酸:seq id no: 299和303、seq id no:298和300、seq id no:299和300、seq idno:298和303、seq id no:299和301、seq id no:298和299、seqid no:301和303、seq id no:298和302、以及seq id no:298和 301。在一些实施方案中,所述两种核糖核酸包含与选自由seq id no: 1-139和304-333组成的组的不同序列互补和/或杂交的序列。在一些实施方案中,所述两种核糖核酸包含和与选自由seq id no:1-139和 304-333组成的组的序列具有单个核苷酸错配的不同序列互补和/或杂交的序列。在一些实施方案中,所述两种核糖核酸包含与选自由seq idno:1-139和304-333组成的组的偏移序列互补和/或杂交的序列。在一些实施方案中,所述两种核糖核酸包含和与选自由seq id no:1-139 和304-333组成的组的序列具有单个核苷酸错配的偏移序列互补和/或杂交的序列。在一些实施方案中,所述靶多核苷酸序列是cxcr4。在一些实施方案中,所述两种核糖核酸包含与选自由seq id no:140-297 组成的组的不同序列互补和/或杂交的序列。在一些实施方案中,所述两种核糖核酸包含和与选自由seq id no:140-297组成的组的序列具有单个核苷酸错配的不同序列互补和/或杂交的序列。在一些实施方案中,所述两种核糖核酸包含与选自由seq id no:140-297组成的组的偏移序列互补和/或杂交的序列。在一些实施方案中,所述两种核糖核酸包含和与选自由seq id no:140-297组成的组的序列具有单个核苷酸错配的偏移序列互补和/或杂交的序列。在一些实施方案中,所述靶多核苷酸序列包含ccr5的多个不同部分。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由seq id no:1-139和304-333组成的组的不同序列互补和/或杂交的序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由seq id no:1-139和304-333组成的组的偏移序列互补和/或杂
交的序列。在一些实施方案中,所述多种核糖核酸中的每种包含和与选自由seq id no:1-139和304-333组成的组的不同序列具有单个核苷酸错配的序列互补和/或杂交的序列。在一些实施方案中,所述多种核糖核酸中的每种包含和与选自由seq idno:1-139和304-333组成的组的偏移序列具有单个核苷酸错配的序列互补和/或杂交的序列。
72.在一些实施方案中,所述靶多核苷酸序列包含cxcr4的多个不同部分。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由 seq id no:140-297和304-333组成的组的不同序列互补和/或杂交的序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由 seq id no:140-297和304-333组成的组的偏移序列互补和/或杂交的序列。在一些实施方案中,所述多种核糖核酸中的每种包含和与选自由seq id no:140-297和304-333组成的组的不同序列具有单个核苷酸错配的序列互补和/或杂交的序列。在一些实施方案中,所述多种核糖核酸中的每种包含和与选自由seq id no:140-297和304-333组成的组的偏移序列具有单个核苷酸错配的序列互补和/或杂交的序列。
73.在一些实施方案中,所述靶多核苷酸序列包含ccr5的至少一部分和cxcr4的至少一部分。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由seq id no:1-297和304-333组成的组的不同序列互补和/或杂交的序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由seq id no:1-297和304-333组成的组的偏移序列互补和/或杂交的序列。在一些实施方案中,所述多种核糖核酸中的每种包含和与选自由seq id no:1-297和304-333组成的组的不同序列具有单个核苷酸错配的序列互补和/或杂交的序列。在一些实施方案中,所述多种核糖核酸中的每种包含和与选自由seq id no:1-297和 304-333组成的组的偏移序列具有单个核苷酸错配的序列互补和/或杂交的序列。在一些实施方案中,所述多种核糖核酸包含与选自由seq idno:1-139和304-333组成的组的偏移序列互补和/或杂交的至少两个核糖核酸序列,以及与选自由seq id no:140-297组成的组的偏移序列互补和/或杂交的至少两个核糖核酸序列。在一些实施方案中,所述多种核糖核酸包含和与选自由seq id no:1-139和304-333组成的组的偏移序列具有单个核苷酸错配的不同序列互补和/或杂交的至少两个核糖核酸序列,以及和与选自由seq id no:140-297组成的组的偏移序列具有单个核苷酸错配的不同序列互补和/或杂交的至少两个核糖核酸序列。
74.在一些实施方案中,所述病症是遗传性病症。在一些实施方案中,所述病症是单基因病症。在一些实施方案中,所述病症是人免疫缺陷病毒(hiv)感染。在一些实施方案中,所述病症是获得性免疫缺陷综合征(aids)。在一些实施方案中,所述两种核糖核酸被设计成与紧邻由 cas蛋白识别的脱氧核糖核酸基序的靶基序杂交。在一些实施方案中,所述两种核糖核酸中的每种被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交,所述靶基序位于定位在所述靶基序之间的突变等位基因侧翼。在一些实施方案中,所述多种核糖核酸被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交。在一些实施方案中,所述多种核糖核酸被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交,所述靶基序位于定位在所述靶基序之间的突变等位基因侧翼。在一些实施方案中,选择所述两种核糖核酸以使得与除所述靶多核苷酸序列之外的核酸序列的杂交最小化。在一些实施方案中,选择所述多种核糖核酸以使得与除所述靶多核苷酸序列之外的核酸序列的杂交最小化。在一些实施方案中,选择所述靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少两个错配。在一些实施方案中,选择每个靶基序以使得当与
细胞中的所有其他基因组核苷酸序列相比较时它含有至少两个错配。在一些实施方案中,选择所述靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少一个错配。在一些实施方案中,选择所述靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少一个错配。在一些实施方案中,所述两种核糖核酸与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少两个错配。在一些实施方案中,所述多种核糖核酸中的每种与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少两个错配。
75.在一些实施方案中,所述两种核糖核酸与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少一个错配。在一些实施方案中,所述多种核糖核酸中的每种与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少一个错配。在一些实施方案中,在每个基因座处改变效率是约50%至约80%。
76.在一些实施方案中,所述cas蛋白由修饰的核酸编码。在一些实施方案中,所述修饰的核酸包含核糖核酸,所述核糖核酸含有至少一个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、2-硫代
ꢀ‑
尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、5,6-二氢尿苷-5
’‑ꢀ
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸。在一些实施方案中,所述两种核糖核酸中的至少一种是修饰的核糖核酸,所述修饰的核糖核酸包含一至两个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、2
‑ꢀ
硫代-尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、5,6-二氢尿苷-5
’‑
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸。在一些实施方案中,所述两种核糖核酸包含修饰的核糖核酸,所述修饰的核糖核酸包含一至两个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、2-硫代
‑ꢀ
尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、5,6-二氢尿苷-5
’‑ꢀ
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸。
77.在一些实施方案中,从质粒表达所述cas蛋白或所述核糖核酸中的任一种。在一些实施方案中,使用经优化以用于在干细胞中增加表达的启动子表达所述cas蛋白或所述核糖核酸中的任一种。在一些实施方案中,所述启动子选自由以下组成的组:巨细胞病毒(cmv)早期增强子元件和鸡β-肌动蛋白启动子、鸡β-肌动蛋白启动子、延伸因子-1α启动子以及泛素启动子。在一些实施方案中,所述方法包括选择表达 cas蛋白的细胞。在一些实施方案中,选择细胞包括facs。在一些实施方案中,facs用于选择共表达cas和荧光蛋白的细胞。
78.在一些方面,本发明提供一种改变细胞中的靶多核苷酸序列的方法,所述方法包括使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和两种核糖核酸相接触,其中所述核糖核酸将 cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解。在一些实施方案中,表达cas蛋白的细胞的改变效率是约8%至约80%。
79.在一些方面,本发明提供一种改变细胞中的靶多核苷酸序列的方法,所述方法包括使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和两种核糖核酸相接触,其中所述核糖核酸将 cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约8%至约80%。
80.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和两种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将 cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。在一些实施方案中,所述改变效率是约8%至约80%。
81.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和两种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将 cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中所述改变效率是约8%至约 80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
82.在一些方面,本发明提供一种同时改变细胞中的多个靶多核苷酸序列的方法,所述方法包括使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解。在一些实施方案中,表达cas蛋白的细胞的改变效率是约8%至约80%。
83.在一些方面,本发明提供一种同时改变细胞中的多个靶多核苷酸序列的方法,所述方法包括使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约8%至约80%。
84.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将 cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。在一些实施方案中,表达cas蛋白的细胞的改变效率是约8%至约80%。
85.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约8%至约80%;以及(b)将所述细胞引
入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
86.在一些方面,本公开提供一种包含至少两种核糖核酸的组合物,所述核糖核酸各自包含选自由seq id no:298-303组成的组的不同序列。
87.在一些方面,本公开提供一种包含至少两种核糖核酸的组合物,所述核糖核酸各自包含与选自由seq id no:1-139和304-333组成的组的不同序列互补和/或杂交的序列。
88.在一些方面,本公开提供一种包含至少两种核糖核酸的组合物,所述核糖核酸各自包含和与选自由seq id no:1-139和304-333组成的组的序列具有单个核苷酸错配的序列互补和/或杂交的序列。
89.在一些方面,本公开提供一种包含至少两种核糖核酸的组合物,所述核糖核酸各自包含与选自由seq id no:140-297组成的组的不同序列互补和/或杂交的序列。
90.在一些方面,本公开提供一种包含至少两种核糖核酸的组合物,所述核糖核酸各自包含和与选自由seq id no:140-297组成的组的序列具有单个核苷酸错配的序列互补和/或杂交的序列。
91.在一些实施方案中,所述两种核糖核酸中的至少一种是修饰的核糖核酸,所述修饰的核糖核酸包含一至两个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、2-硫代-尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、5,6-二氢尿苷-5
’‑
三磷酸以及5-氮杂尿苷-5
’‑ꢀ
三磷酸。
92.在一些实施方案中,所述两种核糖核酸包含修饰的核糖核酸,所述修饰的核糖核酸包含一至两个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、2-硫代-尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、5,6-二氢尿苷-5
’‑
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸。在一些实施方案中,所述组合物包含编码cas蛋白的核酸序列。在一些实施方案中,所述组合物包含编码cas9蛋白或其功能部分的核酸序列。在一些实施方案中,所述核酸包含修饰的核糖核酸,所述核糖核酸包含至少一个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、2-硫代-尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、5,6
‑ꢀ
二氢尿苷-5
’‑
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸。
93.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少两种另外核糖核酸,所述至少两种另外核糖核酸各自具有选自由seq id no:298-303的核糖核酸序列组成的组的序列。
94.在一些方面,本发明提供一种嵌合核酸,所述嵌合核酸包含编码 cas蛋白的核糖核酸和至少两种另外核糖核酸,所述至少两种另外核糖核酸各自具有与选自由seq id no:1-139和304-333组成的组的不同序列互补和/或杂交的序列。
95.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少两种另外核糖核酸,所述至少两种另外核糖核酸各自具有与选自由seq id no:140-297组成的组的不同序列互补和/或杂交的序列。
96.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少两个另外核糖核酸序列,所述至少两个另外核糖核酸序列各自包含和与选自由seq id no:1-139 和304-333组成的组的序列具有单个核苷酸错配的序列互补和/或杂交的序列。
97.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas
蛋白的核糖核酸和至少两个另外核糖核酸序列,所述至少两个另外核糖核酸序列各自包含和与选自由seq id no: 140-297组成的组的序列具有单个核苷酸错配的序列互补和/或杂交的序列。
98.在一些实施方案中,所述组合物包含编码可检测标记物的核酸序列。在一些实施方案中,所述组合物包含编码荧光蛋白的核酸序列。在一些实施方案中,所述组合物包含可操作地连接至所述嵌合核酸的启动子。在一些实施方案中,所述启动子被优化以用于在人干细胞中增加表达。在一些实施方案中,所述启动子选自由以下组成的组:巨细胞病毒(cmv)早期增强子元件和鸡β-肌动蛋白启动子、鸡β-肌动蛋白启动子、延伸因子-1α启动子以及泛素启动子。在一些实施方案中,所述嵌合核酸包含至少一个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、2-硫代-尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷
ꢀ‑5’‑
三磷酸、5,6-二氢尿苷-5
’‑
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸。在一些实施方案中,所述cas蛋白包含cas9蛋白或其功能部分。
99.在一些方面,本发明提供一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两种核糖核酸,所述核糖核酸各自包含选自由seq id no:298-303 的核糖核酸序列组成的组的不同序列。
100.在一些方面,本发明提供一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两种核糖核酸,所述核糖核酸各自包含与选自由seq id no:1-139 和304-333组成的组的不同序列互补和/或杂交的序列。
101.在一些方面,本发明提供一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两种核糖核酸,所述核糖核酸各自包含与选自由seq id no: 140-297组成的组的不同序列互补和/或杂交的序列。
102.在一些实施方案中,所述试剂盒包括选自由以下组成的组的一种或多种细胞系、培养物或群体:人多能细胞、原代人细胞和非转化的细胞。在一些方面,所述试剂盒包括dna修复模板。
103.在一些方面,本发明提供一种将细胞施用至需要这类细胞的受试者的方法,所述方法包括:(a)使细胞或细胞群体与cas蛋白和两种核糖核酸离体相接触,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述靶多核苷酸序列被裂解;以及(b)将来自(a)的所得到的细胞施用至需要这类细胞的受试者。
104.在一些方面,本发明提供一种将细胞施用至需要这类细胞的受试者的方法,所述方法包括:(a)使细胞或细胞群体与以下各项离体相接触:(i)cas蛋白;(ii)至少两种核糖核酸,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m的靶多核苷酸序列并且与所述靶多核苷酸序列杂交;以及(iii)至少两种另外核糖核酸,所述另外核糖核酸将cas蛋白引导至所述细胞或细胞群体中的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述靶多核苷酸序列被裂解;以及(b) 将来自(a)的所得到的一种或多种细胞施用至需要这类细胞的受试者。
105.在一些实施方案中,所述细胞或细胞群体中编码b2m的靶多核苷酸序列的裂解降低当将所得到的一种或多种细胞施用至受试者时所述细胞将触发宿主免疫应答可能性。在一些方面,所述靶多核苷酸序列包含ccr5。在一些实施方案中,所述至少两种核糖核酸包含
选自由 seq id no:298-303组成的组的两个不同序列。在一些实施方案中,所述至少两种核糖核酸各自包含与选自由seq id no:1-139和304-333组成的组的不同序列互补和/或杂交的序列。在一些实施方案中,所述至少两种核糖核酸各自包含序列,所述序列和包含与选自由 seq id no:1-139和304-333组成的组的不同序列的至少一个核苷酸错配的序列互补和/或杂交。在一些实施方案中,所述靶多核苷酸序列包含cxcr4。在一些实施方案中,所述至少两种核糖核酸各自包含与选自由seq id no:140-297组成的组的不同序列互补和/或杂交的序列。在一些实施方案中,所述至少两种核糖核酸各自包含序列,所述序列和包含与选自由seq id no:140-297组成的组的不同序列的至少一个核苷酸错配的序列互补和/或杂交。在一些实施方案中,所述细胞或细胞群体包含原代细胞。在一些实施方案中,需要施用细胞的受试者正患有病症。在一些实施方案中,所述病症包括遗传性病症。在一些实施方案中,所述病症包括感染。在一些实施方案中,所述病症包括hiv或aids。在一些实施方案中,所述病症包括癌症。
106.在一些方面,本发明提供一种降低施用至受试者的细胞将在所述受试者中触发宿主免疫应答的可能性的方法,所述方法包括:(a)使细胞或细胞群体与cas蛋白和两种核糖核酸离体相接触,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述编码b2m的靶多核苷酸序列被裂解,从而降低施用至所述受试者的细胞将在所述受试者中触发宿主免疫应答的可能性;以及(b)将来自(a)的所得到的细胞施用至需要这类细胞的受试者。
107.在一些方面,本发明提供一种降低施用至受试者的细胞将在所述受试者中触发宿主免疫应答的可能性的方法,所述方法包括:(a)使细胞或细胞群体与以下各项离体相接触:(i)cas蛋白;(ii)至少两种核糖核酸,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m 的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述细胞或细胞群体中所述编码b2m的靶多核苷酸序列被裂解,从而降低所述细胞或细胞群体将在所述受试者中触发宿主免疫应答的可能性;以及(iii) 至少两种另外核糖核酸,所述另外核糖核酸将cas蛋白引导至所述细胞或细胞群体中的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述靶多核苷酸序列被裂解;以及(b)将来自(a)的所得到的一种或多种细胞施用至需要这类细胞的受试者。
108.在一些实施方案中,所述靶多核苷酸序列包含ccr5。在一些实施方案中,所述至少两种核糖核酸包含选自由seq id no:298-303组成的组的两个不同序列。在一些实施方案中,所述至少两种核糖核酸各自包含与选自由seq id no:1-139和304-333组成的组的不同序列互补和/或杂交的序列。在一些实施方案中,所述至少两种核糖核酸各自包含序列,所述序列和包含与选自由seq id no:1-139和304-333组成的组的不同序列的至少一个核苷酸错配的序列互补和/或杂交。在一些实施方案中,所述靶多核苷酸序列包含cxcr4。在一些实施方案中,所述至少两种核糖核酸各自包含与选自由seq id no:140-297组成的组的不同序列互补和/或杂交的序列。在一些实施方案中,所述至少两种核糖核酸各自包含序列,所述序列和包含与选自由seq id no: 140-297组成的组的不同序列的至少一个核苷酸错配的序列互补和/或杂交。在一些实施方案中,所述细胞或细胞群体包含原代细胞。在一些实施方案中,需要施用细胞的受试者正患有病症。在一些实施方案中,所述病症包括遗传性病症。在一些实施方案中,所述病症包括感染。在一些实施方案中,所述病症包括hiv或
aids。在一些实施方案中,所述病症包括癌症。
109.附图简述
110.专利或申请文件包括至少一幅以彩色绘制的附图。在提出请求并支付必要费用后,本事务所将提供具有彩色附图的本专利或专利申请公布的副本。
111.图1示出当靶多核苷酸序列是人ccr5时有用的示例性引导rna 序列。
112.图2示出当靶多核苷酸序列是人cxcr4时有用的示例性引导rna序列。
113.图3示出cas蛋白的示例性氨基酸序列。黄色高亮区指示ruv-c 样结构域。加下划线指示hnh核酸酶结构域。
114.图4a、4b、4c、4d以及4e展示单一引导策略在细胞系中实现高效基因组编辑,但在临床上相关的原代体细胞中未实现高效基因组编辑。图4a是示出ccr5基因座中的crispr-靶向位点(单一引导)的表,这些crispr-靶向位点是通过使用crispr设计程序(可在万维网上在http://crispr.mit.edu获得)针对优化的引导rna序列扫描人趋化因子受体ccr5而发现的(左图)。将总计11种得分大于50的引导rna 针对在k562细胞系中的编辑效率进行测试。图4a(右图)示出通过celsurveyor测定测量7种选定引导的编辑效率(插入缺失%)。图4b示出细胞系293t、k562(左边两图)和原代人cd34 hspc(右边两图)中的基因组编辑效率的对比分析,从而说明在原代cd34 细胞中基因组编辑效率低下。将细胞用cas9(泳道1)连同引导rna(泳道2)或表达质粒(泳道3)转染。图4c是示出b2m基因座中的crispr-靶向位点(单一引导) 的示意图。图4d示出在293t细胞中用单一引导rna靶向b2m基因座的结果。图4e示出在293t细胞中使用单一引导策略靶向b2m的流式细胞术分析的结果,所述结果展示b2m crispr以高效率消除b2m 表面表达。
115.图5a、5b和5c展示双重引导策略在临床相关细胞中以高功效实现基因组编辑。图5a示出与单一引导(a或b)相比,2-引导组合(a b) 显示在k562细胞系中在靶向ccr5方面的稳健编辑效率。图5b示出不同引导组合以及具有取向的每个引导对之间的间隔(上图)。pcr结果 (左下图)和cel测定(右下图)显示所测试的引导对的稳健基因组编辑。图5c示出pcr分析的结果,从而指示使用2-引导组合,野生型cas9 有效地缺失两个引导之间的dna序列,相比之下切口酶(d10a)未能有效地缺失两个引导之间的dna序列。图5d是显示双b2m crispr组合的示意图。
116.图6a和6b展示使用2-引导方法,人cd34 hspc中的有效基因组编辑。图6a是显示使用两个引导的有效克隆缺失频率的代表性凝胶图片。通过在生长于甲基纤维素上的单独菌落上进行的pcr测定克隆缺失效率。图6b是显示从两个独立克隆缺失实验获得的数据的表,所述数据表明使用2-引导方法原代人cd34 细胞中的有效基因组编辑。
117.图7a、7b和7c展示与原代细胞相比,双重引导策略未能提高 293t细胞中的b2m编辑效率。图7a示出以6孔形式转染后72小时,用1μg cas9加靶向b2m的0.5μg grna或0.25μg 0.25μg grna电穿孔的293t细胞的流式细胞术分析的门控策略。图7b示出在293t 细胞中用b2m crispr grna进行的surveyor测定的结果(72小时)。图7c示出双重引导策略未能提高293t细胞中的b2m切割效率,相比之下所述双重引导策略显著提高原代细胞中的b2m切割效率(图 5)。
118.图8a、8b、8c和8d展示使用双重引导策略消除体细胞(例如,原代cd4 t细胞)中的b2m表面表达。图8a示出展示cd4 t细胞(总活细胞)中的b2m敲除效率的流式细胞术分析的
结果。图8b示出展示 cd4 t细胞(在gfp 细胞上门控)中的b2m敲除效率的流式细胞术分析的结果。图8c示出定量展示cd4 t细胞中的b2m敲除效率的流式细胞术分析的结果的表。图8d示出在活/7aad neg/gfp 细胞上门控的细胞的流式细胞术分析的结果,从而展示所述双重引导策略导致 b2m表面表达的消除。
119.发明详述
120.本文所述的研究展示了使用crispr/cas系统的等位基因靶向方法以高达80%的效率产生突变细胞。具体地说,本文所述的工作出人意料地且意外地证明一种多重引导策略(例如,使用两种或更多种核糖核酸,所述核糖核酸将cas蛋白引导至靶多核苷酸序列并且与所述靶多核苷酸序列杂交)可高效且有效地缺失原代体细胞(例如,人血液细胞,例如cd34 细胞和t细胞)中的靶多核苷酸序列(例如,b2m、hprt、 ccr5和/或cxcr4),相比之下单一引导策略已由本发明人证明为可高效地缺失细胞系(例如293t)中的靶多核苷酸序列,但未能高效地缺失原代体细胞中的靶多核苷酸序列。这些极大改进的方法允许crispr/cas系统首次有效地用于治疗性目的。提供将crispr/cas系统递送至人干细胞的方法。此外,提供特异性地鉴定有用的rna引导序列的方法,连同适用于靶向特异性基因(例如,b2m、hprt、ccr5 和/或cxcr4)的特定引导序列。此外,提供利用本文公开的组合物和方法的治疗方法(例如,治疗hiv感染的方法)。此外,提供利用本文公开的组合物和方法施用细胞的方法(例如,施用具有降低的触发宿主免疫应答可能性的细胞的方法)。
121.一方面,本发明提供一种改变细胞中的靶多核苷酸序列的方法。
122.一种改变细胞中的靶多核苷酸序列的示例性方法包括使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和一至两种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约80%。
123.如本文所用,术语“接触”(即,使多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和/或核糖核酸相接触)意图包括在体外在细胞中一起孵育cas蛋白和/或核糖核酸(例如,将所述cas蛋白或编码所述cas蛋白的核酸添加至培养物中的细胞)或离体接触细胞。如本文所公开使靶多核苷酸序列与cas蛋白和/或核糖核酸相接触的步骤可以任何适合的方式进行。例如,可以贴壁培养或悬浮培养的形式处理所述细胞。应了解如本文所公开与cas蛋白和/或核糖核酸相接触的细胞还可同时或随后与另一种试剂,如生长因子或其他分化剂或环境相接触以稳定所述细胞或使所述细胞进一步分化。
124.另一方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法。
125.当应用于分离的细胞时,术语“处理(treat)”、“处理(treating)”、“处理(treatment)”等包括使所述细胞经受任何类型的过程或条件,或对所述细胞进行任何类型的操作或工序。当应用于受试者时,所述术语是指向个体提供细胞,在所述细胞中已根据本文所述的方法离体改变靶多核苷酸序列。所述个体通常是生病的或受伤的,或相对于群体的平均成员处于增加的生病风险并且需要这种注意、护理或管理。
126.如本文所用,术语“治疗(treating)”和“治疗(treatment)”是指向受试者施用有效量的具有根据本文所述的方法离体改变的靶多核苷酸序列的细胞,以使得所述受试者具有所述疾病的至少一种症状的减少或所述疾病的改善,例如,有益的或所需的临床结果。出
于本发明的目的,有益的或所需的临床结果包括但不限于一种或多种症状的减轻、疾病程度的减小、疾病状态的稳定(即不恶化)、疾病进展的延迟或减慢、疾病状态的改善或缓和,以及缓解(无论是部分缓解还是全部缓解),无论是可检测的或是不可检测的。治疗可指与未接受治疗情况下的预期存活期相比,延长存活期。因此,本领域的技术人员意识到治疗可改善疾病状况,但可能不是疾病的完全治愈。如本文所用,术语“治疗”包括预防。或者,治疗在疾病的进展减少或停止的情况下是“有效的”。“治疗”还可意指与在未接受治疗情况下的预期存活期相比,延长存活期。需要治疗的那些包括已经被诊断具有与多核苷酸序列的表达相关的病症的那些,以及由于遗传易感性或其他因素可能发展这种病症的那些。
127.疾病或病症的“治疗”、“预防”或“改善”意指延迟或预防所述疾病或病症的发作,逆转、减轻、改善、抑制、减缓或终止与所述疾病或病症相关的病状的进展、加剧或恶化进展或严重程度。在一个实施方案中,疾病或病症的症状被减轻至少5%、至少10%、至少20%、至少 30%、至少40%或至少50%。
128.一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的示例性方法包括(a)通过使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和一至两种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
129.本发明考虑以任何方式改变靶多核苷酸序列,所述方式是熟练的技术人员利用本发明的crispr/cas系统可获得的。可以使用能够改变细胞中的靶多核苷酸序列的任何crispr/cas系统。这类crispr-cas 系统可采用多种cas蛋白(haft等plos comput biol.2005;1(6)e60)。这类cas蛋白的允许crispr-cas系统改变细胞中的靶多核苷酸序列的分子机器包括rna结合蛋白、核酸内切酶和核酸外切酶、解旋酶以及聚合酶。在一些实施方案中,所述crispr/cas系统是crispr i型系统。在一些实施方案中,所述crispr/cas系统是crispr ii型系统。
130.本发明的crispr/cas系统可用于改变细胞中的靶多核苷酸序列。本发明考虑出于任何目的改变细胞中的靶多核苷酸序列。在一些实施方案中,改变细胞中的靶多核苷酸序列以产生突变细胞。如本文所用,“突变细胞”是指具有与其原始基因型不同的所得基因型的细胞。在一些实例中,“突变细胞”表现出突变表型,例如当使用本发明的crispr/cas 系统改变功能正常的基因时。在其他实例中,“突变细胞”表现出野生型表型,例如当本发明的crispr/cas系统用于修正突变基因型时。在一些实施方案中,改变细胞中的靶多核苷酸序列以修正或修复基因突变 (例如,以恢复所述细胞的正常基因型)。在一些实施方案中,改变细胞中的靶多核苷酸序列以诱导基因突变(例如,以破坏基因或基因组元件的功能)。
131.在一些实施方案中,所述改变是插入缺失。如本文所用,“插入缺失”是指由插入、缺失或其组合产生的突变。如本领域的技术人员将理解,除非插入缺失的长度是三的倍数,否则基因组序列的编码区中的插入缺失将导致移码突变。在一些实施方案中,所述改变是点突变。如本文所用,“点突变”是指替代核苷酸中的一个的取代。本发明的 crispr/cas系统可用于诱导靶多核苷酸序列中的任何长度的插入缺失或点突变。
132.在一些实施方案中,所述改变导致所述。使用本发明的 crispr/cas系统敲除靶多
核苷酸序列或其部分可适用于多种应用。例如,敲除细胞中的靶多核苷酸序列可出于研究目的在体外进行。出于离体目的,敲除细胞中的靶多核苷酸序列可适用于治疗或预防与所述靶多核苷酸序列的表达相关的病症(例如,通过离体敲除细胞中的突变等位基因并且将包含敲除的突变等位基因的那些细胞引入受试者中)。
133.如本文所用,“敲除”包括以干扰靶多核苷酸的功能的方式缺失所述靶多核苷酸的全部或一部分。例如,敲除可通过改变靶多核苷酸序列来实现,所述改变是通过在所述靶多核苷酸序列中诱导所述靶多核苷酸序列的功能结构域(例如,dna结合结构域)中的插入缺失来进行的。基于本文所述的细节,本领域的技术人员将容易地理解如何使用本发明的crispr/cas系统来敲除靶多核苷酸或其部分。
134.在一些实施方案中,所述改变导致所述靶多核苷酸序列的表达降低。术语“降低(decrease)”、“降低(reduced)”、“降低(reduction)”和“降低 (decrease)”在本文中通常都用于意指降低统计上显著的量。然而,为避免疑惑,“降低(decrease)”、“降低(reduced)”、“降低(reduction)”、“降低 (decrease)”意指与参考水平相比降低至少10%,例如与参考水平相比降低至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%,或多达且包括100%降低(即与参考样品相比不存在的水平),或10%-100%之间的任何降低。
135.术语“增加(increased)”、“增加(increase)”或“增强”或“活化”在本文中通常都用于意指增加统计上显著的量;为避免任何疑惑,术语“增加 (increased)”、“增加(increase)”或“增强”或“活化”意指与参考水平相比增加至少10%,例如与参考水平相比增加至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%、或多达且包括100%增加或10%-100%之间的任何增加,或与参考水平相比至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍、或至少约10倍增加,或2倍与10倍之间的任何增加。
136.术语“统计上显著的”或“显著地”是指统计显著性并且通常意指在正常标记物浓度以下或低于标记物浓度的两个标准偏差(2sd)。所述术语是指存在差异的统计证据。它被定义为当虚假设实际上为真实时做出拒绝虚假设的决定的概率。所述决定经常使用p-值进行。
137.在一些实施方案中,所述改变是纯合改变。在一些实施方案中,所述改变是杂合改变。
138.在一些实施方案中,所述改变使得所述靶多核苷酸序列从不想要的序列修正为所需序列。本发明的crispr/cas系统可用于修正靶多核苷酸序列中的任何类型的突变或错误。例如,本发明的crispr/cas系统可用于插入由于缺失而在靶多核苷酸序列中缺少的核苷酸序列。本发明的crispr/cas系统还可用于从靶多核苷酸序列中缺失或切除由于插入突变所致的核苷酸序列。在一些实例中,本发明的crispr/cas 系统可用于用正确的核苷酸序列替代不正确的核苷酸序列(例如,以恢复靶多核苷酸序列的由于功能突变的损失而受损的功能,即snp).
139.与常规crispr/cas系统相比,本发明的crispr/cas系统可以出人意料地高效率改变靶多核苷酸。在某些实施方案中,所述改变效率是至少约5%。在某些实施方案中,所述改变效率是至少约10%。在某些实施方案中,所述改变效率是约10%至约80%。在某些实施方
案中,所述改变效率是约30%至约80%。在某些实施方案中,所述改变效率是约50%至约80%。在一些实施方案中,所述改变效率大于或等于约 80%。
140.本发明的crispr/cas系统可用于改变细胞中的任何靶多核苷酸序列。本领域的技术人员将容易地理解,任何特定细胞中待改变的合乎需要的靶多核苷酸序列可对应于基因组序列的表达与病症相关或以另外的方式促进病原体进入细胞的任何基因组序列。例如,用于在细胞中改变的合乎需要的靶多核苷酸序列可以是对应于含有与单个多核苷酸多态性相关的疾病的基因组序列。在这种实例中,本发明的 crispr/cas系统可用于通过用野生型等位基因替代细胞中的疾病相关的snp来修正所述疾病相关的snp。作为另一个实例,靶基因的负责病原体进入或增殖到细胞中的多核苷酸序列可以是用于缺失或插入以破坏所述靶基因的功能来防止病原体进入所述细胞或在所述细胞内部增殖的合适靶标。
141.在一些实施方案中,所述靶多核苷酸序列是基因组序列。在一些实施方案中,所述靶多核苷酸序列是人基因组序列。在一些实施方案中,所述靶多核苷酸序列是哺乳动物基因组序列。在一些实施方案中,所述靶多核苷酸序列是脊椎动物基因组序列。
142.在一些实施方案中,靶多核苷酸序列是病原性基因组序列。示例性病原性基因组序列包括但不限于病毒基因组序列、细菌基因组序列、真菌基因组序列、毒素基因组序列或寄生虫基因组序列。在这类实施方案中,本发明的crispr/cas系统可用于通过裂解病原体的基因组序列(例如,对于进入细胞来说关键的或一旦病原体在细胞内部就负责繁殖、生长或存活的基因组序列)来破坏所述病原体的功能(例如,以治疗或预防所述病原体感染)。
143.在一些实施方案中,所述靶多核苷酸序列是β-2-微球蛋白(b2m;基因id:567)。所述b2m多核苷酸序列编码与在几乎所有有核细胞的表面上表达的主要组织相容性复合体(mhc)i类分子的重链相关的血清蛋白。b2m蛋白包含据发现在某些病理条件下形成淀粉样蛋白原纤维的β-折叠片结构。所述b2m基因具有跨越大约8kb的4个外显子。 b2m已在正常个体的血清中观察到,并且在来自患有威尔逊氏病、镉中毒以及导致肾小管功能障碍的各种病状的患者的尿中以升高的量观察到。已知与b2m相关的其他病理性病状包括但不限于,已在患有家族性分解亢进低蛋白血症的个体中报道了b2m基因中的纯合突变(例如,ala11pro),已在患有家族性内脏淀粉样变性病的个体中报道了b2m 基因中的杂合突变(例如,asp76asn)。
144.在一些实施方案中,所述靶多核苷酸序列是b2m的变体。在一些实施方案中,所述靶多核苷酸序列是b2m的同源物。在一些实施方案中,所述靶多核苷酸序列是b2m的直向同源物。
145.在一些实施方案中,所述靶多核苷酸序列是次黄嘌呤磷酸核糖基转移酶1(hprt1;基因id:3251)。
146.在一些实施方案中,所述靶多核苷酸序列是ccr5(基因id:1234,还被称为cc-ckr-5、ccckr5、ccr-5、cd195、ckr-5、ckr5、 cmkbr5以及iddm22)。在一些实施方案中,所述靶多核苷酸序列是 ccr5的变体。在一些实施方案中,所述靶多核苷酸序列是ccr5的同源物。在一些实施方案中,所述靶多核苷酸序列是ccr5的直向同源物。
147.在一些实施方案中,所述靶多核苷酸序列是cxcr4(基因id: 7852,还被称为fb22;hm89;lap3;lcr1;npyr;whim;cd184; lestr;npy3r;npyrl;hsy3rr;npyy3r;以及d2s201e)。在一些实施方案中,所述靶多核苷酸序列是cxcr4的变体。在一些实施方案中,所述靶多核
苷酸序列是cxcr4的同源物。在一些实施方案中,所述靶多核苷酸序列是cxcr4的直向同源物。应理解本发明的 crispr/cas系统可以多种方式裂解靶多核苷酸序列。在一些实施方案中,所述靶多核苷酸序列被裂解以使得产生双链断裂。在一些实施方案中,所述靶多核苷酸序列被裂解以使得产生单链断裂。
148.本发明的方法可用于改变细胞中的任何靶多核苷酸序列,只要所述细胞中的靶多核苷酸序列包含适合的靶基序,所述靶基序允许 crispr/cas系统的至少一种核糖核酸将cas蛋白引导至所述靶基序并且与所述靶基序杂交。本领域的技术人员将理解用于靶向特定多核苷酸的靶基序取决于所使用的crispr/cas系统以及待靶向的多核苷酸的序列。
149.在一些实施方案中,所述靶基序的长度是至少20bp。在一些实施方案中,所述靶基序是20个核苷酸的dna序列。在一些实施方案中,所述靶基序是以g开始的20个核苷酸的dna序列,并且紧接在由cas 蛋白识别的ngg基序之前。在一些实施方案中,所述靶基序是 g(n)
19
ngg。在一些实施方案中,所述靶基序是20个核苷酸的dna 序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,所述靶基序是(n)
20
ngg。
150.可选择本发明的靶基序以使本发明的crispr/cas系统的脱靶效应最小化。在一些实施方案中,选择所述靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少两个错配。在一些实施方案中,选择所述靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少一个错配。本领域的技术人员将理解不同技术可用于选择适合的靶基序以用于使脱靶效应最小化(例如,生物信息学分析)。
151.在一些实施方案中,所述靶基序包含选自由seq id no:1-139组成的组的dna序列。在一些实施方案中,所述靶基序包含dna序列,所述dna序列与选自由seq id no:1-139组成的组的dna序列相比包含至少一个核苷酸错配。在一些实施方案中,所述靶基序包含dna 序列,所述dna序列与选自由seq id no:1-139组成的组的dna序列相比包含至少两个核苷酸错配。在一些实施方案中,所述靶基序包含选自由seq id no:140-297组成的组的dna序列。在一些实施方案中,所述靶基序包含dna序列,所述dna序列与选自由seq id no: 140-297组成的组的dna序列相比包含至少一个核苷酸错配。在一些实施方案中,所述靶基序包含dna序列,所述dna序列与选自由seqid no:140-297组成的组的dna序列相比包含至少两个核苷酸错配。在一些实施方案中,所述靶基序包含选自由seq id no:304-333组成的组的dna序列。在一些实施方案中,所述靶基序包含dna序列,所述dna序列与选自由seq id no:304-333组成的组的dna序列相比包含至少一个核苷酸错配。在一些实施方案中,所述靶基序包含dna 序列,所述dna序列与选自由seq id no:304-333组成的组的dna 序列相比包含至少两个核苷酸错配。在一些实施方案中,本发明的 crispr/cas系统利用同源介导修复来修正靶多核苷酸序列。在一些实施方案中,在所述靶多核苷酸序列的裂解之后,发生同源介导修复。在一些实施方案中,使用外源引入的dna修复模板进行同源介导修复。所述外源引入的dna修复模板可以是单链的或双链的。所述dna修复模板可具有任何长度。本领域的技术人员将理解任何特定dna修复模板的长度将取决于待修正的靶多核苷酸序列。所述dna修复模板可被设计成修复或替代任何靶多核苷酸序列,特别是包含疾病相关多态性(例如,snp)的靶多核苷酸序列。例如,包含这类snp的突变等位基因的同源介导修复可用crispr/cas系统通过选择位于所述突变等位基因侧翼的两个靶基序并且设计dna修复模板以匹配野生型等位基因来实现。
152.在一些实施方案中,本发明的crispr/cas系统包括cas蛋白和至少一至两种核糖核酸,所述核糖核酸能够将所述cas蛋白引导至靶多核苷酸序列的靶基序并且与所述靶基序杂交。
153.如本文所用,“蛋白质”和“多肽”可互换使用以指通过肽键连接的一系列氨基酸残基(即,氨基酸的聚合物)并且包括修饰的氨基酸(例如,磷酸化的、糖化的、糖基化的等等)和氨基酸类似物。示例性多肽或蛋白质包括基因产物、天然存在的蛋白质、同源物、横向同源物、片段以及以上的其他等效物、变体和类似物。
154.在一些实施方案中,cas蛋白包含一个或多个氨基酸取代或修饰。在一些实施方案中,一个或多个氨基酸取代包含保守性氨基酸取代。在一些实例中,取代和/或修饰可防止或减少蛋白水解降解和/或延长细胞中的多肽的半衰期。在一些实施方案中,所述cas蛋白可包含肽键替代(例如,脲、硫脲、氨基甲酸酯、磺酰脲等)。在一些实施方案中,所述cas蛋白可包含天然存在的氨基酸。在一些实施方案中,所述cas 蛋白可包含替代氨基酸(例如,d-氨基酸、β-氨基酸、高半胱氨酸、磷酸丝氨酸等)。在一些实施方案中,cas蛋白可包含修饰以包括一个部分(例如,peg化、糖基化、脂化、乙酰化、封端等)。
155.在一些实施方案中,cas蛋白包含核心cas蛋白。示例性cas核心蛋白包括但不限于cas1、cas2、cas3、cas4、cas5、cas6、cas7、 cas8和cas9。在一些实施方案中,cas蛋白包含大肠杆菌亚型的cas 蛋白(还被称为cass2)。大肠杆菌亚型的示例性cas蛋白包括但不限于 cse1、cse2、cse3、cse4和cas5e。在一些实施方案中,cas蛋白包含 ypest亚型的cas蛋白(还被称为cass3)。ypest亚型的示例性cas蛋白包括但不限于csy1、csy2、csy3和csy4。在一些实施方案中,cas蛋白包含nmeni亚型的cas蛋白(还被称为cass4)。nmeni亚型的示例性cas蛋白包括但不限于csn1和csn2。在一些实施方案中,cas蛋白包含dvulg亚型的cas蛋白(还被称为cass1)。dvulg亚型的示例性 cas蛋白包括csd1、csd2和cas5d。在一些实施方案中,cas蛋白包含 tneap亚型的cas蛋白(还被称为cass7)。tneap亚型的示例性cas蛋白包括但不限于cst1、cst2、cas5t。在一些实施方案中,cas蛋白包含hmari亚型的cas蛋白。hmari亚型的示例性cas蛋白包括但不限于 csh1、csh2和cas5h。在一些实施方案中,cas蛋白包含apern亚型的 cas蛋白(还被称为cass5)。apern亚型的示例性cas蛋白包括但不限于csa1、csa2、csa3、csa4、csa5和cas5a。在一些实施方案中,cas 蛋白包含mtube亚型的cas蛋白(还被称为cass6)。mtube亚型的示例性cas蛋白包括但不限于csm1、csm2、csm3、csm4和csm5。在一些实施方案中,cas蛋白包含ramp模块cas蛋白。示例性ramp模块cas蛋白包括但不限于cmr1、cmr2、cmr3、cmr4、cmr5和cmr6。
156.在一些实施方案中,所述cas蛋白是酿脓链球菌cas9蛋白或其功能部分。在一些实施方案中,所述cas蛋白是来自任何细菌物种的cas9 蛋白或其功能部分。cas9蛋白是ii型crispr系统的成员,所述ii型 crispr系统通常包括反式编码的小rna(tracrrna)、内源性核糖核酸酶3(rnc)以及cas蛋白。cas 9蛋白(还被称为crispr相关的核酸内切酶cas9/csn1)是包含1368个氨基酸的多肽。cas 9蛋白的示例性氨基酸序列(seq id no:334)在图3中示出。cas 9含有2个核酸内切酶结构域,包括ruvc-样结构域(残基7-22、759-766和982-989),其裂解与 crrna非互补的靶dna;和hnh核酸酶结构域(残基810-872),其裂解与crrna互补的靶dna。在图3中,所述ruvc-样结构域以黄色突出显示并且hnh核酸酶结构域加下划线。
157.如本文所用,“功能部分”是指肽的保留其与至少一种核糖核酸(例如,引导rna(grna))复合且裂解靶多核苷酸序列的能力的一部分。在一些实施方案中,所述功能部分包含选自由以下组成的组的可操作连接的cas9蛋白功能性结构域的组合:dna结合结构域、至少一个 rna结合结构域、解旋酶结构域以及核酸内切酶结构域。在一些实施方案中,所述功能性结构域形成复合体。
158.在一些实施方案中,所述cas9蛋白的功能部分包含ruvc-样结构域的功能部分。在一些实施方案中,所述cas9蛋白的功能部分包含 hnh核酸酶结构域的功能部分。
159.应理解本发明考虑使靶多核苷酸序列与cas蛋白(例如,cas9)相接触的各种方式。在一些实施方案中,可将外源性cas蛋白以多肽形式引入至细胞中。在某些实施方案中,可使cas蛋白与细胞穿透多肽或细胞穿透肽缀合或融合。如本文所用,“细胞穿透多肽”和“细胞穿透肽”是指分别有助于分子摄取至细胞中的多肽或肽。细胞穿透多肽可含有可检测标记。
160.在某些实施方案中,可使cas蛋白与带电荷的蛋白质(例如,携带正、负或总体中性电荷的蛋白质)缀合或融合。这类键联可以是共价的。在一些实施方案中,可使cas蛋白与带超正电荷的gfp融合以显著增加所述cas蛋白穿透细胞的能力(cronican等acs chembiol.2010;5(8):747-52)。
161.在某些实施方案中,可使cas蛋白与蛋白质转导结构域(ptd)融合以有助于其进入细胞。示例性ptd包括tat、寡聚精氨酸和穿膜肽。
162.在一些实施方案中,所述cas9蛋白包含与细胞穿透肽融合的cas9 多肽。在一些实施方案中,所述cas9蛋白包含与ptd融合的cas9多肽。在一些实施方案中,所述cas9蛋白包含与tat结构域融合的cas9 多肽。在一些实施方案中,所述cas9蛋白包含与寡聚精氨酸结构域融合的cas9多肽。在一些实施方案中,所述cas9蛋白包含与穿膜肽结构域融合的cas9多肽。在一些实施方案中,所述cas9蛋白包含与带超正电荷的gfp融合的cas9多肽。
163.在一些实施方案中,可将cas蛋白以编码所述cas蛋白(例如, cas9)的核酸的形式引入含有靶多核苷酸序列的细胞中。将所述核酸引入细胞中的过程可通过任何适合的技术来实现。适合的技术包括磷酸钙或脂质介导的转染、电穿孔、以及使用病毒载体转导或感染。在一些实施方案中,所述核酸包含dna。在一些实施方案中,所述核酸包含修饰的dna,如本文所述。在一些实施方案中,所述核酸包含 mrna。在一些实施方案中,所述核酸包含修饰的mrna,如本文所述(例如,合成、修饰的mrna)。
164.在一些实施方案中,所述cas蛋白与一至两种核糖核酸复合。在一些实施方案中,所述cas蛋白与两种核糖核酸复合。在一些实施方案中,所述cas蛋白由修饰的核酸编码,如本文所述(例如,合成、修饰的mrna)。
165.本发明的方法考虑使用能够将cas蛋白引导至靶多核苷酸序列的靶基序并且与所述靶基序杂交的任何核糖核酸。在一些实施方案中,所述核糖核酸中的至少一种包含tracrrna。在一些实施方案中,所述核糖核酸中的至少一种包含crispr rna(crrna)。在一些实施方案中,所述核糖核酸中的至少一种包含引导rna,所述引导rna将cas 蛋白引导至细胞中的靶多核苷酸序列的靶基序并且与所述靶基序杂交在一些实施方案中,所述一至两种核糖核酸均包含引导rna,所述引导rna将cas蛋白引导至细胞中的靶多核苷酸序列的靶基序并且与所述靶基序杂交可取决于所采用的特定crispr/cas系统和靶多核苷酸的序列
来选择本发明的核糖核酸以与各种不同的靶基序杂交,如将由本领域的技术人员所理解。还可选择所述一至两种核糖核酸以使与除所述靶多核苷酸序列之外的核酸序列的杂交最小化。在一些实施方案中,所述一至两种核糖核酸与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少两个错配。在一些实施方案中,所述一至两种核糖核酸与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少一个错配。在一些实施方案中,所述一至两种核糖核酸被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交。在一些实施方案中,所述一至两种核糖核酸各自被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交,所述靶基序位于定位在所述靶基序之间的突变等位基因侧翼。
166.在一些实施方案中,所述一至两种核糖核酸中的至少一种包含选自由图1的核糖核酸序列组成的组的序列。在一些实施方案中,所述一至两种核糖核酸中的至少一种包含与选自由图1的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。
167.在一些实施方案中,所述一至两种核糖核酸中的至少一种包含选自由图2的核糖核酸序列组成的组的序列。在一些实施方案中,所述一至两种核糖核酸中的至少一种包含与选自由图2的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。
168.在一些实施方案中,所述一至两种核糖核酸各自包含引导rna,所述引导rna将cas蛋白引导至细胞中的靶多核苷酸序列的靶基序并且与所述靶基序杂交。在一些实施方案中,所述两个引导rna序列包含选自由seq id no:1-139组成的组的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq idno:1-139组成的组的两个不同序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:1-139组成的组的两个不同偏移序列互补的rna序列。在一些实施方案中,所述两个引导 rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:1-139组成的组的序列包含至少一个核苷酸错配的两个不同序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:1-139组成的组的序列包含至少一个核苷酸错配的两个不同偏移序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:1-139 组成的组的两个不同序列杂交的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:1-139组成的组的两个不同偏移序列杂交的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:1-139组成的组的序列包含至少一个核苷酸错配的两个不同序列杂交的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:1-139组成的组的序列包含至少一个核苷酸错配的两个不同偏移序列杂交的rna序列。
169.在一些实施方案中,所述两个引导rna序列包含选自由seq idno:140-297组成的组的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导rna序列包含两
个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:140-297组成的组的两个不同序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:140-297组成的组的两个不同偏移序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:140-297组成的组的序列包含至少一个核苷酸错配的两个不同序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:140-297组成的组的序列包含至少一个核苷酸错配的两个不同偏移序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:140-297 组成的组的两个不同序列杂交的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:140-297组成的组的两个不同偏移序列杂交的rna序列。在一些实施方案中,所述两个引导rna 序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:140-297组成的组的序列包含至少一个核苷酸错配的两个不同序列杂交的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:140-297组成的组的序列包含至少一个核苷酸错配的两个不同偏移序列杂交的rna序列。
170.在一些实施方案中,所述两个引导rna序列包含选自由seq idno:298-303组成的组的两个引导核糖核酸序列的任何组合。在一些实施方案中,所述两个引导核糖核酸序列包含选自由以下组成的组的一对引导核糖核酸:seq id no:299和303、seq id no:298和300、seqid no:299和300、seq id no:298和303、seq id no:299和301、 seq id no:298和299、seq id no:301和303、seq id no:298和 302、以及seq id no:298和301。在一些实施方案中,所述两个引导 rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:304-333组成的组的两个不同序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由 seq id no:304-333组成的组的两个不同偏移序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq idno:304-333组成的组的序列包含至少一个核苷酸错配的两个不同序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:304-333组成的组的序列包含至少一个核苷酸错配的两个不同偏移序列互补的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:304-333组成的组的两个不同序列杂交的rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与选自由seq id no:304-333组成的组的两个不同偏移序列杂交的 rna序列。在一些实施方案中,所述两个引导rna序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:304-333组成的组的序列包含至少一个核苷酸错配的两个不同序列杂交的rna序列。在一些实施方案中,所述两
个引导rna 序列包含两个引导核糖核酸序列的任何组合,所述引导核糖核酸序列包含与相较于选自由seq id no:304-333组成的组的序列包含至少一个核苷酸错配的两个不同偏移序列杂交的rna序列。
171.在一些实施方案中,所述两种核糖核酸(例如,引导rna)与在靶多核苷酸序列的同一链上的序列互补和/或杂交。在一些实施方案中,所述两种核糖核酸(例如,引导rna)与在靶多核苷酸序列的相反链上的序列互补和/或杂交。在一些实施方案中,所述两种核糖核酸(例如,引导rna)不与在靶多核苷酸序列的相反链上的序列互补和/或杂交。在一些实施方案中,所述两种核糖核酸(例如,引导rna)与靶多核苷酸序列的重叠靶基序互补和/或杂交。在一些实施方案中,所述两种核糖核酸(例如,引导rna)与靶多核苷酸序列的偏移靶基序互补和/或杂交。
172.本发明还考虑多重基因组编辑。本领域的技术人员将理解以上关于单个基因的基因组编辑的描述同样适用于以下所述的多重基因组编辑实施方案。
173.另一方面,本发明提供一种同时改变细胞中的多个靶多核苷酸序列的方法。
174.一种同时改变细胞中的多个靶多核苷酸序列的示例性方法包括使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约 80%。
175.另一方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法。
176.一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的示例性方法包括(a)通过使所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约50%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
177.如本文所用,术语“施用”、“引入”和“移植”在通过一种方法或途径将细胞,例如本文所述的包含根据本发明的方法改变的靶多核苷酸序列的细胞放置到受试者中的背景下可互换使用,所述方法或途径导致所引入的细胞至少部分定位在所需位点处。所述细胞可直接移植到所需位点,或可替代地通过任何适当途径施用,所述途径导致递送至受试者中的所需位置,其中所移植的细胞或细胞组分的至少一部分保持存活。在施用至受试者之后所述细胞的存活力周期可短至数小时(例如 24小时)至数天,至长达数年。在一些实例中,所述细胞还可例如以胶囊形式施用至除所需位点之外的位置(如肝中或皮下),以将所移植的细胞保持在植入位置处并且避免所植入细胞的迁移。
178.对于离体方法,细胞可包括自体细胞,即从需要改变一种或多种细胞中的靶多核苷酸序列的受试者取得的一种或多种细胞(即,供体和受体是同一个体)。自体细胞具有避免所述细胞的任何基于免疫的排斥的优点。或者,所述细胞可以是异源的,例如,从供体取得的。第二受试者可以是相同或不同物种。通常,当细胞来自供体时,所述细胞将来自与受体足够免疫相容的供体,即将不是移植排斥的受试者,以减少或除去对免疫抑制的需要。在
一些实施方案中,所述细胞从异种来源取得,即已被遗传工程化为与受体或受体的物种足够免疫相容的非人哺乳动物。用于测定免疫相容性的方法是本领域中已知的,并且包括组织分型以针对hla和abo决定簇评定供体-受体相容性。参见,例如,transplantation immunology,bach and auchincloss,编辑(wiley, john&sons,incorporated 1994)。
179.任何适合的细胞培养基可用于本发明的离体方法。
180.术语“受试者”和“个体”可在本文中互换使用,并且是指动物,例如可从其获得细胞和/或向其提供用如本文所述的细胞进行的治疗(包括预防性治疗)的人。对于对特定动物如人受试者具有特异性的那些感染、病状或疾病状态的治疗,术语受试者是指所述特定动物。如可在本文中互换使用的“非人动物”和“非人哺乳动物”包括哺乳动物,如大鼠、小鼠、兔、绵羊、猫、狗、牛、猪,以及非人灵长类动物。术语“受试者”还涵盖任何脊椎动物,包括但不限于哺乳动物、爬行动物、两栖动物和鱼类。然而,有利地,所述受试者是哺乳动物(如人)或其他哺乳动物如家养哺乳动物(例如,狗、猫、马等),或生产哺乳动物,例如牛、绵羊、猪等。
181.在一些实施方案中,所述改变导致所述靶多核苷酸序列的表达降低。在一些实施方案中,所述改变导致所述靶多核苷酸序列的敲除。在一些实施方案中,所述改变使得所述靶多核苷酸序列从不想要的序列修正为所需序列。在一些实施方案中,每个改变是纯合改变。在一些实施方案中,在每个基因座处改变效率是约5%至约80%。在一些实施方案中,在每个基因座处改变效率是约10%至约80%。在一些实施方案中,在每个基因座处改变效率是约30%至约80%。在一些实施方案中,在每个基因座处改变效率是约50%至约80%。在一些实施方案中,在每个基因座处改变效率大于或等于约80%。
182.在一些实施方案中,每个靶多核苷酸序列被裂解以使得产生双链断裂。在一些实施方案中,每个靶多核苷酸序列被裂解以使得产生单链断裂。
183.在一些实施方案中,所述靶多核苷酸序列包含b2m的多个不同部分。在一些实施方案中,所述靶多核苷酸序列包含ccr5的多个不同部分。在一些实施方案中,所述靶多核苷酸序列包含cxcr4的多个不同部分。在一些实施方案中,所述靶多核苷酸序列包含ccr5的至少一部分和cxcr4的至少一部分。
184.在一些实施方案中,每个靶基序是20个核苷酸的dna序列。在一些实施方案中,每个靶基序是以g开始的20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,每个靶基序是20个核苷酸的dna序列,并且紧接在由cas蛋白识别的ngg基序之前。在一些实施方案中,每个靶基序是g(n)19ngg。在一些实施方案中,每个靶基序是(n)20ngg。在一些实施方案中,选择每个靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少两个错配。在一些实施方案中,选择每个靶基序以使得当与细胞中的所有其他基因组核苷酸序列相比较时它含有至少两个错配。
185.在一些实施方案中,每个靶基序包含选自由seq id no:1-139组成的组的不同dna序列。在一些实施方案中,每个靶基序包含不同 dna序列,所述dna序列与选自由seq id no:1-139组成的组的dna 序列相比包含至少一个核苷酸错配。在一些实施方案中,每个靶基序包含dna序列,所述dna序列与选自由seq id no:1-139组成的组的dna序列相比包含至少两个核苷酸错配。在一些实施方案中,每个靶基序包含选自由seq id no:140-297组成的组的不同dna序列。在一些实施方案中,每个靶基序包含不同dna序列,所述dna序列与选自
由seq id no:140-297组成的组的dna序列相比包含至少一个核苷酸错配。在一些实施方案中,每个靶基序包含不同dna序列,所述 dna序列与选自由seq id no:140-297组成的组的dna序列相比包含至少两个核苷酸错配。在一些实施方案中,每个靶基序包含选自由 seq id no:304-333组成的组的不同dna序列。在一些实施方案中,每个靶基序包含不同dna序列,所述dna序列与选自由seq id no: 304-333组成的组的dna序列相比包含至少一个核苷酸错配。在一些实施方案中,每个靶基序包含不同dna序列,所述dna序列与选自由seq id no:304-333组成的组的dna序列相比包含至少两个核苷酸错配。
186.在一些实施方案中,在所述靶多核苷酸序列的裂解之后,发生同源介导修复。在一些实施方案中,使用外源引入的dna修复模板进行同源介导修复。在一些实施方案中,外源引入的dna修复模板是单链的。在一些实施方案中,外源引入的dna修复模板是双链的。
187.在一些实施方案中,所述cas蛋白(例如,cas9)与多种核糖核酸复合。在一些实施方案中,选择多种核糖核酸以使得与除靶多核苷酸序列之外的核酸序列的杂交最小化(例如,单个靶多核苷酸序列的多个改变)。在一些实施方案中,选择多种核糖核酸以使得与除靶多核苷酸序列之外的核酸序列的杂交最小化(例如,多个靶多核苷酸序列的一个或多个改变)。在一些实施方案中,所述多种核糖核酸中的每种与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少两个错配。在一些实施方案中,所述多种核糖核酸中的每种与靶基序杂交,所述靶基序当与细胞中的所有其他基因组核苷酸序列相比较时含有至少一个错配。在一些实施方案中,所述多种核糖核酸中的每种被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交。在一些实施方案中,所述多种核糖核酸中的每种被设计成与紧邻由cas蛋白识别的脱氧核糖核酸基序的靶基序杂交,所述靶基序位于定位在所述靶基序之间的突变等位基因侧翼。
188.在一些实施方案中,所述多种核糖核酸中的每种包含选自由图1 的核糖核酸序列组成的组的不同序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由图1的核糖核酸序列组成的组的不同序列具有单个核苷酸错配的序列。在一些实施方案中,所述多种核糖核酸中的每种包含选自由图2的核糖核酸序列组成的组的不同序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由图2的核糖核酸序列组成的组的不同序列具有单个核苷酸错配的序列。在一些实施方案中,所述多种核糖核酸中的每种包含选自由图1的核糖核酸序列和图2的核糖核酸序列组成的组的不同序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由图1的核糖核酸序列和图2的核糖核酸序列组成的组的不同序列具有单个核苷酸错配的序列。
189.在一些实施方案中,所述多种核糖核酸中的每种包含与选自由 seq id no:1-139(图1)组成的组的序列互补和/或杂交的不同核糖核酸序列。在一些实施方案中,所述多种核糖核酸中的每种包含和与选自由seq id no:1-139(图1)组成的组的序列具有单个核苷酸错配的序列互补和/或杂交的不同核糖核酸序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由seq id no:140-297(图2)组成的组的序列互补和/或杂交的不同核糖核酸序列。在一些实施方案中,所述多种核糖核酸中的每种包含和与选自由seq id no:140-297(图2) 组成的组的序列具有单个核苷酸错配的序列互补和/或杂交的不同核糖核酸序列。
190.在一些实施方案中,所述多种核糖核酸中的每种包含选自由seqid no:298-303
的核糖核酸序列组成的组的不同序列。在一些实施方案中,所述多种核糖核酸中的每种包含与选自由seq id no:304-333组成的组的序列互补和/或杂交的不同核糖核酸序列。在一些实施方案中,所述多种核糖核酸中的每种包含和与选自由seq id no:304-333组成的组的序列具有单个核苷酸错配的序列互补和/或杂交的不同核糖核酸序列。
191.应理解,可从质粒表达所述cas蛋白或所述核糖核酸中的任一种。在一些实施方案中,使用经优化以用于在干细胞(例如,人干细胞)中增加表达的启动子表达所述cas蛋白或所述核糖核酸中的任一种。在一些实施方案中,所述启动子选自由以下组成的组:巨细胞病毒(cmv) 早期增强子元件和鸡β-肌动蛋白启动子、鸡β-肌动蛋白启动子、延伸因子-1α启动子以及泛素启动子。
192.在一些实施方案中,本发明的方法还包括选择表达cas蛋白的细胞。本发明考虑用于选择细胞的任何适合的方法。在一些实施方案中,选择细胞包括facs。在一些实施方案中,facs用于选择共表达cas 和荧光蛋白的细胞,所述荧光蛋白选自由绿色荧光蛋白和红色荧光蛋白组成的组。
193.本发明考虑治疗和/或预防与靶多核苷酸序列的表达相关的多种病症。应理解,本文所述的方法和组合物可用于治疗或预防与细胞中靶多核苷酸序列的表达增加以及靶多核苷酸序列的表达降低相关的病症。靶多核苷酸序列的表达增加和降低包括与正常表达和/或活性水平相比,其中所述靶多核苷酸序列的表达水平分别增加或降低的情况,以及其中所述靶多核苷酸序列的表达产物的功能和/或活性水平分别增加或降低的情况。本领域的技术人员将理解,治疗或预防与靶多核苷酸序列的表达增加相关的病症可通过以下方式来评定:在使细胞与本文所述的组合物相接触之后测定相关细胞中所述靶多核苷酸序列(或其表达产物)的水平和/或活性是否降低。熟练的技术人员还将理解,治疗或预防与靶多核苷酸序列的表达降低相关的病症可通过以下方式来评定:在使细胞与本文所述的组合物相接触之后测定相关细胞中所述靶多核苷酸序列(或其表达产物)的水平和/或活性是否增加。
194.在一些实施方案中,所述病症是遗传性病症。在一些实施方案中,所述病症是单基因病症。在一些实施方案中,所述病症是多基因病症。在一些实施方案中,所述病症是与一种或多种snp相关的病症。与一种或多种snp相关的示例性病症包括描述于美国专利号7,627,436中的复杂疾病、描述于pct国际申请公布号wo/2009/112882中的阿尔茨海默氏病、描述于美国专利申请公布号2011/0039918中的炎性疾病、描述于美国专利申请公布号2012/0309642中的多囊卵巢综合征、描述于美国专利号7,732,139中的心血管疾病、描述于美国专利申请公布号 2012/0136039中的亨廷顿氏病、描述于欧洲专利申请公布号ep2535424 中的血栓栓塞病、描述于pct国际申请公布号wo/2012/001613中的神经血管疾病、描述于美国专利申请公布号2010/0292211中的精神病、描述于美国专利申请公布号2011/0319288中的多发性硬化症、描述于 pct国际申请公布号wo/2006/023719a2中的精神分裂症、情感分裂性精神障碍和双相障碍、描述于美国专利申请公布号u.s.2011/0104674 中的双相障碍和其他疾病、描述于pct国际申请公布号 wo/2006/104370a1中的结肠直肠癌、描述于美国专利申请公布号u.s. 2006/0204969中的与邻近akt1基因座的snp相关的病症、描述于pct 国际申请公布号wo/2003/012143a1中的饮食障碍、描述于美国专利申请公布号u.s.2007/0269827中的自身免疫性疾病、描述于美国专利号 7,790,370中的患有克罗
恩氏病的患者中的纤维性狭窄疾病、以及描述于美国专利号8,187,811中的帕金森氏病,其各自以引用的方式整体并入本文。可根据本发明的方法治疗或预防的与一种或多种snp相关的其他病症对于熟练的技术人员将是显而易见的。
195.在一些实施方案中,所述病症是人免疫缺陷病毒(hiv)感染。在一些实施方案中,所述病症是获得性免疫缺陷综合征(aids)。
196.本发明的方法能够改变多种不同细胞中的靶多核苷酸序列。在一些实施方案中,本发明的方法用于离体改变细胞中的靶多核苷酸序列以用于随后引入受试者中。在一些实施方案中,所述细胞是外周血细胞。在一些实施方案中,所述细胞是干细胞或多能细胞。在一些实施方案中,所述细胞是造血干细胞。在一些实施方案中,所述细胞是 cd34 细胞。在一些实施方案中,所述细胞是cd34 流动的外周血细胞。在一些实施方案中,所述细胞是cd34 脐带血细胞。在一些实施方案中,所述细胞是cd34 骨髓细胞。在一些实施方案中,所述细胞是cd34 cd38-谱系-cd90 cd45ra-细胞。在一些实施方案中,所述细胞是cd4 细胞。在一些实施方案中,所述细胞是cd4 t细胞。在一些实施方案中,所述细胞是肝细胞。在一些实施方案中,所述细胞是人多能细胞。在一些实施方案中,所述细胞是原代人细胞。在一些实施方案中,所述细胞是原代cd34 细胞。在一些实施方案中,所述细胞是原代cd34 造血祖细胞(hpc)。在一些实施方案中,所述细胞是原代cd4 细胞。在一些实施方案中,所述细胞是原代cd4 t细胞。在一些实施方案中,所述细胞是自体原代细胞。在一些实施方案中,所述细胞是自体原代体细胞。在一些实施方案中,所述细胞是同种异体原代细胞。在一些实施方案中,所述细胞是同种异体原代体细胞。在一些实施方案中,所述细胞是有核细胞。在一些实施方案中,所述细胞是非转化的细胞。在一些实施方案中,所述细胞不是癌细胞。在一些实施方案中,所述细胞不是肿瘤细胞。在一些实施方案中,所述细胞不是转化的细胞。
197.在一些方面,本发明提供一种改变细胞中的靶多核苷酸序列的方法,所述方法包括使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和一至两种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约8%至约80%。
198.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和一至两种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中所述改变效率是约 8%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
199.在一些方面,本发明提供一种同时改变细胞中的多个靶多核苷酸序列的方法,所述方法包括使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触,其中所述核糖核酸将cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约8%
至约80%。
200.在一些方面,本发明提供一种治疗或预防受试者的与多核苷酸序列的表达相关的病症的方法,所述方法包括(a)通过使选自由人多能细胞、原代人细胞和非转化的人细胞组成的组的细胞中的所述多核苷酸序列与成簇规律间隔的短回文重复序列相关(cas)蛋白质和多种核糖核酸相接触来离体改变细胞中的靶多核苷酸序列,其中所述核糖核酸将 cas蛋白引导至所述靶多核苷酸序列的靶基序并且与所述靶基序杂交,其中所述靶多核苷酸序列被裂解,并且其中表达cas蛋白的细胞的改变效率是约8%至约80%;以及(b)将所述细胞引入所述受试者中,从而治疗或预防与所述多核苷酸序列的表达相关的病症。
201.本发明还提供包含本发明的cas蛋白或其功能部分、编码所述cas 蛋白或其功能部分的核酸以及核糖核酸序列的组合物,所述核糖核酸序列将cas蛋白引导至细胞中的靶多核苷酸的靶基序并且与所述靶基序杂交。
202.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有选自由图1的核糖核酸序列组成的组的序列。在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有与选自由seq id no:1-139(图1)组成的组的序列互补和/或杂交的序列。
203.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸包含与选自由图1的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有和与选自由seq id no:1-139 (图1)组成的组的序列具有单个核苷酸错配的序列互补和/或杂交的序列。
204.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有选自由图2的核糖核酸序列组成的组的序列。在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有与选自由seq id no:140-297(图2)组成的组的序列互补和/ 或杂交的序列。
205.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸包含与选自由图2的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有和与选自由seq id no:140-297 (图2)组成的组的序列具有单个核苷酸错配的序列互补和/或杂交的序列。
206.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有选自由seq id no:298-303的核糖核酸序列组成的组的序列。在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有与选自由seq id no:304-333组成的组的序列互补和/或杂交的序列。在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有与相较于选自由seq id no: 304-333组成的组的序列包含至少一个核苷酸错配的序列互补和/或杂交的序列。在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有选自由以下组成的组的序列:图1的核糖核酸序列、图2的核糖核酸序列、与图1的核糖核酸序列具有单个核苷酸错配的序列以及与图2的核糖核酸序列具有单个核苷酸错配的序列。
207.在一些实施方案中,所述组合物中的核糖核酸中的至少一种是如本文所述的修饰的核糖核酸(例如,合成、修饰的核糖核酸,例如包含一至两个选自由以下组成的组的修饰的核苷酸:假尿苷、5-甲基胞苷、 2-硫代-尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三
磷酸、5,6-二氢尿苷-5
’‑
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸,或本文所述的任何其他修饰的核苷酸或修饰)。
208.在一些实施方案中,本发明的组合物包含编码cas蛋白的核酸序列。在一些实施方案中,本发明的组合物包含编码cas9蛋白或其功能部分的核酸序列。
209.在一些实施方案中,编码所述cas蛋白(例如,cas9)的核酸包含如本文所述的修饰的核糖核酸(例如,本文所述的合成、修饰的mrna,例如包含至少一个选自由以下组成的组的修饰的核苷酸:假尿苷、5
‑ꢀ
甲基胞苷、2-硫代-尿苷、5-甲基尿苷-5
’‑
三磷酸、4-硫代尿苷-5
’‑
三磷酸、 5,6-二氢尿苷-5
’‑
三磷酸以及5-氮杂尿苷-5
’‑
三磷酸,或本文所述的任何其他修饰的核苷酸或修饰)。
210.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一种另外核糖核酸,所述至少一种另外核糖核酸具有选自由图1的核糖核酸序列组成的组的序列。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一种另外核糖核酸,所述至少一种另外核糖核酸具有与选自由seq id no:1-139(图1)组成的组的序列互补和/或杂交的序列。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和两种另外核糖核酸,所述两种另外核糖核酸各自具有与选自由seq id no:1-139 (图1)组成的组的不同序列互补和/或杂交的序列。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和两种另外核糖核酸,所述两种另外核糖核酸各自具有与选自由seq id no:1-139(图1)组成的组的偏移序列互补和/或杂交的序列。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一种另外核糖核酸,所述至少一种另外核糖核酸具有选自由图2的核糖核酸序列组成的组的序列。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一种另外核糖核酸,所述至少一种另外核糖核酸具有与选自由seq id no:140-297(图2)组成的组的序列互补和/或杂交的序列。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和两种另外核糖核酸,所述两种另外核糖核酸各自具有与选自由seq id no: 140-297(图2)组成的组的不同序列互补和/或杂交的序列。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas 蛋白的核糖核酸和两种另外核糖核酸,所述两种另外核糖核酸各自具有与选自由seq id no:140-297(图2)组成的组的偏移序列互补和/或杂交的序列。
211.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一个另外核糖核酸序列,所述至少一个另外核糖核酸序列包含与选自由图1的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一个另外核糖核酸序列,所述至少一个另外核糖核酸序列和与选自由seq id no:1-139(图1)组成的组的序列具有单个核苷酸错配的序列互补和/或杂交。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和两个另外核糖核酸序列,所述两个另外核糖核酸序列各自和与选自由seq id no: 1-139(图1)组成的组的序列具有单个核苷酸错配的不同序列互补和/或杂交。在一些方面,本发明提供一种包含嵌合核
酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和两个另外核糖核酸序列,所述两个另外核糖核酸序列各自和与选自由seq id no:1-139(图1)组成的组的序列具有单个核苷酸错配的偏移序列互补和/或杂交。
212.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一个另外核糖核酸序列,所述至少一个另外核糖核酸序列包含与选自由图2的核糖核酸序列组成的组的序列具有单个核苷酸错配的序列。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一个另外核糖核酸序列,所述至少一个另外核糖核酸序列和与选自由seq id no:140-297(图1)组成的组的序列具有单个核苷酸错配的序列互补和/或杂交。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和两个另外核糖核酸序列,所述两个另外核糖核酸序列各自和与选自由seq idno:140-297(图1)组成的组的序列具有单个核苷酸错配的不同序列互补和/或杂交。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和两个另外核糖核酸序列,所述两个另外核糖核酸序列各自和与选自由seq id no:140-297(图1) 组成的组的序列具有单个核苷酸错配的偏移序列互补和/或杂交。
213.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一种另外核糖核酸,所述至少一种另外核糖核酸具有选自由seq id no:298-303的核糖核酸序列组成的组的序列。
214.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少两种另外核糖核酸,所述至少两种另外核糖核酸具有选自由seq id no:298-303的核糖核酸序列组成的组的序列。
215.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和包含seq id no:299和303的两个引导核糖核酸。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和包含seq id no:298 和300的两个引导核糖核酸。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和包含seqid no:299和300的两个引导核糖核酸。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和包含seq id no:298和303的两个引导核糖核酸。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas 蛋白的核糖核酸和包含seq id no:299和301的两个引导核糖核酸。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和包含seq id no:298和299的两个引导核糖核酸。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和包含seq id no:301和 303的两个引导核糖核酸。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和包含seq idno:298和302的两个引导核糖核酸。在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和包含seq id no:298和301的两个引导核糖核酸。
216.在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有与选自由seq id no:304-333组成的组的序列互补和/或杂交的序列。在一些方面,本发明提供一种包含至少两种核糖核酸的组合物,所述核糖核酸各自具有与选自由seq id no:
304-333组成的组的不同序列互补和/或杂交的序列。在一些方面,本发明提供一种包含至少两种核糖核酸的组合物,所述核糖核酸各自具有与选自由 seq id no:304-333组成的组的偏移序列互补和/或杂交的序列。在一些方面,本发明提供一种包含至少一种核糖核酸的组合物,所述核糖核酸具有与相较于选自由seq id no:304-333组成的组的序列包含至少一个核苷酸错配的序列互补和/或杂交的序列。在一些方面,本发明提供一种包含至少两种核糖核酸的组合物,所述核糖核酸各自具有与相较于选自由seq id no:304-333组成的组的序列包含至少一个核苷酸错配的不同序列互补和/或杂交的序列。在一些方面,本发明提供一种包含至少两种核糖核酸的组合物,所述核糖核酸各自具有与相较于选自由seq id no:304-333组成的组的序列包含至少一个核苷酸错配的偏移序列互补和/或杂交的序列。
217.在一些方面,本发明提供一种包含嵌合核酸的组合物,所述嵌合核酸包含编码cas蛋白的核糖核酸和至少一种另外核糖核酸,所述至少一种另外核糖核酸具有选自由以下组成的组的序列:图1的核糖核酸序列、图2的核糖核酸序列、与图1的核糖核酸序列具有单个核苷酸错配的序列以及与图2的核糖核酸序列具有单个核苷酸错配的序列。
218.在一些实施方案中,本发明的组合物包含编码荧光蛋白的核酸序列,所述荧光蛋白选自由绿色荧光蛋白和红色荧光蛋白组成的组。在一些实施方案中,本发明的组合物包含可操作地连接至所述嵌合核酸的启动子。在一些实施方案中,所述启动子被优化以用于在人干细胞中增加表达。在一些实施方案中,所述启动子被优化以用于在原代人细胞中增加表达。在一些实施方案中,所述启动子选自由以下组成的组:巨细胞病毒(cmv)早期增强子元件和鸡β-肌动蛋白启动子、鸡β
‑ꢀ
肌动蛋白启动子、延伸因子-1α启动子以及泛素启动子。
219.在一些实施方案中,所述cas蛋白包含cas9蛋白或其功能部分。
220.本发明还提供用于实践本发明的任何方法的试剂盒,以及包括本发明的组合物和用于使用所述试剂盒改变细胞中的靶多核苷酸序列的说明书的试剂盒。
221.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及选自由以下组成的组的至少一个核糖核酸序列:图1的核糖核酸序列、图2的核糖核酸序列、与图1的核糖核酸序列具有单个核苷酸错配的序列以及与图2的核糖核酸序列具有单个核苷酸错配的序列。
222.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少一个选自由seq id no:1-139(图1)的核糖核酸序列组成的组的核糖核酸序列。
223.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少一个核糖核酸序列,所述核糖核酸序列与选自由seq id no:1-139 (图1)组成的组的序列互补和/或杂交。
224.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少一个核糖核酸序列,所述核糖核酸序列和包含与选自由seq idno:1-139(图1)组成的组的序列的至少一个核苷酸错配的序列互补和/ 或杂交。
225.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个选自由seq id no:1-139(图1)
的核糖核酸序列组成的组的核糖核酸序列。
226.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自与选自由seq id no: 1-139(图1)组成的组的不同序列互补和/或杂交。
227.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自与选自由seq id no: 1-139(图1)组成的组的偏移序列互补和/或杂交。
228.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自和包含与选自由seqid no:1-139(图1)组成的组的序列的至少一个核苷酸错配的不同序列互补和/或杂交。
229.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自和包含与选自由seqid no:1-139(图1)组成的组的序列的至少一个核苷酸错配的偏移序列互补和/或杂交。
230.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少一个选自由seq id no:140-297(图2)的核糖核酸序列组成的组的核糖核酸序列。
231.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少一个核糖核酸序列,所述核糖核酸序列与选自由seq id no: 140-297(图2)组成的组的序列互补和/或杂交。
232.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少一个核糖核酸序列,所述核糖核酸序列和包含与选自由seq idno:140-297(图2)组成的组的序列的至少一个核苷酸错配的序列互补和/或杂交。
233.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个选自由seq id no:140-297(图2)的核糖核酸序列组成的组的核糖核酸序列。
234.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自与选自由seq id no: 140-297(图2)组成的组的不同序列互补和/或杂交。
235.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自与选自由seq id no: 140-297(图2)组成的组的偏移序列互补和/或杂交。
236.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自和包含与选自由seqid no:140-297(图2)组成的组的序列的至少一个核苷酸错配的不同序列互补和/或杂交。
237.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂
盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自和包含与选自由seqid no:140-297(图2)组成的组的序列的至少一个核苷酸错配的偏移序列互补和/或杂交。
238.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个选自由seq id no:298-303的核糖核酸序列组成的组的核糖核酸序列。在一些实施方案中,seq id no:298-303的至少两个核糖核酸序列与偏移靶序列互补和/或杂交。
239.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自与选自由seq id no: 304-333组成的组的不同序列互补和/或杂交。
240.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自与选自由seq id no: 304-333组成的组的偏移序列互补和/或杂交。
241.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自和包含与选自由seqid no:304-333组成的组的序列的至少一个核苷酸错配的不同序列互补和/或杂交。
242.在一些方面,本发明包括一种改变细胞中的靶多核苷酸序列的试剂盒,所述试剂盒包括cas9蛋白或编码所述cas9蛋白的核酸,以及至少两个核糖核酸序列,所述核糖核酸序列各自和包含与选自由seqid no:304-333组成的组的序列的至少一个核苷酸错配的偏移序列互补和/或杂交。
243.在一些实施方案中,所述试剂盒包括选自由以下组成的组的一种或多种细胞系、培养物或群体:人多能细胞、原代人细胞和非转化的细胞。在一些实施方案中,所述试剂盒包括dna修复模板。
244.在一些方面,本发明提供一种将细胞施用至需要这类细胞的受试者的方法,所述方法包括:(a)使细胞或细胞群体与cas蛋白和两种核糖核酸离体相接触,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述靶多核苷酸序列被裂解;以及(b)将来自(a)的所得到的细胞施用至需要这类细胞的受试者。
245.在一些方面,本发明提供一种将细胞施用至需要这类细胞的受试者的方法,所述方法包括:(a)使细胞或细胞群体与以下各项离体相接触:(i)cas蛋白;(ii)至少两种核糖核酸,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m的靶多核苷酸序列并且与所述靶多核苷酸序列杂交;以及(iii)至少两种另外核糖核酸,所述另外核糖核酸将cas蛋白引导至所述细胞或细胞群体中的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述靶多核苷酸序列被裂解;以及(b) 将来自(a)的所得到的一种或多种细胞施用至需要这类细胞的受试者。
246.b2m是mhc i类蛋白的辅助链,所述辅助链对于细胞表面上的 mhc i类蛋白的表达来说是必要的。据信缺乏表面mhc i类的工程化的细胞(例如,突变细胞)可降低当将所述工程化的细胞施用至宿主时,所述工程化的细胞将由细胞毒性t细胞检测到的可能性。因此,
在一些实施方案中,所述细胞或细胞群体中编码b2m的靶多核苷酸序列的裂解降低当将所得到的一种或多种细胞施用至受试者时所述细胞将触发宿主免疫应答的可能性。
247.在一些方面,本发明提供一种降低施用至受试者的细胞将在所述受试者中触发宿主免疫应答的可能性的方法,所述方法包括:(a)使细胞或细胞群体与cas蛋白和两种核糖核酸离体相接触,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述编码b2m的靶多核苷酸序列被裂解,从而降低施用至所述受试者的细胞将在所述受试者中触发宿主免疫应答的可能性;以及(b)将来自(a)的所得到的细胞施用至需要这类细胞的受试者。
248.在一些方面,本发明提供一种降低施用至受试者的细胞将在所述受试者中触发宿主免疫应答的可能性的方法,所述方法包括:(a)使细胞或细胞群体与以下各项离体相接触:(i)cas蛋白;(ii)至少两种核糖核酸,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m 的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述细胞或细胞群体中所述编码b2m的靶多核苷酸序列被裂解,从而降低所述细胞或细胞群体将在所述受试者中触发宿主免疫应答的可能性;以及(iii) 至少两种另外核糖核酸,所述另外核糖核酸将cas蛋白引导至所述细胞或细胞群体中的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述靶多核苷酸序列被裂解;以及(b)将来自(a)的所得到的一种或多种细胞施用至需要这类细胞的受试者。
249.考虑施用细胞的方法可被适配用于任何目的,其中施用这类细胞是合乎需要的。在一些实施方案中,需要施用细胞的受试者正患有病症。例如,所述受试者可患有其中特定细胞在功能或数目方面降低的病症,并且可能合乎需要的是施用从健康或正常个体获得的功能细胞 (其中所述特定细胞正确地起作用)并且将足够数目的那些健康细胞施用至所述个体以恢复由那些细胞(例如,在细胞数目或功能方面降低的产生激素的细胞,在细胞数目或功能方面降低的免疫细胞等)提供的功能。在这类实例中,健康细胞可被工程化以降低健康细胞的宿主排斥的可能性。在一些实施方案中,所述病症包括遗传性病症。在一些实施方案中,所述病症包括感染。在一些实施方案中,所述病症包括hiv 或aids。在一些实施方案中,所述病症包括癌症。
250.在一些方面,本发明提供一种降低施用至受试者的细胞将在所述受试者中触发宿主免疫应答的可能性的方法,所述方法包括:(a)使细胞或细胞群体与cas蛋白和两种核糖核酸离体相接触,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述编码b2m的靶多核苷酸序列被裂解,从而降低施用至所述受试者的细胞将在所述受试者中触发宿主免疫应答的可能性;以及(b)将来自(a)的所得到的细胞施用至需要这类细胞的受试者。
251.在一些方面,本发明提供一种降低施用至受试者的细胞将在所述受试者中触发宿主免疫应答的可能性的方法,所述方法包括:(a)使细胞或细胞群体与以下各项离体相接触:(i)cas蛋白;(ii)至少两种核糖核酸,所述核糖核酸将cas蛋白引导至所述细胞或细胞群体中编码b2m 的靶多核苷酸序列并且与所述靶多核苷酸序列杂交,其中所述细胞或细胞群体中所述编码b2m的靶多核苷酸序列被裂解,从而降低所述细胞或细胞群体将在所述受试者中触发宿主免疫应答的可能性;以及(iii) 至少两种另外核糖核酸,所述另外核糖核酸将cas蛋白引导至所述细胞或细胞群体中的靶多核苷酸序列并且与所述靶多核苷酸序列
78,1994;fukuhara等biochemistry 1(4): 563-568,1962;以及xu等.tetrahedron 48(9):1729-1740,1992,所述文献各自以引用的方式整体并入。
256.修饰的核酸(例如,核糖核酸)不必是沿分子的整个长度均匀修饰的。不同核苷酸修饰和/或主链结构可存在于核酸中的不同位置处。本领域的普通技术人员将了解核苷酸类似物或其他修饰可位于核酸的任何位置处,以使得所述核酸的功能大致上不被减少。修饰还可以是5
′
或3
′
末端修饰。所述核酸可包含至少一个且最多100%修饰的核苷酸,或任何中间百分比,如至少50%修饰的核苷酸、至少80%修饰的核苷酸或至少90%修饰的核苷酸。
257.在一些实施方案中,所述一至两种核糖核酸中的至少一种是修饰的核糖核酸。在一些实施方案中,所述一至两种核糖核酸各自是修饰的核糖核酸。在一些实施方案中,所述多种核糖核酸中的至少一种是修饰的核糖核酸。在一些实施方案中,所述多种核糖核酸中的多种是修饰的。在一些实施方案中,所述多种核糖核酸中的每种是修饰的。本领域的技术人员将理解修饰的核糖核酸可包括本文所述的一个或多个核酸修饰。
258.在一些方面,本文提供编码多肽的合成、修饰的rna分子,其中所述合成修饰的rna分子包含一个或多个修饰,以使得将所述合成修饰的rna分子引入细胞导致相对于与不包含所述一个或多个修饰的编码多肽的合成rna分子相接触的细胞减少的先天性免疫应答。在一些实施方案中,所述cas蛋白包含编码cas蛋白的合成、修饰的rna分子。在一些实施方案中,所述cas蛋白包含编码cas9蛋白的合成、修饰的rna分子。
259.本文所述的合成、修饰的rna包括修饰以防止由核酸内切酶和核酸外切酶快速降解并且避免或减少所述细胞对rna的先天性免疫或干扰素应答。修饰包括但不限于,例如(a)末端修饰,例如5
′
端修饰(磷酸化、脱磷酸化、缀合、反向键联等)、3
′
端修饰(缀合、dna核苷酸、反向键联等);(b)碱基修饰,例如用修饰的碱基、稳定化的碱基、脱稳定的碱基或与配偶体的扩增谱系碱基配对的碱基、或缀合的碱基替代;(c) 糖修饰(例如,在2
′
位置或4
′
位置处)或替代糖,以及(d)核苷间键联修饰,包括磷酸二酯键联的修饰或替代。在这类修饰干扰翻译(即,相对于缺乏修饰,导致翻译的50%或更多减少—例如,在兔网织红细胞体外翻译测定中)的程度上,修饰不适合用于本文所述的方法和组合物。适用于本文所述的方法的合成、修饰的rna组合物的具体实例包括但不限于,含有修饰的或非天然核苷间键联的rna分子。具有修饰的核苷间键联的合成、修饰的rna尤其包括在核苷间键联中不具有磷原子的那些。在其他实施方案中,所述合成、修饰的rna在其核苷间键联中具有磷原子。
260.修饰的核苷间键联的非限制性实例包括,硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基和其他烷基膦酸酯(包括3'-亚烷基膦酸酯和手性膦酸酯)、亚膦酸酯、磷酰胺酯(包括3'-氨基磷酰胺酯和氨基烷基磷酰胺酯)、硫羰基磷酰胺酯、硫羰基烷基膦酸酯、硫羰基烷基磷酸三酯,以及具有正常3'-5'键联、这些的2'-5'连接类似物的硼烷磷酸酯,以及具有其中相邻成对的核苷单元是3'-5'至5'-3'或2'-5'至5'-2'连接的反转极性的那些核苷间键联。还包括各种盐、混合盐以及游离酸形式。
261.教导制备以上含磷键联的代表性美国专利包括但不限于,美国专利号3,687,808;4,469,863;4,476,301;5,023,243;5,177,195;5,188,897; 5,264,423;5,276,019;5,278,302;5,286,717;5,321,131;5,399,676; 5,405,939;5,453,496;5,455,233;5,466,677;5,476,925;5,519,126; 5,536,821;5,541,316;5,550,111;5,563,253;5,571,799;5,587,361; 5,625,050;6,028,188;6,124,445;6,160,109;6,169,170;6,172,209; 6,239,265;
5'连接型寡核苷酸中的糖的 3'位置和5'端核苷酸的5'位置。合成、修饰的rna还可具有替代戊呋喃糖基糖的糖模拟物,如环丁基部分。教导此类修饰的糖结构的制备的代表性美国专利包括但不限于,美国专利号4,981,957;5,118,800; 5,319,080;5,359,044;5,393,878;5,446,137;5,466,786;5,514,785; 5,519,134;5,567,811;5,576,427;5,591,722;5,597,909;5,610,300; 5,627,053;5,639,873;5,646,265;5,658,873;5,670,633;以及5,700,920,所述美国专利中的某些与本专利共同地拥有,所述美国专利各自以引用的方式整体并入本文。
267.作为非限制性实例,本文所述的合成、修饰的rna可包含至少一个修饰的核苷,包括2
′‑
o-甲基修饰的核苷、包含5
′
硫代磷酸酯基团的核苷、2
′‑
氨基修饰的核苷、2
′‑
烷基修饰的核苷、吗啉代核苷、氨基磷酰胺酯或包含核苷的非天然碱基或其任何组合。
268.在此方面以及本文所述的所有其他此类方面的一些实施方案中,所述至少一个修饰的核苷选自由以下组成的组:5-甲基胞苷(5mc)、n6
‑ꢀ
甲基腺苷(m6a)、3,2
′‑
o-二甲基尿苷(m4u)、2-硫代尿苷(s2u)、2
′
氟尿苷、假尿苷、2
′‑
o-甲基尿苷(um)、2
′
脱氧尿苷(2
′
du)、4-硫代尿苷(s4u)、 5-甲基尿苷(m5u)、2
′‑
o-甲基腺苷(m6a)、n6,2
′‑
o-二甲基腺苷(m6am)、 n6,n6,2
′‑
o-三甲基腺苷(m62am)、2
′‑
o-甲基胞苷(cm)、7-甲基鸟苷 (m7g)、2
′‑
o-甲基鸟苷(gm)、n2,7-二甲基鸟苷(m2,7g)、n2,n2,7-三甲基鸟苷(m2,2,7g)以及肌苷(i)。
269.或者,合成、修饰的rna可包含至少两个修饰的核苷,至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少15个、至少20个或更多个,直至核苷酸的整个长度。在最低限度,包含至少一个修饰的核苷的合成、修饰的rna分子包含具有如本文所述的修饰的单一核苷。不必在给定合成、修饰的rna中的所有位置上均一修饰,并且实际上可将多于一个上述修饰并入单一合成、修饰的rna中或者甚至并入合成、修饰的rna内的单一核苷中。然而,优选地但不是绝对必要的,分子中的给定核苷的每次出现均是修饰的(例如,每个胞嘧啶是修饰的胞嘧啶,例如5mc)。然而,还考虑在给定合成、修饰的rna分子中同一核苷的不同出现可以不同方式进行修饰(例如,一些胞嘧啶被修饰为5mc,其他胞嘧啶被修饰为 2
′‑
o-甲基胞苷或其他胞嘧啶类似物)。所述修饰不必是对于合成、修饰的rna中的多个修饰的核苷中每个来说相同的。此外,在本文所述的方面的一些实施方案中,合成、修饰的rna包含至少两个不同修饰的核苷。在本文所述的方面的一些此类优选实施方案中,所述至少两个不同修饰的核苷是5-甲基胞苷和假尿苷。合成、修饰的rna还可包含修饰的核苷和未修饰的核苷两者的混合物。
270.如本文所用,“未修饰的”或“天然的”核苷或核碱基包括嘌呤碱基腺嘌呤(a)和鸟嘌呤(g),以及嘧啶碱基胸腺嘧啶(t)、胞嘧啶(c)和尿嘧啶(u)。在一些实施方案中,合成、修饰的rna包含至少一个核苷(“碱基”)修饰或取代。修饰的核苷包括其他合成和天然的核碱基,如肌苷、黄嘌呤、次黄嘌呤、水粉蕈素(nubularine)、异鸟苷(isoguanisine)、杀结核菌素(tubercidine)、2-(卤代)腺嘌呤、2-(烷基)腺嘌呤、2-(丙基)腺嘌呤、 2(氨基)腺嘌呤、2-(氨基烷基)腺嘌呤、2(氨基丙基)腺嘌呤、2(甲硫基) n6(异戊烯基)腺嘌呤、6(烷基)腺嘌呤、6(甲基)腺嘌呤、7(脱氮)腺嘌呤、8(烯基)腺嘌呤、8-(烷基)腺嘌呤、8(炔基)腺嘌呤、8(氨基)腺嘌呤、 8-(卤代)腺嘌呤、8-(羟基)腺嘌呤、8(硫代烷基)腺嘌呤、8-(硫醇)腺嘌呤、n6-(异戊基)腺嘌呤、n6(甲基)腺嘌呤、n6,n6(二甲基)腺嘌呤、 2-(烷基)鸟嘌呤、2(丙基)鸟嘌呤、6-(烷基)鸟嘌呤、6(甲基)鸟嘌呤、7(烷基)鸟嘌呤、7(甲基)鸟嘌呤、7(脱氮)鸟嘌
呤、8(烷基)鸟嘌呤、8-(烯基) 鸟嘌呤、8(炔基)鸟嘌呤、8-(氨基)鸟嘌呤、8(卤代)鸟嘌呤、8-(羟基) 鸟嘌呤、8(硫代烷基)鸟嘌呤、8-(硫醇)鸟嘌呤、n(甲基)鸟嘌呤、2-(硫代)胞嘧啶、3(脱氮)5(氮杂)胞嘧啶、3-(烷基)胞嘧啶、3(甲基)胞嘧啶、 5-(烷基)胞嘧啶、5-(炔基)胞嘧啶、5(卤代)胞嘧啶、5(甲基)胞嘧啶、5(丙炔基)胞嘧啶、5(丙炔基)胞嘧啶、5(三氟甲基)胞嘧啶、6-(偶氮)胞嘧啶、 n4(乙酰基)胞嘧啶、3(3氨基-3羧丙基)尿嘧啶、2-(硫代)尿嘧啶、5(甲基)2(硫代)尿嘧啶、5(甲基氨基甲基)-2(硫代)尿嘧啶、4-(硫代)尿嘧啶、 5(甲基)4(硫代)尿嘧啶、5(甲基氨基甲基)-4(硫代)尿嘧啶、5(甲基)2,4 (二硫代)尿嘧啶、5(甲基氨基甲基)-2,4(二硫代)尿嘧啶、5(2-氨基丙基) 尿嘧啶、5-(烷基)尿嘧啶、5-(炔基)尿嘧啶、5-(烯丙基氨基)尿嘧啶、5(氨基烯丙基)尿嘧啶、5(氨基烷基)尿嘧啶、5(胍烷基)尿嘧啶、5(1,3-二唑
ꢀ‑
1-烷基)尿嘧啶、5-(氰基烷基)尿嘧啶、5-(二烷基氨基烷基)尿嘧啶、5(二甲基氨基烷基)尿嘧啶、5-(卤代)尿嘧啶、5-(甲氧基)尿嘧啶、尿嘧啶-5 氧乙酸、5(甲氧基羰基甲基)-2-(硫代)尿嘧啶、5(甲氧基羰基-甲基)尿嘧啶、5(丙炔基)尿嘧啶、5(丙炔基)尿嘧啶、5(三氟甲基)尿嘧啶、6(偶氮)尿嘧啶、二氢尿嘧啶、n3(甲基)尿嘧啶、5-尿嘧啶(即,假尿嘧啶)、 2(硫代)假尿嘧啶、4(硫代)假尿嘧啶、2,4-(二硫代)假尿嘧啶、5-(烷基) 假尿嘧啶、5-(甲基)假尿嘧啶、5-(烷基)-2-(硫代)假尿嘧啶、5-(甲基)-2-(硫代)假尿嘧啶、5-(烷基)-4(硫代)假尿嘧啶、5-(甲基)-4(硫代) 假尿嘧啶、5-(烷基)-2,4(二硫代)假尿嘧啶、5-(甲基)-2,4(二硫代)假尿嘧啶、1取代的假尿嘧啶、1取代的2(硫代)-假尿嘧啶、1取代的4(硫代)假尿嘧啶、1取代的2,4-(二硫代)假尿嘧啶、1(氨基羰基乙烯基)-假尿嘧啶、1(氨基羰基乙烯基)-2(硫代)-假尿嘧啶、1(氨基羰基乙烯基)-4 (硫代)假尿嘧啶、1(氨基羰基乙烯基)-2,4-(二硫代)假尿嘧啶、1(氨基烷基氨基羰基乙烯基)-假尿嘧啶、1(氨基烷基氨基-羰基乙烯基)-2(硫代)
‑ꢀ
假尿嘧啶、1(氨基烷基氨基羰基乙烯基)-4(硫代)假尿嘧啶、1(氨基烷基氨基羰基乙烯基)-2,4-(二硫代)假尿嘧啶、1,3-(二氮杂)-2-(氧代)-吩噁嗪-1-基、1-(氮杂)-2-(硫代)-3-(氮杂)-吩噁嗪-1-基、1,3-(二氮杂)-2-(氧代)
‑ꢀ
吩噻嗪-1-基、1-(氮杂)-2-(硫代)-3-(氮杂)-吩噻嗪-1-基、7-取代的1,3-(二氮杂)-2-(氧代)-吩噁嗪-1-基、7-取代的1-(氮杂)-2-(硫代)-3-(氮杂)-吩噁嗪-1-基、7-取代的1,3-(二氮杂)-2-(氧代)-吩噻嗪-1-基、7-取代的1-(氮杂)-2-(硫代)-3-(氮杂)-吩噻嗪-1-基、7-(氨基烷基羟基)-1,3-(二氮杂)-2-(氧代)-吩噁嗪-1-基、7-(氨基烷基羟基)-1-(氮杂)-2-(硫代)-3-(氮杂)-吩噁嗪-1-基、7-(氨基烷基羟基)-1,3-(二氮杂)-2-(氧代)-吩噻嗪-1-基、 7-(氨基烷基羟基)-1-(氮杂)-2-(硫代)-3-(氮杂)-吩噻嗪-1-基、7-(胍烷基羟基)-1,3-(二氮杂)-2-(氧代)-吩噁嗪-1-基、7-(胍烷基羟基)-1-(氮杂)-2-(硫代)-3-(氮杂)-吩噁嗪-1-基、7-(胍烷基羟基)-1,3-(二氮杂)-2-(氧代)-吩噻嗪-1-基、7-(胍烷基羟基)-1-(氮杂)-2-(硫代)-3-(氮杂)-吩噻嗪-1-基、 1,3,5-(三氮杂)-2,6-(二氧杂)-萘、肌苷、黄嘌呤、次黄嘌呤、水粉蕈素、杀结核菌素、异鸟苷、肌苷基、2-氮杂-肌苷基、7-脱氮-肌苷基、硝基咪唑基、硝基吡唑基、硝基苯并咪唑基、硝基吲唑基、氨基吲哚基、吡咯并嘧啶基、3-(甲基)异喹诺酮基、5-(甲基)异喹诺酮基、3-(甲基)-7-(丙炔基)异喹诺酮基、7-(氮杂)吲哚基、6-(甲基)-7-(氮杂)吲哚基、咪唑并吡啶基、9-(甲基)-咪唑并吡啶基、吡咯并吡嗪基、异喹诺酮基、 7-(丙炔基)异喹诺酮基、丙炔基-7-(氮杂)吲哚基、2,4,5-(三甲基)苯基、 4-(甲基)吲哚基、4,6-(二甲基)吲哚基、苯基、萘基、蒽基、菲基、芘基、芪基、并四苯基(tetracenyl)、并五苯基(pentacenyl)、二氟甲苯基、 4-(氟)-6-(甲基)苯并咪唑、4-(甲基)苯并咪唑、6-(偶
氮)胸腺嘧啶、2-吡啶酮、5硝基吲哚、3硝基吡咯、6-(氮杂)嘧啶、2(氨基)嘌呤、2,6-(二氨基)嘌呤、5取代的嘧啶、n2-取代的嘌呤、n6-取代的嘌呤、06-取代的嘌呤、取代的1,2,4-三唑、吡咯并-嘧啶-2-酮-3-基、6-苯基-吡咯并
‑ꢀ
嘧啶-2-酮-3-基、对位-取代的-6-苯基-吡咯并-嘧啶-2-酮-3-基、邻位-取代的-6-苯基-吡咯并-嘧啶-2-酮-3-基、双-邻位-取代的-6-苯基-吡咯并
‑ꢀ
嘧啶-2-酮-3-基、对-(氨基烷基羟基)-6-苯基-吡咯并-嘧啶-2-酮-3-基、邻
ꢀ‑
(氨基烷基羟基)-6-苯基-吡咯并-嘧啶-2-酮-3-基、双-邻-(氨基烷基羟基)-6-苯基-吡咯并-嘧啶-2-酮-3-基、吡啶并嘧啶-3-基、2-氧代-7-氨基
‑ꢀ
吡啶并嘧啶-3-基、2-氧代-吡啶并嘧啶-3-基、或其任何o-烷基化的或 n-烷基化的衍生物。修饰的核苷还包括包含缀合部分(例如,配体)的天然碱基。如本文以上所讨论,含有修饰的核苷的rna必须是在宿主细胞中可翻译的(即,不会阻止由修饰的rna编码的多肽的翻译)。例如,含有s2u和m6a的转录物在兔网织红细胞溶解产物中较差翻译,而假尿苷、m5u和m5c是与有效翻译相容的。此外,本领域中已知适用于增加转录物的核酸酶抗性的2
′‑
氟-修饰的碱基导致非常低效的翻译。翻译可由本领域中的普通技术人员使用例如兔网织红细胞溶解产物翻译测定来测定。
271.其他修饰的核碱基包括公开于美国专利号3,687,808中的那些;公开于modified nucleosides in biochemistry,biotechnology and medicine, herdewijn,p.编辑wiley-vch,2008中的那些;公开于2009年3月26 日提交的国际申请号pct/us09/038,425中的那些;公开于the conciseencyclopedia of polymer science and engineering,第858-859页, kroschwitz,j.l,编辑john wiley&sons,1990中的那些;以及由 englisch等,angewandte chemie,international edition,1991,30,613公开的那些。
272.教导某些以上指示的修饰的核碱基以及其他修饰的核碱基的制备的代表性美国专利包括但不限于以上指示的美国专利号3,687,808以及美国专利号4,845,205;5,130,30;5,134,066;5,175,273;5,367,066;5,432,272;5,457,187;5,457,191;5,459,255;5,484,908;5,502,177; 5,525,711;5,552,540;5,587,469;5,594,121,5,596,091;5,614,617; 5,681,941;6,015,886;6,147,200;6,166,197;6,222,025;6,235,887;6,380,368;6,528,640;6,639,062;6,617,438;7,045,610;7,427,672;以及7,495,088,其各自以引用的方式整体并入本文,以及美国专利号 5,750,692,其也以引用的方式整体并入本文。
273.用于与本文所述的合成、修饰的rna一起使用的另一修饰涉及使所述rna化学连接于一个或多个增强所述rna的活性、细胞分布或细胞摄取的配体、部分或缀合物。本文所述的合成、修饰的rna还可包含5
′
帽。在本文所述方面的一些实施方案中,所述合成、修饰的rna 包含5
′
帽,所述5
′
帽包含使用5
′‑5′
三磷酸键联连接至rna分子的5
′
端的修饰的鸟嘌呤核苷酸。如本文所用,术语“5
′
帽”还意图涵盖其他5
′
帽类似物,包括例如,5
′
二鸟苷帽、具有亚甲基-双(膦酸酯)部分的四磷酸帽类似物(参见例如,rydzik,a m等,(2009)org biomol chem 7(22):4763-76)、具有硫代磷酸酯修饰的二核苷酸帽类似物(参见例如, kowalska,j.等,(2008)rna 14(6):1119-1131)、具有针对非桥接氧的硫取代的帽类似物(参见例如,grudzien-nogalska,e.等,(2007)rna 13(10):1745-1755)、n7-苄基化的二核苷四磷酸类似物(参见例如, grudzien,e.等,(2004)rna 10(9):1479-1487)、或抗反向帽类似物(参见例如,jemielity,j.等,(2003)rna 9(9):1108-1122和stepinski,j.等, (2001)rna 7(10):1486-1495)。在一个这种实施方案中,所述5
′
帽类似物是5
′
二鸟苷帽。在一些实施方案中,所述合成、修饰的rna不包含 5
′
三磷酸。
274.所述5
′
帽对于mrna识别和连接至核糖体以起始翻译来说是重要的。所述5
′
帽还保护所述合成、修饰的rna免于5
′
核酸外切酶介导的降解。合成、修饰的rna包含5
′
帽不是绝对要求,并且因此在其他实施方案中所述合成、修饰的rna缺乏5
′
帽。然而,由于包含5
′
帽的合成、修饰的rna的较长半衰期和提高的翻译效率,所以包含5
′
帽的合成、修饰的rna在本文中是优选的。
275.本文所述的合成、修饰的rna还可包含5
′
和/或3
′
非翻译区(utr)。非翻译区是在起始密码子(5
′
)之前和终止密码子(3
′
)之后的rna区,并且因此未由翻译机器翻译。具有一个或多个非翻译区的rna分子的修饰可提高mrna的稳定性,因为非翻译区可干扰核糖核酸酶和参与 rna降解的其他蛋白质。此外,具有5
′
和/或3
′
非翻译区的rna的修饰可通过结合改变核糖体与mrna的结合的蛋白质来提高翻译效率。具有3
′
utr的rna的修饰可用于维持rna的细胞质定位,从而允许翻译在细胞的细胞质中发生。在一个实施方案中,本文所述的合成、修饰的rna不包含5
′
或3
′
utr。在另一个实施方案中,所述合成、修饰的rna包含5
′
或3
′
utr。在另一个实施方案中,本文所述的合成、修饰的rna包含5
′
和3
′
utr两者。在一个实施方案中,所述5
′
和/或 3
′
utr选自已知在细胞中具有高稳定性的mrna(例如,鼠α-珠蛋白3
′ꢀ
utr)。在一些实施方案中,所述5
′
utr、所述3
′
utr或两者包含一个或多个修饰的核苷。
276.在一些实施方案中,本文所述的合成、修饰的rna还包含kozak 序列。“kozak序列”是指在真核mrna上具有共有(gcc)gccrccaugg 的序列,其中r是在起始密码子(aug)的上游三个碱基处的嘌呤(腺嘌呤或鸟嘌呤),其之后是另一个“g”。所述kozak共有序列由核糖体识别以起始多肽的翻译。通常,起始在由翻译机器遇到的第一个aug密码子处发生,所述密码子邻近转录物的5
′
端。然而,在一些情况下,此aug密码子可在被称为漏扫描(leaky scanning)的过程中被绕过。接近aug密码子的kozak序列的存在将增强所述密码子作为翻译的起始位点,以使得发生正确多肽的翻译。此外,将kozak序列添加至合成、修饰的rna将促进更有效的翻译,即使不存在关于起始密码子的模糊性。因此,在一些实施方案中,本文所述的合成、修饰的rna还包含在用于起始翻译的所需位点处的kozak共有序列以产生正确长度多肽。在一些此类实施方案中,所述kozak序列包含一个或多个修饰的核苷。
277.在一些实施方案中,本文所述的合成、修饰的rna还包含“聚(a) 尾”,所述聚(a)尾是指腺嘌呤核苷酸的3
′
同聚物尾部,其可在长度上变化(例如,至少5个腺嘌呤核苷酸)并且可达数百个腺嘌呤核苷酸)。包含3
′
聚(a)尾可保护合成、修饰的rna免于在细胞中降解,并且还有助于核外定位以提高翻译效率。在一些实施方案中,所述聚(a)尾包含 1与500个之间的腺嘌呤核苷酸;在其他实施方案中所述聚(a)尾包含至少5个、至少10个、至少20个、至少30个、至少40个、至少50 个、至少60个、至少70个、至少80个、至少90个、至少100个、至少110个、至少120个、至少130个、至少140个、至少150个、至少160个、至少170个、至少180个、至少190个、至少200个、至少225个、至少250个、至少275个、至少300个、至少325个、至少350个、至少375个、至少400个、至少425个、至少450个、至少475个、至少500个腺嘌呤核苷酸或更多。在一个实施方案中,所述聚(a)尾包含1与150个之间的腺嘌呤核苷酸。在另一个实施方案中,所述聚(a)尾包含90与120个之间的腺嘌呤核苷酸。在一些此类实施方案中,所述聚(a)尾包含一个或多个修饰的核苷。
278.考虑对本文所述的合成、修饰的rna进行的一种或多种修饰允许所述合成、修饰的rna在细胞中的更大稳定性。在这类修饰允许翻译并且减少或不会加剧细胞对具有修饰的
合成、修饰的rna的先天性免疫或干扰素应答的程度上,这类修饰被具体地考虑用于在本文中使用。通常,合成、修饰的rna的稳定性越大,可从所述合成、修饰的rna 产生的蛋白质越多。通常,哺乳动物mrna中富含au区的存在倾向于使转录物不稳定,因为细胞蛋白被募集至富含au区以刺激所述转录物的聚(a)尾的除去。合成、修饰的rna的聚(a)尾的损失可导致增加的rna降解。因此,在一个实施方案中,如本文所述的合成、修饰的 rna不包含富含au区。具体地说,优选3
′
utr基本上缺乏auuua 序列元件。
279.在一个实施方案中,配体改变其所并入的合成、修饰的rna的细胞摄取、细胞内靶向或半衰期。在一些实施方案中,配体提供例如像与不存在这种配体的组合物相比,针对选定靶标(例如,分子、细胞或细胞类型)、细胞内区室(例如,线粒体、细胞质、过氧化物酶体、溶酶体)的增强的亲和力。优选的配体不会干扰从所述合成、修饰的rna 表达多肽。
280.所述配体可以是能够增加所述合成、修饰的rna或其组合物例如通过破坏细胞的微管、微丝和/或中间丝来摄取至细胞中的物质(例如,药物)。所述药物可以是例如,紫杉醇、长春新碱、长春花碱、细胞松弛素、诺考达唑、促微丝聚合剂(japlakinolide)、红海海绵素a、鬼笔环肽、swinholidea、印丹诺辛(indanocine)或肌基质蛋白(myoservin)。
281.另一方面,所述配体是由宿主细胞摄取的部分,例如维生素。示例性维生素包括维生素a、e和k。其他示例性维生素包括b族维生素,例如叶酸、b12、核黄素、生物素、吡哆醛或例如由癌细胞摄取的其他维生素或营养素。还包括hsa和低密度脂蛋白(ldl)。
282.另一方面,所述配体是细胞渗透剂,优选螺旋型细胞渗透剂。优选地,所述试剂是两亲性的。示例性试剂是肽如tat或果蝇触足肽 (antennopedia)。如果所述试剂是肽,则其可被修饰,包括肽基模拟物、反转异构体(invertomer)、非肽或假肽键联以及使用d-氨基酸。所述螺旋型试剂优选地是α-螺旋试剂,其优选地具有亲脂和疏脂相。
[0283]“细胞渗透肽”能够渗透细胞,例如微生物细胞,如细菌或真菌细胞;或哺乳动物细胞,如人细胞。微生物细胞渗透肽可以是例如,α
‑ꢀ
螺旋线性肽(例如,ll-37或天蚕素(ceropin)p1)、含二硫键的肽(例如,α-防御素、β-防御素或杀细菌素(bactenecin))或仅含有一种或两种主要氨基酸的肽(例如,pr-39或牛抗菌肽(indolicidin))。例如,细胞渗透肽可以是二分两亲性肽,如mpg,其源自hiv-1gp41的融合肽结构域和的sv40大t抗原的nls(simeoni等,nucl.acids res.31:2717-2724, 2003)。
[0284]
本文所述的合成、修饰的rna可通过本领域中完善确立的方法来合成和/或修饰,如描述于“current protocols in nucleic acid chemistry,
”ꢀ
beaucage,s.l.等(编辑),john wiley&sons,inc.,new york,n.y.,usa 中的那些方法,所述文献以引用的方式整体并入本文。转录方法在本文实施例中进一步描述。
[0285]
在本文所述的方面的一个实施方案中,用于合成、修饰的rna的模板是使用“夹板介导的连接”合成的,其允许通过长寡聚物和/或 dsdna pcr产物的受控级联快速合成dna构建体并且无需在连接区处引入限制性位点。夹板介导的连接可用于在t7模板生成期间将通用非翻译区(utr)添加至基因的编码序列。夹板介导的连接还可用于将核定位序列添加至开放阅读框,并且用于以野生型开放阅读框开始制备具有点突变的显性阴性构建体。简言之,将单链和/或变性的dsdna组分与夹板寡聚物退火,所述夹板寡聚物使所需端相结合,所述端由热稳定dna连接酶连接且通过pcr扩增所需构建体。然后在体外使用 rna聚合酶从所述模板合成合成、修饰的rna。在合成、修饰的rna 的合成完成之后,在与本文所述的方法
一起使用之前将所述dna模板从转录反应中除去。
[0286]
在这些方面的一些实施方案中,用碱性磷酸酶进一步处理所述合成、修饰的rna。
[0287]
***
[0288]
本领域技术人员易于了解,本发明充分适于执行目标并且获得所提到的以及其中固有的结果和优点。本文的描述和实施例的细节是某些实施方案的代表,是示例性的,而非意图作为对本发明范围的限制。本领域的技术人员将想到其中的修改和其他用途。这些修改涵盖于本发明的精神内。本领域技术人员将易于显而易见的是,在不脱离本发明的范围和精神的情况下可对本文中所公开的发明进行可变的替换和修改。
[0289]
在说明书以及权利要求书中如本文使用的不定冠词“一个/种 (a/an)”应理解为包括复数指示物,除非相反地明确说明。除非相反指出或另外从上下文明显看出,否则如果一个、多于一个或所有组成员存在于、被用于或以其他方式关联于给定的产物或过程,那么认为包括在组的一个或多个成员之间的“或”的权利要求或描述得到了满足。本发明包括其中恰有组中的一个成员存在于、被用于或以其他方式关联于给定的产物或过程的实施方案。本发明还包括多于一个或所有的组成员在给定产物或方法中存在、采用或者另外与给定产物或方法相关的实施方案。此外,应理解,本发明提供将来自一个或多个所列权利要求的一个或多个限制、要素、条款、描述性术语等引入依附于同一个基础权利要求(或,在相关时,任何其他权利要求)的另一权利要求中的所有变化、组合和排列,除非另有说明或者除非对于本领域的技术人员显而易见会出现矛盾或不一致。考虑在适当情况下本文所述的所有实施方案适用于本发明的所有不同方面。还考虑在适当情况下任何实施方案或方面可与一个或多个其他此类实施方案或方面自由地组合。在将要素例如以markush组或类似格式呈现为列表时,应理解,也公开了所述要素的每个亚组,并且可以从所述组中除去任何要素。应了解,一般来说,在本发明或本发明的方面被提及为包括具体要素、特征等的情况下,本发明的某些实施方案或本发明的方面由这类要素、特征等组成或基本上由这类要素、特征等组成。为简洁起见,那些实施方案在本文中并未在任何情况下都明确地具体陈述。还应了解,本发明的任何实施方案或方面可从权利要求书中明确地排除,不管所述具体排除是否在说明书中叙述。例如,可排除任何一种或多种活性剂、添加剂、成分、任选试剂、生物体类型、病症、受试者或其组合。
[0290]
在权利要求书或描述涉及物质组合物时,应了解,除非另外指示或者除非对于本领域的普通技术人员来说显而易见将出现矛盾或不一致,否则根据本文公开的任何方法来制备或使用所述物质组合物的方法和出于本文公开的任何目的使用所述物质组合物的方法是本发明的方面。在权利要求书或描述涉及方法时,例如应了解,除非另外指示或者除非对于本领域的普通技术人员来说显而易见将出现矛盾或不一致,否则制备适用于进行所述方法的组合物的方法和根据所述方法产生的产物是本发明的方面。
[0291]
在本文中给出范围的情况下,本发明包括其中包括端点的实施方案、其中排除两个端点的实施方案以及其中包括一个端点且排除另一个端点的实施方案。除非另外指示,否则应假定包括两个端点。此外,应了解,除非另外指出或另外从上下文和本领域普通技术人员的理解显而易见,否则在本发明的不同实施方案中,表述为范围的值可假定为任何特定值或所述范围内的子范围,到所述范围的下限的单位的十分之一,除非在上下文中另有明确规定。还应了解,在本文中陈述一系列数值的情况下,本发明包括类似地涉及由所述系
列中的任何两个值限定的任何中间值或范围并且最低值可被视为最小值且最高值可被视为最大值的实施方案。如本文所用,数值包括表述为百分比的值。对于数值前置有“约”或“大约”的本发明的任何实施方案,本发明包括叙述精确值的实施方案。对于数值未前置有“约”或“大约”的本发明的任何实施方案,本发明包括值前置有“约”或“大约”的实施方案。
[0292]
如本文所用,当a和b在不同权利要求项中时,“a和/或b”通常意指a、b中的至少一个或a和b两者。例如,与另一个序列互补和/ 或杂交的一个序列包括:(i)与另一个序列互补的一个序列,但是所述一个序列可能不一定在所有条件下与所述另一个序列杂交,(ii)与另一个序列杂交的一个序列,即使所述一个序列不与所述另一个序列完全互补,以及(iii)既与另一个序列互补又与所述另一个序列杂交的序列。
[0293]
除非另外说明或从上下文(除了这样的数字将不允许超过可能值的100%的情况)另外显而易见,“大约(approximately)”或“约(about)”通常包括在数字的1%范围内或在一些实施方案中5%范围内的数字,或在一些实施方案中在任一方向上在数字的10%范围内(大于或小于所述数字)的数字。应了解,除非相反清楚地指示,在本文要求保护的包括多于一个行为的任何方法中,所述方法的行为的顺序不必限于叙述所述方法的行为的顺序,但是本发明包括顺序如此限制的实施方案。还应了解,除非另外指示或从上下文显而易见,否则本文所述的任何产物或组合物可被认为是“分离的”。
[0294]
如本文所用,术语“包含(comprising)”或“包含(comprise)”关于对本发明来说必不可少的组合物、方法及其对应组成部分使用,但对于包括未指定的要素是开放性的,无论是否必不可少。
[0295]
如本文所用,术语“基本上由
…
组成”是指对于给定实施方案所需的那些要素。所述术语允许存在不实质上影响本发明的所述实施方案的基本特征和新颖特征或功能特征的另外要素。
[0296]
术语“由
…
组成”是指如本文所述的组合物、方法及其对应组成部分,其排除未在所述实施方案的所述描述中叙述的任何要素。
[0297]
***
实施例
[0298]
实施例1
[0299]
转录活化因子样效应物核酸酶(talen)作为一个对结合在基因组位点周围,其中通过foki核酸酶结构域的二聚体引入双链断裂(dsb)。最近报道了使用talen基因组编辑系统来在人多能干细胞(hpsc)中快速且有效地产生15种不同基因的突变等位基因作为进行严格疾病建模的一种方式(ding等,cell stem cell 12:238-251(2013));携带至少一个突变等位基因的克隆的比例在2%-34%的范围。
[0300]
如下文所描述,使用之前描述的同一递送平台评定靶向相同hpsc 系中的相同基因组位点的crispr和talen的相对功效(ding等,cellstem cell 12:238-251(2013))。在talen基因组编辑系统中,cag启动子用于共翻译(经由病毒2a肽)具有绿色荧光蛋白(gfp)或红色荧光蛋白(rfp)的每个talen。对于crispr,将人密码子优化的cas9基因与c-末端核定位信号(mali等,science 339:823-826(2013))亚克隆至具有gfp的相同cag表达质粒中,并且从具有人u6聚合酶iii启动子的质粒单独表达引导rna(grna)(mali等,science 339:
823-826 (2013))。使用基于聚合酶链式反应(pcr)的方法引入每个grna的20 个核苷酸的原型间隔区序列。无论使用talen还是crispr,将相等量的两种质粒共电穿孔至hpsc(25μg的每种质粒,或12.5μg的每种质粒连同25μg的dna修复模板(如果试图敲入))中,接着在24-48小时之后进行荧光活化的细胞分选(facs),克隆扩增单个细胞,并且经由pcr筛选基因组靶位点处的突变。
[0301]
设计grna,所述grna匹配之前用talen成功靶向的六种基因 (akt2、celsr2、ciita、glut4、linc00116以及sort1)中的七个基因座(ding等,cell stem cell 12:238-251(2013))以及ldlr中的一个另外基因座中的g(n)19ngg序列。在此系统中,crispr始终且基本上跨基因座和hpsc系胜过talen(参见表s1)。talen以0%-34%的效率产生具有至少一个突变定位基因的克隆,而匹配的crispr以 51%-79%的效率产生突变克隆(表s1)。正如talen一样,crispr产生集中于预测的裂解位点上的大小为一个核苷酸至数十个核苷酸范围的多个插入缺失,从而表明不管是使用crispr还是talen,非同源末端连接诱变均以相同方式发生。此外,crispr容易地产生纯合突变克隆(所有克隆的7%-25%;表s1),如通过测序所辨别。
[0302]
还试图使用如之前所述的67个核苷酸的单链dna寡核苷酸将 e17k突变敲入至akt2中(ding等,cell stem cell 12:238-251(2013))。虽然所预测的crispr裂解位点分别位于距点突变11个核苷酸和13 个核苷酸处,但crispr以11%的比率产生敲入克隆,而talen产生仅1.6%(表s1)。
[0303][0304]
值得注意的是对于g(n)19ngg靶序列的需要在某种程度上限制位点选择。因为可靶向任一dna链,所以靶序列平均每隔32个碱基对出现。在可靶向任何编码序列的情况下这
不是基因敲除的障碍,但当试图敲入或修正特定位置处的突变时它可能构成困难。然而,在原型间隔区起始处对g的需要通过使用u6启动子来指定以表达grna,并且替代crispr/cas系统可缓解这种需求(cong等,science 339:819-823(2013))。这允许使用(n)20ngg靶序列,平均每隔8个碱基对发现所述靶序列。
[0305]
此外,crispr脱靶效应的程度仍有待限定且是高度序列依赖性的。先前分析已经表明在原型间隔区的前一半中的一个核苷酸错配比在后一半中的错配更好地容许(jinek等,science 337:816-821(2012); cong等,science 339:819-823(2013))。对于akt2序列,在原型间隔区的更“容许”的一半中,存在在核苷酸1和3处不同的一个两个错配的序列。与在靶位点处的61%相比,突变位于此潜在脱靶位点处的情况下获得零克隆(表s1)。对于sort1序列中的一个,使用其中单核苷酸多态性导致在靶位点处的一个核苷酸错配的不同人多能干细胞系以 42%的效率产生突变克隆,相比之下在原始细胞系中为66%。因此,靶位点的明智选择对使系统脱靶效应最小化来说是必要的;应避免在基因组中其他地方的具有完全匹配或单个核苷酸错配序列的靶位点。
[0306]
从实际的角度来说,crispr比talen更容易实施。每一talen 对必须从头构建,而对于crispr,cas9组分是固定的并且grna仅需要20个核苷酸的原型间隔区的交换。鉴于这一考虑以及本文中在另外相同系统中由于用crispr替代talen所致的基本上增加的效率的证明,crispr似乎是用于基因组编辑(特别是在治疗背景下)的非常强大和广泛适用的工具。
[0307]
实施例2:原代体细胞中的临床相关基因的有效靶向
[0308]
本文所述的工作首次显示crispr/cas9系统可用于通过使用双重引导策略以高效率编辑体细胞(例如,原代)的基因组。本发明人认为此工作将有助于使临床上相关的原代细胞中的基因组编辑称为现实。
[0309]
允许靶向任何所需基因组位点的基因组编辑工具的出现极大地促进了人类生物学与疾病的研究。具体地说,所述crispr/cas9系统由于其灵活性和高功效而已经成为靶向基因组编辑技术中的黄金标准。此系统由来自微生物ii型crispr/cas系统的cas9核酸酶构成,所述 cas9核酸酶通过合成引导rna分子中的20个核苷酸的区靶向特异性基因组基因座。与其他靶向核酸酶(zfn和talen)类似,cas9包括主要通过易错非同源末端连接(nhej)修复的双链断裂(dsb)(cong等, 2013;jinek等,2013;mali等,2013)。
[0310]
crispr/cas9系统的实施使得有可能实现永生化细胞系(cong等, 2013;jinek等,2013;mali等,2013)、人多能干细胞(ding等,2013)以及甚至小鼠(wang等,2013)、大鼠(li等,2013)和最近猴(niu等,2014) 的受精卵中的前所未有的高靶向效率,从而导致当与经典策略相比较时在非常短的时间段内产生敲除或敲入动物。
[0311]
然而,仍然有待证明crispr/cas9技术是否可用于以高效率编辑临床上相关的原代体细胞的基因组,这是用于完全实现基因组编辑用于再生医学和移植疗法的前景的关键步骤。
[0312]
本发明人寻求测试crispr/cas9系统用于编辑原代体细胞中的临床相关基因的适应性。出于这一目的,本发明人选择靶向两种治疗相关的基因:ccr5,其是cd34 造血祖细胞中(hpc)中hiv的共受体;以及b2m,其是cd4 t细胞中mhc i类分子的辅助链。本发明人发现单一引导策略在hpc和t细胞中产生非常低至不可检测的突变率,尽管在永生化细胞系如
293t和k562中具有高效率。相比之下,出人意料地且意外地,具有一对grna(具有靶向目标基因座的不同偏移序列)的双重引导策略在hpc和t细胞中产生达40%的纯合缺失效率。这些结果确立一种新颖的方法,通过所述方法crispr/cas9系统可用于以高效率编辑临床相关体细胞中的基因组。
[0313]
结果
[0314]
在细胞系中使用crispr/cas9系统进行的有效和快速基因组编辑
[0315]
本发明人用cas9和一系列靶向b2m基因座的crispr引导rna 转染hek293t细胞并且基于surveyor测定(图4)以及流式细胞术测量切割效率,从而利用b2m是表面抗原的事实。这些实验仅在转染后第72小时进行,以便说明细胞膜上的b2m的半衰期。值得注意,b2m 表面表达在达60%的转染的hek293t细胞中被消除(图4)。此外,本发明人观察到单独引导rna之间的广泛效率变化,即使是靶向同一外显子。例如,在结合于b2m的第一外显子的67bp长的蛋白质编码部分内的七个引导rna之中,单一引导切割效率之间的变化是数倍(图 4),从而有力地表明crispr切割效率主要是引导序列依赖性的。
[0316]
原代体细胞是难以crispr/cas9靶向的
[0317]
接着,本发明人在原代细胞中测试了crispr/cas9系统。选择了两种临床上相关的免疫细胞类型:从外周血分离的原代cd34
造血祖细胞(hpc)和原代cd4
t细胞。出人意料地,在细胞系中产生达60%切割效率(293t细胞中的b2m,图4)的相同引导rna揭示在体细胞中无效(图4)。本发明人推测在原代细胞中靶向效率的这种急剧下降是由于核转染的细胞中cas9核酸酶的较低表达水平、增强的dna修复机制或两者的组合。
[0318]
双重引导策略显著增加在原代细胞中的靶向效率
[0319]
本发明人寻求确定使用crispr/cas9系统,临床上相关的原代细胞中的基因组靶向功效是否能够改进,从而希望实现足够高至潜在用于治疗中的靶向效率。本发明人设计了双重引导策略,其中将靶向同一基因座的两个crispr引导rna同时递送至细胞。
[0320]
与单独第一引导rna相比,添加靶向hprt基因座的另一个引导 rna几乎不变地产生增加的突变效率。通过对6-硫鸟嘌呤(6-tg)的抗性选择缺乏hprt的细胞。使用另外的grna不变地产生增加的hprt 突变频率。在一个实施方案中,靶多核苷酸序列包含hprt基因序列。
[0321]
将不同引导rna对针对每一基因座进行测试,并且活性最高的一个用于用原代细胞进一步研究。图4a-4e展示单一引导策略在细胞系中实现高效基因组编辑,但在临床上相关的原代体细胞中未实现高效基因组编辑。在所使用的两种系统中,在原代体细胞中双重引导策略始终且基本上胜过传统的单一引导策略。这些结果在图5a-5d中展示,其示出双重引导策略在临床相关细胞中以高效率实现基因组编辑。
[0322]
讨论
[0323]
在crispr/cas9基因组编辑领域的领域中的主要焦点之一是寻找调节cas9的切割效率的参数。本文所述的数据表明这一现象似乎主要由grna序列确定,因为与同一外显子内的序列非常接近地匹配或甚至部分重叠的grna产生显著不同的靶向效率(图4)。
[0324]
在先前报道中,用于引入靶向双链断裂的组合cas9核酸酶突变体与配对的引导rna的方法已经用于显著减少crispr脱靶效应而不牺牲在靶效率(ran等,2013)。然而,以申请人掌握的情况来看,这种策略不会产生显著突变率(max和pankaj)。因此将wt cas9与成
对的 grna组合以增加在难以靶向的细胞类型
–
原代体细胞中的切割效率。
[0325]
b2m是mhc i类蛋白的辅助链,其对于所述蛋白在细胞表面上的表达来说是必要的。工程化没有表面mhc i类、因此对于细胞毒性t 细胞来说不可见的细胞在移植和过继性细胞疗法中至关重要。
[0326]
总之,数据显示crispr/cas9系统可用于通过使用双重引导策略以显著效率编辑临床上相关的原代体细胞的基因组。预测这种策略具有成为以足够高的效率靶向体细胞中的基因以使得它变得对潜在转化成治疗剂来说相关的通用方法的潜力。
[0327]
一些实验程序
[0328]
流式细胞术。将细胞用小鼠单克隆抗b2m抗体2m2(biolegend) 染色。
[0329]
原代血液细胞电穿孔。使用rosettesep cd4 t细胞富集混合物 (stem cell technologies)从leukopacs(mgh)分离原代cd4 t细胞并且使用amaxa t细胞核转染试剂盒(lonza)用不含内毒素的dna电穿孔。
[0330]
针对hprt缺乏选择6-tg。使用5*10^6个细胞/电穿孔,与25ugcas9和12.5ug的每种grna。对于cas9对照,非切割grna用于保持总dna量相同。在ep之后48小时facs分选以5%-8%gfp相对类似地结束。将细胞以40,000/10cm板/样品接种,并且生长直到可清楚地观察到菌落。mtesr中的30um 6-硫鸟嘌呤(6-tg)(例如,在30μm 的浓度下)用作选择培养基持续8-9天并且再次技术菌落。结果在以下表1中示出。
[0331]
表1
[0332][0333][0334]
以下表2示出根据编辑效率排序的来自以上表1的结果。
enhanced genome editing specificity.cell.154,1380-9。
[0352]
8.wang,h.等,2013.one-step generation of mice carryingmutations in multiple genes by crispr/cas-mediated genome engineering. cell.153,910-8。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。