1.本发明涉及多肽制备技术领域,具体涉及一种厚壳贻贝免疫活性六肽的制备方法。
背景技术:
2.贻贝(mytilus sp.)属于软体动物门(mollusca)、瓣鳃纲(lanellibranchia)、异柱目(anisomyaria)、贻贝族(mytilacea)和贻贝科(mytidea),是一种在全球海岸线广泛分布的双壳类软体动物。近代医学对于贻贝作为传统中医药的活性研究表明,贻贝具有抗炎,抗氧化,抗疲劳,抗肿瘤,抗菌,以及免疫调节等功能活性,这些活性都得益于贻贝中蕴含的多种活性物质。例如从贻贝中提取分离的抗菌肽,这些肽的抗菌谱不尽相同,且分别参与了贻贝体内的不同类型的免疫应答的不同阶段,从而形成了贻贝天然广谱抗菌能力。此外,中国专利cn109206483a公开了贻贝活性肽在抗肿瘤方面的用途,中国专利cn106676155a公开了贻贝多肽在抗血栓方面的用途。因此贻贝活性肽具有极高的研究价值。然而贻贝活性肽在免疫方面的作用鲜有报道。
3.常见生物活性肽制备方法包括已知氨基酸序列的化学合成法,直接提取法,酶水解法,发酵法,基因重组合成法等。化学合成中涉及多种有机试剂,且多数具有毒性,这与生物活性肽最终的食品级定位相悖,这也正是化学合成法的受限之处。基因重组合成法目前还处在较为基础的阶段,操作难度还较大,且投入产出比严重不平衡,尚未能发展到工业化规模生产的程度。因此需要对贻贝活性肽的制备方法进行更加深入的研究。酶水解法生产活性肽,高效且对蛋白质营养价值破坏小、无异味,产品安全性极高,生产条件温和,可定位生产特定的肽,而且成本低,酶水解法已成为活性肽最主要的生产方法。经蛋白水解后所得的酶解物还需进行进一步分离纯化,膜分离技术和高效液相色谱技术在蛋白纯化方面的应用使得活性肽的分离纯化更加精细化和高效化。而目前针对酶水解法制备厚壳贻贝活性肽的系统性研究报道较少。
技术实现要素:
4.本发明的目的在于提供一种具有免疫活性的厚壳贻贝活性六肽及其制备方法。
5.为达到上述发明目的,采用如下技术方案。
6.本发明公开了一种上述制备方法制得的厚壳贻贝免疫活性六肽,其序列如seqidno.2所示。
7.优选地,厚壳贻贝免疫活性六肽的分子量为636.40da。
8.本发明还公开了一种厚壳贻贝免疫活性六肽的制备方法,包括如下步骤:步骤(1)厚壳贻贝粗肽的制备;步骤(2)厚壳贻贝活性肽的分离纯化;步骤(3)厚壳贻贝活性肽的检测;其中,所述厚壳贻贝活性肽包括序列如seqidno.1-seqidno.6所示的6条短肽。
9.优选地,步骤(1)包括:将厚壳贻贝肉绞碎脱脂后酶解,酶解后超滤得酶解液,将酶解液旋转蒸发冷冻干燥即得厚壳贻贝粗肽。
10.本发明采用酶解法提取,由于酶具有特异性酶切位点,因此可以使反应具有高度专一性,只需要选择合适的酶和合适的反应条件就可以精确控制反应,有利于在大规模生产中制定规范的生产标准。
11.优选地,酶解液中所含有的物质分子量小于1kda。
12.优选地,脱脂温度为50-60℃,时间为1-2.5h。
13.优选地,酶解使用胃蛋白酶和/或胰蛋白酶;酶解温度为35-40℃;酶解时间为5-8h。
14.优选地,超滤使用tff cogent μscale系统。
15.优选地,步骤(1)包括:厚壳贻贝肉去除足丝后流水洗净,放入组织匀浆机中绞碎;将碎肉与异丙醇按1g:2-5ml的比例混合,搅拌均匀后于50-60℃脱脂1-2.5h,重复2-3次;脱脂后,弃去上清液,将剩下的厚壳贻贝肉用纯水洗至无醇味,收集沉淀;以料液比1:10-15加入纯水,用0.1-0.2 mol/l hcl或0.1-0.2mol/l naoh调节ph为6-6.5,2000-2500u/g加入胰蛋白酶,在35-40℃水浴搅拌酶解5-8h,随后将酶解液煮沸10-15min灭活;冷却后,于2-4℃预冷条件下,5000g离心10-12min获取上清液;所得上清液经tff cogent μscale 系统超滤,最终得到《1kda的酶解液,经旋转蒸发冷冻干燥后得到厚壳贻贝粗肽。
16.更优选地,步骤(1)包括:厚壳贻贝肉去除足丝后流水洗净,放入组织匀浆机中绞碎。将碎肉与异丙醇按1g:4ml的比例混合,搅拌均匀后于55℃脱脂2h,重复2次;脱脂后,弃去上清液,将剩下的厚壳贻贝肉用纯水洗至无醇味,收集沉淀;以料液比1:12加入纯水,用0.1mol/l hcl或0.1mol/l naoh调节ph为6,以2000 u/g加入胰蛋白酶,在37℃水浴搅拌酶解6 h,随后将酶解液煮沸15 min灭活;冷却后,于4℃预冷条件下,5000 g离心10min获取上清液;所得上清液经tff cogent μscale系统超滤,最终得到《1kda的酶解液,经旋转蒸发冷冻干燥后得到厚壳贻贝粗肽。
17.更优选地,步骤(1)中脱脂时将碎肉与异丙醇、吲哚-5-羧酸、二苯甲胺按1g:2-5ml:0.2-0.5g:0.5-0.8ml的比例混合,搅拌均匀后于50-60℃脱脂1-2.5h,重复2次。
18.脱脂程度对后续肽的制备和纯化会产生影响,使用异丙醇、吲哚-5-羧酸、二苯甲胺三者混合液进行脱脂处理,可以进一步提高脱脂的效果,减少脂质残留对后续步骤产生的负面影响。
19.优选地,步骤(2)包括使用凝胶柱分离纯化和使用rp-hplc分离纯化。
20.优选地,凝胶柱分离纯化包括如下步骤:将凝胶装柱;将配制好的厚壳贻贝粗肽溶液过滤后上样进行洗脱;洗脱收集各洗脱峰对应的样品进行mtt实验;根据实验结果选取最优肽。
21.更优选地,厚壳贻贝粗肽溶液浓度为0.1-0.5g/ml。
22.更优选地,mtt实验所使用的细胞为raw 264.7。
23.更优选地,凝胶柱分离纯化包括如下步骤:将预先处理的凝胶装柱,装柱体积5.0
×
45cm,先用1.0-1.2ml/min的超纯水作为
流动相平衡3-5个柱体积;将冻干的厚壳贻贝粗肽配制成浓度为0.1-0.5g/ml的溶液,上样量1-2ml,上样前先用0.22μm的滤膜过滤,用1.0-1.2ml/min的超纯水洗脱,每管收集时间间隔2-3min,在280nm处测定各管吸光度;以管数为横坐标,吸光度为纵坐标绘制组分曲线,收集各峰冷冻干燥,进行实验,筛选出对巨噬细胞raw 264.7相对增殖率最高的最优峰肽溶液。
24.更进一步优选地,凝胶柱分离纯化包括如下步骤:将预先处理的sephadex g-25凝胶装柱,装柱体积5.0
×
45cm,先用1.0ml/min的超纯水作为流动相平衡4个柱体积;将冻干的厚壳贻贝粗肽配制成浓度为0.2g/ml的溶液,上样量2ml,上样前先用0.22μm的滤膜过滤,用1.0ml/min的超纯水洗脱,每管收集时间间隔3min,在280nm处测定各管吸光度;以管数为横坐标,吸光度为纵坐标绘制组分曲线,收集各峰冷冻干燥,进行mtt实验,筛选出对巨噬细胞raw 264.7相对增殖率最高的最优峰肽溶液。
25.优选地,使用rp-hplc分离纯化包括如下步骤:选用分析型色谱柱对最优峰肽溶液进行进一步分离纯化,柱温23-26℃,进样量为10-15 μl,以超纯水为流动相a、乙腈为流动相b进行洗脱。
26.更优选地,使用rp-hplc分离纯化包括如下步骤:选用zorbax sb-c18分析型色谱柱(5μm,9.4
×
250mm)对最优峰肽溶液进行进一步分离纯化,柱温25℃,进样量为10 μl,以超纯水为流动相a、乙腈为流动相b,洗脱条件为:0-5 min 10% b洗脱、5-15 min 10%-50% b洗脱、15-25 min 50% b洗脱、25-30 min 50%-100% b洗脱、30-35 min 100% b洗脱;洗脱流速为0.5 ml/min,并于280 nm处检测收集峰,即得厚壳贻贝活性肽。
27.优选地,步骤(3)包括使用lc-ms/ms检测厚壳贻贝活性肽,确定厚壳贻贝活性肽序列。
28.本发明还公开了上述的厚壳贻贝免疫活性六肽在制备改善脾脏组织损伤和/或胸腺萎缩的药物和/或保健品中的用途。
29.本发明还公开了上述的厚壳贻贝免疫活性六肽在制备改善细胞免疫和/或体液免疫的药物和/或保健品中的用途。
30.与现有技术相比,本发明的有益效果为:本发明采用酶解法制备厚壳贻贝活性肽,反应条件温和易于操作,并且酶解反应具有高度专一性,有利于在大规模制备中制定统一标准;本发明方法制得的厚壳贻贝免疫活性六肽可以用于制备修复免疫器官损伤、改善巨噬细胞吞噬能力、提高细胞免疫和体液免疫功能的药品或保健品。此外,本发明在对厚壳贻贝肉进行脱脂时,使用异丙醇、吲哚-5-羧酸、二苯甲胺三者混合液进行脱脂处理,有效提高了脱脂率,可达45%以上。
附图说明
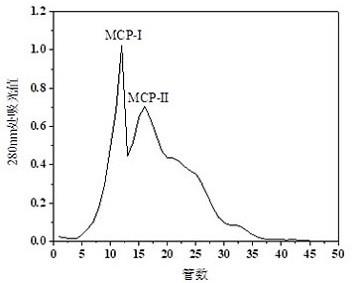
31.图1为sephadex g-25洗脱峰;图2为各洗脱峰相对增殖率大小;图3为rp-hplc色谱柱洗脱峰;图4为不同浓度各厚壳贻贝活性肽的细胞增殖活性;图5为不同浓度各厚壳贻贝活性肽的no含量测定;
50%-100% b洗脱、30-35 min 100% b洗脱;洗脱流速为0.5 ml/min,并于280 nm处检测收集峰。检测结果如图3所示。
39.由图3可知,20min附近出现了最高峰,且远高于其他各峰;其余峰产率过低,故收集最高峰作为厚壳贻贝活性肽,冻干后进行测序。
40.(3)厚壳贻贝活性肽的检测对厚壳贻贝活性肽进行lc-ms/ms检测:将厚壳贻贝活性肽配制成1mg/ml溶液,用0.22μm滤膜过滤后上样进行lc-ms/ms分析,色谱条件如表1所示。
41.所得结果用peaks软件进行de-novo检索及数据库检索;样本采用ncbi中mytilus物种的蛋白数据库。
42.表1 色谱条件
组件参数色谱柱c18,3
µ
m,250mm
×
75
µ
m(eksigent)进样量4μl流速300nl/min流动相a相为乙腈,0.1%甲酸;b相为水,0.1%甲酸;0-16min93%-88%a,16-51min88%-70%a,51-71min70%-58%,71-72min58%-5%a,72-78min5%a
质谱仪器为 orbitrap fusion lumos (thermofisher),检测条件:正离子检测模式,一级分辨率为120000,agc设置为3e6,扫描范围300-1400m/z。1张ms谱中选10个强度最高的离子进行ms/ms分析,二级分辨率为15000,agc设置为2e4,分离窗口1.6m/z。
43.经lc-ms/ms检测后,通过置信度以及uniprot蛋白数据库中mytilus物种的蛋白数据的比对结果,筛选出6条厚壳贻贝活性肽序列,如表2所示。
44.表2 mcp中选择的6条肽的理化性质sequencealc(%)lengthmolecularweight(da)seqidnofggggf996540.23321lvvlgh996636.39592fvlpr995630.38533lltdy995623.31674llal994428.29995flfer995710.37516实施例2厚壳贻贝免疫活性六肽的制备将6条厚壳贻贝活性肽fggggf、lvvlgh、fvlpr、lltdy、llal、flfer分别编号
①
、
②
、
③
、
④
、
⑤
、
⑥
,测定不同浓度(50、100、200μg/ml)的肽序列对raw 264.7相对细胞增殖率及no分泌的影响。
45.测定相对细胞增值率采用cck-8法进行测定:选择对数生长期的raw264.7细胞,使用培养基稀释后移入96孔板,每孔加入细胞悬液200μl,细胞密度1
×
104个/孔;37℃,5% co2条件下培养过夜;培养后除去培养基,加入含不同浓度厚壳贻贝活性肽的培养基,37℃,5% co2条件下培养24h;培养后每孔加入20μl cck-8溶液,相同条件孵育1h后使用酶标仪检测450nm处吸光度并计算细胞相对增值率:相对增值率(%)=(od实验孔-od空白孔)/(od对照孔-od空白孔);其中实验孔为加入含不同浓度厚壳贻贝活性肽培养基的孔,对照孔为加入不含厚
壳贻贝活性肽培养基的孔,空白孔为无细胞的孔。
46.使用griess反应测定不同浓度(50、100、200μg/ml)的肽序列对raw 264.7no分泌的影响,使用no试剂盒(上海碧云天生物科技有限公司)按照说明书操作。
47.结果如图4和5所示。
48.由图4和5可知,
②
号肽lvvlgh(命名为厚壳贻贝免疫活性六肽,用lh-6表示)对raw 264.7的相对增殖作用及促no合成的能力最高。对厚壳贻贝免疫活性六肽使用质谱仪进行检测,结果如图6所示。
49.实施例3厚壳贻贝活性肽的制备(1)厚壳贻贝粗肽的制备;厚壳贻贝肉去除足丝后流水洗净,放入组织匀浆机中绞碎;将碎肉与异丙醇吲哚-5-羧酸、二苯甲胺按1g:4ml:0.5g:0.5ml的比例混合,搅拌均匀后于55℃脱脂2 h,重复2次;脱脂结束后,弃去上清液,将剩下的厚壳贻贝肉用纯水洗至无醇味,收集沉淀;以料液比1:12加入纯水,用0.1mol/lhcl 或0.1mol/l naoh调节ph为6,以2000 u/g加入胰蛋白酶,在37℃水浴搅拌酶解6h,随后将酶解液煮沸15min灭活;冷却后,于4℃预冷条件下,5000g离心10min获取上清液;所得上清液经tff cogent μscale系统超滤,最终得到《1kda的酶解液,经旋转蒸发冷冻干燥后得到厚壳贻贝粗肽(mcp)。
50.步骤(2)、(3)同实施例1,由于步骤(2)、(3)中结果与实施例1几乎完全一致,差异属于误差范围内,在此略去结果示意图以及描述。
51.试验例1厚壳贻贝肉脱脂率的测定取实施例1和实施例3中脱脂处理前后的厚壳贻贝碎肉,按照gb/t 5009.6-2016《食品中脂肪的测定方法》对厚壳贻贝碎肉的脂肪含量进行测定,测定后计算脱脂率:脱脂率(%)=(脱脂前脂肪含量-脱脂后脂肪含量)/脱脂后脂肪含量
×
100%。
52.经测定,实施例1中厚壳贻贝碎肉的脱脂率为33.47%,实施例3中脱脂率为47.16%。实施例3中脱脂率明显升高,说明异丙醇吲哚-5-羧酸、二苯甲胺混合液用于脱脂的效果更好。
53.试验例2厚壳贻贝免疫活性六肽改善小鼠免疫调节功能的测试一、实验动物分组与造模实验动物50只雄性icr小鼠,小鼠均分为5组,每组10只,先进行7天适应性喂养。选取其中4组腹腔注射80 mg/kg/d环磷酰胺(ctx)进行免疫抑制模型诱导,持续5天。另一组作为正常组腹腔注射生理盐水。从第4天起,选取3组免疫抑制小鼠给予厚壳贻贝免疫活性六肽,每天定时灌胃给药(200μl)一次,给药浓度分别为50mg/kg,100mg/kg,200mg/kg,正常组以及模型组分别给予等量的生理盐水,重复操作15天。
54.二、厚壳贻贝免疫活性六肽对免疫抑制小鼠免疫器官指数的影响每两日称量小鼠体重一次,每次称量均在喂食之前,共持续20天。处死前一天断食24h,随后眼球取血,快速摘取胸腺以及脾脏,在生理盐水中洗净血渍并用纱布吸净表面残余水滴后,称重,器官指数按以下公式计算:
免疫器官指数=免疫器官重量(mg)/小鼠体重(g)。
55.厚壳贻贝免疫活性六肽对小鼠免疫器官指数的影响如图7所示,模型组的脾脏指数和胸腺指数均显著低于正常组,说明免疫低下模型成功诱导。各厚壳贻贝免疫活性六肽组的两个免疫器官指数均与模型组有差异,说明厚壳贻贝免疫活性六肽能够修复ctx对于免疫器官所造成的损伤。
56.三、组织病理学观察将胸腺、脾脏固定在4%多聚甲醛中以进行组织病理学检查。然后,每只小鼠的胸腺、脾脏组织在梯度乙醇中逐步脱水并包埋在石蜡中。使用切片机将石蜡包埋的切片切成4μm厚的切片,用苏木精和伊红染色,然后在光学显微镜上检查并拍照,照片如图8所示,其中a1-5为脾脏he染色结果,b1-5为胸腺he染色结果;wp表示白髓,rp表示红髓。
57.脾脏he染色结果显示:模型组小鼠与正常组相比,脾脏白髓、红髓界线不清,成熟淋巴细胞减少;厚壳贻贝免疫活性六肽治疗后各组的上述损伤减轻,脾脏组织接近正常。说明厚壳贻贝免疫活性六肽可以改善因ctx导致的脾脏组织损伤和功能退化。
58.胸腺he染色结果显示:模型组小鼠的胸腺小体形成不明显,皮质髓质交织在一起,给药后胸腺皮髓分界清晰,皮质变厚。说明厚壳贻贝免疫活性六肽可以改善ctx导致的脾脏组织损伤和胸腺萎缩。
59.四、对免疫抑制小鼠迟发型变态反应的影响末次给药前4天,对各组小鼠进行2%(v/v)绵羊红细胞(srbc)腹腔注射,每只小鼠注射200μl(约1
×
108个srbc),从而达到致敏效果。免疫反应3天后,使用游标卡尺分别测量每组小鼠左后足跖厚度,随后向小鼠左后足跖注射20μl(约1
×
108个细胞)20%(v/v)srbc,24h后测量左后足跖注射部位厚度,测量3次以平衡误差。最终每组的小鼠左后足跖的注射前后两次测量的差值用来表示迟发型变态反应的程度。迟发性变态反应结果如表3所示。
60.表3 厚壳贻贝免疫活性六肽对srbc诱导的小鼠dth的影响
组别初始厚度/(cm)最终厚度/(cm)差值/(cm)正常组2.45
±
0.072.96
±
0.090.51
±
0.07模型组2.06
±
0.082.32
±
0.060.26
±
0.03**厚壳贻贝免疫活性六肽-50mg/kg2.29
±
0.052.61
±
0.110.32
±
0.05**厚壳贻贝免疫活性六肽-50mg/kg2.31
±
0.092.68
±
0.070.37
±
0.04*#厚壳贻贝免疫活性六肽-50mg/kg2.27
±
0.092.70
±
0.170.43
±
0.11##
由表3可知,小鼠足趾24h的厚度差值与模型组相比发生了显著的变化,高剂量的厚壳贻贝免疫活性六肽的能够有效的修复小鼠被ctx抑制的dth,从而改善免疫抑制小鼠的细胞免疫功能。
61.五、小鼠血清细胞因子的测定末次厚壳贻贝免疫活性六肽喂养24h后,颈椎脱臼处死小鼠,眼球取血,500g低温离心10min收集血清。按各细胞因子试剂盒(南京森贝伽生物科技有限公司)说明书先绘制标准曲线,再测定血清中的tnf-α,il-6,il-1β的浓度。
62.细胞因子在体液免疫中是重要的免疫介质小分子。如图9所示,厚壳贻贝免疫活性六肽能够剂量依赖性显著提升细胞因子tnf-α,il-6,il-1β的水平。
63.六、小鼠血清中免疫球蛋白(igg、iga、igm)的测定
小鼠处死后眼球取血,离心收集血清,按各免疫球蛋白试剂先绘制标准曲线,再测定血清中免疫球蛋白igg、iga、igm的浓度。
64.测定结果如图10所示。
65.免疫球蛋白在机体体液免疫中发挥着不可替代的作用,实验结果表明,中高剂量的lh-6能显著改善免疫抑制小鼠体内的免疫球蛋白水平,从而修复免疫抑制小鼠的体液免疫功能。
66.本发明的操作步骤中的常规操作为本领域技术人员所熟知,在此不进行赘述。
67.以上所述的实施例对本发明的技术方案进行了详细说明,应理解的是以上所述仅为本发明的具体实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充或类似方式替代等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。