特异性识别鼠伤寒沙门氏菌的t细胞亚群及其应用
技术领域
1.本发明属于细胞免疫领域,具体涉及特异性识别鼠伤寒沙门氏菌的cd4
tcrvβ6
t细胞亚群及其应用。
背景技术:
2.鼠伤寒沙门氏菌(salmonella typhimurium)是一群非适应性或泛嗜性的沙门氏菌,宿主比较广泛,能引起各种家禽和哺乳动物的传染病,也可引起人类感染,具有重要的公共卫生意义。鼠伤寒沙门氏菌是人和动物肠道主要病原菌之一,可引起人类的肠胃炎,是由饮用或食用污染的水或食物引起的,主要症状为急性结肠炎,伴随着炎症性腹泻。除此之外,鼠伤寒沙门氏菌还可引发牛肠炎和小鼠的系统性疾病。沙门氏菌病不仅对畜牧业生产造成巨大经济损失,而且也严重威胁人类健康。目前抗菌药物的使用是治疗沙门氏菌感染的重要措施,但由于滥用、乱用抗菌药物导致了细菌的严重耐药,一些沙门氏菌携带具耐药因子的遗传质粒,耐药因子可传递对多种抗生素的耐药性,尤其可在敏感细菌中散播,给沙门氏菌感染的治疗造成困难。因此,寻找新型药物及治疗方案已成为当前的研究重点。
3.沙门氏菌感染后最终被病原菌特异性的b细胞和t细胞免疫反应控制和清除,这些免疫反应也可保护机体免受二次感染。t细胞受体(t cell receptor,tcr)特异性识别组织相容性-多肽复合物(peptide histocompatibility,pmhc)的过程是t细胞激活的第一信号。tcr在t细胞表面表达,是由两条链组成的异二聚体,具有多样性。大多数t细胞由α和β链组成,少数由γ和δ组成。αβtcr中的β链由可变区(variable,v)、多变区(diversity,d)、结合区(joining,j)和恒定区(constant,c)四个区域组成,而α链由v、j和c三个区域组成。v-j之间的连接区即互补决定区3(complementarity-determining region 3,cdr3)具有高度变异性,是识别不同mhc-抗原肽的主要区域。在小鼠中v、d和j区均包括多种基因,而c区只有一种基因类型。tcr的多样性依赖于组合和连接处的多样性。组合的多样性是指α和β链都由不同的v(d)j基因片段随机组合形成;连接处的多样性是由v-d和d-j(β链)或v-j(α链)连接处碱基无模板的随机删减和插入形成的,α链和β链的随机组合进一步增加了tcr的多样性。单个人体tcrβ链本身的多样性及β链与α链组合的多样性,能形成至少10
11
以上种类的tcr,不同t细胞克隆具有不同序列或不同长度的tcr cdr3基因,从而决定了其特异性,进而反映了t细胞的功能状态。由于cdr3是与抗原直接接触的tcr区域,因此cdr3在tcr与肽-mhc复合物的相互作用中起到了十分重要的作用。
4.常用的分析tcr基因中cdr3序列的方法是pcr-谱型分析-序列分析法。即根据tcrv基因不同家族及恒定区的序列分别设计上下游引物,其中下游引物带入fam荧光标记。pcr扩增后的产物在序列分析仪上进行变性凝胶电泳,通过genscan软件分析不同碱基位置的荧光强度并转化为峰图。根据峰形的变化、峰的个数及高度判断cdr3的克隆性增生,再通过克隆、转化结合sanger测序分析cdr3的序列。但这种方法存在准确性和敏感性低等弊端。近几年,高通量测序技术快速发展并能进行大规模的序列分析且灵敏度高,因此被广泛用于免疫组库的分析中。tcr序列的扩增的方法主要包括两种:多重pcr扩增和5'race扩增。多重
pcr扩增:以cdna为模板,设计tcrv区不同家族上游引物,保守区下游引物,将不同的引物混合加入到反应体系中进行扩增。这种方法能同时扩增多个基因,但容易引起偏倚性,主要原因是由非特异性扩增、引物二聚体的形成和不均匀的反应条件引起的,需要通过矫正和计算机归一化的方法使偏倚性降到最低。5'race扩增:以mrna为模板,以oligo(dt)作为引物与3'末端的poly(a)结合,在反转录酶的作用下,合成第一条cdna,由于反转录酶具有末端转移酶活性,在扩增末端会加入几个dc残基(dctp),残基与smart寡核苷酸序列结合,并以smart序列为模板继续扩增至通用接头。以部分接头序列作为上游引物,tcr的保守区为下游引物,以第一条cdna链作为模板进行pcr扩增。
5.综上所述,沙门氏菌特异性tcr的筛选为沙门氏菌疾病的诊断和免疫治疗、疫苗研发以及动物抗病选育提供了新的方法和理论依据。
技术实现要素:
6.本发明的目的是提供一种特异性识别鼠伤寒沙门氏菌的cd4
tcrvβ6
t细胞亚群及其在抵抗和清除沙门氏菌感染中的应用,和/或,提供一种构建沙门氏菌病tcrβ链基因测序文库的方法。所要解决的技术问题不限于所描述的技术主题,本领域技术人员通过以下描述可以清楚地理解本文未提及的其它技术主题。
7.为了实现上述目的,本发明首先提供了特异性识别鼠伤寒沙门氏菌的cd4
tcrvβ6
t细胞亚群作为靶点的下述任一种应用:
8.a1)在制备用于治疗沙门氏菌病的药物中的应用;
9.a2)在筛选治疗沙门氏菌病的候选药物中的应用;
10.a3)在制备用于增强机体抵抗和清除沙门氏菌感染的药物中的应用;
11.a4)在抗鼠伤寒沙门氏菌的疫苗研究中的应用;
12.a5)在制备识别鼠伤寒沙门氏菌的试剂中的应用;
13.所述cd4
tcrvβ6
t细胞亚群为表达tcrvβ6(又称为trbv19)和cd4的t细胞,所述tcrvβ6是tcr(t细胞受体)的一种。
14.所述cd4
tcrvβ6
t细胞亚群的标志为tcrvβ6和cd4蛋白表达。
15.所述cd4
tcrvβ6
t细胞亚群可识别沙门氏菌并激活t细胞免疫反应,从而杀死鼠伤寒沙门氏菌,增强表达cd4和tcrvβ6细胞亚群(cd4
tcrvβ6
t细胞亚群)的比例,对于抵抗鼠伤寒沙门氏菌具有重要作用。
16.上述应用中,所述沙门氏菌病可为由鼠伤寒沙门氏菌(salmonella typhimurium)引起的疾病。
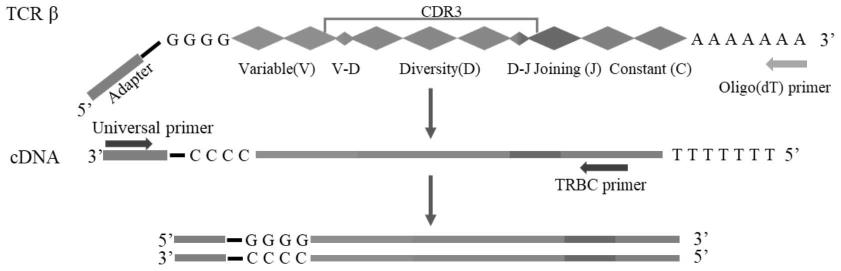
17.本发明还提供了特异性识别鼠伤寒沙门氏菌的所述cd4
tcrvβ6
t细胞亚群作为生物标志物在制备用于诊断或辅助诊断沙门氏菌感染的试剂或试剂盒中的应用。
18.上述应用中,所述诊断或辅助诊断沙门氏菌感染可通过检测所述cd4
tcrvβ6
t细胞亚群的数量比例实现。
19.正常情况下体内各类淋巴细胞的数量保持相对稳定,沙门氏菌感染可引起机体相应免疫细胞数量的异常,对本发明所述cd4
tcrvβ6
t细胞亚群进行数量检测,可以为沙门氏菌病的诊断提供依据。
20.本发明所述的cd4
tcrvβ6
t细胞亚群也在本发明的保护范围内。
21.本发明还提供了一种构建tcrβ链基因测序文库的方法,所述方法包括如下步骤:
22.b1)提取沙门氏菌感染的样本中的总rna;
23.b2)将所述总rna反转录成带有通用接头的cdna;
24.b3)以所述cdna为模板,以seq id no.1所示的上游引物f和seq id no.2所示的下游引物r进行第一轮pcr扩增,第一轮扩增产物稀释后作为模板,进行第二轮pcr扩增,得到第二轮pcr产物,纯化后得到所述tcrβ链基因测序文库。
25.进一步地,所述pcr扩增程序为:94℃2min;98℃10s,60℃30s,68℃20s,20个循环;68℃延伸7min。
26.所述pcr扩增反应体系为10
×
pcr buffer for kod-plus-neo 5ul,上游引物f(10μm)1.5ul,下游引物r(10μm)1.5ul,cdna模板2ul,kod-plus-neo(1u/μl)1ul,2mm dntps 5ul,25mm mgso
4 3ul,h2o 31ul,总体积50ul。
27.进一步地,所述第一次扩增产物稀释到10-4
作为二次pcr扩增的模板。
28.上述方法中,所述沙门氏菌感染的样本可为人或动物的血液样本、脾脏样本或淋巴结样本。
29.本发明还提供了用于构建沙门氏菌病tcrβ链基因测序文库的试剂盒,所述试剂盒包括所述上游引物f(seq id no.1)和所述下游引物r(seq id no.2)。
30.本发明还提供了所述试剂盒在构建沙门氏菌病tcrβ链基因测序文库中的应用。
31.本发明还提供了cd4
tcrvβ6
t细胞亚群的鉴定方法,所述方法包括利用流式细胞术鉴定表面标志物tcrvβ6和cd4为阳性的细胞。
32.本发明的目的是建立了5'race结合高通量测序分析tcr多样性的检测方法,并分析得到一种新的t细胞亚群:cd4
tcrvβ6
t细胞亚群,其在抵抗和清除沙门氏菌中发挥着重要作用。
33.为实现本发明目的,本发明提供如下技术方案:
34.第一方面,本发明建立了5'race结合高通量测序分析tcr多样性的检测方法。用smarter 5’race试剂盒(clontech,usa)反转录并加上接头序列,之后根据接头序列设计上游引物,以恒定β序列(tcrβ链恒定区序列)为下游引物,序列如下:ups tream primers(上游引物f)5’aagcagtggtatcaacgcagagt3’,downstream primers(下游引物r)5’accttgggtggagtcacatttc 3’,采用kod-plus-neo(toyobo,ja pan)扩增cdna,为了丰富cdr3区,对第一轮扩增产物进行稀释,选择到10-4
稀释比例作为二轮pcr模板,用相同的引物进行第二轮pcr。利用凝胶电泳,切割和纯化了包括cdr3区的大约250-500bp的片段,然后用高通量测序平台miseq制备文库并测序。
35.第二方面,本发明提供了一个新的t细胞亚群,cd4
tcrvβ6
t细胞亚群,实验表明,其在鼠伤寒沙门氏菌感染过程中被激活增殖,随后分化为th1细胞,细胞因子ifn-γ和tnf-α表达增加,表明这一新的细胞亚群在抵抗和清除鼠伤寒沙门氏菌过程中发挥重要作用。
36.本发明人经过大量的研究,首次发现了cd4
tcrvβ6
t细胞亚群,该t细胞亚群具有特异性识别鼠伤寒沙门氏菌的功能,实验表明,用鼠伤寒沙门氏菌感染小鼠后,tcrvβ6
t细胞亚群的比例显著升高,其在tcrβ
和cd4
t细胞中的表达显著增加,cd4
t细胞中tcrvβ6
t细胞亚群显著激活,激活的cd4
tcrvβ6
t细胞亚群进一步分化为th1细胞,增加了对刺激性抗原鼠伤寒沙门氏菌的杀伤作用,表明cd4
tcrvβ6
t细胞亚群在抵抗和清除沙门氏菌感染
的过程中具有重要作用。
附图说明
37.图1为通过5’race和pcr获得的小鼠脾脏tcrβ库(tcrβ链基因扩增)示意图。
38.图2为pcr扩增tcrvβ链,凝胶电泳包含tcrvβ链的250-500bp片段。
39.图3为各trbv基因占总序列的百分比热图。
40.图4为tcrvβ6在感染鼠伤寒沙门氏菌后的使用频率。tcr的v区包括不同的trbv基因家族,分析了每只小鼠个体中各trbv基因占总序列的百分比,发现感染后,各trbv基因的平均使用频率变化,trbv19(tcrvβ6)的频率显著升高。
41.图5为cd4
tcrvβ6
t细胞的表达流式示意图。
42.图6为cd4
tcrvβ6
t细胞分别在tcrβ
和cd4
的数量比例统计图。
43.图7为cd44
hi tcrvβ6
细胞的表达流式示意图。
44.图8为cd44
hi tcrvβ6
细胞的表达在cd4
数量比例统计图。
45.图9为脾脏cd4
t细胞中cd44
hi t-bet
的表达流式示意图。
46.图10为脾脏cd4
t细胞中cd44
hi t-bet
的表达在cd4
数量比例统计图。
47.图11为cd44
hi ifn-γ
细胞的表达流式示意图(上图)和cd44
hi
tnf-α
细胞的表达流式示意图(下图)。
48.图12为cd44 hi ifn-γ
细胞的表达在cd4
数量比例统计图。
49.图13为cd44
hi tnf-α
细胞的表达在cd4
数量比例统计图。
50.图14为cd44
hi t-bet
细胞中tcrvβ6
细胞的表达流式示意图。
51.图15为cd44
hi t-bet
细胞中tcrvβ6
细胞的表达数量比例统计图。
52.图16为cd44
hi ifn-γ
细胞中tcrvβ6
细胞的数量比例流式示意图。
53.图17为cd44
hi ifn-γ
细胞中tcrvβ6
细胞的数量比例统计图。
54.图18为cd44
hi tnf-α
细胞中tcrvβ6
细胞的数量比例流式示意图。
55.图19为cd44
hi tnf-α
细胞中tcrvβ6
细胞的数量比例统计图。
56.图4-图19中,ctrl表示未感染鼠伤寒沙门氏菌cvcc541的c57bl/6雌性小鼠的脾脏细胞,s.typhimurium表示感染鼠伤寒沙门氏菌cvcc541的c57bl/6雌性小鼠的脾脏细胞。
具体实施方式
57.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
58.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
59.下述实施例中的小鼠为8-10周spf级c57bl/6雌性小鼠,购于北京维通利华实验动物技术有限公司;鼠伤寒沙门氏菌cvcc541来自于中国兽医微生物菌种保藏管理中心;zombie aqua
tm
fixable viability kit,anti-cd11b(clone m1/70),anti-f4/80(clone bm8),anti-cd11c(clone n418),anti-mouse cd19(clone 6d5),anti-cd3(clone 17a2),
anti-tcrβ(clone h57-597),anti-cd44(clone im7),anti-t-bet(clone 4b10),anti-tcrvβ6(clone rr4-7),anti-ifn-γ(clone xmg1.2),anti-tnf-α(clone mp6-xt22)购于美国biolegend公司;anti-cd4(clone rm4-5)购自美国bd公司;anti-cd62l(clone mel-14)购自美国thermo公司,红细胞裂解液购于北京索莱宝科技有限公司;引物合成及序列测定由生工生物工程(上海)股份有限公司完成。
60.实施例1、5'race结合高通量测序分析tcr多样性的检测方法的建立
61.(1)将小鼠放入固定器中,每只小鼠尾静脉注射200μl菌液(鼠伤寒沙门氏菌cvcc541菌液)(n=4,2.5
×
105cfu/只),对照组小鼠每只尾静脉注射200μl pbs(n=3)。n表示样本数目。
62.(2)鼠伤寒沙门氏菌感染小鼠11d后,通过颈椎脱臼法处死小鼠,取出小鼠脾脏,采用传统trizol法提取总rna。
63.(3)进行5’race tcrβ链基因扩增:将步骤(2)提取的总rna用smarter 5’race试剂盒(clontech,usa)反转录合成带有通用序列接头的cdna链。设计接头序列和β链保守区序列分别作为上下游引物扩增tcrβ链的未知序列,如图1所示。引物序列如下:
64.上游引物f:5
’‑
aagcagtggtatcaacgcagagt-3’(seq id no.1),
65.下游引物r:5
’‑
accttgggtggagtcacatttc-3’(seq id no.2)。
66.以反转录的cdna为模板,以seq id no.1和seq id no.2为引物,用高保真pcr酶kod-plus-neo(日本toyobo)进行扩增,扩增程序为:94℃2min;98℃10s,60℃30s,68℃20s,20个循环;68℃延伸7min。
67.pcr扩增反应体系为:10
×
pcr buffer for kod-plus-neo 5ul,上游引物f(10μm)1.5ul,下游引物r(10μm)1.5ul,cdna模板2ul,kod-plus-neo(1u/μl)1ul,2mm dntps 5ul,25mm mgso
4 3ul,h2o 31ul,总体积50ul。
68.为了保证pcr产物量满足测序要求,进行了两次pcr扩增。如图2所示,当第一次扩增产物稀释到10-4
作为二次pcr扩增的模板时,二次pcr扩增的条带最亮,并且可以看到目的条带是由片段大小为250-500bp的多条带组成。目的条带被回收纯化后进行浓度测定、高通量测序文库(tcrβ链基因测序文库)构建,并通过高通量测序平台miseq对pcr产物进行测序。
69.实施例2、表达tcrvβ6的t细胞在抵抗或清除沙门氏菌中的作用
70.tcr的v区包括不同的trbv基因家族(即tcr vβ基因家族),本实施例利用实施例1中构建的tcrβ链基因测序文库对tcr vβ不同亚家族的基因表达进行分析,首先分析了每只小鼠个体中各trbv基因占总序列的百分比(如图3所示),接着统计了沙门氏菌cvcc541感染后,各trbv基因的平均使用频率变化,结果发现trbv19(tcrvβ6)的频率显著升高(图4),结果表明沙门氏菌可促进表达tcrvβ6的t细胞增殖,初步判断表达tcrvβ6的t细胞在抵抗或清除沙门氏菌中发挥重要作用。
71.实施例3、cd4
tcrvβ6
t细胞亚群在抵抗和清除沙门氏菌感染的过程中的作用
72.1、鼠伤寒沙门氏菌cvcc541感染后,tcrvβ6
t细胞在tcrβ
和cd4
t细胞中的表达显著增加。
73.(1)将小鼠放入固定器中,实验组(s.typhimurium)每只小鼠尾静脉注射200μl菌液(鼠伤寒沙门氏菌cvcc541菌液)(n=4,2.5
×
105cfu/只),对照组(ctrl)小鼠每只尾静脉
注射200μl pbs(n=3)。n表示样本数目。
74.(2)鼠伤寒沙门氏菌感染小鼠11天后,通过颈椎脱臼法处死小鼠,用75%酒精消毒后,用镊子取出小鼠脾脏;取部分组织,将放有组织的70μm细胞筛置于60mm的培养皿中并加入适量的pbs,用注射器针芯轻轻研磨组织制成细胞悬液,置于离心机中2000rpm离心5min后弃去上清;细胞沉淀中加入2ml红细胞裂解液,用移液枪吹打细胞并离心,再用pbs洗涤细胞两次,最后用pbs重悬细胞,调整细胞浓度为4
×
107/ml。
75.(3)取50μl细胞悬液(含2
×
106个细胞)至1.5ml的离心管中,抗体(anti-tcrvβ6、anti-tcrβ(clone h57-597)和anti-cd4(clone rm4-5))染色后流式分析tcrvβ6
t细胞在不同t细胞亚群中的比例,结果如图5、图6,tcrvβ6
t细胞在tcrβ
和cd4
t细胞中的表达显著增加。
76.2、鼠伤寒沙门氏菌感染后,cd4
t细胞中tcrvβ6
t细胞显著激活。
77.按照实施例3中步骤(1)、(2),实验组(s.typhimurium)每只小鼠尾静脉注射200μl鼠伤寒沙门氏菌cvcc541菌液(n=4,2.5
×
105cfu/只),对照组(ctrl)小鼠每只尾静脉注射200μl pbs(n=3),n表示样本数目。鼠伤寒沙门氏菌感染小鼠11d后,通过颈椎脱臼法处死小鼠,用75%酒精消毒后,用镊子取出小鼠脾脏;取部分组织,将放有组织的70μm细胞筛置于60mm的培养皿中并加入适量的pbs,用注射器针芯轻轻研磨组织制成细胞悬液,置于离心机中2000rpm离心5min后弃去上清;细胞沉淀中加入2ml红细胞裂解液,用移液枪吹打细胞并离心,再用pbs洗涤细胞两次,最后用pbs重悬细胞,调整细胞浓度为4
×
107/ml。
78.取50μl细胞悬液(含2
×
106个细胞)至1.5ml的离心管中,用抗体(anti-cd44(clone im7)、anti-tcrvβ6和anti-cd4(clone rm4-5)))流式细胞术分析激活的tcrvβ6
t细胞的变化情况,结果显示:cd44
hi
(高表达cd44的t细胞,在抵抗沙门氏菌感染的t细胞免疫反应中,激活的t细胞发挥主要作用,高表达cd44的t细胞被认为是被抗原识别并激活过的t细胞)tcrvβ6
细胞比例由1.2%增加至5.6%左右,结果如图7、图8所示。表明cd4
t细胞中表达tcrvβ6的t细胞可能具有抵抗沙门氏菌感染的功能。
79.3、激活的tcrvβ6
t细胞随后会分化为th1细胞,进一步清除鼠伤寒沙门氏菌。
80.表达转录因子t-bet的th1细胞可通过释放ifn-γ和tnf-α等细胞因子激活巨噬细胞来抵抗和清除沙门氏菌。
81.(1)将小鼠放入固定器中,实验组(s.typhimurium)每只小鼠尾静脉注射200μl鼠伤寒沙门氏菌cvcc541菌液(n=4,1
×
105cfu/只),对照组(ctrl)小鼠每只尾静脉注射200μl pbs(n=3),n表示样本数目。鼠伤寒沙门氏菌cvcc541感染小鼠11、23d后,通过颈椎脱臼法处死小鼠,用75%酒精消毒后,用镊子取出小鼠脾脏;取部分组织,将放有组织的70μm细胞筛置于60mm的培养皿中并加入适量的pbs,用注射器针芯轻轻研磨组织制成细胞悬液,置于离心机中2000rpm离心5min后弃去上清;细胞沉淀中加入2ml红细胞裂解液,用移液枪吹打细胞并离心,再用pbs洗涤细胞两次,最后用pbs重悬细胞,调整细胞浓度为4
×
107/ml。取50μl细胞悬液(含2
×
106个细胞)至1.5ml的离心管中,抗体(anti-cd44(clone im7),anti-tcrvβ6,anti-t-bet(clone 4b10),anti-ifn-γ(clone xmg1.2),anti-tnf-α(clone mp6-xt22))染色后流式分析结果显示,感染11d后,脾脏组织cd4
t细胞中cd44
hi t-bet
细胞的比例显著升高;感染23d时,感染组中cd44
hi
t-bet
的比例仍然显著高于对照组,但低于11d时的比例,结果如图9、图10。
82.(2)接下来,检测了感染鼠伤寒沙门氏菌11d后,细胞因子ifn-γ和tnf-α的细胞比例变化,结果显示,鼠伤寒沙门氏菌感染后显著促进了th1细胞释放细胞因子ifn-γ和tnf-α,如图11-13。
83.(3)随后检测了脾脏cd44
hi t-bet
中tcrvβ6的表达变化,结果表明:感染11d和23d后,cd44
hi
t-bet
t细胞中tcrvβ6的比例都显著高于对照组,如图14、图15;同样感染11d后,cd44
hi ifn-γ
和cd44
hi tnf-α
t细胞中tcrvβ6的表达也显著升高,如图16-19。
84.综上实验结果表明,cd4
tcrvβ6
t细胞亚群在抵抗和清除沙门氏菌感染的过程中具有重要作用,可以应用在制备用于增强机体抵抗和清除沙门氏菌感染的药物、抗鼠伤寒沙门氏菌的疫苗研究,以及制备识别鼠伤寒沙门氏菌的试剂等方面。
85.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。