1.该发明涉及氨己烯酸和其药学可接受的盐的散剂,该固体制剂不含任何辅料,适合较长时间存放。
背景技术:
2.氨己烯酸主要用于治疗顽固性、复杂性部分发作的癫痫和婴儿痉挛症,结合原料药的结构和理化性质,可将其制备成为口服片剂和散剂。由于儿童和婴幼儿的患者人群的特点,需要依据体重调节给药剂量,因此仅散剂可用于这部分人群患者。氨己烯酸散剂在服用前,需要用水配制成溶液,并且该药液是一次性使用。对于儿童用药尤其是婴幼儿用药,辅料的安全性至关重要,辅料可能是造成儿童用药副作用的因素,因此摄入的辅料越少,往往安全性相对就越高。考虑到经济和安全的原因,将氨己烯酸散剂进行优化,开发出不含任何辅料且与市售产品生物等效的散剂,是目前亟待解决的问题。
3.氨己烯酸是一种氨基酸结构,在酸性或碱性环境下均不稳定。通过将含有辅料和不含辅料的稳定氨己烯酸散剂放置稳定性对比发现,不含辅料的氨己烯酸散剂具有更好的相容性。本发明也通过工艺筛选及优化等手段,实现了工业化无辅料氨己烯酸散的制备。
技术实现要素:
4.本发明新型无辅料的氨己烯酸散剂增加了儿童用药的安全性,降低了成本并提高了药物稳定性,对于需要长期治疗的癫痫患者有了更好的的依从性。
5.本发明涉及一种氨己烯酸散剂,能够通过将氨己烯酸的固体及稀释液混合复溶而成。在某些实施方案中,复溶的溶液为澄清的溶液,所得溶液在合适的ph范围和所需的浓度范围内。本发明的固体剂型或者组合物可以盛装在合适的容器内,其用于盛装所述固体剂型或组合物制备溶液的工具也包含在本发明的范围内。同时,该工具也可用于给药和药物处理及治疗。
6.本发明提供了可制备溶液的稳定的干混粉末或颗粒,所制得的溶液包含氨己烯酸或其药学上等同的衍生物,该溶液具有良好化学稳定性的。
7.本发明还提供了治疗cns疾病的方法,其包括向有需要的受试者服用由本文所述的固体剂型和配方稀释剂所得到复溶的溶液;所述的配方稀释剂为水或特定ph值缓冲水溶液;优选的所述配方稀释剂ph范围为约6.0至约8.0,优选约6.1至约7.9,约6.2至约7.8,约 6.3至约7.7,约6.4至约7.6,或约6.5至约7.5,或约7.0。
8.任选的本发明的配方稀释剂为水,优选为饮用纯净水、蒸馏水、矿泉水、矿物质水、自来水、白开水。任选的,本发明的配方稀释剂为特定ph值的缓冲液,所述缓冲剂选自柠檬酸盐、柠檬酸、富马酸盐、富马酸、酒石酸盐、酒石酸、磷酸、磷酸二氢盐、磷酸氢二盐中的任意组合,所述缓冲剂具有足够的缓冲能力维持所述组合物溶解后的液体剂型的ph范围,优选地其中所述溶液中缓冲剂的浓度范围为10mm至200mm。
9.所述配方稀释剂任选含有药学上可接受的甜味剂和/或矫味剂。
10.所述甜味剂选自蔗糖、葡萄糖、山梨糖醇、三氯蔗糖、阿斯巴甜、糖精钠中的一种或多种,所述甜味剂的量占所述固体组合物溶解后的液体剂型的总体积的0.1%至5%w/v。
11.所述矫味剂选自薄荷,薄荷醇,樱桃香精,桔子香精,柠檬香精,石榴香精,浆果香精,草莓香精,香蕉香精,橙味香精和薄荷香精中的一种或多种,所述甜味剂的量占所述固体组合物溶解后的液体剂型的总体积的0.1%至5%w/v。
12.或者所述的稀释剂为水。
13.本发明的固体组合物和稀释剂存放在合适的容器中,所述容器的质地是指但不限于具有防儿童开启盖的玻璃瓶、hdpe、聚乙烯瓶或聚丙烯聚合物瓶。
14.本发明的固体剂型氨基烯酸药物组合物的固体状态为片剂、颗粒剂、粉剂、、迷你片剂。
15.具体而言,本发明涉及一种含有活性成分的散剂,其包括氨己烯酸或其药学上可接受的盐,异构体,复合物,多晶型,水合物或酯及其他衍生物。氨己烯酸与的液体介质/配方稀释液混合后,可复溶成溶液。
16.本发明还提供了一种口服给药的固体剂型的制备方法,其中所述口服给药的固体剂型包含氨乙烯酸或其药学上可接受的盐且不含聚维酮,且所述的固体剂型由下属方法制备得到:将氨乙烯酸或其药学上可接受的盐过筛、湿法制粒、湿整粒、流化床干燥、干整粒、混合、包装得到终产品。
17.优选的,所述过筛步骤的筛网孔径为0.4-0.6mm。
18.优选的,所述湿法制粒步骤的搅拌桨转速为120-180rpm,切刀速度为400-600rpm,氨乙烯酸或其药学上可接受的盐与水的质量比为6-8:1。
19.优选的,所述湿整粒步骤的网筛孔径为3-5mm,转速为800-1200rpm;所述干整粒的网筛孔径为1.2-1.6mm,转速为800-1200rpm。
20.优选的,所述流化床干燥进风温度为40-60℃,产品终点温度为25-40℃。
21.优选的,所述混合步骤转速为28-36rpm,时间为1-3分钟。
22.本发明中的复溶液体剂型,用于治疗包括儿童和婴儿在内患有cns疾病,例如抗性癫痫,复杂部分性癫痫发作,继发性全身性癫痫发作,难治性复杂部分性发作和婴儿痉挛的患者。该不含任何辅料的制剂,可提高儿童和婴儿的用药安全性。
23.下列文字提及或举例说明的氨己烯酸固体,口服溶液或治疗疾病的方法的具体实施方案,但并不意图将氨己烯酸固体,复溶溶液或治疗方法的范围限定于这些特定说明或实施例。出于实际和经济方面的考虑,本领域技术人员可进行各种修改,例如用于氨己烯酸的固体形态。
24.除非另有说明,否则本文所用的冠词“一”和“一个”是指“一个或多个”或“至少一个”。也就是说,通过不定冠词“一”或“一个”来引用实施例的任何元素或组分并不排除存在多于一个元素或组分的可能性。
25.如本文所用的术语“固体制剂”是指固态的剂型。非限制性实例包括粉末,颗粒,薄片,球状体和其他剂型,当加入可摄取的液体中时,易制备成所需的溶液。在一些实施方案中,固体制剂是干燥的且可流动的。
26.本文所用的术语“治疗有效量”是指有效预防,缓解或改善疾病症状或延长所治疗对象生存期的化合物或活性药物成分(api)的量。治疗有效量的确定完全在本领域技术人
员的能力范围内,特别是根据本文提供和披露的详细内容。
27.如本文所用的术语“受试者”是指动物或人。例如,需要治疗cns疾病的受试者可以是儿科患者。
28.在一些实施方案中,术语中疾病或病症的“治疗”或“疗法”是指改善疾病或病症(即,抑制或减缓疾病的发展或其中的至少一种临床症状的发展)的方法。在一些实施方案中,“治疗”或“疗法”是指改善至少一种身体的参数,其可能是受试者无法辨别的或意识到的。在一些实施方案中,“治疗”或“疗法”是指通过人体上(例如,可识别症状的稳定)地,或生理学上(例如,人体生理学参数的稳定)地或两者共同来调节疾病或病症。在一些实施方案中,“治疗”或“疗法”是指延迟疾病或病症的发作,或甚至预防疾病或病症的发作。“预防性治疗”应解释为用于预防疾病进展,或用于有病症发展风险的人的预防目的的任何治疗方式。
29.氨己烯酸(cas号:60643-86-9)为(rs)-4-氨基-5己烯酸,分子式如下:
[0030][0031]
在一些是实施例中,活性成分在本文披露的剂型中是r构型或者s构型。在一些实施例中,氨己烯酸的对映体,至少为10%,或至少20%,或者至少30%,至少50%,或至少80%,或至少95%.
[0032]
氨己烯酸药学上可接受的盐可能是一种无机酸盐,一种有机酸盐或金属盐。无机酸盐可能是盐酸盐,溴酸盐,磷酸盐,硫酸盐,焦硫酸盐,硝酸盐,偏磷酸盐,高氯酸盐或类似物。有机酸盐可能是羟基丁二酸盐,马来酸盐,柠檬酸盐,甲酸盐,醋酸盐,帕莫酸盐,天冬氨酸盐,乙酰水杨酸盐,富马酸盐,羟乙基磺酸盐,萘磺酸盐,苯丙酸盐,乙二酸盐,脂肪硫酸盐,芳香硫酸盐,苯磺酸盐,苯甲酸盐,樟脑磺酸盐,碳酸盐,肉硅酸盐,乙磺酸盐,葡萄糖酸盐,谷氨酸盐,羟基乙酸盐,庚酸盐,羟基萘盐,己酸盐,乳酸盐,乳糖醛酸盐,十二烷基磺酸盐,丙二酸盐,扁桃酸盐,甲磺酸盐,己二烯二酸盐,草酸盐,邻苯二甲酸盐,丙酸盐,丙酮酸盐,水杨酸盐,硬脂酸盐,琥珀酸盐,酒石酸盐和叔戊酸盐。金属盐可能是钙盐,钠盐,镁盐,锶盐及钾盐。
[0033]
本文还提供了含有本发明所述固体剂型组合物的装置或工具包。该装置或工具包含有复溶组合物和如何给药的说明。
[0034]
可复溶成口服溶液的固体剂型可通过本领域已知的一般方法制备。实例包括干粉混合,湿法制粒,干法制粒,喷雾干燥,热熔挤出,挤出滚圆和流化床造粒。
[0035]
本发明的另一方面提供了由本文所述的口服液体剂型。通常,可复溶成口服液体的固体剂型在复溶于稀释液(例如水或水溶液)之前储存在合适的容器中。该液体剂型可以由药剂师根据固体剂型组合物的说明书制备。在一个示例性实施方案中,通过向装有粉末的瓶子中加入准确量的水,然后摇动瓶子以使水与粉末混合直至所有固体已经溶解来制备溶液。口服给药注射器可根据处方吸取合适的药液量来给予病人。
[0036]
在将固体剂型的组合物复溶成口服溶液后,该液体可为接受治疗的受试者提供便利和准确的剂量滴定,包括例如婴幼儿患者和由于吞咽困难而不能吞咽片剂的患者。在某
些实施例中,这个液体剂型是溶液。在某些实施例中,液体剂型是无色或颜色没有变化。
[0037]
在一些实施方案中,固体剂型的组合物用水复溶后用于口服溶液为每约10ml液体含有约500mg药物的溶液。固体剂型的组合物在储存期间是稳定的,并且当用水或稀释液复溶后给药时,相应的液体溶液在治疗期间使用时也是稳定的。在一些实施方案中,溶液中的药物浓度高于约1mg/ml。在一些实施方案中,溶液中的药物浓度为约1至约500mg/ml,约 5至约400mg/ml,约10至约300mg/ml,约15至约200mg/ml,约20至约100mg/ml,约30 至约90mg/ml,约35至约75mg/ml,或约40至约60mg/ml。
[0038]
在一些实施方案中,液体剂型含有50mg至1000mg的氨己烯酸每剂型,固体剂型优选含 50mg,100mg,150mg,200mg,250mg,300mg,350mg,400mg,450mg,500mg,550mg,600mg, 650mg,700mg,750mg,800mg,850mg,900mg,950mg,1000mg的氨己烯酸。
[0039]
复溶溶液的ph范围为约6.0至约8.0。在一些实施方案中,溶液的ph范围为约6.1 至约7.9,约6.2至约7.8,约6.3至约7.7,约6.4至约7.6,或约6.5至约7.5。非限制性的液体剂型的ph例子为6.0,6.1,6.2,6.3,6.4,6.5,6.6,6.7,6.8,6.9和7.0。
[0040]
本发明的另一方面提供治疗中枢神经系统(cns)疾病的方法,包括向有需要的受试者施用本文所述的复溶的口服溶液。该溶液给药剂量为配制的量部分或者全部。每个单独部分的剂量可以由本领域普通技术人员根据有此需要的受试者的具体疾病状况来确定。当然,组合物的容器或装置上的说明也会为患者提供指导以给予适当量的溶液。在一些实施方案中,cns疾病可为婴儿痉挛症,复杂难治性癫痫发作,妥瑞氏综合征,难治性自身免疫性脑炎,可卡因依赖性,结节性硬化症引起的婴儿痉挛症。
[0041]
本发明的有益效果:
[0042]
本发明的固体剂型不含成人用药的常规辅料,依然取得了很好的稳定性,在药物相容性实验中未检测到相关物质的显著增加;省略辅料的使用,不仅仅降低了生产成本,而且减少了辅料可能引起的副作用和安全性风险,降低了临床上2岁以下儿童服用该剂型的风险。本发明的固体粉末经水或配方稀释剂稀释后即可使用,特别方便的适用于服药依从性不高的儿童或免疫力低下人群使用。
附图说明
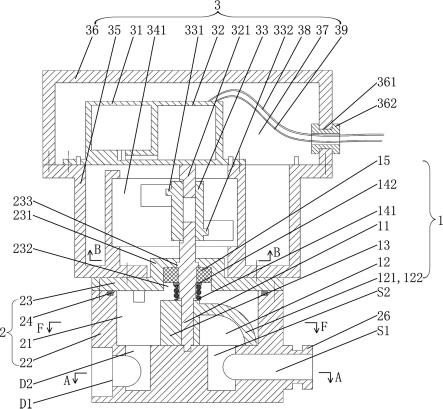
图1为本发明一种生产工艺流程图。
具体实施方式
[0043]
提供以下实施例是为了使本领域技术人员能够实施本发明,并且仅是对本发明的说明。这些实施例不应理解为限制本发明中权利要求所定义的范围。
[0044]
聚维酮
–
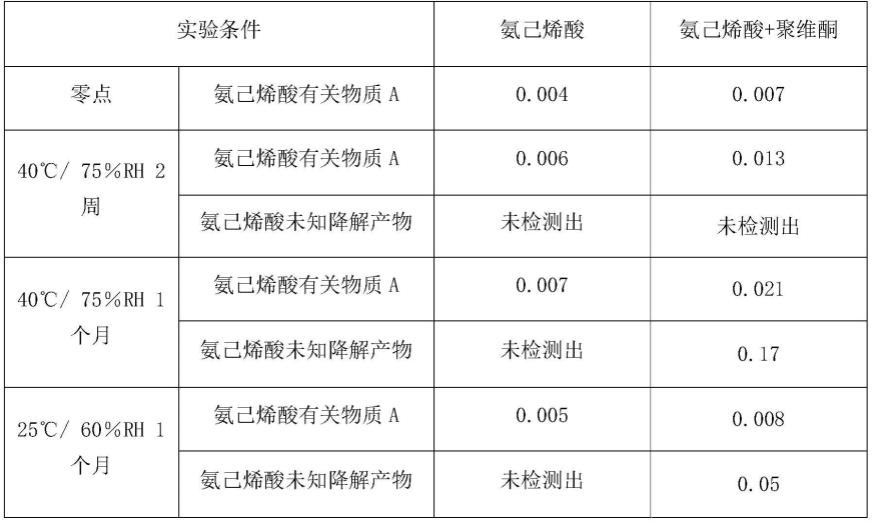
氨己烯酸相容性通过hplc法分析单独的氨己烯酸以及聚维酮和药物的二元混合物进行评估。样品经复合膜包装放置于25℃/60%rh和40℃/75%rh,其相容性结果总结在表1。
[0045]
表1.聚维酮-药物相容性试验结果
[0046][0047]
氨己烯酸的主要降解产物为有关物质a,所述有关物质a的结构为
[0048][0049]
发明人发现,室温下氨己烯酸/聚维酮二元混合物中有关物质a略高于氨己烯酸中的有关物质a,这种趋势在40%/75%rh更为显著,在1个月时,其二元混合物的有关物质a达到0.021%,而单独氨己烯酸仅为0.007%。长期稳定性条件(25/60%rh)这个变化趋势不明显。在加速和长期条件下放置一个月后,都检测到一个较高的未知降解产物。考虑到无论是从未知杂质,还是有关物质a的角度,单独的氨己烯酸似乎更加稳定。由于聚维酮在参比制剂中仅作为粘合剂,并且在制剂中不具有任何其它功能,而氨己烯酸具有非常高的溶解度》300mg/ml,它可作为其自身形成颗粒的粘合剂从而促进产品工艺的可行性,所以将聚维酮从制剂中剔除。
[0050]
将氨己烯酸连续生产了3批30kg批量的散剂,其生产工艺如图1所示。
[0051][0052]
我们将此处方和工艺生产的颗粒进行了考察。在最终的颗粒粉末填装至复合袋之前,先装入不锈钢桶中储存并考察了颗粒粉末在不锈钢桶中的保存时间。3个注册批次的储存时间如表2所示。
[0053]
表2.批次的保存时间
[0054]
颗粒批号产品生产日期复合袋包装日期储存时间1435654104.11,201605.09,201629天1434918503.24,201605.03,201641天1438501104.14,201605.10,201626天
[0055]
对具有最长储存时间的14349185批颗粒粉末质量属性和稳定性进行了评估。表3中的测试结果表明,41天后,颗粒粉末仍然保持良好的物理,化学和微生物稳定性以及流动
性。
[0056]
表3. 1439185批颗粒粉末储存41天的稳定性
[0057][0058][0059]
最后将储存了26-41天的三批颗粒粉末进行复合袋包装后并进行检测,最终检测结果均符合药典的要求,三个批次各项检测结果参见表4。
[0060]
表4三批30kg批次放行测试结果
[0061][0062]
我们又对包装的3批进行了稳定性考察,在25
±
2℃/60
±
5%rh条件下储存了36个月,并进行检测,最终检测结果见表5,表6,表7,均符合要求。
[0063]
表5批号auc160301,储存条件25
±
2℃/60
±
5%rh的稳定性数据
[0064][0065][0066]
表6批号auc160401,储存条件25
±
2℃/60
±
5%rh的稳定性数据
[0067][0068][0069]
表7批号auc160402,储存条件25
±
2℃/60
±
5%rh的稳定性数据
[0070][0071][0072]
综上说明不含任何辅料的本处方生产出来的产品,稳定性良好,在包装前可以存放41 天,在包装后可以在室温条件下保存36个月。
[0073]
复溶测试:
[0074]
将此处方和工艺生产的颗粒进行复溶测试,分别从三个批次14356541、14349185、 14385011制备得到的颗粒中取500mg置入试管,加入10ml蒸馏水,使用药勺搅拌,观察溶解状态并用秒表计时,至溶液呈澄清透明状,停止计时。
[0075]
同时,取市售氨己烯酸颗粒作为对照品,用同样的方法检验其相对复溶时间,其结果如下表所示:
[0076]
颗粒批号143565411434918514385011市售产品
复溶时间(s,秒)32323398
[0077]
以上数据表明本发明的方法制备得到产品复溶时间重复性好,且具有更加优异的复溶时间。
[0078]
以上内容不能认定本发明具体实施方式只局限于这些说明,对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思前提下,还可以做出若干简单推演或替换,都应当视为属于本发明由所提交的权利要求书确定的专利保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。