1.本发明属于遗传转换技术领域,具体涉及一种具有新遗传性状的细胞系和动物的构建方法。
背景技术:
2.在1997年通过mmct技术人们将人染色体转移到老鼠的a9细胞内,并成功的获得了包含人染色体的小鼠。在2002年,研发出了转人人工染色体(hacs)的牛,并成功在牛奶中检测到了人免疫球蛋白。在2018年,研发出转了人染色体的大鼠,用做药物代谢的模型。证明转染色体动物可以正常存活,并且转移的染色体能在宿主动物中正常表达。在2017年通过crispr/cas9技术成功敲出小鼠的y染色体克隆后获得了雌性小鼠。但在大动物特别是人上染色体数量异常往往导致个体畸形,如:21三体综合征、turner综合征、klinefelter综合征等。在2021年,利用talen敲除sry基因后克隆得到的母牛虽然有雌性性征但并没有卵细胞产生。证明牛的y染色体上可能存在其它抑制雌性生殖细胞发育的基因。
3.传统的动物育种法经济成本大,需要10-20年的时间,近年发展起来的转基因育种技术育种时间虽短但有一定的安全隐患,更关键的是国内外民众的抵触心理。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一种具有新遗传性状的细胞系和动物的构建方法,实现了在细胞水平进行染色体转移、性别逆转和染色体删除和添加,实现了合成具有特定遗传性状的细胞系,为后期细胞育种奠定了基础。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种具有新遗传性状的细胞系的构建方法,包括以下步骤:(1)敲除某一性别动物的细胞的一条性染色体,得缺失染色体细胞,例如:xy核型细胞中敲除y变成xo,xx核型细胞中敲除一个x变成xo
7.(2)在相同性别动物的成纤维细胞的另一条染色体进行定点敲入嘌呤霉素抗性基因,并将嘌呤霉素抗性基因标记的性染色体转入cho细胞,得标记cho细胞;
8.(3)将步骤(2)中标记cho细胞的性染色体转入步骤(1)所述缺失染色体细胞中,得具有新遗传性状的细胞;
9.步骤(1)和步骤(2)之间不存在时间上的先后顺序。
10.优选的,所述动物包括牛。
11.优选的,步骤(1)包括利用crispr/cas9的方法敲除成纤维细胞的y或x染色体。
12.优选的,步骤(2)包括利用mmct的方法将标记的x或y染色体转入cho细胞。
13.优选的,步骤(3)包括利用mmct的方法将x染色体转入xo型细胞或y染色体转入xo(来至xx核型),产生xy核型细胞。
14.本发明的另一个目的是利用上述构建方法得到的具有新遗传性状的细胞系。
15.本发明的另一个目的是提供一种具有新遗传性状的动物的培育方法,包括以下步
骤:将上述细胞系去掉抗嘌呤霉素抗性基因后,进行体细胞核移植,获得具有新遗传性状的动物。
16.优选的,通过将所述细胞系转染superpiggybac transposase载体,去掉抗嘌呤霉素抗性基因。
17.本发明的另一个目的是将上述构建方法或上述细胞系或上述培育方法应用到缩短动物育种年限中。
18.本发明的另一个目的是将上述构建方法或上述细胞系或上述培育方法应用培育目标性别且可育的动物中。
19.有益效果:本发明提供了一种方法,在细胞水平实现了:进行性别转换和遗传组成改变。本发明采用染色体技术、分子生物学技术、细胞工程手段实现了在细胞水平进行染色体转移、性别逆转和染色体删除和添加,实现了合成具有特定遗传性状的细胞系,为后期细胞育种奠定了基础。如在本发明实施例中,通过crispr/cas9敲除公牛的y染色体后,再转移一个牛x染色体,将细胞转变成正常母牛的细胞,通过体细胞克隆技术获得母牛。该技术可以快速获得性别反转的母牛,并且有正常的雌性生殖细胞,不含任何外源基因。
附图说明
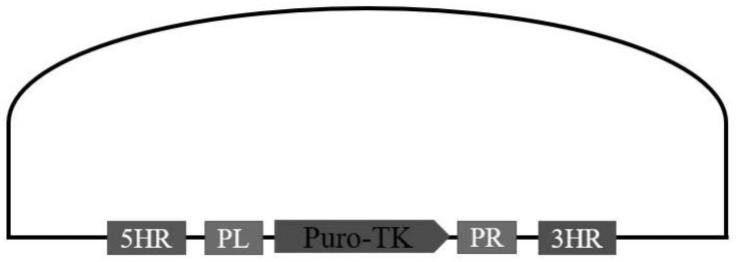
20.图1为打靶载体示意图,注:5hr和3hr为5’端和3’端同源臂;pl和pr为piggybac left arm和piggybac right arm;下同;
21.图2为pcr鉴定的引物位点;
22.图3表示牛原代成纤维细胞生长速度快,状态良好;
23.图4为xo型细胞鉴定结果图,y染色体的短臂末端存在uty基因,长臂末端存在sry基因,对转染后的细胞进行基因组dna的定量pcr;证明uty和sry确实不存在,y染色体被敲除;
24.图5表示在公牛成纤维细胞的x染色体进行定点敲入嘌呤霉素抗性基因的pcr结果及测序结果,证明嘌呤霉素抗性基因定点进入了x染色体;
25.图6为利用mmct技术将标记的x染色体转入cho细胞后的克隆形态;
26.图7为对cho细胞的测序结果。
具体实施方式
27.本发明提供了一种具有新遗传性状的细胞系的构建方法,包括以下步骤:(1)敲除某一性别动物的细胞的一条性染色体,得缺失染色体细胞;
28.(2)在相同性别动物的成纤维细胞的另一条染色体进行定点敲入嘌呤霉素抗性基因,并将嘌呤霉素抗性基因标记的性染色体转入cho细胞,得标记cho细胞;
29.(3)将步骤(2)中标记cho细胞的性染色体转入步骤(1)所述缺失染色体细胞中,得具有新遗传性状的细胞;
30.步骤(1)和步骤(2)之间不存在时间上的先后顺序。
31.本发明所述动物优选包括家畜,更优选包括牛,利用本发明所述构建方法,可实现染色体转移或交换,从而改变细胞的性别基因型,如:由xx转变为xy;或xy转变为xx,实施例中通过对牛的xy染色体定向转换为xx染色体进行说明,但是不能仅将其认定为本发明的全
部保护范围。
32.本发明所述细胞优选包括干细胞或体细胞,且进行遗传转换的两个细胞可以来源于同种、同属,也可以是不同种属间。
33.在本发明实施例中,为将xy染色体的细胞转换为xx染色体的细胞,具体通过如下步骤进行:
34.1.制备公牛成纤维细胞。
35.2.利用crispr/cas9敲除牛成纤维细胞的y染色体,获得xo型细胞。
36.3.在公牛成纤维细胞的x染色体进行定点敲入嘌呤霉素抗性基因。
37.4.利用mmct技术将标记的x染色体转入cho细胞。
38.5.将cho细胞中的牛x色体利用mmct技术转入xo型细胞,获得xx型细胞。
39.本发明在得到xx型细胞后,优选还包括将上述细胞系去掉抗嘌呤霉素抗性基因,更优选通过将所述细胞系转染superpiggybac transposase载体,去掉抗嘌呤霉素抗性基因。
40.值得注意的是,在本发明中,性别转换指的是通过替换性染色体,在遗传水平达到了细胞的性别转换;遗传组成改变是指通过常染色体的转换(转移),在遗传水平达到了细胞遗传组成的改变;染色体转移的方法如:通过对卵子或早期受精卵进行染色体注射;微细胞方法(mmct)融合达到染色体的转移;染色体的删除的方法如:采用酶切方法有目的的酶切一条或多条染色体,导致细胞染色体丢失,达到删除染色体的目的。酶切的方法包括了crispr/cas9;talens(transcription activator
–
like effector nucleases);zfns(zinc-fingernucleases)等方法。
41.本发明限定的染色体转移、转换的染色体数目可以是单个染色体或多条染色体。本发明通过离心或采用流式细胞仪分离的方法分离染色体,更具体的分离染色体的方法是mmct或其它类似于(包括)微细胞方法制备的染色体。
42.本发明所称染色体所指的染色体可以是人工染色体、人工合成的染色体、人工遗传突变的染色体和天然染色体。本发明染色体转移或交换的目的是为改变细胞的遗传成分,如:基因突变等;染色体转移或交换的目的是为改变细胞中染色体的数目;将这些细胞用于培育一个个体,如:通过克隆技术产生一个个体,或干细胞技术。
43.本发明的另一个目的是利用上述构建方法得到的具有新遗传性状的细胞系。
44.本发明的另一个目的是提供一种具有新遗传性状的动物的培育方法,包括以下步骤:将上述细胞系去掉抗嘌呤霉素抗性基因后,进行体细胞核移植,获得具有新遗传性状的动物。
45.本发明优选通过将所述细胞系转染superpiggybac transposase载体,去掉抗嘌呤霉素抗性基因。
46.本发明的另一个目的是将上述构建方法或上述细胞系或上述培育方法应用到缩短动物育种年限中。
47.本发明的另一个目的是将上述构建方法或上述细胞系或上述培育方法应用培育目标性别且可育的动物中。
48.利用本发明所述的技术仅需要3年时间即可获得目标性别且可育的动物,并且最终产物完全不含任何外源基因,因此更加安全,更容易被民众接受。
49.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
50.实施例1
51.1、公牛成纤维细胞的获取与培养
52.1.1取1-6月龄的牛胚胎,手术刀取2cm2的皮肤组织。
53.1.275%酒精浸泡10s后用dpbs(gibco#14190250)冲洗,重复3次。
54.1.3使用剪刀剪碎后,0.25%胰酶(gibco#25200072)消化5min。
55.1.4培养液终止消化后,使用70um的细胞筛(fisher scientific#22-363-548)过滤。
56.1.5过滤后的细胞悬液500g 5min离心。
57.1.6弃上清,用sto培养液重悬后再100mm培养皿中培养,传代后即可进行下一步实验(图3)。
58.sto培养液配方:dmem(gbico#10313021)为基液、10%的fbs(gbico#26140)、1%的glutamax(gbico#35050061)、1%的青链双抗(gbico#15140163)、bme(gbico#21985023)。
59.2、利用crispr/cas9敲除牛成纤维细胞的y染色体,获得xo型细胞
60.2.1针对牛y染色体的sgrna链接到crispr/cas9载体(px458#48138)。
61.2.2测序鉴定后使用大提试剂盒(qiagen#12941)进行质粒提取。
62.2.3使用转染试剂盒(lonza#:vpi-1002)对牛成纤维细胞进行转染。
63.2.448h后过流氏细胞仪挑选gfp阳性细胞到96孔板。
64.2.57天后将96孔板的细胞传代到48孔板,36h后传到12孔板。
65.2.6每个12孔板的细胞取进行基因组提取进行pcr鉴定(图4)。
66.2.7取y敲出的细胞进行下一步实验,即xo型细胞。
67.3、在公牛成纤维细胞的x染色体进行定点敲入嘌呤霉素抗性基因
68.3.1构建嘌呤霉素打靶载体及两个敲除载体。打靶载体示意图如图1所示。
69.两个敲除载体sgrna序列如下:
70.seq id no.1:ggcgctagattgacttgcaa;
71.seq id no.2:cactccaacacgcttcctaa。
72.3.2使用转染试剂盒(lonza#:vpi-1002)对牛成纤维细胞进行转染。
73.3.348h后用1.5μg/ml嘌呤霉素(gibco#a1113803)筛选转染的细胞。
74.3.448h后消化细胞对细胞进行计数,每200个细胞分到装有15mlsto培养基的100mm皿中。
75.3.56-7天后观察克隆形成情况,取状态好的克隆传代到48孔板。
76.3.636h后传代到12孔板中。
77.3.7每个12孔板的细胞进行基因组提取进行pcr鉴定。引物位点及序列如图2所示,鉴定结果如图5所示。
78.lf(seq id no.3):aggacgtgttttgtggaagc;
79.lr(seq id no.4):agttgccagccatctgttgt;
80.rf(seq id no.5):gtggatgtggaatgtgtgcg;
81.rr(seq id no.6):aacgtcattgttaccgatgct。
82.3.8取敲入嘌呤霉素抗性的阳性细胞进行下一步实验。
83.4、利用mmct技术将标记的x染色体转入cho细胞
84.4.1将3.8中的细胞传代培养后穿代到两个25cm2的培养瓶中,使用0.05μg/ml秋水仙素(sigma#c3915)处理细胞48h。
85.4.2随后使用10μg/ml的细胞松弛素b(sigma#c6762)处理。
86.4.3在两个250ml离心瓶中装入70ml 38-40℃的温水配平。
87.4.4将两个25cm2培养瓶装满10μg/ml的细胞松弛素b的dmem,封口膜封号培养瓶口严防污染。
88.4.5将25cm2培养瓶装入250ml离心瓶,配平后10000rpm 40min离心。
89.4.6将培养瓶角落的沉淀用5ml dmem重悬后在15ml离心管中500g10min离心洗涤微细胞沉淀,重复两次。
90.4.7用3ml 50μg/ml pha-p(sigma#l8754)重选微细胞加入受体cho细胞轻晃培养皿,放入培养箱孵育20min。
91.4.8用移液器吸干表面液体,加入3ml 47%的peg(sigma#8074895000)轻晃混匀。
92.4.9用5ml dmem洗涤表面的peg两次。
93.4.1048h后用8μg/ml的嘌呤霉素筛选48h。
94.4.11将细胞分到6个100mm培养皿中,每个培养皿装有4μg/ml嘌呤霉素的15ml培养液。
95.4.125天后将克隆团分别传代培养后进行pcr鉴定。
96.4.13阳性细胞即包含牛x染色体的cho细胞。cho细胞克隆形态及测序结果如6和图7所示,图中cattle x chromosome简写为cx。
97.5、将cho细胞中的牛x色体利用mmct技术转入xo型细胞,获得xx型细胞
98.5.1将4.13中的细胞传代培养后传代到两个25cm2的培养瓶中,使用0.05μg/ml秋水仙素处理细胞48h。
99.5.2随后使用10μg/ml的细胞松弛素b处理。
100.5.3在两个250ml离心瓶中装入70ml 38-40℃的温水配平。
101.5.5将两个25cm2培养瓶装满10μg/ml的细胞松弛素b的dmem,封口膜封号培养瓶口严防污染。
102.5.5将25cm2培养瓶装入250ml离心瓶,配平后10000rpm 50min离心。
103.5.6将培养瓶角落的微细胞沉淀用5ml dmem重悬后在15ml离心管中500g 10min离心洗涤微细胞沉淀,重复两次。
104.5.7用3ml pha-p重选微细胞加入受体2.7步骤的xo细胞轻晃培养皿,放入培养箱孵育20min。
105.5.8用移液器吸干表面液体,加入3ml 47%的peg轻晃混匀。
106.5.9用5ml dmem洗涤表面的peg两次。
107.5.1048h后用1.5μg/ml的嘌呤霉素筛选48h。
108.5.11将细胞分到6个100mm培养皿中,每个培养皿装有1μg/ml嘌呤霉素的15ml培养液。
109.5.127天后将克隆团分别传代培养后进行pcr鉴定。引物序列如下:
110.puro-f(seq id no.7):agataccgcaccgtattggc
111.puro-r(seq id no.8):atagacggtcctcacgggat
112.5.13阳性细胞即xx型细胞。
113.6、转染superpiggybac transposase载体,去掉抗嘌呤霉素抗性基因。
114.6.1对5.13的xo细胞转染super piggybac transposase(pb200pa-1)载体。
115.6.248h后消化计数,每100mm皿分200个细胞,培养液中添加flau。
116.6.37天后将克隆团消化后传代到48孔板。
117.6.448h后分别传代到12孔板。
118.6.5每个12孔板的细胞取进行基因组提取进行pcr鉴定。引物序列如seq id no.7和seq id no.8。
119.6.6 pcr阴性细胞,即嘌呤霉素抗性去除的非转基因细胞。
120.7、对xx型细胞进行体细胞核植技术,获得母牛。
121.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。