1.本发明属于蛋白质修饰技术领域,具体涉及一种多巴胺化修饰的谷氨酰胺多肽及其抗体和应用。
背景技术:
2.由mrna表达产生的蛋白质需要经过蛋白质翻译后的化学修饰,即蛋白质修饰,来完成蛋白质的特定功能。化学修饰会引起蛋白质的结构和理化改变,进而引起蛋白质的活性和功能改变。蛋白质的修饰与降解,和生命活动以及各种人类疾病密切相关,这一领域已成为全球生物医学界关注的焦点。蛋白质修饰包括磷酸化、乙酰化、糖基化、棕榈化等,是调节蛋白质功能的重要方式。例如,蛋白质的磷酸化与细胞信号传导、细胞周期调节、生长发育以及癌症机理等诸多生物学问题具有密切关系;蛋白质的乙酰化是调节蛋白质活性的一种重要方式;蛋白质的糖基化对蛋白质的三维结构和功能具有重要影响;蛋白质的棕榈化对于跨膜蛋白质的活性具有重要的调节作用;蛋白质的硝基化和亚硝基化在蛋白质的氧化损伤方面具有重要作用。来自芝加哥大学的赵英明教授通过lc-ms/ms的方法发现了组蛋白丙酰化、丁酰化、琥珀酰化、巴豆酰化、戊二酰化、2-羟基异丁基酰化、3-羟基丁酰化、苯甲酰化等一系列新型酰化修饰类型,为该领域的突破奠定了基础,据报道这些新型酰化修饰在肿瘤、炎症、生殖、代谢紊乱等众多生理病理调控中发挥关键作用。因此,对蛋白质修饰进行识别和检测对阐明蛋白质的功能、发现疾病的生物标志物和特异性药物靶点具有重要意义。
3.多巴胺(da,或3-羟酪胺,3,4-二羟苯乙胺)是内源性含氮有机化合物,为酪氨酸(芳香族氨基酸)在代谢过程中经二羟苯丙氨酸所产生的中间产物。多巴胺是大脑中含量最丰富的儿茶酚胺类神经递质。多巴胺作为神经递质调控中枢神经系统的多种生理功能,用来帮助细胞传送脉冲的化学物质。这种脑内分泌物和人的情欲、感觉有关,它传递兴奋及开心的信息。另外,多巴胺也与各种上瘾行为有关。多巴胺系统调节障碍涉及帕金森病,精神分裂症,tourette综合症,注意力缺陷多动综合症和垂体肿瘤的发生等。
4.2020年science期刊报道了组蛋白h3氨基端上5号谷氨酰胺残基多巴胺化(h3q5dop)修饰在可卡因诱导的中脑转录可塑性中起关键作用。该研究合成了组蛋白h3尾部多肽(1-10),对其中的q5氨基酸进行了多巴胺化修饰,并通过兔免疫制备了多克隆抗体,证实了组蛋白h3上5号谷氨酰胺残基多巴胺化(h3q5dop)修饰在可卡因诱导的中脑转录可塑性中起关键作用。但该抗体仅可用于识别组蛋白h3第5号谷氨酰胺残基的多巴胺化修饰,无法检测机体其他蛋白多肽谷氨酰胺的多巴胺化修饰。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种多巴胺化修饰的谷氨酰胺多肽及其抗体和应用,能有效识别蛋白多肽上的多巴胺修饰谷氨酰胺。
6.本发明提供了一种多巴胺化修饰的谷氨酰胺多肽,结构式如式i所示;
[0007][0008]
本发明提供了一种所述多巴胺化修饰的谷氨酰胺多肽的合成方法,包括以下步骤:
[0009]
1)将fmoc-glu(oall)-oh氨基酸连接至溶胀的树脂中,得到结构式如ii的化合物1;
[0010][0011]
其中,为树脂;
[0012]
2)在碱性条件下,将步骤1)中所述化合物1去除fmoc保护基,脱保护的化合物1与fmoc-cys(trt)-oh氨基酸进行缩合反应,得到结构式iii所示的化合物3;
[0013][0014]
3)将步骤2)中所述结构式iii所示的化合物3去除fmoc保护基,封闭n端氨基,除oall保护基,得到结构式如iv所示的化合物6;
[0015]
[0016]
4)在pybop催化下,将步骤3)中所述化合物6和多巴胺进行酰胺反应,裂解掉溶胀的树脂,得到多巴胺化修饰的谷氨酰胺多肽。
[0017]
优选的,步骤1)中fmoc-glu(oall)-oh氨基酸和溶胀的树脂的摩尔比为3:1。
[0018]
优选的,步骤2)中所述化合物1去除fmoc保护基的方法为用20%哌啶dmf溶液处理所述化合物15~15min,所述处理重复两次。
[0019]
优选的,步骤2)中脱保护的化合物1和fmoc-cys(trt)-oh氨基酸的摩尔比为1:3~4;
[0020]
在缩合反应时,还包括hbtu和diea参与,所述脱保护的化合物1、hbtu和diea的摩尔比为1:3~4:10~12。
[0021]
优选的,步骤3)中封闭n端氨基的试剂为boc酸酐;
[0022]
脱除oall保护基的试剂为三苯基膦(钯)。
[0023]
优选的,步骤4)中所述化合物6和多巴胺的摩尔比为1:3~4;
[0024]
步骤4)中裂解用切割液为含体积百分含量94.5~95.5%三氟乙酸、体积百分含量0.8%~1.2%的水、体积百分含量1.5%~2.5%的1,2-乙二硫醇和体积百分含量1.5%~2.5%三异丙基硅烷。
[0025]
本发明提供了一种多巴胺化修饰的谷氨酰胺多肽免疫抗原,包括所述多巴胺化修饰的谷氨酰胺多肽和偶联载体。
[0026]
本发明提供了一种识别蛋白质中多巴胺修饰的抗体,由所述多巴胺化修饰的谷氨酰胺多肽免疫抗原免疫动物,收集血清纯化得到。
[0027]
本发明提供了所述识别蛋白质中多巴胺修饰的抗体在制备检测多巴胺修饰的蛋白质的试剂盒中的应用。
[0028]
本发明提供的多巴胺化修饰的谷氨酰胺多肽,制备靶向多巴胺化修饰的谷氨酰胺多肽抗体,用于检测经多巴胺化修饰的谷氨酰胺多肽,对深入研究蛋白质的多巴胺化修饰及其生理、病理功能具有重要意义。
[0029]
本发明提供了一种识别蛋白质中多巴胺修饰的抗体,由所述多巴胺化修饰的谷氨酰胺多肽免疫抗原免疫动物,收集血清纯化得到。本发明采用elisa检测抗体效价,最终得到的抗原亲和纯化的修饰性特异性抗体,elisa检测抗体效价≥1:80000,修饰性多肽与非修饰性多肽效价区分大于16倍。通过dot-blotting的方法验证所纯化的多巴胺化抗体的特异性,结果表明所纯化的多巴胺化修饰抗体—cq(dopamine)抗体可以特异性的识别合成的修饰性多巴胺化谷氨酰胺多肽cq(dopamine),而不识别未经多巴胺化修饰的谷氨酰胺多肽,说明所述抗体具有较强的识别特异性。
附图说明
[0030]
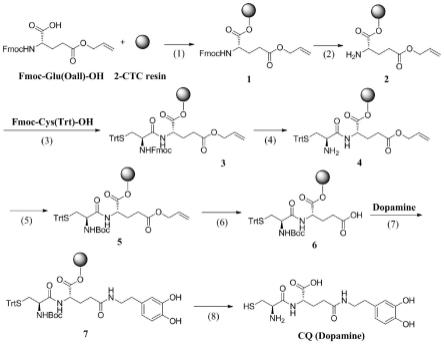
图1为本发明提供的多巴胺化修饰的谷氨酰胺多肽的合成路线图;
[0031]
图2为cq(dopamine)的hplc检测结果;
[0032]
图3为cq(dopamine)的ms检测结果;
[0033]
图4为cq的hplc检测结果;
[0034]
图5为cq的ms检测结果;
[0035]
图6为基于dot-blotting法验证抗体的特异性检测结果;
[0036]
图7为cq(dopamine)抗体特异性识别多巴胺化修饰的多肽的检测结果。
具体实施方式
[0037]
本发明提供了一种多巴胺化修饰的谷氨酰胺多肽,结构式如式i所示;
[0038][0039]
本发明提供了一种所述多巴胺化修饰的谷氨酰胺多肽的合成方法,包括以下步骤:
[0040]
1)将fmoc-glu(oall)-oh氨基酸连接至溶胀的树脂中,得到结构式如ii的化合物1;
[0041][0042]
其中,为树脂;
[0043]
2)在碱性条件下,将步骤2)中所述化合物1去除fmoc保护基,脱保护的化合物1与fmoc-cys(trt)-oh氨基酸进行缩合反应,得到结构式iii所示的化合物3;
[0044][0045]
3)将步骤2)中所述结构式iii所示的化合物3去除fmoc保护基,封闭n端氨基,除oall保护基,得到结构式如iv所示的化合物6;
[0046][0047]
4)在pybop催化下,将步骤3)中所述化合物6和多巴胺进行酰胺反应,裂解掉溶胀的树脂,得到多巴胺化修饰的谷氨酰胺多肽。
[0048]
本发明将fmoc-glu(oall)-oh氨基酸连接至溶胀的树脂中,得到结构式如ii的化合物1。
[0049]
在本发明中,所述树脂优选为2-chlorotrityl chloride resin。2-chlorotrityl chloride resin的取代度为1.03mmol/g。fmoc-glu(oall)-oh氨基酸和溶胀的树脂的摩尔比优选为3~4:1。溶胀的树脂的制备方法为将2-chlorotrityl chloride resin和15ml/gdcm混合振荡30~40min。
[0050]
在本发明中,所述fmoc-cys(trt)-oh氨基酸的溶剂优选为dmf。在连接时,还优选加入diea,所述脱保护的化合物1和diea的摩尔比优选为1:10~12。在连接时优选持续60~70min。连接后,优选用甲醇封闭。
[0051]
得到化合物1后,本发明在碱性条件下,将所述化合物1去除fmoc保护基,脱保护的化合物1与fmoc-cys(trt)-oh氨基酸进行缩合反应,得到结构式iii所示的化合物3。
[0052]
在本发明中,所述化合物1去除fmoc保护基的方法为用20%哌啶dmf溶液处理所述化合物15~15min,所述处理重复两次。去除fmoc保护后,优选对脱保护的化合物1进行检测和洗涤。所述检测方法优选为取若干粒树脂用乙醇洗三次,加入检测试剂检测,105℃~110℃加热5min,变深蓝色为阳性反应。所述检测试剂优选为茚三酮。所述洗涤的方法优选为用10ml/gdmf洗涤一次,用10ml/gdcm洗涤两次,用10ml/gdmf洗涤两次。
[0053]
在本发明中,所述脱保护的化合物1和fmoc-cys(trt)-oh氨基酸的摩尔比优选为1:3~4。所述缩合反应的条件优选为在室温下振荡60~70min。
[0054]
在本发明中,在缩合反应时,还包括hbtu和diea参与。所述脱保护的化合物1、hbtu和diea的摩尔比优选为1:3~4:10~12。
[0055]
得到结构式iii所示的化合物3后,本发明将所述结构式iii所示的化合物3去除fmoc保护基,封闭n端氨基,除oall保护基,得到结构式如iv所示的化合物6。
[0056]
在本发明中,封闭n端氨基的试剂优选为boc酸酐。脱除oall保护基的试剂优选为三苯基膦(钯)。所述化合物6和多巴胺的摩尔比优选为1:3~4。
[0057]
在本发明中,得到化合物6后,优选对化合物6进行洗涤。所述洗涤的方法优选为抽干原有溶剂,按10ml/g的量dmf洗涤两次,按10ml/g的量甲醇洗涤两次,按10ml/g的量dmf洗涤两次,按10ml/g的量dcm洗涤两次,然后抽干10min。
[0058]
得到化合物6后,在pybop催化下,将步骤3)中所述化合物6和多巴胺进行酰胺反应,裂解掉溶胀的树脂,得到多巴胺化修饰的谷氨酰胺多肽。
[0059]
在本发明中,裂解用切割液优选为含体积百分含量94.5%~95.5%三氟乙酸、体积百分含量0.8%~1.2%的水、体积百分含量1.5%~2.5%的1,2-乙二硫醇和体积百分含量1.5%~2.5%三异丙基硅烷。所述切割液的添加量为10/g树脂。所述切割液的处理时间优选为80~90min。裂解后,优选对裂解产物吹干和洗涤。所述吹干的方法优选为氮气吹干。所述洗涤优选用乙醚洗涤5~6次。洗涤后优选自然干燥。
[0060]
本发明提供了一种多巴胺化修饰的谷氨酰胺多肽免疫抗原,包括所述多巴胺化修饰的谷氨酰胺多肽和偶联载体。
[0061]
本发明对所述偶联载体没有特殊限制,采用本领域所熟知的偶联载体即可,例如bsa、klh等。本发明对所述免疫抗原的偶联方法没有特殊限制,采用本领域所熟知的完全抗原的制备方法即可。在本发明实施例中,所述免疫抗原为多巴胺化修饰的谷氨酰胺多肽-klh。
[0062]
本发明提供了一种识别蛋白质中多巴胺修饰的抗体,由所述多巴胺化修饰的谷氨酰胺多肽免疫抗原免疫动物,收集血清纯化得到。
[0063]
在本发明中,所述免疫动物的方法优选为多巴胺化修饰的谷氨酰胺多肽免疫抗原与弗氏完全佐剂按照等体积混合乳化,得到的疫苗1按照多点免疫法注射白兔,首次免疫15天后,多巴胺化修饰的谷氨酰胺多肽免疫抗原与弗氏不完全佐剂按照等体积混合乳化,得到的疫苗2按照多点免疫法注射白兔,以后每14天用疫苗2重复免疫3~4次。免疫结束后,收集白兔抗血清,经亲和柱层析进行纯化,收集洗脱液得到抗体组分,再经透析,得到纯化的抗体。所述抗体采用紫外吸收法检测蛋白浓度,elisa确定抗体效价。纯化的抗体可以特异性的识别合成的修饰性多巴胺化谷氨酰胺多肽cq(dopamine),而不识别未经多巴胺化修饰的谷氨酰胺多肽,这证明了该抗体具有良好的特异性。同时根据检测结果可知,所制备得到的抗体效价大于1:80000。
[0064]
鉴于所述抗体对修饰性多巴胺化谷氨酰胺多肽的识别作用具有良好的特异性,本发明提供了所述抗体在制备检测多巴胺修饰的蛋白质的试剂盒中的应用。
[0065]
在本发明中,所述试剂盒优选基于竞争elisa检测原理构建试剂盒。所述试剂盒优选还包括多巴胺修饰的谷氨酰胺多肽-bsa检测抗原。本发明对所述试剂盒的使用方法没有特殊限制,采用本领域所熟知的elisa检测试剂盒的使用方法即可。
[0066]
下面结合实施例对本发明提供的一种多巴胺化修饰的谷氨酰胺多肽及其抗体和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0067]
实施例1
[0068]
一种多巴胺化修饰的谷氨酰胺多肽的制备方法
[0069]
(一)合成原料及相关试剂、仪器:
[0070]
1、树脂:取代度为1.03mmol/g的2-chlorotritylchlorideresin(天津市南开合成科技有限公司)
[0071]
2、氨基酸:
[0072]
fmoc-cys(trt)-oh(成都诚诺,》99%)。
[0073]
3、特殊原料:
[0074]
fmoc-glu(oall)-oh。
[0075]
dopamine(多巴胺)。
[0076]
4、合成试剂:
[0077]
dmf(原产地韩国),dcm(原产地韩国),meoh(原产地日本),diea(新德化工,99%),hbtu(昊帆生物科技,99%)。
[0078]
5、脱保护试剂:
[0079]
哌啶(国药集团上海化学试剂公司,99%)。
[0080]
6、检测试剂:
[0081]
苯酚试剂(自配),吡啶试剂(自配),茚三酮试剂(自配)。
[0082]
7、裂解试剂:
[0083]
95%切割液:tfa(j.t.baker,99%),tis(上海达瑞精细化工,98%),edt(上海达瑞精细化工,98%),无水乙醚(上海实验,实测99.7%)。
[0084]
8、氮气:新联气体
[0085]
9、仪器:
[0086]
1.十二通道半自动多肽合成仪,上海强耀生物科技有限公司自主设计并申请专利的半自动多肽合成仪,专利号为201020226529.2。
[0087]
2.shimadzu高效液相色谱仪(型号:制备型,分析型,软件:class-vp.sevial system,厂商:shimadzu)。
[0088]
3.labconco冻干机(型号:freezone.plus.6,厂商:labconco)4.离心机(上海安亭科学仪器厂型号:tdl-40b)。
[0089]
(二)多肽合成见图1,具体步骤如下:
[0090]
合成顺序:从c端到n端。
[0091]
溶胀树脂的制备:将2-chlorotrityl chloride resin(2-ctcresin)加入到反应管中,按比例加入dcm(15ml/g),室温搅拌30min,过滤掉dcm,制备溶胀树脂。
[0092]
中间体1的制备:将溶胀的2-ctc resin、fmoc-glu(oall)-oh(3倍摩尔当量)、diea(10倍摩尔当量)加入到含有dmf(15ml/g)的反应管中,室温搅拌反应60min,甲醇封闭后过滤掉反应液,制备中间体1。
[0093]
中间体2的制备:将20%的哌啶/dmf溶液(15ml/g)加入到含有1的反应管中,室温搅拌反应5min,过滤掉反应液,再次加入20%的哌啶/dmf(15ml/g),继续室温搅拌反应15min,过滤掉反应液,制备无fmoc保护的中间体2。
[0094]
中间体3的制备:采用dmf(10ml/g)、dcm(10ml/g)、dmf(10ml/g)洗涤中间体2各两次,洗涤完毕后将中间体2加入到反应管中,并依次加入少量dmf溶解的fmoc-cys(trt)-oh(3倍摩尔当量)、少量dmf溶解的hbtu(3倍摩尔当量)、diea(10倍摩尔当量),室温搅拌反应30min,过滤掉反应液,制备中间体3。
[0095]
中间体4的制备:采用dmf(10ml/g)、dcm(10ml/g)、dmf(10ml/g)洗涤中间体3各两次,按照上述相同脱fmoc方法,使用20%哌啶/dmf溶液脱掉fmoc保护基,过滤掉反应液,dcm(10ml/g)洗涤,制备中间体4。
[0096]
中间体5的制备:将中间体4加入到反应管中,继续加入3倍摩尔当量的(boc)2o、3倍摩尔当量的三乙胺(tea)和dcm(15ml/g),室温搅拌反应2h,过滤掉反应液,dcm(10ml/g)洗涤后制备n端boc封闭的中间体5。
[0097]
中间体6的制备:将中间体5加入到反应管中,继续加入四三苯基膦钯(3倍摩尔当
量)、吗啉(3倍摩尔当量)和四氢呋喃(15ml/g),氮气保护下,室温搅拌反应2h,过滤掉反应液,制备无oall保护的中间体6。
[0098]
中间体7的制备:将中间体6加入到反应管中,继续加入dopamine(3倍摩尔当量)、pybop(3倍摩尔当量)和dcm(15ml/g),室温搅拌反应2h,过滤掉反应液,制备中间体7。
[0099]
多肽cq(dopamine)的制备:中间体7经dmf(10ml/g)、甲醇(10ml/g)、dmf(10ml/g)、dcm(10ml/g)各洗涤两次后干燥10min,并采用切割液(10/g;含95%tfa、1%水、2%edt、2%tis)切割80min,氮气吹干切割液,乙醚洗涤六次。
[0100]
十三.分析提纯:
[0101]
1.质谱检测条件:
[0102]
离子源:esi;毛细管电压(kv):
±
(2500~3000);
[0103]
脱溶剂气流量:800l/hr;脱溶剂温度:450℃;
[0104]
锥孔电压:30~50v;运行时间:1min;
[0105]
进样溶液及浓度:1mg/ml纯水溶液。
[0106]
2.用高效液相色谱将粗品提纯。
[0107]
hplc分析参数:检测波长:220nm溶液流速:1.0ml/min;进样体积:10μl;色谱柱类型:kromasil 100-5-c18,4.6
×
250mm,填料粒径5微米色谱柱温度:30℃;缓冲液a:含有0.1%三氟乙酸的乙腈溶液;缓冲液b:含有0.1%三氟乙酸的水溶液
[0108][0109]
十四.冻干
[0110]
收集目标多肽溶液,用0.22μm除菌过滤装入清洁无菌的西林瓶中,用胶塞半扣塞,将其放入冻干机中进行浓缩,冻干成粉末。
[0111]
十五.通过hplc和ms检测确认多肽结构。
[0112]
通过hplc(见2)和ms(图3)对多巴胺化修饰的谷氨酰胺多肽进行检测,证实了多巴胺化修饰的谷氨酰胺多肽的纯度为96.54%;分子量:385.44;[m h]
:386.31。
[0113]
对比例1
[0114]
按照实施例1的方法制备谷氨酰胺多肽,区别仅在于省略多巴胺修饰步骤,制备谷氨酰胺多肽(qc多肽)。
[0115]
通过hplc(见图4)和ms(图5)分别对谷氨酰胺多肽和多巴胺化修饰的谷氨酰胺多肽进行检测,证实了谷氨酰胺多肽的纯度为:99.82%,分子量为249.29,[m h]
:250.19。
[0116]
实施例2
[0117]
多抗制备流程
[0118]
一、实验材料
[0119]
主要试剂:
[0120]
sulfo-smcc、klh、sulfolink resin为美国pierce公司产品,弗式完全佐剂和弗式不完全佐剂均为美国sigma公司。
[0121]
nacl、kcl、na2hpo4·
12h2o、kh2po4、tris、glycine、edta、tmb、dmso、戊二醛等为国产分析纯试剂。
[0122]
耗材:
[0123]
透析袋为美国viskase公司产品,截留分子量14kd。
[0124]
p-10柱为美国biorad公司产品。
[0125]
仪器:
[0126]
磁力搅拌器(上海梅颖浦),旋转混合器(上海强运),紫外/可见光分光光度计(上海奥普勒),高速离心机(日立)
[0127]
溶液配制:
[0128]
1、pbs(磷酸缓冲盐)液:
[0129]
①
pbs贮存液(10
×
)配法:
[0130][0131]
溶于100ml去离子水中,调节ph值至7.2。
[0132]
②
pbs使用液配法(1
×
):
[0133]
取贮存液50ml加去离子水450ml即可,置室温或4℃保存备用。
[0134]
2、抗原包被液(cbs,1
×
):
[0135]
称取na2co
3 1.59g,nahco
3 2.93g,去离子水950ml,调节ph值至9.6,加去离子水定容至1000ml,4℃保存。
[0136]
3、封闭液
[0137]
称取5g脱脂奶粉,溶解于100ml pbs中,混匀,4℃保存备用(4℃保存不宜超过3天)。
[0138]
4、tmb显色液
[0139]
①
tmb贮存液:称取tmb粉末,用dmso配成1.5mg/ml的贮存液,20℃分装保存。
[0140]
②
naac缓冲液:配制200mm的naac溶液,用hac调节ph值至5.3。
[0141]
③
h2o2溶液,配制0.03%的h2o2溶液。
[0142]
④
使用时按照tmb贮存液:naac缓冲液:h2o2溶液=1:4:5的比例配制显色液,现配现用。
[0143]
5、终止液(2m硫酸)
[0144]
将100ml浓硫酸缓慢加入900ml水中(注意:必须往水中滴加浓硫酸),室温保存备用。
[0145]
6、抗体洗脱液:
[0146]
称取7.5g甘氨酸,溶于100ml去离子水,用浓盐酸调节ph值到2.7,4℃保存备用。
[0147]
二、方法及步骤:
[0148]
1.免疫流程:
[0149]
1.1按照上述步骤合成多肽
[0150]
1.2 cq(dopamine)肽与klh偶联(偶联剂为sulfo-smcc)作为免疫抗原,目标多肽/对照多肽分别与bsa偶联(偶联剂为戊二醛)作为检测抗原。其中偶联方法参见现有技术(李香凝;屈佳肴;蒋静等,针对断裂点集簇区-abelson鼠白血病病毒癌基因(bcr-abl)b3a2位点的兔多克隆抗体制备及鉴定,细胞与分子免疫学杂志2021,37(8):746-751)。
[0151]
1.3用pbs将免疫抗原分别稀释为1mg/ml,分装冻存于-20℃冰箱。
[0152]
1.4第1天,每种免疫抗原取2ml抗原加入2ml弗氏完全佐剂,乳化(检验乳化程度:将一滴乳化抗原液滴入生理盐水中,若不散开,表明已达到要求),颈背部皮下多点(至少8点)注射,每种抗原免疫4只新西兰白兔。
[0153]
1.5第15天,每种免疫抗原取2ml抗原加入2ml弗氏不完全佐剂,乳化(检验乳化程度:将一滴乳化抗原液滴入生理盐水中,若不散开,表明已达到要求),颈背部皮下多点(至少8点)注射,每种抗原免疫4只新西兰白兔。
[0154]
1.6第29天,每种抗原取2ml抗原加入2ml弗氏不完全佐剂,乳化(检验乳化程度:将一滴乳化抗原液滴入生理盐水中,若不散开,表明已达到要求),颈背部皮下多点(至少8点)注射,每种抗原免疫4只新西兰白兔。
[0155]
1.7第43天,每种抗原取2ml抗原加入2ml弗氏不完全佐剂,乳化(检验乳化程度:将一滴乳化抗原液滴入生理盐水中,若不散开,表明已达到要求),颈背部皮下多点(至少8点)注射,每种抗原免疫4只新西兰白兔。
[0156]
1.8第53天,颈动脉取血,将兔子处死。
[0157]
1.9兔血在4度放置过夜,离心(4度,10000rpm)30分钟,收集上清。
[0158]
2.抗体纯化流程:
[0159]
2.1目标多肽/对照多肽分别连接到活化的sulfolinkresin上,制备亲和柱,1ml sulfolink resin偶联1mg多肽;抗血清先过对照多肽柱,去除无修饰的特异性的抗体,收集流穿;流穿液过目标多肽柱,收集洗脱,即为修饰性特异性的抗体。
[0160]
2.2亲和柱用10倍柱体积pbs平衡,流尽溶液;兔血清经0.45μm滤膜过滤。
[0161]
2.3血清过抗原亲和柱,流尽溶液收集流穿。
[0162]
2.4 10倍柱体积pbs平衡,流尽溶液。
[0163]
2.5加入5ml抗体洗脱液,分管收集洗脱液,每管1ml。
[0164]
2.6收集的洗脱液检测280nm处的吸光度,抗体组分合并,对pbs透析。
[0165]
三、样品保存
[0166]
根据使用需要分装后保存于-20度以下,避免反复冻融。
[0167]
对比例2
[0168]
采用实施例2的方法制备多肽,区别仅在于采用谷氨酰胺多肽(cq多肽)替换cq(dopamine)。
[0169]
实施例3
[0170]
抗体验证
[0171]
一、elisa验证
[0172]
1包被:将包被抗原:cq-bsa和cq(dopamine)-bsa用cbs稀释为1μg/ml,加入酶标板中,每孔100μl,4℃过夜
[0173]
2封闭:将包被液弃去,每孔加入200μl封闭液(5%脱脂奶粉),37℃放置1.5小时。
[0174]
3加入样本:弃去封闭液,加入样品(血清或者抗体),每孔100μl加入酶标板,37℃放置1小时。
[0175]
4洗涤:用自来水冲洗10次,拍干。
[0176]
5加入二抗:酶标羊抗兔用封闭液稀释至工作浓度,每孔100μl加入酶标板,37℃放置30分钟。
[0177]
6洗涤:用自来水冲洗10次,拍干。
[0178]
7加入tmb显色底物:每孔100μl加入酶标板,37℃放置15分钟。
[0179]
8加入终止液:每孔加入2mh2so450μl。
[0180]
9读数:酶标仪od
450nm
读数。
[0181]
制备的elisa试剂盒中抗体和抗原的种类和浓度见表1。
[0182]
表1实验组和对照组中抗体和抗原的种类
[0183][0184]
elisa检测抗体结果见表2。
[0185]
表2 elisa检测抗体结果
[0186][0187]
由上述可知,elisa检测抗体效价≥1:80000,修饰性多肽对应抗体与非修饰性多肽对应抗体效价区分大于16倍。
[0188]
实施例4
[0189]
dot-blotting验证抗体特异性
[0190]
操作流程:
[0191]
1.裁取适当大小的硝酸纤维素膜。
[0192]
2.在不去除保护纸的条件下使用圆珠笔和模具在硝酸纤维素膜画出所需点样点
的范围。
[0193]
3.将修饰性目标多肽和非修饰性对照多肽样品稀释至50ng/μl。
[0194]
4.点样:去除上层的保护纸,在原来的印记处点样,每个印记点1μl。
[0195]
5.将点好样的膜室温放置30分钟左右,晾干。
[0196]
6.膜转到培养皿中,加入封闭液(5%脱脂奶粉),4℃过夜。
[0197]
7.加入一抗:倒去封闭液,一抗用封闭液稀释,摇床上室温孵育1小时。
[0198]
8.倒去一抗,pbst洗涤5次,摇床反应,每次5分钟。
[0199]
9.加入二抗:二抗(hrp标记的羊抗兔igg)用封闭液稀释,摇床上室温孵育1小时。
[0200]
10.倒去二抗,pbst洗涤5次,摇床反应,每次5分钟。
[0201]
11.曝光:加入发光底物,x光胶片曝光。
[0202]
通过dot-blotting的方法验证所纯化的多巴胺化抗体的特异性,结果显示,所纯化的多巴胺化修饰抗体—cq(dopamine)抗体可以特异性的识别合成的修饰性多巴胺化谷氨酰胺多肽cq(dopamine),而不识别未经多巴胺化修饰的谷氨酰胺多肽(见图6),进一步证明了该修饰抗体具有良好的特异性。
[0203]
实施例5
[0204]
用上述制备的多巴胺化修饰抗体—cq(dopamine)抗体与合成的谷氨酰胺多巴胺化修饰的多肽(cdqfek;cdq*fek和casiqkfg;casiq*kfg,*为多巴胺化修饰)进行免疫沉淀实验(ip),并进行蛋白质印迹(wb)检测。
[0205]
结果显示,得到的多巴胺化修饰抗体可以特异得识别多巴胺化修饰的谷氨酰胺多肽,而不识别未经多巴胺化修饰的谷氨酰胺多肽(见图7)。
[0206]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。