针对被病原体感染的细胞中诱导的抗原的疫苗接种
1.相关申请的交叉引用
2.本技术要求2020年1月29日提交的美国临时专利申请号62/967,152的权益和优先权,所述临时专利申请的内容特此以引用的方式整体并入。
技术领域
3.本发明部分地涉及用于产生抗感染用途的免疫应答的方法。
4.序列表
5.随此以电子方式提交的文本文件的内容以引用的方式整体并入本文。序列表的计算机可读格式副本(文件名称:seb-005pc_sequence_listing_st25,记录日期:2021年1月27日;文件大小:13,000字节)。
背景技术:
6.感染性疾病仍然是主要的健康问题。恰当的实例是属于疱疹病毒科的病毒,如巨细胞病毒(cmv)、爱泼斯坦-巴尔病毒(ebv)和单纯疱疹病毒(hsv),它们代表了重要的未满足的临床需求。例如,cmv是实体器官和同种异体造血干细胞移植中死亡的主要原因。尽管学术界和行业做出了广泛的努力,但除了几种拥有预防带状疱疹的水痘疫苗制剂外,迄今为止没有针对cmv、hsv或ebv的疫苗被批准用于临床使用。作为另一实例,人免疫缺陷病毒(hiv)在降低hiv相关的发病率和死亡率方面已经取得了成功(例如使用联合抗逆转录病毒疗法),但感染hiv的患者的预期寿命比没有感染所述病毒的患者短,并且根本原因可能是多因素的,包括过早衰老、药物毒性和合并症。
7.需要新的方法来对抗感染。
技术实现要素:
8.因此,本发明提供改变具有被病原体感染的细胞的受试者的免疫系统的方法。例如,本发明的方法刺激针对在所述被病原体感染的细胞中实验性/治疗性诱导的由细胞编码的抗原的免疫应答,例如疫苗应答。在各种实施方案中,本发明的方法在被病原体感染的细胞中诱导抗原,并且因此,受试者的免疫应答可针对这种细胞。在各个方面,本发明的方法针对任何被病原体感染的细胞中与抗原加工相关的转运蛋白(tap)下调诱导的抗原进行疫苗接种。
9.在一个方面,本发明提供了一种治疗有需要的受试者的病原性感染的方法,所述方法包括向所述受试者中的被病原体感染的细胞施用有效量的免疫调节剂,以指导受试者对在所述被病原体感染的细胞中实验性/治疗性诱导的由细胞编码的抗原的现有免疫应答,其中所述免疫调节剂抑制和/或下调抗原加工的介体并诱导抗原形成;并且所述受试者具有针对所述被诱导的抗原的现有免疫应答。
10.在实施方案中,所述病原体是细菌性病原体、病毒抗原或寄生性病原体。在实施方案中,所述病原体是病毒性病原体。在实施方案中,所述病毒来自疱疹病毒科,任选地选自
巨细胞病毒(cmv)、爱泼斯坦-巴尔病毒(ebv)和单纯疱疹病毒(hsv);或者是逆转录病毒,任选地选自人免疫缺陷病毒(hiv)和猿免疫缺陷病毒(siv)。
11.在实施方案中,所述免疫调节剂引发和/或增强抗病原性免疫应答,例如引发和/或增强针对被病原体感染的细胞中实验性/治疗性诱导的由细胞编码的抗原的免疫应答。在实施方案中,所述免疫调节剂抑制和/或下调抗原加工途径的介体。在实施方案中,所述免疫调节剂抑制和/或下调以下介体中的一者或多者:与抗原加工相关的er氨基肽酶(eraap)、与抗原加工相关的转运蛋白(tap)和恒定链(ii)。在实施方案中,所述免疫调节剂包含寡核苷酸分子如小干扰rna或微小rna,或针对所述抗原加工介体的反义rna或针对所述抗原加工介体的基因编辑蛋白,所述基因编辑蛋白选自成簇规律间隔的短回文重复序列(crispr)、talen、切口酶和锌指蛋白。在实施方案中,免疫调节剂还包含靶向剂。在实施方案中,靶向剂是寡核苷酸适体配体、基于蛋白质的靶向剂(任选地是抗体)、肽或它们的组合。在实施方案中,使所述免疫调节剂靶向所述被病原体感染的细胞或靶细胞,所述靶细胞任选地是树突细胞或其它抗原呈递细胞。
12.在实施方案中,所述方法降低所述病原性感染的严重程度或持续时间。
13.在实施方案中,所述病原性感染是cmv,并且所述受试者具有任选地由于干细胞或器官移植和/或hiv感染所致的受损的免疫系统。在实施方案中,所述病原性感染是cmv,并且所述受试者是出生前感染cmv的新生儿(即患有先天性cmv)、婴儿(即患有围产期cmv)或孕妇。
14.在实施方案中,所述病原性感染是ebv,并且所述受试者患有传染性单核细胞增多症。
15.在实施方案中,所述病原性感染是hsv,选自hsv-1和hsv-2。
16.在实施方案中,所述病原性感染是hiv,并且所述受试者患有1期hiv感染、2期hiv感染、3期hiv感染、机会性感染或疾病、或aids。
17.在实施方案中,所述免疫调节剂通过脂质载体递送至所述受试者。
18.在实施方案中,本发明的方法还包括施用另外的治疗剂。
附图说明
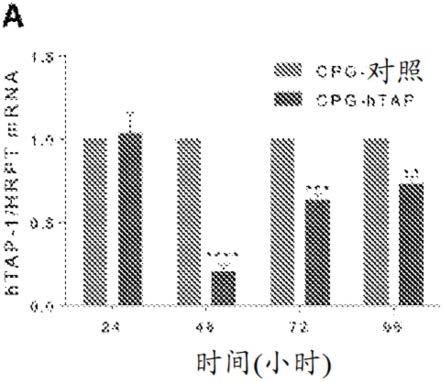
19.图1a-d.cpg-tap sirna脉冲dc在体外刺激人pbmc来源的cd8 t细胞,所述cd8 t细胞识别tap表达降低的肿瘤细胞。图1a.用cpg-tap sirna处理的dc中人tap-1rna水平的时程。用cpg-对照或tap sirna处理单核细胞来源的人dc,并在所指示的时间点生成mrna且通过qrt-pcr进行定量。显示的是一式两份进行的平均值和sem。将来自两个独立实验的结果合并。图1b.在用nucl-sirna处理并与识别hla-a2-p14复合物(32)的同源cd8 t细胞克隆一起培养的518a2黑素瘤细胞中p14(一种tap缺陷诱导肽)的呈递。通过elisa测量20小时刺激后的ifnγ产生。一式四份孔(n=2)的平均值和sem。图1c.tap teipp特异性cd8 t细胞的刺激。将来自hla-a2供体的cd8 t细胞用经cpg-tap sirna处理的自体dc进行刺激。在两轮刺激后,将cd8 t细胞分离并与tap缺陷型518a2细胞(518a2 tap ko)或与用nucl-sirna处理的tap充足型亲本细胞(518a2)一起共培养。通过elisa测量20小时刺激后的ifnγ产生。显示的是一式四份孔(n=2)的平均值和sem。图1d.tap teipp特异性cd8 t细胞的多克隆性。将如图c中描述的cd8 t细胞培养物与用六种先前描述的hla-a2限制性tap缺陷诱导肽(32)
脉冲的518a2细胞一起孵育。mage肽用作阴性对照。通过elisa测量20小时刺激后的ifnγ产生。显示的是一式四份孔(n=2)的平均值和sem。
20.图2针对由被cmv和ebv感染的细胞呈递的tap下调诱导的抗原的用cpg-tap sirna进行的体外“疫苗接种”。mrc5和ramos是分别易受cmv或ebv感染的两种人细胞系。通过测量ifnγ分泌来确定cd8 t细胞对被感染的细胞的抗原特异性识别。cd8 t细胞识别tap下调诱导的抗原的证据由以下事实表明:与缀合至对照sirna的cpg一起培养的pbmc来源的t细胞不产生ifnγ分泌。对于每种标记的条件,存在两个条形:cpg-对照(左)和cpg-tap(右)。
21.图3针对通过tap下调在被hiv感染的细胞中诱导的抗原的用cpg-tap sirna进行的体外“疫苗接种”。实验方案如图1所述,除了使培养的cd8 t细胞与感染了nl4-3 hiv病毒的人cem174 t细胞系反应,所述细胞系与缀合至tap或对照sirna的广泛中和抗hiv env2g12抗体一起孵育。tap 和tap-518a2细胞是充当阳性和阴性对照的人黑素瘤肿瘤细胞系。对于每种标记的条件,存在两个条形:cpg-对照(左)和cpg-tap(右)。
具体实施方式
22.本发明提供改变具有被病原体感染的细胞的受试者的免疫系统以刺激针对所述感染病原体的免疫应答,例如疫苗应答的方法。在各种实施方案中,本发明的方法在被病原体感染的细胞中诱导抗原,并且因此,受试者的免疫应答是针对这种细胞。
23.在一个方面,本发明提供了一种治疗有需要的受试者的病原性感染的方法,所述方法包括向所述受试者中的被病原体感染的细胞施用有效量的免疫调节剂,以指导受试者针对在被病原体感染的细胞中实验性/治疗性诱导的由细胞编码的抗原的现有免疫应答,其中所述免疫调节剂抑制和/或下调抗原加工的介体并诱导抗原形成;并且所述受试者具有针对所述被诱导的抗原的现有免疫应答。
24.感染治疗方法
25.在一些方面,所述方法用于消除病原体。在一些方面,本发明的方法用于治疗一种或多种感染。在一些实施方案中,本发明提供了治疗病毒感染(包括例如hiv和hcv)、寄生虫感染(包括例如疟疾)和细菌感染的方法。在各自实施方案中,感染诱导免疫抑制。例如,hiv感染经常导致受感染受试者的免疫抑制。因此,在各种实施方案中,此类感染的治疗可涉及调节免疫系统以有利于免疫刺激。可替代地,本发明提供了用于治疗诱导免疫激活的感染的方法。例如,肠道蠕虫感染一直与慢性免疫激活相关。在这些实施方案中,此类感染的治疗可涉及调节免疫系统以有利于免疫抑制超过免疫刺激。
26.在各种实施方案中,本发明提供了治疗病毒感染的方法,所述病毒感染包括但不限于急性或慢性病毒感染,例如呼吸道、乳头瘤病毒感染、单纯疱疹病毒(hsv)感染、人免疫缺陷病毒(hiv)感染以及内脏器官的病毒感染(如肝炎病毒感染)的急性或慢性病毒感染。在一些实施方案中,病毒感染是由黄病毒科的病毒引起的。在一些实施方案中,黄病毒科的病毒选自黄热病毒、西尼罗河病毒、登革热病毒、日本脑炎病毒、圣路易斯脑炎病毒和丙型肝炎病毒。在其它实施方案中,病毒感染是由微小核糖核酸病毒科的病毒(例如脊髓灰质炎病毒、鼻病毒、柯萨奇病毒)引起的。在其它实施方案中,病毒感染是由正粘病毒科的成员(例如流感病毒)引起的。在其它实施方案中,病毒感染是由逆转录病毒科的成员(例如慢病毒)引起的。在其它实施方案中,病毒感染是由副粘病毒科的成员(例如,呼吸道合胞病毒、
人副流感病毒、风疹病毒(例如腮腺炎病毒)、麻疹病毒和人偏肺病毒)引起的。在其它实施方案中,病毒感染是由布尼亚病毒科的成员(例如汉坦病毒)引起的。在其它实施方案中,病毒感染是由呼肠孤病毒科的成员(例如轮状病毒)引起的。在其它实施方案中,病毒感染是由疱疹病毒科的成员(例如巨细胞病毒(cmv)、爱泼斯坦-巴尔病毒(ebv)和单纯疱疹病毒(hsv))引起的。
27.在各种实施方案中,本发明提供了治疗寄生虫感染,如原生动物或蠕虫感染的方法。在一些实施方案中,寄生虫感染是由原生动物寄生虫引起的。在一些实施方案中,oritiziab寄生虫选自肠原生动物、组织原生动物或血液原生动物。说明性的原生动物寄生虫包括但不限于溶组织内阿米巴(entamoeba hystolytica)、兰伯氏贾第虫(giardia lamblia)、小鼠隐孢子虫(cryptosporidium muris)、冈比亚锥虫(trypanosomatida gambiense)、罗德西亚锥虫(trypanosomatida rhodesiense)、克氏锥虫(trypanosomatida crusi)、墨西哥利什曼原虫(leishmania mexicana)、巴西利什曼原虫(leishmania braziliensis)、热带利什曼原虫(leishmania tropica)、杜氏利什曼原虫(leishmania donovani)、刚地弓形虫(toxoplasma gondii)、间日疟原虫(plasmodium vivax)、卵形疟原虫(plasmodium ovale)、三日疟原虫(plasmodium malariae)、恶性疟原虫(plasmodium falciparum)、阴道毛滴虫(trichomonas vaginalis)和火鸡组织滴虫(histomonas meleagridis)。在一些实施方案中,寄生虫感染是由蠕虫寄生虫如线虫(例如有腺纲(adenophorea))引起的。在一些实施方案中,寄生虫选自侧尾腺口纲(secementea)(例如,毛首鞭形线虫(trichuris trichiura)、似蚓蛔线虫(ascaris lumbricoides)、蠕形住肠线虫(enterobius vermicularis)、十二指肠钩虫(ancylostoma duodenale)、美洲板口线虫(necator americanus)、粪类圆线虫(strongyloides stercoralis)、班氏吴策线虫(wuchereria bancrofti)、麦地那龙线虫(dracunculus medinensis))。在一些实施方案中,寄生虫选自吸虫(例如血吸虫、肝吸虫、肠吸虫和肺吸虫)。在一些实施方案中,寄生虫选自:曼氏血吸虫(schistosoma mansoni)、埃及血吸虫(schistosoma haematobium)、日本血吸虫(schistosoma japonicum)、肝片吸虫(fasciola hepatica)、大片吸虫(fasciola gigantica)、异形吸虫(heterophyes)、卫氏并殖吸虫(paragonimus westermani)。在一些实施方案中,寄生虫选自绦虫(例如,猪肉绦虫(taenia solium)、牛肉绦虫(taenia saginata)、短膜壳绦虫(hymenolepis nana)、细粒棘球绦虫(echinococcus granulosus))。
28.在各种实施方案中,本发明提供了治疗细菌感染的方法。在各种实施方案中,细菌感染是由革兰氏阳性细菌、革兰氏阴性细菌、需氧细菌和/或厌氧细菌引起的。在各种实施方案中,细菌选自但不限于葡萄球菌属(staphylococcus)、乳杆菌属(lactobacillus)、链球菌属(streptococcus)、八叠球菌属(sarcina)、埃希氏菌属(escherichia)、肠杆菌属(enterobacter)、克雷伯氏菌属(klebsiella)、假单胞菌属(pseudomonas)、不动杆菌属(acinetobacter)、分枝杆菌属(mycobacterium)、变形杆菌属(proteus)、弯曲杆菌属(campylobacter)、柠檬酸杆菌属(citrobacter)、奈瑟氏菌属(nisseria)、芽孢杆菌属(baccillus)、拟杆菌属(bacteroides)、消化球菌属(peptococcus)、梭菌属(clostridium)、沙门氏菌属(salmonella)、志贺氏菌属(shigella)、沙雷氏菌属(serratia)、嗜血杆菌属(haemophilus)、布鲁氏菌属(brucella)以及其它生物体。在实施
方案中,细菌选自但不限于铜绿假单胞菌(pseudomonas aeruginosa)、荧光假单胞菌(pseudomonas fluorescens)、食酸假单胞菌(pseudomonas acidovorans)、产碱假单胞菌(pseudomonas alcaligenes)、恶臭假单胞菌(pseudomonas putida)、嗜麦芽寡养单胞菌(stenotrophomonas maltophilia)、洋葱伯克霍尔德菌(burkholderia cepacia)、嗜水气单胞菌(aeromonas hydrophilia)、大肠杆菌(escherichia coli)、弗氏柠檬酸杆菌(citrobacter freundii)、鼠伤寒沙门氏菌(salmonella typhimurium)、伤寒沙门氏菌(salmonella typhi)、副伤寒沙门氏菌(salmonella paratyphi)、肠炎沙门氏菌(salmonella enteritidis)、痢疾志贺氏菌(shigella dysenteriae)、福氏志贺氏菌(shigella flexneri)、宋内氏志贺氏菌(shigella sonnei)、阴沟肠杆菌(enterobacter cloacae)、产气肠杆菌(enterobacter aerogenes)、肺炎克雷伯氏菌(klebsiella pneumoniae)、产酸克雷伯氏菌(klebsiella oxytoca)、粘质沙雷氏菌(serratia marcescens)、土拉弗朗西斯氏菌(francisella tularensis)、摩氏摩根菌(morganella morganii)、奇异变形杆菌(proteus mirabilis)、普通变形杆菌(proteus vulgaris)、产碱普罗威登斯菌(providencia alcalifaciens)、雷氏普罗威登斯菌(providencia rettgeri)、斯氏普罗威登斯菌(providencia stuartii)、鲍曼不动杆菌(acinetobacter baumannii)、醋酸钙不动杆菌(acinetobacter calcoaceticus)、溶血不动杆菌(acinetobacter haemolyticus)、小肠结肠炎耶尔森氏菌(yersinia enterocolitica)、鼠疫耶尔森氏菌(yersinia pestis)、假结核耶尔森氏菌(yersinia pseudotuberculosis)、中间耶尔森氏菌(yersinia intermedia)、百日咳博代氏杆菌(bordetella pertussis)、副百日咳博代氏杆菌(bordetella parapertussis)、支气管炎博代氏杆菌(bordetella bronchiseptica)、流感嗜血杆菌(haemophilus influenzae)、副流感嗜血杆菌(haemophilus parainfluenzae)、溶血嗜血杆菌(haemophilus haemolyticus)、副溶血嗜血杆菌(haemophilus parahaemolyticus)、杜克雷嗜血杆菌(haemophilus ducreyi)、多杀巴斯德氏菌(pasteurella multocida)、溶血巴斯德氏菌(pasteurella haemolytica)、粘膜炎布兰汉球菌(branhamella catarrhalis)、幽门螺杆菌(helicobacter pylori)、胎儿弯曲杆菌(campylobacter fetus)、空肠弯曲杆菌(campylobacter jejuni)、大肠弯曲杆菌(campylobacter coli)、伯氏疏螺旋体(borrelia burgdorferi)、霍乱弧菌(vibrio cholerae)、副溶血弧菌(vibrio parahaemolyticus)、嗜肺军团菌(legionella pneumophila)、单核细胞增多性李斯特氏菌(listeria monocytogenes)、淋病奈瑟菌(neisseria gonorrhoeae)、脑膜炎奈瑟菌(neisseria meningitidis)、金氏菌属(kingella)、莫拉氏菌属(moraxella)、阴道加德菌(gardnerella vaginalis)、脆弱拟杆菌(bacteroides fragilis)、狄氏拟杆菌(bacteroides distasonis)、拟杆菌属3452a同源组、普通拟杆菌(bacteroides vulgatus)、卵形拟杆菌(bacteroides ovalus)、多形拟杆菌(bacteroides thetaiotaomicron)、单形拟杆菌(bacteroides uniformis)、埃氏拟杆菌(bacteroides eggerthii)、内脏拟杆菌(bacteroides splanchnicus)、艰难梭菌(clostridium difficile)、结核分枝杆菌(mycobacterium tuberculosis)、鸟分枝杆菌(mycobacterium avium)、胞内分枝杆菌(mycobacterium intracellulare)、麻风分枝杆菌(mycobacterium leprae)、白喉棒状杆菌(corynebacterium diphtheriae)、溃疡棒状杆菌(corynebacterium ulcerans)、肺炎链球菌(streptococcus pneumoniae)、无乳链球菌
(streptococcus agalactiae)、酿脓链球菌(streptococcus pyogenes)、粪肠球菌(enterococcus faecalis)、屎肠球菌(enterococcus faecium)、金黄色葡萄球菌(staphylococcus aureus)、表皮葡萄球菌(staphylococcus epidermidis)、腐生葡萄球菌(staphylococcus saprophyticus)、中间葡萄球菌(staphylococcus intermedius)、猪葡萄球菌猪亚种(staphylococcus hyicus subsp.hyicus)、溶血葡萄球菌(staphylococcus haemolyticus)、人葡萄球菌(staphylococcus hominis)或解糖葡萄球菌(staphylococcus saccharolyticus)。
29.免疫调节剂
30.在各种实施方案中,本发明涉及免疫调节剂。在各种实施方案中,免疫调节剂引发和/或增强抗感染免疫应答。在各种实施方案中,免疫调节剂是疫苗。在各种实施方案中,免疫调节剂刺激针对新抗原的免疫应答的产生。在各种实施方案中,免疫调节剂针对新抗原进行疫苗接种。在各种实施方案中,免疫调节剂通过产生新抗原介导的免疫应答来引发和/或增强抗感染免疫应答。
31.在一些实施方案中,免疫调节剂在被病原体感染的细胞中原位诱导新抗原。
32.在一些实施方案中,免疫调节剂提供抗原加工途径的关键介体的靶向抑制和/或下调。在各种实施方案中,免疫调节剂提供eraap的靶向抑制和/或下调。在各种实施方案中,免疫调节剂提供与抗原加工相关的转运蛋白(tap)的靶向抑制和/或下调。在各种实施方案中,免疫调节剂提供恒定链(ii)的靶向抑制和/或下调。
33.在一些实施方案中,免疫调节剂提供抗原加工途径的关键介体,例如eraap、tap和ii中的一者或多者的靶向抑制和/或下调,并且在具有所述抑制和/或下调的细胞中提供相同的表位(即表位生成不是随机的)。
34.在一些实施方案中,免疫调节剂向被病原体感染的细胞提供抗原加工途径的关键介体的靶向抑制和/或下调。
35.eraap是修剪tap转运肽以优化它们与新生mhc i类分子的缔合的er驻留氨基肽酶(参见nature.2002;419(6906):480-3)。重要的是,不希望受理论束缚,eraap缺乏诱导mhc i类呈递的多肽组中的显著改变。一些肽在新肽出现时丢失,可能不希望受理论束缚,新肽出现可能是因为它们逃避eraap加工。与tap缺陷型细胞一样,eraap缺陷型细胞在野生型小鼠中具有免疫原性,从而诱导针对野生型小鼠尚未耐受的新eraap丢失诱导肽的t细胞应答并抑制肿瘤生长。新肽由经典mhc ia类分子以及非经典mhc ib类分子(特别是qa-1b)两者呈递。在h-2b背景中由qa-1b呈递的显性肽被鉴定为源自fam49b蛋白的fyaeatpml(fl9)。fl9肽的qa-1b限制性呈递刺激野生型小鼠中可杀死eraap缺陷型靶标、但不杀死eraap充足型靶标的cd8 t细胞应答。
36.tap是mhc i类呈递的关键组分,负责将蛋白酶体产生的肽从细胞质转运至er,在所述er中所述肽被负载到新生mhc i类分子上(参见nat rev immunol.2011;11(12):823-36。)可以想象但不希望受理论束缚,tap功能在肿瘤中经常被下调以避免免疫识别。tap缺陷型细胞呈递由替代抗原加工途径产生的新型肽-mhc复合物,所述替代抗原加工途径在没有典型tap介导的途径的情况下被上调或变得占主导地位。tap缺乏诱导的肽(称为“与受损的肽加工相关的t细胞表位”或teipp)由经典mhc ia类分子以及非经典qa-1b分子呈递。重要的是,tap缺陷型细胞或负载有受限于经典mhc ia和qa-1b两者的teipp肽的dc可刺激野
生型小鼠中的cd8 t细胞应答,并且用负载teipp的dc、tap缺陷型dc或teipp特异性cd8 t细胞的过继转移进行疫苗接种显示可抑制tap缺陷型肿瘤的生长,但不抑制tap充足型肿瘤的生长。
37.恒定链是参与mhc ii类蛋白的形成和转运的多肽。恒定链的细胞表面形式被称为cd74。mhc ii类朝向细胞表面的路径涉及在粗面内质网中,α链和β链与ii之间的缔合,所述缔合使复合物稳定。在没有恒定链的情况下,α和β蛋白将不会缔合。ii在er中三聚化,与mhc ii类分子缔合,并作为九亚基复合物从er释放。这种mhc-恒定复合物从rer传递至高尔基体并且传递出高尔基体。在移动至细胞表面之前,含有这种复合物的囊泡与内吞区室融合,其中外部蛋白质已被分解成片段。在此,恒定链被蛋白水解降解,并且来自外部蛋白质的肽与α-1和β-1结构域之间的通道中的mhc ii分子缔合。所产生的mhc ii-肽复合物进入其表达的表面。
38.在一些实施方案中,免疫调节剂抑制和/或下调无义介导的mrna(nmd)过程。nmd是真核细胞中的进化上保守的监视机制,可阻止含有提前终止密码子(ptc)的mrna的表达。不希望受理论束缚,的抑制导致由含有ptc的mrna编码的几种产物的上调,并且由异常剪接或nmd依赖性自动调控选择性剪接产生的许多这些产物编码尚未诱导耐受的新肽。在一些实施方案中,免疫调节剂是下调某些nmd因子(例如,smg1、upf1、upf2、upf3、rent1、rent2、eif4a、upf1、upf2、upf3b、rnps1、y14、magoh、nmd1或它们的组合)的小干扰rna(sirna)。
39.在一些实施方案中,免疫调节剂包含小干扰rna、或微小rna、或反义rna。
40.在一些实施方案中,免疫调节剂包含寡核苷酸分子,如例如通过靶向剂靶向被病原体感染的细胞或靶细胞(任选地是树突细胞或其它抗原呈递细胞)的小干扰rna、或微小rna、或反义rna。
41.在一些实施方案中,免疫调节剂包含寡核苷酸分子,如通过缀合至寡核苷酸适体配体或基于蛋白质的或基于肽的靶向剂靶向被病原体感染的细胞或靶细胞(任选地是树突细胞或其它抗原呈递细胞)的小干扰rna、或微小rna、或反义rna。
42.在一些实施方案中,针对被病原体感染的细胞的靶向策略涉及与在被病原体感染的细胞的表面上表达的病原体(例如病毒)产物结合的配体(例如抗体、肽、抗体)。在一些实施方案中,针对专职抗原呈递细胞的靶向策略涉及使用诸如(作为非限制性实例)cpg寡核苷酸的策略靶向细胞表面上与用于被病原体感染的细胞的受体不同的受体,所述不同的受体包括(作为非限制性实例)tlr9和clec9a。
43.在各种实施方案中,免疫调节剂产生抗原加工途径的特异性介体,如eraap、tap和ii中的一者或多者的抑制和/或下调,并刺激免疫系统尚未耐受的新表位,并且因此它们基本上可作为新抗原发挥作用。此类表位是通常未呈递的非突变的亚显性表位,并且因此携带降低的自身免疫性风险。重要的是,由eraap、tap和ii中的一者或多者的下调产生的表位不是由于细胞中的随机事件产生的,因此它们更喜欢被共享,即由其中相应的靶标被下调的任何细胞呈递的相同表位。
44.在各种实施方案中,免疫调节剂基本上不触发自身免疫反应。
45.在各种实施方案中,免疫调节剂包含对所需靶细胞,例如被病原体感染的细胞(例如,被本文所述的任何病原体或微生物感染的细胞)具有特异性的靶向剂。在各种实施方案中,免疫调节剂包含对所需靶细胞,例如树突细胞或其它抗原呈递细胞具有特异性的靶向
剂。
46.在实施方案中,cpg寡核苷酸用于使tap sirna靶向树突细胞或其它抗原呈递细胞。
47.在实施方案中,使用例如抗体、肽或适体将靶向剂引导至树突细胞或其它抗原呈递细胞上的蛋白质、抗原或受体,诸如例如clec9a、dec205、xcr1、rank、cd36/srb3、lox-1/sr-e1、cd68、marco、cd163、sr-a1/msr、cd5l、srec-1、cl-pi/colec12、srec-ii、limpiiisrb2、rp105、tlr4、tlr1、tlr5、tlr2、tlr6、tlr3、tlr9、4-ibb配体/tnfsf9、il-12/il-23p40、4-氨基-1,8-萘二甲酰亚胺、ilt2/cd85j、ccl21/6ckine、ilt3/cd85k、8-氧代基-dg、ilt4/cd85d、8d6a、ilt5/cd85a、a2b5、lutegrin a 4/cd49d、aag、整联蛋白β2/cd18、amica、朗格汉斯蛋白(langerin)、b7-2/cd86、白三烯b4 rl、b7-h3、lmir1/cd300a、blame/slamf8、lmir2/cd300c、clq r1/cd93、lmir3/cd300lf、ccr6、lmir5/cd300lb ccr7、lmir6/cd300le、cd40/tnfrsf5、mag/siglec-4-a、cd43、mcam、cd45、md-1、cd68、md-2、cd83、mdl-1/clec5a、cd84/slamf5、mmr、cd97、ncamli、cd2f-10/slamf9、骨激活素(osteoactivin)gpnmb、chern 23、pd-l2、clec-1、rp105、clec-2、clec-8、siglec-2/cd22、cracc/slamf7、siglec-3/cd33、dc-sign、dce205、siglec-5、dc-signr/cd299、siglec-6、dcar、siglec-7、dcir/clec4a、siglec-9、dec-205、siglec-10、dectin-1/clec7a、siglec-f、dect in-2/clec6a、signr1/cd209、dep-1/cd148、signr4、dlec、slam、emmprin/cd147、tccr/wsx-1、fc-γr1/cd64、tlr3、fc-γriib/cd32b、trem-1、fc-γriic/cd32c、trem-2、fc-y riia/cd32a、trem-3、fc-γriii/cd16、treml1/tlt-1、icam-2/cd102和辣椒素(vanilloid)r1。
48.在实施方案中,使用例如抗体、肽或适体将靶向剂引导至树突细胞或其它抗原呈递细胞上的受体,如clec9a或dec205。
49.在各种实施方案中,免疫调节剂包含靶向剂,如适体-寡核苷酸分子。在一些实施方案中,适体对所需靶细胞,例如被病原体感染的细胞(例如,本文所述的任何病原体或微生物的细胞)具有特异性。在各种实施方案中,免疫调节剂包含核仁蛋白适体。在各种实施方案中,免疫调节剂包含上皮细胞粘附分子(epcam)适体(例如,5
′‑
gcgacugguuacccggucg-3
′
(seq id no:22)或其变体)。在各种实施方案中,免疫调节剂包含vegf适体。
50.在各种实施方案中,靶向剂是针对目标蛋白质、抗原或受体的抗体、抗体形式或它们的包含互补位的片段。在各种实施方案中,抗体是包含两条重链和两条轻链的全长多聚体蛋白。每条重链包含一个可变区(例如,vh)和至少三个恒定区(例如,ch1、ch2和ch3),并且每条轻链包含一个可变区(v
l
)和一个恒定区(c
l
)。可变区决定抗体的特异性。每个可变区包含侧接四个相对保守的框架区(fr)的三个高变区,也称为互补决定区(cdr)。三个cdr(称为cdr1、cdr2和cdr3)促成了抗体结合特异性。在一些实施方案中,抗体是嵌合抗体。在一些实施方案中,抗体是人源化抗体。
51.在一些实施方案中,靶向剂是抗体衍生物或形式。在一些实施方案中,靶向剂包含靶向部分,所述靶向部分是单结构域抗体、重组仅重链抗体(vhh)、单链抗体(scfv)、鲨鱼仅重链抗体(vnar)、微生物蛋白质(半胱氨酸结蛋白,打结素(knottin))、darpin;四连接素(tetranectin);亲和体(affibody);跨膜抗体(transbody);抗运载蛋白(anticalin);adnectin;affilin;affimer、微型体(microbody);肽适体;奥特瑞斯(alterases);塑性抗体(plastic antibodies);费洛体(phylomer);斯塔都体(stradobody);巨型体
(maxibody);伊维体(evibody);菲诺体(fynomer)、犰狳重复序列蛋白、库尼茨型结构域(kunitz domain)、高亲和性多聚体(avimer)、阿特里体(atrimer)、蛋白水解激活抗体(probody)、免疫体(immunobody)、三功能抗体(triomab)、特洛伊体(troybody);肽体(pepbody);疫苗体(vaccibody)、单特异性体(unibody);双特异性体(duobody)、fv、fab、fab'、f(ab')2、肽模拟分子或合成分子,如美国专利号或专利公布号us 7,417,130、us 2004/132094、us 5,831,012、us 2004/023334、us 7,250,297、us 6,818,418、us 2004/209243、us 7,838,629、us 7,186,524、us 6,004,746、us 5,475,096、us 2004/146938、us 2004/157209、us 6,994,982、us 6,794,144、us 2010/239633、us 7,803,907、us 2010/119446和/或us 7,166,697中所描述,所述专利的内容特此以引用的方式整体并入。还参见storz mabs.2011年5月-6月;3(3):310
–
317。
52.在一些实施方案中,抗体与寡核苷酸分子缀合。
53.在一些实施方案中,抗体与sirna缀合。此类抗体可通过例如用短寡核苷酸的6-8个拷贝“修饰”抗体、然后通过在sirna上工程化的短互补序列使所述sirna与所述抗体杂交来构建。最终产物是使sirna的多个拷贝靶向被hiv感染的细胞的抗体(参见图3)。在各种实施方案中,这种抗体用于本发明的方法中。
54.在一些实施方案中,使抗体靶向在被hiv感染的细胞中表达的病毒包膜蛋白(例如env或gp120)。在一些实施方案中,抗体是针对一种或多种hiv抗原的一种或多种广泛中和抗体。
55.在一些实施方案中,靶向剂是针对目标细胞或标志物的肽。
56.在各种实施方案中,寡核苷酸分子包含以下中的至少一者:短干扰rna(sirna);微干扰rna(mirna);反义寡核苷酸;小时序rna(strna);短发夹rna(shrna)和反义rna或它们的组合。在各种实施方案中,寡核苷酸分子靶向抗原加工途径的特异性介体,如eraap、tap和ii中的一者或多者。
57.在各种实施方案中,免疫调节剂包含适合rna干扰的分子,即在动物中由短干扰rna(sirna)介导的序列特异性转录后基因沉默的过程。在各种实施方案中,免疫调节剂包含sirna。
58.细胞中长dsrna的存在刺激被称为dicer的核糖核酸酶iii酶的活性。dicer参与将dsrna加工成被称为sirna的短dsrna片。由dicer活性获得的sirna的长度通常是约21至约23个核苷酸并且包含约19个碱基对的双链体。rnai应答也以通常被称为rna诱导的沉默复合物(risc)的核酸内切酶复合物为特征,所述核酸内切酶复合物介导具有与sirna双链体的反义链互补的序列的单链rna的裂解。靶rna的裂解发生在与sirna双链体的反义链互补的区域的中间。因此,本发明的一些实施方案考虑使用dsrna来下调来自mrna的蛋白质表达。
59.在各种实施方案中,本发明的sirna介于约18-30个碱基对之间(例如,约18、或约19、或约20、或约21、或约22、或约23、或约24、或约25、或约26、或约27、或约28、或约29、或约30个碱基对)并诱导rna干扰(rnai)途径。在一些实施方案中,sirna是具有中心19bp双链体区和末端上的对称2-碱基3'-突出端的21聚体,尽管长度和突出端的其它变化是可能的。
60.双链干扰rna(例如sirna)的链可连接以形成发夹或茎-环结构(例如shrna)。因此,本发明的一些实施方案的dsrna也可以是发夹或短发夹rna(shrna)。
61.在各种实施方案中,免疫调节剂包含mirna。mirna是能够调控靶基因的表达的短核酸分子。参见carrington等人science,第301(5631)卷:336-338,2003的综述。mirna的长度通常介于约18至约24个核苷酸之间。mirna在它们的序列完全互补时通过促进靶mrna的降解和/或在它们的序列含有错配时通过抑制翻译来充当所述靶mrna的阻遏物。不受理论束缚,成熟mirna被认为是由pol ii或pol iii产生的并且来自称为-mirna的初始转录物。这些初级-mirna(pri-mirna)通常为几千个碱基长,并且因此被加工以制成更短的成熟mirna。这些初级-mirna可能是多顺反子的,并且是由若干成簇序列的转录产生的,所述序列组构可能发展成许多mirna的物质。用于产生mirna的加工可以是两个步骤。首先,初级-mirna可在细胞核中由rna酶drosha加工成约70至约100个核苷酸的发夹形前体(前体-mirna(pre-mirna))。其次,在转位至细胞质后,发夹前体-mirna可由rna酶dicer进一步加工以产生双链mirna。然后,成熟mirna链可并入rna诱导的沉默复合物(risc)中,其中所述成熟mirna链可通过碱基对互补性与其靶mrna缔合并导致对蛋白质表达的抑制。未被优先选择进入risc沉默复合物中的mirna双链体的另一条链被称为过客链或次要mirna或星形(*)链。此链可被降解。应当理解,除非另有说明,否则如本文所用,mirna可指mirna的初级-和/或前体-和/或成熟和/或次要(星形)链和/或双链体型式。
62.在各种实施方案中,免疫调节剂包含反义寡核苷酸。反义寡核苷酸是与mrna序列互补的核酸链(或核酸类似物)。反义天然存在并且可通过酶rna酶h的作用触发rna降解。在各种实施方案中,反义寡核苷酸是非天然存在的。在各种实施方案中,反义寡核苷酸包含一种或多种核酸类似物。在各种实施方案中,反义寡核苷酸是核酸酶抗性的并且激活rna酶h。在各种实施方案中,反义寡核苷酸包含硫代磷酸酯rna和与rna结合并在空间上抑制过程而不激活rna酶h的其它核酸类似物(如2'-o-甲基硫代磷酸酯rna、吗啉代寡核苷酸、锁核酸或肽核酸)。后面这些非rna酶-h依赖性寡核苷酸不会触发mrna的降解,但它们可阻断翻译、改变前体-mrna的剪接、抑制mirna的活性、阻断核酶活性并干扰需要其它一些因子来结合至rna分子上的特定序列的各种其它过程。
63.在各种实施方案中,免疫调节剂是美国专利公布号2012/0263740的免疫调节剂,所述专利的全部内容特此以引用的方式并入。
64.在一些实施方案中,寡核苷酸分子和/或靶向剂(如适体)具有一个或多个核苷酸取代(例如,腺嘌呤、鸟嘌呤、胸腺嘧啶、胞嘧啶、尿嘧啶、嘌呤、黄嘌呤、二氨基嘌呤、8-氧代基-n
6-甲基腺嘌呤、7-脱氮黄嘌呤、7-脱氮鸟嘌呤、n4,n
4-桥亚乙基胞嘧啶、n6,n
6-桥亚乙基-2,6-二氨基嘌呤、5-甲基胞嘧啶、5-(c
3-c6)-炔基胞嘧啶、5-氟尿嘧啶、5-溴尿嘧啶、假异胞嘧啶、2-羟基-5-甲基-4-三唑并吡啶、异胞嘧啶、异鸟嘌呤、肌苷、非天然存在的核碱基、锁核酸(lna)、肽核酸(pna)、它们的变体、突变体、类似物或组合中的至少一者。
65.在各种实施方案中,适体和/或sirna(例如,有义链)包含氟修饰的嘧啶,例如,2'-氟修饰的嘧啶,例如,2'-氟-胞嘧啶(c)、2'-氟-胸腺嘧啶(t)和2'-氟-尿嘧啶(u)中的一者或多者。
66.在一个实施方案中,本文所述的任何免疫调节剂(和/或另外的剂)根据程序配制为适合于本文所述的施用模式的组合物。
67.在一些实施方案中,本发明提供了用新抗原mrna-脂质纳米载体进行疫苗接种。在一些实施方案中,可使用与脂质载体如dope和dotma复合的mrna进行疫苗接种
(nature.2016;534(7607):396-401)。说明性脂质载体包括1,2-二油酰基-sn-甘油基-3-磷脂酰胆碱(dopc)、1,2-二油酰基-sn-甘油基-3-磷脂酰乙醇胺(dope)、胆固醇、n-[1-(2,3-二油烯基氧基)丙基]n,n,n-三甲基氯化铵(dotma)、1,2-二油酰基氧基-3-三甲基铵-丙烷(dotap)、双十八烷基酰胺甘氨酰精胺(dogs)、n-(3-氨基丙基)-n,n-二甲基-2,3-双(十二烷基氧基)-1-丙铵溴化物(gap-dlrie)、十六烷基三甲基溴化铵(ctab)、鸟氨酸6-月桂氧基己酯(lhon)、1-)2,3-二油酰基氧基丙基)2,4,6-三甲基吡啶鎓(2oc)、2,3-二油烯基氧基-n-[2(精胺甲酰胺基)-乙基]-n,n-二甲基-1-丙铵三氟乙酸酯(dospa)、1,2-二油烯基-3-三甲基铵-丙烷(dopa)、n-(2-羟乙基)-n,n-二甲基-2,3-双(十四烷基氧基)-1-丙铵溴化物(mdrie)、二肉豆蔻氧基丙基二甲基羟乙基溴化铵(dmri)、3β-[n—(n
′
,n
′‑
二甲基氨基乙烷)-氨甲酰基]胆固醇(dc-chol)、双-胍鎓-tren-胆固醇(bgtc)、1,3-二油酰基氧基-2-(6-羧基-精胺基)-丙基酰胺(dosper)、二甲基十八烷基溴化铵(ddab)、双十八烷基酰胺基甘氨酰基亚精胺(dsl)、外消旋-[(2,3-双十八烷基氧基丙基)(2-羟乙基)]-二甲基氯化铵(clip-1)、外消旋-[2(2,3-双十六烷基氧基丙基-氧基甲基氧基)乙基]三甲基氯化铵(clip-6)、乙基二肉豆蔻酰基磷脂酰胆碱(edmpc)、1,2-二硬脂酰基氧基-n,n-二甲基-3-氨基丙烷(dsdma)、1,2-二肉豆蔻酰基-三甲基铵丙烷(dmtap)、o,o
′‑
二肉豆蔻基-n-赖氨酰基天冬氨酸(dmke)、1,2-二硬脂酰基-sn-甘油基-3-乙基磷酸胆碱(dsepc)、n-棕榈酰基-d-赤式-鞘氨醇基氨甲酰基-精胺(ccs)、n-叔丁基-no-十四烷基-3-十四烷基氨基丙脒(dic14-脒)、十八碳烯酰基氧基[乙基-2-十七碳烯基-3羟乙基]咪唑啉鎓氯化物(dotim)、n1-胆固醇基氧基羰基-3,7-二氮杂壬烷-1,9-二胺(cdan)和2-(3-[双-(3-氨基-丙基)-氨基]丙基氨基)-n-双十四烷基氨甲酰基甲基-乙酰胺(rpr2091290)。在一些实施方案中,此方法将用于使用来自如上所述的同系成纤维细胞或b细胞的总rna、mrna富集的poly a rna或扩增的polya rna针对新抗原进行疫苗接种。
[0068]
施用途径包括例如:皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外、口服、舌下、鼻内、脑内、阴道内、经皮、直肠、通过吸入或局部,特别是施用至耳、鼻、眼或皮肤。在一些实施方案中,施用是通过口服或肠胃外注射进行的。
[0069]
本文所述的免疫调节剂(和/或另外的剂)可肠胃外施用。此类免疫调节剂(和/或另外的剂)还可通过任何其它方便的途径施用,例如通过静脉内输注或快速浓注、通过经上皮或粘膜皮肤衬层(例如口腔粘膜、直肠和肠粘膜等)吸收,并且可与另外的生物活性剂一起施用。施用可以是系统的或局部的。不同递送系统是已知的,例如包封在脂质体、微粒、微胶囊、胶囊等中,并且可用于施用。
[0070]
适于肠胃外施用(例如,静脉内、肌肉内、腹膜内、皮下和关节内注射和输注)的剂型包括例如溶液、混悬液、分散体、乳剂等。它们也可以无菌固体组合物(例如,冻干组合物)的形式制造,可将其在即将使用时溶解或悬浮在无菌注射介质中。它们可含有例如本领域已知的助悬剂或分散剂。
[0071]
受试者
[0072]
在各种实施方案中,受试者患有慢性感染。在各种实施方案中,受试者患有乙型肝炎、丙型肝炎和人乳头状瘤病毒中的一者。在各种实施方案中,受试者患有幽门螺杆菌细菌。
[0073]
如可在hiv阳性或aids受试者、移植接受者、老年受试者等中发现的受抑制的免疫
系统可以是选择合适受试者的另一标准。
[0074]
在各种实施方案中,受试者未患癌症和/或不易患上癌症。
[0075]
在实施方案中,病原性感染是cmv,并且受试者具有任选地由于干细胞或器官移植和/或hiv感染所致的受损的免疫系统。在实施方案中,病原性感染是cmv,并且受试者是出生前感染cmv的新生儿(即患有先天性cmv)、婴儿(即患有围产期cmv)或孕妇。
[0076]
在实施方案中,病原性感染是ebv,并且受试者患有传染性单核细胞增多症。
[0077]
在实施方案中,病原性感染是hiv,并且受试者患有1期hiv感染、2期hiv感染、3期hiv感染、机会性感染或疾病或aids。
[0078]
除非另外定义,否则如本文所用的术语受试者是哺乳动物,例如人。还包括实验动物,如小鼠、大鼠、豚鼠、狗、猫、马、牛、猪,或非人灵长类动物,如猴、黑猩猩或狒狒。在一个实施方案中,受试者是兽医患者,包括本文所述的动物。在一个实施方案中,受试者是人。
[0079]
所述方法也可在不知道有风险的完全健康受试者中实施。
[0080]
在各种实施方案中,提供了本发明的免疫调节剂与一种或多种另外的治疗剂的共同施用。这种共同施用不需要通过相同的施用途径向受试者施用治疗剂。相反,每种治疗剂可通过任何适当的途径(例如,肠胃外或非肠胃外)施用。此外,共同施用涉及同时或依序施用。
[0081]
在一些实施方案中,本文所述的免疫调节剂在与另外的治疗剂共同施用时协同作用。在此类实施方案中,免疫调节剂和另外的治疗剂可以低于当所述剂在单一疗法的情况下使用时所采用的剂量的剂量施用。
[0082]
此外,在各种实施方案中,本发明的方法涉及治疗先前已经用另外的治疗剂进行了治疗的受试者。此外,在各种实施方案中,本发明的方法涉及治疗正在用另外的治疗剂进行治疗的受试者。
[0083]
在包括但不限于感染性疾病应用的一些实施方案中,本发明涉及抗感染剂作为另外的剂。在一些实施方案中,抗感染剂是抗病毒剂,包括但不限于阿巴卡韦、阿昔洛韦、阿德福韦、安普那韦、阿扎那韦、西多福韦、地瑞那韦、地拉夫定、地达诺新、二十二烷醇、依法韦仑、埃替格韦、恩曲他滨、恩夫韦地、依曲韦林、泛昔洛韦和膦甲酸。在一些实施方案中,抗感染剂是抗菌剂,包括但不限于,头孢菌素类抗生素(头孢氨苄、头孢呋辛、头孢羟氨苄、头孢唑啉、头孢噻吩、头孢克罗、头孢孟多、头孢西丁、头孢丙烯和头孢托罗);氟喹诺酮类抗生素(环丙沙星、左氟沙星、氧氟沙星、加替沙星、莫西沙星和诺氟沙星);四环素类抗生素(四环素、米诺环素、土霉素和多西环素);青霉素类抗生素(阿莫西林、氨苄西林、青霉素v、双氯青霉素、羧苄西林、万古霉素和甲氧西林);单环内酰胺类抗生素(氨曲南);和碳青霉烯抗生素(厄他培南、多利培南、亚胺培南/西司他丁和美罗培南)。在一些实施方案中,抗感染剂包括抗疟疾剂(例如,氯喹、奎宁、甲氟喹、伯氨喹、多西环素、蒿甲醚/苯芴醇、阿托伐醌/氯胍和磺胺多辛/乙胺嘧啶)、甲硝唑、替硝唑、伊维菌素、双羟萘酸噻嘧啶和阿苯达唑。
[0084]
定义
[0085]
如本文所用,“一个/种(a/an)”或“所述(the)”可意指一个或多于一个/种。
[0086]
另外,当与参考数字指示结合使用时,术语“约”意指参考数字指示加上或减去所述参考数字指示的多至10%。例如,语言“约50”涵盖了45至55的范围。
[0087]
当与医疗用途结合使用时,“有效量”是有效于提供对目标疾病的可测量治疗、预
防或其发病率的降低的量。
[0088]
如本文所用,如果相对于不存在这种调节,在存在剂或刺激物的情况下活性和/或效果的读数降低显著量,如降低至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%、至少约98%或更多直至并包括至少约100%,则某物“减少”。如本领域普通技术人员将理解的,在一些实施方案中,活性降低并且一些下游读数将减少,但其它可增加。
[0089]
相反,如果相对于不存在剂或刺激物,在这种剂或刺激物存在下,活性和/或效果的读数增加显著量,例如增加至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%、至少约98%或更多、直至并包括至少约100%或更多、至少约2倍、至少约3倍、至少约4倍、至少约5倍、至少约6倍、至少约7倍、至少约8倍、至少约9倍、至少约10倍、至少约50倍、至少约100倍,则活性“增加”。
[0090]
如本文所提及的,除非另外指定,否则所有组成百分比均按总组合物的重量计。如本文所用的,单词“包括”及其变型意图为非限制性的,以使得列表中的项目的详述不排除也可适用于此技术的组合物和方法的其它类似项目。类似地,术语“可以(can)”和“可(may)”以及其变型意图为非限制性的,以使得实施方案可以或可包括某些要素或特征的详述不排除不包含那些要素或特征的本技术的其它实施方案。
[0091]
尽管作为诸如包括、含有或具有等术语的同义词的开放式术语“包含”在本文中用于描述并要求保护本发明,可替代地可使用诸如“由
…
组成”或“基本上由
…
组成”的替代性术语来描述本发明或其实施方案。
[0092]
如本文所用,单词“优选的”和“优选地”是指本技术在某些情况下提供某些益处的实施方案。然而,在相同或其它情况下,其它实施方案也可以是优选的。此外,一个或多个优选实施方案的详述并不意味着其它实施方案不是有用的,并且并不意图从本技术的范围内排除其它实施方案。
[0093]
本文描述的实现治疗效果所需要的组合物的量可出于特定目的根据常规程序凭经验确定。通常,对于出于治疗目的而施用治疗剂,以药理学有效剂量给予所述治疗剂。“药理学有效量”、“药理学有效剂量”、“治疗有效量”或“有效量”是指足以产生所需生理效果的量或能够实现所需结果,尤其是治疗病症或疾病的量。如本文所用的有效量包括足以例如延迟病症或疾病的症状的发展、改变病症或疾病的症状的进程(例如,减缓疾病症状的进展)、减少或消除病症或疾病的一个或多个症状或表现并且逆转病症或疾病的症状的量。治疗益处还包括停止或减缓潜在疾病或病症的进展,不论是否实现改善。
[0094]
可通过标准药物程序在细胞培养物或实验动物中测定有效量、毒性以及治疗功效,所述标准药物程序例如用于测定ld50(对约50%群体致死的剂量)和ed50(在约50%群体中治疗有效的剂量)。剂量可根据所采用的剂型和使用的施用途径而改变。毒性作用与治疗作用之间的剂量比是治疗指数,并且可被表示为比率ld50/ed50。在一些实施方案中,表现出大治疗指数的组合物和方法是优选的。可初始地由体外测定,包括例如细胞培养物测定评估治疗有效剂量。另外,可在动物模型中配制剂量,以实现循环血浆浓度范围,所述循环血浆浓度范围包括如在细胞培养物中或在适当的动物模型中测定的ic50。可例如通过高效液相色谱测量血浆中所述组合物的水平。可通过合适的生物测定来监测任何特定剂量的
效果。可由医师确定剂量,并且必要时进行调整以适合所观察到的治疗作用。
[0095]
在某些实施方案中,所述效果将引起至少约10%、至少约20%、至少约30%、至少约50%、至少约70%或至少约90%的可量化变化。在一些实施方案中,所述效果将引起约10%、约20%、约30%、约50%、约70%或甚至约90%或更大的可量化变化。治疗益处还包括停止或减缓潜在疾病或病症的进展,不论是否实现改善。
[0096]
如本文所用,“治疗方法”同样适用于治疗本文所述的疾病或病症的组合物的用途和/或用于治疗本文所述的疾病或病症的组合物和/或在制造用于治疗本文所述的疾病或病症的药物中的用途。
[0097]
通过以下非限制性实施例进一步描述本发明。
[0098]
实施例
[0099]
实施例1:肿瘤细胞中抗原开发的概念验证
[0100]
本发明人已经描述了靶向新抗原的新疫苗接种概念,所述新抗原通过使用相应的sirna靶向下调肽转运蛋白tap而在肿瘤细胞和树突细胞中实验性地诱导。在这项概念验证研究中,使用广谱核仁蛋白结合适体(nucl)来使tap sirna靶向肿瘤细胞,从而用新抗原“修饰”所述肿瘤细胞;并使用cpg寡核苷酸来使tap sirna靶向树突状细胞(dc),从而引发针对所述被诱导的抗原的免疫应答。
[0101]
结果表明,所述概念通过表明以下事实而可转化为人类环境:针对被诱导的抗原特异性体外富集pbmc来源的cd8 t细胞(通过将所述t细胞与用cpg-tap sirna处理的dc一起孵育)识别培养物中的肿瘤细胞,条件是用nucl-tap sirna处理肿瘤细胞以呈递所述被诱导的抗原。
[0102]
具体地,图1a-d示出体外刺激的与受损肽加工相关的tap t细胞表位(teipp)特异性t细胞识别tap
低
人肿瘤细胞。为了确定针对tap teipp进行疫苗接种是否能够适用于人患者,本发明人测试了用cpg-tap sirna脉冲的树突细胞(dc)是否能够刺激体外cd8 t细胞,所述cd8 t细胞将识别用nucl-tap sirna处理的肿瘤细胞。用缀合至人tap特异性sirna的cpg odn处理的人单核细胞来源的dc导致tap mrna的部分下调(图1a),以及p14呈递至同源t细胞克隆(图1b)。图1c示出cpg-tap sirna处理的dc刺激自体cd8 t细胞,所述cd8 t细胞识别tap缺陷型肿瘤细胞以及nucl-tap而非nucl-对照sirna处理的tap充足型肿瘤细胞两者。下调tap的细胞呈递主要源自管家产物的多个表位。图1d示出cpg-tap sirna刺激的cd8 t细胞识别用tap缺陷型肿瘤细胞所呈递的hla-a2限制性肽脉冲的dc。这表明cpg-tap sirna处理的dc可刺激针对也由tap缺陷型肿瘤细胞呈递的多个共享的tap teipp的多克隆cd8 t细胞应答,并且由此可增强对tap表达降低的广泛肿瘤的识别。
[0103]
在此实施例中,本发明人尤其证明,有可能用(tap下调诱导的)新抗原“标记”肿瘤细胞,以使它们对免疫系统更“可见”并且因此对疫苗接种更敏感。
[0104]
实施例2:被病原体感染的细胞中的抗原诱导
[0105]
在此实施例中,本发明人尤其建立了一种方案,通过所述方案,cpg-tap sirna用于在任何被病原体感染的细胞中针对tap下调诱导的抗原进行疫苗接种
–
条件是tap可特异性地且仅在被感染的细胞中下调。也就是说,本发明人使tap下调靶向被感染的细胞
–
除非病毒本身这样做。
[0106]
由于使用了不会在小鼠细胞中复制的人类病毒,因此在具有人类细胞的培养物中
进行了实验。实验方案与图1a-d中描述的用于人肿瘤的方案相似。简言之,第一步是通过将pbmc来源的cd8 t细胞与用cpg-tap sirna处理的自体dc一起培养来富集对tap下调诱导的抗原具有特异性的cd8 t细胞,所述cpg-tap sirna刺激tap下调诱导的抗原特异性t细胞的增殖。
[0107]
首先,尝试了针对属于疱疹病毒科的病原体cmv、ebv或hsv进行疫苗接种。属于此家族的病毒在急性感染期间下调tap,作为它们用来逃避免疫消除的几种机制之一,因此无需在被感染的细胞中实验性地下调tap。图2中的实验表明,被cmv或ebv感染的细胞由富含对tap下调诱导的抗原的特异性的cd8 t细胞识别(通过将pbmc来源的cd8 t细胞与dc cpg-tap sirna一起孵育)。因此,这些实验表明,用cpg-tap sirna进行疫苗接种也可引发针对属于疱疹病毒科的病原体的保护性免疫,所述病原体下调被感染的细胞中的tap。
[0108]
其次,尝试了针对对抗hiv的病原体的疫苗接种。与疱疹病毒科不同,hiv感染不会导致tap下调。因此,在这种情况下,本发明人需要下调被感染的细胞中的tap。问题是如何使tap sirna特异性地靶向且仅靶向被hiv感染的细胞。本发明人针对在被hiv感染的细胞中表达的病毒包膜蛋白(env或gp120);实际上“标记”感染了hiv的细胞。这最初是使用hiv gp120 env适体完成的,但也已使用在识别广泛hiv物种方面提供优势的抗体完成。将sirna与抗体缀合的方法包括首先用短寡核苷酸的6-8个拷贝“修饰”抗体,然后通过在sirna上工程化的短互补序列使所述sirna与所述抗体杂交。最终产物是靶向被hiv感染的细胞的sirna的多个拷贝的抗体(参见图3)。图3所示的实验类似于图2(和图1)中描述的实验,除了使富含对被诱导抗原的特异性的经培养的cd8 t细胞与被hiv感染的细胞反应,识别被hiv感染的细胞,但前提是用gp 120ab-tap sirna缀合物处理所述被hiv感染的细胞。
[0109]
因此,cpg-tap sirna刺激的cd8 t细胞识别肿瘤细胞以及被病原体感染的细胞,其中tap表达与疱疹病毒科或经hpv转化的肿瘤细胞的情况一样自然地降低或通过使sirna分别靶向肿瘤细胞或被感染的肿瘤细胞实验性地降低。
[0110]
用于实施例1和2的材料和方法
[0111]
细胞和培养条件
[0112]
ramos和mrc-5细胞购自atcc。
[0113]
将细胞系在来自gibco的补充有8%-10%热灭活fcs、100u/ml青霉素和100μg/ml链霉素的rpmi-1640培养基(a20、4t1、67nr、caski、c33a、ramos、tmd8、tc-1、b6 hlf和dc2.4细胞)、杜尔贝科氏改良的伊格尔氏培养基(dulbecco’s modified eagle’s medium)(mc38、mrc-5、sw480和sw620)或伊思科夫氏改良的杜尔贝科氏培养基(iscove's modified dulbecco's medium)(rma、rma-s、518a2和小鼠t细胞激活测定)中培养。小鼠t细胞另外补充有1mm丙酮酸钠、0.05mmβ-巯基乙醇和2mm最低必需培养基(mem)非必需氨基酸。tc-1和b6 hlf细胞另外补充有1mm丙酮酸钠、2mm最低必需培养基(mem)非必需氨基酸和50μg/ml庆大霉素。对于tc-1细胞,还添加了0.4mg/ml g418和0.2mg/ml潮霉素。来自stemcell的dc和t细胞培养基分别用于人dc分化和t细胞培养。所有细胞系和测定培养物均保持在37℃和5%co2。定期测试所有细胞的支原体污染。
[0114]
cpg-sirna缀合物的设计
[0115]
研究中使用的cpg odn的序列是如下cpg 1668(5
’‑
tccatgacgttcctgatgct-3seq id no:1)、cpg 2006(5
’‑
tcgtcgttttgtcgttttgtcgtt-3’seq id no:2)和cpg d19(5
’‑
ggtgcatcgatgcagggggg-3’seq id no:3)。呈大写字母的碱基是磷酸二酯,呈小写的碱基是硫代磷酸酯(核酸酶抗性)。将这些序列在3'端用以下序列(称为接头)延伸:5’cgaggcuaucuagaauguac(seq id no:4),并且购自trilink biotechnologies。在3'端用以下序列(称为接头)延伸的核仁蛋白适体购自trilink biotechnologies:5’guacauucuagauagcc(seq id no:5)。从鼠tap2(5’gcugcacacgguucagaat seq id no:6)、鼠eraap(5’gcuauuacauugugcauta seq id no:7)、人tap1(5’caggaugaguuacuugaaa seq id no:8)或对照(ctrl)(5’uaaagaaccauggcuaacc seq id no:9)sirna的有义链延伸的互补接头序列从idt订购并含有2'o-甲基修饰的嘧啶,其中最后两个碱基是脱氧核苷酸。从idt订购的反义sirna序列是如下:鼠tap2(5’auucugaaccgugugcagcmumu seq id no:10)、鼠eraap(5’uaaugcacaauguaauagcmumu seq id no:11)、人tap1(5'uuucaaguaacucauccugmumu seq id no:12)和对照(5’gguuagccaugguucuuuamumu seq id no:13),其中
‘
m'表示存在2'o'-甲基修饰的核糖核苷酸。将cpg或核仁蛋白适体与双链sirna在pbs中在模块加热器中分别在82℃下退火4分钟或在37℃下退火10分钟并使其冷却至室温。
[0116]
sirna敲低和qpcr分析
[0117]
对于体外sirna敲低,将细胞一式三份涂铺到24孔板(2.5-5x104细胞)上持续18小时。完全粘附后,将细胞与0.5μm的nucl-sirna或0.3um的cpg-sirna缀合物一起孵育两次,每次8小时。在最后一次处理后24、48、72或96小时收获细胞。对于体内sirna敲低,将balb/c小鼠在右侧腹的腹股沟ln附近皮下注射一次cpg-sirna(0.75nmol)。24小时后切除ln,并使用cd11 microbeads(miltenyi biotec)分离dc细胞。通过qpcr对鼠tap-2或人tap-1mrna进行定量。使用rneasy试剂盒(qiagen)分离rna。使用agilent 2100bioanalyzer(agilent technologies)对rna进行定量。使用高容量cdna逆转录试剂盒(applied biosystems)进行cdna合成。在使用step one qpcr机器(applied biosystems)的taqman qpcr测定中,每个反应使用25-50ng mrna的cdna等效物,引物组对应于目标基因或管家产物。
[0118]
体外病毒感染
[0119]
将mrc-5细胞接种在6孔板中,并以5的moi用具有2.2x10^8pfu/ml的tb40/e hcmv菌株感染。将细胞孵育90分钟并更换培养基。48小时后,将细胞分到96孔板中。在通过流式细胞术确定hla-abc下调后,在感染后72小时开始与多克隆t细胞池共培养。同样,在室温下将ramos细胞用ebv病毒以moi=100以800x g旋转接种90分钟,然后置于t25烧瓶中。在确定hla-abc下调后第48小时取出细胞并与多克隆t细胞一起共培养。
[0120]
产生富含tap下调诱导的表位的人cd8 t细胞。
[0121]
将从单核细胞分化的人dc与0.3um的cpg-sirna缀合物一起孵育两次,每次24小时。第二次脉冲后24小时,将dc与同源cd8 t细胞在il2(20ng/ml)和il-15(50ng/ml)存在下共培养6天。在停止共培养的当天用cpg-sirna进行第三次脉冲。每2-3天用含有细胞因子的新鲜完全t细胞培养基补充培养基。在两轮特异性刺激后,使用阳性选择cd8 t细胞分离试剂盒(miltenyi biotec)分离cd8 t细胞。
[0122]
人tap下调诱导的表位特异性cd8 t细胞对靶标的识别。
[0123]
将cpg-sirna或tap-sirna处理的、肽脉冲的、病毒感染的或未处理的细胞与激活的lnb5 t细胞、1a8 t细胞或富含tap缺陷表位的cd8 t细胞一起共培养(e:t比率,1:10)。肽
(1μg/ml)购自anaspec并且序列是如下:p14-flgpwpaas(seq id no:14);p29-llalaaglav(seq id no:15);p44-flypflshl(seq id no:16);p49-ileyltaev(seq id no:17);p9-vlavfikav(seq id no:18);p67-lsekleri(seq id no:19);p32-lllsaepvpa(seq id no:20);对照mage-alsrkvael(seq id no:21)。通过来自r&d systems的elisa测量20小时刺激后的鼠或人ifnγ产生。在第4小时在体外乳酸脱氢酶测定(thermo fisher scientific)中测定细胞毒性活性。特异性裂解的百分比被计算为:([实验性释放-效应细胞释放-自发释放]/[最大释放-自发释放])x100。
[0124]
统计学分析
[0125]
当研究的变量呈正态分布时,使用单向方差分析(one-way anova)与杜凯氏后检验(tuckey post-test)进行多重比较的统计学分析,并使用学生非配对t检验进行仅两组之间的比较。非参数方法应用于非正态分布的变量。对于这些统计学分析,使用kruskall-wallis与邓恩事后检验(dunn post-test)进行多重比较,并且使用曼-惠特尼u检验(mann
–
whitney u test)进行仅两组之间的比较。通过卡普兰-迈耶分析(kaplan-meier analysis)与对数秩分析(log-rank analysis)确定总体存活的显著性。所有统计学分析均使用graphpad prism 6和7(graphpad)进行。误差线显示平均值的标准误差(sem),并且p《0.05被认为具有统计学意义。*表示p《0.05,**表示p《0.01,***表示p《0.001,并且****表示p《0.0001,除非另有说明。ns表示不显著。
[0126]
等效方案
[0127]
本领域技术人员仅使用常规实验将会认识到或将能够确定本文中确切描述的具体实施方案的许多等效方案。此类等效方案意图涵盖在所附权利要求书的范围中。
[0128]
以引用的方式并入
[0129]
本文引用的所有专利和公布特此以引用的方式整体并入。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
