1.本发明涉及骨肉瘤治疗药物领域,特别是涉及一种从白花蛇舌草中提取槲皮素的方法及其脂质体的制备方法和脂质体产品。
背景技术:
2.骨肉瘤高发于15-19岁,是青少年和儿童最易发生的一种恶性骨肿瘤,大约40%的患者在发现时就已经发生了转移,传统的治疗手段不能达到预期,预后并不乐观。近年来,即使新型辅助化疗技术和手术手段不断进步,骨肉瘤患者的5年生存率仍仅为70%。对于化疗不耐受或肿瘤晚期的患者,目前尚无有效的应对手段。因此,探索骨肉瘤治疗的新策略,改善患者的预后,就成了一个严肃且急需解决的课题。
3.免疫治疗一直是骨肉瘤临床和基础研究的热点,对检查点蛋白抑制剂的研究更是备受关注。在肿瘤的发生和发展过程中,免疫系统在某些阶段不仅会消灭肿瘤细胞,也会促进肿瘤细胞的免疫逃逸。相关研究已经表明,通过阻断特定检查点,可实现免疫调控作用,完成对肿瘤尤其是实体肿瘤的治疗。免疫检查点抑制剂可抑制免疫检查点活性,重新激活t细胞对肿瘤的免疫应答效应,从而达到抗肿瘤的作用。深入研究免疫检查点及其抑制剂的作用机制,将为肿瘤的免疫治疗提供新的思路和方向。
4.在现有的技术中,选用的骨肉瘤抑制剂通常是传统的共价结合靶点,共价修饰类药物通常含有亲电性基团或者能够经体内代谢产生亲电基团,通过共享电子的方式与靶标亲核部位结合形成复合物,从而使靶标失活,发挥药理作用。其与靶标常通常不可逆,因为其亲电性较强的缘故,对亲核基团缺乏足够的选择性,往往容易产生非特异性结合而出现脱靶效应,在体内产生诸多不良反应甚至毒性反应,造成组织损伤或免疫反应。
5.槲皮素是一种具有生物活性的类黄酮,可以发挥非常广泛的生物学效应,它存在于植物皮、花、叶、芽、种子、果实中,是一种非共价的肿瘤抑制剂,这使得它成为了骨肉瘤治疗重要的研究点与新的希望。但在人体内,由于其与白蛋白之间存在氢键作用,槲皮素存在低吸收、清除快、副作用大的问题,这严重限制了槲皮素的生物学功能。其不溶于水的性质,进一步限制了其临床应用。
技术实现要素:
6.本发明的目的是提供一种从白花蛇舌草中提取槲皮素的方法及其脂质体的制备方法和脂质体产品,以解决上述现有技术存在的问题,使槲皮素溶解度更高,稳定性更好,同时降低其毒性;利用叶酸修饰槲皮素使其靶向效率更好,提高其对骨肉瘤的增殖、侵袭和免疫逃逸的抑制。
7.为实现上述目的,本发明提供了如下方案:
8.本发明提供一种从白花蛇舌草中提取槲皮素的方法,包括以下步骤:
9.(1)将白花蛇舌草粉碎后,用95%乙醇进行浸提,得到粗提取溶液;
10.(2)所述粗提取溶液经聚酰胺柱层析色谱分离纯化,得到所述槲皮素。
11.进一步地,在步骤(1)中,粉碎后的白花蛇舌草与95%乙醇的质量比为1:40。
12.进一步地,在步骤(1)中,所述浸提为在90℃条件下提取180min。
13.进一步地,所述聚酰胺柱层析色谱分离纯化的具体操作包括:
14.(1)聚酰胺预处理:取聚酰胺,用95%乙醇浸泡10min,不断搅拌,待完全去除气泡后装入柱中,再用400ml的95%乙醇洗脱,洗至洗脱液透明,之后,依次用250ml的5%naoh水溶液、100ml的蒸馏水、250ml的10%醋酸水溶液洗脱,最后用蒸馏水洗脱至ph中性;
15.(2)上样:按照每100ml聚酰胺加入1.5-2.5g所述粗提取溶液上样;
16.(3)洗脱:先依次用体积分数为10%、30%、50%、70%、95%的乙醇水溶液洗脱,再依次用氯仿与甲醇体积比分别为20:1、10:1、5:1、2:1和1:1的氯仿-甲醇混合溶液洗脱;最后用石油醚和乙酸乙酯体积比分别为20:1、10:1、5:1、2:1和1:1的石油醚-乙酸乙酯混合溶液洗脱;
17.(4)浓缩:石油醚和乙酸乙酯体积比为10:1的石油醚-乙酸乙酯的洗脱液真空干燥,得到所述槲皮素。
18.本发明还提供一种槲皮素脂质体的制备方法,包括以下步骤:
19.a根据上述的方法制备得到槲皮素;
20.b将步骤a制备得到的槲皮素与卵磷脂、脑磷脂、胆固醇、聚乙二醇和叶酸混合,得到混合液1,所述混合液1再与氯仿混合得到混合液2,所述混合液2溶解于二甲基亚砜中,得到混合液3;
21.c所述混合液3经真空干燥后,加入pbs液进行水合反应得到混合液4;
22.d所述混合液4经超声波破碎后,用微孔滤膜过滤得到所述槲皮素脂质体。
23.进一步地,在步骤b中,所述槲皮素、所述卵磷脂、所述脑磷脂、所述胆固醇、所述聚乙二醇和所述叶酸的质量比为6:9:5:4:1:1。
24.进一步地,在步骤c中,所述水合反应的条件为4℃。
25.进一步地,在步骤d中,所述超声波破碎的频率为20khz,时间为1.5h。
26.进一步地,在步骤d中,所述微孔滤膜的孔径为220nm。
27.本发明还提供一种根据上述的制备方法制备得到的槲皮素脂质体。
28.本发明公开了以下技术效果:
29.1.本发明直接从白花蛇舌草中提取槲皮素,来源广,易获得,价格低廉,大大减少了成本支出。
30.2.本发明简化了槲皮素提纯的步骤,减少了制备槲皮素所需的时间与精力,且所提取的槲皮素纯度更高。
31.3.本发明将疏水性的槲皮素进行处理后,采用脂质体将槲皮素包裹在直径190nm的纳米粒中,使其溶解性更高,药物的利用率更高,且降低了其毒副作用。
32.4.本发明通过叶酸修饰脂质体,改变了其作用范围过于广泛的性质,使其产生主动靶向效益,增强了其对肿瘤细胞的靶向性。
33.5.考察不同制备处方工艺条件对脂质体包埋率的影响。随着不同比例槲皮素:脑磷脂(1:1、1:1.5、1:2、1:2.5、1:3),随着比例的上升,包埋率呈现明显的上升趋势,当药脂比超过1:1.5时,脂质体包埋率呈下降趋势(包封率分别为90%、95%、90%、85%、80%)。配
置胆固醇:卵磷脂比例1:1、2:1、3:1、4:1、5:1、6:1,结果发现随着比例上升,脂质体的包封率呈下降趋势(包封率分别为95%、93%、93%、92%、90%、85%),胆固醇:卵磷脂大于为4:1时磷脂双分子层破坏导致药物渗漏。本技术的脂质体配方(槲皮素:脑磷脂:卵磷脂:胆固醇:聚乙二醇:叶酸=6:9:5:4:1:1)是对影响最终产物包埋率和粒径的工艺条件和制备处方的优化。该制备处方可增加槲皮素纳米脂质体的包埋率,更好地使药物熔融于油相中,在增加槲皮素溶解度的同时提高包埋率。
34.6.本发明制备的槲皮素脂质体应用在骨肉瘤的治疗中,大幅度提高了药物对骨肉瘤增殖、转移、侵袭以及免疫逃逸的抑制作用,提高了骨肉瘤患者的生存率。
附图说明
35.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
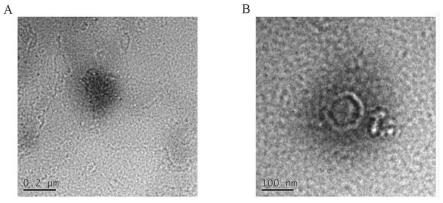
36.图1为实施例1制备的叶酸修饰的槲皮素脂质体在不同比例尺下的透射电镜图;其中,a为0.2μm,b为100nm;
37.图2为实施例1制备的叶酸修饰的槲皮素脂质体粒子直径分布和ζ电位,其中a为粒径直径分布图,b为ζ电位分布图;
38.图3为以峰面积为纵坐标,药物浓度为横坐标,进行线性回归,绘制的标准曲线;
39.图4为利用实施例1制备的叶酸修饰的槲皮素脂质体处理骨肉瘤细胞系后,cck-8法检测细胞体外增殖能力的变化;
40.图5为利用实施例1制备的叶酸修饰的槲皮素脂质体处理mnng/hos骨肉瘤细胞系和u-2骨肉瘤细胞系后,pcr显示的pd-l1 mrna的表达量;
41.图6为利用实施例1制备的叶酸修饰的槲皮素脂质体处理mnng/hos骨肉瘤细胞系和u-2骨肉瘤细胞系24小时后,western bolt显示的pd-l1的表达量;
42.图7为使用不同浓度的实施例1制备的叶酸修饰的槲皮素脂质体处理mnng/hos骨肉瘤细胞系和u-2骨肉瘤细胞系后,菌落形成的情况;
43.图8为使用不同浓度的实施例1制备的叶酸修饰的槲皮素脂质体处理mnng/hos骨肉瘤细胞系和u-2骨肉瘤细胞系后,肿瘤细胞的细胞迁移和侵袭能力。
具体实施方式
44.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
45.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
46.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规
技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
47.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
48.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
49.实施例1
50.1.槲皮素的制备
51.1.1白花蛇舌草样品制备
52.将准备好的白花蛇舌草样品用蒸馏水进行清洗,确保洗净后晾干。将干燥的白花蛇舌草粉碎,确保其粉碎后的产物能通过60目筛孔。
53.1.2白花蛇舌草与95%乙醇混合液体的制备
54.准确称取2.000g步骤1.1制备完成的白花蛇舌草样本,缓缓将其完全倒入100ml圆底烧瓶中,按照95%乙醇:白花蛇舌草=40:1的比例加入80.000g的95%乙醇于圆底烧瓶中,使其充分混合。
55.1.3粗提取溶液的制备
56.将步骤1.2所得混合液液体置于90℃的温度下,使其充分反应180min。反应完成后过滤,得含有槲皮素的溶液。
57.1.4总黄酮的提取
58.将步骤1.3所得溶液经聚酰胺柱层析色谱进一步纯化,洗脱液真空干燥,分别得到含穗花双黄酮、槲皮素、山奈酚和芦丁的样品。聚酰胺柱层析色谱纯化法具体包括以下步骤:
59.1.4.1聚酰胺预处理
60.取聚酰胺,用95%乙醇浸泡10min,不断搅拌,待完全去除气泡后装入柱中。完成后,用400ml的95%乙醇洗脱,洗至洗脱液透明。完成后,依次用250ml的5%naoh水溶液、100ml的蒸馏水、250ml的10%醋酸水溶液洗脱,最后用蒸馏水洗脱至ph中性,备用。
61.1.4.2装柱
62.将颗粒状聚酰胺混置于水中,使其自然沉降。
63.1.4.3上样
64.每100ml聚酰胺加入1.5-2.5g样品(即1.3得到的有槲皮素的溶液),样品需先用60%乙醇溶解,浓度为20%-30%。
65.1.4.4洗脱
66.采用水-乙醇(乙醇的体积分数依次为10%、30%、50%、70%、95%),氯仿-甲醇(氯仿与甲醇体积比分别为20:1,10:1,5:1,2:1,1:1)依次洗脱。若仍有物质未洗脱下来,可采用3.5%氨水洗脱。
67.1.5槲皮素的提纯
68.观察步骤1.4.4洗脱后流出液的颜色,当颜色变为很淡时更换下一种溶剂,即石油醚-乙酸乙酯(体积比石油醚:乙酸乙酯=l:1),从洗脱液中得到黄色固体。将黄色固体用硅胶柱层析,以石油醚:乙酸乙酯体系(体积比分别为20:1,10:1,5:1,2:1,1:1)进行梯度洗脱,当石油醚:乙酸乙酯=10:1时,洗脱得到槲皮素粗品。
69.将经大孔树脂纯化处理得到的槲皮素粗品进行水解、石油醚脱去色素等杂质、甲醇重结晶等操作制备槲皮素,具体是:称取槲皮素粗品1.0g,加入100ml石油醚和20ml水,于80℃加热搅拌0.5h,趁热过滤,用20ml去离子水洗涤沉淀3次,于60℃烘干得槲皮素。
70.本步骤制备的槲皮素化学结构式如下:
[0071][0072]
2.叶酸修饰的槲皮素脂质体的制备
[0073]
2.1含槲皮素混合物的制备
[0074]
槲皮素为脂溶性药物,与构成脂质体的主要成分磷脂和胆同醇极性相近,具有较好的亲和性,在预实验的基础上,将步骤1.5所得的槲皮素与卵磷脂、胆固醇、聚乙二醇和叶酸按照槲皮素:卵磷脂:脑磷脂:胆固醇:聚乙二醇:叶酸=6:9:5:4:1:1的质量比进行混合,得含槲皮素的混合溶液,此比例为最佳制备工艺。
[0075]
2.2混合溶液的溶解
[0076]
将步骤2.1所制得的含槲皮素的混合溶液10ml与10ml氯仿(三氯甲烷)混合,并将其溶解于20ml二甲基亚砜(dmso)中。
[0077]
2.3混合物的干燥及水化
[0078]
将步骤2.2所制溶液置于85℃的真空旋转干燥器中,使其充分反应8小时。反应完成后加入10mlpbs液在4℃下进行水合20min。
[0079]
2.4混合物的破碎
[0080]
将步骤2.3所得溶液置于超声波细胞破碎仪中,将超声波细胞破碎仪调至20khz进行破碎,按照破碎5秒-停止破碎5秒的顺序对步骤2.3所得溶液中的物质进行反复破碎,该过程一共持续1.5h。
[0081]
2.5过滤
[0082]
用220nm的微孔滤膜过滤对步骤2.4所得样品进行多次过滤,最终得叶酸修饰的槲皮素脂质体。
[0083]
3.成品检测
[0084]
3.1透射电镜观测
[0085]
将适量步骤2.5制备完成的叶酸修饰的槲皮素脂质体用蒸馏水稀释,稀释后滴入
2%磷钨酸盐进行负染。染色完成后,将其滴在铜丝上,通过透射电镜观察其外观(图1)。
[0086]
3.2颗粒粒径和zeta电位的测量
[0087]
使用适量的水稀释步骤2.5制备完成的叶酸修饰的脂质体槲皮素。使用激光粒度分析仪通过高效液相色谱法测量脂质体槲皮素颗粒的粒径和zeta电位(图2)。
[0088]
3.3药物浓度和包埋率
[0089]
以峰面积为纵坐标,浓度为横坐标,进行线性回归,绘制标准曲线(图3)。根据高效液相色谱法测定的浓度和理论药物浓度计算药物回收率100.82%,测定的药物浓度为0.364mg/ml,包埋率为91.18
±
078%。
[0090]
3.4抗肿瘤效果实验
[0091]
将骨肉瘤细胞mnng/hos和u2-os细胞分别分为对照组、槲皮素处理组和叶酸修饰脂质体槲皮素处理组,采用cck-8法检测细胞的体外增殖能力,发现叶酸修饰脂质体槲皮素较槲皮素可增强抗肿瘤效应(图4)。
[0092]
将骨肉瘤细胞mnng/hos和u2-os细胞分别予以25μmol/l、50μmol/l、100μmol/l叶酸修饰脂质体槲皮素处理,克隆形成实验结果发现与空白对照组相比,叶酸修饰脂质体槲皮素的抗肿瘤效应呈现浓度依赖性,浓度越高,抗肿瘤效应越强(图5)。
[0093]
将骨肉瘤细胞mnng/hos和u2-os细胞分别予以25μmol/l、50μmol/l、100μmol/l叶酸修饰脂质体槲皮素处理,transwell实验技术检测后,结果发现与空白对照组相比,叶酸修饰脂质体槲皮素的抗肿瘤效应呈现浓度依赖性,浓度越高,抗肿瘤效应越强,肿瘤的侵袭和迁移能力减弱(图6)。
[0094]
将骨肉瘤细胞mnng/hos和u2-os细胞分别予以25μmol/l、50μmol/l、100μmol/l叶酸修饰脂质体槲皮素处理,pcr检测pdl1 mrna表达水平,结果发现与空白对照组相比,叶酸修饰脂质体槲皮素浓度越高,pdl1 mrna表达水平越低(图7);pdl1蛋白表达水平越低(图8)。
[0095]
本发明采用脂质体将槲皮素包裹在直径190nm的纳米粒中,保证了槲皮素的靶向效应,大大改善了其在体内作用范围过广的缺陷。脂质体具有物理上稳定的结构,是第一个被美国食品和药物管理局(fda)批准用于治疗癌症的纳米药物传递系统。有报道称,脂质体可以有效地在肿瘤部位聚集,产生被动靶向效益,其强渗透性和滞留效应也有助于脂质体在肿瘤部位积聚。
[0096]
本发明还创新性地利用叶酸修饰脂质体以增强其主动靶向能力。癌细胞表面通常可以观测到高表达、高亲和的叶酸受体,因此叶酸被认为是配体靶向的理想候选。同时,叶酸偶联药物载体通过受体介导的内吞作用转运到细胞内,本发明通过叶酸修饰脂质体槲皮素,与单独使用槲皮素相比,其在体内抗肿瘤的作用明显增强。
[0097]
pd-l1是一种经常在人类癌症细胞膜上被观察到的程序性细胞死亡蛋白配体,当其与相关分子结合后,会抑制t细胞活化信号,从而导致肿瘤的逃逸。相关研究表明,pd-l1高表达与骨肉瘤患者预后不良呈显著相关,其高表达会促进骨肉瘤早期转移。
[0098]
总之,本发明通过技术手段将槲皮素包裹在脂质体中,利用叶酸修饰脂质体运输槲皮素,使其能够持续缓慢地释放,增强其溶解度,提高稳定性的同时,降低药物毒性,产生被动靶向效应,从而达到更好的治疗效果。于此同时,本发明使用叶酸修饰脂质体槲皮素,增强其主动靶向能力,显著增强其抗肿瘤作用。最终,本发明制备的脂质体槲皮素通过调节
pd-l1抑制肿瘤的增殖,最终提高骨肉瘤患者的生存率,改善其预后。
[0099]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
