1.本发明属于有机光电及生物医药材料技术领域,具体涉及一种新型光敏剂及其制备方法和应用。
背景技术:
2.细菌,尤其是革兰氏阳性菌,导致的感染及相关疾病严重威胁着全球人类的生命健康。例如,革兰氏阳性肠球菌是重要的医院内感染病原菌,主要包括占临床分离株80%-90%的粪肠球菌和5%-10%的屎肠球菌,可以引起尿路感染、腹腔感染、盆腔感染、皮肤软组织感染、败血症和心内膜炎等多种临床感染。自20世纪80年代以来,肠球菌严重感染的发病率和死亡率明显升高。
3.在临床上,青霉素、头孢菌素和万古霉素等抗生素的使用为人类对抗革兰氏阳性菌感染提供了有力保障,但是随着抗生素的广泛使用以及滥用,细菌的耐药性问题日益严峻。根据美国疾病控制和预防中心发布的《2019年美国抗生素耐药性威胁》报告,2017年耐万古霉素肠球菌感染占医疗相关肠球菌感染的比例为30%,住院54500例,死亡5400例,医疗支出高达53900万美元。因此,耐万古霉素肠球菌被世界卫生组织列为全球最需要重点关注的12种耐药性细菌之一。
4.近年来,研究人员一直致力于开发新型的光学抗菌疗法,以更好地应对耐药性细菌引起的感染。其中,光动力抗菌疗法利用光敏剂在激光照射下产生的活性氧,破坏蛋白质、磷脂和脱氧核糖核酸等生物大分子,进而诱导细菌死亡。基于光动力抗菌疗法的精准性、高效性、微创性以及不易导致细菌耐药性的优势,开发能够选择性杀灭革兰氏阳性菌的新型光敏剂,将对治疗革兰氏阳性菌感染和解决细菌耐药性危机具有重要的意义。
技术实现要素:
5.本发明提供一种选择性杀灭革兰氏阳性菌的新型光敏剂及其制备方法和应用,以解决传统抗生素疗法导致的革兰氏阳性菌耐药性的问题。
6.为实现上述目的,本发明所提供的技术解决方案是:
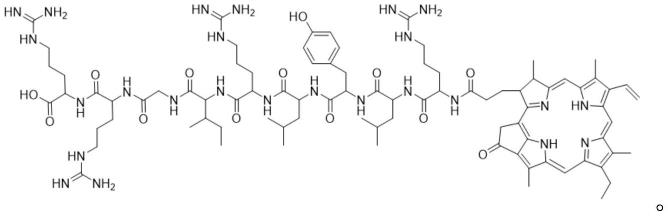
7.一种新型光敏剂,其特殊之处在于,是一种能够利用分子识别策略选择性识别革兰氏阳性菌中脂磷壁酸的rlylrigrr多肽序列功能化的光敏剂,分子结构如下:
[0008][0009]
本发明还提供了上述新型光敏剂的制备方法,其特殊之处在于,包括以下步骤:
[0010]
1)树脂的活化:
[0011]
将2-氯三苯甲基氯树脂置于固相多肽合成管中,加入二氯甲烷(dcm),在惰性气体保护下活化树脂,加压去除二氯甲烷(dcm);
[0012]
2)氨基酸的连接:
[0013]
将fmoc-arg(pbf)-oh和n,n-二异丙基乙胺(dipea)溶解于二氯甲烷(dcm),加入步骤1)后的固相多肽合成管中,在惰性气体保护下反应,加压去除反应液,用二氯甲烷(dcm)清洗树脂;
[0014]
3)未反应树脂的去活化:
[0015]
将甲醇(meoh)、二氯甲烷(dcm)和n,n-二异丙基乙胺(dipea)加入步骤2)后的固相多肽合成管中,在惰性气体保护下反应,加压去除反应液,用n,n-二甲基甲酰胺(dmf)清洗树脂;
[0016]
4)fmoc保护基团的去除:
[0017]
配置含哌啶体积分数为20%的n,n-二甲基甲酰胺(dmf)溶液,加入步骤3)后的固相多肽合成管中,在惰性气体保护下反应,加压去除反应液,用n,n-二甲基甲酰胺(dmf)清洗树脂;
[0018]
5)氨基酸的缩合:
[0019]
将fmoc-arg(pbf)-oh、o-苯并三氮唑-四甲基脲六氟磷酸盐(hbtu)和n,n-二异丙基乙胺(dipea)溶解于n,n-二甲基甲酰胺(dmf),加入步骤4)后的固相多肽合成管中,在惰性气体保护下反应,加压去除反应液,用n,n-二甲基甲酰胺(dmf)清洗树脂;
[0020]
6)其它氨基酸的缩合:
[0021]
重复步骤4)-步骤5)的操作方法,按上述新型光敏剂的分子结构,依次去除fmoc保护基团并缩合fmoc-gly-oh、fmoc-ile-oh、fmoc-arg(pbf)-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、fmoc-leu-oh和fmoc-arg(pbf)-oh,之后再重复步骤4),去除fmoc保护基团,进入步骤7);
[0022]
7)光敏剂的缩合:
[0023]
将焦脱镁叶绿酸a(ppa)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和1-羟基苯并三唑(hobt)溶解于n,n-二甲基甲酰胺(dmf),加入上一步骤后的固相多肽合成管中,在惰性气体保护下反应,加压去除反应液,用n,n-二甲基甲酰胺(dmf)和二氯甲烷(dcm)清洗树脂;
[0024]
8)新型光敏剂的纯化:
[0025]
将三氟乙酸(tfa)、三异丙基硅烷(triisopropylsilane)和水(h2o)加入步骤7)后的固相多肽合成管中,加压收集溶液,进行反应,减压浓缩去除溶剂,加入冰乙醚沉淀,过滤、洗涤得到新型光敏剂;
[0026]
合成工艺如下:
[0027][0028]
进一步地,步骤1)中,反应温度为室温25-30℃,反应时间为10-15min,所述惰性气体为氩气或氮气;
[0029]
步骤2)中,反应温度为室温25-30℃,反应时间为1-1.5h,所述惰性气体为氩气或氮气;
[0030]
步骤3)中,反应温度为室温25-30℃,反应时间为10-15min,所述惰性气体为氩气或氮气;
[0031]
步骤4)中,反应温度为室温25-30℃,反应时间为20min,所述惰性气体为氩气或氮气;
[0032]
步骤5)中,反应温度为室温25-30℃,反应时间为4-5h,所述惰性气体为氩气或氮气;
[0033]
步骤6)中,反应温度为室温25-30℃,fmoc-arg(pbf)-oh的反应时间为4-5h,其余氨基酸的反应时间为2-3h,所述惰性气体为氩气或氮气;
[0034]
步骤7)中,反应温度为室温25-30℃,反应时间为24-30h,所述惰性气体为氩气或氮气;
[0035]
步骤8)中,反应温度为室温25-30℃,反应时间为2h。
[0036]
进一步地,2-氯三苯甲基氯树脂、步骤2)中的fmoc-arg(pbf)-oh、步骤2)中的n,n-二异丙基乙胺、步骤5)中的fmoc-arg(pbf)-oh、步骤5)中的o-苯并三氮唑-四甲基脲六氟磷酸盐、步骤5)中的n,n-二异丙基乙胺、步骤6)中依次使用的fmoc-gly-oh、fmoc-ile-oh、fmoc-arg(pbf)-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、fmoc-leu-oh和fmoc-arg(pbf)-oh、焦脱镁叶绿酸a、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1-羟基苯并三唑的当量比为1.0∶1.5∶3.0∶1.5∶1.5∶1.5∶1.5∶1.5∶1.5∶1.5∶1.5∶1.5∶1.5∶1.5∶3.0∶3.0。
[0037]
与此同时,本发明还提供了:
[0038]
新型光敏剂在杀灭革兰氏阳性菌方面的应用。
[0039]
新型光敏剂在制备杀灭革兰氏阳性菌的非抗生素试剂中的应用。
[0040]
新型光敏剂在制备用于治疗革兰氏阳性菌感染的非抗生素试剂中的应用。
[0041]
新型光敏剂在制备用于治疗耐药性革兰氏阳性菌感染的非抗生素试剂中的应用。
[0042]
一种杀灭革兰氏阳性菌的非抗生素试剂,其特殊之处在于:有效成分为上述新型光敏剂。
[0043]
一种治疗革兰氏阳性菌感染的非抗生素试剂,其特殊之处在于:有效成分为上述新型光敏剂。
[0044]
一种治疗耐药性革兰氏阳性菌感染的非抗生素试剂,其特殊之处在于:有效成分为上述新型光敏剂。
[0045]
本发明的优点是:
[0046]
1.本发明中的新型光敏剂能够基于革兰氏阳性菌和革兰氏阴性菌细胞壁结构的不同,利用rlylrigrr多肽序列和脂磷壁酸的分子识别作用选择性识别革兰氏阳性菌,实现近红外光激发下对革兰氏阳性菌的选择性光动力杀灭。该新型光敏剂将在治疗革兰氏阳性菌感染和解决细菌的耐药性方面具有潜在的应用,也将为开发新型的选择性杀灭细菌的非抗生素试剂提供有效的指导,具有重要的应用价值。
[0047]
2.本发明光敏剂制备方法简单,具有强的近红外区吸收和荧光发射以及优异的单线态氧产生能力。
附图说明
[0048]
图1为本发明实施例1中新型光敏剂p-ppa的紫外-可见-近红外吸收光谱图;
[0049]
图2为本发明实施例1中新型光敏剂p-ppa的荧光光谱图;
[0050]
图3为本发明实施例1中新型光敏剂p-ppa与单线态氧指示剂9,10-蒽二基-双(亚甲基)二丙二酸(abda)混合后在不同光照时间下的紫外-可见-近红外吸收光谱图以及380nm处的吸光度变化结果;其中,a)为紫外-可见-近红外吸收光谱图,b)为380nm处的吸光度变化结果。
[0051]
图4为本发明实施例1中新型光敏剂p-ppa在不同浓度和光照条件下对革兰氏阳性耐万古霉素肠球菌(vre)和革兰氏阴性耐四环素大肠杆菌(tre)的杀菌效果图;其中,a)为革兰氏阳性耐万古霉素肠球菌(vre),b)为革兰氏阴性耐四环素大肠杆菌(tre);
[0052]
图5为本发明实施例1中新型光敏剂p-ppa在不同浓度和光照条件下对革兰氏阳性耐万古霉素肠球菌(vre)和革兰氏阴性耐四环素大肠杆菌(tre)的扫描电子显微镜图像;
[0053]
图6为本发明实施例1中新型光敏剂p-ppa在不同浓度下对小鼠胚胎成纤维细胞的细胞毒性测试结果;
[0054]
图7为本发明实施例1中新型光敏剂p-ppa在不同浓度下对血红细胞的溶血率结果。
具体实施方式
[0055]
以下结合附图和具体实施例对本发明的内容作进一步的详细描述:
[0056]
实施例1:新型光敏剂p-ppa的合成
[0057]
合成工艺如下:
[0058][0059]
1)树脂的活化:将2-氯三苯甲基氯树脂(20.0mg,0.02mmol)置于固相多肽合成管(20.0ml)中,加入二氯甲烷(dcm,4.0ml),在惰性气体保护下室温活化树脂10min,加压去除二氯甲烷(dcm);
[0060]
2)氨基酸的连接:将fmoc-arg(pbf)-oh(19.5mg,0.03mmol)和n,n-二异丙基乙胺(dipea,9.9μl,0.06mmol)溶解于二氯甲烷(dcm,4.0ml),加入步骤1)后的固相多肽合成管中,在惰性气体保护下室温反应1h,加压去除反应液,用二氯甲烷(dcm)清洗树脂;
[0061]
3)未反应树脂的去活化:将甲醇(meoh,2.0ml)、二氯甲烷(dcm,2.0ml)和n,n-二异丙基乙胺(dipea,200.0μl)加入步骤2)后的固相多肽合成管中,在惰性气体保护下室温反应10min,加压去除反应液,用n,n-二甲基甲酰胺(dmf)清洗树脂;
[0062]
4)fmoc保护基团的去除:配置含哌啶体积分数为20%的n,n-二甲基甲酰胺(dmf)溶液(3.0ml),加入步骤3)后的固相多肽合成管中,在惰性气体保护下室温反应20min,加压去除反应液,用n,n-二甲基甲酰胺(dmf)清洗树脂;
[0063]
5)氨基酸的缩合:将fmoc-arg(pbf)-oh(19.5mg,0.03mmol)、o-苯并三氮唑-四甲基脲六氟磷酸盐(hbtu,11.4mg,0.03mmol)和n,n-二异丙基乙胺(dipea,5.0μl,0.03mmol)溶解于n,n-二甲基甲酰胺(dmf,4.0ml),加入步骤4)后的固相多肽合成管中,在惰性气体保护下室温反应4h,加压去除反应液,用n,n-二甲基甲酰胺(dmf)清洗树脂;
[0064]
6)其它氨基酸的缩合:重复步骤4)-步骤5)的操作方法,按上述新型光敏剂的分子结构,依次去除fmoc保护基团并缩合fmoc-gly-oh(8.9mg,0.03mmol)、fmoc-ile-oh(10.6mg,0.03mmol)、fmoc-arg(pbf)-oh(19.5mg,0.03mmol)、fmoc-leu-oh(10.6mg,
0.03mmol)、fmoc-tyr(tbu)-oh(13.8mg,0.03mmol)、fmoc-leu-oh(10.6mg,0.03mmol)和fmoc-arg(pbf)-oh(19.5mg,0.03mmol),重复步骤4),去除fmoc保护基团,进入步骤7);其中,fmoc-arg(pbf)-oh的反应时间为4h,其余氨基酸的反应时间为2h;
[0065]
7)光敏剂的缩合:将焦脱镁叶绿酸a(ppa,16.0mg,0.03mmol)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc,11.5mg,0.06mmol)和1-羟基苯并三唑(hobt,8.1mg,0.06mmol)溶解于n,n-二甲基甲酰胺(dmf,4.0ml),加入上一步骤后的固相多肽合成管中,在惰性气体保护下室温反应24h,加压去除反应液,用n,n-二甲基甲酰胺(dmf)和二氯甲烷(dcm)清洗树脂;
[0066]
8)新型光敏剂的纯化:将三氟乙酸(tfa,9.5ml)、三异丙基硅烷(triisopropylsilane,250.0μl)和水(h2o,250.0μl)加入步骤7)后的固相多肽合成管中,加压收集溶液于圆底烧瓶(50.0ml),室温下反应2h,减压浓缩去除溶剂,加入冰乙醚(10.0ml)沉淀,过滤并经冰乙醚洗涤得到新型光敏剂p-ppa。
[0067]
上述惰性气体为氩气或氮气。
[0068]
实施例2:质谱测试
[0069]
称取少量实施例1中的p-ppa,溶解于1.5ml甲醇中,进行质谱测试。p-ppa质核比(m/z)的理论值为1719.25,实验值为860.64,对应于[1/2m h]
,表明了新型光敏剂p-ppa的成功制备。
[0070]
实施例3:紫外-可见-近红外吸收光谱测试
[0071]
配置实施例1中p-ppa的二甲基亚砜(dmso)溶液(10μm),移取1.0ml的p-ppa溶液于比色皿中进行紫外-可见-近红外吸收光谱测试。如图1所示,新型光敏剂p-ppa具有两个特征吸收峰,分别位于可见光区的410nm和近红外区的670nm。
[0072]
实施例4:荧光发射光谱测试
[0073]
配置实施例1中p-ppa的dmso溶液(10μm),移取1.0ml的p-ppa溶液于比色皿中进行荧光发射光谱测试。如图2所示,当激发波长为410nm时,新型光敏剂p-ppa在670nm处表现出强的近红外荧光发射。
[0074]
实施例5:单线态氧检测
[0075]
配置10mm的ph=7.4的磷酸氢二钠和磷酸二氢钠的缓冲溶液(pbs)。配置包含实施例1中p-ppa(0和40μm)和9,10-蒽二基-双(亚甲基)二丙二酸(abda,200μm)的pbs溶液,经660nm激光(100mw/cm2)照射不同时间后测定溶液的紫外-可见-近红外吸收光谱,记录380nm处吸光度的变化。如图3所示,在近红外激光照射下,含有p-ppa的abda溶液的吸收光谱强度逐渐降低,光照16min后380nm处的吸光度降低至59.2%。在同样条件下,仅含有abda的溶液在380nm处的吸光度没有发生明显变化,表明新型光敏剂p-ppa在近红外激光照射下可以有效地产生单线态氧。
[0076]
实施例6:细菌存活率测试
[0077]
培养耐万古霉素肠球菌(vre,革兰氏阳性菌)至对数期(细菌浓度约为108cfu/ml),移取细菌悬浮液(1.0ml),离心去掉培养基后用pbs洗涤3次。加入实施例1中p-ppa的pbs溶液(0、2.5、5、7.5和10μm,200.0μl,1%dmso),在室温黑暗条件下孵育1h,离心后用pbs洗涤3次。加入pbs(200.0μl)重新悬浮细菌,细菌悬浮液在660nm激光(100mw/cm2)下照射15min或在黑暗条件下放置15min。用pbs稀释上述细菌悬浮液后用于菌落计数,计算细菌存
活率。所有实验独立重复3次。利用相同的实验步骤,测试不同浓度的p-ppa在黑暗和光照条件下对耐四环素大肠杆菌(tre,革兰氏阴性菌)的杀菌效果。如图4所示,在黑暗条件下,p-ppa对耐万古霉素肠球菌几乎没有细菌毒性,在近红外激光照射下,p-ppa显示了浓度依赖的杀菌效果,在10μm时杀菌率达到了100%。此外,无论在黑暗还是光照条件下,p-ppa对耐四环素大肠杆菌的毒性都很小。这些结果表明新型光敏剂p-ppa可以在近红外激光照射下选择性杀灭革兰氏阳性菌。
[0078]
实施例7:杀菌效果的扫描电子显微镜图像测试
[0079]
与实施例6中的实验步骤类似,耐万古霉素肠球菌(vre)和耐四环素大肠杆菌(tre)经实施例1中p-ppa(0和10μm)在黑暗和光照条件下处理,所得的细菌悬液滴于硅片、4%多聚甲醛固定和乙醇梯度脱水后,利用扫描电子显微镜拍摄细菌形貌的变化。如图5所示,经pbs处理、近红外激光照射或p-ppa处理后,耐万古霉素肠球菌边缘清晰,未发生明显的形貌变化;而经p-ppa处理和近红外激光照射后,细菌表面出现了明显的塌陷。耐四环素大肠杆菌经过以上条件处理后,细菌形貌未发生明显的变化。这些结果与细菌存活率的结果一致,表明新型光敏剂p-ppa可以在近红外激光照射下选择性杀灭革兰氏阳性菌。
[0080]
实施例8:生物相容性测试
[0081]
将小鼠胚胎成纤维细胞(nih3t3,6000个/孔)接种于96孔细胞培养板(100.0μl/孔)后进行贴壁培养,移去dmem培养基后加入不同浓度的实施例1中p-ppa(0、2.5、5、7.5和10μm,每组有5个平行实验)培养,用alamar blue细胞增殖及细胞毒性检测试剂盒测试细胞存活率。如图6所示,新型光敏剂p-ppa在不同浓度下对nih3t3细胞没有明显的毒性,且细胞存活率均在98%以上,表明其具有优异的生物相容性。
[0082]
实施例9:血液相容性测试
[0083]
将血红细胞(5%,500.0μl,0.9%氯化钠)与不同浓度的实施例1中p-ppa(0、5、10、15和20μm,500.0μl)或曲拉通(triton x-100,0.1%,500.0μl)共孵育1h,离心收集上清液,经0.9%氯化钠稀释后用酶标仪测试545nm处的吸光度并计算溶血率。如图7所示,新型光敏剂p-ppa在不同浓度下对血红细胞没有明显的毒性,且溶血率均低于5%,表明其具有优异的血液相容性。
[0084]
鉴于实施例3~实施例9对于新型光敏剂p-ppa的性能及用途验证,可使用新型光敏剂p-ppa杀灭革兰氏阳性菌、制备杀灭革兰氏阳性菌的非抗生素试剂、治疗革兰氏阳性菌感染的非抗生素试剂以及治疗耐药性革兰氏阳性菌感染的非抗生素试剂。
[0085]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明公开的技术范围内,可轻易想到各种等效的修改或替换,这些修改或替换都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。