1.本发明涉及一种壳聚糖改性的纳米材料,具体涉及一种基于壳聚糖的多功能自组装双亲性纳米载体及其制备方法,属于海洋生物材料制备技术领域。
背景技术:
2.壳聚糖是由d-氨基葡萄糖和n-乙酰氨基葡萄糖单元组成,当壳聚糖的脱乙酰度达到50%左右时,溶于酸性水溶液;壳聚糖在酸性环境中溶解时,氨基变成阳离子,使壳聚糖成为唯一的阳离子海洋多糖。壳聚糖无毒无副作用,具有良好的保湿和吸附性能,然而因其不溶于水和大多数有机溶剂的缺点而限制了在各个领域的应用。通过对壳聚糖活性官能团进行化学修饰得到壳聚糖衍生物以发挥壳聚糖的更大作用。化学改性不仅可以保留壳聚糖的独特性质,还能改善壳聚糖的物理化学性质,扩大壳聚糖衍生物的应用范围。
3.利用壳聚糖作为药物/基因载体是当前的研究热点,也具有广阔的应用前景。
技术实现要素:
4.本发明的目的是提供一种基于壳聚糖的多功能双亲性自组装纳米载体,另一目的是提供该纳米载体的制备方法,并研究该纳米载体在药物/基因协同治疗肿瘤方面的应用。
5.为达到上述目的,本发明采取的具体技术方案为:一种基于壳聚糖的多功能双亲性自组装纳米载体(vcph),该纳米载体以壳聚糖为主体,壳聚糖的氨基分别接有维生素e琥珀酸酯(ves)、聚乙二醇单甲醚(mpeg)和组氨酸(his)。
6.进一步的,上述vcph呈球形或椭球形,平均粒径为147.6
±
40.4 nm,pdi=0.38
±
0.029;ves的取代度为4.13 %,mpeg取代度为22.6%,his的取代度为17.39 %。
7.进一步的,上述vcph表面zeta电位为 32.8
±
7.3 mv。
8.所述vcph的形态呈球形或椭球形,粒径大小较均一,分散性良好,纳米粒之间存在较强的静电作用,有利于纳米胶束保持稳定,且具有良好的生物安全性。
9.上述纳米载体的制备方法,包括以下步骤:(1)将壳聚糖溶于稀酸溶液;(2)制备 ves 溶液,并加入活化剂;(3)将(1)得到的壳聚糖液滴加至(2)ves 溶液中,反应;(4)将(3)反应完的混合液进行醇沉、透析和冻干,即得到海绵状维生素e琥珀酸酯-壳聚糖(vc);(5)将(4)得到的vc溶于酸液,制备mpeg溶液并进行活化,再将vc溶液滴加至mpeg溶液中进行反应;(6)待(5)反应结束后,透析、冻干,得到产物维生素e琥珀酸酯-壳聚糖-聚乙二醇单甲醚(vcp);(7)将所述vcp溶于酸液,制备his溶液并进行活化,再将vcp溶液滴加至his溶液中
进行反应;(8)待(7)反应结束后,透析、冻干,得到终产物维生素e琥珀酸酯-壳聚糖-聚乙二醇单甲醚-组氨酸(vcph)。
10.所述vcph在共负载疏水药物和荷负电子基因载体制备中的应用。
11.进一步的,将疏水性药物分散于二甲亚砜中,将所述vcph溶解于水中,二者混合均匀,透析处理,除去未包载的疏水性药物,冷冻干燥即得。
12.进一步的,将荷负电子基因溶解于水中,将包封疏水药物的纳米粒溶液滴加至基因水溶液中,二者混合均匀,静置制备可得。
13.更进一步的,所述疏水药物为疏水阿霉素,荷负电子基因为已构建好的pgpu6/gfp/neo stat3-shrna(pdna)。
14.基于vcph制备的dox/vcph的包封率为84.21%,载药量高达31.58%,表面zeta电位为 28.1
±
1.3 mv,并且所述的dox/vcph纳米粒存在π-π共轭作用,具有一定的ph敏感性。
15.基于vcph制备的dox/vcph/pdna的平均粒径为267.9
±
8.9 nm,pdi=0.219
±
0.007,表面zeta电位为 15.1
±
0.21 mv,形态呈球形或椭球形,分散均一且稳定。在体内外功能性实验中展现了良好的抗肿瘤效果:体外抑瘤率为62.40%,体内抑瘤率为 40.12%。
16.本发明的优点和技术效果:本发明制备得到的vcph分散性好、稳定性高,具有良好的生物安全性;其制备的载药纳米粒稳定性强,包封率、载药量高。实际验证了,vcph能够有效作为载药载体进行应用。
附图说明
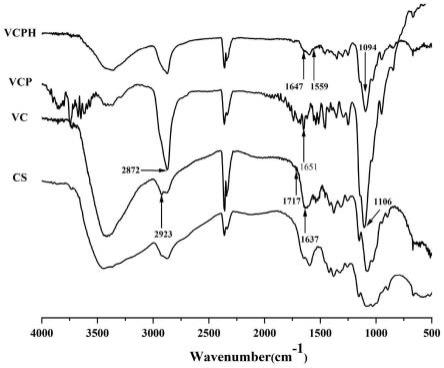
17.图1为cs、vc、vcp及vcph的红外光谱图。
18.图2为vcph的1h nrm图。
19.图3为vcph纳米粒的粒径分布图。
20.图4为vcph纳米粒表面zeta电位图。
21.图5为vcph纳米粒扫描电镜图。
22.图6为不同浓度vcph纳米粒处理l929细胞在24 h和48 h时生长状态观察图。
23.图7为不同浓度vcph纳米粒子处理后l929细胞的相对增殖率结果图。
24.图8为dox/vcph的粒径分布图。
25.图9为dox/vcph的表面zeta电位图。
26.图10为dox/vcph的扫描电镜图。
27.图11为dox
·
hcl和dox/vcph的紫外吸收光谱图。
28.图12为dox/vcph在ph=5.7和ph 7.4的pbs缓冲液中的释放曲线。
29.图13为dox/vcph/pdna的粒径分布图。
30.图14为dox/vcph/pdna表面zeta电位图。
31.图15为dox/vcph/pdna纳米粒扫描电镜图。
32.图16为dox
·
hcl、dox/vcph、dox/vcph/pdna的ic
50
结果图。
33.图17为不同纳米粒转染a549细胞后的细胞相对抑制率结果图。
34.图18为不同纳米复合粒子转染a549细胞后的激光共聚焦扫描显微镜观察图。
35.图19为流式细胞术检测不同纳米复合粒子转染a549细胞后的gfp阳性率结果图。
36.图20为不同纳米粒子组裸鼠的相对体重变化图(与生理盐组相比,*p《0.05)。
37.图21为不同纳米粒子组裸鼠的相对瘤径变化图(与生理盐组相比,*p《0.05,**p《0.01)。
38.图22为不同组别的裸鼠主要器官的脏器指数(与生理盐组相比,*p《0.05)。
39.图23为不同组别的裸鼠切除肿瘤后的肿瘤实体图。
具体实施方式
40.以下通过具体实施例并结合附图对本发明进一步解释和说明。
41.实施例1称取0.24 g壳聚糖并溶于60 ml 0.5%醋酸溶液中,取1.59 g ves溶于40 ml dmf并置于三口瓶中,再称取1.15 g edc和0.68 g nhs加入到上述溶液中,磁力搅拌2 h,通过恒压滴定漏斗将壳聚糖溶液逐滴加入到三口瓶中,室温下搅拌48 h。将反应后的混合液倒入5倍体积无水乙醇中沉淀,搅拌8 h后在12000rpm转速下室温离心20 min,再用无水乙醇清洗沉淀4-5次,用200 ml蒸馏水溶解沉淀,置于透析袋(截留率 8000-14000k)中透析三天,冷冻干燥得到海绵状维生素e琥珀酸酯-壳聚糖(vc)。
42.称取0.24 g vc并溶于60 ml 0.5%醋酸溶液中备用。称取0.2 g聚乙二醇单甲醚(mpeg)溶于60 ml 0.5%醋酸溶液中,并加入0.57 g edc和0.34 g nhs,磁力搅拌2 h后,将上述vc溶液缓慢逐滴加入到混合液中,室温下机械搅拌36 h。反应结束后将混合液置于透析袋(截留率3500k)中,透析三天,通过冷冻干燥的方法得到维生素e琥珀酸酯-壳聚糖-聚乙二醇单甲醚(vcp)。
43.称取0.4 g vcp并溶解于80 ml 0.5%醋酸溶液中备用。称取0.193 g组氨酸(his)溶解于去离子水中,并加入0.286 g edc和0.476 g nhs,磁力搅拌2 h后,将上述vcp溶液缓慢逐滴加入到混合液中,室温下机械搅拌24 h。反应结束后将混合液置于透析袋(截留率8000-14000k)中,透析三天,冷冻干燥可得到终产物维生素e琥珀酸酯-壳聚糖-聚乙二醇单甲醚-组氨酸(vcph)。
44.采用红外光谱和核磁氢谱表征合成的终产物vcph,结果如图1和图2所示,结合红外和核磁的结果可判断维生素e琥珀酸酯、mpeg和his成功接枝到了壳聚糖上。采用激光粒度电位分析仪测定vcph纳米粒子的粒径、表面zeta电位和多分散指数(pdi),结果如图3和图4所示,vcph纳米粒子的平均粒径为147.6
±
40.4 nm,pdi=0.38
±
0.029,表面zeta电位为 32.8
±
7.3 mv。
45.以上结果表明vcph纳米粒的粒径大小分散且均一,且纳米粒之间存在较强的静电作用,有利于纳米胶束保持稳定。通过扫描电子显微镜观察vcph纳米粒的形貌结果如图5所示,从图中可以观察到vcph纳米粒呈球形或椭球形,粒径大小约为100-200 nm,分散均匀,无明显的团聚现象。
46.实施例2待l929细胞处于对数生长期时,加胰酶消化,再用培养基终止消化,离心、收集细胞沉淀、重悬细胞后,调整细胞悬液浓度至2
×
104个/ml,以每孔200 μl种植于96孔板中。培养24 h后,吸弃孔板中旧培养基,加入200 μl含不同浓度vcph溶液的培养基,浓度梯度设置为10、50、100、200 μg/ml,将正常培养基培养的细胞种植孔和只含正常培养基但未种细胞
的孔分别设置成对照组和空白对照组,每组均设6组重复孔。轻轻混匀后,将孔板孵育24 h、48 h后,分别在不同时间点取出,倒置显微镜下观察细胞形态并拍照,再向每孔加20 μl 配制的mtt溶液,37℃培养箱中孵育4 h,吸弃上清液,加150 μl二甲亚砜(dmso),酶标仪上37℃振荡孵育10 min后,在492 nm波长下测定每孔的吸光值(od值),按如下公式计算出细胞相对增殖率(rgr)。
47.细胞相对增殖率(rgr%)=(实验组平均吸光值-空白组平均吸光值)/(对照组平均吸光值-空白组平均吸光值)
×
100%细胞毒性评级标准如下表1:表1 细胞毒性评级表毒性评级5级4级3级2级1级0级rgr(%)01-2425-4950-7475-99≥100备注:0级或1级视为合格,2级则需结合细胞形态进行评价,3-5级视为不合格。
48.图6为不同浓度的vcph纳米粒与l929细胞共培养24 h和48 h的细胞形态图。由图可知,培养24 h和48 h后l929细胞均能够正常生长和增殖,细胞形态良好,呈现出正常的梭形或扁平状细胞形态,细胞数目与对照组的细胞相比无明显差异,未发现细胞变形、皱缩或细胞之间相互脱离等明显的细胞凋亡现象。
49.图7为mtt法检测不同浓度的vcph纳米粒子对l929细胞的细胞相对增殖率。由图可知,不论vcph与l929共培养24 h还是48 h,其细胞相对增殖率都超过80%,根据细胞毒性评级可知各纳米粒子组的细胞毒性为0级或1级,说明vcph纳米粒子无细胞毒性、具有良好的细胞相容性。
50.实施例3配制成1 mg/ml的vcph水溶液,将一定质量的阿霉素(dox)溶于1 ml dmso中,并逐滴加入vcph水溶液中,将此溶液转移到透析袋(截留分子量为8000-14000k)中,于4oc避光透析12 h,每隔2 h换水,除去有机溶剂和没有包裹到纳米粒子中的阿霉素,即为dox/vcph溶液。
51.根据上述配制不同药质比的(dox: vcph药质比分别为2: 5、3: 5、4: 5)的dox/vcph纳米粒溶液,在25 ml棕色容量瓶中加入1 ml dox/vcph溶液并用二甲亚砜补加至刻度线,经超声处理后于荧光酶标仪测dox的相对荧光强度。根据公式计算出不同药质比的dox/vcph的包封率和载药量:包封率(ee%)=(纳米粒包封的药物质量)/(投药质量)
×
100%载药量(lc%)=(纳米粒包封的药物质量)/(载药纳米粒总质量)
×
100%dox/vcph药质比对包封率和载药量的影响如表2所示:表2不同药物载质比对包封率和载药量的影响药物载体质量比(mg/mg)包封率(ee%)载药量(dl%)2:588.69
±
10.66%.34
±
3.04%3:584.21
±
7.771.58
±
2.91%4:575.96
±
3.554.09
±
1.74%从表2可以看出,dox/vcph的载药量与药质比呈正向关系,而包封率与药质比则呈负向关系,提高药质比虽然会使得包封进vcph纳米粒疏水层的药物增加,但却有更多比例
的dox未包封而造成损失,因此选择药质比为3:5来制备dox/vcph。
52.dox/vcph纳米粒并通过激光粒度电位分析仪测定其粒径、表面zeta电位及pdi,结果如图8、9所示,dox/vcph的平均粒径为283.2
±
31.7 nm,pdi=0.27
±
0.011,表面zeta电位为 28.1
±
1.3 mv,表明dox/vcph粒径大小较为均一,分散性良好。通过扫描电子显微镜观察dox/vcph的形貌结果如图10所示,dox/vcph的粒径约为200-300 nm,呈球形或椭球形,与vcph纳米粒相比更饱满,无明显的团聚现象。
53.实施例4分别配制1mg/ml的dox
·
hcl水溶液和dox/vcph溶液,稀释一定倍数后分别置于紫外分光光度计中测其250-650 nm的全波长吸收光谱,并绘制紫外吸收光光谱曲线。
54.制备dox/vcph溶液,分别在ph=7.4和5.7的pbs缓冲液中浸入含1 ml dox/vcph溶液的透析袋(截留率为8000-14000k),37℃、100 rpm孵育48 h,在设定的时间点分别吸取200 μl pbs测定dox的荧光强度,同时补加200 μl新的pbs,通过dox的标准曲线计算dox的累计释放量,绘制dox/vcph药物释放曲线。
55.dox
·
hcl和dox/vcph的紫外吸收光谱结果如图11所示, dox
·
hcl在485 nm处存在最大吸收峰,而dox/vcph在496 nm处存在最大吸收峰,dox/vcph相较dox
·
hcl发生转移,说明vcph包封dox过程中发生了π
–
π共轭作用力,dox/vcph共轭体系更稳定。dox/vcph在ph=7.4和ph=5.7条件下的药物释放行为结果如图12所示,0-0.5 h,dox释放较快,而0.5-48 h,dox/vcph存在缓慢的释放;在48 h时,dox/vcph在ph=7.4和5.7环境下的dox累计释放量分别为15.53%和28.72%,说明dox/vcph纳米粒具备一定的ph敏感性。
56.实施例5制备dox/vcph溶液,按n/p为55向含有4 μg稀释后的stat3-shrna重组质粒(pdna)溶液中等体积加入dox/vcph溶液,彻底混匀,37℃静置30 min,利用静电作用制备出稳定负载shrna的dox/vcph/pdna纳米复合粒子。树枝状水溶性高分子聚合物聚乙烯亚胺(pei,1 mg/ml)与重组质粒按上述方法以n/p比为10:1进行复合,制备出pei/pdna复合粒子。
57.dox/vcph/pdna纳米复合粒子的粒径、表面zeta电位及pdi结果如图13、图14所示,dox/vcph/pdna纳米粒的平均粒径为267.9
±
8.9 nm,pdi=0.219
±
0.007,表面zeta电位 15.1
±
0.21 mv,粒径大小均一且分散良好。dox/vcph/pdna纳米复合粒子在扫描电子显微镜下的观察结果如图15所示,大小约在200-300 nm,呈球形或椭球形,均匀分散,无团聚现象。
58.实施例6将处于对数生长期的a549细胞经胰酶消化,f-12k培养基终止消化,离心重悬,以2
×
104个/ml密度种于96孔板,培养24 h后,吸弃原培养基,加入含有dox
·
hcl、dox/vcph和dox/vcph/pdna的培养基(dox在培养基中的终浓度设置为0.1-100 μg/ml不等),设f-12k培养基正常培养的细胞为对照组,不含细胞的正常培养基为空白组。培养24 h后,于倒置显微镜下观察细胞形态,并向每孔加20 μl mtt溶液,37℃孵育4 h,吸弃上清液,加150 μl二甲亚砜,酶标仪上37℃振荡孵育10 min后,在492 nm波长下测定每孔的吸光值,计算出各组的细胞相对增殖率。
59.从图16中可以看出,dox
·
hcl、dox/vcph、dox/vcph/pdna对a549细胞在24 h的ic
50
分别为1.39 μg/ml、12.50 μg/ml和6.95 μg/ml。
60.实施例7处于对数生长期的a549细胞经胰酶消化、离心重悬,调整细胞密度为2
×
104个/ml种于96孔板中,培养24 h后,加入制备的dox
·
hcl、pei/pdna、dox/vcph、vcph/pdna、dox/vcph/pdna,其中dox终浓度分别为1、5、10、15、20 μg/ml,设f-12k培养基正常培养的细胞为对照组,不含细胞只含培养基的为空白组。培养24 h后,于倒置显微镜下观察细胞形态并向每孔加20 μl mtt溶液,37℃孵育4 h,弃上清并加150 μl二甲亚砜,于酶标仪中测定每孔的吸光值,计算出各组的细胞相对抑制率。
61.由图17可得,随着dox药物浓度的增加,dox
·
hcl、dox/vcph、dox/vcph/pdna、pei/pdna、vcph/pdna对a549细胞生长的抑制作用明显提高,在dox浓度为20 μg/ml时,dox
·
hcl的细胞生长抑制率为71.81%,dox/vcph的细胞生长抑制率为57.93%,vcph/pdna的细胞生长抑制率为41.85%,pei/pdna的细胞生长抑制率为68.56%,双载纳米粒dox/vcph/pdna的细胞生长抑制率为62.40%。
62.实施例8将对数生长期的a549细胞通过胰酶消化,离心重悬后调整细胞密度为105个/ml种于六孔板中,培养24 h后,加入制备的naked pdna、vcph/pdna、dox/vcph/pdna和pei/pdna,dox在培养基中的终浓度为20 μg/ml。培养48 h后,吸弃孔板中培养基并用pbs避光清洗后用激光共聚焦显微镜进行荧光观察,转染成功的细胞可表达出gfp绿色荧光蛋白(激发波长488 nm,发射波长507 nm)。实验中naked pdna组和pei/pdna组分别作为实验的阴性和阳性对照组。
63.根据上述将naked pdna、vcph/pdna、dox/vcph/pdna和pei/pdna转染a549细胞,培养48 h后,避光条件下,pbs清洗后加入胰酶消化,用新鲜培养基终止消化后离心,pbs重悬孔板中细胞,通过细胞滤网进行流式细胞术检测。
64.由图18可得,阴性对照naked pdna组中无荧光信号表达,而含有不同纳米粒子组表现出的转染效率不一致,vcph/pdna组、dox/vcph/pdna组和pei/pdna组均显示出较强的荧光表达强度和数量,其中vcph/pdna组与阳性对照pei/pdna组相比表达数量和强度均较弱,而dox/vcph/pdna组的绿色荧光表达量及强度最高。由图19可得,dox/vcph/pdna组转染率为98.2%,vcph/pdna组转染率为15.1%,pei/pdna组转染效率为21%。
65.实施例9异硫氰酸荧光素(fitc)(激发波长490 nm)通过异硫氰根打开碳氮双键与vcph的氨基发生反应来标记vcph。称取0.1 g vcph溶于10 ml 0.5%乙酸中,用0.1m的naoh溶液调整ph为9.0,加入10 ml甲醇搅拌混合均匀,逐滴加入12 ml浓度为2 mg/ml的fitc甲醇溶液,4℃避光反应24 h,95%乙醇反复清洗反应溶液后加入透析袋(截留率为3500k)中透析三天,冻干后得fitc-vcph。称取2 mg cy5溶于800 μl二甲亚砜中,加入1 ml溶解于等体积的二甲亚砜中的浓度为0.5 μg/μl的pdna,避光搅拌反应12 h后离心,得到的上清即为cy5-pdna。
66.将对数生长期的a549细胞经胰酶消化,离心重悬,稀释至8
×
104个/ml种于至六孔板中,培养24 h,吸弃原培养基,加入制备好的dox
·
hcl、dox/fitc-vcph、dox/fitc-vcph/cy5-pdna、fitc-vcph/cy5-pdna,dox在培养基中的终浓度为20 μg/ml。在加入不同纳米粒的1 h、3 h和5 h时分别加入1 ml hoechst33258染色液37℃孵育15 min,pbs清洗后加入1 ml pbs浸没细胞,于激光共聚焦显微镜下观察标记材料在细胞内的分布情况。
67.细胞核经hoechst 33258染色后呈蓝色,vcph经fitc标记后呈绿色,经cy5标记的pdna和dox呈红色。转染1 h后,所有组别的蓝色荧光、红色荧光和绿色荧光强度均不明显,此时复合粒子已进入细胞。转染3 h后,dox
·
hcl组在细胞核处显示出较强的红色荧光,而dox/vcph组在细胞质的红色荧光较强,dox/vcph/pdna组和vcph/pdna组在细胞质和细胞核处均出现红色荧光。转染5 h后,各组的蓝色荧光、红色荧光和绿色荧光基本重叠,说明vcph包载的dox和pdna均已递送到细胞核。
68.实施例10在f-12k培养基中培养a549细胞,传代三次后用胰酶消化,离心重悬,用0.9%生理盐水调整细胞密度为为1
×
107个/ml。将a549细胞以每只0.1 ml的接种剂量种于balb/c
ꢀ‑
nu雌鼠右侧腋下,正常喂养一周后,裸鼠的接种部位长出80-100 mm3左右大小的肿瘤即成功建立裸鼠肿瘤模型。
69.将30只肿瘤状态良好的荷瘤小鼠随机分成六组,分别为生理盐水组,dox
·
hcl组、dox/vcph组、dox/vcph/pdna组、vcph/pdna组和pei/pdna组。按裸鼠体重以每针剂5 mg/kg的药剂量注射至裸鼠的尾静脉,每3天注射一次,连续注射4次,每隔3天记录裸鼠的体重、肿瘤的长径(l)和短径(w)。裸鼠治疗完成后,将其断颈处死,剥离并收集裸鼠腋下肿瘤瘤体和心肝脾肺肾脏器组织,精确称量并记录各组瘤体和脏器组织的重量,计算出各组的肿瘤抑制率和脏器指数。肿瘤体积的大小按照以下公式计算:v
肿瘤体积
=(l
×
w2)/2开始给药的第一天标记为第0天,由图20可得,生理盐组的裸鼠体重一直在上升,dox
·
hcl组自第2次给药后体重有了明显的下降趋势,给药后第12天后体重呈上升变化;dox/vcph组给药后也有体重下降的情况,但下降程度较低,后逐步上升;dox/vcph/pdna组、vcph/pdna组、pei/pdna组体重一直呈上升趋势。在给药24天后,dox
·
hcl组与生理盐组相比具有显著性差异,其他四组无显著性差异,说明vcph作为药物/基因载体,可以有效降低化疗药物的毒副作用。治疗24天后,从图21中可以看出,从治疗开始,生理盐组裸鼠的肿瘤体积一直呈上升趋势,治疗到第24天后,生理盐组肿瘤体积增长至初体积的6.36倍,dox
·
hcl组增长至初体积的3.89倍,dox/vcph组增长至5.18倍,dox/vcph/pdna组增长至初体积的4.37倍,vcph/pdna组增长至初体积的4.69倍,pei/pdna组增长至初体积的4.06倍。治疗到第24天后,dox
·
hcl组相较生理盐组具有极显著差异,dox/vcph/pdna组和pei/pdna组相较生理盐组具有显著性差异,而其他两组无显著性差异。从裸鼠的瘤体积的相对变化情况可以看出,dox/vcph/pdna组的肿瘤体积变化较dox/vcph组和vcph/pdna组有明显的优势,说明dox/vcph/pdna具有较良好的抑瘤效果。
70.脏器指数能够初步反映药物或材料对脏器的影响。从图22中可以看出,dox/vcph组、vcph/dna组和dox/vcph/dna组的各组织的脏器指数与生理盐水组相比无显著性差异。而dox
·
hcl组的脾和pei/pdna组的肝与生理盐水组相比存在显著性差异,说明dox和pei对裸鼠的正常脏器组织具有一定的毒性作用。
71.治疗结束,处死裸鼠后,剥离各组的肿瘤瘤体并拍照记录,由图23可得,实体瘤图片与治疗期间裸鼠的相对肿瘤体积变化的趋势较一致。按照裸鼠体内抑瘤率公式计算,dox
·
hcl组的肿瘤抑制率为50.60%,pei/pdna组的肿瘤抑制率为43.71%,dox/vcph组的肿瘤抑制率为36.72%,vcph/pdna组的肿瘤抑制率为29.49%,dox/vcph/pdna组的肿瘤抑制率
为40.12%(见表3),此可以看出,dox/vcph/pdna相较dox/vcph和vcph/pdna显示出较好的体内抗肿瘤效果。
72.表3 不同组别在裸鼠体内的肿瘤抑制率groupinhibitionrate(%)control—dox
·
hcl50.60dox/vcph36.72dox/vcph/pdna40.12vcph/pdna29.49pei/pdna43.71本发明通过亲疏水嵌段改性自组装制备出的多功能性的新型纳米胶束vcph兼具双亲性、被动靶向性、ph敏感性以及提高基因转染效率等特性,是一种多功能性的智能型药物载体和基因载体。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
