1.本发明属于生物医药技术领域,具体涉及苹果酸酶1在制备防治肺动脉高压的药物中的应用。
背景技术:
2.肺动脉高压(pulmonary hypertension,ph)是指由多种病因和发病机制导致的肺血管结构和/或功能改变,肺血管阻力进行性增加,平均肺动脉压(mpap)≥25mmhg的临床病理生理综合征。若不能有效控制,ph可进一步发展成右心衰竭甚至死亡。ph主要病理改变包括肺血管重塑、肺动脉远端肌化、血管闭塞和复杂丛状病变。其中,肺血管重塑被认为是ph疾病发生、发展的关键。参与肺血管重塑的机制,主要涉及以下3条经典途径,包括内皮素途径、一氧化氮途径以及前列环素途径。尽管针对上述途径的靶向药物在临床应用中取得了不错的治疗效果,但它们仅改善患者的临床症状,并不能有效地缓解或者逆转肺血管重塑及ph疾病进展。越来越多的研究表明,代谢重编程在肺血管重塑及ph进展中发挥关键作用,靶向关键的代谢通路/代谢酶可改善ph进展。因此从代谢重编程和关键代谢酶入手,对寻找ph新的治疗靶点具有重要意义。
3.苹果酸酶作为三羧酸(tricarboxylic acid,tca)循环的关键酶,可催化苹果酸氧化脱羧为丙酮酸,并伴随nadph的生成。在哺乳动物细胞中,已鉴定出三种苹果酸酶亚型,由三个同源基因编码,根据其在细胞内分布和辅酶特异性分别命名为:胞质nadp依赖的me(me1)、线粒体nad(p)依赖的me(me2)和线粒体nadp依赖的me(me3)。这些酶在自然界中广泛存在,其中me1和me2是主要的亚型。me1由于其定位于细胞质并且调节丙酮酸的生成,因此可将糖酵解途径和三羧酸循环相联系;同时,me1通过生成nadph可使脂肪酸从头合成途径与谷氨酰胺代谢途径相互关联。研究表明,me1在多种肿瘤中高表达,通过促进葡萄糖摄取和乳酸堆积,导致有氧糖酵解,从而增强肿瘤细胞的增殖和侵袭能力。在肥厚性心脏病中,发现抑制me1可促进碳水化合物氧化,减少乳酸的积累,增加谷胱甘肽含量,从而平衡细胞内氧化还原状态,改善病理性肥厚心脏的功能。然而,苹果酸酶在ph疾病发生发展中的作用仍然未知。
技术实现要素:
4.本发明的目的在于提供苹果酸酶1抑制剂在制备防治肺动脉高压的药物中的应用。苹果酸酶1可以作为检测和治疗肺动脉高压的靶点,苹果酸酶1抑制剂可以作为防治肺动脉高压的活性物质,增加苹果酸酶1和苹果酸酶1抑制剂的用途。
5.本发明提供了苹果酸酶1在制备检测和/或治疗肺动脉高压的标志物中的应用。
6.优选的,所述苹果酸酶1的蛋白水平和/或酶活性在肺组织中增加。
7.本发明还提供了敲除或敲低编码苹果酸酶1的基因在制备防治肺动脉高压的药物中的应用。
8.本发明还提供了苹果酸酶1抑制剂在制备防治肺动脉高压的药物中的应用。
9.优选的,所述肺动脉高压包括由低氧和/或su5416/缺氧诱导的肺动脉高压。
10.本发明还提供了苹果酸酶1抑制剂在制备改善肺循环阻力和/或重塑肺血管的药物中的应用。
11.本发明还提供了苹果酸酶1抑制剂在制备降低右心室收缩压(rvsp)、降低右心室肥厚指数(rvhi)、升高paat/et、升高tapse和降低肺动脉中层厚度中一项或多项的药物中的应用。
12.优选的,所述苹果酸酶1抑制剂包括小分子抑制剂me1*。
13.本发明还提供了一种防治肺动脉高压的药物,所述药物的活性成分包括苹果酸酶1抑制剂。
14.优选的,所述苹果酸酶1抑制剂包括小分子抑制剂me1*。
15.有益效果:
16.本发明提供了苹果酸酶1在制备检测和/或治疗肺动脉高压的标志物中的应用,所述苹果酸酶1的蛋白水平和/或酶活性在肺组织中显著增加,因而,可以作为检测或治疗肺动脉高压的标志物。
17.同时,本发明还提供了苹果酸酶1抑制剂在制备防治肺动脉高压的药物中的应用,所述苹果酸酶1抑制剂可以通过降低右心室收缩压和右心室肥厚指数,改善肺动脉高压患者的肺循环阻力和右心室受累/右心衰竭,因而苹果酸酶1抑制剂可以作为治疗肺动脉高压的治疗靶点,增加苹果酸酶1和苹果酸酶1抑制剂的医药用途。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
19.图1为me1蛋白水平和酶活性在ph患者肺组织中增加,其中a为ph患者(n=4)和健康供体(n=4)肺组织苹果酸酶的代表性蛋白免疫印迹和相对定量分析;b为ph患者(n=4)和健康供体(n=4)肺组织切片me1免疫组织化学代表性图像和定量分析;c为ph患者(n=4)和健康供体(n=4)肺组织中me1酶活性,以上数据表示为中位数
±
四分位间距;统计方法为mann-whitney u检验;*p《0.05;n.s.:无显著差异;标尺=50μm;
20.图2为慢性低氧和su5416/低氧(suhx)诱导的ph小鼠模型的构建与评估,其中a为慢性低氧诱导的ph小鼠模型示意图;b为右心室收缩压(rvsp)随低氧刺激时间增加的变化;c为右心室肥厚指数百分比(rvhi%)随低氧刺激时间增加的变化;d为慢性低氧诱导小鼠ph过程中,小鼠肺组织切片α-sma(红色)免疫组织化学代表性图像,肺动脉中层厚度百分比的变化,包括肺动脉直径0-50μm和50-100μm,e为suhx诱导的ph小鼠模型构建示意图,f.rvsp随suhx刺激时间增加的变化,g.rvhi%随suhx刺激时间增加的变化,h.suhx诱导小鼠ph过程中,小鼠肺组织切片α-sma(红色)免疫组织化学代表性图像;肺动脉中层厚度百分比变化,包括肺动脉直径0-50μm和50-100μm,以上数据表示为平均值
±
标准误;每组n=8只小鼠;单因素方差分析;*p《0.05,**p《0.01,***p《0.001和****p《0.0001;n.s.:无显著差异;标尺=25μm;
21.图3为me1蛋白水平和酶活性在ph小鼠肺组织中增加,其中a为慢性低氧暴露下小鼠肺组织me1的代表性蛋白免疫印迹和相对定量分析;b为慢性低氧暴露下小鼠肺组织me1
酶活性;c为suhx暴露下小鼠肺组织me1的代表性蛋白免疫印迹和相对定量分析;d为suhx暴露下小鼠肺组织me1酶活性,以上数据表示为中位数
±
四分位间距;每组n=8只小鼠;统计方法为单因素方差分析;*p《0.05,**p《0.01,***p《0.001和****p《0.0001;n.s.:无显著差异;
22.图4为me1全身性敲除小鼠的全身性敲除策略,图中e表示外显子;
23.图5为me1全身性敲除小鼠构建成功,其中a为新生野生型(me1 / )和全身性敲除(me1-/-)小鼠基因型鉴定的典型图;b为me1 / 和me1-/-小鼠肺组织me1代表性蛋白免疫印迹;
24.图6为me1全身性敲除缓解慢性低氧或suhx诱导的小鼠ph,其中a为慢性低氧(hx)或suhx诱导的me1 / 和me1-/-小鼠ph的模式图;b为rvsp的变化;c为rvhi%的变化;d为肺动脉加速时间与射血时间比(paat/et)的代表性超声心动图及统计图;e为三尖瓣环收缩期位移(tapse)的代表性超声心动图及统计图;f为暴露于常氧(nor)、hx或suhx小鼠肺组织切片,α-sma免疫组织化学代表性图像;肺动脉中层厚度百分比变化,包括肺动脉直径0-50μm或50-100μm,所有数据均表示为平均值
±
标准误;常氧组n=8只小鼠,hx或suhx组n=12只小鼠;双因素方差分析;***p《0.001和****p《0.0001与常氧暴露的me1 / 小鼠比较;##p《0.01,###p《0.001和####p《0.0001与hx或suhx暴露的me1-/-小鼠比较;标尺=25μm;
25.图7为预防性给予me1*治疗suhx诱导的ph小鼠,其中a为评估me1*(剂量分别为1、10、100、200和500mg/kg)对常氧小鼠肺组织me1酶活性的抑制效率;b为me1*预防性治疗suhx诱导的ph小鼠示意图,数据表示为平均值
±
标准误;每组n=3只小鼠;单因素方差分析;**p《0.01;n.s.:无统计学意义;
26.图8为me1*预防性治疗suhx诱导的小鼠ph的疗效评估,其中a为me1*或vehicle预防性治疗常氧或suhx小鼠rvsp的变化;b为me1*或vehicle预防性治疗常氧或suhx小鼠rvhi%的变化;c为暴露于常氧或suhx后小鼠肺组织切片中α-sma(红色)的免疫组织化学代表性图像,肺动脉中层厚度百分比变化,肺动脉直径0-50μm或50-100μm;d为me1*或vehicle预防性治疗常氧或suhx小鼠paat/et的代表性超声心动图和统计;e为me1*或vehicle预防性治疗常氧或suhx小鼠tapse的代表性超声心动图和统计,所有数据均表示为平均值
±
标准误;常氧组n=6只小鼠,suhx组n=10只小鼠;双因素方差分析;**p《0.01,***p《0.001和****p《0.0001(与常氧暴露vehicle组相比);#p《0.05,##p《0.01,###p《0.001和####p《0.0001(与suhx暴露的me1*组相比);标尺=25μm;
27.图9为me1*预防性治疗suhx诱导的ph小鼠的安全性评价,其中a为me1*治疗后对小鼠体重影响的评估;b为小鼠肺、心脏、肝脏、脾脏、肾脏和小肠的代表性he染色图像,数据表示为平均值;常氧组n=6只小鼠,suhx组n=10只小鼠;单因素方差分析;标尺=50μm。
具体实施方式
28.本发明提供了苹果酸酶1(malic enzyme 1,me1)在制备检测和/或治疗肺动脉高压的标志物中的应用。本发明所述苹果酸酶1在肺动脉高压肺组织样本中高表达,蛋白水平和酶活性增加,可以将所述苹果酸酶1作为检测肺动脉高压的标志物以及治疗肺动脉高压的靶点。
29.本发明还提供了敲除或敲低编码苹果酸酶1的基因在制备防治肺动脉高压的药物
中的应用。本发明所述敲除优选为全身性敲除。本发明所述药物优选包括诊疗制剂。本发明通过敲除苹果酸酶1的编码基因me1可以使肺动脉高压患者或模型动物的肺循环阻力和右心室受累/右心衰竭的情况得到显著改善,进而达到防治肺动脉高压的目的。
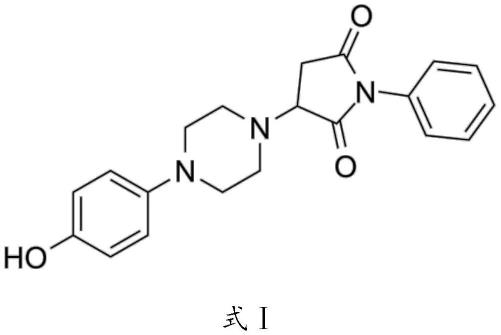
30.本发明还提供了苹果酸酶1抑制剂在制备防治肺动脉高压的药物中的应用。在本发明中,以下内容均属于本发明的保护范围:苹果酸酶1抑制剂在制备改善肺循环阻力和/或重塑肺血管的药物中的应用;苹果酸酶1抑制剂在制备降低右心室收缩压(rvsp)、降低右心室肥厚指数(rvhi)、升高paat/et、升高tapse和降低肺动脉中层厚度中一项或多项的药物中的应用。本发明所述苹果酸酶1抑制剂优选包括小分子抑制剂me1*,所述小分子抑制剂me1*的化学结构优选如式ⅰ所示,cas号为522649-59-8。本发明所述药物优选包括诊疗制剂。
[0031][0032]
本发明所述肺动脉高压优选包括由低氧和su5416/缺氧诱导(su5416联合低氧诱导)的肺动脉高压。本发明所述苹果酸酶1抑制剂可以有效降低右心室收缩压(rvsp)和右心室肥厚指数(rvhi)、升高paat/et和tapse,降低肺动脉中层厚度,进而改善肺循环阻力、改善右心室受累和/或右心衰竭,达到重塑肺血管和延缓肺动脉高压的技术效果,所述苹果酸酶1抑制剂可以用于制备治疗肺动脉高压药物。
[0033]
本发明还提供了一种防治肺动脉高压的药物,所述药物的活性成分包括苹果酸酶1抑制剂。本发明所述苹果酸酶1抑制剂优选包括小分子抑制剂me1*。本发明所述药物优选还包括药学上可接受的辅料。本发明对所述辅料没有特殊限定,采用本领域中常规辅料即可。本发明所述药物的使用方式优选为腹腔注射。
[0034]
为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0035]
实施例1
[0036]
me1高表达于ph患者和ph小鼠肺组织。
[0037]
1.1收集人肺组织样本
[0038]
实验组肺组织(n=4)来自于接受肺移植的晚期ph患者,对照组肺组织(n=4)来自于健康捐赠者因肺移植过程中肺大小不匹配而切除的部分。该研究获得了所有参与者的知情同意。使用的人肺组织已获得北京协和医学院伦理委员会(批准号:2018043)和阜外医院(批准号:2017-877)的批准。
[0039]
1.2收集暴露于单纯低氧0、1、2、3和4周的c57bl/6j小鼠肺组织
[0040]
将体重为25-30g的8-10周龄雄性spf级c57bl/6j小鼠饲养在低氧仓(仓内氧气浓
度维持在10%),连续饲养0周(n=8)、1周(n=8)、2周(n=8)、3周(n=8)和4周(n=8)后收集小鼠肺组织,并评估右心室收缩压(rvsp)、右心室肥厚指数(rvhi)以及分析肺血管中膜厚度。
[0041]
1.3收集暴露于suhx 0、1、2和3周的c57bl/6j小鼠肺组织
[0042]
将体重为25-30g的8-10周龄雄性spf级c57bl/6j小鼠饲养在低氧仓(仓内氧气浓度维持在10%),同时予以每周一次su541620mg/kg皮下注射,连续饲养0周(n=8)、1周(n=8)、2周(n=8)和3周(n=8)后收集小鼠肺组织,并评估右心室收缩压(rvsp)、右心室肥厚指数(rvhi)以及分析肺血管中膜厚度。
[0043]
1.4rvsp和rvhi的测定
[0044]
rvsp可用于评估小鼠肺动脉压力,rvhi可反映小鼠因肺循环阻力过大导致右心室受累、右心室肥厚情况。具体操作步骤如下:(1)2%戊巴比妥钠(经腹腔注射50mg/kg)麻醉小鼠后将其固定于手术板上。(2)打开power lab,连接好压力换能器。(3)用手术剪剪开小鼠胸前壁皮肤,清晰暴露胸骨柄位置。(4)将22号针头通过闭胸沿胸骨柄与左肋缘交点45
°
插入右心室(rv),并通过波形判断针尖在心腔内的位置,通过chart程序保存稳定的rvsp波形和记录rvsp测定值。(5)处死小鼠,获取心脏,去除心脏多余结缔组织和心耳,剪开右心室游离壁,分别称重右心室和左心室及室间隔(left ventricular septum,lv s),计算右心室肥厚指数=rv/lv s。
[0045]
1.5肺血管中膜厚度评估
[0046]
肺血管中膜厚度用于分析肺血管形态变化,本发明用肺血管平滑肌细胞表面标记,即α-平滑肌肌动蛋白(α-sma)一抗,通过免疫组织化学染色,然后计算肺血管中膜厚度百分比,从而评估肺动脉高压小鼠肺血管重塑情况。收集左肺组织,10%中性福尔马林室温固定至少24小时,全自动组织脱水机脱水后,在石蜡包埋冷热台一体机中进行石蜡包埋,肺组织石蜡切片厚度为4-5μm。切片脱蜡、抗原修复(柠檬酸缓冲液ph=6.0)后,在4℃下用抗α-sma一抗孵育过夜,然后用辣根过氧化物酶结合的二抗孵育。用苏木精复染细胞核后,自来水冲洗并用0.5%盐酸乙醇分化,自来水浸泡15min,进行常规脱水、透明、甘油明胶封片,拍照。统计分析:测量直径为0-50μm和50-100μm的肺血管厚度。每只小鼠评估直径0-50μm血管至少20根和直径50-100μm血管至少15根,肺血管中膜厚度百分比计算公式如下:(外周长/2п-内周长/2п)/(外周长/2п)
×
100。
[0047]
1.6苹果酸酶蛋白水平检测
[0048]
具体操作步骤如下:(1)加入含有ripa、磷酸酶抑制剂的组织裂解液后,充分剪碎肺组织,彻底匀浆至看不见组织,冰上裂解30分钟,然后4℃下13,000rpm离心15分钟,取上清则为总蛋白;(2)bca法测定蛋白浓度;(3)煮蛋白:100℃金属浴5分钟;(4)制胶、电泳(每孔上样蛋白为20μg)和转膜;(5)转膜完成后,5%专用脱脂牛奶室温封闭1小时,然后用1
×
tbst短暂清洗;(6)一抗4℃过夜孵育后,然后回收一抗,1
×
tbst洗3次,每次5-10分钟。(7)室温孵育二抗1小时,然后回收二抗,1
×
tbst洗3次,每次5-10分钟;(8)使用tanon自动化学发光/荧光图像分析系统收集蛋白信号,通过image-pro plus软件分析wb条带灰度值,以计算目标蛋白的相对水平。
[0049]
1.7苹果酸酶活性检测
[0050]
组织蛋白上清或线粒体提取物用于检测me1酶活性,具体操作步骤如下:(1)配液:
cellular epigenetic state by inhibiting hdac3-ncor complex[j].nature metabolism,2021.制备获得;
[0061]
me1-/-小鼠基因型鉴定步骤如下:
[0062]
(1)小鼠剪趾或剪尾;
[0063]
(2)加入50μl genotyping i液(碱性,naoh),95℃金属浴1小时;
[0064]
(3)加入50μl genotyping ii液(酸性,tris-hcl)终止反应,然后涡旋30-60秒,5000转每分,10分钟后4℃离心;
[0065]
(4)配置聚合酶链反应(pcr)体系,所使用基因型鉴定引物序列如表1:
[0066]
表1基因型鉴定的引物序列
[0067][0068]
(5)配dna胶:用1
×
tae液溶解琼脂糖,琼脂糖终浓度1.5%,微波炉p100加热约3-4分钟进行溶解,晾至不烫手后加入gelstain染料(10000
×
),轻轻摇匀后导入胶板中,静置等待dna胶凝固;
[0069]
(6)上样:上样孔在负极(黑色),加入1
×
tae液,至刚好没过dna胶,加入样品和marker(100bp dnaladder)10μl;
[0070]
电泳:由负极(黑色)向正极(红色),120v,30分钟。
[0071]
2.2suhx诱导的ph小鼠模型构建
[0072]
将体重为25-30g的8-10周龄雄性spf级me1 / 和me1-/-随机分为suhx模型组,小鼠饲养在低氧仓(仓内氧气浓度维持在10%),同时予以每周一次su541620mg/kg皮下注射,连续饲养3周后收集肺组织,并评估rvsp、rvhi以及肺血管中膜厚度。具体分组情况如下:
①
suhx me1 / 组:n=12只小鼠;
②
suhx me1-/-组:n=12只小鼠。
[0073]
2.3小鼠rvsp、rvhi测定以及肺血管中膜厚度评估方法同实施例1。
[0074]
2.4小鼠超声心动图检测
[0075]
使用vevo 2100超声成像平台进行超声心动图检查,以评估肺动脉高压小鼠的右心血流动力学变化。具体操作步骤如下:(1)对小鼠进行脱毛处理,充分暴露胸前壁皮肤。(2)将小鼠置于37℃恒温加热板,以3.0%异氟烷经鼻、经口吸入麻醉小鼠麻醉好后以1.5%异氟烷持续吸入。(3)将小鼠四肢涂抹少量耦合剂并固定四肢后,连续记录小鼠体温、心率、呼吸率和心电图动态变化,确保小鼠呈静息状态。(4)安置超声探头,加适量耦合剂后进行操作,在短轴位置进行肺动脉射血加速时间(paat)、肺动脉射血时间(paet)、速度时间积分等指标测量,然后保存频谱和加彩超声。(5)调整至四腔心位置,沿着游离右室壁找到三尖瓣环位置,测量三尖瓣环收缩期位移(tapse)。(6)测量相应指标,进行统计分析。
[0076]
2.5结果分析
[0077]
me1全身性敲除小鼠构建成功如图4和图5所示:其中图4为me1全身性基因敲除策略,图4中的e表示外显子,如e4代表第4个外显子;图5中的a图为新生野生型(me1 / )和全
身性基因敲除(me1-/-)小鼠基因型鉴定的典型图,若3f3r有两条带而5f3r有一条带,说明为野生型(me1 / )小鼠;若3f3r无条带而5f3r有一条带,说明是全身性基因敲除(me1-/-)小鼠;b图为me1 / 和me1-/-小鼠肺组织me1代表性蛋白免疫印迹;由a图和b图可证明本技术中的全身性基因敲除(me1-/-)小鼠构建成功,me1被成功敲除了。
[0078]
将me1 / 和me1-/-小鼠暴露于慢性低氧或suhx构建ph小鼠模型如图6中a图:发现与野生型小鼠相比,暴露于慢性低氧或suhx的me1-/-小鼠表现出rvsp和rvhi的明显降低如图6中b图和c图,提示在敲除me1基因的情况下,ph小鼠的肺循环阻力和右心室受累/右心衰竭的情况得到了显著改善。
[0079]
同样的,小鼠超声心动图结果提示,在慢性低氧或suhx诱导ph后,me1-/-小鼠paat/et和tapse均明显高于me1 / 小鼠如图6中d图和e图,表明在敲除me1基因的情况下,ph小鼠肺血管阻力和右心收缩功能明显改善。
[0080]
同时,在慢性低氧或suhx暴露的me1-/-小鼠肺动脉中膜厚度百分比明显降低,表明抑制me1改善了ph小鼠的肺血管重塑和ph小鼠疾病进展,如图6中f。实施例2中的以上结果表明me1参与了ph疾病的发生发展,me1可作为ph的潜在治疗靶点。
[0081]
实施例3
[0082]
me1酶活性抑制剂(me1*)治疗suhx诱导的ph小鼠的疗效评估及安全性评价
[0083]
3.1me1*体内治疗的剂量探索
[0084]
本发明利用常氧小鼠,予以小鼠腹腔注射me1*,单次注射剂量分别为1、10、100、200和500mg/kg,以探索me1*对小鼠肺组织中me1酶活性的抑制效果。
[0085]
3.2me1*预防性治疗suhx诱导的ph小鼠
[0086]
我们将体重为25-30g的8-10周龄雄性spf级c57bl/6j小鼠随机分为如下4组:
[0087]
(1)常氧 vehicle对照组:6只小鼠,常氧环境饲养3周;从第2周起每天腹腔注射一次vehicle(100mg/kg),共注射14次。
[0088]
(2)常氧 me1*治疗组:6只小鼠,常氧环境饲养3周;从第2周起每天腹腔注射一次me1*(100mg/kg),共注射14次。
[0089]
(3)suhx建模 vehicle对照组:10只小鼠,suhx处理3周(suhx建模方法同前所述);从第2周起每天腹腔注射一次vehicle(100mg/kg),共注射14次。
[0090]
(4)suhx建模 me1*治疗组:10只小鼠,suhx处理3周;从第2周起每天腹腔注射一次me1*(100mg/kg),共注射14次。
[0091]
3.3小鼠rvsp、rvhi、超声心动图测定以及肺血管中膜厚度评估方法实施例1。
[0092]
3.4结果分析
[0093]
在me1*体内治疗的剂量探索实验中,本发明中数据显示,当me1*剂量大于或等于100mg/kg时,小鼠肺组织中me1酶活性被明显抑制,如图7中的a图;
[0094]
同时,考虑suhx刺激1周后,本发明才观察到小鼠肺组织中me1蛋白水平和酶活性逐渐升高如图3中c图和d图;因此,本发明选择从第2周开始每天腹腔注射1次100mg/kg的me1*或vehicle,预防性治疗suhx诱导的ph小鼠,如图7中b图;
[0095]
与vehicle治疗相比,经me1*治疗后的小鼠ph疾病进展明显减缓,表现为改善的rvsp、rvhi%、paat/et、tapse以及肺血管中膜厚度百分比,提示ph小鼠的肺血管阻力、右心功能和肺血管重塑得到明显缓解,如图8,其中,a图为me1*或vehicle预防性治疗常氧或
suhx小鼠rvsp的变化,b图为me1*或vehicle预防性治疗常氧或suhx小鼠rvhi%的变化,经me1*治疗后的小鼠的rvsp和rvhi(%)较vehicle治疗明显降低;c图为暴露于常氧或suhx后小鼠肺组织切片中α-sma(红色)的免疫组织化学代表性图像,肺动脉中层厚度百分比变化,肺动脉直径0-50μm或50-100μm,经me1*治疗后的小鼠的肺动脉中层厚度较vehicle治疗显著降低;d图me1*或vehicle预防性治疗常氧或suhx小鼠paat/et的代表性超声心动图和统计,经me1*治疗后的小鼠的pa at/et较vehicle治疗显著升高;e图为me1*或vehicle预防性治疗常氧或suhx小鼠tapse的代表性超声心动图和统计,经me1*治疗后的小鼠的tapse较vehicle治疗显著升高;所有数据均表示为平均值
±
标准误;常氧组n=6只小鼠,suhx组n=10只小鼠;双因素方差分析;**p《0.01,***p《0.001和****p《0.0001(与常氧暴露vehicle组相比);#p《0.05,##p《0.01,###p《0.001和####p《0.0001(与suhx暴露的me1*组相比);标尺=25μm。
[0096]
通过每周对小鼠进行称重,发现相比vehicle组小鼠,经me1*治疗后的小鼠体重并未观察到明显减轻,如图9中a图。同时治疗结束后,本发明还收集了小鼠多个组织器官包括肺、心脏、肝脏、脾脏、肾脏和小肠,进行he染色未见明显的组织器官损伤,如图9中b图,其中a图为me1*治疗后对小鼠体重影响的评估,b图为小鼠肺、心脏、肝脏、脾脏、肾脏和小肠的代表性he染色图像,数据表示为平均值;常氧组n=6只小鼠,suhx组n=10只小鼠;单因素方差分析;标尺=50μm。
[0097]
由以上实施例可知,me1*可安全、有效延缓suhx诱导的小鼠肺动脉高压和肺血管重塑,提示me1*可用于制备ph的治疗药物。
[0098]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。