1.本技术涉及一种用于冷冻包括神经细胞的细胞聚集体的方法。
背景技术:
2.近年来,以细胞作为活性成分的药物的开发已经得以推广;例如,从多能干细胞(psc)诱导产生多巴胺的神经元或其祖细胞并将其移植到患者的中脑中的细胞疗法被认为是一种很有前景的帕金森病治疗方法(非专利文献1至3)。对于基于细胞的药物,最终产品的冷冻保存是普及细胞疗法的必要要素(专利文献1至4)。与细胞生物学研究不同,冷冻保存的细胞在用于临床实践时,在解冻后不经恢复培养即可立即移植。因此,对于冷冻细胞重要的是在解冻后保持其植入能力、功能或活性以及细胞活力。
3.已经表明,实体组织的移植由于残留的供体血管和抗原呈递细胞而诱导比细胞悬液的移植诱导的更强的免疫应答(非专利文献4)。另一方面,如果通过同基因移植或免疫抑制剂来抑制免疫应答,就会消除这一问题,并且中脑腹侧(vm)组织的移植显示出比细胞悬液移植具有更高的存活率和行为恢复的产生多巴胺的神经(非专利文献5)。另外,获得细胞悬液的机械和酶解离过程可能改变细胞特性从而引起细胞损伤。因此,在临床应用中,希望将最终产品配制成球体而不是细胞悬液。然而,球体比单个细胞更难冷冻保存。
4.作为用于冷冻细胞的方法,已知缓冷法和玻璃化法(非专利文献6至8)。缓冷法是一种将细胞与低浓度的冷冻保护剂(cpa)(诸如10%二甲基亚砜(dmso))一起以约1℃/min冷冻的方法(专利文献5、非专利文献9和10)。在缓冷法中,冰的形成首先在细胞外间隙中开始,从而导致细胞外液浓缩。结果,由于跨细胞膜的渗透梯度,水被从细胞中抽出。细胞的这种脱水避免了细胞内冰的形成。然而,如果细胞过度脱水,它们会被浓缩的细胞内液和冷冻保存溶液中的cpa损伤。另一方面,玻璃化法是一种超快冷却方法,其中在添加高浓度的冷冻保护剂(例如,dmso、乙酰胺或乙二醇)后立即将细胞转移到液氮中并且立刻在非晶态下冷冻(专利文献6、非专利文献11)。换句话说,它是一种通过使细胞内外的溶剂在玻璃态下凝固来最大限度地减少冰晶生长的方法。玻璃化法需要严格的时间控制;与分散在溶剂中的单个细胞的情况不同,在细胞聚集体的情况下,冷冻保存溶液渗透到细胞聚集体中需要时间,因此可能无法充分获得对冷冻保存溶液的玻璃化效果。因此,将其应用于临床细胞生产在技术上是困难的(非专利文献12)。如上所述,由于需要精确控制冰形成和细胞脱水,因此尚未建立球体的临床冷冻保存方法。另外,虽然非专利文献13披露,通过使用可以在-190℃下储存的气相液氮储存容器将培养的细胞冷冻在气相中,可以防止支原体污染,但将细胞聚集体冷冻在液氮的气相中是完全未知的。引用列表专利文献
5.[专利文献1]jp2017-104061a[专利文献2]wo 2017/159862[专利文献3]jp2015-521469a[专利文献4]jp2008-501320a[专利文献5]jp2011-103885a[专利文献6]jp2013-110988a非专利文献
[0006]
[非专利文献1]doi等人,stem cell reports,2(3),337-350,2014[非专利文献2]sundberg等人,stem cells 31,1548-1562,2013[非专利文献3]nolbrant等人,nature protocols,12(9),1962-1979,2017[非专利文献4]redmond等人,neurobiology of disease,29(1),103-116,2008[非专利文献5]fricker等人,plos one,7(10),e47169,2012[非专利文献6]chong等人,stem cells,27(1),29-39,2009[非专利文献7]smith等人,fertility和sterility,94(6),2088-2095,2010[非专利文献8]jang等人,integrative medicine research,6(1),12-18,2017[非专利文献9]schwartz等人,journal of neuroscience research,74(6),838-851,2003[非专利文献10]woods等人,cryobiology,59(2),150-157,2009[非专利文献11]fahy和wowk.,methods in molecular biology(methods and protocols),1257卷.springer,纽约州纽约,2015[非专利文献12]nagano等人,biomedical research,28(3),153-160,2007[非专利文献13]tiss cult res commun 26:165-170(2007)
技术实现要素:
技术问题
[0007]
本技术的一个目的是提供一种用于冷冻包括神经细胞的细胞聚集体的方法。问题的解决方案
[0008]
作为深入研究的结果,本发明人发现了一种用于冷冻包括神经细胞的细胞聚集体的方法并且完成了本发明。更具体地,本发明涉及以下内容:[1]一种用于冷冻包括神经细胞并且具有三维结构的细胞聚集体的方法,所述方法包括以下步骤(1)和(2):(1)在冷冻前将包括神经细胞的所述细胞聚集体浸泡在0℃至30℃的冷冻保存溶液中以制备冷冻保存溶液浸泡的细胞聚集体;以及(2)将所述冷冻保存溶液浸泡的细胞聚集体冷冻在温度为-150℃或更低的液氮容器的气相中。[2]根据[1]所述的方法,其中在步骤(1)中将所述细胞聚集体在所述冷冻保存溶液中浸泡15分钟至360分钟。[3]根据[1]或[2]所述的方法,其中所述液氮容器中所含的所述细胞聚集体和所述冷冻保存溶液的体积与所述液氮容器的气相体积的比例为5%或更小。
[4]根据[1]至[3]中任一项所述的方法,其中所述细胞聚集体相对于所述保存溶液的填充密度为50至500个细胞聚集体/ml。[5]根据[4]所述的方法,其中含有所述细胞聚集体和所述冷冻保存溶液的所述容器的大小为0.5至5ml。[6]根据[1]至[5]中任一项所述的方法,其中包括神经细胞的所述细胞聚集体是包括源自多能干细胞的神经细胞的细胞聚集体。[7]根据[1]至[6]中任一项所述的方法,其中包括神经细胞的所述细胞聚集体包括对foxa2、th和nurr1中的至少一种呈阳性的细胞。[8]根据[7]所述的方法,其中包括神经细胞的所述细胞聚集体包括对foxa2和lmx1a呈阳性的细胞。[9]根据[7]所述的方法,其中包括神经细胞的所述细胞聚集体包括对foxa2、th和nurr1呈阳性的细胞。[10]根据[1]至[9]中任一项所述的方法,其中所述神经细胞是产生多巴胺的神经元或其祖细胞。[11]根据[1]至[10]中任一项所述的方法,其中所述细胞聚集体包含60%或更多的产生多巴胺的神经元祖细胞。[12]根据[1]至[11]中任一项所述的方法,其中包括神经细胞的所述细胞聚集体是具有150μm至1000μm的当量球径的细胞聚集体。[13]根据[12]所述的方法,其中所述细胞聚集体包括500至150000个细胞。[14]根据[1]至[13]中任一项所述的方法,其中所述冷冻保存溶液中所含的细胞的数量为80000至5000000个细胞/ml。[15]一种用于长期保存包括神经细胞的细胞聚集体的方法,其中所述方法包括将含有通过根据[1]至[14]中任一项所述的方法获得的细胞聚集体的容器储存在所述液氮容器的气相或液相中。[16]一种移植用组合物,其中所述组合物包含通过根据[1]至[14]中任一项所述的方法获得的细胞聚集体作为活性成分。[17]根据[16]所述的移植用组合物,其中所述组合物包含:包含60%或更多的产生多巴胺的神经元祖细胞并且具有150μm至1000μm的当量球径的细胞聚集体;以及冷冻保存溶液,并且其中所述组合物可以在解冻后不经恢复培养的情况下使用。[18]根据[16]或[17]所述的移植用组合物,其中所述组合物中的细胞数量为80000至5000000个细胞/ml。[19]根据[16]至[18]中任一项所述的移植用组合物,其中所述组合物包含10至500个细胞聚集体/ml。[20]根据[16]至[19]中任一项所述的移植用组合物,其中将所述细胞聚集体和所述冷冻保存溶液填充在0.5ml至15ml的容器中。[21]一种用于产生包含产生多巴胺的神经元祖细胞作为活性成分的移植用组合物的方法,所述方法包括:通过根据[1]至[14]中任一项所述的方法冷冻细胞聚集体,其中所述组合物中的细胞数量为80000至5000000个细胞/ml,并且所述细胞聚集体包含60%或更多的所述产生
多巴胺的神经元祖细胞并且具有150μm至1000μm的当量球径。[22]根据[21]所述的用于产生移植用组合物的方法,其中将所述细胞聚集体和所述冷冻保存溶液填充在0.5ml至15ml的容器中。[23]一种用于治疗需要多巴胺神经的再生的疾病的方法,所述方法包括以下步骤:(1)在30℃至40℃下解冻根据[16]至[20]中任一项所述的移植用组合物;以及(2)将在(1)中获得的所述移植用组合物移植到患者的纹状体区域中。[24]根据[23]所述的方法,其中在(1)中在所述解冻后不进行培养的情况下将所述冷冻保存溶液更换为给药媒介物以执行步骤(2)。发明效果
[0009]
本技术提供了一种用于冷冻包括神经细胞的细胞聚集体的方法。通过本技术的方法冷冻的神经细胞的细胞聚集体展现出高细胞活力并保持功能特性,诸如神经突延伸特性。此外,当使用本发明时,可以在不将冷冻细胞聚集体转移到保存装置的情况下对其进行保存。因此,可以避免由于转移到保存装置而引起的暂时温度升高,从而不会对细胞聚集体造成不希望的损坏。即使在低于液氮的气相的温度下进行保存的情况下,也可以直接将细胞聚集体浸泡在液氮中而无需将其从容器中取出,从而减少了步骤数并且提高了用于工业生产方法的和易性。
附图说明
[0010]
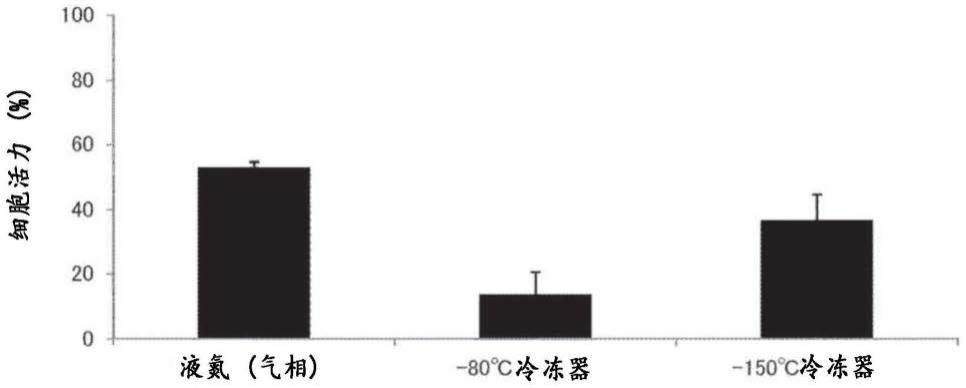
[图1]将在液氮冷冻保存容器(气相保存类型)、-80℃深度冷冻器或-150℃深度冷冻器中冷冻的细胞聚集体解冻时的细胞活力。
[0011]
[图2]冷冻前在冷冻保存溶液中的预浸泡时间对冷冻和解冻后细胞聚集体的细胞活力的影响。
[0012]
[图3]冷冻前在冷冻保存溶液中的预浸泡时间对冷冻和解冻后细胞聚集体的神经突延伸能力的影响。
[0013]
[图4]液氮容器的气相的体积对冷冻和解冻后细胞聚集体的细胞活力的影响。
[0014]
[图5]液氮容器的气相的体积对冷冻和解冻后细胞聚集体的神经突延伸能力的影响。
[0015]
[图6]样品容器中填充的细胞聚集体的数量对冷冻和解冻后细胞聚集体的细胞活力的影响。
[0016]
[图7]样品容器中填充的细胞聚集体的数量对冷冻和解冻后细胞聚集体的神经突延伸能力的影响。
[0017]
[图8]填充溶液的体积对冷冻和解冻后细胞聚集体的细胞活力的影响。
[0018]
[图9]填充溶液的体积对冷冻和解冻后细胞聚集体的神经突延伸能力的影响。
[0019]
[图10]细胞聚集体的当量球径对冷冻和解冻后细胞聚集体的细胞活力的影响。
[0020]
[图11]细胞聚集体的当量球径对冷冻和解冻后细胞聚集体的神经突延伸能力的影响。
[0021]
[图12]在液氮的气相或液相中冷冻的细胞聚集体的解冻后细胞活力。
具体实施方式
[0022]
在本说明书和权利要求书中,当数值伴随术语“约”时,其旨在包括所述值的
±
10%的范围。例如,“约20”应包括“18至22”。数值范围包括两个端点之间的所有数值以及两个端点处的数值。用于范围的术语“约”适用于所述范围的两个端点。因此,例如,“约20至30”应包括“18至33”。
[0023]
[神经细胞]本技术提供了一种用于冷冻包括神经细胞并且具有三维结构的细胞聚集体的方法。
[0024]
神经细胞包括神经元细胞或神经元、神经元的祖细胞,即神经祖细胞或神经前体细胞。神经细胞可以是源自任何部位的神经细胞,诸如中枢神经系统的神经细胞或周围神经系统的神经细胞,诸如运动神经或感觉系统的体神经细胞或自主神经的神经细胞;神经细胞的例子包括神经(神经元)、源自神经嵴的细胞、神经胶质细胞诸如少突胶质细胞或星形胶质细胞,以及其干细胞或祖细胞。神经细胞的例子包括表达神经细胞标志物的细胞。神经细胞标志物的例子包括但不限于ncam、βiii-微管蛋白(tuj1)、酪氨酸羟化酶(th)、5-羟色胺、神经上皮干细胞蛋白、map2、map2ab、neun、gaba、谷氨酸盐、chat、sox1、bf1、emx1、vglut1、pax、nkx、gsh、端脑素(telencephalin)、glur1、camkii、ctip2、tbr1、络丝蛋白(reelin)、tbr1、brn2、otx2、lmx1a、lmx1b、en1、nurr1、pitx3、dat、girk2和th。神经细胞可以通过一种或多种神经细胞标志物的表达来识别。在本说明书中,神经细胞的例子包括表达上述神经细胞标志物中的一种或多种、两种或更多种或者三种或更多种的细胞。
[0025]
中枢神经系统的神经细胞可以根据神经细胞神经系统存在的部位的差异进行分类。即,中枢神经系统的神经细胞的例子包括源自前脑、端脑、间脑、大脑、下丘脑、中脑、后脑、中脑-后脑边界区域、小脑、视网膜、脑垂体或脊髓的神经元及其祖细胞。
[0026]
源自前脑的神经元是存在于前脑组织(即端脑、大脑、海马或脉络丛、间脑、下丘脑等)中的神经元。前脑的神经元可以通过前脑神经元标志物的表达来识别。前脑神经元标志物的例子包括otx1(前脑)、bf1(也称为foxg1)或six3(也用作端脑或大脑的标志物)。在本说明书中,神经细胞的例子包括表达上述前脑神经细胞标志物或者端脑或大脑的标志物中的一种或多种、两种或更多种或者三种或更多种的细胞。
[0027]
源自大脑的神经元的例子包括背细胞(例如,大脑皮层细胞、cajal-retzius细胞、海马神经元)和腹细胞(例如,基底神经节)。大脑腹侧神经元标志物的例子包括基底神经节神经元标志物(例如,gsh2、mash1、nkx2.1、noz1)。大脑背侧神经元标志物的例子包括大脑皮层神经元标志物(例如,pax6、emx1、tbr1)。在本说明书中,神经细胞的例子包括表达上述大脑神经元标志物、基底神经节神经元标志物或大脑皮层神经元标志物中的一种或多种、两种或更多种或者三种或更多种的细胞。
[0028]
源自中脑的神经细胞的例子包括源自中脑腹侧的神经祖细胞、产生多巴胺的神经元(也称为多巴胺能神经元)和产生多巴胺的神经元祖细胞(也称为多巴胺能神经元祖细胞或多巴胺能祖细胞)。源自中脑的神经细胞标志物的例子包括foxa2、en2和tuj1。foxa2阳性和tuj1阳性神经细胞的例子包括产生多巴胺的神经元祖细胞和产生多巴胺的神经元。产生多巴胺的神经元可以通过呈foxa2阳性、nurr1阳性和th阳性来识别。
[0029]
产生多巴胺的神经元祖细胞可以通过呈foxa2阳性和lmx1a阳性来识别。产生多巴胺的神经元祖细胞更优选地含有对otx2、lmx1a、lmx1b、corin、shh、aadc、βiii-微管蛋白、en1、nurr1、pitx3、dat、girk2和th中的一种或多种呈阳性的细胞。在本说明书中,除非另有规定,否则包括产生多巴胺的神经元祖细胞的细胞聚集体可包括产生多巴胺的神经元或多巴胺能神经元。
[0030]
在本说明书中,所述神经细胞的例子包括表达源自中脑的神经细胞标志物、产生多巴胺的神经元祖细胞标志物或产生多巴胺的神经元标志物中的一种或多种、两种或更多种或者三种或更多种的细胞。
[0031]
在本说明书中,产生多巴胺的神经元祖细胞的例子包括表达foxa2和/或lmx1a(foxa2阳性和/或lmx1a阳性)的细胞,优选地除了foxa2和lmxa1之外还表达选自otx2、lmx1b、en1、corin、shh、aadc和βiii-微管蛋白的一种或多种、两种或更多种或者三种或更多种的细胞。
[0032]
在本说明书中,产生多巴胺的神经元(多巴胺能神经元)的例子包括表达th和/或nurr1(th阳性和/或nurr1阳性)的细胞,优选地除了th和nurr1之外还表达选自foxa2、aadc、dat和girk2的一种或多种、两种或更多种或者三种或更多种的细胞。
[0033]
源自中脑-后脑边界区域的神经元的例子包括存在于小脑、小脑板组织、室管膜层、菱唇等中的神经元。中脑-后脑边界区域标志物的例子包括en2(中脑)、gbx2(后脑)、n-钙粘蛋白(中脑-后脑边界区域中的神经祖细胞)。小脑神经祖细胞标志物的例子包括作为gaba能祖细胞标志物的kirrel2、ptf1a和sox2,以及作为小脑颗粒细胞祖细胞标志物的atoh1和barhl1。在本说明书中,神经细胞的例子包括表达上述中脑-后脑边界区域标志物、小脑神经祖细胞标志物、gaba能祖细胞标志物或小脑颗粒细胞祖细胞标志物中的一种或多种、两种或更多种或者三种或更多种的细胞。源自视网膜的神经细胞的例子包括感光细胞、感光祖细胞、视网膜色素上皮细胞和角膜细胞。
[0034]
神经细胞也可以根据产生(分泌)的神经递质的差异进行分类;其例子包括产生多巴胺的神经元、产生多巴胺的神经元祖细胞、gaba能神经元、gaba能祖细胞、胆碱能神经元、胆碱能祖细胞、羟色胺能神经元、羟色胺能祖细胞、谷氨酸能神经元、谷氨酸能祖细胞、去甲肾上腺素能神经元、去甲肾上腺素能祖细胞、肾上腺素能神经元和肾上腺素能祖细胞。
[0035]
运动神经或感觉系统的神经细胞的例子包括胆碱能神经元及其祖细胞。自主神经的神经细胞的例子包括胆碱能神经元、肾上腺素能神经元及其祖细胞。
[0036]
本说明书中的神经细胞的优选例子包括产生多巴胺的神经元(多巴胺能神经元)和产生多巴胺的神经元祖细胞(多巴胺能神经元祖细胞)。
[0037]
源自活体的神经细胞是从哺乳动物诸如人中分离的细胞,并且从人脑组织中分离的细胞的例子包括如nature neuroscience,2,1137(1999)或n.engl.j.med.;344:710-9(2001)中所述的胎儿中脑组织中包含的细胞。
[0038]
神经细胞也可以是通过诱导从多能干细胞诸如胚胎干细胞(es细胞)和ips细胞分化而获得的细胞。用于诱导从多能干细胞分化为神经细胞的方法的例子包括以下文献中所述的方法:非专利文献3和4以及wo 2015/034012(多巴胺能神经元祖细胞);wo 2009/148170(大脑神经细胞等);wo 2013/065763、wo 2016/013669或wo 2017/126551(垂体或丘
脑下神经细胞);wo 2016/039317(小脑神经细胞);wo 2015/076388(端脑神经细胞);numasawa-kuroiwa,y等人,stem cell reports,2:648-661(2014)(神经祖细胞);qiu,l等人,stem cells transl med.6(9):1803-1814(2017)(产生多巴胺的神经元祖细胞)。
[0039]
神经细胞可以是通过诱导从多潜能干细胞诸如间充质干细胞(msc)分化而获得的细胞。用于诱导从间充质干细胞分化成神经细胞的方法的例子包括j chem neuroanat.96:126-133(2019)中所述的方法。
[0040]
[多能干细胞]多能干细胞是指既具有能够分化成存在于活体中的几乎所有细胞的多能性又具有增殖能力的干细胞。多能干细胞可以源自受精卵、克隆胚胎、生殖干细胞、间质干细胞或体细胞。多能干细胞的例子包括但不特别限于胚胎干(es)细胞、源自克隆胚胎的核移植胚胎干(ntes)细胞、精原干细胞(gs细胞)、胚胎生殖细胞(eg细胞)、诱导多能干(ips)细胞、源自培养的成纤维细胞和骨髓干细胞的多能干细胞(muse细胞)。多能干细胞可以是es细胞、ntes细胞或ips细胞。鉴于伦理考虑,多能干细胞可以是ips细胞。注意,胚胎干细胞是在受精14天内从胚胎建立的。
[0041]
胚胎干细胞在1981年首次建立,并且自1989年以来已经应用于敲除小鼠的产生。人胚胎干细胞在1998年建立,并且正被用于再生医学。胚胎干细胞可以通过在饲养细胞上或在含有白血病抑制因子(lif)的培养基中培养内细胞团来产生。用于产生胚胎干细胞的方法描述于例如wo 96/22362、wo 02/101057、us 5,843,780、us 6,200,806、us6,280,718等中。胚胎干细胞可以从给定机构获得或商业购买。例如,人胚胎干细胞khes-1、khes-2和khes-3可从京都大学前沿生命医学科学研究所获得。人胚胎干细胞系rx::gfp(源自khes-1系)可从物理和化学研究所获得。小鼠胚胎干细胞系eb5和d3分别可从物理和化学研究所和atcc获得。
[0042]
核移植胚胎干细胞(ntes细胞)作为一类胚胎干细胞可以从克隆胚胎建立,所述克隆胚胎通过将体细胞的细胞核转移到已去除细胞核的卵细胞中而产生。
[0043]
eg细胞可以通过在含有mscf、lif和bfgf的培养基中培养原始生殖细胞来产生(cell,70:841-847,1992)。
[0044]
如本文所用的术语“诱导多能干细胞”是指通过将体细胞重编程以具有使用已知方法诱导的多能性而获得的细胞。其具体例子包括通过表达选自包括oct3/4、sox2、klf4、myc(c-myc、n-myc、l-myc)、glis1、nanog、sall4、lin28、esrrb的重编程基因组的多个基因的任何组合来对分化的体细胞诸如成纤维细胞或外周血单个核细胞重编程以诱导多能性而获得的细胞。重编程因子的组合的优选例子包括(1)oct3/4、sox2、klf4和myc(c-myc或l-myc),(2)oct3/4、sox2、klf4、lin28和l-myc(stem cells,2013;31:458至466),以及(3)oct3/4、sox2、nanog和lin28(science 2007;318:1917至1920)。
[0045]
yamanaka等人在2006年用小鼠细胞建立了诱导多能干细胞(cell,2006,126(4),第663至676页)。还在2007年用人成纤维细胞建立了诱导多能干细胞,并且所述诱导多能干细胞具有与胚胎干细胞相似的多能性和复制能力(cell,2007,131(5),第861至872页;science,2007,318(5858),第1917至1920页;nat.biotechnol.,2008,26(1),第101至106页)。
[0046]
除了通过直接经由基因表达重编程来产生诱导多能干细胞的方法之外,还可以通
过经由添加化合物等从体细胞衍生诱导多能干细胞的方法来产生诱导多能干细胞(science,2013,341,第651至654页)。
[0047]
也可以获得建立的诱导多能干细胞系;例如,在京都大学建立的人诱导多能干细胞系诸如201b7细胞、201b7-ff细胞、253g1细胞、253g4细胞、1201c1细胞、1205d1细胞、1210b2细胞、1231a3细胞等可从京都大学获得。例如,在京都大学建立的ff-i01细胞、ff-i01s04细胞、qhj-i01和ff-i14细胞可作为建立的诱导多能干细胞系从京都大学获得。
[0048]
用于诱导多能干细胞的产生的体细胞的例子包括但不特别限于源自组织的成纤维细胞、红系细胞(例如,外周血单个核细胞(pbmc)、t细胞)、肝细胞、胰腺细胞、肠细胞和平滑肌肌细胞。
[0049]
对于在诱导多能干细胞的产生中通过几种基因的表达进行重编程,用于表达基因的手段没有特别限制。上述手段的例子包括用病毒载体(例如,逆转录病毒载体、慢病毒载体、仙台病毒载体、腺病毒载体或腺相关病毒载体)进行感染、使用质粒载体(例如,质粒载体或附加型载体)进行基因转移(例如,磷酸钙转染、脂质体转染、retronectin方法或电穿孔)、使用rna载体进行基因转移(例如,磷酸钙转染、脂质体转染或电穿孔)以及蛋白质的直接注射(例如,基于针的方法、脂质体转染或电穿孔)。
[0050]
诱导多能干细胞可以在存在饲养细胞的情况下或不存在饲养细胞(无饲养层)的情况下产生。在存在饲养细胞的情况下产生诱导多能干细胞时,可以通过已知方法在存在未分化状态维持因子的情况下产生诱导多能干细胞。用于在不存在饲养细胞的情况下产生诱导多能干细胞的培养基没有特别限制,并且可以是用于胚胎干细胞和/或诱导多能干细胞的任何已知维持培养基,或者用于以无饲养层方式建立诱导多能干细胞的任何培养基。用于以无饲养层方式建立诱导多能干细胞的培养基的例子包括无饲养层培养基,诸如essential 8培养基(e8培养基)、essential 6培养基、tesr培养基、mtesr培养基、mtesr-e8培养基、stabilized essential 8培养基和stemfit培养基。在诱导多能干细胞的产生中,例如,可以使用仙台病毒载体以无饲养层方式将四种因子oct3/4、sox2、klf4和myc(l-myc或c-myc)转移到体细胞中来制备诱导多能干细胞。
[0051]
在本发明中使用的多能干细胞是哺乳动物多能干细胞,优选啮齿动物(例如,小鼠或大鼠)或灵长类动物(例如,人或猴)多能干细胞,更优选人或小鼠多能干细胞,甚至更优选人诱导多能干细胞(ips细胞)或人胚胎干细胞(es细胞)。
[0052]
[细胞聚集体]本文的“具有三维结构”的细胞聚集体是指这样的细胞聚集体(细胞聚集体或球体),其是通过例如悬浮培养或3d培养使培养的细胞相互粘附而形成的三维细胞群。神经细胞的细胞聚集体也称为神经球。细胞聚集体的形状没有特别限制并且可以是球形或非球形。本说明书中的细胞聚集体优选地是具有类似于球体的三维形状的细胞聚集体。类似于球体的三维形状是具有三维结构的形状,并且当投影到二维平面上时显示例如圆形或椭圆形。
[0053]
包括神经细胞并且具有三维结构的细胞聚集体对其大小没有特别限制,但通常具有150μm至1000μm(并且在一个实施方案中,例如,200μm至800μm或300μm至500μm)的当量球径。包括神经细胞并且具有三维结构的细胞聚集体通常包括500至150000个细胞,并且在一个实施方案中,例如,1000至100000个细胞、1000至70000个细胞或3000至30000个细胞。
[0054]
包括神经细胞的细胞聚集体可包括与神经细胞一起的其他细胞。这种细胞聚集体的例子包括包含60%或更多、70%或更多、80%或更多并且更优选90%或更多的神经细胞的细胞聚集体。
[0055]
在一个实施方案中,包括神经细胞的细胞聚集体可包含60%或更多、70%或更多或者80%或更多的产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元。即,包括神经细胞的细胞聚集体可包含量为60%或更多、70%或更多或者80%或更多的表达选自foxa2、lmx1a、lmx1b、nurr1和th的一种或多种标志物的神经细胞。
[0056]
在一个实施方案中,包括神经细胞的细胞聚集体包含40%或更多、60%或更多、70%或更多、80%或更多、85%或更多或者90%或更多的产生多巴胺的神经元祖细胞。
[0057]
在一个实施方案中,包括神经细胞的细胞聚集体包含量为40%或更多、60%或更多、70%或更多、80%或更多、85%或更多或者90%或更多的表达产生多巴胺的神经元祖细胞的一种或多种、两种或更多种或者三种或更多种标志物的细胞。
[0058]
在一个实施方案中,包括神经细胞的细胞聚集体包含量为40%或更多、60%或更多、70%或更多、80%或更多、85%或更多或者90%或更多的对foxa2和lmx1a呈阳性的细胞。在一个实施方案中,所述细胞聚集体进一步包含量为40%或更少的对th和nurr1呈阳性的细胞。
[0059]
在一个实施方案中,包括神经细胞的细胞聚集体可包含量为0%或更多、10%或更多或者20%或更多的对foxa2、th和nurr1呈阳性的细胞。
[0060]
在一个实施方案中,包括产生多巴胺的神经元祖细胞的细胞聚集体可包含量为60%或更少、50%或更少、40%或更少、5%至50%、5%至40%或者5%至20%的nurr1阳性细胞。
[0061]
在一个实施方案中,包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体可包含量为30%或更少、20%或更少、1%至30%、5%至30%、1%至20%、5%至20%或者5%至15%的th阳性细胞。
[0062]
在一个实施方案中,包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体可包含量为30%或更少、1%至25%、1%至20%或者5%至20%的ki67阳性细胞。
[0063]
在一个实施方案中,包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体可包含量为20%或更少、10%或更少、5%或更少或者1%或更少的sox1阳性细胞。
[0064]
在一个实施方案中,包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体可包含量为5%或更少、2%或更少、1%或更少或者0.5%或更少的pax6阳性细胞。
[0065]
在一个实施方案中,包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体进一步包含量为20%或更少、具体地1%至20%、更具体地5%至15%的对th和nurr1呈阳性的细胞。
[0066]
在一个实施方案中,包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体包含量为50%或更多、优选地60%或更多、70%或更多或者80%或更多的对foxa2和lmx1a呈阳性的细胞,以及量为20%或更少、1%至20%、更具体地5%至15%的对th
和nurr1呈阳性的细胞。
[0067]
在一个实施方案中,在包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体中,sox1阳性细胞为10%或更少、优选地7%或更少、更优选地3%或更少,并且pax6阳性细胞为5%或更少、优选地4%或更少、更优选地2%或更少。
[0068]
在一个实施方案中,包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体包含量为60%或更多的对foxa2和lmx1a呈阳性的细胞以及量为1%至20%的对th和nurr1呈阳性的细胞,并且sox1阳性细胞为10%或更少、优选地7%或更少、更优选地3%或更少,并且pax6阳性细胞为5%或更少、优选地4%或更少、更优选地2%或更少。
[0069]
在一个实施方案中,包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体包含量为总细胞的60%或更多的对foxa2和lmx1a呈阳性的细胞,并且可包含量为总细胞的20%或更少、1%至20%或者5%至15%的对th和nurr1呈阳性的细胞。
[0070]
在一个实施方案中,上述包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体是具有150μm至1000μm的当量球径的细胞聚集体。
[0071]
在一个实施方案中,上述包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体包含量为60%或更多的对foxa2和lmx1a呈阳性的细胞以及量为1%至20%的对nurr1和th呈阳性的细胞并且具有150μm至1000μm的当量球径。
[0072]
[冷冻方法]本技术的方法包括以下步骤:(1)在冷冻前将包括神经细胞并且具有三维结构的细胞聚集体浸泡在0℃至30℃的冷冻保存溶液中以制备冷冻保存溶液浸泡的细胞聚集体。
[0073]
在本技术中,冷冻保存溶液是指包含冷冻保护剂的水溶液。冷冻保护剂是指与水分子具有高亲和力并且在抑制冷冻保存溶液中的冰晶生长方面高度有效的物质。冷冻保护剂包括例如二甲基亚砜(dmso)、乙二醇(eg)、丙二醇(pg)、1,2-丙二醇(1,2-pd)、1,3-丙二醇(1,3-pd)、丁二醇(bg)、异戊二醇(ipg)、二丙二醇(dpg)和甘油。在本技术中,冷冻保护剂优选地是二甲基亚砜、甘油和/或丙二醇。当二甲基亚砜、甘油和/或丙二醇用作冷冻保护剂时,冷冻保存溶液中的冷冻保护剂的浓度通常为约2%至12%、优选地约5%至12%、更优选地7%至12%、甚至更优选地约7%至10%、甚至还更优选地约10%。
[0074]
作为水溶液,例如,可以使用生理盐水、缓冲液(诸如pbs、ebss或hbss)、用于培养细胞或组织的培养基(诸如dmem、gmem或rpmi)、血清、血清代用品或其混合物等。
[0075]
作为冷冻保存溶液,可以使用包含二甲基亚砜(dmso)、甘油和/或丙二醇作为主要成分的市售冷冻保存溶液。冷冻保存溶液的具体例子包括市售冷冻保存溶液,诸如stem-cell banker(scb;zenoaq)、无dmso stem-cell banker(无dmso scb;zenoaq)、bambanker hrm(bbk;nippon genetics)、无dmso bambanker(无dmso bbk;nippon genetics)、cryostor cs5(cs5;biolife solutions)、cryostor cs10(cs10;biolife solutions)和synth-a-freeze(saf;thermo fisher scientific)。例如,希望使用包含7%至12%、优选地约10%的二甲基亚砜、甘油和/或丙二醇的冷冻保存溶液(诸如stem-cell banker、bambanker hrm、cryostor cs10或synth-a-freeze)。更优选地,可以使用bambanker hrm。
[0076]
在本说明书中,当冷冻细胞聚集体时,相对于冷冻保存溶液的细胞数量(细胞堆积密度)为80000至5000000个细胞/ml、100000至4000000个细胞/ml或200000至2000000个细
胞/ml、300000至1000000个细胞/ml。
[0077]
在本说明书中,当冷冻细胞聚集体时,所述细胞聚集体具有150至1000μm、150μm至600μm或300μm至500μm的当量球径。
[0078]
在本说明书中,细胞聚集体和保存溶液具有0.25ml至2ml、0.5ml至1.5ml或0.5ml至1ml的体积。
[0079]
在本说明书中,细胞聚集体和保存溶液可装在0.5ml至15ml、1ml至5ml或1ml至2ml的容器中。
[0080]
本技术中的冷冻保存溶液的冻结点没有特别限制,但通常为约-1℃至-10℃、优选地-3℃至-10℃、更优选地-3℃至-6℃、甚至更优选地约-5℃。
[0081]
将包括神经细胞的细胞聚集体浸泡在冷冻保存溶液中的温度通常为0℃至30℃、优选地0℃至20℃、更优选地0℃至10℃并且甚至更优选地0℃至5℃。
[0082]
将包括神经细胞的细胞聚集体浸泡在冷冻保存溶液中的时间段通常为5分钟至360分钟、5分钟至240分钟、5分钟至180分钟、5分钟至120分钟、优选地5分钟至60分钟、15分钟至360分钟、15分钟至240分钟、15分钟至180分钟、15分钟至150分钟、优选地15分钟至120分钟并且更优选地15分钟至60分钟。
[0083]
本技术的方法还包括以下步骤:(2)将在步骤(1)中获得的冷冻保存溶液浸泡的细胞聚集体冷冻在温度为-150℃或更低的液氮容器的气相中。
[0084]
在本说明书中,液氮容器是填充液氮的容器,并且容器中的气相空间保持在-150℃或更低。气相空间的温度没有特别限制,只要它为-150℃或更低即可。例如,它可为约-160℃、约-170℃、约-180℃或约-190℃。
[0085]
液氮容器中液氮的体积与气相空间的体积之比没有特别限制,只要气相空间的温度可以保持在-150℃或更低即可。具体地,液氮容器中液氮与气相空间的体积比可为约1:2至1:10。这样的液氮容器可作为g48-6r(taiyo nippon sanso corporation)和cryosystem 6000(mve)商购获得。
[0086]
可替代地,可以使液氮容器中的液氮渗进吸收剂诸如玻璃纤维中以提供液氮气相气氛。这样的液氮容器(被称为干吸器类型)可作为dr-22ds(taiyo nippon sanso corporation)和cryoshipper(mve)商购获得。
[0087]
在本技术的方法中,将填充有冷冻保存溶液浸泡的细胞聚集体的容器放置在液氮容器中的气相空间中。
[0088]
容器中填充的细胞聚集体和冷冻保存溶液的体积与液氮容器中的气相体积的比例没有特别限制,只要气相空间的温度可以保持在-150℃或更低即可。所述比例可以根据待使用的液氮气相储存器的容量和体积适当调整,但其优选地为5%或更小。例如,当气相空间的体积为1500l时,可以填充2ml细胞聚集体和冷冻保存溶液的容器(小瓶)的数量为约1至35200。
[0089]
在本发明的方法中,细胞聚集体相对于冷冻保存溶液的填充密度为5至500个聚集体/ml或10至500个聚集体/ml、优选地50至500个聚集体/ml并且更优选地50至200个聚集体/ml。填充有细胞聚集体的容器的形状和材料没有特别限制,并且可以使用能够密封细胞聚集体和冷冻保存溶液的任何容器。
[0090]
填充有通过本技术的方法冷冻的包含细胞聚集体和冷冻保存溶液的组合物的容
器可以在液氮容器中长期保存。换句话说,本技术的方法可进一步包括以下步骤:(3)将填充有在步骤(2)中获得的冷冻细胞聚集体的容器保存在液氮容器的气相或液相中,其中所述容器可以在-150℃或更低温度长期保存。
[0091]
可替代地,可将填充有通过本技术的方法冷冻的包含细胞聚集体和冷冻保存溶液的组合物的容器转移到深度冷冻器、程序冷冻器、质子冷冻器、快速液体冷冻器、静电空气快速冷冻器、细胞存活系统(cas)快速冷冻器、盐水快速冷冻器或用于保存的另一液氮容器中,以将其长期保存在-80℃或更低温度、优选地-150℃或更低温度。例如,所述温度可为约-160℃、约-170℃、约-180℃或约-190℃。
[0092]“长期保存”的保存期限没有限制,并且例如为一周或更长、一个月或更长、六个月或更长、一年或更长、三年或更长或者五年或更长。长期保存的保存期限没有上限,并且所述保存期限包括例如10年、20年、30年、50年、100年或更长。
[0093]
可以将冷冻细胞聚集体解冻并且视情况使用。解冻方法没有特别限制,但从细胞的功能、活性和活力的观点来看,希望在约体温下在短期内进行解冻。具体地,希望在30℃至40℃下、优选地在35℃至38℃下并且更优选地在人体温度附近的温度下(例如,在约37℃下)进行解冻。
[0094]
通过本发明的方法冷冻的细胞聚集体可以保持与未冷冻细胞聚集体等同的特性。例如,通过本发明的方法冷冻并在解冻后经历恢复培养7天的细胞聚集体具有与冷冻前的细胞聚集体等同的标志物表达率。例如,在包括产生多巴胺的神经元祖细胞的细胞聚集体的情况下,在所述细胞上表达的标志物的例子包括foxa2、lmx1a、nurr1和th。等同的标志物表达率意指,在冷冻前与解冻后或在解冻后培养7天后之间,表达标志物的细胞相对于总细胞的百分比的数值差异为约10%或更小。
[0095]
[药物组合物]本技术进一步提供了一种药物组合物,即移植用组合物(配制品),所述药物组合物包含通过上述方法冷冻或长期保存的细胞聚集体作为活性成分。
[0096]
本发明的药物组合物(移植用组合物)是这样的概念,其包括通过本发明的方法冷冻的药物组合物和通过将所述冷冻药物组合物解冻而获得的药物组合物两者。即,本发明的药物组合物(移植用组合物)的例子包括包含包括神经细胞的细胞聚集体和冷冻保存溶液的冷冻或未冷冻组合物,以及在解冻后已将冷冻保存溶液更换为给药媒介物的情况下,包含包括神经细胞的细胞聚集体和所述给药媒介物的组合物。
[0097]
本发明的药物组合物(移植用组合物)的例子包括根据上文[16]至[20]的移植用组合物。
[0098]
作为一个实施方案,本发明包括一种移植用组合物,其中所述组合物中的细胞数为80000至5000000个细胞/ml、100000至4000000个细胞/ml或200000至2000000个细胞/ml、300000至1000000个细胞/ml,并且所述组合物包含量为总细胞的40%或更多、优选地60%或更多、60%或更多、80%或更多、85%或更多或者90%或更多的foxa2阳性和lmx1a阳性细胞,以及量为总细胞的40%或更少、1%至20%或者5%至15%的th阳性和nurr1阳性细胞。
[0099]
在一个实施方案中,细胞聚集体具有150至1000μm、150μm至600μm或300μm至500μm的当量球径。
[0100]
在一个实施方案中,细胞聚集体和保存溶液具有0.25ml至2ml、0.5ml至1.5ml或
0.5ml至1ml的体积。
[0101]
在一个实施方案中,细胞聚集体和保存溶液可装在0.5ml至15ml、0.5ml至5ml或1ml至2ml的容器中。
[0102]
作为一个实施方案,本发明包括一种移植用组合物,所述移植用组合物可以在解冻后不进行恢复培养的情况下使用。
[0103]
作为一个实施方案,本发明包括根据[16]至[20]中任一项的移植用组合物,其中所述组合物以8至192个细胞聚集体/ml包含细胞聚集体,所述细胞聚集体具有150μm至1000μm的平均粒径,并且每个容器的细胞数量为80000至2400000。
[0104]
所述细胞聚集体可作为用于移植的药物组合物用于患有需要移植神经细胞的疾病的患者,并且可以用作用于伴随神经细胞变性、损伤或功能障碍的疾病的药物诸如治疗药物。即,包含本发明的细胞聚集体和药学上可接受的载体的药物组合物也在本发明的范围内。
[0105]
需要移植神经细胞的疾病或者伴随神经细胞损伤或功能障碍的疾病的例子包括脊髓损伤、运动神经疾病、多发性硬化症、肌萎缩侧索硬化、萎缩性侧索硬化、亨廷顿病、多系统萎缩、脊髓小脑变性、阿尔茨海默病、视网膜色素变性、老年性黄斑变性和帕金森综合征(包括帕金森病)。
[0106]
本发明的一个实施方案包括一种用于治疗帕金森病的药物组合物,所述药物组合物包含本发明的细胞聚集体作为活性成分,所述细胞聚集体包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元。用于帕金森病的治疗剂中包括的产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的数量没有特别限制,只要在施用后可以植入移植物即可;例如,每次移植可以包括1.0
×
104个细胞或更多细胞。另外,可根据症状或体型适当增加或减少细胞数量以制备所述治疗剂。例如,可以通过nature neuroscience,2,1137(1999)或n engl j med.;344:710至9(2001)中描述的技术将产生多巴胺的神经元祖细胞移植到疾病部位。
[0107]
作为一个实施方案,本发明的药物组合物(也称为移植用组合物)包含待移植到人体内的包括神经细胞的细胞聚集体以及冷冻保存溶液。本发明的药物组合物包括冷冻固体形式和冷冻前或解冻后的液体形式。所述药物组合物可视情况包括用于维持细胞存活的添加剂,其程度使得它不会影响冷冻速率和冷冻温度。所述冷冻保存溶液的例子包括上述那些。
[0108]
如下所述,本发明的药物组合物或移植用组合物用于在将其解冻并且除去冷冻保存溶液并更换为可注射到活体的给药媒介物后进行移植。即,包含解冻的细胞聚集体和给药媒介物的组合物也在本发明的药物组合物(也称为移植用组合物)的范围内。
[0109]
[用于产生移植用组合物的方法]根据上文[16]至[20]的药物组合物(移植用组合物)可以通过根据上文[1]至[14]中任一项的冷冻方法来产生。即,本发明包括一种用于产生上述药物组合物(移植用组合物)的方法。
[0110]
[治疗方法]本发明的一个实施方案包括一种用于治疗需要补充神经细胞的疾病的方法,所述方法包括以下步骤:将本发明的细胞聚集体移植到患有需要移植神经细胞的疾病的患者体
内。
[0111]
在本发明的一个实施方案中,可以将通过本发明获得的包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体作为药物组合物、特别是作为用于移植的材料施用至帕金森病患者。
[0112]
具体地,所述施用如下进行:将包含包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体以及冷冻保存溶液的本发明的冷冻药物组合物解冻,适当地悬浮在用于移植的适当介质诸如生理盐水中,然后移植到多巴胺能神经元不足的患者区域例如纹状体中。例如,可将解冻后的药物组合物用包含适当载体的媒介物洗涤,并且可将冷冻保存溶液更换为用于悬浮细胞聚集体移植媒介物,用于移植到人体内。解冻温度没有特别限制,但可以为30℃至40℃、优选地35℃至38℃,并且更优选地人体温度附近的温度,例如约37℃,如上所述。本发明的药物组合物(移植用组合物)中包括的细胞聚集体可以通过在解冻后不进行恢复培养的情况下将冷冻保存溶液更换为给药媒介物来移植到活体中。
[0113]
对于用于包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞聚集体的移植媒介物(给药媒介物)所用的载体,可以使用本领域技术人员已知的任何物质,只要它是用于维持细胞存活的物质即可。具体地,可以使用生理水性溶剂(诸如生理盐水、缓冲液、无血清培养基等)。在移植医学中,如果需要,可将包含待移植的组织或细胞的药物组合物与常用的防腐剂、稳定剂、还原剂或等渗剂组合。
[0114]
对于移植,可将解冻的细胞聚集体保存在维持每个细胞聚集体的活力所必需的媒介物中。“维持活力所必需的媒介物”的例子包括培养基和生理缓冲溶液;所述媒介物没有特别限制,只要所述媒介物允许包括产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元的细胞群存活即可,并且本领域技术人员可以适当地选择这样的媒介物。所述媒介物的一个例子是通过使用通常用于培养动物细胞的培养基作为基础培养基而制备的培养基。所述基础培养基的例子包括可以用于培养动物细胞的培养基,诸如bme培养基、bgjb培养基、cmrl 1066培养基、gmem培养基、改良mem zinc option培养基、neurobasal培养基、imdm培养基、medium 199培养基、eagle mem培养基、αmem培养基、dmem培养基、f-12培养基、dmem/f12培养基、imdm/f12培养基、ham培养基、rpmi 1640培养基、fischer培养基或其混合培养基。
[0115]
由于上述细胞聚集体的移植,将移植的产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元以及移植后诱导的产生多巴胺的神经元祖细胞和/或产生多巴胺的神经元功能性地植入被施用所述细胞聚集体的患者体内。
[0116]
如本文所用的术语“植入”意指移植的细胞在活体中存活长时间段(例如,30天或更长、60天或更长或者90天或更长),并且粘附并保留在器官中。
[0117]
如本文所用的术语“功能性植入”意指移植的细胞被植入以在活体中发挥其初始功能的状态。
[0118]
如本文所用的术语“功能性存活率”是指在移植的细胞中已实现功能性植入的细胞的百分比。移植的产生多巴胺的神经元祖细胞的功能性存活率可以例如通过测量移植物中th阳性细胞的数量来确定。
[0119]
由于上述细胞聚集体的移植,移植的细胞以及移植后诱导的产生多巴胺的神经元
祖细胞和/或产生多巴胺的神经元具有0.1%或更大、优选地0.2%或更大、更优选地0.4%或更大、甚至更优选地0.5%或更大并且还更优选地0.6%或更大的功能性存活率。
[0120]
作为一个实施方案,本发明包括一种用于治疗需要产生多巴胺的神经的再生的疾病的方法,所述方法包括以下步骤:(1)在30℃至40℃下、优选地在37℃
±
3℃下解冻根据[16]至[20]中任一项的移植用组合物;以及(2)将在(1)中获得的所述移植用组合物移植到患者的纹状体区域中。本发明的一个实施方案包括所述治疗方法,其中在解冻后不进行培养的情况下将冷冻保存溶液更换为给药媒介物以进行步骤(2)。
[0121]
在本说明书中要经历移植的哺乳动物的例子包括人、小鼠、大鼠、豚鼠、仓鼠、兔、猫、狗、绵羊、猪、奶牛、马、山羊和猴,优选啮齿动物(例如,小鼠和大鼠)或灵长类动物(例如,人和猴),并且更优选人。实施例
[0122]
在下文中,将参考实施例更详细地描述本技术,但本技术不限于这些实施例。
[0123]
实施例1:细胞聚集体的产生人ips细胞的维持和神经分化将人ipsc(1231a3)(京都大学)维持在涂有imatrix-511(nippi,inc.)的6孔板上的stemfit培养基(ajinomoto co.,inc.)中。为了启动神经元分化,将ipsc与tryple select(invitrogen)一起孵育10分钟,然后解离成单个细胞,并与分化培养基一起以5
×
106个细胞/孔的密度接种在涂有imatrix-511(nippi,inc.)的6孔板上。分化培养基是含有补充有8%ksr、0.1mm mem非必需氨基酸(均来自invitrogen)、丙酮酸钠(sigma-aldrich)和0.1mm 2-巯基乙醇的gmem的培养基。从接种后当天到第12天,每天更换分化培养基。为了有效地诱导神经元分化,添加ldn193189(stemgent,inc.)和a83-01(wako chemical co.,ltd.)。为了诱导底板细胞,在第1天至第7天添加2μm嘌吗啡胺(purmorphamine)和100ng ml-1
fgf8(wako chemical co.,ltd.),并且在第3天至第12天添加3μm chir99021(wako chemical co.,ltd.)。
[0124]
培养将培养第12天的细胞以1.5
×
104个细胞/孔的密度重新接种在低细胞粘附u形96孔板(sumitomo bakelite co.,ltd.)上的神经元分化培养基中,所述神经元分化培养基含有补充有b27补充剂、2μm glutamax-i(均来自invitrogen)、10ng ml-1
gdnf、200mm抗坏血酸、20ng ml-1
bdnf(均来自wako chemical co.,ltd.)和400μm dbcamp(sigma-aldrich)的neurobasal培养基。每3天更换培养基,并且将30μm y-27632(wako chemical co.,ltd.)添加到第一培养基中。对于延长的培养,将漂浮球体在神经元分化培养基中培养直至第28天,以获得细胞聚集体。
[0125]
测试实施例1:细胞活力测定将在实施例1中获得的冷冻前的细胞聚集体在水浴(37℃)中用神经元细胞分散溶液(wako pure chemical industries,ltd.:目录号297-78101)浸泡10分钟,然后通过吸液将球体分散成单个细胞,然后通过countess
tm
自动细胞计数器(thermo fisher scientific inc.:目录号c10281)确定活细胞的数量。
[0126]
另外,将在下文实施例2至7和比较实施例1中获得的冷冻细胞聚集体在水浴(37℃)中浸泡约2分钟以进行解冻,然后经历在神经元分化培养基中进行的恢复培养。恢复培养一天后,除去上清液,并且以与冷冻前的细胞聚集体相同的方式确定活细胞的数量。
[0127]
实施例2至7和比较实施例1中冷冻和解冻后的细胞活力(%)是通过将冷冻后的球体中活细胞的数量除以冷冻前的球体中活细胞的数量来计算的。
[0128]
测试实施例2:神经突延伸测定将在实施例1中获得的冷冻前的细胞聚集体以每孔一个细胞聚集体接种在涂有imatrix-511的24孔板上,在神经元分化培养基中培养5天,然后用4%多聚甲醛固定。用pe标记的抗psa-ncam抗体(miltenyi biotec)对固定的球体进行染色,并且使用荧光显微镜(bz-9000,keyence)进行可视化。使用photoshop(adobe systems)和winroof(mitani corporation)测量从细胞聚集体延伸的神经突的面积。
[0129]
另外,将在下文实施例3至7中获得的冷冻细胞聚集体在水浴(37℃)中浸泡约2分钟以进行解冻,然后在神经元分化培养基中培养5天。使用培养5天后获得的细胞聚集体通过与用于上述细胞聚集体的相同的方法来测量神经突的面积。
[0130]
实施例2:细胞聚集体的冷冻将通过实施例1的方法产生的第28天的六十四个细胞聚集体与培养基一起收集在15ml离心管(iwaki:目录号2323-015)中,并且它们自发沉淀。然后除去上清液,并且添加1.0ml冷冻保存溶液无dmso(gc lymphotec inc.),以获得细胞聚集体悬浮液。将全部细胞聚集体悬浮液注入样品容器(sarstedt:目录号72.687.028s,1.5ml螺旋盖微管)中,并且将所述样品容器放置在冰上40分钟,然后放置在低温箱中。为了评价冷冻细胞聚集体的方法的效果,将低温箱送入液氮冷冻保存容器(taiyo nippon sanso corporation:目录号dr-430m,气相保存类型)、-80℃深度冷冻器(panasonic corporation:目录号km-du73y1)和-150℃深度冷冻器(panasonic corporation:目录号mdf-c2156van)中并且冷冻,以获得细胞聚集体的测试制剂。
[0131]
根据测试实施例1中描述的方法,评价了从液氮冷冻保存容器、-80℃深度冷冻器和-150℃深度冷冻器中取出的测试制剂的细胞活力(图1)。
[0132]
结果,在液氮冷冻保存容器的气相空间中冷冻的测试制剂在解冻后的细胞活力为53.2
±
1.5%(平均值
±
标准差,n=11)。另一方面,在-80℃深度冷冻器(腔室内实际温度:-77℃)和-150℃深度冷冻器(腔室内实际温度:-145℃)中冷冻的测试制剂在解冻后的细胞活力分别为13.7
±
6.9%(平均值
±
标准差,n=11)和36.8
±
7.9%(平均值
±
标准差,n=11)(图1)。
[0133]
因此,发现在液氮的气相空间中冷冻的测试制剂在解冻后具有高细胞活力,并且样品容器之间的变化被显著抑制。
[0134]
实施例3:细胞聚集体在冷冻保存溶液中的浸泡时间的影响将通过实施例1的方法产生的第28天的六十四个细胞聚集体与培养基一起收集在15ml离心管(iwaki:目录号2323-015)中,并且它们自发沉淀。然后除去上清液,并且添加1.0ml冷冻保存溶液hrm(gc lymphotec inc.),以获得球体悬浮液。为了评价细胞聚集体在冷冻保存溶液中的浸泡时间的影响,将全部细胞聚集体悬浮液注入样品容器(sarstedt:目录号72.687.028s,1.5ml螺旋盖微管)中,并且将所述样品容器放置在冰上15
分钟、30分钟、60分钟、120分钟、180分钟、240分钟或360分钟,然后放置在低温箱中。将低温箱送入液氮冷冻保存容器(taiyo nippon sanso corporation:目录号dr-430m,气相保存类型)中并且冷冻,以获得测试制剂。
[0135]
根据测试实施例1和2中描述的方法,评价从液氮冷冻保存容器中取出的测试制剂的细胞活力和神经突延伸能力。结果在图2和图3中示出。结果表明,当在冷冻保存溶液中的浸泡时间为15分钟至120分钟时,细胞活力和神经突延伸能力往往特别高。
[0136]
因此,认为细胞聚集体在冷冻保存溶液中的浸泡时间特别优选地为15分钟至120分钟。
[0137]
实施例4:液氮容器的气相体积的影响将通过实施例1的方法产生的第28天的六十四个细胞聚集体与培养基一起收集在15ml离心管(iwaki:目录号2323-015)中,并且它们自发沉淀。然后除去上清液,并且添加2ml冷冻保存溶液hrm(gc lymphotec inc.),以获得球体悬浮液。将全部细胞聚集体悬浮液转移到2ml样品容器(nalgene:目录号nl5000-0020)中,并且将样品容器用盖子密封并放置在冰上35分钟。为了评价细胞聚集体和冷冻保存溶液的体积与液氮容器的气相体积的比例的影响,本发明人准备了一个具有三个2ml样品容器(所述2ml样品容器中填充的细胞聚集体和冷冻保存溶液的体积与液氮容器的气相体积的比例为0.3%)的25位低温箱以及两个各自具有二十五个2ml样品容器(所述2ml样品容器中填充的细胞聚集体和冷冻保存溶液的体积的比例为5%)的25位低温箱。将这些低温箱送入填充有液氮的2l杜瓦瓶(isotherm:目录号27b-e)中以提供液氮气相气氛,并且冷冻,以获得测试制剂。
[0138]
根据测试实施例1和2中描述的方法,评价从液氮冷冻保存容器(2l杜瓦瓶)中取出的测试制剂的细胞活力和神经突延伸能力。
[0139]
结果,当样品容器中填充的细胞聚集体和冷冻保存溶液的体积与液氮容器的气相体积的比例为0.3%和5%时,细胞活力和神经突延伸能力是相当的(图4和图5)。
[0140]
因此,发现细胞聚集体和冷冻保存溶液的体积与液氮容器的气相体积的比例对细胞活力和神经突延伸能力没有影响。
[0141]
实施例5:填充的细胞聚集体的数量的影响
[0142]
将通过实施例1的方法产生的第28天的10、25、50、100、250或500个细胞聚集体与培养基一起收集在15ml离心管(iwaki:目录号2323-015)中,并且它们自发沉淀。然后除去上清液,并且添加1.0ml冷冻保存溶液hrm(gc lymphotec inc.),以获得细胞聚集体悬浮液。将全部细胞聚集体悬浮液转移到样品容器(1.5ml sumilon superquality slim tube:sumitomo bakelite co.,ltd.:目录号ms-4702ws)中,并且将所述样品容器放置在冰上35分钟,然后放置在低温箱中。将该低温箱送入液氮冷冻保存容器(taiyo nippon sanso corporation:目录号dr-430m,气相保存类型)中并且冷冻,以获得细胞聚集体的测试制剂。
[0143]
根据测试实施例1和2中描述的方法,评价从液氮冷冻保存容器中取出的测试制剂的细胞活力和神经突延伸能力。
[0144]
结果,在填充密度的范围为10至500个细胞聚集体/ml的测试制剂中,细胞活力和神经突延伸能力是相当的,这表明细胞聚集体的填充密度对细胞活力和神经突延伸能力没
有影响(图6和图7)。
[0145]
因此,发现样品容器中细胞聚集体的填充密度对细胞活力和神经突延伸能力没有影响。
[0146]
实施例6:每个细胞聚集体的填充溶液的体积(样品容器的大小)的影响将通过实施例1的方法产生的第28天的六十四个细胞聚集体与培养基一起收集在15ml离心管(iwaki:目录号2323-015)中,并且它们自发沉淀。然后除去上清液,并且添加0.5ml、1.5ml或5ml冷冻保存溶液hrm(gc lymphotec inc.),以获得球体悬浮液。为了评价每个细胞聚集体的填充溶液的体积的影响,将总量为0.5ml、1.5ml和5ml的细胞聚集体悬浮液分别转移到0.5ml样品容器(sarstedt:目录号72.733.001)、1.5ml样品容器(sarstedt:目录号72.687.028s)和5ml样品容器(sumitomo bakelite co.,ltd.:目录号ms-4605)中,并且将所述样品容器放置在冰上35分钟,然后放置在低温箱中。将这些低温箱送入液氮冷冻保存容器(taiyo nippon sanso corporation:目录号dr-430m,气相保存类型)中并且冷冻,以获得测试制剂。
[0147]
根据测试实施例1和2中描述的方法,评价从液氮冷冻保存容器中取出的测试制剂的细胞活力和神经突延伸能力。
[0148]
结果,在0.5ml、1.5ml和5ml样品容器中,细胞活力和神经突延伸能力是相当的,这表明每个细胞聚集体的填充溶液的体积对细胞活力和神经突延伸能力没有影响(图8和图9)。
[0149]
实施例7:细胞聚集体的当量球径的影响在实施例1的方法中,将细胞以0.5
×
104个细胞/孔、1.0
×
104个细胞/孔、2.0
×
104个细胞/孔或3.0
×
104个细胞/孔重新接种在神经元分化培养基中,以在第28天获得具有四种不同大小的细胞聚集体(平均当量球径为:329μm、457μm、594μm或676μm)。将每种大小的这些细胞聚集体与培养基一起收集在15ml离心管(iwaki:目录号2323-015)中,并且它们自发沉淀。然后除去上清液,并且添加1.0ml冷冻保存溶液hrm(gc lymphotec inc.),以获得细胞聚集体悬浮液。将全部这些细胞聚集体悬浮液转移到它们相应的样品容器(1.5ml sumilon superquality slim tube:sumitomo bakelite co.,ltd.:目录号ms-4702ws)中,并且将所述样品容器放置在冰上45分钟,然后放置在低温箱中。将该低温箱送入液氮冷冻保存容器(taiyo nippon sanso corporation:目录号dr-430m,气相保存类型)中并且冷冻,以获得细胞聚集体的测试制剂。
[0150]
根据测试实施例1和2中描述的方法,评价从液氮冷冻保存容器中取出的测试制剂的细胞活力和神经突延伸。
[0151]
结果,在平均当量球径为329μm、457μm、594μm和676μm的细胞聚集体中,细胞活力是相当的,并且在平均当量球径为329μm、457μm和594μm的细胞聚集体中,神经突伸长能力往往特别高(图10和图11)。
[0152]
因此,认为细胞聚集体特别优选地具有329μm至594μm的当量球径。
[0153]
比较实施例1将通过实施例1的方法产生的第28天的六十四个细胞聚集体与培养基一起收集在15ml离心管(iwaki:目录号2323-015)中,并且它们自发沉淀。然后除去上清液,并且添加1.0ml冷冻保存溶液无dmso(gc lymphotec inc.),以获得细胞聚集体悬浮液。
将全部细胞聚集体悬浮液转移到样品容器(sarstedt:目录号72.687.028s,1.5ml螺旋盖微管)中,并且将所述样品容器放置在冰上30分钟,然后放置在低温箱中。将低温箱浸泡在液氮的液相中以将其冷却并冷冻至-190℃,然后送入液氮冷冻保存容器(taiyo nippon sanso corporation:目录号dr-430m,气相保存类型)中进行保存,以获得测试制剂。
[0154]
结果,与在气相中冷冻的测试制剂(参见实施例2)相比,在液氮的液相中冷却并冷冻至-190℃的测试制剂中,细胞活力显著更低(图12)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。