一株产赤霉素ga4菌株及其应用
技术领域
1.本发明属于生物工程技术领域,具体涉及一株产赤霉素ga4高产菌株及其应用。
背景技术:
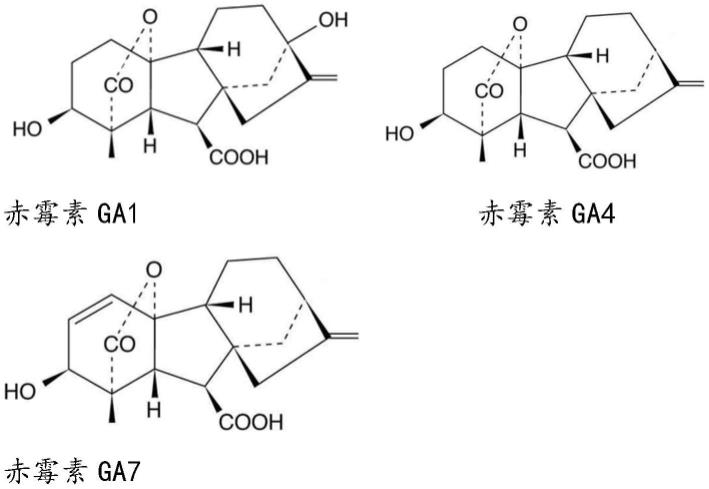
2.本发明涉及得赤霉素ga1、ga4、ga7,其结构式如下:
[0003][0004]
赤霉素(gibberellins,gas)是一类属于双萜类化合物的植物激素,广泛存在于高等植物、真菌和细菌中。其种类繁多,目前已发现的赤霉素共有136种,总称为赤霉素类(gas)。其中具有生物活性的主要是ga1、ga3、ga4和ga7。ga3开发最为成功,生产和应用、研究开发均形成了较大规模,是主要的植物生长调节剂之一。随着对赤霉素研究的深入,该族的其它同系物,特别是ga4、ga7越来越受到重视。赤霉素类化合物作为植物生长调节剂有多种调节功能。在不同的光照、温度条件下以及植物生长的不同时期甚至同一植株的不同部位,产生的赤霉素各不相同。ga7主要产生在茎尖及未成熟的种子中,ga4在植物的根、茎、叶及种子中都有发现。在促进植物茎生长的活性上赤霉素表现为ga3>ga7>ga4。ga3目前虽然应用很广泛,但由于ga3活性太高,在打破植物休眠时会促进胚轴的过度生长,降低植株的抗倒伏性,同时还会促进表皮细胞的迅速生长,致使表皮角质层较薄,果实容易长斑破裂。而ga4活性相对较温和,具有多种生理功能,比如刺激植物细胞伸长,使植株长高,叶片增大;打破种子、块茎、块根的休眠,促使其萌发;刺激果实生长,提高结实率或形成无籽果实;促进一些需要低温才能通过生育阶段的植物提早花芽分化;使一些植物在短日照条件下也能抽苔开花;能诱导α-淀粉酶形成,加速胚乳细胞中贮藏物质的水解;提高坐果率,促进果实生长,延缓果实衰老。ga4因其独特的活性与优势正受到越来越多的关注。
[0005]
国内从90年代以来以中国农大为代表,对赤霉素ga4进行了较深入的系列研究,目前赤霉素ga4主要是通过液体深层发酵法获得。但是生产过程中主要存在两个突出问题,一是ga4的产量低,发酵水平在800-1000mg/l左右;二是副产物多,主要是ga1和ga7,ga4在脱
氢酶作用下转化成ga7,ga7和ga4在13-羟化酶作用下转化成ga3和ga1,导致ga4分离纯化成本高,严重阻碍了其大规模的商业化运用。
[0006]
国内外对于ga4的研究报道较少,浙江钱江生物化学股份有限公司通过诱变选育筛选获得一株藤仓赤霉菌在摇瓶中培养9天(cn 201510630480.4),虽然该发明公开了经过9天发酵周期后,赤霉素ga4产量可达到1447mg/l,但还伴随产生含有较多的赤霉素ga7副产物(约3%),且发酵周期很长。
[0007]
另外,目前还有很多研究集中在从ga4 7混合物中分离ga4,主要是菌种特异性不强,发酵过程中产生了大量的赤霉素ga7,浙江工业大学金志敏等(cn 200810061778.8)公开了一种从赤霉素ga4 7混合物中分离赤霉素ga4的方法。南京工业大学杨文革等(cn 201210464476.1)公开了一种ga4和/或ga7的分离纯化方法,也是从ga4 7混合物中获得单一的ga4或者ga7。南京工业大学杨文革等(cn 201710214169.0)公开一种赤霉菌发酵生产赤霉素ga1和ga4工艺,在摇瓶中发酵9天赤霉素ga1发酵水平达到2950mg/l,赤霉素ga4发酵水平达到1441mg/l,同样发酵周期很长,还有大量的副产物赤霉素ga1的产生,增加了分离纯化成本。geetanjali等通过紫外诱变获得一株形态突变菌株gibberella fujikuroi mor-189在以小麦面筋为唯一氮源时,补料分批培养7天,赤霉素ga4的产量达到600mg/l(geetanjali lale,ramchandra gadre.enhanced production of gibberellin a4(ga4)by a mutant of gibberella fujikuroi in wheat gluten medium.journal of industrial microbiology&biotechnology(2010)37:297
–
306.)。
[0008]
从总体生产性能考虑,这些菌株或者工艺并不适合赤霉素ga4规模化工业生产。
技术实现要素:
[0009]
本发明所要解决的技术问题是:针对现有技术中的赤霉素ga4生产过程中主要存在两个突出问题:一是ga4的产量低,发酵水平在800-1000mg/l左右;二是副产物多,主要是ga1和ga7,等缺陷与不足,提供一株产赤霉素ga4高产菌株及利用该菌株生产赤霉素ga4的方法,其发酵液中不产生赤霉素副产物ga1和ga7,通过双阶段控制发酵条件提高赤霉素ga4的产量,发酵120小时,ga4发酵水平可达到1200mg/l以上。
[0010]
本发明采用如下技术方案,来实现发明目的。
[0011]
首先,本发明公开了一株产赤霉素ga4的菌株。
[0012]
该菌株是从原赤霉素ga3菌种经过artp多轮诱变与筛选而获得,该菌株分类命名为:藤仓赤霉(fusarium fujikuroi)nrf01,已于2022年5月19日保藏于中国典型培养物保藏中心,保藏单位地址为:中国武汉市武汉大学,保藏编号cctcc no.m2022683。
[0013]
其次,本发明公开了该产赤霉素ga4菌株在发酵生产赤霉素ga4中的应用。
[0014]
该藤仓赤霉nrf01菌株应用于工业化发酵生产赤霉素ga4,该菌株只产生赤霉素ga4目标产物,不产生赤霉素ga1和赤霉素ga7二种副产物,发酵水平稳定,适合工业化生产。当发酵生产过程中采取分阶段控制发酵条件时,发酵120小时,其发酵水平可达到1200mg/l以上。
[0015]
最后,本发明还具体公开了该产赤霉素ga4的菌株用于发酵生产赤霉素ga4的方法。该方法包括如下步骤:
[0016]
s1、将所述藤仓赤霉nrf01菌株接至液体活化培养基中进行活化,控制温度28-30
℃,摇床转速200-300rpm,培养24-48小时,得到活化菌液;
[0017]
s2、按照体积比,将步骤s1中已活化的菌液5-10%接种至含有种子培养基的摇瓶中,控制温度28-30℃,摇床转速300-400rpm,培养18-36小时,得到种子液;
[0018]
s3、按照体积比,将步骤s2中的种子液10-15%接种至含有发酵培养基的摇瓶中,进行双阶段发酵培养后,得到不含赤霉素ga1和赤霉素ga7副产物的赤霉素ga4发酵醪液;
[0019]
s4、将步骤s3中得到的赤霉素ga4发酵醪液进行提取分离,得到赤霉素ga4产品。
[0020]
进一步地,步骤s1所述的液体活化培养基按照质量/体积比计为:葡萄糖2.0-5.0%,黄豆饼粉1.5-2.5%,花生饼粉0.8-1.5%,kh2po
4 0.8-1.6%,(nh4)2so
4 0.005-0.015%,mgso4.7h2o 0.05-0.15%。
[0021]
进一步地,步骤s2所述的种子培养基按照质量/体积比计为:葡萄糖1.0-3.0%,黄豆饼粉1.5-2.5%,花生饼粉0.8-1.5%,糊精2.0-4.0%,kh2po
4 0.08-0.16%,(nh4)2so
4 0.01-0.03%,mgso4.7h2o 0.05-0.15%。
[0022]
进一步地,步骤s3所述的发酵培养基按照质量/体积比计为:碳源8%-12%,氮源2.5-4.0%,mgso4.7h2o 0.08-0.12%,(nh4)2so4 0.02-0.04%,kh2po4 0.15-0.30%。
[0023]
更进一步地,所述发酵培养基中的碳源,选自淀粉液化液、糊精、饴糖、麦芽糖、葡萄糖的一种或者几种组合。
[0024]
更进一步地,所述发酵培养基中的氮源,选自黄豆饼粉、花生饼粉、玉米蛋白粉,大米蛋白粉,(nh4)2so4、nh4cooh、nano3、kno3的一种或者几种组合。
[0025]
进一步地,步骤s3所述的双阶段发酵培养包括发酵前期和发酵后期;在发酵前期,培养温度28-30℃,摇床转速220-300rpm,培养时间24-48小时;在发酵后期,培养温度31-33℃,摇床转速160-220rpm,培养时间72-96小时。
[0026]
更进一步地,所述发酵在该双阶段发酵培养控制条件下,发酵120小时,ga4发酵水平达到1200mg/l以上。
[0027]
有益效果:
[0028]
(1)本发明提供了一株藤仓赤霉(fusarium fujikuroi)nrf01菌株,该菌株能够在较短发酵周期内产生较高产量的赤霉素ga4。通过对该菌株的逐级培养,赤霉素ga4产量可以达到950mg/l,不产生赤霉素ga1和ga7副产物;当采用双阶段发酵培养控制条件,赤霉素ga4产量可以达到1200mg/l以上,不产生赤霉素ga1和ga7副产物,具有很好的应用前景,对赤霉素ga4的工业化生产具有积极的推动作用。
附图说明:
[0029]
图1是实施例2中利用藤仓赤霉(fusarium fujikuroi)nrf01菌株,经发酵生产所得的赤霉素产物图谱。
具体实施方式
[0030]
下面结合具体实施例对本发明作进一步的说明,但本发明并不限于以下实施例。所述方法如无特别说明均为常规方法。所述原材料如无特别说明均能从公开商业途径获得。下述实施例与对比例的所列数据,均为同期制备、同期试验而得到。
[0031]
附:赤霉素ga4、ga7、ga1分析方法:
[0032]
仪器:岛津lc-20at,采用150mm
×
4.6mm(id)不锈钢柱,内装ods-c18(5μm填充物)色谱柱。流动相:甲醇 水 甲酸=67 33 0.05(v/v)使用前超声波脱气。流速:0.7ml/min。检测波长:210nm。进样量:20μl。样品溶液配置:发酵液用2%naoh溶液调节ph在7.0左右,滤纸过滤,准确吸取滤液5.0ml于25ml容量瓶中用流动相稀释至刻度,然后离心取上清,用0.45μm滤膜过滤,以备进样检测。保留时间:赤霉酸ga1约5.1min,赤霉酸ga7约9.4min,赤霉酸ga4约11.0min。
[0033]
实施例1:藤仓赤霉nrf01菌株的获得与保藏
[0034]
该藤仓赤霉nrf01菌株是从原赤霉素ga3菌种经过artp多轮诱变与筛选获得,具体过程如下:
[0035]
(1)幼嫩菌丝制备:挑取长宽各1cm大小的菌丝块到含20ml0.90%生理盐水的玻璃瓶中打散10min;直径80mm,孔径0.45μm的无菌微孔滤膜铺到带有pda培养基(葡萄糖2%,土豆20%,琼脂1.8%)的平皿中。将打散的菌悬液吸取1ml在微孔滤膜上涂布均匀,置于霉菌培养箱28℃培养36小时左右。
[0036]
(2)原生质体制备:配制混合酶液30ml用带有0.22μm微孔滤膜的抽滤瓶进行过滤除菌备用,混合酶液组成纤维素酶2.0%,蜗牛酶0.4%,果胶酶2.5%nacl 4.0%;将培养好的带有幼嫩菌丝的滤膜置于空白培养皿中,吸取混合酶液20ml左右,用工具将幼嫩菌丝刮下,然后用镊子把滤膜取出,28℃酶解4小时左右;酶解液离心去除酶液,用4.0%的nacl稳渗溶液清洗一次后再次离心去除上清液,用4.0%的nacl稳渗溶液定容到相应的体积,得到原生质体菌悬液。
[0037]
(3)artp诱变处理:取原生质体菌悬液10μl均匀涂布在灭菌载片表面,将装有载片的灭菌培养皿转移至artp操作室内,用无菌镊子将载片放到对应凹槽,调节手动旋转样品载台旋钮,使载片与等离子体发生器射流出口间距约为2-3mm,设定气量8-12slm,功率设置100-200w,时间控制在0-60s。将处理完毕的载片放入盛有1ml无菌溶液的离心管中振荡洗脱,洗脱液稀释涂皿于再生培养基中培养,再生培养基成分(蔗糖2.0%,蛋白胨0.2%,酵母膏0.2%,kh2po
4 0.05%,氯化钠3.6%,琼脂1.5%)。
[0038]
(4)发酵培养及稳定性测试挑取再生平板上的单菌落,经过种子培养、发酵培养后,检测发酵液中赤霉素ga4及赤霉素ga7、ga1的浓度。初筛发现10株菌株赤霉素ga4浓度较高都在800mg/l以上,进一步复筛获得高产菌株3株。进一步菌株稳定性测试,挑选出一株菌株遗传稳定性好,该菌株命名为藤仓赤霉(fusarium fujikuroi)nrf01,赤霉素ga4产物浓度高稳定在950mg/l以上,且没有赤霉素ga1和赤霉素ga7副产物产生。
[0039]
上述种子培养的培养基组成成分为,葡萄糖1.0-3.0%,黄豆饼粉1.5-2.5%,花生饼粉0.8-1.5%,糊精2.0-4.0%,kh2po
4 0.08-0.16%,(nh4)2so
4 0.01-0.03%,mgso4.7h2o 0.05-0.15%。种子培养条件为:温度28-30℃,摇床转速300-400rpm,培养18-36小时,得到种子液。
[0040]
上述发酵培养的培养基组成成分为:碳源8%-12%,氮源2.5-4.0%,mgso4.7h2o 0.08-0.12%,(nh4)2so
4 0.02-0.04%,kh2po
4 0.15-0.30%。发酵培养条件为:培养温度30℃,摇床转速250rpm,培养时间120小时。
[0041]
生物材料保藏信息:
[0042]
本实施例1所得到的藤仓赤霉(fusarium fujikuroi)nrf01菌株,已在中国典型培养物保藏中心(简称cctcc)进行了菌株保藏;
[0043]
分类命名为:藤仓赤霉(fusarium fujikuroi)nrf01;
[0044]
保藏日期为2022年5月19日;
[0045]
保藏号为cctcc no.m2022683
[0046]
保藏地址:武汉,武汉大学,中国典型培养物保藏中心;邮政编码:430072
[0047]
实施例2:
[0048]
(1)种子活化:活化培养基成分为:葡萄糖4.0%,黄豆饼粉2.0%,花生饼粉1.2%,kh2po
4 1.5%,(nh4)2so
4 0.01%,mgso4.7h2o 0.10%,摇瓶装液量30ml/250ml。从液氮管中吸取0.1ml藤仓赤霉nrf01菌株的菌液至摇瓶中,温度29℃,摇床转速200rpm,培养36小时,得到活化菌液;
[0049]
(2)种子培养:种子培养基组成成分为:葡萄糖1.5%,黄豆饼粉2.0%,花生饼粉1.5%,糊精2.5%,kh2po
4 0.12%,(nh4)2so
4 0.02%,mgso4.7h2o 0.10%,摇瓶装液量30ml/250ml。将活化菌液5-10%(v/v)接种至种子摇瓶中,温度30℃,摇床转速300rpm,培养24小时,得到种子液;
[0050]
(3)发酵培养:发酵培养基组成成分:淀粉液化液10%,花生饼粉1.5%,黄豆饼粉1.5%,mgso4.7h2o 0.10%,(nh4)2so
4 0.03%,kh2po
4 0.25%,装液量150ml/1000ml。将种子液12%(v/v)接种至含有发酵培养基的摇瓶中,30℃,转速250rpm,发酵120小时,得到发酵液,经过检测赤霉素ga4产量850mg/l,未检测到赤霉素ga1和ga7。该发酵液中所含赤霉素产物图谱详见图1。
[0051]
实施例3:
[0052]
(1)种子活化:同实施例1。
[0053]
(2)种子培养:同实施例1。
[0054]
(3)发酵培养基组成成分:淀粉液化液10%,花生饼粉1.5%,黄豆饼粉1.5%,mgso4.7h2o 0.10%,(nh4)2so
4 0.03%,kh2po
4 0.25%,装液量150ml/1000ml。将种子液12%(v/v)接种至含有发酵培养基的摇瓶中,28℃,转速300rpm,发酵120小时,得到发酵液,经过检测赤霉素ga4产量825mg/l,未检测到赤霉素ga1和ga7。
[0055]
实施例4:
[0056]
(1)种子活化:同实施例1。
[0057]
(2)种子培养:同实施例1。
[0058]
(3)发酵培养基组成成分:淀粉液化液10%,花生饼粉1.5%,黄豆饼粉1.5%,mgso4.7h2o 0.10%,(nh4)2so
4 0.03%,kh2po
4 0.25%,装液量150ml/1000ml。将种子液12%(v/v)接种至含有发酵培养基的摇瓶中,33℃,转速300rpm,发酵120小时,得到发酵液,经过检测赤霉素ga4产量925mg/l,未检测到赤霉素ga1和ga7。
[0059]
实施例5:
[0060]
(1)种子活化:同实施例1。
[0061]
(2)种子培养:同实施例1。
[0062]
(3)发酵培养基组成成分:淀粉液化液10%,花生饼粉1.5%,黄豆饼粉1.5%,mgso4.7h2o 0.10%,(nh4)2so
4 0.03%,kh2po
4 0.25%,装液量150ml/1000ml。将种子液
12%(v/v)接种至含有发酵培养基的摇瓶中,32℃,转速200rpm,发酵120小时,得到发酵液,经过检测赤霉素ga4产量950mg/l,未检测到赤霉素ga1和ga7。
[0063]
实施例6:
[0064]
(1)种子活化:同实施例1。
[0065]
(2)种子培养:同实施例1。
[0066]
(3)发酵培养基组成成分:淀粉液化液10%,花生饼粉1.5%,黄豆饼粉1.5%,mgso4.7h2o 0.10%,(nh4)2so
4 0.03%,kh2po
4 0.25%,装液量150ml/1000ml。将种子液12%(v/v)接种至含有发酵培养基的摇瓶中,32℃,转速300rpm,发酵120小时,得到发酵液,经过检测赤霉素ga4产量850mg/l,未检测到赤霉素ga1和ga7。
[0067]
实施例7:
[0068]
(1)种子活化:同实施例1。
[0069]
(2)种子培养:同实施例1。
[0070]
(3)发酵培养基组成成分:淀粉液化液10%,花生饼粉1.5%,黄豆饼粉1.5%,mgso4.7h2o 0.10%,(nh4)2so
4 0.03%,kh2po
4 0.25%,装液量150ml/1000ml。将种子液12%(v/v)接种至含有发酵培养基的摇瓶中,发酵条件分阶段控制,发酵0-48小时29℃,转速300rpm,48小时后-发酵结束32℃,转速200rpm,发酵120小时,得到发酵液,经过检测赤霉素ga4产量1236mg/l,未检测到赤霉素ga1和ga7。
[0071]
实施例8:
[0072]
(1)种子活化:同实施例1。
[0073]
(2)种子培养:同实施例1。
[0074]
(3)发酵培养基组成成分:淀粉液化液10%,花生饼粉1.5%,黄豆饼粉1.5%,mgso4.7h2o 0.10%,(nh4)2so
4 0.03%,kh2po
4 0.25%,装液量150ml/1000ml。将种子液12%(v/v)接种至含有发酵培养基的摇瓶中,发酵条件分阶段控制,发酵0-48小时32℃,转速200rpm,48小时后-发酵结束29℃,转速300rpm,发酵120小时,得到发酵液,经过检测赤霉素ga4产量825mg/l,未检测到赤霉素ga1和ga7。
[0075]
实施例9:
[0076]
(1)种子活化:同实施例1。
[0077]
(2)种子培养:同实施例1。
[0078]
(3)发酵培养基组成成分:饴糖10%,花生饼粉1.5%,黄豆饼粉1.5%,mgso4.7h2o 0.10%,nano
3 0.03%,kh2po
4 0.25%,装液量150ml/1000ml。将种子液12%(v/v)接种至含有发酵培养基的摇瓶中,发酵条件分阶段控制,发酵0-48小时29℃,转速300rpm,48小时后-发酵结束32℃,转速200rpm,发酵120小时,得到发酵液,经过检测赤霉素ga4产量1205mg/l,未检测到赤霉素ga1和ga7。
[0079]
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都涵盖在本发明范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。