mesenchymal stromal cells and their interaction with platelets[j].jcell sci,2019,132(5).)研究表明,pdpn的敲低,显著降低mscs的迁移能力,而pdpn主要通过介导rac-1调控mscs迁移。但是间充质干细胞复杂的生物学异质性、体外培养的方式的不同,pdpn在msc表达也不相同,这可能造成msc迁移能力不相同。基于此,通过增加mscs上pdpn阳性亚群比例,提高mscs的迁移和趋化能力,对治疗疾病和临床转化至关重要。但如何提高mscs上pdpn阳性亚群比例,未见报道。
技术实现要素:
[0007]
为了解决上述的技术问题,提高mscs的迁移能力和趋化能力,进而提高mscs治疗各种损伤疾病的能力,本发明提供更加安全、有效的细胞产品和该产品的培养方法,具体的:
[0008]
本发明第一方面,提供一种炎症因子在提高间充质干细胞群中的平足蛋白阳性亚群比例中的应用,所述炎症因子包括tnf-α和ifn-γ,所述的间充质干细胞群经炎症因子培养后,所述的平足蛋白阳性亚群比例提高至少12%。
[0009]
优选的,所述间充质干细胞群采用炎症因子tnf-α和ifn-γ或包含炎症因子ynf-α和ifn-γ的培养基培养。
[0010]
优选的,所述tnf-α在培养基中的浓度为5-30ng/ml,进一步优选为5-20ng/ml,更优选为5-15ng/ml,可以为5-30ng/ml之间的任意数值,例如5ng/ml、8ng/ml、10ng/ml、13ng/ml、15ng/ml、17ng/ml、20ng/ml、25ng/ml、27ng/ml、30ng/ml。
[0011]
优选的,所述ifn-γ在培养基中的浓度为5-30ng/ml,进一步优选为5-20ng/ml,更优选为5-15ng/ml,可以为5-30ng/ml之间的任意数值,例如5ng/ml、8ng/ml、10ng/ml、13ng/ml、15ng/ml、17ng/ml、20ng/ml、25ng/ml、27ng/ml、30ng/ml。
[0012]
优选的,所述间充质干细胞群经培养后,细胞群中的趋化因子受体表达增加,更优选的,所述趋化因子受体包括ccr1、ccr3、ccr4或cxcr4中的一种或多种。
[0013]
优选的,所述间充质干细胞群经培养后细胞迁移能力提高。
[0014]
本发明第二方面,提供一种培养基,所述培养基包括基础培养基、tnf-α和ifn-γ。
[0015]
优选的,tnf-α在培养基中的浓度为5-30ng/ml,进一步优选为5-20ng/ml,更优选为5-15ng/ml,可以为5-30ng/ml之间的任意数值,例如5ng/ml、8ng/ml、10ng/ml、13ng/ml、15ng/ml、17ng/ml、20ng/ml、25ng/ml、27ng/ml、30ng/ml。
[0016]
优选的,ifn-γ在培养基中的浓度为5-30ng/ml,进一步优选为5-20ng/ml,更优选为5-15ng/ml,可以为5-30ng/ml之间的任意数值,例如5ng/ml、8ng/ml、10ng/ml、13ng/ml、15ng/ml、17ng/ml、20ng/ml、25ng/ml、27ng/ml、30ng/ml。
[0017]
优选的,所述基础培养基是适合间充质干细胞培养的任意基础培养基,例如:mem、α-mem、dmem、imdm、deme-lg、rpmi-1640、dmem/f12、df12 fbs或msc无血清培养基中的至少一种,进一步优选为msc无血清培养基。
[0018]
本发明第三方面,提供一种上述培养基在提高间充质干细胞群中pdpn阳性亚群比例中的应用。
[0019]
优选的,所述的间充质干细胞群经包含炎症因子的培养基培养后,所述的平足蛋白阳性亚群比例提高至少12%。
[0020]
优选的,所述间充质干细胞群经培养后,细胞群中的趋化因子受体表达增加,更优选的,所述趋化因子受体包括ccr1、ccr3、ccr4或cxcr4中的一种或多种。
[0021]
优选的,所述间充质干细胞群经培养后细胞迁移能力提高。
[0022]
本发明第四方面,提供一种间充质干细胞群的培养方法,所述间充质干细胞群采用炎症因子tnf-α和ifn-γ或包含炎症因子tnf-α和ifn-γ的培养基进行培养,所述的间充质干细胞群经炎症因子培养后,细胞群中的平足蛋白阳性亚群比例提高至少12%。
[0023]
优选的,当培养过程中mscs细胞融合度达到60-70%时,采用含有tnf-α和ifn-γ的培养基进行培养,进一步优选的,在tnf-α和ifn-γ条件下培养20-30h,更优选为20-24h,例如:20h、22h、24h。
[0024]
优选的,tnf-α在培养基中的浓度为5-30ng/ml,进一步优选为5-20ng/ml,更优选为5-15ng/ml,可以为5-30ng/ml之间的任意数值,例如5ng/ml、8ng/ml、10ng/ml、13ng/ml、15ng/ml、17ng/ml、20ng/ml、25ng/ml、27ng/ml、30ng/ml。
[0025]
优选的,ifn-γ在培养基中的浓度为5-30ng/ml,进一步优选为5-20ng/ml,更优选为5-15ng/ml,可以为5-30ng/ml之间的任意数值,例如5ng/ml、8ng/ml、10ng/ml、13ng/ml、15ng/ml、17ng/ml、20ng/ml、25ng/ml、27ng/ml、30ng/ml。
[0026]
优选的,mscs培养基为mem、α-mem、dmem、imdm、deme-lg、rpmi-1640、dmem/f12、df12 fbs或msc无血清培养基中的至少一种,进一步优选为msc无血清培养基。
[0027]
优选的,在将间充质干细胞群进行培养之前包括对间充质干细胞群进行解冻复苏步骤。
[0028]
更优选的,所述解冻复苏步骤包括水浴解冻细胞,将细胞重悬于缓冲液。
[0029]
优选的,所述方法包括对间充质干细胞群进行分级。
[0030]
更优选的,所述分级包括对间充质干细胞群建立原始细胞库(p2)、主细胞库(p4)、和工作细胞库(p5)。
[0031]
优选的,在授权专利zl202210033348.5的技术上对细胞进行分级管理后,建立上述的细胞库。专利zl202210033348.5全文引用,在此作为参考。
[0032]
上述分级使得间充质干细胞群更适合于临床上使用,间充质干细胞群更具有安全性,同时具备更多的功能。
[0033]
优选的,所述间充质干细胞选自胎盘间充质干细胞、羊膜间充质干细胞、脂肪间充质干细胞、皮肤间充质干细胞或脐带间充质干细胞。进一步优选脐带间充质干细胞。
[0034]
优选的,所述间充质干细胞群经培养后,细胞群中的趋化因子受体表达增加,更优选的,所述趋化因子受体包括ccr1、ccr3、ccr4或cxcr4中的一种或多种。
[0035]
优选的,所述间充质干细胞群经培养后细胞迁移能力提高。
[0036]
优选的,所述培养方法还包括对平足蛋白阳性亚群比例提高,和/或趋化因子受体表达增加的亚群的间充质干细胞群进行分离、浓缩的步骤选自免疫磁珠分选法、流式细胞仪分离法中的其中之一。更优选的,所述分离及浓缩的方法为流式细胞仪分离法。
[0037]
在一个具体的实施方式中,所述培养方法包括:
[0038]
步骤1,建立原始细胞库(p2)、主细胞库(p4)及工作细胞库(p5),获取符合临床级别的间充质干细胞。
[0039]
步骤2,采用含有tnf-α和ifn-γ的培养基对间充质干细胞进行培养。
[0040]
步骤3,对经过步骤2培养获得的平足蛋白阳性亚群比例提高,和/或趋化因子受体表达增加的亚群的间充质干细胞群进行分离、浓缩。
[0041]
优选的,所述趋化因子受体包括ccr1、ccr3、ccr4或cxcr4中的一种或多种。
[0042]
优选的,对pdpn阳性亚群比例提高的间充质干细胞群分离、浓缩的方法选自免疫磁珠分选法、流式细胞仪分离法中的其中之一。进一步优化为流式细胞仪分离法。
[0043]
优选的,对主细胞库(p4)的mscs进行培养。
[0044]
优选的,可以在培养后对间充质干细胞的形态或功能进行检测。
[0045]
更优选的,mscs检测的内容包括细胞形态、免疫特征、pdpn亚群比例、趋化因子受体mrna表达量、mscs迁移能力。
[0046]
本发明第五方面,提供一种间充质干细胞群,所述间充质干细胞群中的pdpn阳性亚群比例提高,所述pdpn阳性亚群比例提高是指培养后的间充质干细胞的平足蛋白阳性亚群提高至少12%。
[0047]
优选的,所述pdpn阳性亚群比例提高至少12%,可以是高于或等于12%的任意数值,例如至少12%、12.2%、12.4%、12.6%、12.8%、13.0%、15%、17%、18%、19%、21%、25%、27%、28%、29%、30%,甚至更高。
[0048]
优选的,所述间充质干细胞群中细胞的趋化因子受体表达增加;更优选的,所述趋化因子受体mrna表达增加。
[0049]
更优选的,所述趋化因子受体包括ccr1、ccr3、ccr4或cxcr4中的一种或多种。
[0050]
优选的,所述间充质干细胞群培养后,细胞群的迁移能力增加。
[0051]
优选的,所述间充质干细胞群通过上述培养方法制备获得。
[0052]
本发明第六方面,提供一种第五方面所述间充质干细胞群的应用,具体包括与提高间充质干细胞群中pdpn阳性亚群比例相关的研究、药物研发;在免疫调节中的应用;在制备组合物中的应用。
[0053]
优选的,上述应用不是疾病的治疗或者诊断方法。
[0054]
优选的,在免疫调节和制备组合物方面,可将培养的间充质干细胞群开发成药物,用于机体组织损伤的修复,或者基于pdpn阳性比例提高、迁移能力和/或趋化能力提高,相应地提高间充质干细胞群对疾病的治疗作用,这些疾病包括例如:血液系统疾病、心血管疾病、神经系统疾病、消化系统疾病、生殖系统疾病、泌尿系统疾病、自身免疫性疾病、再生医学/修复医学领域的疾病、肿瘤和损伤等等。
[0055]
优选的,将上述培养的间充质干细胞群开发成针对特异疾病的专用药,例如针对溃疡性结肠炎(uc)、i型糖尿病、糖尿病足、脊髓损伤、脑瘫、肌萎缩侧索硬化症、系统性红斑狼疮及系统性硬化症等的药物。
[0056]
优选的,根据患者个体差异,将上述培养的间充质干细胞群开发成针对特异患者的药物。
[0057]
更优选的,上述药物为注射剂或微针剂。
[0058]
优选的,上述药物还包括药物辅料。进一步优选的,所述辅料包括药学上可接受的载体、稀释剂和/或缓冲剂等。
[0059]
本发明相关的技术术语说明:
[0060]
间充质干细胞(mesenchymal stem cells,mscs):是一种多能干细胞,它具有干细
胞的所有共性,即自我更新和多向分化能力。mscs可以从各种组织中分离出来,如脐带、骨髓、脂肪组织等。临床应用于解决多种血液系统疾病、心血管疾病、肝硬化、神经系统疾病、自身免疫性疾病等。
[0061]
平足蛋白(podoplanin,pdpn):是ⅰ型唾液酸黏蛋白样的跨膜糖蛋白,可以作为淋巴内皮细胞和淋巴管生成的特异性标志物。
[0062]
本发明的有益效果:
[0063]
1、本发明通过使用tnf-α和ifn-γ对间充质干细胞群进行培养,提高了间充质干细胞群中pdpn阳性亚群的比例,提高了间充质干细胞群中细胞的迁移能力。相较于si-linc01773,该方法不需要针对特异靶点,操作简单,应用范围广。
[0064]
2、采用本发明的方法培养的间充质干细胞群的细胞迁移能力和趋化能力强,与普通间充质干细胞相比,能更快速地转移至损伤组织,从而能提高间充质干细胞药物对疾病的治疗效果。
附图说明
[0065]
图1为分离出的脐带间充质干细胞中不同代次的细胞形态图片;
[0066]
图2为tnf-α和ifn-γ处理后的huc-mscs形态学和免疫表型特征的变化,其中(a)为未处理的p5代细胞和tnf-α和ifn-γ处理的p5代细胞,(b)为未处理的p5代细胞和tnf-α和ifn-γ处理的免疫表型柱状图;
[0067]
图3为tnf-α和ifn-γ处理的pdpn阳性亚群比例,其中(a)为流式细胞术分析结果,(b)为pdpn阳性亚群比例柱状图;
[0068]
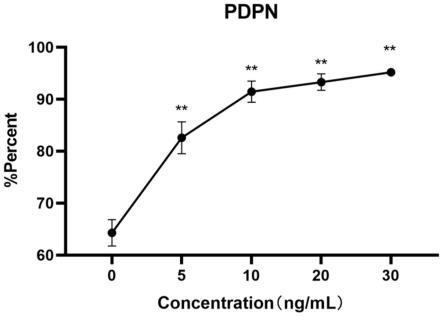
图4为不同浓度炎症因子处理huc-mscs后pdpn阳性亚群比例的变化;
[0069]
图5为不同培养体系中,经tnf-α和ifn-γ处理后pdpn阳性亚群比例,其中(a)为同立海源培养基(tl)培养体系中pdpn阳性亚群比例,(b)为df12培养基培养体系中pdpn阳性亚群比例;
[0070]
图6为tnf-α和ifn-γ处理后的huc-mscs的趋化因子受体mrna表达结果;
[0071]
图7为transwell迁移实验结果,其中(a)为hu-mscs迁移图片,(b)为迁移细胞数统计结果。
具体实施方式
[0072]
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
[0073]
本发明中采用的设备及厂家信息见表1:
[0074]
表1
[0075][0076]
本发明中采用的试剂及厂家信息如下:
[0077]
tnf-α(peprotech 300-01a-50)、ifn-γ(peprotech af-300-02-20)、间充质干细胞(mscs)无血清培养基(北京三有利科技发展有限公司120408)、msc medium serum free medium animal free medium sterile filtered(同立海源as09-2)、dmem/f12基础培养基(普诺赛pm150310)、tryple
tm
express enzyme(gibco 12604-021)、0.9%氯化钠注射液(石家庄四药有限公司)、胎牛血清(gibco 10099141)、pbs磷酸盐缓冲液,ph7.2(gibco 20012027)、ao/pi染液(nexcelom bioscience cs2-0106-5ml)、dapi solution 1.0mg(bd pharmingen 564907)、fitc anti-human cd90(bd pharmingen 555595)、pe anti-human cd73(bd pharmingen 550257)、apc anti-human cd105(bd pharmingen 562408)、fitc anti-human cd45(bd pharmingen 555482)、pe anti-human cd34(bd pharmingen 550761)、apc anti-human cd19(bd pharmingen 555415)、pe mouse anti-human cd14 clone m5e2(bd pharmingen 561707)、fitc mouse anti-human hla-dr(bd pharmingen 555560)、podoplanin monoclonal antibody(nz-1.3)pe(ebioscience 12-9381-42)、4%组织细胞固定液(solarbio p1110-100ml)、qubit
tm
rna br assay kit(invitrogen q10210)、primescript
tm
rt reagent kit(takara rr047a)、2
×
realstar green fast mixture(with rox ii)(genstar a304-10)、草酸铵结晶紫染色液(结晶紫染色液)(1%)(solarbio g1062-10ml)、引物合成于英潍捷基(上海)贸易有限公司、乙醇、异丙醇、氯仿等常规生化试剂均为分析纯。
[0078]
实施例1建立三级细胞库工艺,生产足够量的各级细胞库
[0079]
方法:在已授权专利202210033348.5技术上对细胞进行分级管理,建立原始细胞库(p2)主细胞库(p4)及工作细胞库(p5),获取足量符合临床级别的脐带间充质干细胞。每代细胞库检验项目包括且不限于此:细胞形态、细胞数量及活率、细胞表型、分化能力、细胞遗传学、端粒酶、遗传标志物、无菌、支原体、内毒素、特殊人源病毒、免疫学反应及细胞因子分泌。各项指标合格的细胞即为临床级别干细胞。
[0080]
对每代细胞库检测的形态学和免疫表型特征结果见图1和表2。
[0081]
表2:p5代细胞免疫表型流式细胞术检测结果
[0082][0083]
图1结果表明,原始细胞库(p2)、主细胞库(p4)及工作细胞库(p5)的细胞形态为梭形。并且表2细胞免疫表型表明,p5代细胞高表达或强表达间充质干细胞的标志物:cd90、cd73、cd105;而不表达cd14、cd19、cd45、cd34及hia-dr。说明经过分级管理,获得了临床级别的干细胞。
[0084]
实施例2脐带间充质干细胞经tnf-α和ifn-γ处理后细胞形态学和免疫特征的变化
[0085]
具体实验过程如下:
[0086]
2.1、解冻复苏。
[0087]
在37~40℃下水浴解冻p4代huc-mscs,将细胞悬液重悬于pbs缓冲液中,重悬比例至少为2倍缓冲液,300~500
×
g,离心8-10min,弃上清重悬,取样计数。
[0088]
2.2、细胞培养。
[0089]
将复苏的p4代细胞按照5000~6000个细胞/cm2的接种密度接种于装有msc无血清培养基的t75培养瓶中,置于37℃、5%co2培养箱中进行培养48
±
2h,待细胞融合度约60~70%时,更换含有10ng/mltnf-α和10ng/mlifn-γ的msc无血清培养基,继续培养处理22
±
2h。
[0090]
2.3、收获细胞。
[0091]
细胞培养结束后,使用tryple
tm
express enzyme(gibco)消化2~3min中,用缓冲液稀释tryple
tm
express enzyme比例以达到终止的效果,300~500
×
g,离心8-10min,收获细胞沉淀。
[0092]
2.4、检测分析。
[0093]
选取步骤2.1和2.3结束后的沉淀细胞,用生理盐水或msc无血清培养基重悬huc-mscs,取2
×
106个细胞用于流式细胞术分析,使用spss statistics 24软件进行显著性分析。*表示p<0.05,差异显著;**表示p<0.01,差异极显著;ns表示p>0.05,差异不显著。分析结果见图2和表3。
[0094]
表3:huc-mscs免疫表型流式细胞术检测结果
[0095][0096]
图2和表3结果表明,tnf-α和ifn-γ处理前后的huc-mscs均贴壁生长,细胞形态均为长梭形,没有明显变化。tnf-α和ifn-γ处理前后的huc-mscs均高表达cd90、cd73、cd105(大于99%);而低表达cd14、cd19、cd45、cd34及hia-dr(<2%)。并且huc-mscs的表面marker蛋白表达差异不显著(p>0.05)。说明huc-mscs经tnf-α和ifn-γ处理后不改变其细胞形态学和免疫表型。
[0097]
实施例3脐带间充质干细胞经tnf-α和ifn-γ处理后pdpn细胞表型的变化
[0098]
实施例3的具体实验过程与实施例2的相同,流式细胞术检测结果见图3和表4。
[0099]
表4:tnf-α和ifn-γ处理后pdpn细胞表型的变化
[0100][0101]
图3和表4结果表明,经过tnf-α和ifn-γ处理后的huc-mscs表面pdpn阳性亚群比例由处理前的67.02%提高到88.93%,与处理前相比,处理后的pdpn阳性亚群比例提高了21.91%,达到了极显著差异水平(p<0.01)。
[0102]
实施例4不同浓度的炎症因子处理huc-mscs后pdpn阳性亚群比例的变化
[0103]
实施例4的具体实验过程与实施例2相同,不同之处在于tnf-α和ifn-γ的浓度均为0、5、10、20、30ng/ml。不同浓度的炎症因子处理后的流式细胞术检测结果见图4和表5。
[0104]
表5:不同浓度的炎症因子处理后pdpn阳性亚群比例的变化
[0105][0106]
图4和表5结果表明,经tnf-α和ifn-γ同时处理的huc-mscs,随着tnf-α和ifn-γ的浓度的增加,pdpn阳性亚群比例也极显著增加(p<0.01),mscs细胞表面蛋白pdpn最初的阳性亚群比例为64.29%,随着炎症因子处理后(浓度从小到大)分别提高18.29%、27.15%、29.01%、31.42%,都达到了极显著差异水平(p<0.01)。
[0107]
实施例5在不同的培养体系中脐带间充质干细胞经tnf-α和ifn-γ处理后pdpn细胞表型的变化
[0108]
实施例5的具体实验过程与实施例2的相同,不同之处在于建立了两种培养体系:即一个实验采用了含有tnf-α和ifn-γ的同立海源培养基(tl)进行,另一个实验采用了dmem/f12 10%fbs(df12)培养基进行。两种培养体系的流式细胞术检测结果见图5和表6。
[0109]
表6:在不同培养体系中经tnf-α和ifn-γ处理后的pdpn表型的变化
[0110][0111]
图5中(a)和表6结果表明,在同立海源培养体系中,经过tnf-α和ifn-γ处理后的huc-mscs表面pdpn阳性亚群比例由处理前的43.77%提高到70.86%,与处理前相比,处理后的pdpn阳性亚群比例提高了27.09%,达到了极显著差异水平(p<0.01)。
[0112]
图5中(b)和表6结果表明,在df12培养体系中,经过tnf-α和ifn-γ处理后的huc-mscs表面pdpn阳性亚群比例由处理前的81.53%提高到93.64%,与处理前相比,处理后的pdpn阳性亚群比例提高了12.11%,达到了极显著差异水平(p<0.01)。
[0113]
以上结果说明,tnf-α和ifn-γ在不同培养体系下,均能极显著地提高huc-mscs表面pdpn阳性亚群的比例,从而进一步提高huc-mscs的迁移能力。
[0114]
实施例6脐带间充质干细胞经tnf-α和ifn-γ处理后趋化因子受体mrna表达量的变化
[0115]
具体实验过程如下:
[0116]
6.1、细胞培养。
[0117]
将复苏的p4代细胞按照5000~6000个细胞/cm2的接种密度接种于六孔板中,每组接种9个复孔,培养48
±
2h,待细胞长至约60-70%时,向msc间充质干细胞无血清培养基中添加10ng/ml tnf-α和10ng/ml ifn-γ预处理24h后,trizol法收集3个复孔的rna。
[0118]
6.2、rt-pcr。
[0119]
根据trizol法提取总rna,使用qubit仪器测定总rna的纯度和浓度,a260/a280值为1.9~2.0,浓度在3000ng/μl左右,将其稀释至1000ng/μl,按照primescript
tm
rt reagent kit试剂盒说明书进行反转录,反转录的cdna用ddh2o 4倍稀释。
[0120]
6.3、qpcr。
[0121]
反应总体积20μl,包括2
×
realstar green fast mixture(with rox ii)10μl,浓度为10μmol/l的上、下游引物(见表7)各0.5μl,cdna 2μl,ddh2o 7μl;反应程序为:95℃,2min;95℃15s,60℃20s,40个循环;95℃15s,65℃5s,95℃50s。每个样本进行3次重复,用2-δct
法对定量结果进行分析,结果见图6和表8。
[0122]
表7:引物序列信息
[0123][0124]
表8:tnf-α和ifn-γ处理后huc-mscs趋化因子受体mrna表达量
[0125][0126]
图6和表8结果表明,相较于未经tnf-α和ifn-γ处理的对照,经过tnf-α和ifn-γ处理后,huc-mscs中趋化因子受体ccr1、ccr3、ccr4和cxcr4 mrna表达量极显著增加(p<0.01)。说明tnf-α和ifn-γ处理后huc-mscs趋化因子受体mrna表达量增加,进而提高huc-mscs的迁移能力。
[0127]
实施例7脐带间充质干细胞经tnf-α和ifn-γ处理后细胞趋化能力的变化
[0128]
具体实验过程如下:
[0129]
7.1、细胞培养。
[0130]
将复苏的p4代细胞按照5000~6000个细胞/cm2的接种密度接种于装有msc无血清培养基的t75培养瓶中,培养48
±
2h,待细胞融合度约60~70%时,更换含有10ng/ml tnf-α和10ng/ml ifn-γ的msc无血清培养基,继续处理22
±
2h后,消化,离心,计数。使用α-mem培养基(2%fbs)调整细胞密度为5
×
105个/ml,取200μl细胞悬液置于上室,下室α-mem培养基(30%fbs)700μl,置于37℃、5%co2培养箱中进行培养24h。
[0131]
7.2、染色、处理。
[0132]
细胞培养结束后,用棉棒轻轻擦除未迁移的细胞,pbs洗涤3次,4%多聚甲醛固定
30min,pbs洗涤5次,0.1%结晶紫染色20min,pbs洗涤3次,晾干,采集10
×
细胞图片,两种处理分别各采集3个视野,使用image j统计迁移细胞数,使用spss statistics 24软件进行显著性分析。*表示p<0.05,差异显著;**表示p<0.01,差异极显著;ns表示p>0.05,差异不显著。实验结果如图7和表9所示。
[0133]
表9:迁移的细胞数明细表
[0134]
组别percent(%)p值ntc514
±
23.25 tnf-α ifn-γ793.33
±
39.600.000
[0135]
图7和表9的结果表明,经过tnf-α和ifn-γ处理的huc-mscs趋化细胞数明显多于对照组,相较于对照组的细胞迁移数514,经过tnf-α和ifn-γ处理的huc-mscs细胞迁移数约为793个,是对照组的1.5倍,经过tnf-α和ifn-γ处理后的huc-mscs细胞迁移数增加了279个,为对照组迁移的细胞数的54%,两种处理的huc-mscs细胞迁移数差异达到极显著水平(p<0.01)。说明tnf-α和ifn-γ能显著提高huc-mscs的趋化/迁移能力。
[0136]
实施例8:平足蛋白阳性亚群比例提高,和/或趋化因子受体表达增加的亚群的分离与浓缩
[0137]
采用本领域常规的,例如免疫磁珠分选法、流式细胞仪分离法中的任意一种,对目的亚群的分离与浓缩。
[0138]
流式细胞仪分选方法:具体细胞培养过程与实施例2的相同,将收获后的细胞(1
×
107个)使用含2%fbs的pbs重悬。重悬后的细胞悬液通过70μm细胞筛,获得单细胞悬液。炎症因子组加入pdpn抗体,避光孵育30min后,1500rpm,离心5min,弃上清。使用含2%fbs的pbs洗涤一次后,调整细胞密度为1
×
106/ml,同时准备装有msc无血清培养基的收集管,使用流式细胞仪上机分选pdpn阳性亚群。然后将分选后的细胞按5000~6000cm2接种t75或t175培养瓶中,使用msc无血清培养基(含10ng/ml tnf-α ifn-γ)培养72h后收获、冻存。
[0139]
以上实施例的结果表明,采用tnf-α和ifn-γ处理间充质干细胞,能提高间充质干细胞群中pdpn阳性亚群的比例,同时提高间充质干细胞群中细胞的迁移和趋化能力。
[0140]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。